Кристаллография, 2021, T. 66, № 5, стр. 802-806
Олигомеризация церулоплазмина под действием ионов меди
М. В. Петухов 1, 2, А. В. Соколов 3, В. А. Костевич 3, В. Р. Самыгина 1, 4, *
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
3 Институт экспериментальной медицины
Санкт-Петербург, Россия
4 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: lera@crys.ras.ru
Поступила в редакцию 22.04.2020
После доработки 02.05.2020
Принята к публикации 27.05.2020
Аннотация
Методом малоуглового рентгеновского рассеяния исследована олигомеризация медьсодержащей ферроксидазы церулоплазмина при наличии не связанной с белком меди в растворе. Церулоплазмин является мономером с молекулярной массой ∼132 кДа. Добавление хлорида меди в концентрации 10 мкМ приводит к димеризации 60% белка. Анализ межсубъединичных контактов показал, что димеризация может препятствовать образованию белок-белковых комплексов церулоплазмина с белками лейкоцитов миелопероксидазой и пероксидазой эозинофилов. Образование этих комплексов является частью защитной реакции организма на воспалительные процессы. Также, вероятно, димерный церулоплазмин теряет способность связывать и окислять один из субстратов – p-фенилендиамин.
ВВЕДЕНИЕ
Олигомеризация белков может являться причиной некоторых нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Паркинсона и других [1, 2]. Триггерами олигомеризации могут служить ионы металлов. Индуцированная металлами агрегация может встречаться как у частично разупорядоченных белков, так и у глобулярных. Например, ионы хрома, кобальта и никеля способствуют агрегации альбумина [3]. Часто встречаются данные, свидетельствующие о том, что агрегацию белков способны вызывать ионы цинка и меди [4–7]. Медь присутствует в организме человека в концентрации 16–20 мкМ в крови, 15 мкМ в синаптической щели и 0.5–2.5 мкМ в спинномозговой жидкости [8]. Ее концентрация в спинномозговой жидкости повышена в 2.2 раза у пациентов с болезнью Альцгеймера [9]. При болезни Альцгеймера концентрация так называемой свободной (диализуемой) меди в плазме крови достигает 5 мкМ [10].
Церулоплазмин (ЦП) – медьсодержащая многофункциональная гликозилированная ферроксидаза с молекулярной массой (ММ) ∼132 кДа, циркулирующая в растворимой форме в плазме крови. Благодаря способности превращать токсичное двухвалентное железо в трехвалентное он является природным антиоксидантом. ЦП содержит от 40 до 70% меди плазмы крови [11]. Большинство исследований такими методами, как гель-фильтрация, электрофорез в полиакриламидном геле в неденатурирующих условиях и малоугловое рентгеновское рассеяние (МУРР), показывают, что ЦП млекопитающих является мономером [12–15]. Ранее в литературе была описана так называемая димерная изоформа ЦП с молекулярной массой ∼200 кДа [16]. Димер ЦП был обнаружен в плазме крови здоровых доноров и секретировался культурой гепатоцитов (HepG2). Опыты, в которых при кросс-сшивке мономерного ЦП с помощью дитиобиссукцинимидилпропионата образовался продукт с ММ ∼200 кДа, а при ограниченном протеолизе мономерного и димерного ЦП образовались идентичные фрагменты, позволили заключить, что обнаруженная ими изоформа ЦП является димером, а не продуктом посттрансляционной модификации или альтернативного сплайсинга [16]. Полипептидная цепь белка свернута в глобулу, состоящую из шести доменов, расположенных в форме псевдогексамера, соединенных длинными петлями. Благодаря ионам меди в структуре ЦП помимо ферроксидазной активности обладает свойствами оксидазы, NO-оксидазы, NO2-синтазы, супероксиддисмутазы. Структурные исследования показывают, что ЦП человека содержит шесть–восемь центров связывания меди, из которых шесть основных сайтов всегда заполнены, а заполнение двух лабильных сайтов наблюдается не всегда [13]. ЦП крысы содержит на один лабильный сайт больше [17]. Обнаружено, что при избытке меди ЦП подвержен олигомеризации. Было исследовано олигомерное состояние ЦП в растворе методом МУРР в присутствии хлорида меди и обнаружена частичная димеризация белка. В результате была получена трехмерная модель димера низкого разрешения, определены зоны контактов мономер–мономер.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение и очистка церулоплазмина. Для получения препарата мономерного ЦП с A610/A280 > > 0.049 плазму крови с добавлением 1 мМ этилендиаминтетрауксусной кислоты и 0.1 мМ фенилметилсульфонил фторида (PMSF) подвергали хроматографии на UNOsphere Q и неомицин-агарозе [18]. Далее ЦП концентрировали до 80 мг/мл с помощью центрифужной ячейки Vivaspin 20 (M > 100 кДа), трижды заменяя 0.1 M Hepes-NaOH рН 7.5.
Малоугловое рентгеновское рассеяние. Предварительные измерения малоуглового рассеяния ЦП были проведены на станции БиоМУР Курчатовского центра синхротронного излучения [19]. Финальные измерения МУРР были проведены на станции EMBL P12 BioSAXS (кольцо PETRA-III синхротрона DESY, Гамбург, Германия) [20] в диапазоне векторов рассеяния 0.023 < s < 5.0 нм–1 (s = $4\pi \sin \theta {\text{/}}\lambda $, где 2θ – угол рассеяния и λ = = 0.124 нм – длина волны). Линия P12 оснащена оборудованием для автоматической смены образцов и двумерным детектором Pilatus 2M (фирма DECTRIS, Швейцария). Время экспозиции одного образца – 20 кадров по 0.05 с каждый. При сравнении временных кадров радиационного повреждения зафиксировано не было. Данные были собраны при концентрации ЦП 1.5–7.0 мг/мл (11–53 мкМ) как в присутствии 10 мкМ CuCl2, так и без добавления соли меди. Первичную обработку экспериментальных данных проводили в соответствии со стандартными процедурами [21]. В частности, усреднение сигнала от буфера и его вычитание осуществляли с использованием программы PRIMUS [22]. Рассеяние в нулевой угол I(0) и радиус инерции Rg вычислены с помощью приближения Гинье [23]. Программу обратного фурье-преобразования GNOM [24] использовали для оценки максимального размера частиц Dmax. Эффективные ММ частиц в растворе получены путем сравнения с рассеянием на эталонном образце бычьего сывороточного альбумина (66 кДа). В качестве дополнительного контроля ММ использовали исключенный (породовский) объем Vp [25, 26].
Олигомерное равновесие. Альтернативные модели димера ЦП, полученные с помощью докинга, применяли для приближения экспериментальных данных образца, содержащего мономеры и димеры. Анализ смесей мономер–димер осуществляли по программе OLIGOMER [22], которая приближает данные рассеяния линейной комбинацией кривых рассеяния компонентов смеси. Варьируемыми параметрами являются объемные доли компонентов, а приближение осуществляется путем минимизации невязки χ2 между экспериментальными данными Iexp(s) и рассчитанной кривой Icalc(s).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментальная кривая МУРР для раствора ЦП с добавлением 10 мкМ хлорида меди показана на рис. 1. Соответствующие общие параметры растворенных частиц приведены в табл. 1. В табл. 1 также приведены теоретические значения Rg, Dmax, Vp для кристаллографической модели и ММ мономера по данным масс-спектрометрии [27], поскольку этот метод намного точнее определяет ММ белка, чем теоретические расчеты по кристаллографической модели (118 кДа) или аминокислотной последовательности ЦП (122.2 кДа) из-за гликозилирования, типичного для белков млекопитающих [27]. Полученные экспериментально для образца церулоплазмина ММ и Vp свидетельствуют о том, что в растворе находятся как мономеры, так и димеры ЦП в соотношении 40 : 60%. Действительно, кривая МУРР, рассчитанная для мономера ЦП, систематически отличается от экспериментальных данных в области малых и средних углов. Олигомерное равновесие в смеси было охарактеризовано с помощью линейной комбинации кривых рассеяния, рассчитанных для кристаллографической модели ЦП (код pdb 4enz) и моделей димера, построенных с использованием сервера ClusPro [28]. Всего было рассмотрено двадцать возможных вариантов димеризации ЦП. При помощи программы OLIGOMER и докинга найден оптимальный вариант димера, а также определены объемные доли мономера и димера, которые совпали со значениями, полученными из анализа ММ и Vp. На рис. 2, 3 представлена оптимальная модель димера, a на рис. 1 – приближение экспериментальных данных МУРР смесью 40% кристаллографического мономера с 60% оптимального варианта димера. Несколько высокое значение χ2, видимо, связано с недооцененными ошибками эксперимента. Контакт мономеров расположен далеко от сайтов связывания меди, как основных, так и лабильных.
Рис. 1.
Кривые МУРР раствора церулоплазмина (а): кружки – экспериментальные данные, штриховая линия – приближение кристаллографической моделью мономера, сплошная линия – приближение смесью мономера и димера в соотношении 40 : 60%; распределение взвешенных аминокислотных остатков в случае приближения смесью (I(si)–Iсмесь(si))/σ(si) (б).
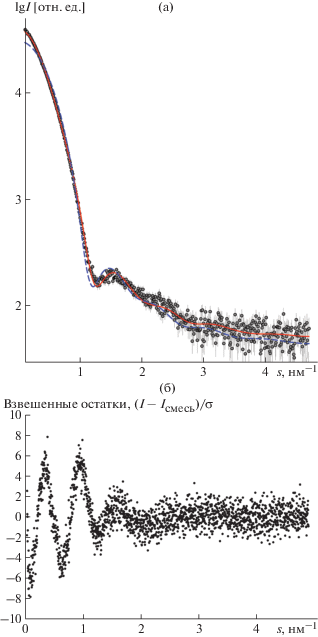
Таблица 1.
Структурные параметры ЦП, полученные по данным МУРР
| Rg, нм | Dmax, нм | Vp, нм3 | MM, кДа | χ2 | Объемные доли мономер : димер |
|
|---|---|---|---|---|---|---|
| Эксперимент | 4.2 ± 0.1 | 15 ± 1 | 305 ± 10 | 190 ± 20 | 4.03 | (0.4 ± 0.01) : (0.6 ± 0.01) |
| Мономер ЦП | 2.9 | 9.0 | 195 | 129.1* | ||
| Димер ЦП | 4.2 | 15 | 390 | 258.2** |
Рис. 2.
Кристаллографическая модель мономера церулоплазмина (а) и оптимальная модель димера, полученная докингом (б).

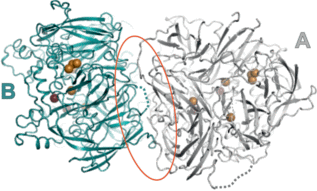
Рис. 3.
Модель димера церулоплазмина: ионы меди изображены сферами, темным цветом показаны ионы в лабильных сайтах связывания меди, зона контакта мономер–мономер выделена овалом, А и B – субъединицы.
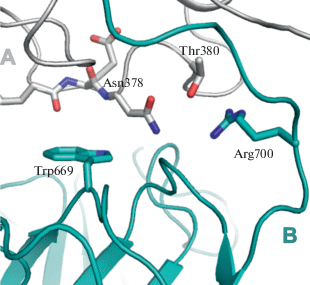
Анализ областей димеризации позволил приблизительно определить основные зоны контактов. Петля 698–710 субъединицы А взаимодействует с доменом III субъединицы В. С этим доменом взаимодействует, вероятно, и Trp669 субъединицы А (рис. 4). Trp669 и Ser662 относятся к сайту связывания р-фенилендиамина. Этот ароматический амин является классическим субстратом для измерения оксидазной активности ЦП [29, 30]. Следовательно, образование димера может блокировать связывание этого субстрата и, соответственно, его окисление.
Другой контакт расположен в области петли 885–890, соединяющей домены V и VI субъединицы А с доменом IV субъединицы В. Способность ионов металлов вызывать агрегацию конкретного белка зависит от многих параметров. В их число входят тип металла и белка, внутриклеточная концентрация ионов металла, структура белка, содержание и взаимное расположение потенциальных лигандирующих групп в боковых цепях аминокислот. К таким группам относятся тиоловая, имидазольная и карбоксилатная [31]. Предпочтительным кандидатом на роль лиганда ионов меди является гистидин [32]. Используемый метод не позволяет точно определить сайты связывания металла, тем более что в зонах контактов расположены преимущественно лабильные междоменные петли, которые могут иметь различные конформации. Конформацию одного из участков ЦП, а.а 885–890, предположительно вовлеченного в межмолекулярное взаимодействие, ни разу не удалось установить при рентгеноструктурном анализе [13].
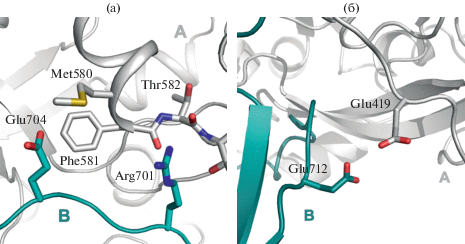
Аминокислотные последовательности областей зон межмолекулярных контактов не содержат гистидины. Однако потенциальный сайт связывания иона меди с типичными лигандами может быть сформирован боковыми цепями Glu704 (субъединицы В) и Met580 (субъединицы А), расположенными на α-спирали (рис. 5а). Другой потенциальный сайт включает в себя Glu 419 (субъединицы А) и Glu712 (субъединицы В) (рис. 5б). Аргинин также является предпочтительным лигандом для Cu2+ [32], и нельзя исключить, что Arg701 (субъединицы В) (рис. 5а) может быть вовлечен в связывание ионов металла, как и соседний Arg700 (рис. 4). Потенциальная роль димеризации ЦП под действием ионов меди вытекает из анализа областей олигомеризации. Петля 885–890 участвует в обнаруженных in vivo белок-белковых взаимодействиях ЦП [13], ингибируя в них миелопероксидазу и пероксидазу эозинофилов [33]. Таким образом, ЦП предотвращает синтез хлорноватистой кислоты (HOCl) и окисление ряда ароматических субстратов. HOCl является мощным антибактериальным агентом и частью врожденного иммунного ответа. Однако HOCl повреждает все виды биополимеров, и ее избыток может приводить к галогенирующему стрессу, сопровождающему хронические воспалительные заболевания, в том числе атеросклероз [13, 34]. Расположение в области димеризации петли 885–890 экранирует ее и, предположительно, будет мешать образованию упомянутых выше белок-белковых комплексов, лишая ЦП ингибирующего действия на миелопероксидазу и пероксидазу эозинофилов. Таким образом, в результате действия избытка ионов меди эффективность реализации части функций ЦП может существенно снижаться.
Рис. 5.
Потенциальные сайты связывания ионов свободной меди: а – контакт в области Met580, б – контакт в области Glu419.
Работа выполнена при финансовой поддержке Совета по грантам Президента РФ (грант № МД-1901.2020.4) в части выделения и очистки ЦП, Министерства науки и высшего образования РФ в рамках Государственного задания ФНИЦ “Кристаллография и фотоника” РАН в части обработки малоугловых данных и при поддержке НИЦ “Курчатовский институт” (Приказ № 1360) в части измерения экспериментальных кривых МУРР и моделирования димера ЦП.
Список литературы
Chiti F., Dobson C.M. // Annu. Rev. Biochem. 2006. V. 75. P. 333. https://doi.org/10.1146/annurev.biochem.75.101304.123901
Soto C. // Nat. Rev. Neurosci. 2003. V. 4. P. 49. https://doi.org/10.1038/nrn1007
Hedberga X.Y.S., Dobryden I., Chaudhary H. et al. // Colloids Surf. B: Biointerfaces. 2019. V. 173. P. 751. https://doi.org/10.1016/j.colsurfb.2018.10.061
Brown D.R., Qin K., Herms J.W. et al. // Nature. 1997. V. 390. P. 684. https://doi.org/10.1038/37783
Atwood C.S., Moir R.D., Huang X. et al. // J. Biol. Chem. 1998. V. 273. P. 12817. https://doi.org/10.1074/jbc.273.21.12817
Paik S.R., Shin H.J., Lee J.H. et al. // Biochem. J. 1999. V. 340. P. 821.
Morgan C.J., Gelfand M., Atreya C. et al. // J. Mol. Biol. 2001. V. 309. P. 339. https://doi.org/10.1006/jmbi.2001.4661
Brown D.R., Qin K., Herms et al. // Nature (London). 1997. V. 390. P. 684. https://doi.org/10.1038/37783
Multhaup G., Schlicksupp A., Hesse et al. // Science. 1996. V. 271. P. 1406. https://doi.org/10.1126/science.271.5254.1406
Squitti R., Quattrocchi C.C., Salustri C. et al. // Prion. 2008. V. 2. P. 23. https://doi.org/10.4161/pri.2.1.6297
Lindely M.C. // Metallomics. 2016. V. 8. P. 887. https://doi.org/10.1039/C6MT00103C
Sabatucci A., Vachette P., Vasilyev V.B. et al. // J. Mol. Biol. 2007. V. 371. P. 1038. https://doi.org/10.1016/j.jmb.2007.05.089
Samygina V.R., Sokolov A.V., Bourenkov G. et al. // PlosOne. 2013. V. 8. P. e67145. https://doi.org/10.1371/journal.pone.0067145
Sokolov A.V., Dadinova L.A., Petoukhov M.V. et al. // Biochem. (Moscow). 2018. V. 83. P. 701. https://doi.org/10.1134/S000629791806007X
Samygina V.R., Sokolov A.V., Pulina M.O. et al. // Crystallography Reports. 2008. V. 53. P. 655. https://doi.org/10.1134/S1063774508040172
Sato M., Schilsky M.L., Stockert R.J. et al. // J. Biol. Chem. 1990. V. 265. P. 2533.
Samygina V.R., Sokolov A.V., Bourenkov G. et al. // Metallomics. 2017. V. 9. P. 1828. https://doi.org/10.1039/C7MT00157F
Соколов А.В., Костевич В.А., Романико Д.Н. и др. // Биохимия. 2012. Т. 77. С. 775.
Peters G.S., Zakharchenko O.A., Konarev P.V. et al. // Nucl. Instrum. Methods Phys. Res. A. 2019. V. 945. P. 162616. https://doi.org/10.1016/j.nima.2019.162616
Blanchet C.E., Spilotros A., Schwemmer F. et al. // J. Appl. Cryst. 2015. V. 48. P. 431. https://doi.org/10.1107/S160057671500254X
Feigin L.A., Svergun D.I. Structure Analysis by Small-Angle X-Ray and Neutron Scattering. New York: Plenum Press. XIII, 1987. 335 p. https://doi.org/10.1007/978-1-4757-6624-0
Konarev P.V., Volkov V.V., Sokolova A.V. et al. // J. Appl. Cryst. 2003. V. 36. P. 1277. https://doi.org/10.1107/S0021889803012779
Guinier A. // Ann. Phys. (Paris). 1939. V. 12. P. 161. https://doi.org/10.1051/anphys/193911120161
Svergun D.I. // J. Appl. Cryst. 1992. V. 25. P. 495. https://doi.org/10.1107/S0021889892001663
Porod G. // General Theory, in Small-Angle X-ray Scattering / Eds. Glatter O., Kratky O. London: Academic Press, 1982. P. 17.
Petoukhov M.V., Franke D., Shkumatov A.V. et al. // J. Appl. Cryst. 2012. V. 45. P. 342. https://doi.org/10.1107/S0021889812007662
Boivin S., Aouffen M., Founier A. et al. // Biochem. Biophys. Res. Commun. 2001. V. 288. P. 1006. https://doi.org/10.1006/bbrc.2001.5881
Kozakov D., Hall D.R., Xia B et al. // Nature Protocols. 2017. V. 12. P. 255. https://doi.org/10.1038/nprot.2016.169
Ravin H.A. // J. Lab. Clin. Med. 1961. V. 58. P. 161.
Varfolomeeva E.Y., Semenova E.V., Sokolov A.V. et al. // Free Radical Res. 2016. V. 50. P. 909. https://doi.org/10.1080/10715762.2016.1197395
Tamás M.J., Fauvet B., Christen Ph. et al. // Curr. Genet. 2018. V. 64. P. 177. https://doi.org/10.1007/s00294-017-0748-x
Wu Zh., Fernandez-Lima A., Russel D.H. // J. Am. Soc. Mass. Spectr. 2010. V. 21. P. 522. https://doi.org/10.1016/j.jasms.2009.12.020
Sokolov A.V., Kostevich V.A., Zakharova E.T. et al. // Free Radical Res. 2015. V. 46. P. 800. https://doi.org/10.3109/10715762.2015.1005615
Panasenko O.M., Torkhovskaya T.I., Gorudko I.V. et al. // Biochem. (Moscow). 2020. V. 85. (S. 1.) P. 34. https://doi.org/10.1134/S0006297920140035
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография