Кристаллография, 2022, T. 67, № 4, стр. 608-616
Строение и физико-химические свойства трех структурных форм органического люминофора 2-((2-бензо[d]тиазол-2-ил)фенил)карбомаил)бензойной кислоты
Л. Г. Кузьмина 1, *, С. И. Беззубов 1, С. В. Кулагин 2, Б. М. Болотин 2, 3, **
1 Институт общей и неорганической химии РАН им. Н.С. Курнакова
Москва, Россия
2 ООО Фирма “ОЛБО”
Москва, Россия
3 Национальный исследовательский центр “Курчатовский институт” – ИРЕА
Москва, Россия
* E-mail: kuzmina@igic.ras.ru
** E-mail: bolotin70@yandex.ru
Поступила в редакцию 03.08.2021
После доработки 28.09.2021
Принята к публикации 28.09.2021
- EDN: RBKBVK
- DOI: 10.31857/S0023476122030134
Аннотация
По результатам исследований методами рентгеноструктурного анализа монокристаллов, дифференциально-сканирующей калориметрии и люминесцентной спектроскопии установлено, что причиной цветовых различий флуоресценции люминофора 2-((2-(бензо[d]тиазол-2-ил)фенил)карбамоил)бензойной кислоты (I) является его существование в трех структурных формах, две из которых представляют разные кристаллические модификации, а одна – аморфную. При облучении соединения УФ-светом появляется зеленое, желтое и оранжевое свечение. Переход от формы с зеленым свечением к форме с желтым свечением, равно как и от формы с желтым к форме с оранжевым свечением, не является фазовым переходом типа кристалл–кристалл, а реализуется как переход типа твердое вещество1–расплав–кристалл2. В кристаллических структурах наблюдается ослабление внутримолекулярной водородной связи под влиянием межмолекулярной водородной связи. Оно тем сильнее, чем прочнее образовавшаяся связь. Ослабление внутримолекулярной водородной связи коррелирует со степенью смещения люминофорной полосы в длинноволновую область.
ВВЕДЕНИЕ
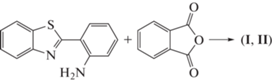
Настоящая работа является продолжением исследования структуры и свойств соединений, проявляющих флуоресценцию с аномально большим сдвигом Стокса [1]. Ранее установлено, что возникновение внутримолекулярной водородной связи N–H⋅⋅⋅N в стерически напряженных орто-арилзамещенных бензоксазинонах, хиназолинонах или бензтиазолах может приводить к получению соответствующего флуоресцентного соединения [2]. В частности, таким соединением может быть 2-((2-(бензо[d]тиазол-2-ил)фенил)карбамоил)бензойная кислота (I). Для его получения проведена реакция взаимодействия 2-(2-аминофенил)бензтиазола с фталевым ангидридом:
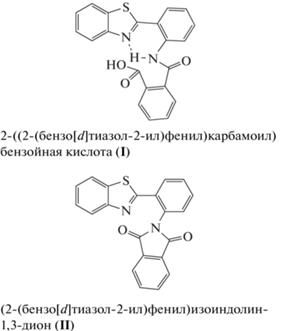
В результате этой реакции можно ожидать образования двух соединений (I и II): Соединение I может обладать внутримолекулярной водородной связью с участием экзо- и эндоциклических атомов азота, что должно приводить к возникновению флуоресценции с аномально большим сдвигом Стокса. У соединения II такой водородной связи быть не может, и ожидать в этом случае подобной флуоресценции нельзя. Аналогичным образом в о-аминоарилзамещенных бензоксазинонах и хиназолинонах может образовываться соответствующий фталимид (IIбенз и IIхин). Действительно, проведя упомянутый выше синтез в ледяной уксусной кислоте, получили бесцветное соединение с интенсивной флуоресценцией. Это свойство, а также элементный анализ свидетельствуют о том, что получившееся соединение является соединением I.При облучении УФ-светом соединение I флуоресцирует, давая свечение трех разных цветов – оранжевое, желтое и зеленое. Объяснением эффекта цветовых различий флуоресценции может быть существование соединения I в трех разных структурных формах. Возможно, они представляют разные кристаллические модификации I. Также можно предположить образование сольватированных кристаллических форм, включающих в себя малые молекулы растворителя в качестве дополнительного строительного блока кристаллической структуры. Эти молекулы могут встраиваться в систему водородных связей, создавая новые варианты супрамолекулярной архитектуры. Для выяснения истинной причины рассматриваемого явления проведено комплексное изучение полученного соединения разными методами, включая рентгеноструктурный анализ (РСА) монокристаллов, дифференциально-сканирующую калориметрию (ДСК) и люминесцентно-спектроскопическое исследование выделенных форм соединения I. Для сравнительного анализа геометрии проведено рентгеноструктурное исследование соответствующего фталимидного производного II для хиназолинонового аналога
(IIхин), который в отличие от II и IIбенз удалось получить в виде качественных монокристаллов.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Бесцветное соединение I получено при взаимодействии 2-(2-аминофенил)бензтиазола с фталевым ангидридом в ледяной уксусной кислоте при 50°С в присутствии сульфаминовой кислоты. Элементный анализ выполнен на приборе CHNS Eurovector EuroEA 3000. Найдено: С 67.22, 67.49; Н 3.71, 3.75; N 7.46, 7.51; S 9.02, 8.79 мас. %. Химическая формула C21H14N2O3S. Вычислено: С 67.37, Н 3.77, N 7.48, S 8.56 мас. %.
Бесцветное соединение IIхин получено длительным кипячением с обратным холодильником соответствующего Iхин в ледяной уксусной кислоте.
ДСК-исследование проводили на сканирующем калориметре DSC-60 Plus (Shimadzu, Japan) в токе аргона при скорости нагрева 5°C/мин.
Микроскопия. Визуально монокристалл наблюдали, используя оптическую систему ДСК (Linkam DSC600), оснащенную микроскопом Olimpus BX43, при его нагревании до 200°С со скоростью 5°C/мин.
Люминесцентный анализ. Спектры испускания твердых образцов регистрировали при температуре 5°C на люминесцентном спектрометре Perkin Elmer LS55.
Рентгеноструктурный анализ. Монокристалл каждого из соединений Iо и Iж, а также IIхин, пригодный для РСА, помещали на дифрактометр CCD D8 Venture (MoKα-излучение, графитовый монохроматор, ω-сканирование) и выдерживали под потоком охлажденного азота. Первичную обработку экспериментальных данных проводили с помощью программы SAINT [3].
Структуры расшифрованы прямыми методами и уточнены методом наименьших квадратов в анизотропном приближении смещений всех атомов, кроме водорода. Положения атомов водорода рассчитаны геометрически. Их уточнение проводили по модели наездника. Кристаллографические параметры, данные эксперимента и результаты уточнения структуры приведены в табл. 1. Все расчеты выполнены по программе OLEX-2 [4, 5].
Таблица 1.
Кристаллографические параметры, данные эксперимента и результаты уточнения структур Io и Iж
| Формула, соединение | C21H14N2O3S, Io | C21H14N2O3S, Iж |
|---|---|---|
| Сингония, пр. гр., Z | Моноклинная, P21/n, 4 | Ромбическая, Pna21, 8 |
| a, b, c, Å | 11.936(2), 7.0878(13), 20.017(4) | 14.1665(6), 6.2036(3), 38.9018(18) |
| β, град | 91.359(6) | 90.00 |
| V, Å3 | 1693.0(5) | 3418.8(3) |
| Dx, г/см3 | 1.469 | 1.443 |
| Излучение; λ, Å | MoKα; 0.71073 | |
| μ, см–1 | 0.217 | 0.215 |
| Т, К | 150 | |
| Размер образца, мм | 0.16 × 0.12 × 0.08 | 0.10 × 0.04 × 0.02 |
| Дифрактометр | Bruker Venture D8 | |
| Учет поглощения; Тmin, Tmax | SADABS; 0.811, 0.971 | SADABS; 0.824, 0.970 |
| 2θmax, град | 53.34 | 54.34 |
| Пределы h, k, l | –14 ≤ h ≤ 15, –8 ≤ k ≤ 8, –25 ≤ l ≤ 25 | –18 ≤ h ≤ 18, –7 ≤ k ≤ 7, –49 ≤ l ≤ 49 |
| Число отражений: измеренных/независимых (N1), Rint/c I > 2σ(I) (N2) | 19 708/3546, 0.0492/2947 | 40 236/3832, 0.0547/3610 |
| Метод уточнения | МНК по F 2 | |
| Число параметров | 248 | 489 |
| R1/wR2 по N1 | 0.0571/0.1023 | 0.1003/0.1855 |
| R1/wR2 по N2 | 0.0454/0.0969 | 0.0742/0.1720 |
| S | 1.054 | 1.154 |
| Δρmin/Δρmax, э·Å–3 | –0.29/0.26 | –0.33/0.83 |
| Параметр Флэка | – | 0.12(14) |
| Программы | SAINT [3], Olex-2 [4, 5] | |
Кристаллографические данные депонированы в Кембриджский банк структурных данных, CCDC: 2098844 (Io), 2098855 (Iж), 2098856 (IIхин). Рентгенодифракционные исследования проведены в ЦКП ИОНХ РАН.
Таблица 2.
Кристаллографические параметры, данные эксперимента и результаты уточнения структуры IIхин
| Формула, соединение | C24H17N3O5, IIхин |
|---|---|
| Сингония, пр. гр., Z | Триклинная, Р$\bar {1}$, 2 |
| a, b, c, Å | 7.4667(10), 10.1602(12), 13.8284(17) |
| α, β, γ, град | 75.043(4), 80,996(4), 85.821(4) |
| V, Å3 | 1000.5(2) |
| Dx, г/см3 | 1.419 |
| Излучение; λ, Å | MoKα; 0.71073 |
| μ, см–1 | 0.102 |
| Т, K | 100 |
| Размер образца, мм | 0.28 × 0.22 × 0.18 |
| Дифрактометр | Bruker Venture D8 |
| Учет поглощения; Тmin, Tmax | SADABS; 0.801, 0.971 |
| 2θmax, град | 56.62 |
| Пределы h, k, l | –9 ≤ h ≤ 9, –13 ≤ k ≤ 13, –18 ≤ l ≤ 18 |
| Число отражений: измеренных/независимых (N1), Rint/c I > 2σ(I) (N2) | 12 669/4951, 0.0363/4160 |
| Метод уточнения | МНК по F 2 |
| Число параметров | 291 |
| R1/wR2 по N1 | 0.0504/0.1129 |
| R1/wR2 по N2 | 0.0416/0.1076 |
| S | 1.046 |
| Δρmin/Δρmax, э Å–3 | –0.32/0.35 |
| Программы | SAINT [3], Olex-2 [4, 5] |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кристаллизация I из разных растворителей во всех случаях приводит к получению смеси мелких (средний размер ∼0.1 мм) пластинчатых кристаллов, бесформенных кристаллических сростков (средний размер ∼0.3 мм) и рентгеноаморфного порошка. Все компоненты смеси флуоресцируют при УФ-облучении, давая разное свечение – оранжевое (581 нм), желтое (568 нм) и зеленое (540 нм) (формы Io, Iж и Iз соответственно). Части вещества, дающие оранжевое и желтое свечение, представлены кристаллическими формами. Часть вещества, дающая зеленое свечение, находится в рентгеноаморфном состоянии (не гаснет в поляризованном свете микроскопа и не дает рентгеновской дифракционной картины). Многочисленные попытки вырастить кристаллы “зеленой” формы соединения методом диффузной кристаллизации при использовании большого набора растворителей оказались безрезультатными. Во всех случаях получались смеси кристаллов только “желтой” и “оранжевой” форм и аморфной “зеленой” формы. Логично предположить, что кристаллов, дающих зеленое свечение, не существует; зеленое свечение характерно исключительно для аморфной формы соединения.
Поскольку люминесценция – это свойство молекул, а не вещества как совокупности взаимодействующих между собой молекул, зеленое свечение обусловлено особенностями строения самих молекул, поскольку в аморфном состоянии не создается надмолекулярной структуры, способной воздействовать на электронные эффекты, определяющие спектральные характеристики соединения. Поэтому зеленая полоса в спектре люминесценции I является тем репером, в сравнении с которым можно судить о степени воздействия молекулярного окружения на электронные эффекты в молекуле. Более существенный сдвиг этой полосы люминесценции в оранжевой форме Iо по сравнению с ее положением в желтой форме Iж должен свидетельствовать о более значительном ослаблении в ней внутримолекулярной водородной связи, ответственной за возникновение флуоресценции, которое обусловлено межмолекулярными водородными связями в кристалле.
Формы вещества Io, Iж и Iз присутствуют в разных соотношениях во всех образцах, кристаллизованных в разных растворителях. Каждый из образцов, содержащий кристаллизат с небольшим количеством растворителя, после хранения в холодильнике (при 6°С) и при комнатной температуре (22°С) дает как разное соотношение указанных форм, так и их разное распределение по объему сосуда. Это свидетельствует о том, что в растворе осуществляется динамическое равновесие форм, положение которого зависит от внешних условий (температуры и природы растворителя).
Визуальное наблюдение под микроскопом процесса нагрева монокристалла формы Iж на нагревательном столике при УФ-освещении показывает, что ниже температуры 173°С с кристаллом ничего не происходит. При температуре выше 173°С кристалл начинает менять цветовой тон флуоресценции, превращаясь из кристалла желтого свечения в кристалл оранжевого свечения (рис. 1).
Рис. 1.
Изменение свечения монокристалла размером ∼0.15 мм при повышении температуры в ходе его УФ-облучения.

Этот процесс мог бы быть похож на фазовый переход кристалл–кристалл, если бы не следующее наблюдение. Изменение цвета свечения происходит в изолированных, но быстро разрастающихся областях кристалла, в которых наблюдается локальное плавление. Почти одновременно с плавлением формы Iж в этих областях происходит кристаллизация формы Iо, которая более тугоплавкая, чем форма Iж. Таким образом, переход от формы Iж к форме Iо не является фазовым переходом типа кристалл–кристалл, а осуществляется как переход кристалл(Iж)–расплав–кристалл(Iо). Кристаллизация оранжевой формы из расплава желтой формы происходит стремительно и в изолированных областях, так что внешняя форма исходного кристаллического образца не успевает измениться. Представляло интерес исследовать термическое поведение всех трех форм соединения.
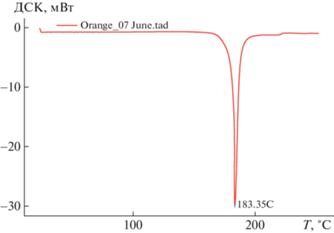
На рис. 2 показана кривая ДСК формы Iо. На ней наблюдается один пик, отвечающий плавлению формы Io при температуре 183.35°С. Небольшое дальнейшее повышение температуры (на ∼1–2°) сопровождается разложением вещества; оно утрачивает способность люминесцировать, превращаясь в соединение II с отщеплением воды.
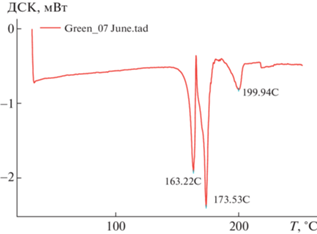
Более сложный вид имеет ДСК-кривая формы Iз (рис. 3). На ней выделяются два пика при температуре 163.22 и 173.53°С. Первый пик соответствует плавлению зеленой формы, затем из полученного расплава кристаллизуется новая форма, которая плавится при более высокой температуре 173.53°С. Эта температура соответствует описанному выше, наблюдавшемуся плавлению монокристалла желтой формы (рис. 1). Поэтому можно предположить, что из расплава зеленой формы кристаллизуется желтая форма с последующим ее плавлением. Таким образом, данная термограмма отвечает фазовым переходам твердое вещество(Iз)–расплав–кристалл(Iж).
Основная масса желтой формы присутствует в образцах в виде мелкокристаллической пыли, покрывающей кристаллы оранжевой формы. Удалось отыскать лишь несколько очень мелких кристаллов Iж, что позволило провести РСА и визуально изучить монокристалл на нагревательном столике под микроскопом, но такого количества недостаточно для проведения ДСК-исследования.
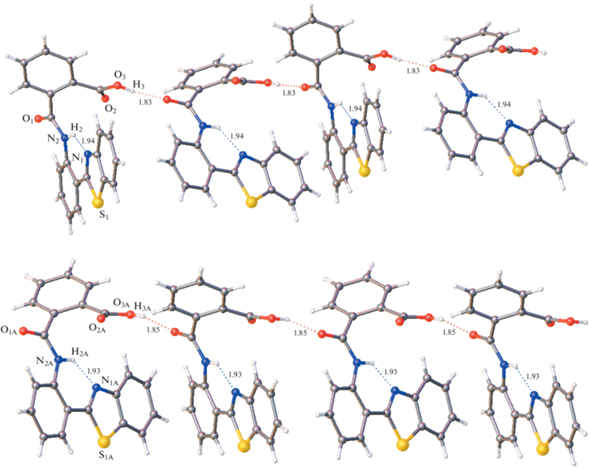
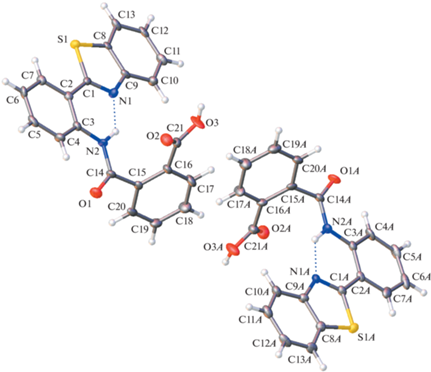
Рентгеноструктурный анализ. Строение молекул и нумерация атомов в молекулах оранжевой и желтой форм показаны на рис. 4 и 5. В независимой части кристаллической ячейки Iж присутствуют две кристаллографически независимые молекулы. Нумерация соответствующих атомов во всех молекулах одинакова; во второй независимой молекуле в кристаллах Iж к номеру добавлен суффикс А.
Рис. 4.
Строение молекулы в кристаллах Iо, эллипсоиды среднеквадратичных отклонений атомов приведены на уровне вероятности 50%.
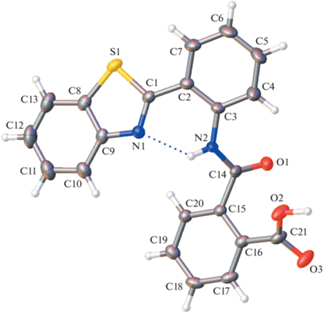
Рис. 5.
Строение двух кристаллографически независимых молекул в кристаллах Iж, эллипсоиды среднеквадратичных отклонений атомов приведены на уровне вероятности 50%.
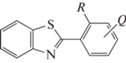
Кристаллы обеих модификаций построены только из молекул I и не включают в себя дополнительный строительный блок в виде сольватной молекулы растворителя. Молекулы имеют неплоское строение, но степень их непланарности различна, причем не только в разных кристаллах, но и в кристаллографически независимых молекулах кристалла Iж. Кембриджская база структурных данных [6] содержит 603 входа для арилзамещенных бензотиазолов, не являющихся составной частью координационного соединения (R – орто-заместитель, Q – любой заместитель в мета- и пара-положениях):
Во всех случаях, когда арильная группа не содержит орто-заместителей (R = H), она располагается в той же плоскости, что и бензотиазольный фрагмент. Если в арильной группе имеется один орто-заместитель – функциональная группа R = = ОН, NH, то этот заместитель сближен с атомом азота тиазольного цикла и образует с ним водородную связь N⋅⋅⋅H–O [7–14] или N⋅⋅⋅H–N [15–18]. Во всех цитированных структурах арилзамещенный бензотиазол плоский. Однако в Кембриджской базе структурных данных представлены случаи, когда арильный и бензотиазольный фрагменты почти перпендикулярны. Во всех таких случаях в одном орто-положении арила или в обоих оказывается объемистый заместитель [19, 20].Отметим, что из двух возможностей минимизировать стерические взаимодействия в рассматриваемых молекулах – за счет разворота объемистого орто-заместителя из плоскости арила или за счет поворота самого арильного фрагмента из плоскости бензотиазола – всегда реализуется первая. Это свидетельствует о сильной тенденции к сопряжению между арильным и бензотиазольным фрагментами.
В молекулах обоих изученных кристаллов Iо и Iж арильный заместитель немного повернут относительно плоскости бензотиазола. В Iж двугранный угол между плоскостями бензотиазола и бензольного кольца С2…С7 в независимых молекулах мал и составляет 3.7(2)° и 2.8(2)°. В кристаллах Iо этот угол больше – 10.71(9)°. При такой геометрии в молекулах обеих кристаллических форм возникает внутримолекулярная водородная связь N2–H⋅⋅⋅N1. В кристаллической форме Iо межатомные расстояния N…N1 и H…N1 составляют 2.682(2) и 2.10 Å. В двух независимых молекулах формы Iж эти расстояния равны 2.667(7)/2.655(7) и 1.94/1.93 Å. Они свидетельствуют о том, что в кристаллах Iж внутримолекулярная водородная связь прочнее, чем в кристаллах Iо. Найденное различие является следствием не только разной степени копланарности бензотиазольного и арильного остатков, но главным образом разного поворота амидной группы из плоскости арильной группы вокруг связи С3–N(2). Действительно, в независимых молекулах Iж соответствующие двугранные углы составляют 14.6(2)° и 16.0(2)°, тогда как в Iо величина достигает 31.82(9)°.
Вывод о том, что внутримолекулярная водородная связь N–H⋅⋅⋅N в кристаллах Iж прочнее, чем в кристаллах Iо, вполне коррелирует с меньшим смещением в них полосы люминесценции в длинноволновую область относительно ее реперного значения в Iз. Это может быть только следствием влияния электронных эффектов, создаваемых слабыми направленными взаимодействиями, и главным образом межмолекулярными водородными связями, структура которых в Iо и Iж существенно различна.
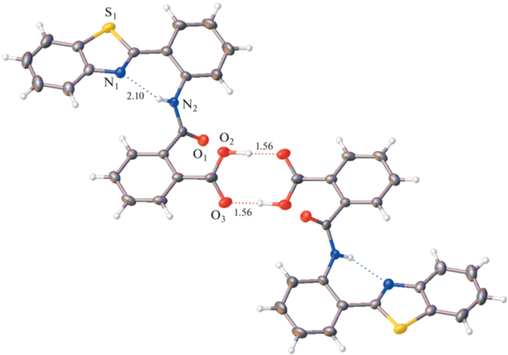
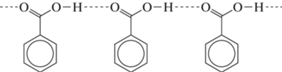
Рассмотрим кристаллическую упаковку соединений. В кристаллах формы Io молекулы образуют типичную для карбоновых кислот систему водородных связей, а именно центросимметричный димер, сформированный за счет пары водородных связей О–Н⋅⋅⋅О (рис. 6). Димер такого типа наиболее распространен и стабилен в кристаллах арилкарбоновых кислот, поскольку в нем достигается самая оптимальная геометрия взаимодействующих фрагментов. Параметры этой пары водородных связей (расстояния О…О 2.668(2) и Н…О 1.56 Å) отвечают довольно прочному взаимодействию. Амидная группа находится в орто-положении к карбоксильной группе, вовлеченной в пару водородных связей, и значительно влияет как акцептор электронов на амидный атом азота. По-видимому, следствием этого является меньшая вовлеченность атома водорода при атоме N2 во внутримолекулярную водородную связь.
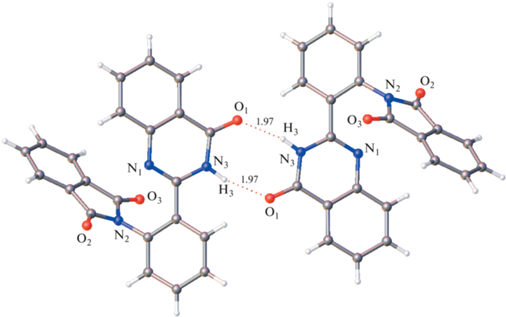
В кристаллах Iж реализуется совершенно иной тип водородного связывания. Можно было бы предположить, что в данной кристаллической упаковке возникает менее распространенный тип водородного связывания, а именно цепочечная структура:
Однако в действительности в данной структуре обнаружен иной, не типичный для карбоновых кислот способ водородного связывания: образуются бесконечные цепи молекул, объединенных водородными связями, но совершенно другого вида. Фрагмент ОН карбоксильной группы образует водородную связь не с карбонильным фрагментом карбоксильной группы соседней молекулы, а с кето-группой амидного фрагмента. Каждая кристаллографически независимая молекула формирует свою цепь (рис. 7). Длины водородных связей в цепочках О3–Н⋅⋅⋅О2 кристалла Iж (Н…О 1.85 и 1.83 Å) значительно больше, чем межмолекулярных водородных связей в структуре Io (Н...О 1.56 Å) и, по-видимому, они меньше влияют на внутримолекулярную водородную связь N–H⋅⋅⋅N.Таким образом, сдвиг полосы люминесценции в длинноволновую область обусловлен ослаблением внутримолекулярной водородной связи в результате воздействия межмолекулярных водородных связей на распределение электронов в молекулах. Этот сдвиг более значителен в кристаллах Io, где возникает центросимметричная пара прочных водородных связей.
В исследованных соединениях I структура молекул уплощенная главным образом вследствие замыкания внутримолекулярной водородной связи. И это оказывается существенным для передачи влияния на распределение электронов в молекуле в целом, поскольку оно должно осуществляться по механизму сопряжения. Как только пропадут условия для стягивающего действия внутримолекулярной водородной связи, очертания молекул будут определяться исключительно стерическими эффектами, и молекулы должны будут утратить свою планарность. Этот факт отмечался выше для структур с объемистыми орто-заместителями арильной группы [19, 20], в которых арил и бензотиазол почти перпендикулярны. Эта особенность должна воспроизводиться и в структуре соответствующего фталимида II. Однако удалось получить монокристалл, пригодный для РСА, только для фталимидного производного 2-(2-аминофенил)хиназолинона IIхин. Кристалл получен в виде сольвата с этанолом. Строение формульных единиц кристалла показано на рис. 8.
Рис. 8.
Строение формульных единиц IIхин, эллипсоиды среднеквадратичных отклонений атомов приведены на уровне вероятности 50%.
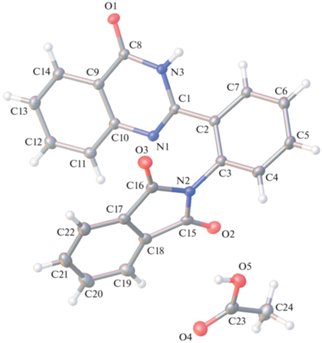
Сольватная молекула этанола образует центросимметричный димер, объединенный парой водородных связей О–Н⋅⋅⋅О (Н⋅⋅⋅О 1.81 Å). Молекула фталимидного производного действительно имеет существенно неплоское строение. Бензольное кольцо С2…С7 повернуто из плоскости гетероцикла хиназолинона вокруг связи С1–С2 на угол 34.59(4)°, а фталимидный фрагмент повернут из плоскости бензольного кольца С2…С7 вокруг связи С3–N2 на угол 74.45(4)°.
В кристалле молекулы IIхин объединены в центросимметричные димеры за счет пары водородных связей (рис. 9). Это лишний раз свидетельствует об особой выгоде такого типа центросимметричных структурных мотивов.
ВЫВОДЫ
Проведено люминесцентно-спектроскопическое, термографическое и рентгеноструктурное исследование трех форм соединения I, обнаруживающих три разных цветовых тона свечения в УФ-свете, а также рентгеноструктурное исследование фталимида IIхин.
Установлено, что две из трех цветовых форм соединения I (Iж и Iо) соответствуют разным кристаллическим модификациям соединения, а третья (Iз) находится в аморфном состоянии.
В системе обнаружены необычные фазовые переходы, при которых локальное плавление вещества происходит одновременно с кристаллизацией иной более тугоплавкой модификации: аморфное вещество(Iз)–расплав–кристалл(Iж) и кристалл(Iж)–расплав–кристалл(Iо).
Список литературы
Кузьмина Л.Г., Салыкин С.Ю., Кулагин С.В. и др. // Кристаллография. 2021. Т. 3. № 3. С. 417. https://doi.org/10.31857/S0023476121030139
Krasovitskii B.M., Bolotin B.M. Organic LuminescentMaterials. Weinheim: VCH Publishers, 1989. 351 p.
Bruker (2008). APEX2, SADABS and SAINT. Bruker AXS Inc. Madison, Wiskonsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Bourhis L.J., Dolomanov O.V., Gildea R.J. et al. // Acta Cryst. A. 2015. V. 71. P. 59. https://doi.org/10.1107/S2053273314027685
Groon C.R., Allen F.H. // Angew. Chem. 2014. V. 53. P. 662.
Gobel D., Rusch P., Duvinage D. et al. // Chem. Commun. 2020. V. 56. P. 15430. DOI: . 57https://doi.org/10.1039/DOCC05780K
Bakthadoss M., Selvakumar R. // J. Org. Chem. 2016. V. 81. P. 3391.
Lakshmanan D., Raj R.M., Selvakumar R. et al. // Acta Cryst. E. 2011. V. 67. P. o2259. https://doi.org/10.1107/S160053681103114X
Kargar H., Kia R., Sharafi Z. et al. // Acta Cryst. E. 2012. V. 68. P. o2628. https://doi.org/10.1107/S1600536812033879
Tanimura M., Watanabe N., Ijuin H.K., Matsumoto M. // J. Org. Chem. 2012. V. 77. P. 4725. https://doi.org/10.1021/jo300417e
Thekkeppat N.P., Lakshmipathi M., Jalilov A.S. et al. // Cryst. Growth Des. 2020. V. 20. № 6. P. 3937.
Wang R., Ding J., Zhang Y. // New J. Chem. 2019. V. 43. P. 9152. https://doi.org/10.1039/c9nj01685f
Venkatachalam T.K., Pierens G.K., Bernhardt P.V., Reutens D.C. // Magn. Reson. Chem. 2015. V. 53. P. 448. https://doi.org/10.1002/mrc.4228
Chen Y., Fang Y., Gu H. et al. // ACS Appl. Mater. Interfaces. 2020. V. 12. P. 55094. https://doi.org/10.2147/NDT.S308360
Singh M., Vaishali, Paul A.K., Singh V. // Org. Biomol. Chem. 2020. V. 18. P. 4459.
Liu D., Ding Q., Y. Fu, Zh. Song, Y. Peng // Org Lett. 2019. V. 21. № 8. P. 2523. https://doi.org/10.1021/acs.orglett.9b00115
Al-Amiery A.A., Al-Temimi A.A., Kadhum A.A.H. et al. // Zh. Strukt Khim. (Russ). 2013. V. 54 P. 593.
Tanimura M., Watanabe N., Ijuin H.K., Matsumoto M. // J. Org. Chem. 2012. V. 77. P. 4725. https://doi.org/10.1021/jo300417e
Goswami S., Das A.K., Manna A. et al. // Tetrahedron Lett. 2014. V. 55. P. 2633.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография