Кристаллография, 2022, T. 67, № 4, стр. 623-627
Предварительные рентгеноструктурные исследования оболочечного белка E вируса клещевого энцефалита дальневосточного подтипа штамма Софьин
К. М. Дубова 1, А. В. Власкина 2, Д. А. Корженевский 3, Ю. К. Агапова 2, Т. В. Ракитина 2, В. Р. Самыгина 1, 2, *
1 Институт кристаллографии А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Федеральный центр мозга и нейротехнологий ФМБА России
Москва, Россия
* E-mail: lera@crys.ras.ru
Поступила в редакцию 21.02.2022
После доработки 21.02.2022
Принята к публикации 22.02.2022
- EDN: NQPACA
- DOI: 10.31857/S0023476122040063
Аннотация
Оболочечный белок Е флавивирусов является привлекательной мишенью для разработки противовирусных препаратов, поскольку играет важную роль в процессе формирования вирусных частиц, а также инвазии вируса в клетку хозяина. Специфических противовирусных препаратов от клещевого энцефалита не существует. Работа посвящена изучению кристаллической структуры эктодомена оболочечного белка Е вируса клещевого энцефалита дальневосточного подтипа штамма Софьин. Знание пространственной структуры может быть основой для разработки специфических ингибиторов конформационных перестроек белка Е, являющихся существенными для первых этапов инфицирования.
ВВЕДЕНИЕ
Флавивирусы относятся к семейству Flaviviradae и могут быть разделены на три группы по типу переносчика инфекции: клещевые, комариные и флавивирусы с неизвестным переносчиком [1]. Известные патогены, поражающие человека, такие как вирус Зика, вирус Денге, вирус Западного Нила, переносятся комарами. Вирус клещевого энцефалита и вирус шотландского энцефалита овец относятся к флавивирусам, переносимым клещами. Они могут вызывать энцефалиты или менингоэнцефалиты центральной нервной системы. Вирус шотландского энцефаломиелита овец (ВШЭО) в основном поражает небольших животных, таких как овцы и красные тетерева. Изредка может поразить человека. Более широко распространенный вирус клещевого энцефалита (ВКЭ), напротив, в основном поражает людей, хотя может поражать и грызунов. Вирус клещевого энцефалита распространен на евразийском континенте, в год регистрируется 10 000–14 000 случаев [2, 3]. Несмотря на наличие вакцин, уровень заражения ВКЭ остается довольно высоким из-за низкого процента вакцинации. Специфических лекарств от ВКЭ не существует. Одним из современных способов разработки лекарств является так называемый “драг дизайн”, который основан на знании пространственной структуры мишени [4, 5]. В случае ВКЭ мишенью является оболочечный белок Е. Этот белок образует наружную поверхность вириона, обеспечивает стабильность вирусной частицы и определяет первые этапы инфекции – связывание с клеточными рецепторами, проникновение вируса в клетку, раздевание вирусной РНК [2].
Существуют три основных подтипа ВКЭ: центрально-европейский, сибирский и дальневосточный. На территории России распространены сибирский и дальневосточный подтипы. Каждый подтип содержит множество штаммов, имеющих небольшие различия в аминокислотной последовательности белков.
Целью работы было получить кристаллы эктодомена белка Е вируса клещевого энцефалита дальневосточного подтипа штамма Софьин, аминокислотная последовательность которого представлена на рис. 1, для дальнейшего анализа структуры апоформы белка, а также для детального структурного исследования взаимодействия белка с прототипами ингибиторов.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение, очистка эктодомена белка Е. Штамм-продуцент рекомбинантного эктодомена белка E получен путем трансформации клеток штамма E. coli BL21(DE3) RIPL рекомбинантной плазмидой pET22. Белок выделяли из телец включения посредством рефолдинга, используя методику, приведенную в [6]. Супернатант концентрировали на кассетах VIVAFLOV 200, PES-мембрана, 10 кДа (Sartorius stedim LAB Ltd), затем на центрифужном концентраторе, 10 кДа (Millipore, Burlington, MA, США), и отфильтровали через фильтр с размером пор 0.22 мкм (PES-мембрана Millipore Millex-GP). Целевой белок очищали методом гель-фильтрации с использованием колонки HiLoad 16/600 Superdex 200prep grade (GE Healthcare, Швеция).
Кристаллизация эктодомена белка Е(sE). Подбор условий кристаллизации мономера и димера эктодомена белка E проводили методом диффузии в парах в варианте сидячей капли. Капли получали смешиванием 0.7 мкл раствора белка концентрации 5 мг/мл с 0.7 мкл резервуарного раствора. Объем резервуарного раствора составлял 200 мкл. Поиск первоначальных условий кристаллизации белка проводили с использованием планшетов Intelli-Plate 48-3 (Hampton Research). Поиск условий кристаллизации был проведен с использованием коммерческих скринингов Hampton Research при температуре 20°С. Было выявлено, что ограненные монокристаллы вырастают в кислых буферных системах. Определены начальные условия кристаллизации: 2.0 М сульфата аммония в 0.1 М цитратном буфере, pH 4.0. В этих условиях получены мелкие кристаллы (рис. 2а). Найденные условия оптимизировали путем варьирования концентрации сульфата аммония, рН буфера и использования добавок: полиэтиленгликоля, глицерина и 2-метил-2,4-пентандиола (МПД), пока не были найдены условия, в которых вырастали монокристаллы размером не менее 0.1 мм.
Рис. 2.
Кристаллы эктодомена белка Е вируса клещевого энцефалита, дальневосточный подтип, штамм Софьин: при начальных условиях кристаллизации (а); при условиях после оптимизации (б, в).

Cбор дифракционных данных и предварительный рентгеноструктурный анализ. Кристаллы для получения набора дифракционных данных переносили в криораствор, используя криопетлю (Hampton Research), на 15 с. Наряду с компонентами кристаллизационного раствора криораствор содержал дополнительно 20% глицерина. Затем кристаллы в петле помещали в металлическую кассету, совместимую с автоматической системой смены образцов и находящуюся в жидком азоте. Сбор дифракционных данных проводили при 100 К на станции синхротронного излучения ID30B синхротрона ESRF (Гренобль, Франция) c использованием детектора PILATUS3 6M (Dectris). Данные обрабатывали с использованием программ XDS и XSCALE [7]. Статистика дифракционных наборов приведена в табл. 1, набор собран до разрешения 3.2 Å. Структура решена методом молекулярного замещения по программе MOLREP [8] с использованием структуры эктодомена белка Е ВШЭО (Louping ill virus), уточненной до разрешения 3.6 Å (pdb код 6J5C) [1], в качестве стартовой модели. Полученная модель была уточнена до промежуточного R-фактора 22.6% по программе Refmac [9]. Структуру анализировали с использованием программ Coot [10], PyMol [11] и комплекса программ ССР4 [12].
Таблица 1.
Статистические характеристики дифракционных данных
| Пр. гр. | P4132 |
| a = b = c, Å | 165.06 |
| α = β = γ, град | 90 |
| Длина волны, Å | 0.899990 |
| Расстояние детектор–кристалл, см | 590 |
| Шаг сканирования, град | 0.1 |
| Угол сканирования, град | 360 |
| Мозаичность, град | 0.073 |
| Область разрешения, Å | 50.00–3.2 (3.42–3.2)* |
| Количество рефлексов | 1285978 |
| Количество уникальных рефлексов | 50365 |
| Полнота набора, % | 100 (100) |
| I/ϭ (I) | 32.5 (3.6) |
| Повторяемость | 75.9 (65.4) |
| Rpim | 0.023 (0.221) |
| Rmerge | 0.145 (1.775) |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Первоначальный поиск условий кристаллизации проведен методом диффузии паров растворителя в сидячей капле с использованием коммерческих кристаллизационных наборов фирмы Hampton Research. Найденные условия оптимизировали для получения кристаллов размером 0.1–0.15 мм, которые удовлетворяют требованиям, предъявляемым к кристаллам, пригодным для рентгеноструктурного анализа (рис. 2). Для этого концентрацию сульфата аммония понизили на 0.2–0.4 М по сравнению с исходной, изменили рН и добавили МПД, что позволило сократить количество кристаллов, образующихся в капле, и получить монокристаллы большего размера. Поскольку белок не обладает высокой растворимостью, концентрацию белка не меняли. Наилучшие кристаллы выращены в 1.6–1.8 М сульфате аммония с 2%-ным МПД в 0.1 М цитратном буфере, pH 4.5. Кристаллы вырастали до 0.1–0.15 мм в течение двух–трех дней (рис. 2б).
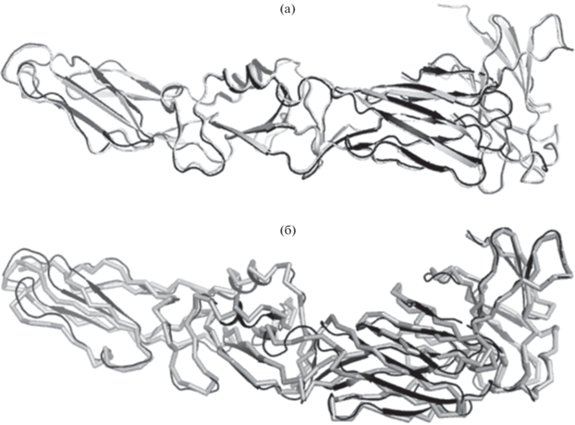
Дифракционные наборы от замороженных кристаллов были собраны при 100 К на источнике синхротронного излучения ESRF. Обработка данных показала, что наивысшее пространственное разрешение составляет 3.2 Å. Кристаллы принадлежат кубической пр. гр. Р4121 с параметрами элементарной ячейки a = b = c = 165.061 Å, α = = β = γ = 90°. Независимая часть элементарной ячейки кристалла содержит одну молекулу. Ход полипептидной цепи сходен с ходом полипептидной цепи в структуре эктодомена белка Е ВКЭ центрально-европейского подтипа, штамм Ньюдорфф (код pdb 1SVB) [13], а также эктодомена белка Е ВШЭО (pdb код 6J5C) (рис. 3). Причем конформация эктодомена белка Е ВШЭО, кристаллы для исследования структуры которого получены в похожих кристаллизационных условиях, имеет меньше различий с конформацией изучаемой структуры, несмотря на меньшую гомологию [1], особенно в области домена III. При наложении молекулы полученной структуры по Сα-атомам на молекулу структуры 6J5C среднеквадратичное отклонение (rmsd) составляет 0.546 Å, а при наложении на молекулу структуры 1SVB – 1.519 Å. Отметим, что структура 1SVB получена из эктодомена белка Е ВКЭ западного подтипа (штамм Ньюдорфф), “срезанного” с поверхности вирусных частиц трипсином. В данной работе получена структура рекомбинантного белка, экспрессированного в бактериальной системе экспрессии. Тем не менее схожесть конформаций рекомбинантного белка и природного показывает, что растворимая часть белка Е, экспрессированная в E. coli, подходит для детального структурного исследования взаимодействия белка с ингибиторами. В настоящее время структура уточняется.
Рис. 3.
Совмещение структуры sE, полученной в настоящей работе, со структурами 6J5C (а) и 1SVB (б). Структуры 6J5C и 1SVB показаны темным цветом.
Работа показала, что, несмотря на выбор бактериальной системы экспрессии для получения рекомбинантного белка E, конформация молекулы близка к наблюдаемой в частице вируса, поэтому кристаллы такого белка могут быть использованы для рентгеноструктурного анализа комплексов с прототипами ингибиторов белка Е. Однако, поскольку из-за низкой растворимости ингибиторов наиболее часто используемый метод получения кристаллов с целью использования их для исследования кристаллических структур таких комплексов – настаивание, при котором, как правило, ухудшается пространственное разрешение кристаллов, найденные условия кристаллизации не являются оптимальными. Разрешение, при котором можно провести достоверный анализ деталей связывания ингибиторов с белком, составляет не менее 2.5 Å [5]. Разрешение кристаллов в процессе настаивания, вероятно, понизится, поэтому полученные кристаллы с разрешением 3.2 Å не дадут возможности получить кристаллические комплексы, обеспечивающие требуемую высокую детальность.
В связи с этим проводится поиск условий кристаллизации белка sE, позволяющих получить cтруктуру с разрешением около 2 Å.
Авторы выражают благодарность ESRF за обеспечение эксперимента по сбору дифракционных данных на синхротроне.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (грант № 18-02-40026), в рамках темплана НИЦ “Курчатовский институт” и при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Xu Yang, Jianxun Qi, Ruchao Peng et al. // J. Virology. 2019. V. 93. № 8. P. e02132. https://doi.org/10.1128/JVI.02132-18
Fuzik T., Formanova P., Růžek D. et al. // Nature Commun. 2018. V. 9. P. 436. https://doi.org/10.1038/s41467-018-02882-0
Gritsun T.S., Lashkevich V.A., Gould E.A. // Antiviral Res. 2003. V. 57. P. 129. https://doi.org/10.1128/JVI.77.1.25-36.2003
Jaeyoung Ha, Hankum Park, Jongmin Park, Seung Bum Park // Cell Chem. Biol. 2021. V. 28. № 3. P. 394. https://doi.org/10.1016/j.chembiol.2020.12.001
Bradley A.R., Echalier A., Fairhead M. et al. // Essays Biochem. 2017. V. 61. № 5. P. 495. https://doi.org/10.1042/EBC20170051
Lianpan Dai, Jian Song, Xishan Lu et al. // Cell Host. Microbe. 2016. V. 19. P. 696. https://doi.org/10.1016/j.chom.2016.04.013
Kabsch W. // Acta Cryst. D. 2010. V. 66. P. 125. https://doi.org/10.1107/S0907444909047337
Vagin A.A., Teplyakov A. // J. Appl. Cryst. 1997. V. 30. P. 1022. https://doi.org/10.1107/S0021889897006766
Murshudov G.N., Skubák P., Lebedev A.A. et al. // Acta. Cryst. D. 2011. V. 67. P. 355. https://doi.org/10.1107/S0907444911001314
Emsley P., Lohkamp B., Scott W. et al. // Acta. Cryst. D. 2010. V. 66. P. 486. https://doi.org/10.1107/S0907444910007493
DeLano W.L., Lam J.W. // Abstr. Papers Am. Chem. Soc. 2005. V. 230. P. 1371.
Collaborative Computational Project Number 4 // Acta Cryst. D. 1994. V. 50. P. 760. https://doi.org/10.1107/S0907444994003112
Rey F.A., Heinz F.X., Mandl C. et al. // Nature. 1995. V. 375. P. 291.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография



