Кристаллография, 2022, T. 67, № 4, стр. 586-596
Новый микропористый дифосфат хлорид меди в ряду гомеотипных соединений: гидротермальный синтез, кристаллическая структура и особенности кристаллохимии
Г. В. Кирюхина 1, 2, *, О. В. Якубович 1, О. В. Димитрова 1, А. С. Волков 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт экспериментальной минералогии РАН
Черноголовка, Россия
* E-mail: g-biralo@yandex.ru
Поступила в редакцию 22.02.2022
После доработки 24.02.2022
Принята к публикации 24.02.2022
- EDN: TZYRRW
- DOI: 10.31857/S0023476122040117
Аннотация
Методом дифракции рентгеновских лучей с использованием синхротронного излучения (λ = = 0.64066 Å) при T = 100 К изучена кристаллическая структура (R = 0.052) нового цеолитоподобного дифосфата хлорида меди |(NH4)5(H2O)9CaVCl3(OH)|[(Cu6(P2O7)4Cl3], полученного в виде монокристаллов методом гидротермального синтеза: a = 17.9357(5), c = 13.5377(4) Å, пр. гр. I4/mcm, Z = 4, ρвыч = 2.541 г/см3. Основная структурная единица – тетрамеры меди, образованные четырьмя пирамидами CuO4Cl, делящими общую вершину – атом Cl. Кластеры состава Cu4O12Cl объединяются через дифосфатные группы и дополнительные центрированные атомами Cu полиэдры с образованием открытого каркаса смешанного типа. Внутри крупных каналов каркаса распределены катионы ${\text{NH}}_{4}^{ + }$, V4+, Ca2+, анионы (OH)–, Cl– и молекулы H2O. Подобные сложные ионные включения характерны для ряда гомеотипных дифосфатов хлоридов меди, проявляющих ионообменные свойства.
ВВЕДЕНИЕ
Кристаллохимическое многообразие фосфатов меди обусловлено ее переменной валентностью, а также способностью ян-теллеровских ионов Cu2+ (d9) в окружении атомов кислорода формировать различные координационные полиэдры: тетрагональные пирамиды и бипирамиды, плоские четырехугольники, тетраэдры и другие многогранники. Оксокомплексы меди, проявляющие свойство амфотерности, могут выполнять кристаллохимическую функцию как катиона (например, в структурах RbCu[Al(PO4)2] и KCu[Al(PO4)2]), центрируя каналы алюмофосфатного паракаркаса совместно с атомами щелочного металла [1, 2]), так и анионообразователя, участвуя в формировании анионных построек смешанного типа [3] вместе с фосфатными тетраэдрами [4, 5]. Большинство известных природных и синтетических оксосолей меди характеризуется достаточно высокой плотностью. Однако среди пористых материалов [6] известны три цеолита – это |Rb4|[Cu4P4O16] с анионным каркасом ABW из медных и фосфатных тетраэдров [7], CuAPO-5 с медно-алюмофосфатным каркасом типа AFI [8] и CuAPO-31 с “классическим” алюмофосфатным каркасом типа ATO и микропримесью катионов меди [9]. Типы каркасов ABW, AFI, ATO соответствуют классификации атласа цеолитных структур [10]. Сложность получения открытых и пористых каркасных построек на основе меди и фосфора связана с достаточно большим ионным радиусом Cu2+ (0.71 Å) по сравнению с Al3+ (0.52) Å и P5+ (0.31 Å) [11] и обусловленной этим фактором довольно редкой тетраэдрической координацией катиона Cu2+. Обычно для синтеза цеолитоподобных соединений в качестве темплатов используют либо органические добавки, либо расплавы солей крупных щелочных или щелочноземельных катионов. В настоящей работе представлены результаты гидротермального синтеза монокристаллов каркасного дифосфата хлорида меди с крупными открытыми каналами, заполненными положительно и отрицательно заряженными ионами-включениями ${\text{NH}}_{4}^{ + }$, V4+, Ca2+, (OH)–, Cl– и молекулами воды.
СИНТЕЗ КРИСТАЛЛОВ, РЕНТГЕНОВСКИЙ ЭКСПЕРИМЕНТ И РАСШИФРОВКА КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ
Смесь реагентов CuCl2 (1 г, 7.4 ммоль), (NH4)2HPO4 (1 г, 7.6 ммоль), VO2 (0.5 г, 6 ммоль), CaCl2 (0.3 г, 2.7 ммоль) была тщательно перемешана в агатовой ступке и засыпана в стандартный автоклав из нержавеющей стали с тефлоновым покрытием объемом 6 мл. Объем заполнения автоклава дистиллированной водой составил 83%. Печь с автоклавом нагревали до 250°С; эту температуру поддерживали неизменной в течение 20 сут с целью завершения реакций гидротермальной кристаллизации. Охлаждение до комнатной температуры происходило естественным путем в течение суток. Продукты фазообразования были промыты горячей дистиллированной водой и высушены при комнатной температуре. Под бинокулярным микроскопом выделены ограненные, изометричные очень мелкие монокристаллы зеленого цвета (рис. 1). По данным качественного рентгеноспектрального анализа, выполненного на энергодисперсионном спектрометре JEOL JSM-6480LV Oxford X-MaxN в Лаборатории локальных методов исследования вещества кафедры петрологии геологического факультета МГУ, в состав кристаллов входят атомы Cu, V, Ca, Cl, P, N и O.
Рис. 1.
Изображение кристалла, полученное в режиме детектирования обратно рассеянных электронов в растровом электронном микроскопе.

Рентгеновские экспериментальные данные, необходимые для расшифровки кристаллической структуры, собраны с помощью источника синхротронного излучения (λ = 0.64066 Å) на многофункциональном дифрактометре PILATUS@SNBL [12] с детектором PILATUS2M на станции BM01 (SNBL) Европейского центра синхротронного излучения (ESRF, Гренобль). Набор интенсивностей получен при 100 К с использованием охлаждающей приставки Oxford Crystream 700+. Дифракционные данные обработаны с учетом коррекции фона, поглощения, эффектов Лоренца и поляризации в программе Crysalis Pro [13]. Кристаллическая структура решена прямыми методами и уточнена с помощью комплекса программ SHELX [14, 15] в рамках программной среды WinGX [16]. На первом этапе расшифровки структуры были локализованы атомы Cu, P, Cl и O, формирующие упорядоченный каркас смешанного типа. При последующем анализе карт разностного распределения электронной плотности внутри крупных полостей каркаса найдены многочисленные пики, интерпретацию которых проводили на основе их координационного окружения, величин межатомных расстояний, химического состава и баланса валентных усилий. В результате выявленные максимумы электронной плотности были успешно идентифицированы как атомы азота ионов аммония, атомы кислорода молекул воды, а также как катионы Ca2+ и V4+, статистически заселяющие позиции в окружении дополнительных дефектных позиций атомов O и Cl. Благодаря использованию низкотемпературных экспериментальных рентгеновских данных, полученных на синхротроне, оказалось возможным локализовать часть атомов водорода в составе групп ${\text{NH}}_{4}^{ + }$ и H2O. Структурные позиции атомов меди, формирующих каркас, оказались расщепленными и расположенными на расстояниях 0.71(2) и 0.43(2) Å от дополнительных атомов ванадия, которые образуют ванадильные связи с добавочными атомами кислорода. Кристаллическая структура уточнена в анизотропном приближении тепловых колебаний большинства атомов до R = 5.2%.
Кристаллографические данные, детали рентгеновского эксперимента и результаты уточнения структуры представлены в табл. 1, координаты атомов и параметры тепловых смещений – в табл. 2. Данные о структуре депонированы в банк данных CCDC/FIZ Karlsruhe под номером 2119351. Установленной структуре отвечает следующая кристаллохимическая формула: |(NH4)5(H2O)4Ca1.1V1.2Cl3.3(H2O,OH)6.4| [(Cu5.2(VO)0.8)(P2O7)4Cl3], при написании которой квадратными скобками выделена каркасная часть, а прямыми – состав внекаркасной, “гостевой” составляющей в открытых каналах. Идеализированная формула может быть записана как |(NH4)5(H2O)9CaVCl3(OH)|7+[(Cu6 (P2O7)4Cl3]7–, Z = 4.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структуры |(NH4)5(H2O)9CaVCl3(OH)|[(Cu6(P2O7)4Cl3]
| M | 1661.95 |
| Сингония, пр. гр., Z | Тетрагональная, I4/mcm, 4 |
| a, с, Å | 17.9357(5), 13.5377(4) |
| V, Å3 | 4354.9(3) |
| ρ, г/см3 | 2.541 |
| Излучение; λ, Å | Синхротрон; 0.64066 |
| Размер кристалла, мм | 0.07 × 0.06 × 0.05 |
| µ, мм–1 | 2.80 |
| T, К | 100 |
| Дифрактометр | PILATUS@SNBL |
| θмакс, град | 27.492 |
| Пределы h, k, l | –25 ≤ h ≤ 25, –25 ≤ k ≤ 25, –15 ≤ l ≤ 15 |
| Число отражений: измеренных/Rвн, Rσ; независимых (N1)/с I > 2σ(I) (N2) | 18 289/0.0348, 0.0174; 1731/1623 |
| Метод уточнения | МНК по F 2 |
| Число уточняемых параметров | 156 |
| Весовая схема | w = 1/[σ2($F_{o}^{2}$) + (0.057P)2 + + 36.370P], P = ($F_{o}^{2}$+ 2$F_{c}^{2}$)/3 |
| R1/ωR1 по N1 | 0.0572/0.1305 |
| R2/ωR2 по N2 | 0.0523/0.1274 |
| S | 1.217 |
| Δρмин/Δρмакс, э/Å3 | –1.62/1.00 |
Таблица 2.
Координаты базисных атомов и параметры тепловых атомных смещений в структуре |(NH4)5(H2O)9CaVCl3(OH)|[(Cu6(P2O7)4Cl3]
| Атом | x/a | y/b | z/c | $U_{{{\text{изо}}}}^{*}$/Uэкв, Å2 | Заселенность позиции |
|---|---|---|---|---|---|
| Cu1 | 0.34668(5) | 0.5 | 0.75 | 0.0150(2) | 0.940(3) |
| V1 | 0.3073(13) | 0.5 | 0.75 | 0.0150(2) | 0.060(3) |
| Cu2 | 0.26610(17) | 0.23390(17) | 0.5 | 0.0096(6) | 0.720(13) |
| V2 | 0.2830(4) | 0.2170(4) | 0.5 | 0.0096(6) | 0.280(13) |
| P1 | 0.36172(4) | 0.35796(4) | 0.60828(7) | 0.0087(2) | 1 |
| N1 | 0.500000 | 0.5 | 0.5 | 0.0225(19) | 1 |
| N2 | 0.2323(3) | 0.5026(3) | 0.5 | 0.0268(11) | 1 |
| O1 | 0.35392(19) | 0.39551(18) | 0.5 | 0.0114(6) | 1 |
| O2 | 0.44515(14) | 0.35225(16) | 0.62681(18) | 0.0160(5) | 1 |
| O3 | 0.31984(14) | 0.41026(13) | 0.67634(19) | 0.0140(5) | 1 |
| O4 | 0.32358(15) | 0.28208(14) | 0.60364(19) | 0.0144(5) | 1 |
| O5 | 0.17936(19) | 0.32064(19) | 0.7315(3) | 0.0255(9) | 1 |
| Cl1 | 0.5 | 0.5 | 0.75 | 0.0244(6) | 1 |
| Cl2 | 0.15745(13) | 0.34255(13) | 0.5 | 0.0383(6) | 1 |
| H1 | 0.207(5) | 0.465(3) | 0.5 | 0.06(3)* | 1 |
| H2 | 0.267(2) | 0.504(4) | 0.461(3) | 0.05(2)* | 1 |
| H3 | 0.194(5) | 0.527(8) | 0.5 | 0.09(4)* | 1 |
| H4 | 0.164(4) | 0.3636(4) | 0.724(6) | 0.01(2)* | 0.5 |
| Cl3 | 0.1524(4) | 0.4999(5) | 0.7723(5) | 0.064(3) | 0.409(9) |
| V3 | 0 | 0.5 | 0.2295(14) | 0.014(8)* | 0.075(12) |
| Ca1 | 0.4487(15) | 0.0513(15) | 0.337(3) | 0.090(13)* | 0.12(2) |
| Ca2 | 0 | 0.457(3) | 0.25 | 0.089(15)* | 0.095(12) |
| V4 | 0.0530(9) | 0.4470(9) | 0.3526(17) | 0.040(6)* | 0.095(8) |
| V5 | 0.117(2) | 0.5 | 0.75 | 0.010(11)* | 0.032(9) |
| V6 | 0.4047(18) | 0.0953(18) | 0.459(3) | 0.043(12)* | 0.041(7) |
| V7 | 0.4290(17) | 0.0710(17) | 0.379(3) | 0.067(15)* | 0.067(13) |
| Ca3 | 0 | 0.5 | 0.168(13) | 0.05(5)* | 0.021(14) |
| Ca4 | 0.473(3) | 0.027(3) | 0.448(6) | 0.07(3)* | 0.038(10) |
| V8 | 0.438(3) | 0.062(3) | 0.463(5) | 0.04(2)* | 0.024(8) |
| O6 | 0.3818(8) | 0.1182(8) | 0.5 | 0.058(3) | 0.668(13) |
| O7 | 0.3482(13) | 0.1518(13) | 0.5 | 0.058(3) | 0.332(13) |
| O8 | 0.0694(4) | 0.4306(4) | 0.3847(9) | 0.0303(15) | 0.568(12) |
| O9 | 0.0498(4) | 0.4502(4) | 0.3042(14) | 0.0303(15) | 0.432(12) |
| O10 | 0.218(5) | 0.5 | 0.75 | 0.032(16)* | 0.06(2) |
| O11 | 0.4898(6) | 0.0102(6) | 0.4806(15) | 0.021(5)* | 0.208(8) |
| O12 | 0.5 | 0 | 0.418(7) | 0.021(5)* | 0.083(16) |
АНАЛИЗ МЕЖАТОМНЫХ РАССТОЯНИЙ И ОПИСАНИЕ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ
Две симметрийно независимые тетрагональные пирамиды CuO4Cl и тетраэдр PO4 диортофосфатной группы являются строительными блоками каркаса – основы кристаллической структуры (рис. 2). Атом Cu1 находится в позиции с симметрией 2 и окружен четырьмя кислородными лигандами в общих положениях на расстояниях 1.939(3) Å × 2 и 1.954(20) Å × 2 и атомом хлора в высокосимметричной позиции 422, удаленной на 2.750(1) Å (табл. 3). Атом Cu2 с более высокой позиционной симметрией m2m координирован четырьмя атомами O на равных расстояниях 1.944(2) Å по квадрату и атомом Cl на расстоянии 2.756(5) Å, достраивающим полиэдр до тетрагональной пирамиды. Позиции Cu1 и Cu2 статистически расщеплены: на коротких расстояниях 0.71(2) и 0.43(2) Å расположены примесные атомы ванадия (рис. 2). Атомы V1 и V2 образуют сильные ванадильные связи V–O = 1.61(9) и 1.65(3) Å с дополнительными кислородными лигандами O10 и O7. Длины связей в фосфатном тетраэдре типичны для пирофосфатов: три из них незначительно варьируются от 1.514(3) до 1.524(2) Å, тогда как существенно увеличенное расстояние 1.619(2) Å отвечает вершинно-мостиковому контакту дифосфатной группы P–О–P.
Рис. 2.
Независимый фрагмент изученной кристаллической структуры, эллипсоиды тепловых колебаний атомов показаны с вероятностью 90%. Операции симметрии: (') y, 1 – x, z; ('') x, 1 – y, 1.5 – z; (*) y, x, 1.5 – z; (**) x, y, 1 – z; (''') 1/2 – y, 1/2 – x, z; (*') 1/2 – y, 1/2 – x, 1 – z.
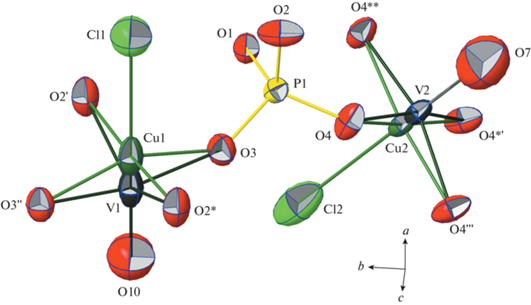
Таблица 3.
Межатомные расстояния* (Å) в кристаллической структуре |(NH4)5(H2O)9CaVCl3(OH)|[(Cu6(P2 O7)4Cl3]
| Cu1-пирамида | V1-пирамида | ||
| Cu1–O2 | 1.939(3) × 2 | V1–O10 | 1.61(9) |
| Cu1–O3 | 1.954(2) × 2 | V1–O3 | 1.907(4) × 2 |
| Cu1–Cl1 | 2.750(1) | V1–O2 | 2.098(10) × 2 |
| (Cu1–O10)** | 2.31(9) | ||
| Тетрагональная Cu2-пирамида | Тетрагональная V2-пирамида | ||
| Cu2–O4 | 1.944(2) × 4 | V2–O7 | 1.65(3) |
| Cu2–Cl2 | 2.756(5) | V2–O4 | 1.965(3) × 4 |
| (Cu2–O7)** | 2.08(3) | ||
| P1-тетраэдр | V3-тетраэдр | ||
| P1–O3 | 1.514(3) | V3–O9 | 1.62(2) × 2 |
| P1–O2 | 1.521(3) | V3–O8 | 2.34(2) × 2 |
| P1–O4 | 1.524(2) | ||
| P1–O1 | 1.619(2) | ||
| V7-тетраэдр | Ca3-семивершинник | ||
| V7–O12 | 1.88(4) | Ca3–O9 | 2.24(15) |
| V7–O6 | 2.03(4) | Ca3–O11 | 2.55(18) × 2 |
| V7–Cl3 | 2.42(4) × 2 | Ca3–Cl3 | 3.08(8) × 4 |
| Ca4-пирамида | N2${\text{H}}_{4}^{ + }$-девятивершинник | ||
| Ca4–O6 | 2.42(6) | N2–O1 | 2.907(6) |
| Ca4–O9 | 2.42(7) × 2 | N2–O2 | 2.908(5) × 2 |
| Ca4–O8 | 2.95(7) × 2 | N2–O6 | 2.91(2) |
| Искаженный N1${\text{H}}_{4}^{ + }$-тетрагексаэдр | N2–Cl2 | 3.169(6) | |
| N2–O3 | 3.303(5) × 2 | ||
| N1–O1 | 3.221 (3) × 4 | N2–Cl3 | 3.40(1) × 2 |
| N1–O2 | 3.307 (3) × 8 | ||
| N1–Cl1 | 3.384 (1) × 2 | ||
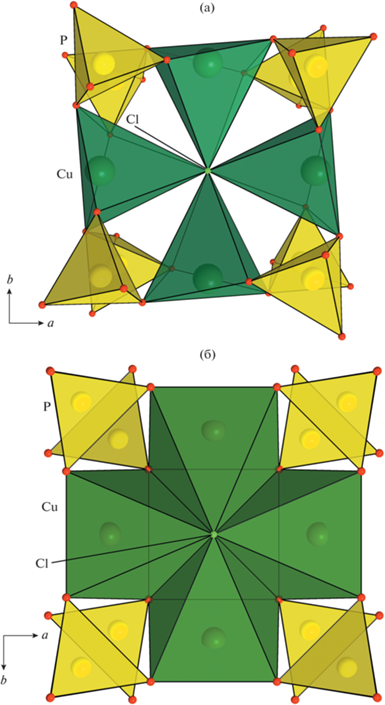
Размноженные осью четвертого порядка пирамиды Cu1O4Cl образуют тетрамеры (CuO4)4Cl с общей вершиной – атомом Cl (рис. 3). В направлении [001] такие кластеры связаны между собой дифосфатными группами с формированием лент, вытянутых вдоль оси z (рис. 4). Тетрагональные пирамиды Cu2O4Cl объединяют ленточные конструкции в анионный каркас смешанного типа [Cu5.2(VO)0.8(P2O7)4Cl3]7– (рис. 3, 4).
Рис. 3.
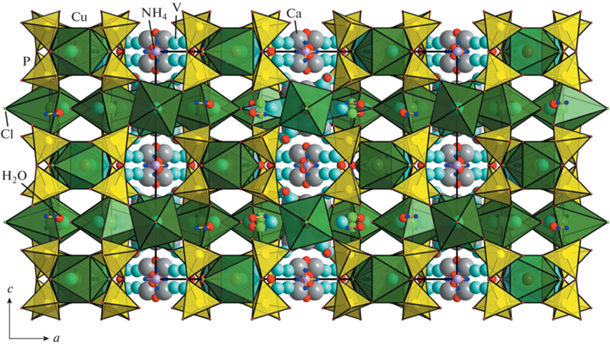
Проекция каркасной кристаллической постройки |(NH4)5(H2O)9CaVCl3(OH)|7+[(Cu5.2(VO)0.8)(P2O7)4Cl3]7– с крупными каналами, ограниченными шестнадцатичленными окнами, на плоскость xy.
Дифосфатная группа P2O7 замкнута на ребре центрированного Cu2 полиэдра, параллельном оси z, ребра фосфатных тетраэдров фиксируют расстояния между соседними в кластере Cu1O4Cl пирамидами в плоскости xy. Такой тип гетерополиэдрического каркаса устойчив при нагреве и обменных реакциях, что экспериментально показано для ряда гомеотипных соединений [17, 18].
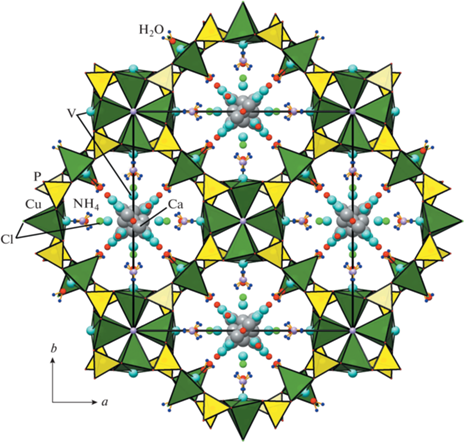
Анионный каркас [Cu5.2(VO)0.8(P2O7)4Cl3]7– пронизан сетью туннелей, наиболее крупные из которых вытянуты вдоль оси z; они ограничены открытыми шестнадцатичленными окнами из пирамид CuO4Cl и тетраэдров PO4 (рис. 3, 5а). Эффективные диаметры канала составляют 5.0 × × 5.0 Å (если ионный радиус кислорода 1.35 Å [10]), что позволяет классифицировать синтезированную фазу как микропористый материал [19]. Каналы меньшего размера параллельны осям х (у), их свободные диаметры эллиптического сечения имеют размеры 0.73 × 1.86 Å (рис. 4). Каркас также содержит поры с топологией [384264], ограненные треугольными, квадратными и шестиугольными окнами (рис. 5б). Плотность каркаса, рассчитанная по формуле, обобщенной для построек из полиэдров различного типа [20],
составляет 12.86. Здесь df – плотность каркаса, $\sum\nolimits_i^{} {n(A_{i}^{{{\text{fr}}}})} $ – количество катионов, участвующих в формировании каркасной постройки, Vuc – объем элементарной ячейки. Согласно [21] плотность каркаса в диапазоне 12.5–20.2 свойственна микропористым цеолитам и цеолитоподобным материалам.Рис. 5.
Фрагменты катионной подрешетки медно-фосфатного каркаса: туннели вдоль [001], ограниченные шестнадцатичленными окнами (а), и фонари с топологией [384264] (б).
Заметим, что анионный “каркас-хозяин”, образованный медными пирамидами и дифосфатными тетраэдрами, в основном упорядочен. Напротив, его каналы заполнены преимущественно статистически разупорядоченными “гостевыми” ионными включениями, как правило, с низкой заселенностью. Только ионы аммония ${\text{NH}}_{4}^{ + }$ в частных положениях 4c и 16k и молекула воды O5 целиком заселяют свои структурные позиции. В результате локализации атомов водорода и уточнения их позиций в структуре установлено, что атомы N2 и O5 формируют слабые нелинейные водородные связи с выступающими в роли акцепторов анионами кислорода и хлора (табл. 4). Ионы аммония центрируют крупные пустоты, образуемые атомами кислорода и хлора на расстояниях 2.907(6)–3.40(1) Å (табл. 3).
Таблица 4.
Характеристики водородных связей в кристаллической структуре |(NH4)5(H2O)9CaVCl3(OH)| [(Cu6(P2O7)4Cl3]
| D–H⋅⋅⋅A | D–H, Å | H⋅⋅⋅A, Å | D⋅⋅⋅A, Å | ∠D–H⋅⋅⋅A, град |
|---|---|---|---|---|
| N2–H1⋅⋅⋅Cl2 | 0.82(1) | 2.38(3) | 3.178(6) | 166(9) |
| N2–H2⋅⋅⋅O2i | 0.82(1) | 2.14(3) | 2.907(5) | 157(6) |
| N2–H3⋅⋅⋅O6ii | 0.82(1) | 2.16(6) | 2.924(6) | 155(13) |
| N2–H3⋅⋅⋅O7ii | 0.82(1) | 2.39(10) | 3.024(9) | 135(12) |
| O5–H4⋅⋅⋅Cl3vi | 0.82(1) | 2.53(3) | 3.305(10) | 158(7) |
| O5–H4⋅⋅⋅O8iv | 0.82(1) | 2.60(6) | 3.217(9) | 133(7) |
| O5–H4⋅⋅⋅O10vi | 0.82(1) | 2.63(6) | 3.304(18) | 140(7) |
Атомы Ca и V в полостях каркаса статистически заселяют позиции на близких расстояниях; они окружены дополнительными атомами Cl3 и O6–O12. Все катионы ванадия V1–V8 в структуре образуют сильные ванадильные связи длиной от 1.53(4) до 1.88(4) Å. Расстояния в полиэдрах кальция варьируются от 2.24(15) до 2.95(7) Å (табл. 3). Атомы Cl3 статистически, с вероятностью 41%, занимающие позиции общего типа, формируют первую координационную сферу большинства слабозаселенных “гостевых” катионов совместно с атомами кислорода молекул воды O6–O12.
Таким образом, отмеченные выше особенности кристаллической структуры с высоким уровнем статистического беспорядка среди “атомов-гостей”, захваченных упорядоченным “каркасом-хозяином”, дают основания предполагать каталитические и сорбционные свойства нового фосфата и его потенциальную востребованность в качестве материала для катализа, обмена, распознавания и разделения ионов, а также переработки радиоактивных отходов.
ОСОБЕННОСТИ КРИСТАЛЛОХИМИИ РЯДА ГОМЕОТИПНЫХ СОЕДИНЕНИЙ
В настоящий момент известны несколько соединений, полученных в гидротермальных условиях и в расплаве солей [17, 18], основой кристаллических структур которых также являются анионные каркасы смешанного типа M6(X2O7)4Cl3 (M = Cu, Mn, X = P, As) из кислотных диортогрупп и оксокомплексов, центрированных атомами переходного металла. Заметим, что замещение Cu на Mn и P на As в этом ряду не приводит к изменению топологии каркасной постройки, и такая группа соединений образует гомеотипный ряд совместно с изученным дифосфат-хлоридом меди (табл. 5). Содержание крупных каналов, способных накапливать как отдельные ионы и молекулы, так и комплексные группы, существенно различается. Так, плоские квадраты меди или золота TCl4 (T = Cu, Pt, Pd, Au), ортофосфатные тетраэдры P(O/OH/F)4 или молекулы соли ACl (A = Cs, Rb, K, NH4) оказываются захваченными структурной матрицей аналогично инкапсулированным ионам Cu2+, V4+, Cl– и OH– в структуре изученной фазы.
Таблица 5.
Некоторые представители ряда гомеотипных соединений с открытыми каркасными постройками*
| Соединение | Пр. гр. | а, b, с, Å | R-фактор | Условия синтеза | Измеренные свойства | Литера-тура |
|---|---|---|---|---|---|---|
| {(NH4)5(H2O)4(Cu5.2
(VO)0.8)[P2O7]4Cl3} ⋅ ⋅ {CaVCl3(H2O,OH)6} |
I4/mcm | 17.9007(3) 13.5442(5) |
0.052 | Гидротермальный метод, 280°С | Настоящая работа | |
| K9Cu6(P2O7)4Cl [P(O,OH)4]Cl2 | I4/mcm | 17.4776(4) 13.3510(4) |
0.069 | Гидротермальный метод, 280°С | Термостойкость вплоть
до 470°С Ионообменные свойства в растворе |
[18] |
| Rb9Cu6(P2O7)4Cl [CuCl4]Cl2** | I4/mcm | 17.8432(2) 13.4932(3) |
0.045 | |||
| K7.62Cs2.88Cu6 (P2O7)4Cl6.5 | I4/nbm | 17.741(2) 13.337(2) |
0.031 | В расплаве соли, 800°С |
Термостойкость вплоть
до 650°С Ионообменные свойства в растворе Топотактические реакции деинтеркаляции – интеркаляции |
[17] |
| Cs8.3Rb2.3Cu6 (As2O7)4Cl6.4 | I4/mcm | 17.928(3) 13.555(3) |
0.037 | |||
| Na4Cs4Cu6(P2O7)4Cl4 | P42/mnm | 15.868(2) 13.238(2) |
0.032 | В расплаве соли, 800°С |
Отсутствие ионообменных свойств из-за эллиптической формы канала | [22] |
| Cs2Cu7(P2O7)4⋅6CsCl | P212121 | 9.942(1), 13.810(2) 30.703(4) |
0.060 | Высокотемпературная реакция вхождения солей, 700°С |
[23] | |
| Cs2Cu5(P2O7)3⋅3CsCl | Pna21 | 13.9425(3) 20.429(1) 9.8366(5) |
0.059 | |||
| Cs4Cu2.2(VO)3.8(P2O7)4 | Pna21 | 13.7364(2) 9.2666(2) 11.5678(2) |
0.030 | Спонтанная кристаллизация из расплава, 850°С |
Магнитная аномалия при T = 22 К | [24] |
** Представлены две фазы; другие примеры – в [18].
Внутреннее содержимое каналов (вне зависимости от конкретного состава) закономерно характеризуется высоким уровнем разупорядочения для всех соединений ряда. Более того, как показано в [17, 18], состав включений может меняться в ходе обменных реакций в воде или солевых растворах. Это означает, что рассматриваемый тип открытого каркаса может быть использован в качестве анионообменного материала. Широкий диапазон температур синтеза кристаллических фаз от 280 до 850°С согласно данным термогравиметрического анализа обеспечивает их высокую термическую стабильность вплоть до 650°С [17, 18].
Несколько структурно родственных дифосфат-хлоридов меди были также синтезированы гидротермально, в солевом расплаве или в ходе высокотемпературных реакций солевых включений [22–24]. Их каркасы построены из тех же структурных единиц – оксохлоридных пирамид меди и дифосфатных групп, отличие заключается в форме каналов. Изометричные шестнадцатичленные окна, окаймляющие крупные туннели в кристаллической структуре изученной фазы |(NH4)5(H2O)9CaVCl3(OH)|[(Cu6(P2O7)4Cl3] (пр. гр. I4/mcm), сменяются окнами в форме эллипса или параллелограмма в структурах Na2Cs2Cu3[P2O7]2 Cl2 (пр. гр. P42/mnm) и Cs2Cu7[P2O7]4⋅6CsCl (пр. гр. P212121) либо каналами с окнами в форме сердца в ромбических ацентричных кристаллических постройках Cs2Cu5[P2O7]3⋅3CsCl и Cs2Cu1.1(VO)1.9[P2O7]2 (пр. гр. Pna21). В процессе роста кристаллов атомы Cs или ионные включения солей [CsCl] и [Na2CsCl]2+, центрирующие туннели различной формы, выступают в качестве темплатов при образовании открытых каркасов. Интересно, что два дифосфата меди, |(NH4)5(H2O)9CaVCl3(OH)| [(Cu5.2(VO)0.8)(P2O7)4Cl3] и Cs2Cu1.1(VO)1.9[P2O7]2 демонстрируют редкий тип изоморфизма Cu2+–VO2+. Замена Cu2+ на V4+ – довольно редкое явление, ранее установленное лишь для сверхпроводников на основе купратов [25, 26].
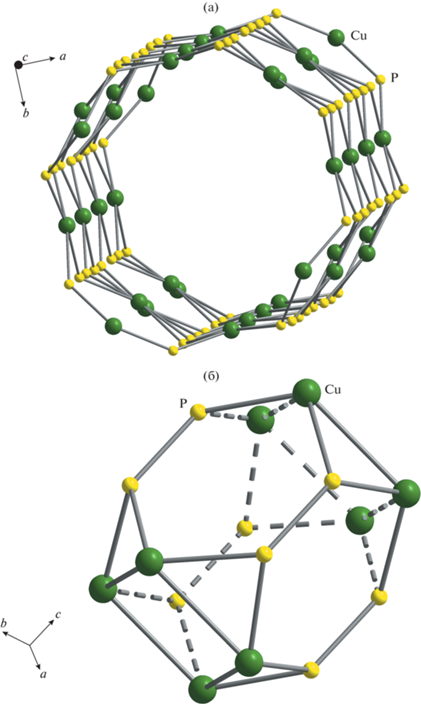
В недавнем обзоре природных и синтетических хлор-оксосолей меди выделены 26 типов полиэдров CuOmCln различной стереометрии [27]. Тетрагональная пирамида CuO4Cl представляет собой типичный пример координации ян-теллеровского катиона Cu2+ и участвует в формировании кристаллических структур нескольких редких минералов из различных химических классов, например ильинскита NaCu5O2(SeO3)2Cl3 [27], набокоита KCu7TeO4(SO4)5Cl [28] и бобкингита Cu5Cl2(OH)8(H2O)2 [29]. Если принять во внимание значительное увеличение разнообразия кристаллических построек природных оксохлоридов меди за счет недавно открытых новых минералов фумарол [27, 30–35], то можно сказать, что структурная единица из четырех медных пирамид, объединенных общей хлорной вершиной (рис. 6а), встречается редко. Такие кластеры состава [Cu4O16Cl] формируют каркас {(Cu5.2(VO)0.8)[P2O7]4Cl3} изученного соединения и родственных ему фаз. Схожие кластеры [Cu4O12Cl] (рис. 6б) описаны в структурах членов меро-плезиотипной полисоматической серии лавендулана, включающей в себя природные арсенаты и фосфаты меди и их синтетические разновидности [36]. Совместно с ортофосфатными тетраэдрами такие кластеры формируют структурные фрагменты {Cu4[PO4]4Cl}, лежащие в основе тетрагональных (и псевдотетрагональных) кристаллических построек в этом полисоматическом ряду. Как видно из рис. 6, различие между двумя типами тетрамеров заключается в способе сочленения пирамид меди – по вершинам либо по ребрам.
Рис. 6.
Структурные фрагменты из пирамид меди и фосфатных тетраэдров в кристаллических постройках изученной фазы (а) и синтетических аналогов минералов группы лавендулана (б).
Отметим, что в многокомпонентной гидротермальной системе была получена минералоподобная фаза Na6Cu7BiO4(PO4)4[Cl,(OH)]3 с кристаллической структурой, также образованной кластерами [Cu4O12Cl] (рис. 6б). В композитной кристаллической постройке медно-висмутового хлорид-фосфата натрия катионная подрешетка медных кластеров характеризуется топологией квадратных сеток кагоме, наличие которой обусловливает редкие магнитные свойства спиновой жидкости в кристаллах [37].
ВЫВОДЫ
В среднетемпературных гидротермальных условиях синтезированы кристаллы водного дифосфата хлорида меди. Исследование монокристаллов методом рентгеновской дифракции на синхротронном источнике излучения при температуре 100 К позволило установить весьма сложную микропористую цеолитоподобную кристаллическую структуру |(NH4)5(H2O)9CaVCl3(OH)|[(Cu6(P2O7)4Cl3] с сильно разупорядоченной “гостевой” частью внутри каналов каркаса. Ее открытый медно-дифосфатный каркас содержит крупные туннели с эффективным диаметром 5 Å и крупные пустоты с топологией [384264], заполненные ионами аммония, молекулами воды, а также целым набором катионов и анионов со статистическим характером распределения атомов в соответствующих слабозаселенных позициях. Установлено место новой фазы в ряду гомеотипных разновидностей. Особенности кристаллической структуры характеризуют новое соединение как потенциальный материал для катализа, ионного обмена и переработки отходов.
Авторы выражают благодарность В.О. Япаскурту за рентгеноспектральный анализ химического состава кристаллов.
Исследование выполнено в рамках гранта Президента Российской Федерации для государственной поддержки молодых российский ученых – кандидатов наук № МК-1613.2021.1.5.
Список литературы
Yakubovich O.V., Kiriukhina G.V., Dimitrova O.V. et al. // Dalton Trans. 2016. V. 45. P. 2598.
Yakubovich O.V., Kiriukhina G.V., Shvanskaya L.V. et al. // Acta Cryst. B. 2020. V. 76. P. 483.
Сандомирский П.А., Белов Н.В. Кристаллохимия смешанных анионных радикалов. М.: Наука, 1984.
Yakubovich O.V., Steele I.M., Kiriukhina G.V. et al. // Z. Krist. 2015. V. 230. № 5. P. 337.
Kiriukhina G., Yakubovich O., Shvanskaya L. et al. // Materials. 2022. V. 15. № 4. P. 1411.
Baerlocher C., McCusker L.B. Database of Zeolite Structures. http://www.iza-structure.org/databases/
Henry P.F., Hughes R.W., Ward S.C. et al. // Chem. Commun. 2000. V. 19. P. 1959.
Muñoz T.Jr., Prakash A.M., Kevan L. et al. // J. Phys. Chem. B. 1998. V. 102. P. 1379.
Finger G., Kornatowski J., Jancke K. et al. // Micropor. Mesopor. Mater. 1999. V. 33. P. 127.
Baerlocher C., McCusker L.B., Olson D.H. Atlas of Zeolite Framework Types. Elsevier, 2007.
Shannon R.D. // Acta Cryst. A. 1976. V. 32. P. 751.
Dyadkin V., Pattison Ph., Dmitriev V. et al. // J. Synchr. Rad. 2016. V. 23. P. 825.
Agilent. 2011. CrysAlis PRO. Agilent Technologies Ltd, Yarnton, Oxfordshire.
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. P. 8.
Farrugia L.J. // J. Appl. Cryst. 2012. V. 45. P. 849.
Huang Q., Ulutagay M., Michener P.A. et al. // J. Am. Chem. Soc. 1999. V. 121. P. 10323.
Williams E.R., Leithall R.M., Rajab R. et al. // Chem. Commun. 2013. V. 49. P. 249.
Rouquerol J., Avnir D., Fairbridge C.W. et al. // Pure Appl. Chem. 1994. V. 66. № 8. P. 1739.
Liebau F., Küppers H. // Acta Cryst. B. 2002. V. 58. P. 457.
Brunner G.O., Meier W.M. // Nature. 1989. V. 337 (6203). P. 146.
Huang Q., Hwu Sh.-J., Mo X. // Ang. Chem. Int. Ed. 2001. V. 40. № 9. P. 1690.
Huang Q., Hwu Sh.-J. // Inorg. Chem. 2003. V. 42. P. 655.
Shvanskaya L., Yakubovich O., Bychkov A et al. // J. Solid State Chem. 2015. V. 222. P. 44.
Liu L., Che G., Liu G. et al. // Physics C. 2003. V. 384. P. 75.
Kurmaev E.Z., Moewes A., Woods G.T. et al. // J. Solid State Chem. 2003. V. 170. P. 188.
Krivovichev S.V., Filatov S.K., Vergasova L.P. // Miner Petrol. 2013. V. 107. P. 235.
Pertlik F., Zemann J. // Mineral. Petrol. 1988. V. 38. P. 291.
Hawthorne F.C., Cooper M.A., Grice J.D. et al. // Mineral. Mag. 2002. V. 66. P. 301.
Pekov I.V., Zubkova N.V., Zelenski M.E. et al. // Mineral. Mag. 2018. V. 77. P. 107.
Badrtdinov D.I., Kuznetsova E.S., Verchenko V.Yu. et al. // Sci. Rep. 2018. V. 8. P. 2379.
Constable E., Raymond S., Petit S. et al. // Phys. Rev. B. 2017. V. 96. P. 014413.
Kornyakov I.V., Vladimirova V.A., Siidra O.I. et al. // Molecules. 2021. V. 26. № 7. P. 1833.
Siidra O.I., Nazarchuk E.V., Agakhanov A.A. et al. // Mineral. Mag. 2019. V. 83. P. 847.
Пеков И.В., Бритвин С.Н., Япаскурт В.О. и др. // Записки РМО. 2020. Т. 149. № 3. С. 1.
Yakubovich O.V., Kiriukhina G.V. // Minerals. 2021. V. 11. № 3. P. 273.
Yakubovich O.V., Shvanskaya L.V., Kiriukhina G.V. et al. // Inorg. Chem. 2021. V. 60. P. 11450.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография