Кристаллография, 2022, T. 67, № 5, стр. 831-849
Самоорганизация белковых молекул при формировании кристаллов и пленок
Ю. А. Дьякова 1, *, М. В. Ковальчук 1, 2
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: Dyakova_YA@nrcki.ru
Поступила в редакцию 12.04.2022
После доработки 14.04.2022
Принята к публикации 14.04.2022
- EDN: MRUOIR
- DOI: 10.31857/S0023476122050034
Аннотация
Представлены наиболее важные, уникальные результаты цикла исследований, проведенных под руководством М.В. Ковальчука, по изучению фундаментальных закономерностей взаимодействия белковых молекул и их самоорганизации при формировании упорядоченных систем. Разработан и апробирован принципиально новый научно-методический подход к мультимасштабному исследованию механизмов организации и структуры белковых систем, основанный на анализе их кристаллической структуры и применении комплекса рентгеновских, синхротронных, нейтронных методов и методов молекулярного моделирования. Данный подход состоит в изучении формирования предкристаллизационной фазы, т.е. образования кластеров-прекурсоров, 3D-фрагментов будущей структуры материала, на начальной стадии атомно-молекулярной организации системы в упорядоченную кристаллическую структуру. На примере модельного белка лизоцима изучены структура предкристаллизационной фазы, механизмы образования ее компонент и термодинамические параметры данной системы при формировании кристаллов и пленок. Разработанный подход эффективно применен к описанию структуры кластеров-прекурсоров в предкристаллизационной фазе ряда других белков, после чего предложенная структура была установлена и подтверждена экспериментально.
ОГЛАВЛЕНИЕ
Введение
1. Методы и подходы к исследованию взаимодействия белков в растворах и тонких пленках
1.1. Комплексный подход к исследованию белковых растворов, тонких пленок и кристаллов
1.2. Методы исследования структуры растворов белков
1.3. Методы анализа структуры белковых кристаллов
1.4. Методы получения и анализа структуры слабоупорядоченных систем
2. Определение структуры растворов в условиях кристаллизации на примере белка лизоцима, выявление механизма влияния термодинамических параметров на процесс кристаллизации
2.1. Об образовании “единиц роста” кристалла в кристаллизационном растворе белка
2.2. Состав кристаллизационного раствора лизоцима в различных условиях
2.3. Исследование динамики олигомеров лизоцима в растворах
2.4. Новый подход к поиску условий кристаллизации
3. Определение роли ионов осадителя в механизме кристаллизации белков по результатам исследований структуры растворов, кристаллов лизоцима и моделирования молекулярной динамики
3.1. Зависимость доли октамеров и димеров от катиона осадителя
3.2. Взаимодействие ионов (металлов и хлора) с молекулами лизоцима и их роль в образовании кристалла
3.3. Молекулярная динамика олигомеров в растворе лизоцима с добавлением осадителя NaCl в зависимости от температуры
4. Формирование ленгмюровских пленок на основе растворов лизоцима в условиях кристаллизации
5. Структура предкристаллизационной фазы для белков протеиназа K и термолизин
Заключение
ВВЕДЕНИЕ
Белки играют ключевую роль во всех жизненно важных физиологических процессах организмов: функционировании органов чувств, метаболизме клеток, передаче информации, формировании иммунного ответа, являются строительным материалом клетки и т.д. Функционирование белковых молекул основано на их специфическом взаимодействии с субстратом (от молекул воды и ионов до макромолекул – белков, ДНК, РНК и др.), определяющимся их трехмерной структурой и реализующимся по принципу “ключ-замок” [1]. Даже небольшие вариации структуры белков, вызванные как мутациями в самой полипептидной цепи, так и изменением ее пространственного строения, обусловленного взаимодействием с молекулярным и ионным окружением, ведут к резкому изменению их активности и функциональных свойств.
Таким образом, знание механизмов взаимодействия белков с компонентами растворов крайне важно для понимания функционирования белков в нативной среде, а также разработки технологий использования белков как функциональных элементов природоподобных технических систем. Сегодня знание трехмерной структуры белков и их комплексов с целевыми молекулами не только имеет фундаментальное значение для исследования механизмов функционирования живых организмов и вирусов, но и является неотъемлемой частью технологических процессов – дизайна и ускоренной разработки терапевтических препаратов и диагностических систем, технологий для сельского хозяйства и промышленной биотехнологии, биоэнергетики, а также создания новых биоподобных материалов.
Начало исследованиям структуры биомолекул с атомарным разрешением было положено в тридцатые годы прошлого века. Так, в 1934 г. получена первая рентгенограмма белкового кристалла, пепсина (одного из протеолитических ферментов), закристаллизованного в 1929 г., а в 1958 г. расшифрованы первые структуры глобулярных белков – миоглобина и гемоглобина.
В настоящее время наибольшее число структур белков и белковых комплексов (более 85%) решено с помощью метода рентгеноструктурного анализа (РСА). Для применения этого метода исследования структуры необходимо предварительно получить кристалл белка, причем чем более совершенным будет кристалл, тем с лучшим разрешением удастся определить структуру белковой молекулы. Белковые кристаллы получают из растворов, как правило, добавляя к раствору белка раствор осадителя, что приводит к изменению растворимости белка. Для того чтобы получить кристалл белка, необходимо, чтобы все параметры раствора (температура, концентрация белка и осадителя, pH, состав буферного раствора) попали в достаточно узкую область значений, при которых белковые молекулы выстраиваются в упорядоченную структуру.
В СССР огромный вклад в кристаллографию вообще и разработку метода РСА в частности внес академик Борис Константинович Вайнштейн, многие годы возглавлявший Институт кристаллографии им. А.В. Шубникова АН СССР. Школа Вайнштейна заложила прочный фундамент развития структурной биологии и оказала решающее влияние на становление РСА биомакромолекул в нашей стране [2]. Механизмы взаимодействия и самоорганизации белковых молекул в растворах, в том числе при образовании белковых кристаллов, изучались ранее в [3]. Было показано, что добавление осадителя к раствору белка приводит к увеличению среднего радиуса частиц, сформированных из молекул белка в растворе [4, 5]. Были сделаны различные предположения о природе и возможной структуре комплексов белков, образующихся при кристаллизации, однако они не нашли однозначного экспериментального подтверждения. В большинстве представленных ранее гипотез о механизмах кристаллизации белков, основанных на предположении об образовании промежуточных белковых комплексов, допускалось, что такие комплексы формируются произвольным образом и могут содержать любое количество молекул.
Таким образом, дальнейшее продвижение в исследовании механизмов самоорганизации белков в упорядоченные системы требовало применения экспериментальных методов исследования структуры биологических молекул в нативном состоянии и в пленках с высоким разрешением. Основа создания и развития таких методов и экспериментальной техники для исследования процессов самоорганизации биологических молекул и систем заложена Михаилом Валентиновичем Ковальчуком. Им был выполнен цикл пионерских работ по развитию метода стоячих рентгеновских волн в области полного внешнего отражения (СРВ в ПВО), позволившего с субангстремной точностью исследовать тонкие слои и пленки [6–8], развит подход по применению данного и других высокоразрешающих рентгеновских методов для исследования биологических пленок [9–11]; создана уникальная экспериментальная техника, включая не имеющие аналогов экспериментальные станции на источнике синхротронного излучения (СИ) [12]. Под руководством Михаила Валентиновича введен в эксплуатацию и модернизирован единственный действующий сегодня на постсоветском пространстве специализированный Курчатовский источник синхротронного излучения (“КИСИ-Курчатов”), инфраструктура которого позволяет проводить комплексные исследования биомолекул и биосистем на современном уровне [12, 13]; создан комплекс “Белковая фабрика”, позволяющий наработать, выделить и очистить любой белок, провести скрининг условий его кристаллизации в автоматическом режиме [2, 14]; создан суперкомпьютерный центр [15] для анализа и обработки экспериментальных данных и молекулярного моделирования.
Поскольку к настоящему времени наибольшее число белковых структур решено с помощью метода РСА, это делает его наиболее эффективным методом определения трехмерной структуры биомолекул с высоким (атомарным) разрешением. Однако доля белков, для которых определена трехмерная структура, составляет проценты от количества известных белков, что связано главным образом с необходимостью получения кристалла белка, поскольку в основе РСА лежат регистрация и анализ дифракционной картины от кристаллической структуры.
С развитием технологий генерации СИ – появлением источников СИ четвертого поколения и рентгеновских лазеров на свободных электронах – требования к размеру кристалла снижаются. Для определения структуры макромолекулы с атомарным разрешением достаточно получить кристаллы субмикронного размера.
Основным “узким” местом определения структуры белков методом РСА остается поиск условий кристаллизации, необходимый даже для получения нанокристаллов, который сегодня проводится методом проб и ошибок. При этом для оценки результата – образования кристалла – может потребоваться от нескольких часов до нескольких месяцев.
Решение указанных выше проблем требует разработки новых методов и подходов к исследованию взаимодействия белковых молекул и механизмов их самоорганизации в упорядоченные системы. Такие подходы и методы должны обеспечить определение с высоким пространственным разрешением структуры не только кристаллов, но и слабоупорядоченных систем, включая растворы. Для эффективного решения данной задачи необходимо применение комплекса взаимодополняющих современных экспериментальных методик определения структуры белков и их комплексов в нативном состоянии с атомарной точностью – синхротронные и нейтронные методы исследования структуры, молекулярное моделирование и пр. Таким образом, знание фундаментальных основ взаимодействия белковых молекул и механизмов их самоорганизации в упорядоченные системы, основанное на применении указанного выше инструментария, необходимо как для решения технологических задач сегодняшнего дня – ускоренного дизайна лекарственных препаратов и методов диагностики, разработки новых биотехнологий, подходов к обеспечению биобезопасности, так и для формирования нового базиса создания принципиально новых природоподобных технологий.
В течение последних нескольких лет научной группой под руководством М.В. Ковальчука проведен цикл работ с целью выявления фундаментальных закономерностей взаимодействия белковых молекул и их самоорганизации при формировании упорядоченных систем на основе применения нового подхода к широкомасштабному исследованию механизмов организации и структуры белковых систем в растворах, основанного на применении синхротронных и нейтронных методов и молекулярного моделирования. В ходе этой работы получен ряд уникальных, прорывных научных результатов, представлению и анализу которых посвящен настоящий обзор.
1. МЕТОДЫ И ПОДХОДЫ К ИССЛЕДОВАНИЮ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ В РАСТВОРАХ И ТОНКИХ ПЛЕНКАХ
Настоящий раздел посвящен методам и подходам к изучению структуры неупорядоченных, слабоупорядоченных и кристаллических систем, позволяющим проводить исследование взаимодействия белков в растворах и тонких пленках.
Под руководством М.В. Ковальчука в НИЦ “Курчатовский институт” создана уникальная инфраструктура для решения современных научных задач, в том числе изучения структуры белков и систем на их основе, включающая в себя экспериментальные станции СИ на источнике “КИСИ-Курчатов” (станции “Ленгмюр”, “РКФМ”, “БиоМУР”, “РСА” и др.) [16], исследовательские комплексы крио-ПЭМ [17], ЯМР [18], Комплекс моделирования и обработки данных исследовательских установок мега-класса [15]. Под его научным руководством ранее были развиты методы структурной диагностики и анализа наносистем, тонких пленок и многослойных систем, как на твердых подложках, так и на поверхности жидкости, на основе сочетания дифракционных, спектральных методов и методов рассеяния рентгеновского излучения, включая метод СРВ в ПВО [6–11, 19–23].
Созданная инфраструктура и указанные выше научно-методические подходы позволяют подобрать комплекс взаимодополняющих, комплементарных методов для исследования белковых систем, в том числе в нативном состоянии, и тем самым проследить переход “от хаоса к порядку” и провести анализ структуры белковых систем на всех его стадиях.
1.1. Комплексный подход к исследованию белковых растворов, тонких пленок и кристаллов
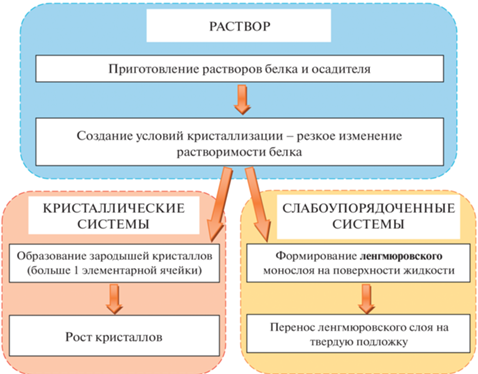
На рис. 1 представлена блок-схема, иллюстрирующая суть (структуру) методологического подхода к исследованию процессов кристаллизации, – от растворов до слабоупорядоченных и кристаллических систем. Методология исследований состоит в изучении белковых систем в трех состояниях (раствор, монослой, кристалл), а также процесса перехода между этими состояниями в различных условиях (температура, концентрация компонентов растворов, тип растворителя и др.).
Рис. 1.
Блок-схема, иллюстрирующая суть (структуру) методологического подхода к исследованию взаимодействия белков в растворах и процессов кристаллизации, – от растворов до слабоупорядоченных и кристаллических систем.
В табл. 1 приведен комплекс взаимодополняющих методов, сгруппированных в соответствии со структурой научно-методического подхода (рис. 1) к исследованию взаимодействий белков в различных системах.
Таблица 1.
Комплекс взаимодополняющих методов исследования взаимодействия белков в растворах и процессов кристаллизации
| Методы исследований | |
|---|---|
| Раствор | 1. Малоугловое рассеяние рентгеновского, синхротронного излучения и нейтронов (МУРР,
МУРН) 2. Динамическое рассеяние света (ДРС) 3. Молекулярная динамика |
| Слабоупорядоченные системы (ленгмюровские монослои) | 4. π/A-изотерма 5. Атомно-силовая микроскопия (АСМ) 6. Рентгеновская рефлектометрия 7. Стоячие рентгеновские волны в области полного внешнего отражения (СРВ в ПВО) |
| Кристаллические системы | 8. Оптическая микроскопия 9. Рентгеноструктурный анализ (РСА)/Белковая кристаллография 10. In situ рентгеновская высокоразрешающая дифрактометрия |
В силу специфики работы с органическими материалами (“живыми” системами) практически для каждого из указанных методов (табл. 1) требуется адаптация методик измерений и подбор условий экспериментов, которые позволяли бы в ходе исследований сохранять белки в состоянии, максимально приближенном к нативному. Были разработаны специальные методики исследований, в том числе специализированное оборудование – экспериментальный комплекс окружения образца для исследования белковых систем в нативном состоянии, включающий в себя четыре специализированные измерительные ячейки и позволяющий проводить исследования с применением рентгеновского излучения и СИ, а также оптических методов:
– термостатируемая ячейка для исследований методом малоуглового рентгеновского рассеяния (МУРР) с использованием СИ (на станциях СИ “БиоМУР”, “ДИКСИ” [24, 25] источника “КИСИ-Курчатов”, НИЦ “Курчатовский институт”, Москва);
– микрофлюидная ячейка для оптимизации расхода белков и изучения структуры их растворов методом МУРР [26, 27] (рис. 2а);
Рис. 2.
Измерительные ячейки для образцов растворов и кристаллов: а – микрофлюидная ячейка; б – специализированная ячейка для исследований белковых структур методом СРВ в ПВО.

– специализированная ячейка для структурных in situ-исследований слабоупорядоченных и кристаллических белковых систем на стадиях зарождения и роста кристаллов рентгеновскими и оптическими методами [28, 29];
– специализированная ячейка проточного типа, позволяющая реализовать исследования белковых структур (кристаллы, ленгмюровские пленки) в условиях гелиевой атмосферы методами СРВ в ПВО, рентгенофлуоресцентного анализа и др. (рис. 2б). Обеспечивает уменьшение фона флуоресцентного излучения, позволяет исключить из флуоресцентного спектра линию Ar, перекрывающую сигналы от ряда элементов – K, Cl, S и др.
В последующих разделах приводится краткое описание каждой группы методов (табл. 1), применяемых для исследования структуры растворов белка (разд. 1.2), кристаллов (разд. 1.3) и тонких пленок (разд. 1.4).
1.2. Методы исследования структуры растворов белков
Малоугловое рассеяние рентгеновского излучения и нейтронов. Исследования состояния и взаимодействия белковых молекул в растворе как до добавления осадителя (в отсутствие взаимодействия, приводящего к образованию упорядоченной структуры), так и непосредственно после добавления осадителя проводятся методами МУРР и малоуглового рассеяния нейтронов (МУРН).
Малоугловое рассеяние (МУР) – когерентное диффузное рассеяние монохроматических рентгеновских лучей и нейтронов вблизи первичного луча на апериодических флуктуациях электронной плотности в материалах. При типичных длинах волн излучения в диапазоне от 0.05 до 0.5 нм МУР позволяет исследовать структуры размером от единиц до нескольких сотен нанометров, обычно в диапазоне ~1–200 нм. Указанные методы позволяют определить изменение характера взаимодействия белковых молекул в растворе, а также фиксировать образование частиц (олигомеров) размером от двух молекул (димеров).
Основы метода МУРР/МУРН, его подробное описание и применения изложены в ряде научных работ и монографий [30–33].
Исследования растворов белков методами МУРР/МУРН проводились с использованием разных установок, как лабораторных, так и установок класса “мегасайенс” (источников СИ и нейтронов):
– Лабораторная рентгеновская установка АМУР-К (ФНИЦ “Кристаллография и фотоника” РАН, ИК РАН, Москва) [34];
– Станции СИ “ДИКСИ” [24] и “БиоМУР” [25] (“КИСИ-Курчатов”);
– Станция СИ “BM29 BioSAXS” [35, 36] (ESRF, Гренобль, Франция);
– Нейтронная станция ЮМО [37] (ОИЯИ, ИБР-2, Дубна).
Проводилось исследование изменения структуры растворов белка с осадителем для разных условий. При этом для каждого эксперимента проводилась регистрация МУР от раствора белка с осадителем, раствора осадителя в буфере (вычиталось, как фон при обработке данных), а также в качестве контроля регистрировалось МУР от раствора белка без осадителя.
Для анализа экспериментальных данных МУР на основании известной трехмерной структуры белка с использованием программ СOOT [38] и PyMOL [39] были построены модели различных олигомеров – димер, тетрамер, октамер и др. Первичную обработку полученных экспериментальных данных и расчеты интенсивности МУРР проводили с помощью программ AGBEH, SASPLOT, CRYSOL, MIXTURE, OLIGOMER [40] и ряда других с использованием методики, описанной в [41]. Дальнейшая обработка проводилась с использованием OLIGOMER. Первичная обработка экспериментальных данных МУРР, полученных на “BM29 BioSAXS” (ESRF), проводилась с помощью системы “SaxsAnalysis” [42]. Следующие этапы обработки выполнялись с помощью программы PRIMUS [43], входящей в программный пакет ATSAS [40, 44]. Обработка данных МУРН проводилась с использованием программы SAS [45], а расчетные кривые рассеяния от заданных моделей олигомеров были получены с использованием программы CRYSON [46].
Динамическое рассеяние света. Метод динамического рассеяния света (ДРС) (также известен как метод фотон-корреляционной спектроскопии или квазиупругого рассеяния света) – один из наиболее распространенных методов, используемых для определения размера эмульсий, мицелл, полимеров, белков, наночастиц или коллоидных частиц, диспергированных или растворенных в жидкости [47]. Измеряя и анализируя флуктуацию интенсивности рассеяния света (а именно частоту осцилляций интенсивности света относительно среднего значения, используя автокорреляционную функцию), можно вычислить коэффициент диффузии, рассчитать распределение частиц по размерам и дать описание движения частиц в растворе (в среде).
Разрешающая способность данного метода – от нескольких нанометров до нескольких микрометров. Метод ДРС эффективно применяется для исследования монодисперсных растворов слабой концентрации. Таким образом, метод ДРС позволяет контролировать образование в растворе более крупных агрегатов, чем регистрируемые методами МУРР/МУРН.
Метод молекулярной динамики (МД) – метод, в котором временная эволюция системы взаимодействующих атомов или частиц отслеживается интегрированием их уравнений движения [48, 49]. Метод МД допускает рассмотрение большого числа частиц, так как при расчетах решаются только уравнения Ньютона:
(1)
${{m}_{i}}\frac{{{{d}^{2}}{{{\mathbf{r}}}_{i}}}}{{d{{t}^{2}}}} = {{{\mathbf{F}}}_{i}} = --\frac{{dU}}{{d{{{\mathbf{r}}}_{i}}}},$Метод МД широко применяется для моделирования динамики молекул и их агломератов в растворе и в условиях кристаллизации. В [50] метод МД использован с целью определения стабильности олигомеров белка в растворе, что является принципиально важным при анализе структуры растворов белка как в присутствии, так и в отсутствие осадителя, а также при разных температурах. Моделирование методом МД выполнено с использованием оборудования ЦКП “Комплекс моделирования и обработки данных исследовательских установок мега-класса” (суперкомпьютер) [15], Объединенный вычислительный кластер, НБИКС-ПТ, НИЦ “Курчатовский институт” (Москва). Расчеты проведены с помощью программного пакета GROMACS версии 5.0.4 [51] в поле Amber ff99SB-ILDN [52].
1.3. Методы анализа структуры белковых кристаллов
Анализ структуры белковых кристаллов проводился рентгенодифракционными методами: расшифровка структуры методом РСА; оценка степени совершенства кристалла белка в процессе его роста методом in situ высокоразрешающей рентгеновской дифрактометрии.
Образование кристаллов и кристаллографическая ориентация граней определялись методом оптической микроскопии.
Структура полученных кристаллов определялась методом РСА. Дифракционный набор от кристалла собирали при температуре 100 К на станции “БЕЛОК” [53], модернизированной станции “РСА” (с 2018 г.) [54] (НИЦ “Курчатовский институт”, Москва). В качестве детектора использовалось ПЗС-устройство Rayonix SX165. Дифракционные данные получены с использованием монокристалла путем вращения. Длина волны составляла 0.8 Å, диапазон колебаний – 1°, угол поворота – 180°. Обработка наборов экспериментальных интенсивностей проводилась с использованием программного обеспечения iMosflm [55]. Структуры определены методом молекулярного замещения с использованием программного обеспечения PHASER [56] и структуры лизоцима из куриного яйца (PDBID 4WLD) в качестве исходной модели. Атомные модели уточнены с использованием программы REFMAC [57].
Вследствие потери воды на воздухе, содержание которой в кристалле белка может достигать 70%, кристаллы белков быстро разрушаются. В связи с этим для исследований степени их совершенства in situ в процессе роста рентгеновскими методами, в том числе методом высокоразрешающей рентгеновской дифрактометрии, разработана и создана специальная кристаллизационная измерительная ячейка в составе экспериментального комплекса окружения образца, описанного в разд. 1.1. Подробное описание ячейки и результаты исследований, полученные с ее использованием, представлены в [28, 29].
1.4. Методы получения и анализа структуры слабоупорядоченных систем
В целях анализа структуры слабоупорядоченных систем изучались планарные белковые системы из кристаллизационных растворов с добавлением осадителя, которые были сформированы с применением ленгмюровской технологии [29, 58, 59]. Ленгмюровские монослои получены как на поверхности водной субфазы, так и при переносе на твердые подложки.
Для переноса белковых пленок на твердые подложки (монокристалл Si, предметные стекла с различными покрытиями) применялся метод Ленгмюра–Шеффера [60–63]. Структура полученных монослоев контролировалась с помощью записи изменения поверхностного давления пленки (монослоя) в зависимости от площади, приходящейся на одну молекулу (изотерма сжатия, π/A-изотерма). Полученные монослои переносили на кремниевые и стеклянные подложки, после чего сформированные пленки исследовали методами атомно-силовой микроскопии (АСМ), рентгеновской рефлектометрии (РР), СРВ в ПВО [64]. Исследования монослоев лизоцима проводились методом СРВ в ПВО как на поверхности жидкости в процессе их формирования, так и после переноса на твердую подложку.
Структурные исследования пленок белка как на твердых подложках, так и на поверхности жидкости проводили методами СРВ в ПВО и РР [8, 23]. Метод СРВ в ПВО основан на одновременной регистрации интенсивности зеркальной компоненты рентгеновского отражения (метод РР) и угловой зависимости выхода рентгеновской флуоресценции.
Метод РР широко используется в исследованиях качества поверхности и определения параметров планарных периодических и апериодических наносистем (шероховатостей, толщин, плотностей), в том числе органических пленок [65, 66], многослойных систем на их основе и монослоев на поверхности жидкости [67]. Форма угловой зависимости зеркальной компоненты рентгеновского отражения дает информацию о распределении общей электронной плотности по нормали к поверхности, которая определяет распределение СРВ [68, 69].
Метод СРВ в ПВО, являющийся частным случаем метода СРВ, сочетает в себе возможности рентгеновского рассеяния и спектроскопии [8, 70, 71] и успешно применяется для исследования различного рода тонкопленочных планарных систем [10, 72]. Применение данного метода позволяет получать профили распределения атомов определенного сорта по нормали к поверхности образца. Алгоритм восстановления профиля заключается в представлении системы пленка–подложка в виде слоистой модели, характеризующейся ступенчатым профилем электронной плотности [73, 74]. Параметры слоев исходной модели уточнялись путем минимизации методом Левенберга–Марквардта [68] расхождения между расчетными и экспериментальными данными.
Применение данного метода в работе позволило определить распределение атомов химических элементов по толщине пленки – анализ распределения ионов осадителя (K, Cl, Cu, Ni и т.д.) и молекул белка (S). Исследования проводились как на лабораторном источнике, так и на синхротронной станции РКФМ [75, 76] (НИЦ “Курчатовский институт”, Москва).
Использование уникальной синхротронной станции “Ленгмюр” [22, 77] (НИЦ “Курчатовский институт”, Москва) позволило исследовать взаимодействие слоя белка с компонентами субфазы непосредственно в процессе формирования монослоя на поверхности жидкости, что дало дополнительную информацию о роли осадителя в процессе образования упорядоченных белковых структур.
2. ОПРЕДЕЛЕНИЕ СТРУКТУРЫ РАСТВОРОВ В УСЛОВИЯХ КРИСТАЛЛИЗАЦИИ НА ПРИМЕРЕ БЕЛКА ЛИЗОЦИМА, ВЫЯВЛЕНИЕ МЕХАНИЗМА ВЛИЯНИЯ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ НА ПРОЦЕСС КРИСТАЛЛИЗАЦИИ
В настоящем разделе представлено описание результатов определения структуры растворов в условиях кристаллизации на примере белка лизоцима и механизмов влияния термодинамических параметров на процесс кристаллизации, полученных в [78–83]. Исследовано влияние температуры [79–81], концентраций белка и осадителя [80–82], растворителя [82] на количество октамеров и димеров, образующихся в растворе перед началом кристаллизации. Установление взаимосвязи между олигомерным составом кристаллизационного раствора и образованием кристалла позволило разработать технологический процесс ускоренного подбора условий кристаллизации.
2.1. Об образовании “единиц роста” кристалла в кристаллизационном растворе белка
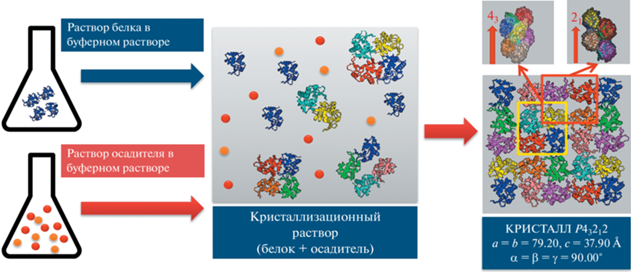
Авторами было сделано предположение (гипотеза), что еще до начала образования зародышей кристалла в растворе белка при создании условий кристаллизации образуются олигомеры, являющиеся составными элементами, из которых впоследствии образуется кристалл. Эмпирическая проверка данного предположения проведена на примере изучения процесса образования кристалла лизоцима тетрагональной сингонии.
Выбраны условия (концентрация белка 40 мг/мл, осадитель – NaCl с концентрацией 25 мг/мл, температура 20°С), при которых стабильно получались достаточно крупные и совершенные кристаллы тетрагональной сингонии (пр. гр. P43212, a = b = 79.20, c = 37.90 Å, α = β = = γ = 90.00°). Предварительный анализ данных, полученных МУРР от растворов лизоцима с добавлением осадителя, показал, что в условиях кристаллизации в растворе помимо мономеров образуются частицы, объем которых приблизительно в 8 раз превышает объем одной молекулы [78].
Так, в [78, 79] впервые была выдвинута гипотеза о том, что образующиеся в кристаллизационном растворе белка комплексы имеют строго определенную структуру и представляют собой промежуточную предкристаллизационную фазу. Эти комплексы возникают еще до начала образования зародышей кристаллов и представляют собой олигомеры белка, которые в дальнейшем участвуют в качестве структурных элементов в процессе роста кристаллической фазы. Схема, иллюстрирующая суть гипотезы, представлена на рис. 3.
2.2. Состав кристаллизационного раствора лизоцима в различных условиях
На основе анализа структуры кристалла лизоцима предложены модели различных олигомеров, являющихся элементарными мотивами кристаллической решетки (рис. 4).
Рис. 4.
Построение двух типов октамеров на основе структуры кристалла лизоцима тетрагональной сингонии: а – проекция кристаллической решетки перпендикулярно оси четвертого порядка; б – октамер типа А (обладающий минимальным объемом) − стабильный; в – октамер типа Б (имеет больший объем) − нестабильный.

Использование таких моделей для обработки экспериментальных данных МУРР позволило качественно и количественно определить состав полидисперсного раствора. Результаты показали, что при добавлении осадителя в растворе белка перед началом кристаллизации образуются димеры и октамеры, при этом других олигомеров не образуется [78, 79]. Аналогичные исследования были проведены с помощью комплементарного метода МУРН [81], а также на различных синхротронных станциях МУРР [79, 80, 82]. Результаты всех проведенных экспериментов оказались сходны – в растворе белка с осадителем помимо мономеров наблюдалось образование димеров и около 3–4% октамеров (табл. 2). Несколько отличаются результаты исследования растворов лизоцима методом МУРН (количество октамеров, обнаруженных в растворе, превышает 9%), что связано с тем, что при проведении данных исследований белок растворяли в тяжелой воде (дейтерированной, D2O), которая оказывает существенное влияние на процесс и условия кристаллизации.
Таблица 2.
Олигомерный состав растворов лизоцима с добавлением осадителя, определенный методом малоуглового рассеяния на различных экспериментальных установках
Показано, что количество октамеров растет при понижении температуры и повышении концентрации белка [79–81]. При этом октамеры в растворе сохраняются после образования кристаллов, непосредственно в процессе их роста, но их количество уменьшается по мере уменьшения концентрации лизоцима, находящегося в растворенном состоянии.
В [82] представлены результаты исследований методом МУРР изменения состава раствора лизоцима в дейтерированной воде в условиях кристаллизации. Показано, что при замене растворителя – обычной воды (H2O) на D2O – на начальной стадии кристаллизации лизоцима в условиях роста кристалла так же, как и в случае растворителя H2O, образуются димеры и октамеры, причем количество октамеров растет при повышении концентрации белка и понижении температуры. Замена растворителя приводит к увеличению процентного содержания октамеров в растворе при прочих равных условиях.
Результаты исследований термодинамических параметров раствора белка лизоцима в условиях кристаллизации как в H2O, так и в D2O представлены на рис. 5 [82].
2.3. Исследование динамики олигомеров лизоцима в растворах
В кристаллической решетке лизоцима тетрагональной сингонии октамеры можно выделить различными способами (рис. 4). Использование разных моделей октамеров A, Б для обработки данных МУР приводило к результатам, которые совпадали в пределах ошибки.
Для определения типа октамера, A или Б, который образуется в растворе, а также объяснения того факта, что в растворе не наблюдается других олигомеров, были проведены исследования методом МД устойчивости различных олигомеров в условиях, соответствующих кристаллизации. На траектории 100 нс в присутствии и в отсутствие осадителя выполнено моделирование поведения октамеров двух возможных типов A и Б, которые путем трансляции образуют кристаллическую решетку кристалла лизоцима тетрагональной сингонии.
В результате исследований [83] показано, что в присутствии осадителя стабилен октамер типа А, в то время как октамер типа Б диссоциирует как в присутствии, так и в отсутствие осадителя. Также установлено поведение тетрамеров, гексамеров и димеров различного типа – в присутствии осадителя тетрамеры и гексамеры различных типов диссоциируют на составляющие, а димеры устойчивы.
2.4. Новый подход к поиску условий кристаллизации
На основе гипотезы об образовании “единиц роста” (олигомеров, являющихся составными элементами будущей кристаллической структуры) в кристаллизационном растворе белка, а также исследований методами МУРР/МУРН, молекулярного моделирования и МД, результаты которых представлены в настоящем разделе, предложен новый подход к поиску условий кристаллизации белков [84].
Предложенный подход состоит в установлении взаимосвязи между параметрами раствора, образованием олигомеров в растворе и образованием кристаллов. Блок-схема, иллюстрирующая предложенный подход к поиску условий кристаллизации белков, представлена на рис. 6.
Установление взаимосвязи между олигомерным составом кристаллизационного раствора и образованием кристалла позволит более осознанно, целенаправленно подбирать условия кристаллизации на основе исследования структуры раствора сразу после добавления осадителя.
3. ОПРЕДЕЛЕНИЕ РОЛИ ИОНОВ ОСАДИТЕЛЯ В МЕХАНИЗМЕ КРИСТАЛЛИЗАЦИИ БЕЛКОВ ПО РЕЗУЛЬТАТАМ ИССЛЕДОВАНИЙ СТРУКТУРЫ РАСТВОРОВ, КРИСТАЛЛОВ ЛИЗОЦИМА И МОДЕЛИРОВАНИЯ МОЛЕКУЛЯРНОЙ ДИНАМИКИ
В разделе представлены результаты исследований роли ионов осадителя в механизме кристаллизации белков по результатам анализа структуры растворов [85], кристаллов лизоцима [86] и моделирования МД [87].
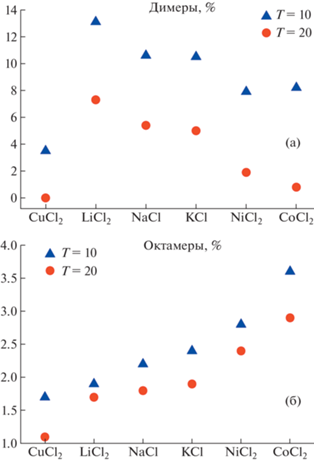
3.1. Зависимость доли октамеров и димеров от катиона осадителя
В [85] изучено влияние ионного состава осадителя на образование олигомеров разного типа. Показано, что замена аниона приводит к изменению сингонии кристалла лизоцима. Исследовано влияние типа катиона и концентрации осадителя в ряду хлоридов (NaCl, KCl, LiCl, NiCl2, CuCl2, CoCl2) на объемную долю олигомеров (димеров, октамеров), образующихся перед началом кристаллизации белка. Объемные доли димеров и октамеров возрастают с увеличением концентрации осадителя и понижением температуры (рис. 7). В ряду одновалентных ионов объемная доля октамеров увеличивается в порядке K+ – Na+ – Li+, а для двухвалентных – в порядке Cu2+–Ni2+–Co2+, что соответствует ряду Гофмейстера увеличения энергии гидратации [88].
3.2. Взаимодействие ионов (металлов и хлора) с молекулами лизоцима и их роль в образовании кристалла
На основе структурных данных, полученных с высоким разрешением, в [86] проанализированы связи между молекулами лизоцима в кристалле и ионами хлоридов – осадителей (NaCl, KCl, LiCl, NiCl2, CuCl2). Ионы металлов и хлора можно разделить на три группы: 1 – связанные непосредственно с молекулой белка; 2 – связанные с молекулами белка в прекурсоре кристалла (димере и октамере); 3 – расположенные на границе октамеров в кристалле.
Выявлено, что кристаллы, выращенные с различными осадителями, различаются по количеству связанных ионов металла и хлорида (рис. 8, табл. 3).
Рис. 8.
Локализация ионов осадителя в кристалле лизоцима (левый ряд – молекулы, правый – октамеры). С осадителем KCl – ион калия в структуре не обнаружен.
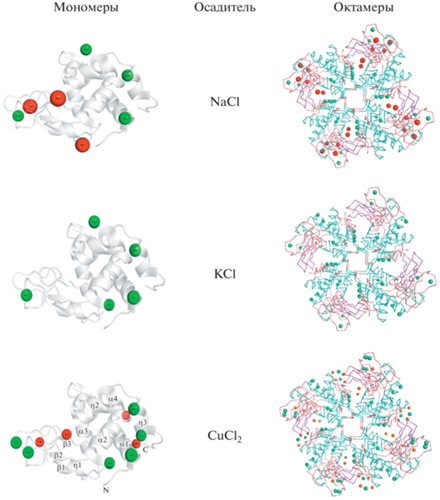
Таблица 3.
Количество ионов хлора и металла в мономере в кристаллах лизоцима, полученных с разными осадителями
| Осадитель | CuCl2 | NiCl2 | NaCl | KCl | LiCl |
|---|---|---|---|---|---|
| PDB ID | 6QWW | 6QWX | 6QWY | 6QWZ | 6QX0 |
| Количество анионов (ионов Cl–) | 6 | 4 | 4 | 5 | 3 |
| Количество катионов (ионов металла) | 4 | 2 | 3 |
Для всех осадителей показано, что:
– ионы группы 1 обеспечивают распределение поверхностного заряда, приводящее к упорядоченной ассоциации молекул и образованию прекурсоров кристалла – октамеров, влияют на равновесную концентрацию октамеров в кристаллизационных растворах и обеспечивают дальнейший рост кристаллов;
– ионы хлора и металла группы 2 вносят вклад в конформационную стабильность октамера посредствам взаимодействия с аминокислотными остатками, принадлежащими удаленным сегментам полипептидной цепи;
– ионы группы 3 способны различным образом влиять на связывание октамеров между собой. Так, для ионов Cu, расположенных на границе октамера, обнаружены особенности, которые оказывают влияние на равновесную концентрацию октамеров. Ионы Cu образуют регулярную пространственную сетку в кристалле белка и потенциально способны взаимодействовать друг с другом и влиять на физические свойства кристалла белка.
3.3. Молекулярная динамика олигомеров в растворе лизоцима с добавлением осадителя NaCl в зависимости от температуры
С учетом позиций ионов осадителя NaCl в структуре лизоцима проведено МД-моделирование мономеров и олигомеров (мотивов кристаллической структуры) в условиях, в которых ранее проводились эксперименты по исследованию процесса кристаллизации методами МУРР и МУРН (разд. 2.2) [79–82].
Из кристаллической структуры лизоцима тетрагональной сингонии (PDB ID: 6QWY) (разд. 3.2) [86] выделялись молекулярные модели возможных единиц роста кристалла лизоцима. В структуре олигомеров оставляли ионы осадителя NaCl, связанные с лизоцимом (на одну молекулу белка приходится три иона натрия и четыре иона хлора) (табл. 3), воду удаляли.
Проведено сравнение результатов, полученных методом МД в трех случаях: использовались модели олигомеров с ионами натрия и хлора, связанными с молекулой лизоцима; модели только с ионами натрия, связанными с лизоцимом; олигомеры без связанных с белком ионов. Показано, что в случае олигомеров (димеров и октамеров) только при учете всех связанных с белком ионов осадителя NaCl наблюдается соответствие результатов МД экспериментальным температурным исследованиям растворов в условиях кристаллизации тетрагонального лизоцима методом МУРР (разд. 2.2) [79, 80].
В результате установлено, что ионы натрия и хлора, связанные с молекулой лизоцима в кристалле, играют важную роль в формировании кристалла тетрагональной сингонии, а также вносят существенный вклад в обеспечение стабильности основной “единицы роста” – октамера специфической структуры (типа А) (рис. 4).
4. ФОРМИРОВАНИЕ ЛЕНГМЮРОВСКИХ ПЛЕНОК НА ОСНОВЕ РАСТВОРОВ ЛИЗОЦИМА В УСЛОВИЯХ КРИСТАЛЛИЗАЦИИ
Настоящий раздел посвящен результатам исследований взаимодействия ионов осадителя с белком в слабоупорядоченных системах, а также формированию ленгмюровских пленок на основе растворов лизоцима в условиях кристаллизации (кристаллизационных растворов) [89–91].
Исследование такой модельной системы позволило уточнить степень стабильности промежуточной фазы кристаллизации и роль ионов осадителя в образовании такой фазы. Было сделано предположение: если для формирования ленгмюровских монослоев на поверхности жидкости использовать растворы белка с добавлением осадителя, то в процессе формирования монослоя будут принимать участие октамеры, что окажет влияние на структуру полученных пленок. Данное предположение подтвердили экспериментально. Методами РР, СРВ в ПВО и АСМ показано, что при формировании ленгмюровского монослоя из раствора белка лизоцима с добавлением осадителя NaCl на подложке образуется сплошная однородная пленка толщиной ~6.5 нм, что соответствует усредненному диаметру октамера [89] (рис. 9).
Рис. 9.
Схема пленки лизоцима, полученной модифицированным методом ЛШ, построенная на основе данных исследования СРВ в ПВО.

По результатам [89] разработана новая модификация метода Ленгмюра–Шеффера (ЛШ) для получения белковых пленок на твердых подложках, основанная на использовании кристаллизационного раствора лизоцима, содержащего октамеры, для формирования монослоя на поверхности водной субфазы [92] (рис. 10).
Рис. 10.
Схема, иллюстрирующая предложенный способ получения упорядоченных пленок белка на твердых подложках.

В [90] представлены результаты структурных исследований пленок лизоцима, полученных при добавлении осадителя KI, методами РР и СРВ в ПВО. В данном случае, когда условия соответствуют образованию кристаллов моноклинной сингонии, показано, что толщина полученной пленки белка составляет ~3 нм, а электронная плотность в 4 раза превышает плотность, рассчитанную для пленки, сформированной из раствора чистого белка, при этом ионы осадителя формируют над поверхностью пленки тонкие слои, образуя слоистую (многослойную) структуру.
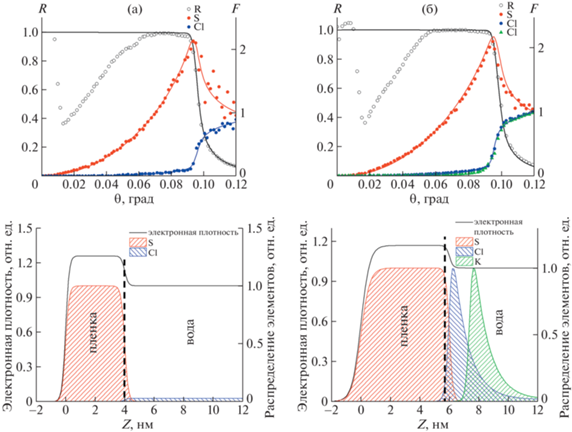
Результаты исследований процесса формирования ленгмюровского монослоя на поверхности водной субфазы непосредственно в ленгмюровской ванне методом СРВ в ПВО [91] показали, что уже на поверхности субфазы формируется монослой толщиной в две молекулы, что соответствует тому, что в формировании монослоя принимают участие октамеры лизоцима (рис. 11). Показано, что под монослоем образуется тонкий слой ионов хлора и калия. При этом структура “слой белка/слой осадителя/субфаза” остается стабильной в течение длительного времени (не менее 12 ч в случае KCl) [91]. Отметим, что тонкие “подслои” ионов осадителя, связанные с монослоем белка, сохраняются при переносе белкового монослоя на твердую подложку.
Рис. 11.
Угловые зависимости зеркальной компоненты рентгеновского отражения (R) и выхода рентгеновской флуоресценции (F) (сверху) и соответствующие профили распределения электронной плотности и химических элементов K, Cl, S по толщине слоя (снизу). Ленгмюровский слой, сформированный из раствора лизоцима без осадителя, толщина слоя лизоцима составляет ~3 нм (а). Ленгмюровский слой, сформированный из раствора лизоцима с осадителем, толщина слоя лизоцима составляет ~6 нм (б).
5. СТРУКТУРА ПРЕДКРИСТАЛЛИЗАЦИОННОЙ ФАЗЫ ДЛЯ БЕЛКОВ ПРОТЕИНАЗА K И ТЕРМОЛИЗИН
С целью верификации и распространения предположения о том, что механизм кристаллизации белков включает формирование промежуточной фазы, на другие водорастворимые белки были проведены исследования начальной стадии кристаллизации белков протеиназы К и термолизина [93, 94]. Показано, что при добавлении к раствору протеиназы К сульфата аммония или нитрата натрия в качестве осадителей в растворе образуется существенная доля димеров белка, причем содержание димеров в растворе слабо возрастает с уменьшением температуры [93]. Образование димеров обусловлено тем, что в кристалле именно между димерами наблюдаются наиболее сильные связи, а сами димеры связаны друг с другом слабее (рис. 12).
Рис. 12.
Структура димера (а) и относительное положение димеров в кристаллической решетке протеиназы К (в). Черным цветом выделена область с наибольшим количеством водородных связей между двумя молекулами белка. Связи между димерами в нестабильных олигомерах (тетрамер, гексамер, октамер) существенно слабее, чем между молекулами в самом димере (б).

В растворе термолизина при добавлении осадителя (NH4)2SO4 на начальной стадии кристаллизации обнаружено формирование димеров и гексамеров [94]. При этом количество гексамеров растет при понижении температуры и повышении концентрации осадителя. Кристалл термолизина имеет гексагональную сингонию, и анализ связей между отдельными молекулами в кристалле показал, что наиболее вероятным прекурсором для образования кристалла могут являться димеры и один из двух гексамеров, представленных на рис. 13.
Рис. 13.
Возможные типы А (а, в) и Б (б, г) гексамеров, смоделированные на основе анализа кристаллической решетки термолизина. В верхнем (а, б) и нижнем (в, г) рядах гексамеры показаны в двух взаимно перпендикулярных направлениях.

Таким образом, результаты исследования механизмов кристаллизации протеиназы К и термолизина еще раз подтвердили, что образование олигомеров в растворе на начальной стадии кристаллизации обусловлено определенным для каждого белка и осадителя взаимодействием между молекулами белка и ионами, обеспечивающим формирование прекурсоров определенного типа и дальнейшую “сборку” из них кристалла.
Образование в растворе белка прекурсоров – олигомеров определенного типа, являющихся элементами будущего кристалла, – представляет собой дополнительную промежуточную фазу между беспорядком молекул белка в растворе и упорядоченным кристаллом. Взаимодействия между отдельными молекулами белка, которые возникают при добавлении осадителя, приводят к образованию таких прекурсоров, процентное содержание которых в свою очередь взаимосвязано с условиями, способствующими росту кристалла.
ЗАКЛЮЧЕНИЕ
Представлены результаты исследований, посвященных разработке научных основ перехода вещества из жидкой фазы в кристаллическую, предложенные и экспериментально подтвержденные коллективом авторов под руководством члена-корреспондента РАН, профессора М.В. Ковальчука. В основе полученных результатов лежит изучение формирования предкристаллизационной фазы – образования кластеров-прекурсоров на атомно-молекулярном уровне на начальной стадии построения кристалла.
Ключевое значение в изучении принципов и механизмов атомно-молекулярной организации материи имеют рентгеновские, синхротронные и нейтронные методы кристаллографии. В основе этих методов лежит определение атомарной структуры органических и неорганических веществ, которая однозначным образом определяет связи составных элементов данных веществ и описывает их взаимодействие, как внутренние взаимодействия в субъединицах (например, в олигомерах в белковых кристаллах), так и внешние взаимодействия между ними в кристаллической надмолекулярной структуре.
Под руководством М.В. Ковальчука разработан принципиально новый научно-методический подход и получены прорывные результаты, основанные на изучении формирования предкристаллизационной фазы, – образования кластеров-прекурсоров, 3D-фрагментов будущей структуры кристалла, на начальной стадии атомно-молекулярной организации системы в упорядоченную кристаллическую структуру.
Полученные в работе фундаментальные знания о механизмах самоорганизации белковых молекул позволят разработать принципиально новые подходы к управляемому получению белковых кристаллов и упорядоченных систем.
На основе полученных в работе фундаментальных результатов по изучению процессов самоорганизации белков предложен новый подход к формированию упорядоченных белковых пленок как основы для создания биоподобных устройств – как биосенсоров (основанных на биохимических процессах в живых организмах), так и элементов биоэлектроники, принцип действия которых приближен к нервной системе.
Предложенный в работе метод ускоренного подбора условий кристаллизации и полученные результаты составляют основу для формирования технологических процессов дизайна и создания новых лекарственных средств, а также ферментов и других макромолекул для сельского хозяйства, промышленной биотехнологии, создания новых материалов.
Предложенный в работе новый комплексный подход, основанный на применении синхротронных и нейтронных методов, а также молекулярного моделирования, к исследованию механизмов формирования упорядоченных белковых систем позволит сформировать методическую базу метрологии принципиально новых природоподобных технологических процессов.
Список литературы
Финкельштейн А.В., Птицын О.Б. Физика белка: Курс лекций с цветными и стереоскопическими иллюстрациями и задачами. 3-е изд. М.: КДУ, 2012. 456 с.
Ковальчук М.В., Попов В.О. // Наука в России. 2013. № 3. С. 4.
Dauter Z., Dauter M., de La Fortelle E. et al. // J. Mol. Biol. 1999. V. 289. № 1. P. 83. https://doi.org/10.1006/jmbi.1999.2743
Boue F., Lefaucheux F., Robert M.C. et al. // J. Cryst. Growth. 1993. V. 133. № 3–4. P. 246. https://doi.org/10.1016/0022-0248(93)90161-O
Ducruix A.F., Guilloteau J.-P., Ries-Kautt M.M., Tardieu A. // J. Cryst. Growth. 1996. V. 168. № 1–4. P. 28. https://doi.org/10.1016/0022-0248(96)00359-4
Kovalchuk M.V., Kazimirov A.Yu., Zheludeva S.I. // Nuclear Instrum. Methods Phys. Res. 1995. V. 101. № 4. P. 435. https://doi.org/10.1016/0168-583X(95)00377-0
Zheludeva S.I., Kovalchuk M.V., Novikova N.N. // Spectrochim. Acta. B. 2001. V. 56. № 11. P. 2019. https://doi.org/10.1016/S0584-8547(01)00314-7
Ковальчук М.В., Кон В.Г. // Успехи физ. наук. 1986. Т. 149. № 5. С. 69.
Kovalchuk M.V., Zheludeva S.I., Novikova N.N. et al. // J. Appl. Cryst. 1997. V. 30. № 5. P. 833. https://doi.org/10.1107/S0021889897001167
Kovalchuk M.V., Zheludeva S.I., Novikova N.N. et al. // Mater. Sci. Eng. C. 2003. V. 23. № 5. P. 567. https://doi.org/10.1016/S0928-4931(03)00048-1
Kovalchuk M.V., Novikova N.N., Stepina N.D. et al. // J. Surf. Invest. X-ray Synchrotron Neutron Tech. 2011. V. 5. № 5. P. 816. https://doi.org/10.1134/S1027451011090126
Ковальчук М.В., Квардаков В.В., Корчуганов В.Н. // Природа. 2013. № 12. С. 25.
Ковальчук М.В., Квардаков В.В. // Вопросы атомной науки и техники: Серия: Материаловедение и новые материалы. 2004. № 2 (63). С. 392.
Куранова И.П., Ковальчук М.В. // Природа. 2014. № 3. С. 12.
http://ckp.nrcki.ru/
http://kcsni.nrcki.ru/pages/main/sync/beamlines/index.shtml
http://rc.nrcki.ru/pages/main/nanozond/facilities/index.shtml#3
http://rc.nrcki.ru/pages/main/molbiotech/facilities/index.shtml#3
Желудева С.И., Новикова Н.Н., Коновалов О.В. и др. // Кристаллография. 2003. Т. 48. № 6. С. 30.
Желудева С.И., Ковальчук M.B., Новикова H.H. и др. // Письма в ЖТФ. 1989. Т. 15. № 20. С. 49.
Zheludeva S.I., Kovalchuk M.V., Novikova N.N. et al. // J. Phys. D. 1993. V. 26. P. A206.
Карайченцев В.Г., Ковальчук М.В., Кузнецов М.Г. и др. // Приборы и техника эксперимента. 2011. № 3. С. 33.
Серегин А.Ю., Дьякова Ю.А., Якунин С.Н. и др. // Кристаллография. 2013. Т. 58. № 6. С. 940. https://doi.org/10.7868/S0023476113060210
Korneev V.N., Shlektarev V.A., Zabelin A.V. et al. // J. Surf. Invest. X-ray Synchrotron Neutron Tech. 2012. V. 6. № 5. P. 849. https://doi.org/10.1134/S1027451012100084
Peters G.S., Zakharchenko O.A., Konarev P.V. et al. // Nucl. Instrum. Methods Phys. Res. A. 2019. V. 945. № 21. P. 162616. https://doi.org/10.1016/j.nima.2019.162616
Попов А.М., Бойкова А.С., Волков В.В. и др. // Кристаллография. 2018. Т. 63. № 5. С. 697. https://doi.org/10.1134/S0023476118050235
Ковальчук М.В., Писаревский Ю.В., Волков В.В. и др. Микрофлюидная ячейка для определения условий кристаллизации белков методом малоуглового рассеяния. Патент на полезную модель № 182997.
Ковальчук М.В., Просеков П.А., Марченкова М.А. и др. // Кристаллография. 2014. Т. 59. № 5. С. 749. https://doi.org/10.7868/S0023476114050105
Дьякова Ю.А., Марченкова М.А. // Кристаллография. 2016. Т. 61. № 5. С. 718. https://doi.org/10.7868/S0023476116050064
Свергун Д.И., Фейгин Л.А. Рентгеновское и нейтронное малоугловое рассеяние. М.: Наука, 1986. 280 с.
Бекренев А.Н., Миркин Л.И. Малоугловая рентгенография деформации и разрушения материалов. М.: МГУ, 1991. 247 с.
Glatter O., Kratky O. Small-Angle X-ray Scattering. London: Academic Press Inc. Ltd, 1982. 515 p.
Guinier A., Fournet G. Small-Angle Scattering of X-Rays. New York: John Wiley & Sons, Inc, 1955. 268 p.
Могилевский Л.Ю., Дембо А.Т., Свергун Д.И. и др. // Кристаллография. 1984. Т. 29. Вып. 3. С. 587.
Pernot P., Round A., Barrett R. et al. // J. Synchrotron Rad. 2013. V. 20. P. 660. https://doi.org/10.1107/S0909049513010431
Round A., Felisaz F., Fodinger L. et al. // Acta Cryst. D. 2015. V. 71. P. 67. https://doi.org/10.1107/S1399004714026959
Kuklin A.I., Islamov A.K., Gordeliy V.I. // Neutron News. 2005. V. 16. № 3. P. 16. https://doi.org/10.1080/10448630500454361
Emsley P., Lohkamp B., Scott W.G., Cowtan K. // Acta Cryst. D. 2010. V. 66. № 4. P. 486. https://doi.org/10.1107/S0907444910007493
Schrodinger L.L.C. The PyMOL Molecular Graphics System, Version 1.8. 2015. http://pymol.org/
Konarev P.V., Petoukhov M.V., Volkov V.V. et al. // J. Appl. Cryst. 2006. V. 39. № 2. P. 277. https://doi.org/10.1107/S0021889806004699
ГОСТ Р 8.698–2010. Государственная система обеспечения единства измерений. Размерные параметры наночастиц и тонких пленок. Методика выполнения измерений с помощью малоуглового рентгеновского дифрактометра. М.: Стандартинформ, 2010. 41 с.
Brennich M.E., Kieffer J., Bonamis G. et al. // J. Appl. Cryst. 2016. V. 49. P. 203. https://doi.org/10.1107/S1600576715024462
Konarev P.V., Volkov V.V., Sokolova A.V. et al. // J. Appl. Cryst. 2003. V. 36. P. 1277. https://doi.org/10.1107/S0021889803012779
Petoukhov M.V., Franke D., Shkumatov A.V. et al. // J. Appl. Cryst. 2012. V. 45. P. 342. https://doi.org/10.1107/S0021889812007662
Soloviev A.G., Solovieva T.M., Stadnik A.V. et al. SAS. Package for Small-Angle Neutron Scattering Data Treatment, v.2.4. 2003. http://wwwinfo.jinr.ru/programs/jinrlib/sas/indexe.html
Svergun D.I., Richard S., Koch M.H.J. et al. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 2267. https://doi.org/10.1073/pnas.95.5.2267
Baitan D., Schubert R., Meyer A. et al. // JoVE. 2018. № 138. P. e57070. https://doi.org/10.3791/57070
Allen M.P., Tildesley D.J. Computer simulation of liquids. Oxford: Clarendon Press, 1989. 385 p.
Холмуродов Х.Т., Алтайский М.В., Пузынин И.В. и др. // Физика элементарных частиц и атомного ядра. 2003. Т. 34. № 2. С. 472.
Кордонская Ю.В., Тимофеев В.И., Дьякова Ю.А. и др. // Кристаллография. 2018. Т. 63. № 6. С. 902. https://doi.org/10.1134/S002347611806019X
Van Der Spoel D., Lindahl E., Hess B. et al. // J. Comput. Chem. V. 26. № 16. P. 1701. https://doi.org/10.1002/jcc.20291
Lindorff-Larsen K., Piana S., Palmo K. et al. // Proteins. 2010. V. 78. № 8. P. 1950. https://doi.org/10.1002/prot.22711
http://kcsni.nrcki.ru/pages/main/sync/beamlines/belok/index.shtml
http://kcsni.nrcki.ru/pages/main/sync/beamlines/rsa/index.shtml
Battye T.G.G., Kontogiannis L., Johnson O. et al. // Acta Cryst. D. 2011. V. 67. P. 271. https://doi.org/10.1107/S0907444910048675
McCoy A.J., Grosse-Kunstleve R.W., Adams P.D. et al. // J. Appl. Cryst. 2007. V. 40. P. 658. https://doi.org/10.1107/S0021889807021206
Vagin A.A., Steiner R.A., Lebedev A.A. et al. // Acta Cryst. D. 2004. V. 60. № 12. P. 2184. https://doi.org/10.1107/S0907444904023510
Blodgett K.B., Langmuir I. // Phys. Rev. 1937. V. 51. № 11. P. 964. https://doi.org/10.1103/PhysRev.51.964
Peng J.B., Barnes G.T., Gentle I.R. // Adv. Colloid Interface Sci. 2001. V. 91. № 2. P. 163. https://doi.org/10.1016/S0001-8686(99)00031-7
Langmuir I., Schaefer V.J. // J. Am. Chem. Soc. 1938. V. 60. № 11. P. 2803. https://doi.org/10.1021/ja01278a074
Leblanc R.M., Huo Q. // Encyclopedia of Surface and Colloid Science, Third Edition. CRC Press, 2015. P. 3545.
Pechkova E., Innocenzi P., Malfatti L. et al. // Langmuir. 2007. V. 23. № 3. P. 1147. https://doi.org/10.1021/la061970o
Bertoncello P., Nicolini D., Paternolli C. et al. // IEEE Trans. Nanobiosci. 2003. V. 2. № 2. P. 124. https://doi.org/10.1109/tnb.2003.813940
Ковальчук М.В., Бойкова А.С., Дьякова Ю.А. и др. // Кристаллография. 2017. Т. 62. № 4. С. 650. https://doi.org/10.7868/S0023476117040129
Schneck E., Papp-Szabo E., Quinn B.E. et al. // J. R. Soc. Interface. 2009. V. 6. P. 671. https://doi.org/10.1098/rsif.2009.0190.focus
Nguyen L-T.T., Musser A.J., Vorenkamp E.J. et al. // Langmuir. 2010. V. 17. P. 14073. https://doi.org/10.1021/la100374j
Cristofolini L., Berzina T., Erokhin V. et al. // Colloids Surf. A. 2008. V. 321. P. 158. https://doi.org/10.1016/j.colsurfa.2007.12.040
Pedersen J.S., Hamley I.W. // J. Appl. Cryst. 1994. V. 27. № 1. P. 36. https://doi.org/10.1107/S0021889893006272
Ghose S.K., Dev B.N. // Phys. Rev. B. 2001. V. 63. № 24. P. 245409. https://doi.org/10.1103/PhysRevB.63.245409
Zegenhagen J. // Surf. Sci. Rep. 1993. V. 18. P. 202. https://doi.org/10.1016/0167-5729(93)90025-K
Batterman B.W., Cole H. // Rev. Mod. Phys. 1964. V. 36. № 3. P. 681. https://doi.org/10.1103/RevModPhys.36.681
Novikova N.N., Yurieva E.A., Zheludeva S.I. et al. // J. Synchrotron Rad. 2005. V. 12. № 4. P. 511. https://doi.org/10.1107/S0909049505013579
Parratt L. // Phys. Rev. 1954. V. 95. № 2. P. 359. https://doi.org/10.1103/PhysRev.95.359
Кон В.Г. // Кристаллография. 2006. Т. 51. № 5. С. 1001.
http://kcsni.nrcki.ru/pages/main/12016/12076/12083/ index.shtml
Кон В.Г., Просеков П.А., Серегин А.Ю. и др. // Кристаллография. 2019. Т. 64. № 1. С. 29. https://doi.org/10.1134/S0023476119010144
http://kcsni.nrcki.ru/pages/main/sync/beamlines/langmuir/index.shtml
Марченкова М.А., Волков В.В., Благов А.Е. и др. // Кристаллография. 2016. Т. 61. № 1. С. 14. https://doi.org/10.7868/S0023476116010148
Kovalchuk M.V., Blagov A.E., Dyakova Yu.A. et al. // Cryst. Growth Des. 2016. 16. № 4. P. 1792. https://doi.org/10.1021/acs.cgd.5b01662
Дьякова Ю.А., Ильина К.Б., Конарев П.В. и др. // Кристаллография. 2017. Т. 62. № 3. С. 364. https://doi.org/10.1134/S0023476119010156
Boikova A.S., Dyakova Y.A., Ilina K.B. et al. // Acta Cryst. D. 2017. V. 73. P. 591. https://doi.org/10.1107/S2059798317007422
Бойкова А.С., Дьякова Ю.А., Ильина К.Б. и др. // Кристаллография. 2017. Т. 62. № 6. С. 876. https://doi.org/10.7868/S0023476117060078
Кордонская Ю.В., Тимофеев В.И., Дьякова Ю.А. и др. // Кристаллография. 2018. Т. 63. № 6. С. 902. https://doi.org/10.1134/S002347611806019X
Ковальчук М.В., Писаревский Ю.В., Благов А.Е и др. Способ определения условий кристаллизации белков. Патент № 2626576.
Дьякова Ю.А., Бойкова A.С., Ильина К.Б. и др. // Кристаллография. 2019. Т. 64. № 1. С. 15. https://doi.org/10.1134/S0023476119010065
Marchenkova M.A., Kuranova I.P., Timofeev V.I. et al. // J. Biomol. Struct. Dyn. 2020. V. 38. № 17. P. 5159. https://doi.org/10.1080/07391102.2019.1696706
Kordonskaya Y.V., Marchenkova M.A., Timofeev V.I. et al. // J. Biomol. Struct. Dyn. 2021. V. 39. № 18. P. 7223. https://doi.org/10.1080/07391102.2020.1803138
Hyde A.M., Zultanski S.L., Waldman J.H. et al. // Org. Process Res. Dev. 2017. V. 21. P. 1355. https://doi.org/10.1021/acs.oprd.7b00197
Ковальчук М.В., Бойкова А.С., Дьякова Ю.А. и др. // Кристаллография. 2017. Т. 62. № 4. С. 650. https://doi.org/10.7868/S0023476117040129
Бойкова А.С., Дьякова Ю.А., Ильина К.Б. и др. // Кристаллография. 2018. Т. 63. № 5. С. 703. https://doi.org/10.1134/S0023476118050065
Kovalchuk M.V., Boikova A.S., Dyakova Y.A. et al. // Thin Solid Films. 2019. V. 677. P. 13. https://doi.org/10.1016/j.tsf.2019.02.051
Ковальчук М.В., Писаревский Ю.В., Дьякова Ю.А. и др. Заявка на патент “Способ получения упорядоченных белковых пленок на твердых подложках в ленгмюровской ванне”. Патент № 2672410.
Ковальчук М.В., Бойкова А.С., Дьякова Ю.А. и др. // Кристаллография. 2018. Т. 63. № 6. С. 857. https://doi.org/10.1134/S0023476118060061
Kovalchuk M.V., Boikova A.S., Dyakova Y.A. et al. // J. Biomol. Struct. Dyn. 2019. V. 37. № 12. P. 3058. https://doi.org/10.1080/07391102.2018.1507839
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография