Лесоведение, 2019, № 2, стр. 115-127
Участие каталазы и пероксидазы в процессах ксилогенеза у карельской березы
К. М. Никерова a, *, Н. А. Галибина a, Ю. Л. Мощенская a, Л. Л. Новицкая a, М. Н. Подгорная a, И. Н. Софронова a
a Федеральный исследовательский центр “Карельский научный центр Российской академии наук”
Институт леса КарНЦ РАН
185910 Республика Карелия, Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: knikerova@yandex.ru
Поступила в редакцию 24.05.2017
После доработки 14.12.2017
Принята к публикации 05.06.2018
Аннотация
У растений карельской березы в тканях ствола изучена активность ферментов антиоксидантной системы (АОС) (каталазы (КАТ) и пероксидазы (ПОД)) и фермента, участвующего в утилизации избытка сахарозы, – апопластной инвертазы (АпИнв). Исследования проводили на 46-летних деревьях карельской березы, обладающих высокой степенью узорчатости древесины (узорчатые растения), и деревьев, у которых признак узорчатости не проявился (безузорчатые растения). Даты отбора были приурочены к протеканию различных фенофаз: период покоя, выход из состояния покоя, сокодвижение, рост листовой пластинки, камбиальный рост, подготовка к состоянию покоя. Для анализа отбирали ткани флоэмы и ксилемы. У исследуемых деревьев выявлена разница в преимущественном пути утилизации перекиси водорода. У безузорчатых растений во флоэме и ксилеме была выше активность КАТ, за исключением периода камбиального роста, когда происходит формирование древесины и отложение вторичной клеточной стенки. В этот период в ксилеме наблюдалась обратная тенденция: активность КАТ была выше у узорчатых растений. У узорчатых растений в тканях ствола на протяжении всего сезона была выше активность ПОД. Полученные данные подтверждают обнаруженную ранее в тканях ствола обратную корреляцию между ростовыми процессами и активностью ПОД и АпИнв. Наибольшая активность ПОД и АпИнв наблюдалась в периоды выхода растения из состояния глубокого покоя и интенсивного оттока метаболитов в ствол. В период камбиального роста активность ПОД и АпИнв в тканях ствола растений березы падала. Выявленная в течение всего сезона корреляция активностей КАТ и ПОД с активностью АпИнв подтверждает наше предположение, что изменение активности ферментов АОС у карельской березы может быть связано с нарушением углеводного обмена.
Ксилогенез, или процесс формирования древесины, – это фиксация углерода в составе структурных полимеров углеводной и фенольной природы в клеточных стенках древеснеющих тканей растений. Понимание процессов, лежащих в основе ксилогенеза, актуально, так как эффективное управление образованием древесины необходимо для повышения продуктивности древесных растений.
Один из методических подходов к изучению нормального развития – это исследование аномальных вариантов ксилогенеза. Ярким представителем растений с аномальным строением является карельская береза (Betula pendula Roth var. carelica (Mercl.) Hämet-Ahti). Карельская береза – форма березы повислой, у которой в результате отклонений в деятельности камбия не запускается программа гибели клеток, приводящая к формированию сосудов ксилемы и ситовидных трубок флоэмы, дифференцирующиеся камбиальные производные сохраняют протопласт и превращаются в клетки запасающей паренхимы, которые накапливают большие количества липидов и таннинов. Формируется аномальная по строению древесина, визуально характеризующаяся наличием узора в местах крупных скоплений паренхимных клеток (Коровин и др., 2002; Novitskaya, Kushnir, 2006).
В результате многолетних исследований выявлен ряд физиолого-биохимических и молекулярно-генетических особенностей сценариев ксилогенеза у карельской и обычной березы (B. pendula Roth var. pendula), а также в ряду растений карельской березы с разной степенью узорчатости древесины. Формирование нормальной по строению древесины, в составе которой преобладают сосуды и волокна, происходит на фоне интенсивной метаболизации сахарозы – основной транспортной формы сахаров у березы (Новицкая и др., 2015) – сахарозосинтазой (СС) под контролем гена SUS1 и сопровождается активным синтезом структурных компонентов клеточных стенок (целлюлозы). Формирование аномальной узорчатой древесины, для которой характерны крупные включения клеток паренхимы, происходит на фоне низкой активности СС в связи со снижением экспрессии кодирующих ее генов SUS1 и SUS2 и сопровождается уменьшением содержания целлюлозы (Галибина и др., 2015б, 2016а; Мощенская и др., 2016, 2017). При этом избыток сахарозы в аномальных участках (Галибина и др., 2012; Новицкая и др., 2015; Novitskaya et al., 2016) метаболизируется АпИнв (Галибина и др., 2015а, 2016а; Мощенская и др., 2016), что сопровождается увеличением содержания гексоз в тканях.
Гексозы, вовлекаясь в цикл Кребса и пентозофосфатный путь, участвуют в реакциях образования активных форм кислорода (АФК) и синтезе веществ фенольной природы (Couée et al., 2006; Донцов и др., 2006; Wellen, Thompson, 2010). Глюкоза самостоятельно может взаимодействовать с АФК и образовывать субстраты пероксидазного окисления (Синькевич и др., 2009). Утилизация АФК и свободных радикалов происходит при участии антиоксидантной системы (АОС), компонентами которой являются ферменты (супероксиддисмутаза, каталаза (КАТ), пероксидаза (ПОД)) и низкомолекулярные антиоксиданты. Изучение активности ПОД в тканях ствола березы повислой выявило, что у взрослых деревьев карельской березы активность фермента выше, чем у растений обычной березы (Галибина и др., 2013; Никерова, Галибина, 2017), а в ряду растений карельской березы активность ПОД возрастает с увеличением степени узорчатости древесины (Галибина и др., 2016б). На основании проведенных исследований предложен способ количественной экспресс-диагностики “узорчатости” древесины карельской березы по определению активности гваякол-пероксидазы в ксилеме (Способ …, 2016).
Определенный низкий уровень АФК всегда присутствует в клетках. При относительно умеренных и низких неповреждающих концентрациях АФК вовлекаются в нормальный метаболизм клетки (Apel, Hirt, 2004), их наличие необходимо для жизнедеятельности любого организма (Mittler, 2017). АФК задействованы в синтезе веществ фенольной и углеводной природы, модификации белковых молекул и регуляции важнейших биологических процессов, таких как фотосинтез, фотодыхание, биосинтез лигнина (Полесская и др., 2004; Гарифзянов и др., 2011; Креславский и др., 2012; Колупаев, 2016). Первым ферментом, принимающим участие в утилизации АФК, а особенно H2O2, которая накапливается в процессе дыхания, является каталаза. Взаимосвязь активности ПОД и КАТ весьма интересна: как правило, активность одного фермента компенсирует активность другого (Fernández-García et al., 2004; Chen et al., 2006).
Целью нашей работы было изучение активности ферментов АОС как в период камбиального роста, так и в периоды, предшествующие формированию нормальной и аномальной древесины. На основании наших исследований и имеющихся литературных данных (Половникова, Воскресенская, 2008) выдвинута гипотеза, что по изменению активности антиоксидантных ферментов можно судить об особенностях ксилогенеза в растении. В работе представлены данные по сезонной динамике активностей ПОД и КАТ в тканях ствола безузорчатых и узорчатых растений карельской березы, рассмотрена компенсаторная роль этих ферментов. Для обсуждения полученных результатов у деревьев исследовали активность АпИнв.
ОБЪЕКТЫ И МЕТОДИКА
Растительный материал и отбор образцов
Исследования проводили на деревьях карельской березы, произрастающих на Агробиологической станции КарНЦ РАН (61°45′ c.ш., 34°20′ в.д.), в 2 км от г. Петрозаводска, Республика Карелия. Возраст деревьев на момент отбора образцов ткани составлял 46 лет. Все растения были выращены из сеянцев, полученных из семян от контролируемого опыления деревьев карельской березы.
При любом варианте скрещивания родительских форм в потомстве появляются особи как с узорчатой, так и безузорчатой текстурой древесины (Любавская, 1978; Ермаков, 1986; Машкина и др., 2000). Для исследования отбирали высокоствольные растения карельской березы с высокой степенью узорчатости древесины (узорчатые растения) и растения, у которых признак узорчатости не проявился (безузорчатые растения). Узорчатые особи карельской березы характеризовались невысоким уровнем индивидуальной изменчивости по расположению и плотности рисунка на стволе. Всего было взято 10 растений: 5 узорчатых и 5 безузорчатых.
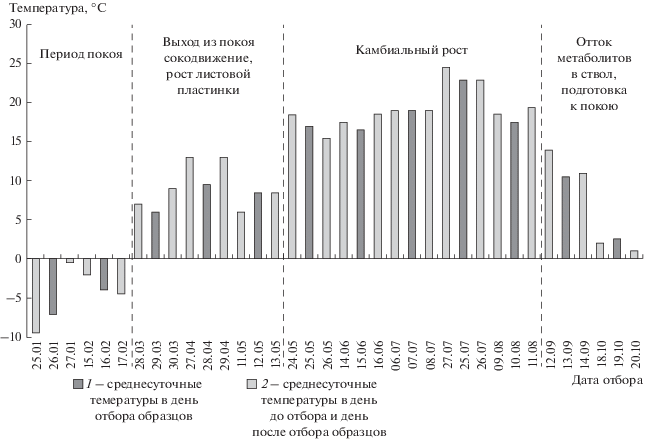
Исследование проводили в течение 2016 г. Ткани препарировали в утреннее время (с 9 до 11 ч утра), для их отбора подбирали дни без осадков. Температура, наряду с фотопериодом, – основной фактор, запускающий или тормозящий важнейшие метаболические процессы, происходящие в растении, и, тем самым, характеризующий определенную фенологическую фазу (Федорков, 2007). На рис. 1 представлены среднесуточные температуры в день отбора образцов (1), день до отбора и день после отбора (2). Даты отбора были приурочены к протеканию различных фенофаз.
Рис. 1.
Динамика среднесуточной температуры в течение 2016 года в г. Петрозаводске. По данным c сервера “Погода России” (https://rp5.ru). 1 – среднесуточные температуры в день отбора образцов, 2 – среднесуточные температуры в день до отбора и день после отбора образцов.
Период покоя:
26.01 – состояние глубокого покоя (в лабораторных условиях почки не распускаются);
16.02 – состояние вынужденного покоя (почки способны распускаться и расти).
Выход из состояния покоя, сокодвижение, рост листовой пластинки:
29.03 – выход из состояния покоя, в стволе начинается гидролиз запасных веществ (Галибина и др., 2012);
28.04 – активное сокодвижение;
12.05 – активные процессы во флоэме, клетки флоэмы сильно вакуолизированы, отделение коры от ксилемы идет по зоне дифференциации флоэмных клеток (Барильская, 1978), лист распустился на 50–70%.
Камбиальный рост:
25.05 – начало формирования прироста ксилемы, камбиальная зона оводнена, отделяется к флоэме, лист распустился на 100%;
15.06 – активное формирование ранней тонкостенной древесины;
07.07 – активизация утолщения клеточной стенки;
25.07 – продолжение формирования вторичной клеточной стенки;
10.08 – завершение камбиального роста, кора плохо отходит от ксилемы.
Подготовка к состоянию покоя:
13.09 – интенсивный отток метаболитов в ствол, кора не отходит от ксилемы;
19.10 – подготовка к состоянию покоя.
На стволе карельской березы вырезали “окошки” 4 × 6 см и отделяли кору от древесины. С обнаженной поверхности древесины бритвенным лезвием отбирали ткани ксилемы, с внутренней поверхности коры – ткани флоэмы. У узорчатых растений ткани отбирали из участков ствола с характерными вздутиями, неровностями, крупными бугорками и бугорчатыми выпуклостями. Весь растительный материал замораживали в жидком азоте и хранили в низкотемпературной морозильной камере при –70°C.
Биохимические исследования
Ткани ксилемы и флоэмы растирали с жидким азотом и гомогенизировали при 4°C в буфере следующего состава: 50 мМ Hepes (pH 7.5), 1 мМ ЭДТА, 1 мМ ЭГТА, 3 мМ ДТТ, 5 мМ MgCl2, 0.5 мМ PMSF. После 20-минутной экстракции гомогенат центрифугировали при 10 000 g в течение 20 минут (центрифуга Sigma 2-16PK, Германия). Осадок троекратно промывали буфером. Объединенный супернатант и осадок диализовали при 4°C в течение 18–20 ч против буфера для гомогенизации, разбавленного в 10 раз (Галибина и др., 2016а). В полученных после диализа ферментативных препаратах спектрофотометрически (СФ 2000, Россия) определяли активность ферментов. В супернатанте определяли КАТ и ПОД, в осадке – АпИнв. Об активности КАТ судили по ферментативному разложению перекиси водорода (Никерова и др., 2016). Инкубационная среда содержала 50 мМ K, Na-фосфатный буфер (рН 7.8) и 14.7 мМ перекись водорода. Время инкубации – 4 мин. Для определения активности КАТ измеряли уменьшение оптической плотности при 240 нм, содержание H2O2 рассчитывали по предварительно построенному градуировочному графику. Активность КАТ выражали в мкмоль восстановленной перекиси водорода на 1 мг белка (мкмоль H2O2 1 мг–1 белка). Для определения активности ПОД в качестве донора водорода использовали гваякол, в качестве субстрата – перекись водорода. Инкубационная среда для определения активности ПОД содержала 50 мМ K, Na-фосфатный буфер (рН 5), 2.6 мМ перекись водорода и 21.5 мМ гваякол. Время инкубации – 30 мин. Активность ПОД определяли по скорости образования продукта реакции – тетрагваякола (ТГ). Для определения содержания образовавшегося ТГ измеряли увеличение оптической плотности при 470 нм, количество ТГ рассчитывали с учетом коэффициента экстинкции (ε470нм = = 0.0266 мкМ–1 см–1). Активность ПОД выражали в мкмоль образовавшегося ТГ на 1 мг белка (мкмоль ТГ 1 мг–1 белка) (Галибина и др., 2016б; Никерова, Галибина, 2017). Содержание белка определяли по методу Бредфорда. Активность АпИнв определяли после инкубации ферментного препарата при 30°C в течение 30 мин. Инкубационная среда для определения активности АпИнв содержала 100 мМ ацетатный буфер (рН = = 4.7) и 25 мМ сахарозу. Количество образовавшейся в процессе инкубации глюкозы определяли глюкозооксидазным методом (набор реагентов “Глюкоза-Агат”, Россия). Активность АпИнв выражали в мкмоль распавшейся сахарозы на 1 г сырой ткани (мкмоль сахарозы 1 г–1 сырой ткани) (Галибина и др., 2015б).
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
Статистическая обработка
Статистическая обработка данных осуществлялась в среде Microsoft Excel. Эксперименты проводили в 5 биологических и 3 аналитических повторностях. На диаграммах приведены средние значения и их стандартные ошибки (n = 15). Для оценки достоверности различий использовали t-критерий Стьюдента, а также двухвыборочный t-тест с различными дисперсиями. Статистически значимыми считали различия при р < 0.05. Для нахождения корреляций использовали пакет программ для анализа данных PAST.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Активность каталазы у безузорчатых и узорчатых растений карельской березы
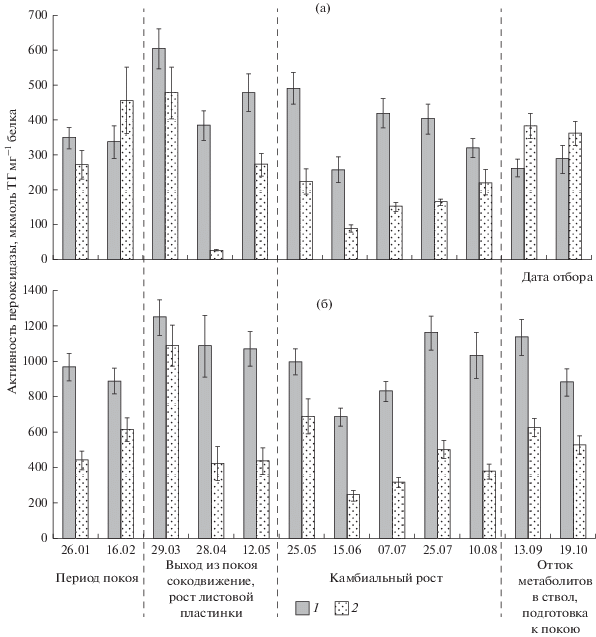
У безузорчатых растений в ксилеме при переходе от глубокого к вынужденному покою активность КАТ увеличивалась от 405 до 463 мкмоль H2O2 на 1 мг белка и продолжала возрастать по мере выхода растения из состояния покоя. Максимальную активность КАТ в ксилеме наблюдали в период развертывания листовой пластинки (12 мая) – 622 мкмоль H2O2 на 1 мг белка. Во флоэме активность КАТ в период покоя была около 380 мкмоль H2O2 на 1 мг белка. В период выхода растений из состояния покоя активность КАТ возросла и колебалась в диапазоне 470–520 мкмоль H2O2 на 1 мг белка, за исключением периода сокодвижения, когда ее активность упала до 190 мкмоль H2O2 на 1 мг белка. В период камбиального роста происходит снижение активности КАТ, особенно в тканях ксилемы. Прекращение ростовых процессов и интенсивный отток метаболитов в ткани ствола сопровождались возрастанием активности КАТ, особенно во флоэме, значение ее активности достигало 571 мкмоль H2O2 на 1 мг белка. При переходе растений к состоянию покоя активность КАТ в тканях ствола была близка к таковым в период покоя (рис. 2).
Рис. 2.
Сезонная динамика активности каталазы (мкмоль H2O2 1 мг–1 белка) в тканях ствола у безузорчатых (а) и узорчатых (б) растений карельской березы 1 – во флоэме и 2 – в ксилеме.
У узорчатых растений активность КАТ в ксилеме имела такую же динамику, как у безузорчатых растений. Активность фермента в период покоя колебалась в диапазоне 340–380 мкмоль H2O2 на 1 мг белка, повышалась при выходе из состояния покоя, достигала максимальных значений в период развертывания листовой пластинки – 486 мкмоль H2O2 на 1 мг белка и снижалась в период камбиального роста до 250–360 мкмоль H2O2 на 1 мг белка. Во флоэме узорчатых растений сезонная динамика активности КАТ отличалась от таковой у безузорчатых растений. При выходе растений из состояния покоя (29.03) и после окончания камбиального роста в период интенсивного оттока метаболитов в ствол (13.09) происходило снижение активности КАТ до 55 и 213 мкмоль H2O2 на 1 мг белка соответственно (рис. 2).
Активность КАТ у безузорчатых растений была выше, чем у узорчатых растений во флоэме и в ксилеме, за исключением периода камбиального роста, когда происходит формирование древесины и отложение вторичной клеточной стенки. В этот период в ксилеме наблюдалась обратная тенденция: КАТ была выше у узорчатых растений (рис. 2). Статистическая обработка данных с применением двухвыборочного t-теста с различными дисперсиями показала, что КАТ достоверно выше в течение всего сезона у безузорчатых растений карельской березы по сравнению с узорчатыми только в тканях флоэмы (p = 0.008).
Активность пероксидазы у безузорчатых и узорчатых растений карельской березы
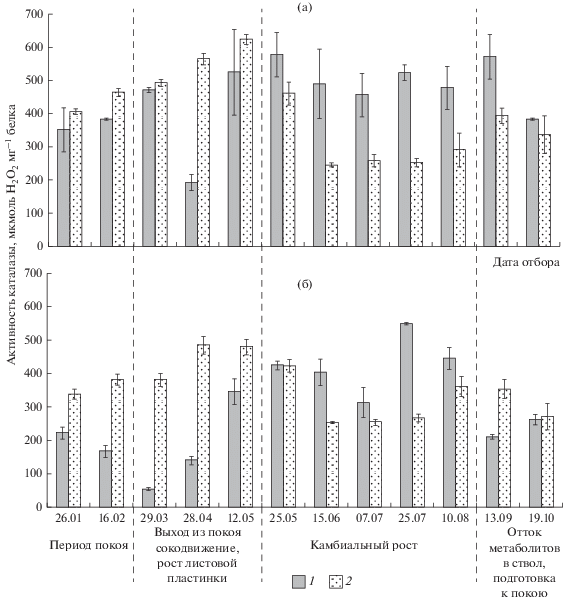
Пик активности ПОД пришелся на конец марта, когда растения еще находились в состоянии вынужденного покоя. Значения ее активности в ксилеме достигали 485 и 1087 и во флоэме 611 и 1250 мкмоль ТГ на 1 мг белка у безузорчатых и узорчатых растений соответственно. Низкие значения активности наблюдались в ксилеме в период сокодвижения (31 и 424 мкмоль ТГ на 1 мг белка у безузорчатых и узорчатых растений соответственно), во флоэме – в период формирования ранней тонкостенной древесины (263 и 688 мкмоль ТГ на 1 мг белка у безузорчатых и узорчатых растений соответственно). В ксилеме в этот период также наблюдаются невысокие значения активности ПОД: 91 и 243 мкмоль ТГ на 1 мг белка у растений с безузорчатой и узорчатой древесиной соответственно.
Активность ПОД была значимо выше в тканях флоэмы по сравнению с тканями ксилемы: у безузорчатых (p = 0.02) и узорчатых растений (p = = 0.000006).
У безузорчатых растений на протяжении всего сезона активность ПОД была ниже, чем у узорчатых растений, как в тканях ксилемы, так и в тканях флоэмы (рис. 3). Статистическая обработка данных с применением двухвыборочного t-теста с различными дисперсиями показала, что ПОД достоверно выше в течение всего сезона у узорчатых растений карельской березы, по сравнению с безузорчатыми: в ксилеме (p = 0.003) и во флоэме (p = 0.0000000009).
Активность апопластной инвертазы у безузорчатых и узорчатых растений карельской березы
Наибольшая активность АпИнв наблюдалась в период выхода растения из состояния покоя и в период интенсивного оттока метаболитов в ствол. Значения ее у безузорчатых растений достигали во флоэме 18 и 26 мкмоль сахарозы на 1 г сырой ткани, в ксилеме 3.8 и 2.2 мкмоль сахарозы на 1 г сырой ткани. У узорчатых растений активность АпИнв была выше и составила в эти периоды во флоэме 31 и 35 мкмоль сахарозы на 1 г сырой ткани, в ксилеме 5.7 и 4.3 мкмоль сахарозы на 1 г сырой ткани. В период камбиального роста активность АпИнв в тканях ствола растений березы падает и достигает во флоэме 7 и 11 сахарозы на 1 г сырой ткани, в ксилеме 0.2 и 0.8 сахарозы на 1 г сырой ткани у безузорчатых и узорчатых растений соответственно (рис. 4).
Рис. 4.
Сезонная динамика активности апопластной инвертазы (мкмоль распавшейся сахарозы 1 г–1 сырой ткани) во флоэме (а) и ксилеме (б) у безузорчатых (1) и узорчатых (2) растений карельской березы.
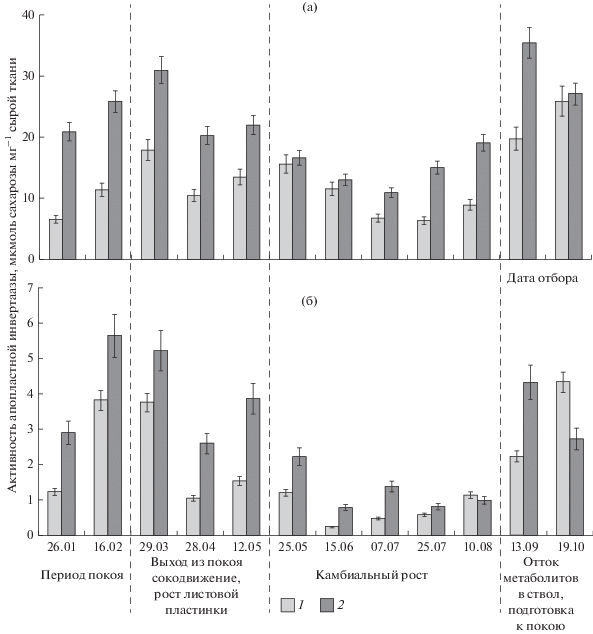
Статистическая обработка данных с применением двухвыборочного t-теста с различными дисперсиями показала, что АпИнв во флоэме достоверно выше (p = 0.005) в течение всего сезона у узорчатых растений карельской березы по сравнению с безузорчатыми.
Взаимосвязь пероксидазы и каталазы с апопластной инвертазой у растений карельской березы
Корреляционный анализ с использованием пакета программ для анализа данных PAST показал, что в ксилеме активность АпИнв коррелирует с активностью ПОД у безузорчатых (p = 0.0004) и узорчатых (p = 0.002) растений. У узорчатых растений активность АпИнв в ксилеме положительно коррелирует с активностью КАТ в ксилеме (p = 0.003) и отрицательно – с активностью КАТ во флоэме (p = 0.005).
Результаты исследования показали, что сезонная динамика активности КАТ и ПОД у изучаемых форм березы отличается. Активность каталазы в тканях ствола выше у безузорчатых растений (рис 2), особенно во флоэме. Формирование нормальной древесины сопряжено с активными ростовыми процессами (Галибина и др., 2015б, 2016а). Известно, что активизация работы меристем связана с увеличением уровня дыхания, затрат энергии на метаболизм (Sairam et al., 2003; Мазей и др., 2009; Павлова и др., 2014), которые, вероятно, сопровождаются высокой каталазной активностью. Активность КАТ может служить показателем формирования новых жизнеспособных органов и тканей (Карасев и др., 2015). Активность ПОД в тканях ствола на протяжении всего сезона выше у узорчатых растений (рис 3). Бо́льшую активность ПОД в аномальной древесине по сравнению с КАТ можно объяснить ингибированием последней высоким содержанием перекиси водорода (Fernández-García et al., 2004). Компенсаторная роль ПОД и КАТ не редко встречается у разных растений (Fernández-García et al., 2004; Chen et al., 2006). Ранее было показано, что в ряду растений карельской березы при увеличении признака узорчатости снижается активность СС и возрастает активность АпИнв (Галибина и др., 2016а), что влечет за собой увеличение активности ПОД (Галибина и др., 2016б), и уже даже слабоузорчатые растения карельской березы превосходят безузорчатые по значениям активности АпИнв и ПОД.
В период глубокого покоя у безузорчатых и узорчатых деревьев березы наблюдаются невысокие активности ПОД и КАТ (рис. 2, 3, дата 26.01). Известно, что ферменты АОС являются показателем активных аэробных процессов, а в зимний период покоя в растении преобладают анаэробные процессы (Рогожин, 2004). Во флоэме в период покоя активность КАТ ниже, чем в ксилеме (рис. 2, дата 26.01), так как процессы дыхания у древесного растения в большей степени сосредоточены в ксилеме (Крамер, Козловский, 1983).
Выход из состояния покоя в связи с повышением температуры (рис. 1), когда происходит интенсификация процессов дыхания и расход метаболитов углеводной природы (Исаева, Рязанова; 2006; Федорков, 2007), сопровождался возрастанием активности КАТ и ПОД (рис. 2, 3, дата 29.03). Повышение активности ферментов АОС, вероятно, связано с интенсивным гидролизом полимерных компонентов. Обнаруженные высокие значения активности АпИнв (рис. 4, дата 29.03) свидетельствуют о большой концентрации сахарозы в апопласте, особенно у растений с узорчатой древесиной. Избыток гексоз, образующихся при апопластной утилизации сахарозы, может, в свою очередь, расходоваться на образование субстратов окисления и АФК (Couée et al., 2006; Донцов и др., 2006; Wellen, Thompson, 2010), приводя к возрастанию активности ПОД и КАТ. Особенно активность ферментов АОС увеличивается во флоэме, где выше активность АпИнв. Если у безузорчатых растений во флоэме высокая активность ПОД наблюдается на фоне высокой активности КАТ, то у узорчатых растений мы отмечаем другую тенденцию: экстремально высокая пероксидазная активность на фоне самой низкой каталазной активности. Полученный эффект можно объяснить, вероятно, высокими концентрациями перекиси водорода во флоэме у узорчатых растений. Известно, что большой избыток перекиси водорода может ингибировать КАТ, вследствие чего фермент теряет свою активность (Мирошниченко, 1992; Еремин, Метелица, 1996).
Период сокодвижения сопровождается резким падением пероксидазной активности и у узорчатых, и у безузорчатых растений, особенно в тканях ксилемы (рис. 3, дата 28.04). В это время идет интенсивный ксилемный транспорт, и основная масса сахаров с ксилемным потоком поступает к развивающимся листьям, главным акцепторам в этот период. В тканях ствола падает активность АпИнв (рис. 4, дата 28.04), что также свидетельствует о снижении содержания сахарозы. В клетках сахара участвуют в поддержании тургорного давления и дыхания. Возрастание активности каталазы в ксилеме (рис. 2, дата 28.04) можно рассматривать как показатель интенсивности дыхания.
В период камбиальной деятельности активность КАТ и ПОД в ксилеме понижена (рис. 2, 3, дата 15.06–10.08). В это время сахара, притекающие из фотосинтезирующих листьев, активно расходуются в камбиальной зоне на рост и дифференциацию ксилемы и флоэмы. В ксилеме доминирует сахарозосинтазный путь утилизации сахарозы (Галибина и др., 2015б, 2016а) на фоне снижения активности АпИнв (рис. 4, дата 15.06–10.08). Низкие значения перекиси водорода в ксилеме могут быть связаны с использованием ее другими ферментами в биосинтезе лигнина (Oslon, Varner, 1993; Ros Barceló, 2005). Полученные данные подтверждают обнаруженную ранее (Галибина и др., 2013) обратную корреляцию между ростовыми процессами и пероксидазной активностью в тканях ствола. На фоне интенсивного расхода метаболитов на камбиальный рост в ксилеме во флоэме наблюдается высокая активность КАТ, особенно во время интенсивного отложения вторичной клеточной стенки (рис. 2, дата 25.07), что может свидетельствовать об активных дыхательных процессах в этих тканях (Мазей и др., 2009; Павлова и др., 2014).
В период подготовки растения к состоянию покоя в стволе в результате осеннего оттока ассимилятов из кроны повышается содержание сахарозы, что отражается в повышении активности АпИнв (рис. 4, дата 13.09). Сахароза расщепляется АпИнв с образованием моносахаров, которые, вероятно, возвращаются в клетки паренхимы и идут на синтез запасных биополимеров. Как и в период выхода растения из состояния покоя повышение активности АпИнв у безузорчатых растений происходит на фоне повышения активности КАТ и ПОД (рис. 2, 3, дата 13.09). У узорчатых растений на фоне большей активности АпИнв (рис. 2, дата 13.09) существенно возрастает пероксидазная активность (рис. 3, дата 13.09), падает каталазная активность (рис. 2 дата 13.09).
Выявленная в течение всего сезона корреляция активностей КАТ и ПОД с активностью АпИнв подтверждает наше предположение, что изменение активности ферментов АОС у карельской березы может быть связано с нарушением углеводного обмена (Никерова, Галибина, 2017). Перекись водорода может играть роль сигнальной молекулы, регулируя уровень экспрессии PR-генов (Bi et al., 1995; Pellinen et al., 2002), кодирующих патоген-индуцируемые белки (PR-белки, от pathogenesis related). PR-белки, в числе прочих к ним относятся и пероксидазы, управляют неспецифичной устойчивостью растений к действию различных факторов (Kinkema et al., 2000; Van Loon et al., 2006; Almagro et al., 2009). Как правило, повышение уровня экспрессии PR-генов рассматривают в связи с влиянием патогенов. На трансгенных растениях тополя (сверхэкспрессия генов, кодирующих АпИнв) продемонстрировано увеличение уровня экспрессии PR-генов в ответ на повышение активности АпИнв (Zhang et al., 2014). Полученные в работе данные подтверждают выдвинутую нами гипотезу, что по изменению активности КАТ и ПОД можно судить о возможном сценарии ксилогенеза у древесного растения.
Заключение. Представленные в настоящей статье данные по динамике активности КАТ, ПОД и АпИнв и результаты выполненных ранее исследований свидетельствуют о разных моделях функционирования ферментных систем у узорчатых и безузорчатых растений карельской березы. Различный способ утилизации сахарозы, лежащий в основе проявления структурных аномалий ствола и выраженный внешне наличием признаков узорчатости, сказывается и на механизме утилизации перекиси водорода, что отражается в разных стратегиях поведения пероксидазы и каталазы.
Выявленные закономерности в активности пероксидазы и каталазы при проявлении узорчатости впервые рассмотрены в сезонной динамике, что дало возможность указать их роль в важнейших процессах, протекающих у древесных растений в отдельных фенологических фазах. Более того, сделаны предположения о взаимном влиянии ферментов друг на друга и преимущественном способе утилизации перекиси водорода для каждой из изучаемых форм. Результаты исследования показали, что в нейтрализации избытков перекиси у узорчатых растений велика роль ПОД, а у безузорчатых – КАТ.
Результаты, описанные в статье, а также находящиеся на стадии интерпретации данные других биохимических, анатомических и молекулярно-генетических исследований, помогут сформировать полноценную картину причин формирования узорчатой древесины у карельской березы и, возможно, станут основой для обнаружения механизмов управления процессами аномального ксилогенеза.
Список литературы
Барильская Л.А. Сравнительный структурный анализ древесины березы повислой и карельской березы: Дисс. канд. биол. наук. Петрозаводск: ИЛ Карельского филиала АН СССР. 1978. 202 с.
Галибина Н.А., Новицкая Л.Л., Никерова К.М. Избыток экзогенных нитратов подавляет формирование аномальной древесины у карельской березы // Онтогенез. 2016а. Т. 47. № 2. С. 83–91.
Галибина Н.А., Новицкая Л.Л., Софронова И.Н. Динамика сахаров в тканях ствола Betula pendula (Betulaceae) при выходе из зимнего покоя // Растительные ресурсы. 2012. Т. 48. № 4. С. 554–564.
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. Активность инвертазы в тканях ствола карельской березы // Физиология растений. 2015а. Т. 62. № 6. С. 804–813.
Галибина Н.А., Новицкая Л.Л., Красавина М.С., Мощенская Ю.Л. Активность сахарозосинтазы в тканях ствола карельской березы в период камбиального роста // Физиология растений. 2015б. Т. 62. № 3. С. 410–419.
Галибина Н.А., Мошкина Е.В., Никерова К.М., Мощенская Ю.Л., Знаменский С.Р. Активность пероксидазы как индикатор степени узорчатости древесины карельской березы // Лесоведение. 2016б. № 4. С. 294–304.
Галибина Н.А., Целищева Ю.Л., Андреев В.П., Софронова И.Н., Никерова К.М. Активность пероксидазы в органах и тканях деревьев березы повислой // Ученые записки ПетрГУ. Серия Естественные и технические науки. 2013. № 4 (133). С. 7–13.
Гарифзянов А.Р., Жуков Н.Н., Иванищев В.В. Образование и физиологические реакции активных форм кислорода в клетках растений // Современные проблемы науки и образования. 2011. № 2. С. 1–21.
Донцов В.И., Крутько В.Н., Мрикаев Б.М., Уханов С.В. Активные формы кислорода как система: значение в физиологии, патологии и естественном старении // Труды Института системного анализа Российской академии наук. 2006. Т. 19. С. 50–69.
Еремин А.Н., Метелица Д.И. Каталитические свойства каталазы в микроэмульсиях поверхностно-активных веществ в октане // Биохимия. 1996. Т. 61. № 9. С. 1672–1686.
Ермаков В.И. Механизмы адаптации березы к условиям севера. Л.: Наука, 1986. 144 с.
Исаева Е.В., Рязанова Т.В. Групповой состав углеводов почек тополя // Химия растительного сырья. 2006. № 1. С. 33–36.
Карасев В.Н., Карасева М.А., Серебрякова Н.Е., Абрамова Д.А. Активность каталазы как показатель жизненного состояния древесных растений в городских условиях // Актуальные проблемы лесного комплекса. 2015. № 43. С. 88–90.
Колупаев Ю.Е. Антиоксиданты растительной клетки и их роль в АФК-сигналинге и устойчивости растений // Успехи современной биологии. 2016. Т. 136. № 2. С. 181–198.
Коровин В.В., Новицкая Л.Л., Курносов Г.А. Структурные аномалии стебля древесных растений. М.: Московский гос. университет леса, 2002. 258 с.
Крамер П.Д., Козловский Т.Т. Физиология древесных растений. М.: Лесн. пром-сть, 1983. 464 с.
Креславский В.Д., Лось Д.А., Аллахвердиев С.И., Кузнецов Вл.В. Сигнальная роль активных форм О2 при стрессе у растений // Физиология растений. 2012. Т. 59. № 2. С. 163–178.
Любавская А.Я. Карельская береза. М.: Лесн. пром-сть, 1978. 158 с.
Мазей Н.Г., Шиленков А.В., Вяль Ю.А. Влияние низких температур на дыхание прорастающих семян гречихи // Известия Пензенского государственного педагогического университета им. В.Г. Белинского. 2009. № 18. С. 36–38.
Машкина О.С., Табацкая Т.М., Исаков Ю.Н. Клональное размножение березы карельской // Лесн. хоз-во. 2000. № 4. С. 33–34.
Мирошниченко О.С. Биогенез, физиологическая роль и свойства каталазы // Biopolymers and Cell. 1992. Т. 8. № 6. С. 3–25.
Мощенская Ю.Л., Галибина Н.А., Топчиева Л.В., Новицкая Л.Л. Экспрессия генов, кодирующих изоформы сахарозосинтазы, в ходе аномального ксилогенеза карельской березы // Физиология растений. 2017. Т. 64. № 3. С. 301–310.
Мощенская Ю.Л., Галибина Н.А., Новицкая Л.Л., Никерова К.М. Активность ферментов диссимиляции сахарозы в раннем онтогенезе разных форм березы повислой // Труды Карельского научного центра Российской академии наук. 2016. № 11. С. 78–87.
Никерова К.М., Галибина Н.А. Влияние нитратного азота на пероксидазную активность в тканях Betula pendula Roth var. pendula и B. pendula var. carelica (Mercklin) // Сибирский лесной журнал. 2017. № 1. С. 15–24.
Никерова К.М., Галибина Н.А., Мощенская Ю.Л., Новицкая Л.Л., Подгорная М.Н., Софронова И.Н. Каталазная активность в листовом аппарате у сеянцев березы повислой разных форм (Betula pendula Roth): var. pendula и var. carelica (Mercklin) // Труды Карельского научного центра Российской академии наук. 2016. № 11. С. 68–77.
Новицкая Л.Л., Галибина Н.А., Никерова К.М. Транспорт и запасание сахаров во флоэме Betula pendula Roth var. pendula и var. carelica // Труды Карельского научного центра Российской академии наук. 2015. № 11. С. 35–47.
Павлова В.А., Нефедьева Е.Э., Лысак В.И., Шайхиев И.Г. Влияние импульсного давления на некоторые биохимические процессы семян гречихи при прорастании // Вестник Казанского технологического университета. 2014. Т. 17. № 21. С. 199–203.
Полесская О.Г., Каширина Е.И., Алехина Н.Д. Изменение активности антиоксидантных ферментов в листьях и корнях пшеницы в зависимости от формы и дозы азота в среде // Физиология растений. 2004. Т. 51. № 5. С. 686–691.
Половникова М.Г., Воскресенская О.Л. Активность компонентов антиоксидантной защиты и полифенолоксидазы у газонных растений в онтогенезе в условиях городской среды // Физиология растений. 2008. Т. 55. № 5. С. 777–785.
Рогожин В.В. Пероксидаза как компонент антиоксидантной системы живых организмов. СПб.: ГИОРД, 2004. 240 с.
Синькевич М.С., Дерябин А.Н., Трунова Т.И. Особенности окислительного стресса у растений картофеля с измененным углеводным метаболизмом // Физиология растений. 2009. Т. 56. № 2. С. 186–192.
Способ диагностики узорчатой текстуры древесины карельской березы: Патент 2 596 013 Российской Федерации. № 2015114510/13; заявл. 17.04.2015; опубл. 27.08.2016. Бюл. № 24. 4 с.
Федорков А.Л. Адаптация хвойных пород к бореальному климату Северной Европы // Лесоведение. 2007. № 3. С. 46–51.
Almagro L., Gómez Ros L.V., Belchi-Navarro S., Bru R., Ros Barceló A., Pedreño M.A. Class III peroxidases in plant defense reactions // J. Experimental Botany. 2009. V. 60. № 2. P. 377–390.
Apel K., Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction // Annual Review of Plant Biology. 2004. V. 55. P. 373–399.
Bi Y.-M., Kenton P., Mur L., Darby R., Draper J. Hydrogen peroxide does not function downstream of salicylic acid in the induction of PR protein expression // The Plant J. 1995. V. 8. № 2. P. 235–245.
Chen Y., Zhang M., Chen T., Zhang Y., An L. The relationship between seasonal changes in anti-oxidative system and freezing tolerance in the leaves of evergreen woody plants of Sabina // South African J. Botany. 2006. V. 72. № 2. P. 272–279.
Couée I., Sulmon C., Gouesbet G., El Amrani A. Involvement of soluble sugars in reactive oxygen species balance and responses to oxidative stress in plants // J. Experimental Botany. 2006. V. 57. № 3. P. 449–459.
Fernández-García N., Carvajal M., Olmos E. Graft union formation in tomato plants. Peroxidase and catalase involvement // Annals of Botany. 2004. V. 93. № 1. P. 53–60.
Kinkema M., Fan W., Dong X. Nuclear Localization of NPR1 Is Required for Activation of PR Gene Expression // The Plant Cell. 2000. V. 12. № 12. P. 2339–2350.
Mittler R. ROS are good // Trends in Plant Science. 2017. V. 22. № 1. P. 11–19.
Novitskaya L., Nikolaeva N., Galibina N., Tarelkina T., Semenova L. The greatest density of parenchyma inclusions in Karelian birch wood occurs at confluences of phloem flows // Silva Fennica. 2016. V. 50. № 3. Article 1461. doi 10.14214/sf.1461
Novitskaya L.L., Kushnir F.V. The role of sucrose in regulation of trunk tissue development in Betula pendula Roth // J. Plant Growth Regulation. 2006. V. 25. № 1. P. 18–29.
Olson P.O., Varner J.E. Hydrogen peroxide and lignification // The Plant J. 1993. V. 4. № 5. P. 887–892.
Pellinen R.I., Korhonen M.-S., Tauriainen A.A., Palva E.T., Kangasjärvi J. Hydrogen peroxide activates cell death and defense gene expression in birch // Plant Physiology. 2002. V. 130. № 2. P. 549–560.
Ros Barceló A. Xylem parenchyma cells deliver the H2O2 necessary for lignification in differentiating xylem vessels // Planta. 2005. V. 220. № 5. P. 747–756.
Sairam R.K., Singh D.V., Srivastava G.C. Changes in activity of activity of antioxidant enzymes in sunflower leaves of different ages // Biologia Plantarum. 2003. V. 47. № 1. P. 61–66.
Van Loon L.C., Rep M., Pieterse C.M.J. Significance of inducible defence-related proteins in infected plants // Annual Review of Phytopathology. 2006. V. 44. P. 135–162.
Wellen K.E, Thompson C.B. Cellular metabolic stress: Considering how cells respond to nutrient excess // Molecular Cell. 2010. V. 40. № 2. P. 323–332.
Zhang C. Han L., Slewinski T.L., Sun J., Zhang J., Wang Z.-Y., Turgeon R. Symplastic Phloem Loading in Poplar // Plant Physiology. 2014. V. 166. № 1. P. 306–313.
Дополнительные материалы отсутствуют.