Лесоведение, 2020, № 2, стр. 147-161
Опыт долговременного хранения коллекции ценных генотипов березы с использованием безгормональных питательных сред
Т. М. Табацкая 1, О. С. Машкина 1, 2, *
1 ФГБУ Всероссийский НИИ лесной генетики, селекции и биотехнологии
394087 Воронеж, ул. Ломоносова, д. 105, Россия
2 ФГБОУ ВПО “Воронежский государственный университет”
394006 Воронеж, Университетская пл., 1, Россия
* E-mail: mashkinaos@mail.ru
Поступила в редакцию 20.09.2018
После доработки 05.11.2019
Принята к публикации 10.12.2019
Аннотация
Проводили исследование 12 коллекционных клонов березы повислой (Betula pendula L.), карельской (B. pendula Roth var. carelica (Mercklin) Hämet-Ahti), далекарлийской (B. pendula “dalekarlica”(L.f.)) и пушистой (B. pubescens Ehrh.) разной длительности хранения in vitro и оценивали их регенерационную способность, генетическую стабильность, характер проявления ценных признаков в полевых условиях (ex vitro). Выявлено, что в процессе многолетнего хранения in vitro (от года до 26 лет) с использованием питательных сред без гормонов и периодического тиражирования микрорастений для получения посадочного материала все клоны демонстрировали высокую жизнеспособность, хорошую спонтанную укореняемость микрочеренков (87–100%), нормальный рост и развитие с сохранением ростовых и морфологических особенностей. В ходе длительного культивирования клоны проявляли цитогенетическую стабильность, сохраняя плоидность (2n = 2х = 28, 2n = 3х = 42 или 2n = 4х = 56) и миксоплоидную природу материнских деревьев. Полевые испытания (ex vitro) клонов после длительного хранения in vitro выявили их высокую приживаемость и сохранность (71–99%), внутриклоновую однородность и идентичность исходным деревьям (по росту, качеству древесины и молекулярно-генетическим особенностям). Исключение гормонов из состава питательной среды на этапах хранения и клонирования in vitro способствовало уменьшению возможности возникновения сомаклональной изменчивости и обеспечивало генетическую стабильность коллекционных образцов. Это создает основу использования коллекции в длительной пересадочной культуре in vitro для сохранения ex situ и устойчивого воспроизводства ценных генотипов березы, выращивания качественного посадочного материала для создания лесных культур целевого назначения.
Сохранение лесных генетических ресурсов – актуальная проблема современности. Обеднение и сокращение генофонда лесов обусловлено влиянием комплекса факторов: глобальным изменением климата, лесными пожарами, техногенным загрязнением, повреждениями, болезнями, вредителями, нерациональным использованием генетических ресурсов, массовыми вырубками и другими причинами (Ирошников, 1975; Александров, Пандева, 2008; Лукина и др., 2015). Следствием изменения климата, например, явилось увеличение за последние годы числа засух в европейской части России. Так, сильная засуха 2010 г. с аномально высокими температурами привела к частичному (а в отдельных районах массовому) усыханию деревьев березы повислой (Газизуллин, Сингатуллин, 2014), стала причиной катастрофических лесных пожаров в России на площади более 6 млн. га, в том числе на особо охраняемой территории площадью 2.3 млн га (Ерицов и др., 2016). С начала XXI в. наблюдается заметное сокращение покрытой лесом площади Российской Федерации, обусловленное комбинированным влиянием природных и антропогенных факторов (Исаев и др., 2014; Лукина и др., 2015). В этих условиях “сохранять леса как основу нашей среды обитания стало гораздо важнее, чем извлекать лесной доход” (Писаренко, 2014).
Одним из современных и успешно развивающихся подходов сохранения представителей ценного генофонда, дополняющих классические приемы консервации in situ и ex situ, является лесная биотехнология – применение технологии культуры in vitro (Martin et al., 2007; Cha-um, Kirdmanee, 2007; Shestibratov et al., 2008; Концевая, 2009; Pritchard et al., 2014; Rathwell, 2015; Gaidamashvili et al., 2017). Это нашло отражение в стратегических документах нашей страны. В Комплексной программе развития биотехнологий в Российской Федерации на период до 2020 г. (2012) отмечено, что применение биотехнологий для сохранения и воспроизводства лесных ресурсов относится к приоритетным направлениям развития лесных биотехнологий России. В Плане мероприятий (“дорожная карта”) “Развитие биотехнологий и генной инженерии” на 2018–2020 гг. (План …, 2018) особое внимание уделяется созданию коллекции in vitro (банка растительного материала) лесных древесных растений.
Коллекция in vitro – это искусственно созданная и длительно поддерживаемая в контролируемых асептических условиях совокупность образцов живого растительного материала (культуры протопластов, клеток, меристемы, каллуса, эмбриогенных культур, микропобегов, целых микрорастений и др.), соответствующая конкретным генотипам разных видов древесных растений, предназначенная для их сохранения и воспроизводства. В коллекции in vitro, как правило, сохраняют уникальные и/или экономически ценные генотипы, редкие и исчезающие виды растений, преимущественно те, которые трудно размножаются вегетативно или теряют ценные признаки при семенном размножении. Подобные коллекции (организованные, как правило, при ботанических садах, научно-исследовательских институтах или университетах) имеются за рубежом и в нашей стране. Они считаются национальным достоянием конкретных стран и являются “многолетней гарантией от современных рисков” (Popov et al., 2006; Решетников и др., 2014; Молканова и др., 2016).
Одна из первых в России коллекция клонов ценных генотипов лесных древесных растений была сформирована нами (в виде микрорастений) в 1991 г. Она ежегодно пополняется новыми экономически ценными и уникальными клонами, гибридами, полиплоидами и сортами березы (Betula pendula L., B. pubescens Ehrh., B. pendula Roth var. carelica (Mercklin) Hämet-Ahti, B. pendula “dalekarlica”(L.f.), тополя (Populus alba L., P. canescence Sm. и др.), осины (P. tremula L.) и ивы (Salix spp.) (Mashkina et al., 1999, 2011; Машкина и др., 2016). Большинство из них трудно размножается обычным черенкованием. По состоянию на октябрь 2019 г. в составе коллекции находится 70 клонов лиственных древесных (21 вид, 3 рода, 2 семейства). Клоны поддерживаются на протяжении 1–26 лет путем редкого субкультивирования (один раз в 5–6 мес.) при обычных условиях климатического режима на питательных средах без гормонов (за исключением ивы), которые были впервые нами применены для указанных видов (Mashkina et al., 1999).
Коллекции клонов элитных генотипов лесных древесных растений позднее были созданы и в других институтах нашей страны. В Институте леса Карельского НЦ РАН (г. Петрозаводск) организована одна из самых крупных коллекций клонов карельской березы (семенного и вегетативного происхождения) и других редких видов сем. Betulaceae (продолжительность хранения – 14 лет) (Ветчинникова и др., 2013). В Институте леса им. В.Н. Сукачева СО РАН (г. Красноярск) в составе коллекции хранятся (от года до 8 лет) клеточные линии, эмбриогенные культуры и растения-регенеранты Larix sibirica Ledeb. (Третьякова и др., 2016). В Филиале Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН (г. Пущино Московской обл.) длительно (в течение 6 лет) поддерживается коллекция in vitro ценных генотипов березы и осины (Vidyagina et al., 2013).
Несмотря на значительные успехи в этой области, еще недостаточно изучены вопросы, касающиеся влияния условий и длительности хранения in vitro живой коллекции лесных древесных растений на ее генетическую стабильность, регенерационную способность, особенности проявления ценных признаков у растений в полевых условиях (ex vitro). Это важно для разработки эффективных и малозатратных методов долгосрочного хранения различных генотипов с гарантированным сохранением у них генетической и хозяйственной ценности материнских деревьев.
Известно, что долговременное поддержание коллекции может осуществляться различными способами: в виде пересадочных коллекций в условиях нормального роста (путем регулярного субкультивирования в стандартных климатических условиях), депонирования в условиях замедленного роста (при низкой положительной температуре и редком (до года и более) субкультивировании), в криобанках (при сверхнизких температурах, полной остановке роста) (Бутенко, 1999; Shibli et al., 2006; Pritchard et al., 2014). При этом каждый способ имеет свои преимущества и недостатки. Так, в ходе длительного и частого субкультивирования (раз в 1–2 месяца) может накапливаться генетическая изменчивость клеток и тканей, особенно если присутствует стадия каллусообразования (Kuznetsova et al., 2006; Smykal et al., 2007; Кунах, 2011). Отмечено, что даже оптимальный уровень растительных гормонов при длительном культивировании часто приводит к сомаклональной (в том числе эпигенетической) изменчивости растений (Smykal et al., 2007). Низкая положительная (ниже оптимума) температура в условиях беспересадочного хранения микрорастений может действовать как стрессовый фактор (Саматова и др., 2008). Высокое содержание осмотически активных веществ, добавляемых в питательную среду для лимитирования роста, может привести к появлению мутаций и потере ценных признаков исходных экземпляров (Сафразбекян и др., 1991). Криосохранение – дорогостоящий и трудоемкий процесс. К тому же методы криоконсервации тканей и органов лесных древесных растений еще недостаточно разработаны для универсального применения.
Цель настоящей работы – проведение сравнительной оценки клонов березы разной длительности хранения in vitro (от года до 26 лет) на питательных средах без гормонов по их регенерационной способности, генетической стабильности (уровню плоидности и молекулярно-генетическим особенностям), характеру проявления ценных признаков в полевых условиях (ex vitro).
ОБЪЕКТЫ И МЕТОДИКА
Объектом исследования послужила коллекция in vitro 12 клонов 20-33-летних деревьев карельской березы (B. pendula Roth var. carelica (Mercklin) Hämet-Ahti) с узорчатой текстурой древесины, продуктивных форм березы повислой (Betula pendila L.) и березы пушистой (B. pubescens Ehrh.), декоративных рассеченнолистных форм березы далекарлийской (B. pendula “dalekarlica”(L.f.).
Экспланты взрослых деревьев были однократно введены в культуру in vitro, из них регенерированы микрорастения по разработанной нами методике (Mashkina et al., 1999), которые затем длительно (от года до 26 лет) поддерживались in vitro при обычных условиях климатического режима (24–26°С, длина светового дня – 16 ч, пониженная освещенность – 1 клк). Регенерацию растений карельской березы проводили через каллусные культуры (из стеблевых эксплантов с использованием регуляторов роста: 0.5–1 мг/л 6-бензиламинопурина (БАП) и 3 мг/л 2.4-дихлорфеноксиуксусной кислоты, а березы повислой, далекарлийской и пушистой – путем прямого органогенеза из одноузловых эксплантов однолетних одревесневших побегов. В качестве индуктора морфогенеза использовали 0.2–2 мг/л 6-БАП. Для уменьшения вероятности возникновения сомаклональной изменчивости применение гормональных питательных сред на этапе регенерации растений ограничивали 1–3 пассажами. С этой же целью многолетнее хранение исходного клона осуществляли путем редкого субкультивирования (один раз в 5–6 мес.) микрорастений на безгормональной питательной среде 1/2 нормы макросолей MS (1/2 MS) (Murashige, Skoog, 1962). Питательную среду дополняли 0.6%-м агаром, 2%-й сахарозой, 100 мг/л мезоинозитом, 1 мг/л тиамина, 0.5 мг/л никотиновой кислоты, 2 мг/л глицина, 10–25 мг/л глютамина при рН 5.7. Например, клоны Ia и Тр карельской березы, хранящиеся без обновления в составе коллекции на протяжении 26 лет, прошли за этот срок 50–60 циклов субкультивирования.
Для снижения вероятности микробной контаминации культур и повышения их сохранности при долгосрочном хранении в качестве культуральных сосудов использовали биологические пробирки, закрытые колпачками из фольги, куда помещали по одному растению (не менее 20–30 пробирочных растений для каждого клона).
При необходимости получения посадочного материала проводили клонирование in vitro (многократное микрочеренкование на основе пролиферации пазушных меристем) растений определенного клона с более коротким интервалом субкультивирования (раз в 2 месяца) на тех же безгормональных питательных средах, дополненных активированным углем (2.0%), в аналогичных условиях климатического режима (но при повышенной освещенности 2–3 клк). Культуральные сосуды на этапе “клонирование” – стеклянные колбы или пластиковые контейнеры. В каждый сосуд высаживали не более 10 микрочеренков.
Эффективность длительного хранения in vitro клонов березы оценивали по числу микропобегов, образовавших корни in vitro; росту и сохранности регенерантов in vitro и ex vitro (в теплице и питомнике); коэффициенту мультипликации; внутриклоновой однородности по морфологическим признакам; характеру проявления ценных признаков в полевых условиях.
Каждый опыт осуществлялся в 2–3 повторностях, по 20–30 микрорастений в каждом.
Микрорастения одних и тех же клонов березы разной длительности культивирования in vitro периодически высаживали в весенне-летний период в теплицу летнего типа с поликарбонатным покрытием и регулируемым поливом, где их доращивали в течение одного вегетационного периода, а затем пересаживали в питомник. Перевод микрорастений в почвенный субстрат (торф : песок – 1 : 1) проводили путем прямой высадки растений из пробирочной культуры сразу в теплицу с предварительной их адаптацией к условиям климатической камеры в течение 2–3 суток на агаровой среде в открытых культуральных сосудах с добавлением в них 1–1.3 мл дистиллированной нестерильной воды.
Цитогенетическую стабильность оценивали по числу хромосом и уровню миксоплоидии (проценту клеток с числом хромосом, отклоняющимся от модального) в меристеме кончиков корешков микрорастений или молодых листьев из распускающихся почек вегетирующих растений разной длительности культивирования in vitro. Материал фиксировали в спирто-уксусной смеси (3 : 1) с предобработкой 0.002-молярным раствором 8-оксихинолина при температуре 10–14°С в течение 3 ч. Давленые препараты, окрашенные ацетогематоксилином, изготавливали по методике А.К. Буториной (1985), в нашей модификации. В каждом образце (пробирочное растение, дерево) анализировали не менее 20–30 метафазных пластинок. Просмотр микропрепаратов осуществляли на микроскопе “Микмед 6” при увеличении 40 × 1.5 × 10 и 100 × 1.5 × 10. Микрофотосъемку проводили с использованием цифровой камеры окуляра DCM500 (USB 2.0; WEBBERS MYscope 500 M). Критерием для отнесения образца к тому или иному уровню плоидности являлось преобладание (свыше 60%) клеток с определенным числом хромосом.
ДНК-генотипирование вегетирующих в питомнике растений карельской березы проводили с использованием микросателлитных локусов совместно с Институтом леса НАН Беларуси (ведущий научн. сотр., д-р биол. наук О.Ю. Баранов). Экстракцию ДНК осуществляли из молодых листьев СТАВ-методом J.J. Doyle, J.L. Doyle (1987). Микросателлитный анализ проводили согласно (Падутов и др., 2007) по пяти полиморфным для березы SSR- локусам – L2.2, L5.5, L7.8, L10.1, L52 (Kulju et al., 2004). Электрофоретический анализ и детекцию осуществляли с помощью генетического анализатора ABI Prism Genetic Analyzer 310 (фирма Applied Biosystems). Анализ размера и количества ампликонов производили с помощью программного обеспечения Gene Mapper 4.0 (Applied Biosystems, США).
Компьютерную статистическую обработку данных осуществляли с помощью пакета программ “Stadia” 7.0. Для сравнения выборок использовали t-критерий Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Регенерационная способность коллекции долгосрочного хранения in vitro. В табл. 1 на примере клона Ia карельской березы представлены результаты оценки регенерационной способности коллекционных образцов в процессе их длительного хранения (от года до 26 лет) на питательной среде без гормонов. На протяжении всего периода хранения in vitro побеги имели хороший рост, стабильно высокую ризогенную активность (спонтанную укореняемость in vitro), а регенерировавшие растения – жизнеспособность и сохранность. Микрорастения характеризовались внутриклоновой однородностью по росту (о чем свидетельствуют стабильно низкие коэффициенты вариации – 6–12%). Не отмечено появления аномально развитых и витрифицированных (с признаками стекловидности) побегов, снижающих регенерационную способность. Аналогичные результаты были получены и для других генотипов березы (табл. 2). Для всех проанализированных клонов березы карельской, повислой, далекарлийской и пушистой отмечено формирование “нормального” морфотипа, стабильно высокие показатели сохранности (от 89 до 100%), сохранение особенностей роста (от 4.0 до 9.5 см в высоту в зависимости от клоновой принадлежности микрорастений), активный спонтанный ризогенез (87–100%) (рис. 1).
Таблица 1.
Регенерационная способность карельской березы (клон Ia) в процессе длительного хранения in vitro (на питательной среде 1/2 MS без гормонов) и приживаемость растений разного срока культивирования в теплице (ex vitro)
| Длительность хранения in vitro, лет | Биометрические показатели in vitro | Приживаемость растений в теплице (ex vitro), % |
|||
|---|---|---|---|---|---|
| укореняемость микрочеренков, % |
высота растений | сохранность растений, % | |||
| см | C.V., % | ||||
| 1 | 100 ± 0 | 4.5 ± 0.06 | 10 | 97 ± 2 | 76 ± 8 |
| 2 | 96 ± 2 | 4.5 ± 0.07 | 9 | 88 ± 3 | 88 ± 6 |
| 3 | 89 ± 4 | 4.0 ± 0.08 | 7 | 87 ± 4 | 96 ± 2 |
| 4 | 97 ± 2 | 4.3 ± 0.10 | 8 | 93 ± 4 | – |
| 5 | 94 ± 3 | 4.5 ± 0.06 | 6 | 86 ± 4 | 83 ± 7 |
| 6 | 98 ± 2 | 4.5 ± 0.04 | 7 | 92 ± 5 | 96 ± 3 |
| 7 | 98 ± 2 | 4.7 ± 0.10 | 8 | 86 ± 4 | – |
| 11 | 100 ± 0 | 5.0 ± 0.07 | 12 | 86 ± 3 | 89 ± 6 |
| 17 | 96 ± 4 | 5.2 ± 0.08 | 9 | 82 ± 5 | 81 ± 9 |
| 22 | 92 ± 3 | 5.4 ± 0.07 | 8 | 94 ± 3 | – |
| 25 | 90 ± 2 | 4.8 ± 0.07 | 9 | 90 ± 3 | 75 ± 5 |
| 26 | 100 ± 0 | 5.0 ± 0.10 | 7 | 94 ± 3 | – |
Таблица 2.
Регенерационная способность клонов березы повислой, карельской, далекарлийской и пушистой различного срока хранения на питательной среде 1/2 MS без гормонов на этапах “хранение in vitro” (без активированного угля) и “клонирование in vitro” (с добавлением активированного угля, 2.0%)
| Клон | Длительность хранения in vitro, лет | Укореняемость микрочеренков, % |
Высота растений, см | Сохранность растений, % | Коэффициент мультипликации |
|---|---|---|---|---|---|
| Этап “хранение in vitro” | |||||
| Iа | 26 | 100 ± 0 | 5.0 ± 0.10 | 94 ± 3 | – |
| Тр | 26 | 100 ± 0 | 6.5 ± 0.36 | 100 ± 0 | |
| Aп | 20 | 92 ± 1 | 6.7 ± 0.40 | 89 ± 1 | – |
| Ю | 20 | 87 ± 2 | 6.5 ± 0.20 | 90 ± 2 | |
| R1 | 17 | 100 ± 0 | 5.0 ± 0.10 | 85 ± 2 | – |
| R2 | 17 | 96 ± 1 | 5.6 ± 0.17 | 89 ± 2 | |
| д.5 | 4 | 96 ± 2 | 4.0 ± 0.10 | 90 ± 1 | – |
| д.1 | 4 | 91± 2 | 4.0 ± 0.04 | 92 ± 2 | |
| 3пш | 3 | 100 ± 0 | 9.5 ± 0.18* | 95 ± 1 | – |
| 7гб | 3 | 100 ± 0 | 8.1 ± 0.10* | 90 ± 1 | |
| Этап “клонирование in vitro” | |||||
| Iа | 24 | 100 ± 0 | 8.0 ± 0.05 | 96 ± 2 | 5 |
| 26 | 100 ± 0 | 8.2 ± 0.17 | 93 ± 2 | 6 | |
| Тр | 24 | 97 ± 2 | 10.3 ± 0.16 | 97 ± 2 | 7 |
| 26 | 100 ± 0 | 9.9 ± 0.10 | 100 ± 0 | 6 | |
| Aп | 18 | 97 ± 2 | 9.0 ± 0.18 | 92 ± 3 | 5 |
| 20 | 96 ± 2 | 8.5 ± 0.23 | 93 ± 3 | 5 | |
| Ю | 18 | 87 ± 2 | 7.6 ± 0.22 | 97 ± 2 | 6 |
| 20 | 92 ± 3 | 8.0 ± 0.31 | 95 ± 2 | 6 | |
| д.5 | 2 | 96 ± 2 | 4.5 ± 0.22 | 85 ± 2 | 4 |
| 4 | 94 ± 2 | 5.3 ± 0.17 | 89 ± 3 | 4 | |
| 3пш | 1 | 100 ± 0 | 14.6 ± 0.30* | 100 ± 0 | 12 |
| 3 | 100 ± 0 | 14.1 ± 0.17* | 100 ± 0 | 11 | |
| 7гб | 1 | 100 ± 0 | 12.6 ± 0.30* | 100 ± 0 | 9 |
| 3 | 100 ± 0 | 13.1 ± 0.11* | 100 ± 0 | 10 | |
* Клоны березы пушистой (3пш, 7гб) достоверно различаются со всеми остальными по высоте при Р < 0.01. Примечание. Приведены данные для двухмесячных микрорастений березы (за исключением сохранности на этапе “хранение in vitro”, оцениваемой для 5-месячных растений). Клоны: Iа, Тр, Aп, Ю – карельская береза, R1, R2 – далекарлийская береза; д.5, д.1 – береза повислая; 3пш, 7гб – береза пушистая. “–" – данные отсутствуют. Коэффициент мультипликации – количество микрочеренков от одного побега in vitro.
Рис. 1.
Общий вид культур березы из коллекции длительного хранения (а), микрорастения отдельных клонов березы на этапах “хранение in vitro” (б–з) и “клонирование in vitro” (и), посадочный материал березы, высаженный в теплицу после 25 лет хранения in vitro (к). (б) – карельская береза, клон Iа (26 лет хранения); (в, г) – береза повислая, клон д.5 (4 года хранения); (д, е) – береза пушистая, клон 3пш (3 года хранения); (ж) – береза далекарлийская с рассеченными листьями (17 лет хранения); (з) – сомаклональный вариант карельской березы Л (20 лет хранения).

Таким образом, полное исключение регуляторов роста из состава питательной среды при долгосрочном хранении in vitro способствовало нормальному развитию растений, сохранению регенерационной активности и жизнеспособности культур на достаточно высоком уровне, уменьшению возможности возникновения сомаклональной изменчивости, что может обеспечить генетическую стабильность коллекционных образцов.
Вместе с тем, имеющиеся в составе коллекции сомаклональные варианты (мутантный клон Л карельской березы, характеризующийся комплексом измененных морфологических признаков (рис. 1), клон-ревертант березы далекарлийской с цельными листьями и др.) на протяжении 17–20 лет хранения in vitro сохраняли свой характерный, отклоняющийся от нормы фенотип. Такие сомаклоны представляют значительный интерес для изучения генетики развития растений.
Долгосрочное хранение культур можно считать успешным, если их ростовые особенности, жизнеспособность, регенерационный потенциал сохраняются и при клонировании in vitro (многократном микрочеренковании). Перевод из режима “хранение in vitro” в режим “клонирование in vitro” осуществляли путем добавления активированного угля (2.0%) в питательную среду 1/2 MS без гормонов, увеличения интенсивности освещения до 2–3 клк и более частого субкультивирования (один раз в два месяца) до получения необходимой численности клона. Как следует из табл. 2, при соблюдении указанных условий двухмесячные микрорастения разных клонов березы демонстрируют более интенсивный рост, чем в том же возрасте на этапе “хранение in vitro”, высокую укореняемость микрочеренков и сохранность растений (85–100%). При этом сохраняются особенности роста клонов в высоту. Так, по данным 2017 г. при сходных условиях культивирования клон д.5 березы повислой демонстрировал наименьшие (5.3 см), а клоны березы пушистой (7гб и 3пш ) – наивысшие показатели роста побегов в высоту (в 2.5–2.7 раз выше – 13.1 и 14.1 см). Причем, по сравнению с данными 2015 г. эти показатели оставались сходными. Независимо от высоты микрорастений междоузлия хорошо выражены (1.5–2 см), что благоприятно для микрочеренкования побегов. Коэффициент мультипликации, характеризующий регенерационный потенциал коллекционных образцов, в зависимости от их клоновой принадлежности составил от 4 до 12 (табл. 2), что находится в пределах нормы для березы.
Более частое субкультивирование (один раз в два месяца) на этапе мультипликации растений, по-видимому, способствует поддержанию ювенильности тканей и успешному спонтанному ризогенезу микрочеренков in vitro. При добавлении в питательную среду активированного угля (20 г/л) у микрочеренков формировалась мощная корневая система (что способствует успешной адаптации микрорастений при их переводе в нестерильный субстрат теплицы) и, как следствие, более развитые хорошо растущие побеги. Положительное действие активированного угля может быть связано с его адсорбирующей способностью продуктов метаболизма (в частности, этилена, значительное повышение содержания которого на свету может оказывать отрицательное влияние на укоренение (Eliasson, Bollmark, 1988; Деменко и др., 2010)), а также выступающего в качестве защитного от света слоя, затемняющего основание микрочеренка in vitro.
Таким образом, использование коллекции в обоих режимах (“хранение”–“клонирование”) выявило сохранение стабильно высокой жизнеспособности и регенерационной способности растительного материала различного срока культивирования in vitro. При этом сохраняются особенности роста клонов в высоту (средние значения которых различаются в зависимости от режима использования коллекции и индивидуальных особенностей клонов), их внутриклоновая однородность.
Цитогенетическая стабильность клонов березы по числу хромосом и уровню миксоплоидии в процессе длительного хранения in vitro. В таблице 3 и на рис. 2 на примере 4 коллекционных клонов березы повислой (Пв 1), карельской (Ia, Тр) и пушистой (3пш) представлены результаты их многолетней оценки по числу хромосом в сравнении с материнскими (исходными) деревьями. В процессе длительного хранения in vitro клоны сохранили уровень плоидности (диплоидный (2n = 2x = 28) – клоны Ia и Пв 1, триплоидный (2n = 3x = 42) – клон Тр; тетраплоидный (2n = 4x = 56) – клон 3пш ), а также миксоплоидную природу, присущие материнским деревьям. Так, клон березы пушистой (3пш ) в течение трех первых лет культивирования in vitro демонстрирует высокое (свыше 90%) содержание клеток с тетраплоидным (2n = 56) числом хромосом. Остальная часть приходится на долю анеуплоидных клеток. Клоны Ia и Тр (как и их материнские деревья) имеют выраженную миксоплоидную природу, характерную для карельской березы (Буторина, 1985; Mashkina et al., 2011), которая считается разновидностью березы повислой. У клона Ia преобладают клетки с диплоидным (2n = 28), а у клона Тр – с триплоидным (2n = 3x = 42) числом хромосом. Уровень миксоплоидии соматической ткани у них в течение 5–26 лет хранения in vitro был в 2.3–9.6 раза выше (соответственно 10.5 и 44.0%) по сравнению с клоном березы повислой (Пв 1), культивируемой in vitro в аналогичных условиях в течение 10 лет (4.6%). По мнению А.К. Буториной (1985) соотношение клеток разного уровня плоидности у миксоплоидов является решающим фактором в определении особенностей роста и проявлении узорчатости древесины у карельской березы.
Таблица 3.
Цитогенетическая стабильность различных клонов березы по плоидности и уровню миксоплоидии в процессе длительного хранения in vitro
| Материнское дерево, клон in vitro |
Длительность хранения in vitro, лет | Доля клеток с числом хромосом, % | Уровень миксоплоидии, %* | |||
|---|---|---|---|---|---|---|
| 2n = 28 | 2n = 42 | 2n = 56 | анеуплоидные | |||
| Материнское дерево Iа | – | 89.3 | – | – | 10.7 | 10.7 |
| Клон Ia | 18 | 90.4 | – | – | 9.6 | 9.6 |
| 22 | 88.6 | – | – | 11.4 | 11.4 | |
| 24 | 90.5 | – | – | 9.5 | 9.5 | |
| 26 | 88.6 | – | – | 11.4 | 11.4 | |
| Среднее для клона | 10.5 ± 0.5* | |||||
| Материнское дерево Тр | – | 21.7 | 60.9 | – | 17.4 | 39.1 |
| Клон Тр | 5 | 35.8 | 50.9 | 13.3 | 49.1 | |
| 14 | 28.6 | 54.3 | – | 17.1 | 45.7 | |
| 17 | 30.8 | 61.5 | – | 7.7 | 38.5 | |
| 22 | 32.4 | 51.6 | – | 16.0 | 48.4 | |
| 26 | 26.5 | 61.8 | – | 11.7 | 38.2 | |
| Среднее для клона | 44.0 ± 2.4* | |||||
| Материнское дерево Пв 1 | – | 96.7 | – | – | 3.3 | 3.3 |
| Клон Пв 1 | 2 | 97.8 | – | – | 2.2 | 2.2 |
| 5 | 96.5 | – | – | 3.5 | 3.5 | |
| 10 | 91.8 | – | – | 8.2 | 8.2 | |
| Среднее для клона | 4.6 ± 1.8 | |||||
| Материнское дерево 3пш | – | – | – | 88.2 | 11.8 | 11.8 |
| Клон 3пш | 1 | – | – | 92.4 | 7.6 | 7.6 |
| 3 | – | – | 90.9 | 9.1 | 9.1 | |
| Среднее для клона | 8.3 ± 0.4 | |||||
* Клоны карельской березы (Iа, Тр) достоверно различаются со всеми остальными по уровню миксоплоидии при Р < 0.01. Примечание. Клоны: Iа, Тр – карельская береза; Пв 1 – береза повислая; 3пш – береза пушистая. Плоидность исходного дерева анализировали перед введением эксплантов в культуру in vitro. Уровень миксоплоидии – процент клеток с числом хромосом, отклоняющимся от модального диплоидного (2n = 2x = 28), триплоидного (2n = 3x = 42) или тетраплоидного (2n = 4x = 56) набора хромосом.
Рис. 2.
Метафазные пластинки с модальным числом хромосом клеток корневой меристемы микрорастений березы: диплоидным (2n = 2x = 28) у березы повислой – клон Пв 1 (а) и карельской березы – клон Ia (б); триплоидным (2n = 3x = 42) у карельской березы – клон Тр (в); тетраплоидным (2n = 4x = 56) у березы пушистой – клон 3пш (г).
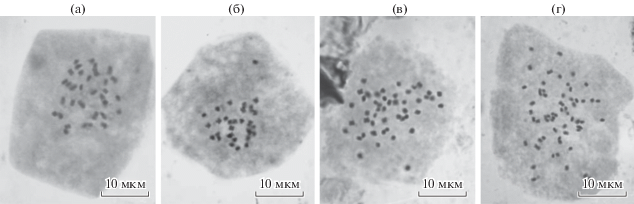
Таким образом, проанализированные клоны березы повислой, карельской и пушистой в ходе длительного хранения in vitro сохраняли свои цитогенетические особенности (уровень плоидности, миксоплоидную природу), присущие материнским деревьям, проявляя цитогенетическую стабильность.
Приживаемость микроклонов березы разного срока хранения in vitro в теплице. Из литературных источников известно, что даже при 100% укоренении побегов in vitro может наблюдаться 100% гибель растений в нестерильных условиях – ex vitro (Деменко и др., 2010), поскольку перевод стерильных растений в почву является одним из уязвимых, трудоемких и порой непредсказуемых этапов выращивания посадочного материала. Наши многолетние исследования показали, что прямая высадка растений из пробирочной культуры сразу в теплицу летнего типа (ex vitro) дает стабильно хороший результат только при наличии определенных условий: влажность не менее 80%, температурный режим без резких колебаний (ночные температуры не ниже 15°C, а дневные – не выше 30°С), естественное освещение. Так, при соблюдении указанных условий, приживаемость пробирочных растений одного и того же клона карельской березы Ia разной длительности хранения in vitro (от года до 25 лет) в теплице была высокой и составила от 75 до 96% (табл. 1). После года доращивания в теплице растения высаживали в полевые условия.
Полевые испытания клонов березы, полученных на основе коллекции длительного хранения in vitro. Опытные плантационные культуры 5 клонов карельской березы с узорчатой текстурой древесины и двух клонов березы повислой после одного года хранения in vitro заложены в 1993 г. в Семилукском лесопитомнике Воронежской области. В России нет аналогов плантаций березы данного возраста, созданных с использованием технологии in vitro (Табацкая и др., 2004). В 1997–2003 гг. плантация дополнена растениями (раметами) этих же клонов после 5 и 11 лет хранения in vitro. По результатам многолетних (в течение 25 лет) полевых испытаний клоны березы проявили все признаки полноценного развития: имели хорошую приживаемость и рост в полевых условиях, в целом сохраняли специфичные для их исходных генотипов особенности роста, относительную внутриклоновую однородность по росту (табл. 4). Рост в высоту клонов высокоствольной формы (Ia, Тр и R) карельской березы на протяжении всего периода изучения был существенно больше, чем клонов короткоствольной (IIa) и кустовидной (III) форм.
Таблица 4.
Морфометрическая характеристика рамет клона Ia карельской березы и клона 3/1 березы повислой, высаженных в питомник после длительного культивирования in vitro
| Анализируемый показатель | Длительность культивирования in vitro/возраст растений, лет (данные 2017 г.) | ||||
|---|---|---|---|---|---|
| карельская береза | береза повислая | ||||
| 1/25 | 5/21 | 11/15 | 1/21 | 5/17 | |
| Число растений (рамет) | 127 | 29 | 19 | 30 | 22 |
| Высота растений, м | 11.5 ± 0.1 | 9.8 ± 0.1 | 5.4 ± 0.1 | 17.3 ± 0.2 | 12.2 ± 0.3 |
| Коэффициент вариации, % | 7.9 | 5.0 | 11.2 | 8.6 | 13.1 |
| Диаметр ствола на высоте 1.3 м, см | 14.5 ± 0.2 | 12.3 ± 0.3 | 8.2 ± 0.2 | 18.5 ± 0.4 | 13.8 ± 0.4 |
| Коэффициент вариации, % | 15.3 | 16.4 | 15.3 | 13.4 | 15.2 |
| Доля растений с признаками узорчатой древесины, % | 100.0 | 100.0 | 100.0 | 0.0 | 0.0 |
| Сохранность растений, % (учет 2008 г.) | 99.2 | 89.6 | 89.5 | 93.3 | 71.4 |
| Сохранность растений после засухи 2010 г., % (учет 2012 г.) | 99.2 | 79.3 | 78.9 | 83.3 | 63.6 |
| Доля одноствольных растений (учет 2008 г.), % | 34.0 | 100.0 | 100.0 | 100.0 | 100.0 |
Независимо от длительности хранения in vitro (от года до 11 лет) растения всех пяти клонов карельской березы каллусного происхождения характеризовались полным (у всех без исключения деревьев) и хорошо выраженным проявлением признаков узорчатости древесины: анатомических и внешних (вздутия отчетливо видны и распространены по всей длине ствола) (рис. 3).
Рис. 3.
Общий вид плантационных культур и отдельных рамет клона карельской березы (а–е) и березы повислой (и, к), высаженных в питомник после длительного хранения in vitro. Ямчатая поверхность древесины карельской березы под снятой корой (ж) и тангентальный спил древесины с узорчатой текстурой (з). Плантационные культуры в возрасте 5 (а), 25 (б) и 17 лет (и); многоствольная (в) и одноствольные (г–е) раметы карельской березы высокоствольной формы с хорошо выраженными вздутиями на поверхности ствола после 1 (в, г), 5 (д) и 11 лет (е) хранения in vitro.

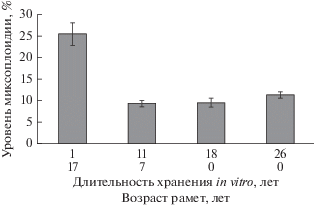
Вместе с тем, характер проявления признаков узорчатости древесины различался в зависимости от длительности хранения клонов в культуре in vitro. С повышением срока хранения in vitro (до 5–11 лет) отмечено более позднее (начиная с 6–7 лет по сравнению с 3–5 лет у исходного клона, высаженного в питомник после одного года хранения in vitro) проявление первых признаков узорчатости древесины, которые к 12-летнему возрасту наблюдались у всех без исключения рамет. Проявление узорчатости древесины у карельской березы положительно коррелирует со степенью миксоплоидии ее соматической ткани, которая была сильнее выражена у растений, полученных в первые годы культивирования микроклонов каллусного происхождения (Mashkina et al., 2011). Так, у растений клона Ia, высаженных в питомник после одного года культивирования in vitro, уровень миксоплоидии в 2.5 раз выше, чем у растений того же клона после 11, 18 и 26 лет хранения (рис. 4). Таким образом, у растений, полученных через каллусные культуры, в первый год наблюдался всплеск геномной (хромосомной) изменчивости, относительно высокий уровень которой оставался неизменным в течение одного-трех лет субкультивирования. По-видимому, в последующем при культивировании на средах без гормонов внутриклеточный отбор приводит к уменьшению степени миксоплоидии (до уровня, присущего исходному дереву) и, соответственно, к более позднему проявлению признака узорчатости древесины у растений-регенерантов. Это дало нам возможность предположить миксоплоидно-эпигенетическую модель проявления узорчатости древесины у карельской березы (Mashkina et al., 2011).
Рис. 4.
Уровень миксоплоидии культивируемых in vitro и высаженных в питомник рамет клона Ia карельской березы разного срока хранения in vitro. Различия с исходным клоном (1 год культивирования in vitro) достоверны при Р < 0.01.
Практическим результатом настоящей работы является возможность получения посадочного материала и создания плантационных культур с обычным для карельской березы сроком проявления признаков узорчатости (с 8–12-летнего возраста) с использованием длительного беспрерывного культивирования коллекции клонов по предлагаемой нами методике. Для раннего проявления признаков узорчатости древесины (что позволит сократить сроки получения ценной древесины) у клонов каллусного происхождения длительность хранения in vitro не должна превышать 1–3 года.
Каллусным происхождением клонов может быть обусловлена и более высокая их фенотипическая неоднородность. Это проявилось в появлении у исходных клонов карельской березы высокоствольной формы значительного числа многоствольных рамет (до 66% у клона Ia). С повышением срока субкультивирования на питательной среде без гормонов клоны становились более однородными. Все растения, высаженные в питомник после 5 и 11 лет хранения in vitro, были типичными одноствольными (табл. 4). У березы повислой, полученной через меристемные культуры, в процессе многолетнего культивирования in vitro не наблюдалось ни одного случая внутриклоновой изменчивости (многоствольности). Известно (Кунах, 2011), что перепрограммирование генома (смена генетических программ развития при переходе клеток из дифференцированного к недифференцированному состоянию и каллусообразованию) сопровождается высоким уровнем геномной изменчивости.
Отмечено относительно хорошее состояние размноженных in vitro клонов березы повислой и карельской после трех засух (2007, 2010 и 2012 г.) (табл. 4). Засушливые годы оказали наиболее сильное воздействие на молодые по возрасту раметы (сохранность 18–20-летних растений составила 83–99%, 10–12-летних – 64–79%).
Микросателлитный анализ клонов разной длительности хранения in vitro. С использованием пяти микросателлитных ядерных локусов, специфичных для березы (Kulju et al., 2004), составлены многолокусные генетические паспорта 11 рамет двух клонов карельской березы (Ia и R) разного срока хранения in vitro (табл. 5). На основании полученных данных выделено два генотипа. Показана высокая генетическая однородность (не выявлены изменения в ДНК-спектрах) двух клонов, высаженных в питомник после длительного хранения in vitro (1 год, 5 и 11 лет).
Таблица 5.
Многолокусные генетические паспорта образцов двух клонов карельской березы разного срока хранения в условиях in vitro, полученные на основе микросателлитного анализа
| Номер раметы |
Длительность хранения in vitro, лет |
Микросателлитные локусы | ||||
|---|---|---|---|---|---|---|
| L 2.2 | L 5.5 | L 10.1 | L 7.8 | L 52 | ||
| Клон Ia | ||||||
| 1 | 1 | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 2 | » | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 3 | » | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 4 | 5 | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 5 | » | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 6 | » | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 7 | 11 | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 8 | » | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| 9 | » | 133/133 | 120/128 | 254/258 | 295/297 | 271/271 |
| Клон R | ||||||
| 1 | 1 | 133/133 | 132/138 | 257/257 | 299/306 | 267/267 |
| 2 | 11 | 133/133 | 132/138 | 257/257 | 299/306 | 267/267 |
Заключение. Проведенные нами исследования свидетельствуют о возможности долговременного хранения in vitro (до 26 лет) коллекционных образцов ценных генотипов березы (Betula pendula L., B. pendula Roth var. carelica (Mercklin) Hämet-Ahti, B. pendula “dalekarlica”(L.f.), B. pubescens Ehrh.) с использованием безгормональных питательных сред. Это устойчиво пролиферирующие, адаптированные к условиям in vitro культуры, способные к полноценному развитию растений in vitro и ex vitro (в полевых условиях), сохраняющие генетические особенности и хозяйственно-ценные признаки исходных экземпляров. В процессе многолетнего хранения in vitro (от года до 26 лет) все 12 клонов березы демонстрировали высокую жизнеспособность и регенерационную способность, что важно для многолетних древесных растений, теряющих с возрастом способность к регенерации и вегетативному размножению. Коллекционные образцы сохраняли плоидность (2n = 28, 2n = 42 или 2n = 56) и миксоплоидную природу деревьев-доноров, проявляли высокую внутриклоновую генетическую однородность по микросателлитным локусам. Упрощение питательной среды (исключение гормонов) и относительно редкое субкультивирование (один раз в 5–6 мес.) на основе использованной нами модели микрочеренкования (регенерации на основе пролиферации пазушных меристем) снижает вероятность витрификации растительного материала (которая довольно часто появляется при его депонировании) и возникновения сомаклональной изменчивости, способствует сохранению генетической и хозяйственной ценности коллекционного материала. Предлагаемые биотехнологические регламенты хранения достаточно унифицированы, воспроизводимы и применимы к различным генотипам, разновидностям и видам березы.
Это создает основу для использования коллекции в длительной пересадочной культуре in vitro по предлагаемой нами технологии для сохранения ex situ и устойчивого воспроизводства ценных генотипов березы. Использование коллекции будет способствовать повышению эффективности выращивания качественного посадочного материала для создания лесных культур целевого назначения, снижению его себестоимости (за счет исключения начальных трудоемких этапов получения асептических культур и регенерации растений в культуре in vitro). Сохранение генетических ресурсов на основе использования коллекций in vitro имеет и стратегическое значение для поддержания и сохранения биоразнообразия в роде Betula, защиты селекционных достижений, доступности этих ресурсов для нынешнего и будущего поколений.
Список литературы
Александров А., Пандева Д. Лесные генетические ресурсы Европы, их сохранение и использование // Теоретическая и прикладная экология. 2008. № 1. С. 80–84.
Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М.: ФБК-ПРЕСС, 1999. 159 с.
Буторина А.К. Цитогенетика хозяйственно-ценных форм карельской березы // Генетика. 1985. Т. XXI. № 7. С. 1192–1198.
Ветчинникова Л.В., Титов А.Ф., Кузнецова Т.Ю. Карельская береза: биологические особенности, динамика ресурсов и воспроизводство. Петрозаводск: Изд-во Карельского НЦ РАН, 2013. 312 с.
Газизуллин А.Х., Сингатуллин И.К. Состояние березняков возвышенного Заволжья Республики Татарстан после засухи 2010 г. // Вестник КазГАУ. 2014. № 2(32). С. 99–103.
Деменко В.И., Шестибратов К.А., Лебедев В.Г. Укоренение – ключевой этап размножения растений in vitro // Известия ТСХА. 2010. Вып. 1. С. 73–85.
Ерицов А.М., Волков С.Н., Ломов В.Д. Катастрофические лесные пожары последних лет // Лесной вестник. 2016. Т. 20. № 5. С. 106–110.
Ирошников А.И. Изучение, охрана и рациональное использование генофонда лесов // Биосфера и человек: Сб. статей, М.: Наука, 1975. С. 60–62.
Исаев А.С., Барталев С.А., Лупян Е.А., Лукина Н.В. Спутниковое зондирование Земли – уникальный инструмент мониторинга лесов России // Вестник РАН. 2014. Т. 84. № 12. С. 1073–1079.
Комплексная программа “Развитие биотехнологий в Российской Федерации на период до 2020 года” (БИО 2020). 2012. Утв. постановлением Правительства Российской Федерации № 1853п-П8 от 24.04.2012 http:// economy.gov.ru/wps/wcm/connect/2c9d7d804b0988f09-b2a9ba338dd8a95/biotechdevelopcomprog_2020.pdf?MOD= AJPERES&CACHEID=2c9d7d804b0988f09b2a9ba338-dd8a95 (Дата обращения 14.08.2018).
Концевая И.И. Длительное хранение микрорастений березы в культуре тканей // Лесоведение. 2009. № 5. С. 50–56.
Кунах В.А. Пластичность генома соматических клеток и адаптивность растений // Молекулярная и прикладная генетика. 2011. Т. 12. С. 7–14.
Лукина Н.В., Исаев А.С., Крышень А.М., Онучин А.А., Сирин А.А., Гагарин Ю.Н., Барталев С.А. Приоритетные направления развития лесной науки как основы устойчивого управления лесами // Лесоведение. 2015. № 4. С. 243–254.
Машкина О.С., Табацкая Т.М., Морковина С.С., Панявина Е.А. Выращивание посадочного материала тополя белого (Populus alba L.) на основе коллекции in vitro и оценка его себестоимости // Лесотехнический журн. 2016. Т. 6. № 1(21). С. 28–44.
Молканова О.И., Коновалова Л.И., Стахеева Т.С. Особенности размножения и сохранения коллекции ценных и редких видов растений в условиях in vitro // Бюллетень ГНБС. 2016. № 120. С. 17–23.
Падутов В.Е., Баранов О.Ю., Воропаев Е.В. Методы молекулярно-генетического анализа. Минск: Юнипол, 2007. 176 с.
Писаренко А.И. Защитные леса и защитное лесоводство в устойчивом лесоуправлении // Вестник Поволжского государственного технологического университета. Сер.: Лес. Экология. Природопользование. 2014. № 1(21). С. 5–17.
План мероприятий (“дорожная карта”) “Развитие биотехнологий и генной инженерии”. Утв. Распоряжением Правительства Российской Федерации № 337-р от 28.02.2018 http://static.government.ru/media/files/v6MiUgQdmSRpmUebtv8Aqzk2KdmZ76CI.pdf (Дата обращения 14.08.2018).
Решетников В.Н., Спиридович Е.В., Носов А.М. Биотехнология растений и перспективы ее развития // Физиология растений и генетика. 2014. Т. 46. № 1. С. 3–17.
Саматова И.С., Шарова Е.И., Щипарев С.М., Гавриленко Т.А., Медведев С.С. Динамика физиологических и биохимических показателей микрорастений ежевики при длительном хранении in vitro // Вестник Санкт-Петербургского университета. 2008. Сер. 3. Вып. 3. С. 127–137.
Сафразбекян С.А., Урманцева В.В., Катаева Н.В. Роль сахарозы в регуляции морфогенеза каперса in vitro // Биология культивируемых клеток и биотехнология растений. М.: Наука, 1991. С. 192–197.
Табацкая Т.М., Бутова Г.П., Машкина О.С. Объект № 95. Опытные плантационные культуры хозяйственно-ценных форм карельской березы, созданные на основе технологии in vitro // Опытно-производственные селекционно-семеноводческие объекты НИИЛГиС. Воронеж: НИИ лесной генетики и селекции, 2004. Т. 2. С. 171–172.
Третьякова И.Н., Пак М.Э., Иваницкая А.С., Орешкова Н.В. Особенности соматического эмбриогенеза длительно пролиферирующих эмбриогенных клеточных линий Larix sibirica in vitro // Физиология растений. 2016. Т. 63. № 6. С. 812–822.
Cha-um S., Kirdmanee C. Minimal growth in vitro culture for preservation of plant species // Fruit, Vegetable & Cereal Science & Biotechnology. 2007. V. 1. P. 13–25.
Doyle J.J., Doyle J.L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue // Phytochemical Bulletin. 1987. № 19. P. 11–15.
Eliasson L., Bollmark M. Ethylene as possible mediator of light-induced inhibition of root growth // Physiologia Plantarum. 1988. V. 72. № 2. P. 605–609.
Gaidamashvili M., Khurtsidze E., Khechoshv V. Conservation of six threatened tree species of Georgia by in vitro propagation // Acta Horticulturae. 2017. V. 1187. P. 189–198.
Kulju K.K.M., Pekkinen M., Varvio S. Twenty-three microsatellite primer pairs for Betula pendula (Betulaceae) // Molecular Ecology Notes. 2004. V. 4. № 3. P. 471–473.
Kuznetsova O.I., Ash O.A., Gostimsky S.A. The effect of the duration of callus culture on the accumulation of genetic alterations in pea Pisum sativum L // Russian J. Genetics. 2006. V. 42. № 5. P. 555–562.
Martin M.T., Pedranzani H.E., Sierra de Grado R. Behavior and preservation of an in vitro collection of European aspen in Spain // Biocell. 2007. V. 31. № 1. P. 41–49.
Mashkina O.S., Butorina A.K., Tabatskaya T.M. Karelian birch (Betula pendula Roth var. carelica Merkl.) as a model for studying genetic and epigenetic variation related to the formation of patterned wood // Russian J. Genetics. 2011. V. 47. № 8. C. 951–957.
Mashkina O.S., Tabatskaya T.M., Starodubtseva L.M. Mass clonal propagation of Karelian birch and poplar through long-term shoot multiplication // Russian J. Plant Physiology. 1999. V. 46. № 6. P. 835–837.
Murashige T., Skoog F. A revised medium for rapid growth and bio assays with Tobacco tissue cultures // Physiologia Plantarum. 1962. V. 15. P. 473–497.
Popov A.S., Popova E.V., Nikishina T.V., Vysotskaya O.N. Cryobank of plant genetic resources in Russian Academy of Sciences // International J. Refrigeration. 2006. V. 29. № 3. P. 403–410.
Pritchard H.W., Moat J.F., Ferraz J.B.S., Marks T.R., Camargo J.L.C., Nadarajan J., Ferraz I.D.K. Innovative approaches to the preservation of forest trees // Forest Ecology & Management. 2014. V. 333. P. 88–98.
Rathwell R. In vitro propagation and preservation of cherry birch (Betula lenta L.). Guelph, Ontario, Canada: University of Guelph, 2015. 117 p.
Shestibratov K.A., Lebedev V.G., Miroshnikov A.I. Forest Biotechnology: methods, technologies, and perspectives // Biotechnology in Russia. 2008. № 5. P. 1–34.
Shibli R.A., Shatnawi M., Subaih W.S., Ajlouni M. In vitro conservation and cryopreservation of plant genetic resources: A review // World J. Agricultural Sciences. 2006. V. 2. № 4. P. 372–382.
Smykal P., Valledor L., Rodríguez R., Griga M. Assessment of genetic and epigenetic stability in long-term in vitro shoot culture of pea (Pisum sativum L.) // Plant Cell Reports. 2007. V. 26. № 11. P. 1985–1998.
Vidyagina E.O., Filippov M.V., Shestibratov K.A. Long-term of different aspen genotypes in vitro without repotting // Plant Cell Biology in Vitro and Biotechnology // Proc. Conf., 2013. Kazan, October 14–18. 2013. P. 274.
Дополнительные материалы отсутствуют.


