Лесоведение, 2021, № 2, стр. 187-194
Компонентный состав базидиом ежовика гребенчатого и их антиоксидантные свойства в зависимости от предобработки опилок сосны и бука
А. В. Голышкин a, *, Н. Р. Альмяшева a, Л. М. Краснопольская a
a Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, ул. Большая Пироговская, 11, стр. 1, Россия
* E-mail: a.v.golyshkin@gmail.com
Поступила в редакцию 27.03.2018
После доработки 09.04.2019
Принята к публикации 07.10.2020
Аннотация
Исследовано влияние предобработки лигноцеллюлозных субстратов на плодоношение ксилотрофного базидиомицета Hericium erinaceus (Bull.) Persoon и антиоксидантные свойства экстрактов плодовых тел. Предобработка опилок бука и сосны минеральными кислотами способствовала увеличению биодоступности субстрата для H. erinaceus и приводила к значительному сокращению времени выхода на плодоношение с 63 до 35 сут по сравнению с непредобработанными опилками. Все варианты субстратов с сосновыми опилками обеспечивали получение плодовых тел с повышенным содержанием фенольных соединений по сравнению с субстратами, содержащими опилки бука. Предобработка серной кислотой приводила к увеличению антирадикальной активности и хелатирующей способности экстрактов плодовых тел.
Лекарственно-съедобный ксилотрофный базидиальный гриб Hericium erinaceus (Bull.) Persoon представляет собой ценный продукт питания, содержащий полноценные белки, эссенциальные жирные кислоты, витамины группы B, провитамин D (Автономова и др., 2012). H. erinaceus известен своей способностью к образованию широкого спектра биологически активных соединений, прежде всего полисахаридов (Автономова и др., 2012, Альмяшева и др., 2017, Автономова, Краснопольская, 2013, Краснопольская и др., 2015, Краснопольская и др., 2016). Среди метаболитов H. erinaceus известны соединения с иммуномодулирующими, противоопухолевыми, антиоксидантными, нейроактивными и другими свойствами (Автономова и др., 2012, Альмяшева и др., 2017, Friedman, 2015). Биологически активные соединения H. erinaceus содержатся в плодовых телах и вегетативном мицелии.
Плодовые тела гриба H. erinaceus, вызывающего белую гниль древесины, т.е. способного утилизировать лигнин, получают с использованием твердофазного культивирования на лигноцеллюлозных субстратах, основой которых служат отходы лесопереработки и сельского хозяйства – опилки твердых лиственных пород деревьев, солома, лузга подсолнечника и кукурузные кочерыжки, содержащие целлюлозу, гемицеллюлозу и лигнин (Stamets., 2011).
В России ежегодно образуется не менее 4.2 млн м3 учтенных древесных опилок. Более 70% из них остаются невостребованными, что повышает пожароопасность и ухудшает экологическую обстановку в местах расположения предприятий (Челышева и др., 2017). Разработка новых эффективных субстратов для культивирования съедобных ксилотрофных грибов актуальна как для получения высококачественной пищевой продукции и биологически активных соединений, так и для рационального использования природных ресурсов (Kretschmer et al., 2013). Ценное сырье, которое может быть включено в существующие производственные циклы, представляют собой опилки и кора хвойных пород деревьев, хвоя. Однако эти отходы помимо целлюлозы, гемицеллюлозы и лигнина, содержат большое количество полифенольных и дубильных соединений, подавляющих рост грибов и ухудшающих качество получаемой продукции. Введение их в субстрат без предварительной обработки приводит к снижению скорости развития мицелия, увеличению срока культивирования, а также к ухудшению пищевых качеств получаемых плодовых тел.
Удаление нежелательных компонентов может быть осуществлено в процессе предобработки физическими, химическими или биологическим методами воздействия (Ewanick et al., 2007). В результате, происходит увеличение биологической доступности целлюлозы и лигнина за счет разрыва межмолекулярных связей, уменьшения степени кристалличности, увеличение размера пор и площади доступной поверхности сырья (Zheng et al., 2009).
Цель настоящей работы состояла в сравнительном изучении разных способов химической предобработки древесных отходов при получении субстратов для культивирования H. erinaceus, обеспечивающих высокие показатели урожайности без снижения качества грибной продукции. В качестве древесных отходов использовали опилки сосны и бука. В работе оценивали скорость освоения культурой H. erinaceus опилочных субстратов, урожайность гриба, содержание белков, полисахаридов, фенольных соединений в полученных плодовых телах, антиоксидантные свойства экстрактов.
ОБЪЕКТЫ И МЕТОДИКА
Экспериментальные исследования были структурированы следующим образом.
1. Химическая предобработка опилок сосны и бука растворами кислот, щелочей и пероксида водорода.
2. Оценка содержания легко- и трудногидролизуемых полисахаридов в химически модифицированных опилках сосны и бука.
3. Подготовка субстратов для культивирования H. erinaceus: добавление к опилкам источника азота, карбоната кальция и воды, стерилизация полученного субстрата.
4. Засев культурой H. erinaceus чашек Петри с субстратом и субстратных блоков.
5. Изучение скорости освоения субстрата и плотности выросшего мицелия гриба на чашках Петри.
6. Определение урожайности гриба и числа волн плодоношения при выращивании на субстратных блоках.
7. Биохимические исследования плодовых тел H. erinaceus: оценка содержания белков, полисахаридов, фенольных соединений.
8. Изучение антиоксидантных свойств экстрактов плодовых тел H. erinaceus.
В качестве реактивов использовали. Серная кислота (ООО “Химмед”, Россия), соляная кислота (ООО “Химмед”, Россия), гидроксид натрия, CaCO3 (х. ч., ООО “Русхим”, Россия), пероксид водорода 37% (Марка А, ООО “Русхим”, Россия), 3.5-динитросалициловая кислота 98% (Acros, Бельгия), калий-натрий винокислый 4‑водный (ООО “Русхим”, Россия), фенол (ЗАО “Вектон”, Россия), глюкоза (ООО “НТК ДИАЭМ”, Россия), агар-агар (ООО “НТК ДИАЭМ”, Россия), реактив Фолина–Чиокальто (AppliChem, Германия), натриевая соль этилендиаминтетрауксусной кислоты (ЭДТА-Na2) (ООО “Русхим”, Россия), хлорид железа (II) (ООО “Русхим”, Россия), 2.2'-дифенил-1-пикрилгидразил (ДФПГ) (Sigma-Aldrich, США), феррозин (Sigma-Aldrich, США).
Предобработка лигноцеллюлозного сырья. Опилки сосны Pinus sylvestris L. получены из Щелковского учебно-опытного лесхоза Мытищинского филиала МГТУ им. Н.Э. Баумана, опилки бука Fagus orientalis Lipsky – из Тебердинского государственного природного биосферного заповедника, Архызкий участок. Опилки сосны и бука измельчали и высушивали при температуре 60°С в течение 48 ч. В работе использовали фракции опилок с размером частиц 0.24–0.315 мм. Для предобработки использовали 2 мас. % растворы соляной и серной кислот, гидроксида натрия и пероксида водорода. Предобработку субстратов проводили при 120°С в автоклаве. Образцы лигноцеллюлозного сырья взвешивали на аналитических весах с точностью до 0.01 г до и после обработки.
Определение доли легкогидролизуемых полисахаридов в лигноцеллюлозном сырье. Образцы лигноцеллюлозного сырья взвешивали на аналитических весах с точностью 0.01 г, помещали в реакционные сосуды с раствором серной кислоты 1.5% (масс.) и выдерживали в автоклаве при температуре 120°С в течение 120 мин. Реакционную смесь воздушно охлаждали до комнатной температуры. Долю легкогидролизуемых полисахаридов в опилках сосны и бука оценивали спектрофотометрическим методом с использованием 3.5-динитросалициловой кислоты по количеству образуемых в результате кислотного гидролиза редуцирующих сахаров (РС) (Miller, 1959).
Штаммы и условия культивирования. В работе использовали штамм базидиомицета H. erinaceus из коллекции лаборатории биологически активных соединений ФГБНУ “Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе”. Рабочую культуру хранили на картофельно-глюкозном агаре при 4°С.
Определение скорости роста и плотности мицелия H. erinaceus при твердофазном культивировании в чашках Петри. В чашки Петри помещали твердый субстрат, содержащий 4.5 г опилок, 0.5 г пшеничных отрубей, 0.05 г CaCO3, и стерилизовали при 120°С в течение 1 ч. Чашки Петри засевали мицелиально-агаровыми блоками 10-дневной культурой гриба (диаметр 3 мм) и инкубировали при 25°С в течение 9 сут, после чего проводили измерение диаметров колоний. Плотность мицелия оценивали общепринятым визуальным методом в баллах: 1 – редкая, 2 – средняя, 3 – плотная (Бисько и др., 1983).
Получение плодовых тел H. erinaceus. В конические плоскодонные колбы объемом 200 мл помещали твердый увлажнённый субстрат, содержащий 18 г опилок, 2 г пшеничных отрубей, 0.2 г CaCO3, и стерилизовали при 120°С в течение 1 ч. Колбы засевали мицелиально-агаровыми блоками 10-дневной культуры гриба H. erinaceus (диаметр 3 мм) и инкубировали при 25°С в течение 3 нед. до полного зарастания мицелием субстрата, после чего удаляли ватно-марлевые пробки и колбы инкубировали при 20°С и относительной влажности воздуха 80% в течение 2 мес. В инкубационной камере поддерживали воздухообмен 0.1 об. мин–1 и 8‑часовой световой день. Полученные плодовые тела лиофильно высушивали, взвешивали на аналитических весах с точностью 0.01 г и измельчали. Урожайность выражали в процентах массовых как отношение сухой массы полученных плодовых тел к сухой массе субстрата.
Определение содержания белков и полисахаридов в плодовых телах H. erinaceus. Общее содержание полисахаридов определяли фенол-сернокислотным методом с использованием глюкозы в качестве стандарта.
Белки экстрагировали фосфатным буферным раствором (pH 7.4, 0.1-молярный) в течение 3 ч при постоянном перемешивании. Общее содержание белков определяли методом Брэдфорд с использованием бычьего сывороточного альбумина в качестве стандарта.
Получение экстрактов плодовых тел H. erinaceus. Навеску порошка биомассы (1 г на 100 мл) дважды экстрагировали 80%-м этанолом на водяной бане, нагретой до 80°C, в течение 30 мин. Экстракты объединяли и центрифугировали в течение 10 мин при 5000 об. мин–1, супернатанты упаривали на роторном испарителе до постоянной массы. Сухой остаток растворяли в 80%-м этаноле в концентрации 5 мг мл–1. Содержание фенольных соединений в этанольных экстрактах определяли с использованием реагента Фолина–Чиокальто и галловой кислоты в качестве стандарта.
Определение хелатирующей способности по отношению к Fe2+. Подготавливали растворы этанольных экстрактов с концентрациями от 0.01 до 2.0 мг мл–1. В пробирке смешивали 1 мл образца, 3.7 мл метанола, 100 мкл водного раствора FeCl2 (2-милимолярный) и 200 мкл водного раствора феррозина (5-милимолярный). Реакционную смесь выдерживали при 25°C в течение 10 мин, после чего определяли оптическую плотность при 562 нм (Dinis et al., 1994). Хелатирующую способность оценивали по величине ${\text{EC}}_{{{\text{5}}0}}^{*},$ соответствующей концентрации исследуемого образца, необходимой для снижения содержания ионов двухвалентного железа на 50% от исходного значения.
Определение антирадикальной активности. Подготавливали растворы этанольных экстрактов с концентрациями от 0.5 до 5.0 мг мл–1. Антирадикальную активность определяли спектрофотометрическим методом по отношению к ДФПГ. В кювете смешивали 100 мкл образца и 900 мкл раствора ДФПГ (6 × 10–5 – молярный). Реакционную смесь выдерживали в темноте при 25°C в течение 60 мин, после чего определяли оптическую плотность при 527 нм. Антирадикальную активность оценивали по величине EC50, соответствующей концентрации исследуемого образца, необходимой для снижения содержания ДФПГ на 50% от исходного значения.
Статистическая обработка результатов экспериментов
Все эксперименты проводили в 3 биологических и 3 аналитических повторностях. Статистическую обработку результатов проводили c помощью пакета программ MS Excel 2013. На рисунках и в таблицах представлены средние (M) и стандартные ошибки средних (±SEM). Достоверность различий между средними значениями исследуемых показателей оценивали по t-критерию Стьюдента, статистически значимыми считали различия Р ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
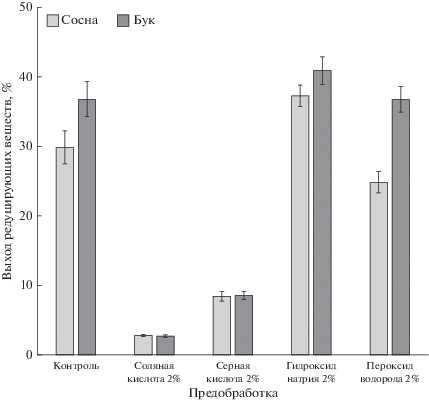
Доля легкогидролизуемых компонентов в необработанных опилках сосны составила 30%, бука – 37% (рис. 1), что соответствует количеству гемицеллюлозы в исходном сырье (Amidon et al., 2008). Предобработка раствором гидроксида натрия способствовала повышению доли легкогидролизуемых компонентов в сырье, выход РС увеличился на 7% для опилок сосны и на 4% – для опилок бука. Скорее всего, это явилось следствием удаления лигнина и части гемицеллюлозы, что согласуется с данными литературы (Jönsson, Martín, 2016). Перекисная предобработка опилок сосны приводила к снижению выхода РС на 5%, тогда как в случае опилок бука изменение компонентного состава отмечено не было. Возможно, на результат предобработки лигноцеллюлозного сырья пероксидом водорода влияло различие в химической структуре гемицеллюлоз и лигнина хвойных и лиственных пород деревьев (McMillan, James, 1994). Кислотная предобработка приводила к резкому увеличению доли трудногидролизуемых компонентов в сырье, содержание легкогидролизуемых сахаров в составе опилок сосны и бука снизилось более чем на 20%. В результате кислотной предобработки убыль массы субстрата превосходила долю удаленных легкогидролизуемых сахаров. Это свидетельствовало о гидролизе не только гемицеллюлозы и аморфных участков целлюлозы, но также о частичном удалении лигнина. Аналогичный результат воздействия минеральных кислот был получен при изучении предобработки древесины тополя (Sun et al., 2014).
На следующем этапе исследования оценивали влияние предобработки на биодоступность лигноцеллюлозных субстратов для ксилотрофного базидиомицета H. erinaceus. В опыте определяли скорость освоения субстрата и интенсивность развития мицелия (табл. 1).
Таблица 1.
Диаметр 8-суточных колоний (d) и визуальная оценка плотности мицелия (q) H. erinaceus при выращивании в чашках Петри
| Субстрат | Предобработка | d, мм | q, балл |
|---|---|---|---|
| Сосна | Контроль | 19 ± 2 | 2 |
| HCl 2%-й раствор | 23 ± 4 | 2 | |
| H2SO4 2%-й раствор | 29 ± 2 | 2 | |
| NaOH 2%-й раствор | – | – | |
| H2O2 2%-й раствор | 24 ± 2 | 1 | |
| Бук | Контроль | 19 ± 2 | 2 |
| HCl 2%-й раствор | 32 ± 3 | 2 | |
| H2SO4 2%-й раствор | 32 ± 3 | 2 | |
| NaOH 2%-й раствор | 24 ± 1 | 1 | |
| H2O2 2%-й раствор | 26 ± 2 | 1 |
Скорость освоения субстратов культурой H. erinaceus была выше после их кислотных предобработок. При этом обогащение субстратов лигнином и увеличение их биодоступности привело к повышению скорости роста базидиомицета как на предобработанных опилках сосны, так и бука по сравнению с соответствующим контролем. Перекисная и щелочная предобработка не способствовала повышению биодоступности субстратов, о чем свидетельствуют низкая скорость роста гриба и снижение плотности мицелия. Рост H. erinaceus на субстрате, содержащем сосновые опилки, после щелочной предобработки отсутствовал.
На заключительном этапе исследования были получены плодовые тела H. erinaceus на субстратах, содержащих предобработанные кислотами опилки бука или сосны, определено содержание в них белков, полисахаридов и фенольных соединений и изучены антиоксидантные свойства экстрактов плодовых тел.
На необработанных опилках сосны и бука за все время эксперимента была получена только одна волна плодовых тел на 63-е сут культивирования (табл. 2). Кислотная предобработка привела к значительному сокращению времени выхода на плодоношение. За два месяца эксперимента на субстратах, содержащих все варианты предобработанных опилок, за исключением опилок бука после сернокислотной предобработки, были получены две волны плодоношения. Повышение урожайности по сравнению с контролем было отмечено на опилках после предобработки соляной кислотой. При этом урожайность второй волны не уступала первой. Возможно, это связано с тем, что хлорид-анионы способны разрушать межмолекулярные водородные связи лигноцеллюлозного комплекса и увеличивать биодоступность лигнина (Foston, Ragauskas, 2012). Несмотря на то, что при сернокислотной предобработке сосновых опилок было получено две волны плодоношения, суммарная урожайность была сопоставима с урожайностью первой волны, полученной на субстрате без предобработки.
Таблица 2.
Время выхода на плодоношение и урожайность H. erinaceus в зависимости от предобработки опилок сосны и бука
| Субстрат | Предобработка | Время выхода на плодоношение, сут. | Число волн плодоношения | Урожайность, масс. % |
|---|---|---|---|---|
| Сосна | Контроль | 63 | 1 | 3.9 |
| HCl 2%-й раствор | 35 | 2 | 7.9 | |
| H2SO4 2%-й раствор | 35 | 2 | 3.8 | |
| Бук | Контроль | 63 | 1 | 5.1 |
| HCl 2%-й раствор | 35 | 2 | 6.5 | |
| H2SO4 2%-й раствор | 35 | 1 | 3.6 |
В базидиомах, выращенных на субстратах с непредобработанными опилками сосны и бука, было отмечено наибольшее содержание полисахаридов – 41.6 и 35.4 мас. % соответственно (табл. 3). На всех исследованных субстратах, за исключением опилок бука после солянокислотной предобработки, были получены базидиомы с достоверно одинаковым содержанием белков. Все варианты субстратов с сосновыми опилками обеспечивали получение базидиом с повышенным содержанием фенольных соединений по сравнению с субстратами, содержащими опилки бука.
Таблица 3.
Содержание полисахаридов, белков и фенольных соединений в плодовых телах H. erinaceus
| Субстрат | Предобработка | Полисахариды, % | Белки, % | Фенольные соединения, мг экв. галловой кислоты г–1 плодового тела |
|---|---|---|---|---|
| Сосна | Контроль | 4.6 ± 3.9 | 12.7 ± 0.4 | 7.0 ± 0.2 |
| HCl 2%-й раствор | 34.5 ± 5.3 | 13.7 ± 2.2 | 7.1 ± 0.3 | |
| H2SO4 2%-й раствор | 19.3 ± 3.4 | 12.9 ± 3.9 | 7.9 ± 0.4 | |
| Бук | Контроль | 35.4 ± 0.9 | 13.5 ± 0.5 | 5.2 ± 0.3 |
| HCl 2%-й раствор | 32.2 ± 2.3 | 7.9 ± 1.2 | 5.1 ± 0.4 | |
| H2SO4 2%-й раствор | 29.4 ± 0.1 | 12.4 ± 0.6 | 6.3 ± 0.5 |
Все этанольные экстракты плодовых тел, полученные в условиях эксперимента, проявляли высокую антирадикальную активность и хелатирующую способность (табл. 4). Анализ экспериментальных результатов показал, что использование сосновых опилок способствует более высокой антирадикальной активности экстрактов плодовых тел. Сравнительное изучение антиоксидантных свойств экстрактов плодовых тел H. erinaceus выявило зависимость между величиной антирадикальной активности экстрактов и содержанием в них фенольных соединений. Базидиомы, полученные на необработанных опилках сосны, содержали в 1 г 7.02 мг эквивалентов галловой кислоты и проявили на 19% более высокую антирадикальную активность по сравнению с базидиомами, выращенными на необработанных опилках бука и содержащими в 1 г 5.67 мг эквивалентов галловой кислоты. Такая зависимость была отмечена также при сравнении антирадикальной активности и содержания фенольных соединений в экстрактах погруженного мицелия Ganoderma lucidum (Curtis) P. Karst., Flammulina velutipes (Curtis) Singer и H. erinaceus (Альмяшева и др., 2017). Наибольшую антирадикальную активность проявил экстракт базидиом, выращенных на опилках сосны после предобработки серной кислотой.
Таблица 4.
Антиоксидантные свойства этанольных экстрактов плодовых тел H. erinaceus
| Субстрат | Предобработка | Антиоксидантные свойства (ЕС50), мг мл–1 | |
|---|---|---|---|
| антирадикальная активность по отношению к ДФПГ | хелатирующая способность по отношению к Fe2+ | ||
| Сосна | Контроль | 0.45 ± 0.03 | 0.86 ± 0.05 |
| HCl 2%-й раствор | 0.55 ± 0.02 | 0.81 ± 0.06 | |
| H2SO4 2%-й раствор | 0.40 ± 0.03 | 0.65 ± 0.03 | |
| Бук | Контроль | 0.56 ± 0.04 | 0.66 ± 0.04 |
| HCl 2%-й раствор | 0.90 ± 0.04 | 0.87 ± 0.05 | |
| H2SO4 2%-й раствор | 0.47 ± 0.02 | 0.71 ± 0.05 | |
Проведение предобработки лигноцеллюлозного сырья по-разному влияло на хелатирующую способность экстрактов плодовых тел, полученных на опилках сосны и бука. Предобработка минеральными кислотами опилок сосны способствовала уменьшению хелатирующей способности, опилок бука – увеличению. Причиной этого может служить различие химического состава лигнина в составе древесины хвойных и лиственных пород деревьев (Amidon et al., 2008). Аналогично с результатами, полученными при изучении антирадикальной активности экстрактов плодовых тел, наибольшая хелатирующая способность была отмечена у экстракта базидиом, выращенных на сосновых опилках после сернокислотной предобработки, и составила 0.65 мг экстракта мл–1.
ЗАКЛЮЧЕНИЕ
Сравнительное изучение разных способов химической предобработки древесных отходов при получении субстратов для культивирования H. erinaceus показало перспективность использования минеральных кислот для этой цели. Предобработка соляной кислотой увеличивает долю лигнина и целлюлозы в субстрате на основе опилок сосны и бука, что приводит к увеличению скорости роста древоразрушающего гриба H. erinaceus, интенсивности развития его мицелия и урожайности. Снижение содержания легкогидролизуемых углеводов в результате кислотной предобработки древесных отходов создает неблагоприятные условия для развития микроорганизмов-контаминантов, конкурирующих за субстрат. Кислотная предобработка опилок сосны и бука не приводит к снижению содержания белка в плодовых телах H. erinaceus, что свидетельствует о сохранении качества получаемой продукции. Для получения плодовых тел H. erinaceus, экстракты которых отличаются высокой антиоксидантной активностью, следует рекомендовать использование субстратов, содержащих опилки сосны. По-видимому, антиоксидантная активность во многом обусловлена накоплением фенолов, содержание которых выше при культивировании H. erinaceus на субстратах на основе опилок сосны по сравнению с выращиванием гриба на субстратах, содержащих опилки бука.
Таким образом, предложенный способ кислотной предобработки позволяет более активно использовать опилки сосны и, возможно, других хвойных пород деревьев для разработки составов новых эффективных субстратов для твердофазного культивирования H. erinaceus и получения плодовых тел этого вида.
Список литературы
Автономова А.В., Баканов А.В., Леонтьева М.И., Винокуров В.А., Усов А.И. Краснопольская Л.М. Погруженное культивирование и химический состав мицелия Hericium erinaceus // Антибиотики и химиотерапия. 2012. Т. 57. № 7–8. С. 7–11.
Автономова А.В., Краснопольская Л.М. Противоопухолевые и иммуномодулирующие свойства трутовика лакированного (Ganoderma lucidum) //Микология и фитопатология. 2013. Т. 47. № 1. С. 3–11.
Альмяшева Н.Р., Ярина М.С., Голышкин А.В., Джавахян Б.Р., Краснопольская Л.М. Антиоксидантные свойства водорастворимых полисахаридов и этанольных экстрактов мицелия ксилотрофных базидиальных грибов // Антибиотики и химиотерапия. 2017. Т. 62. № 7–8. С. 8–12.
Бисько Н.А., Бухало А.С., Вассер С.П., Дудка И.А., Кулеш М.Д., Соломко Э.Ф., Шевченко С.В. Высшие съедобные базидиомицеты в поверхностной и глубинной культуре // Киев, Наукова думка. 1983. С. 312.
Краснопольская Л.М., Шуктуева М.И., Автономова А.В., Ярина М.С., Джавахян Б.Р., Исакова Е.Б., Бухман В.М. Противоопухолевые и антиоксидантные свойства водорастворимых полисахаридов из мицелия базидиального гриба Flammulina velutipes // Антибиотики и химиотерапия. 2016. Т. 61. № 11–12. С. 16–20.
Краснопольская Л.М., Ярина М.С., Автономова А.В., Усов А.И., Исакова Е.Б., Бухман В.М. Сравнительное изучение противоопухолевой активности полисахаридов из мицелия Ganoderma lucidum в опытах in vivo // Антибиотики и химиотерапия. 2015. Т.60. № 11–12. С. 29–34.
Челышева И.Н., Плотников Н.П., Афанасьева Н.А. Совершенствование технологии получения древесных композиционных материалов //Лесной вестник. 2017. Т. 21. №. 5. С. 75–82.
Amidon T.E., Wood C.D., Shupe A.M., Wang Y., Graves M., Liu S. Biorefinery: Conversion of Woody Biomass to Chemicals, Energy and Materials // J. Biobased Materials & Bioenergy. 2008. V. 2. № 2. P. 100–120.
Dinis T.C.P., Madeira V.M.C., Almeida L.M. Action of phenolic derivatives (acetaminophen, salicylate, and 5-aminosalicylate) as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers // Archives of Biochemistry & Biophysics. 1994. V. 315. № 1. P. 161–169.
Ewanick S.M., Bura R., Saddler J.N. Acid-catalyzed steam pretreatment of lodgepole pine and subsequent enzymatic hydrolysis and fermentation to ethanol. Biotechnology and bioengineering // Biotechnology & Bioengineering. 2007. V. 98. № 4. P. 737–746.
Foston M., Ragauskas A.J. Biomass characterization: recent progress in understanding biomass recalcitrance // Industrial Biotechnology. 2012. V. 8. № 4. P. 191–208.
Friedman M. Chemistry, nutrition, and health-promoting properties of Hericium erinaceus (Lion’s Mane) mushroom fruiting bodies and mycelia and their bioactive compounds // J. Agricultural & Food Chemistry. 2015. V. 63. № 32. P. 7108–7123.
Jönsson L.J., Martín C. Pretreatment of lignocellulose: formation of inhibitory by-products and strategies for minimizing their effects // Bioresource Technology. 2016. V. 199. P. 103–112.
Kretschmer B., Buckwell A., Smith C., Watkins E., Allen B. Recycling agricultural, forestry & food wastes & residues for sustainable bioenergy & biomaterials. London, United Kingdom: Institute for European Environmental Policy, 2013. 151 p.
McMillan J.D. Pretreatment of lignocellulosic biomass // ACS Symposium Series. 1994. V. 556. № 15. P. 292–324.
Miller G.L. Use of dinitrosalicylic acid reagent for determination of reducing sugar// Analytical Chemistry. 1959. V. 31. № 3. P. 426–42.
Stamets P. Growing Gourmet and Medicinal Mushrooms / N.Y. Ten Speed Press, 2011. 614 p.
Sun Q., Foston M., Meng X., Sawada D., Pingali S.V., O’Neill H.M., Kumar R. Effect of lignin content on changes occurring in poplar cellulose ultrastructure during dilute acid pretreatment // Biotechnology for Biofuels. 2014. V. 7. № 1.
Zheng Y., Pan Z., Zhang R. Overview of biomass pretreatment for cellulosic ethanol production // International J. Agricultural & Biological Engineering. 2009. V. 2. № 3. P. 51–68.
Дополнительные материалы отсутствуют.