Лесоведение, 2021, № 3, стр. 303-317
Влияние опилочно-почвенных субстратов на рост саженцев сосны и ели в лесопитомнике экспериментального хозяйства “Погорельский бор”
Г. И. Антонов a, *, А. П. Барченков a, Н. В. Пашенова a, О. Э. Кондакова a, И. Д. Гродницкая a
a Институт леса им. В.Н. Сукачева СО РАН, Федеральный исследовательский центр
“Красноярский научный центр СО РАН”
660036 Красноярск, Академгородок 50/28, Россия
* E-mail: egoan@yandex.ru
Поступила в редакцию 16.10.2019
После доработки 29.12.2019
Принята к публикации 03.02.2021
Аннотация
Сравнивается эффективность применения в почве лесопитомника двух видов опилочно-почвенных субстратов под культурами сосны (Pinus sylvestris L.) и ели (Picea obovata L.) – опилочно-почвенного субстрата (ОПС) и опилочно-почвенного субстрата с добавлением микопродукта (ОПСМ). Отмечено воздействие микопродукта в опилочно-почвенной смеси на показатели микробиологической и энзиматической активности почвы, содержание азотистых веществ в хвое и морфометрические характеристики саженцев сосны и ели. Применение обоих видов опилочно-почвенных субстратов (ОПС и ОПСМ) значительно сказалось на увеличении общего и белкового азота в хвое саженцев по сравнению с контролем. Вместе с тем, использование ОПСМ оптимизировало процессы трансформации опилочной массы: увеличилась биомасса микроорганизмов, снизилась интенсивность дыхания, к середине вегетационного периода повысился целлюлозоразлагающий потенциал, усилилась активность ферментов окислительно-восстановительной группы, что в дальнейшем нашло свой отклик в минерализации органического вещества. Содержание общего азота в саженцах, удобренных ОПСМ, возросло с 17.3 до 46.1 мг г–1 абсолютно сухого вещества (а. с. в.) в хвое сосны и с 21.7 до 52.6 мг г–1 а. с. в. в хвое ели соответственно. При этом содержание белкового азота в хвое после применения микопродукта повысилось до 91.8% у сосны и до 89.8% у ели. Приросты верхушечной почки главного побега саженцев, а также их высота оказались достоверно выше на участках с ОПСМ.
Проблема рециклинга отходов в лесном хозяйстве Красноярского края стоит достаточно остро. В связи с возросшим объемом лесозаготовок увеличиваются и запасы трудноразлагаемого растительного сырья. Мелкие сыпучие отходы лесозаготовок и лесопиления пока еще не нашли широкого применения, но уже имеют перспективные направления использования в виде удобрений, пеллет, питательных субстратов, биопрепаратов, всевозможных биологически активных экстрактов (Рабинович Г., 1999; Беседина и др., 2002; Рабинович М., 2002; Ленскинова, 2003; Беловежец и др., 2010; Ларченко, 2013; Кротова и др., 2017; Igbokwe et al., 2015). Вместе с тем, опилки используются не более чем на 30% от общего объема. Наибольшая их часть вывозится на полигоны ТБО для перегнивания, либо сжигается в отвалах (Степень, Репях, 2001; Дитрих и др., 2010; Медведев и др., 2010). Коллективом лаборатории микробиологии и экологической биотехнологии Института леса им. В.Н. Сукачева СО РАН в ходе экспериментов по утилизации древесно-опилочной массы разработаны варианты композиций удобрений на основе опилочно-почвенной смеси, содержащих микродозы различных азотных удобрений (Антонов и др., 2017, 2018).
Помимо этого, в мелкоделяночных опытах ранее было показано положительное влияние сосновых опилок, частично делигнифицированных грибом Trametes versicolor (L.) Lloyd (микопродукт), на морфометрические параметры сеянцев хвойных, сохранность микробов-антагонистов, биогенность почвы (ферментативную активность, микробную биомассу, общую микробную численность) в условиях лесопитомников. Показано, что в микопродукте, полученном путем лабораторного культивирования мицелия гриба T. versicolor на сосновых опилках “в тонком слое” в течение 2 мес., помимо частичной минерализации древесины (потери веса достигали 28%) происходила заметная модификация структуры полисахаридной и ароматической составляющих древесины (Пашенова и др., 2009). Данные изменения способствовали быстрой утилизации микопродукта почвенными микроорганизмами, что обусловило дополнительное поступление в почву углерода. Для лучшего роста растений также необходимо увеличить поступление азота в почву. Выполненные ранее исследования указали на необходимость сочетания микопродукта с азотными удобрениями для стимулирования роста и развития сеянцев хвойных (Ульянова и др., 2007; Кондакова, 2019). В связи с этим представлялось целесообразным исследовать сочетание опилочно-почвенного субстрата с добавлением микродоз азотных удобрений (ОПС) и микопродукта (ОПСМ).
Цель настоящего исследования – оценить эффективность применения различных вариантов композиций азотных удобрений в сочетании с микопродуктом (ОПСМ) и без него (ОПС) на состояние саженцев сосны обыкновенной и ели сибирской, а также почвенных микробоценозов под ними на опытных лесных участках.
Реализация поставленной цели исследования позволит оценить и спрогнозировать улучшение ростовых показателей культур сосны и ели при применении композиций ОПС и ОПСМ в качестве удобрений на истощенных и деградированных почвах лесных питомников.
ОБЪЕКТЫ И МЕТОДИКА
Работа выполнялась на территории опытного экспериментального хозяйства “Погорельский бор” Института леса им. В.Н. Сукачева СО РАН в условиях островной Красноярской лесостепи. В 2014 г. были заложены экспериментальные участки с саженцами хвойных для наблюдений за их ростом и развитием при внесении композиций удобрений принципиально нового типа, созданных на основе отходов лесохозяйственной деятельности (опилок) с добавлением оригинальных субстратов. Почва на экспериментальных участках темно-серая слабооподзоленная оглееная тяжелосуглинистая на древнеаллювиальных отложениях, достаточно хорошо обеспечена гумусом и элементами минерального питания (табл. 1). Более подробно характеристика почвы и описание саженцев хвойных приведены в нашей работе (Антонов и др., 2018).
Таблица 1.
Характеристика почвы экспериментального хозяйства “Погорельский бор"
| Горизонт, глубина, см | Гумус, % | С орг.* | pH | NВал.** | NЛГ** | N ТГ** | N НГ** | C : N | Подвижные, мг 100 г–1 | |
|---|---|---|---|---|---|---|---|---|---|---|
| мг 100 г–1 | N-NH4 | P2O5 | ||||||||
| AU – 5–15 | 7.54 | 4.37 | 5.66 | 76.4 | $\frac{{9.4}}{{12.4}}$ | $\frac{{2.8}}{{3.6}}$ | $\frac{{64.2}}{{84.0}}$ | 57 | 2.54 | 81.08 |
| AU – 20–30 | 5.26 | 3.05 | 5.85 | 73.9 | $\frac{{5.6}}{{7.5}}$ | 0 | $\frac{{68.3}}{{92.5}}$ | 41 | 1.23 | 72.03 |
| AEL – 35–45 | 0.69 | 0.40 | 5.91 | 66.3 | $\frac{{2.2}}{{3.3}}$ | $\frac{{0.5}}{{0.8}}$ | $\frac{{63.6}}{{95.8}}$ | 6 | 0.51 | 60.04 |
| BEL – 50–60 | 0.13 | 0.07 | 6.00 | 70.4 | $\frac{{1.9}}{{2.7}}$ | $\frac{{0.4}}{{0.6}}$ | $\frac{{68.1}}{{96.6}}$ | 1 | 0.44 | 58.84 |
Использованные в работе варианты ОПС с наиболее эффективными композициями азотных удобрений были отобраны по предыдущим результатам эксперимента на основе достоверного положительного воздействия на микробиологические и биохимические показатели почвы и содержание азотистых веществ в хвое саженцев сосны обыкновенной и ели сибирской (Антонов и др., 2018). Они были представлены ОПС с добавлением диаммофоски, аммонийной селитры, сульфата аммония и мочевины. Опытная партия микопродукта была наработана в лабораторных условиях посредством твердофазного культивирования мицелия базидиального гриба Trametes versicolor (L.) Lloyd на сосновых опилках (Антонов и др., 2019). Чистая культура гриба была изолирована из плодового тела в 1991 г. и поддерживалась в рабочей коллекции Института леса на сусло-агаре. Молекулярно-генетическая проверка корректности идентификации и чистоты культуры была выполнена в г. Новосибирске в 2017 г. специалистами ЦКП “Геномика” СО РАН.
В соответствии с поставленной целью выполнялись следующие задачи: определение скорости разложения опилок в ОПС, внесенных под саженцы хвойных; оценка производительного потенциала почвы по основным интегральным показателям ее биологической активности (целлюлозоразлагающая способность, содержание микробной биомассы, интенсивность базального дыхания, энзимологическая активность, определение коэффициента гумификации); проведение сравнительного анализа содержания азотистых элементов питания в хвое саженцев сосны (Pinus sylvestris Ledeb) и ели (Picea obovate Ledeb) на участках с применением разных композиций ОПС и ОПСМ, и оценка их влияния на морфометрические характеристики саженцев сосны и ели на экспериментальных участках. ОПС с разными азотными удобрениями компостировали экстенсивным способом на территории экспериментального хозяйства в течение летнего вегетационного периода 2017 г. Осенью компосты с добавкой микопродукта (5% по сырому весу) были внесены в почву на участках с посадками 4-летних саженцев сосны и ели. ОПСМ в количестве 25 кг (по сырому весу) распределяли на поверхности почвы по площади 9 м2. Ранее в почву вносили 5 вариантов ОПС после компостирования с азотными удобрениями, а затем те же 5 вариантов ОПС с добавлением микопродукта (ОПСМ) (табл. 2). Породы хвойных на каждом участке представлены тремя повторностями.
Таблица 2.
Схема полевого эксперимента по тестированию опилочно-почвенных субстратов в лесопитомнике “Погорельский бор”
| Композиции удобрений без микопродукта (ОПС*) | Композиции удобрений с добавлением микопродукта (ОПСМ**) | ||
|---|---|---|---|
| СОСНА | ЕЛЬ | СОСНА | ЕЛЬ |
| Контроль: Опилки + почва | Контроль: Опилки + почва + Микопродукт | ||
| Диаммофоска | Диаммофоска + Микопродукт | ||
| Аммонийная селитра | Аммонийная селитра + Микопродукт | ||
| Сульфат аммония | Сульфат аммония + Микопродукт | ||
| Мочевина | Мочевина + Микопродукт | ||
Для определения микробиологических свойств почвы для всех вариантов композиций производили точечный отбор почвенных образцов с глубины 0–10 см. Отбор проб был приурочен к фенофазам развития сосны обыкновенной и ели сибирской в исследуемом регионе и осуществлялся три раза за весь вегетационный период: в период роста побегов (18 мая), в период развертывания хвои и начала закладки верхушечной почки центрального побега (13 июля), а также в начале формирования верхушечных почек (10 сентября). Далее готовили смешанный образец из 3 полевых повторностей (из-под каждого саженца), который высушивали и перерабатывали до пылевого состояния. Для микробиологических анализов использовали свежие образцы почвы. В момент взятия образцов на каждом участке измеряли температуру воздуха и почвы с использованием портативного термометра “Hanna Checktemp 1”. В лабораторных условиях традиционными методами определяли влажность почвы и значения рН в водной вытяжке в течение 1 ч (1 : 10) при помощи портативного потенциометра “Аквилон-410”. С использованием фотоэлектроколориметра КФК-3 методами Л.А. Карягиной и Н.А. Михайловой определяли активность ферментов окислительно-восстановительной группы (пероксидаза, полифенолоксидаза), с предварительным получасовым компостированием при температуре 30°С. Активность пероксидазы и полифенолоксидазы выражали в мг 1.4-бензохинона 1 г–1 почвы за 30 мин. По соотношению активности полифенолоксидазы и пероксидазы высчитывали коэффициент гумификации, позволяющий судить об интенсивности процесса минерализации гумуса (Методы исследования …, 2003; Хазиев, 2005; Sinsabaugh, 2010). Целлюлозоразлагающую способность почвы оценивали с помощью аппликационного и весового методов Е.Н. Мишустина и А.Н. Петровой (Методы почвенной …, 1991).
Респираторную активность – микробную биомассу (Смик), базальное дыхание (БД), микробный респираторный коэффициент (qCO2) почвенных микробоценозов определяли методом субстрат-индуцированного дыхания (СИД), согласно (Методы почвенной …, 1991; Anderson, Domsch, 1978, 1990; Sparling, 1995).
СИД почвы оценивали по скорости начального максимального дыхания микроорганизмов после добавления в почву глюкозо-минеральной смеси (ГМС, мг мл–1: глюкоза (200); К2НРО4 (20); (NH4)2SO4 (20) (Методы почвенной …, 1991). В стеклянные флаконы (250 мл) помещали 2 г почвы и добавляли 0.1 мл ГМС. Конечная концентрация глюкозы в почве – 10 мг г–1. Флаконы герметично закрывали пробками, фиксировали время и инкубировали при 25°С. Спустя 3 ч после закрытия флакона, регистрировали СИД: пробу воздуха из флакона (1 мл) отбирали шприцем и вводили в газовый хроматограф Agilent Technologies 6890 N Network GC (USA). Скорость СИД выражали в мкг С–СО2 г–1 ч–1 (Anderson, Domsch, 1978). Углерод микробной биомассы (Смик = МБ) почвенного образца определяли согласно (Sparling, 1995), путем пересчета скорости СИД по формуле: Смик (мкг С г–1 почвы) = 50.4 × СИД (мкг С–СО2 г–1 ч–1). БД (фоновое) измеряли по скорости выделения СО2 почвой за 24 ч ее инкубации при 25°С. Скорость продуцирования СО2 определяли хроматографически, как описано для определения СИД, только вместо внесения раствора ГМС в почву вносили воду. Скорость базального дыхания выражали в мкг С–СО2 г–1 ч–1. По соотношению БД и МБ рассчитывали микробный метаболический (дыхательный) коэффициент qCO2 (БД : МБ) (Anderson, Domsch, 1990; Ананьева, 2003). Для определения общего азота в хвое сосны и ели применяли метод озоления в серной кислоте с последующим колориметрированием на фотоэлектроколориметре КФК-3 с реактивом Несслера при 440 нм и с использованием осаждения гидратом окиси меди для белкового азота. Полученные результаты выражали количественно в мг г–1 абсолютно сухого вещества (а. с. в.) (Гирс, Прокушкин, 1977; Прокушкин, 1982). Чтобы определить зависимость некоторых показателей биологической активности почвы от абиотических факторов (температура, влажность, pH), установить достоверность различий и показать долю влияния инновационной смеси удобрений на показатели биологической активности почвы участков и ростовые показатели саженцев хвойных, проводили статистический анализ полученных данных параметрическими методами описательной статистики, дисперсионного и корреляционно-регрессионного анализов с использованием MS Excel и StatSoft Statistica 2010. Все анализы проведены в трехкратной повторности (n = 3). Планки погрешностей характеризуют ошибку среднего при доверительном интервале p = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Поскольку гидротермические условия и кислотность почвы имеют большое значение для жизнедеятельности почвенной биоты и роста растений, данные факторы были учтены в эксперименте. На экспериментальных участках без микопродукта температура почвы (0–10 см) под саженцами сосны и ели колебалась от 2.2°С в мае и до 22.3°С в июле, а на участках с применением микопродукта от 2.3°С в мае до 23.1°С в июле. То есть температурные условия в вариантах ОПС и ОПСМ не имели значительных различий и соответствовали благоприятным условиям для высвобождения элементов минерального питания для саженцев сосны и ели. Влажность почвы на участках ОПС варьировала от 26.5 до 40.7%. Участки ОПСМ характеризовались более засушливыми условиями в верхнем плодородном слое 0–10 см как под саженцами сосны, так и ели. Влажность там составляла от 17.2 до 27.6%, причем к середине периода вегетации снижалась до 13.4%, в частности в варианте К + М. Также после применения микопродукта прослеживалась тенденция увеличения pH почвы в щелочную сторону на участках под саженцами сосны с 6.9 до 7.5 и с 6.7 до 7.4 под саженцами ели, что наиболее отчетливо проявлялась к концу вегетационного периода.
Значения МБ в ризосфере саженцев хвойных (0–10 см) в вариантах ОПСМ в среднем за вегетационный сезон были выше, чем в вариантах ОПС: под сосной в 1.8, под елью – в 1.2 раза, в то время как интенсивность БД наоборот была снижена (в 1.2 раза). На протяжении вегетации отмечали, что в вариантах ОПС в ризосфере ели формировалось больше МБ, чем под сосной (в 1.5 раза), в вариантах ОПСМ содержание МБ было высоким под обеими культурами и различалось незначительно (рис. 1). Наибольшие значения МБ отмечали в июле во всех вариантах опыта, в среднем в ОПС под сосной формировалось 222, под елью – 367 мкг С г–1 почвы, а в ОПСМ под сосной 342, под елью – 351 мкг С г–1 почвы. Двухфакторный анализ показал, что добавление микопродукта к ОПС вызывало достоверное увеличение биомассы микроорганизмов в ризосфере саженцев в течение всего вегетационного сезона: так, рассчитанная сила влияния этого фактора (применение микопродукта) возросла с 49.8 в мае до 94.2% в сентябре. Микродозы композиций удобрений также влияли на накопление МБ под саженцами. Наибольшие значения МБ в ОПСМ под сосной регистрировали в вариантах с диаммофоской и мочевиной, а под елью – с аммонийной селитрой, сульфатом аммония и мочевиной. В ОПС – под сосной в вариантах с диаммофоской, аммонийной селитрой и мочевиной, под елью – сульфатом аммония, диаммофоской и мочевиной. На интенсивность БД в вариантах ОПС повлияли микродозы аммонийной селитры и мочевины, особенно в середине летнего периода, когда интенсивность дыхания доходила до 15–19 мкг С–СО2 г–1 ч–1 под сосной и до 16–29 мкг С–СО2 г–1 ч–1 под елью (рис. 1).
Рис. 1.
Содержание микробной биомассы (1) и интенсивность базального дыхания (2) под саженцами хвойных на ОПС (a) и ОПСМ (б) Д – диаммофоска, АС – аммонийная селитра, СА – сульфат аммония, М – мочевина, КО –контроль.
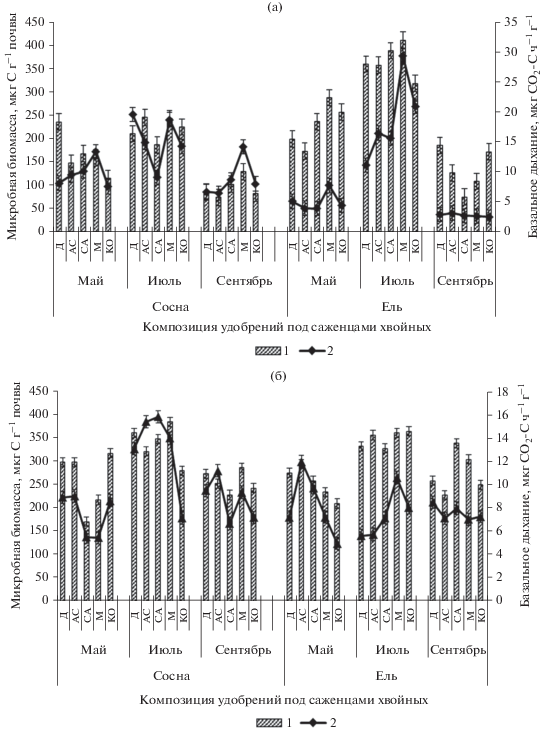
Исследованиями О.А. Ульяновой (2002) также показано, что применение коры хвойных в биокомпостах с минеральными удобрениями усиливало продуцирование CO2 в 1.3–1.4 раза. В результате корреляционно-регрессионного анализа выявлена зависимость биомассы микроорганизмов от температуры, как под саженцами сосны (R = 0.44), так и ели (R = 0.67).
Подобным же образом микопродукт повлиял на показатели удельного почвенного дыхания (qCO2). Значения коэффициента удельного микробного дыхания изменялись в зависимости от времени вегетации и породы саженцев. В вариантах ОПС в среднем за сезон под сосной значение qCO2 составило 74, а под елью – 32 мг С мкг–1 С–СО2 ч–1, в вариантах ОПСМ – под сосной 34, а под елью 27 мг С мкг–1 С–СО2 ч–1, что в 2.2 и 1.2 раза меньше. Уменьшение интенсивности удельного почвенного дыхания свидетельствует о более благоприятных экофизиологических условиях для почвенного микробоценоза при добавлении в почву микопродукта. Использование двухфакторного дисперсионного анализа также показало большее влияние сезона и времени отбора образцов на почвенное дыхание, как при применении ОПС, так и ОПСМ. Так, в вариантах ОПСМ под елью сила влияния микопродукта достигает к концу вегетации 97%. Под саженцами сосны наиболее сильное влияние на почвенное дыхание оказывали ранее выбранные микродозы удобрительных композиций, особенно увеличивает микробное дыхание, также, как и МБ, мочевина. Доля влияния фактора времени (месяца) вегетации также высока: в вариантах ОПС 77% под сосной и 86% под елью, при применении О-ПСМ – 47% под сосной и елью 64%. При этом уровень значимости так же не превышал 0.05. Корреляционно-регрессионный анализ показал зависимость удельного дыхания от температуры под саженцами сосны (R = 0.50). Под саженцами ели таковая зависимость была незначимой.
О скорости разложения растительных остатков и древесины в почве можно судить по показателю активности целлюлозоразрушения (Latter et al., 1988; Казеев и др., 2004). В образцах почвы в вариантах ОПСМ под сосной скорость разложения целлюлозы была выше в 2–3 раза, чем на опытных участках с микродозами минеральных удобрений. Причем целлюлозоразлагающая способность почвы под сосной повышалась в середине сезона (от 26% на контрольном участке до 50% на участке ОПСМ с сульфатом аммония), а под елью оставалась высокой до конца вегетационного периода (сентябрь) – 45–50% (рис. 2).
Рис. 2.
Целлюлозоразлагающая активность почвы под саженцами хвойных на ОПС (а) и на ОПСМ (б) Д – диаммофоска, АС – аммонийная селитра, СА – сульфат аммония, М – мочевина, КО –контроль; 1 – Май, 2 – Июль, 3 – Сентябрь n = 3.
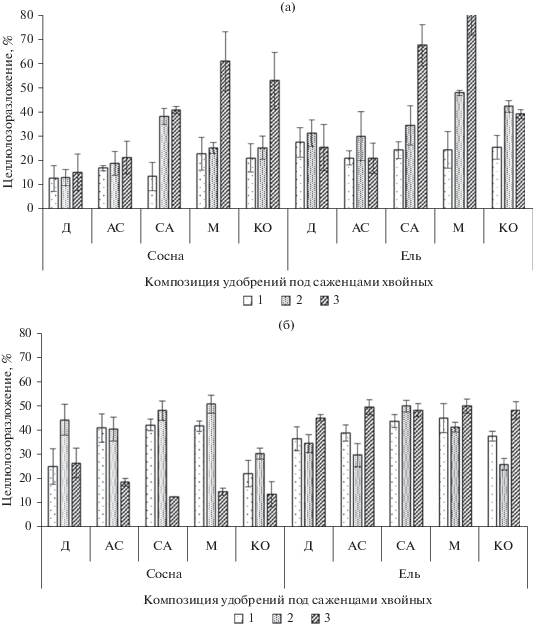
Использование однофакторного дисперсионного анализа выявило недостоверность различий между разными видами применяемых микродоз композиций удобрений. Более чем на 50% различия возникают из-за случайных факторов. Так, например, в середине вегетационного периода различия были недостоверны при уровне значимости 0.07, что немного превышает допустимый уровень значимости для биологических исследований. Двухфакторный дисперсионный анализ выявил, что варианты микродоз композиций удобрений достоверно влияют на целлюлозоразлагающую способность как под саженцами сосны, так и под саженцами ели. В мае и июле на целлюлозоразлагающую способность почвы больше влияли культуры с их месторасположением в питомнике, но в сентябре заметное влияние начинают оказывать выбранные микродозы ОПС. Сила влияния субстратов с микопродуктом на целлюлозоразлагающую способность почвы в разное время вегетации составляет от 26.4 до 49.5% под сосной, и от 23.3 до 76% под елью, при этом различия между применяемыми субстратами под елью достоверны только в конце вегетационного периода. Согласно двухфакторному дисперсионному анализу в мае и июле выбранные субстраты более влияли на целлюлозоразложение, чем место произрастания саженцев в питомнике при уровне значимости 0.013, что не превышает допустимый показатель для биологических исследований. Выявлено, что воздействие микопродукта на целлюлозоразлагающий потенциал почвы под саженцами сосны проявляется только в конце вегетационного периода (сентябрь). Под саженцами ели в данный период наибольшее влияние оказывали ранее выбранные микродозы композиций удобрений (рис. 2). Также в результате корреляционно-регрессионного анализа выявлена зависимость целлюлозоразлагающей активности под саженцами сосны от температуры (R = 0.64), под саженцами ели такая зависимость отсутствует.
В процессах трансформации лигно-целлюлозосодержащего материала в ОПС и ОПСМ принимало участие множество различных почвенных ферментов, среди которых пероксидаза и полифенолоксидаза. Высокая активность оксидаз приводит к увеличению интенсивности минерализации органического вещества и уменьшению его содержания в почве (Sinsabaugh, 2010; Datta et al., 2017). Вышеприведенным оксидазам ряд исследователей отводит важную роль в формировании гумусовых веществ, особо стойких к разложению (Гулько, Хазиев, 1992; Раськова, 1995; Хазиев, 2005). Пероксидаза и полифенолоксидаза катализируют окисление соединений фенольной природы, которыми зачастую богаты растительные остатки хвойных пород до хинонов. Хиноны, в свою очередь, вступая в реакцию поликонденсации с аминокислотами и пептидами, образуют протогуминовые вещества, иммобилизуя углерод в почвенном гумусе. Известно, что целлюлозразлагающие грибы и бактерии образуют лакказы и лигнин-пероксидазы, участвующие в разложении лигнина в почве (Ребриков и др., 2006; Arantes et al., 2010). Таким образом, пероксидаза и полифенолоксидаза ответственны в почве за минерализацию лигнина и синтез соединений, участвующих в гумификации (Хазиев, 2005; Johnsen, 2008). После применения микопродукта заметно увеличилась активность полифенолоксидазы под саженцами ели (с 0.27 до 0.61 мг), что нашло отражение в коэффициенте гумификации, который в начале вегетационного периода во всех вариантах композиций стал выше единицы (табл. 3). Данная характеристика, показывающая минерализацию гумуса и его новообразование, которая определяется как соотношение полифенолоксидазы к пероксидазе, свидетельствует об удовлетворительных условиях для гумусообразования. До применения микопродукта в субстратах коэффициент гумификации достигал единицы только в вариантах с диаммофоской, аммонийной селитрой, увеличиваясь под культурами до 1.15 лишь к концу вегетационного периода. Некоторые исследователи отмечали, что в основном неблагоприятные последствия для гумусонакопления в лесопитомниках создаются несовершенными способами обработки почвы в комплексе с неудовлетворительными гидротермическими условиями (Алексеева, Фомина, 2014). После применения микопродукта данный коэффициент почти во всех вариантах композиций как под сосной, так и под елью всегда оставался не ниже единицы, за редким исключением. Так, в середине вегетационного периода коэффициент гумификации увеличился в варианте с аммонийной селитрой до 1.22, а в конце вегетационного периода и в варианте с диаммофоской – до 1.25.
Таблица 3.
Ферментативная активность почвы с двумя видами опилочно-почвенных субстратов под саженцами хвойных
| Вид субстрата |
Вариант композиции |
СОСНА | ЕЛЬ | ||||
|---|---|---|---|---|---|---|---|
| ПФО* | ПО | Кгум | ПФО | ПО | Кгум | ||
| мг 1.4-бензохинона 1 г–1 | мг 1.4-бензохинона 1 г–1 | ||||||
| ОПС | Май | ||||||
| К | 0.30 | 0.31 | 0.98 | 0.31 | 0.41 | 0.76 | |
| Д | 0.30 | 0.29 | 1.03 | 0.27 | 0.29 | 0.91 | |
| АС | 0.52 | 0.50 | 1.05 | 0.43 | 0.41 | 1.03 | |
| СА | 0.39 | 0.50 | 0.77 | 0.47 | 0.46 | 1.01 | |
| М | 0.46 | 0.46 | 0.99 | 0.42 | 0.43 | 0.98 | |
| Июль | |||||||
| К | 0.30 | 0.26 | 1.15 | 0.32 | 0.28 | 1.13 | |
| Д | 0.23 | 0.30 | 0.76 | 0.40 | 0.40 | 1.00 | |
| АС | 0.43 | 0.50 | 0.86 | 0.45 | 0.41 | 1.08 | |
| СА | 0.41 | 0.45 | 0.91 | 0.43 | 0.50 | 0.87 | |
| М | 0.48 | 0.43 | 1.10 | 0.35 | 0.32 | 1.08 | |
| Сентябрь | |||||||
| К | 0.47 | 0.51 | 0.92 | 0.55 | 0.72 | 0.76 | |
| Д | 0.37 | 0.34 | 1.11 | 0.50 | 0.33 | 1.50 | |
| АС | 0.32 | 0.32 | 1.01 | 0.32 | 0.33 | 0.98 | |
| СА | 0.38 | 0.46 | 0.83 | 0.44 | 0.66 | 0.67 | |
| М | 0.52 | 0.62 | 0.83 | 0.53 | 0.52 | 1.02 | |
| ОПСМ | Май | ||||||
| К | 0.43 | 0.49 | 0.88 | 0.61 | 0.52 | 1.18 | |
| Д | 0.28 | 0.30 | 0.94 | 0.48 | 0.44 | 1.08 | |
| АС | 0.55 | 0.50 | 1.09 | 0.47 | 0.43 | 1.11 | |
| СА | 0.39 | 0.49 | 0.80 | 0.57 | 0.56 | 1.01 | |
| М | 0.43 | 0.51 | 0.84 | 0.61 | 0.55 | 1.10 | |
| Июль | |||||||
| К | 0.44 | 0.48 | 0.91 | 0.24 | 0.24 | 1.00 | |
| Д | 0.31 | 0.30 | 1.01 | 0.61 | 0.50 | 1.22 | |
| АС | 0.57 | 0.49 | 1.17 | 0.55 | 0.51 | 1.07 | |
| СА | 0.46 | 0.50 | 0.92 | 0.48 | 0.48 | 0.99 | |
| М | 0.48 | 0.52 | 0.92 | 0.41 | 0.44 | 0.92 | |
| Сентябрь | |||||||
| К | 0.47 | 0.47 | 1.00 | 0.23 | 0.19 | 1.25 | |
| Д | 0.24 | 0.30 | 0.81 | 0.52 | 0.49 | 1.07 | |
| АС | 0.50 | 0.49 | 1.01 | 0.46 | 0.51 | 0.91 | |
| СА | 0.40 | 0.45 | 0.89 | 0.47 | 0.51 | 0.91 | |
| М | 0.46 | 0.51 | 0.90 | 0.29 | 0.34 | 0.83 | |
Об эффективности снабжения почвой растения нутриентами можно судить по содержанию элементов питания в органах растения, и прежде всего в хвое (Прокушкин, 1982). Е.Н. Судачкова (1977) при изучении химического состава различных вегетативных органов установила, что содержание азота в хвое сосны и ели почти в два раза больше, чем в молодых побегах. Именно хвоя является аппаратом, определяющим продуктивность дерева, поскольку там проходит наиболее важный с биохимической точки зрения процесс в растении – фотосинтез. Поэтому изучение содержания азота в хвое как неотъемлемого компонента хлорофилла важно для оценки продуктивности и физиологического состояния саженцев и подроста. В нашем эксперименте применение ОПС значительно сказалось на увеличении общего и белкового азота в хвое саженцев. Помимо содержания общего азота, которое увеличилось после применения под культурами микопродукта от 14–21 до 20–52 мг г–1 а. с. в., увеличилась также и доля белкового азота в хвое с 55 до 92% (табл. 4). Известно, что содержание белкового азота в хвое характеризует прирост хвои, побегов и в целом продуктивность дерева. В нашем случае максимальное увеличение содержания белкового азота в хвое сосны и ели наблюдалось после применения микопродукта в вариантах ОПС с использованием микродоз сульфата аммония и мочевины (до 43–46 мг г–1 а. с. в.), что составило 90–92% от общего азота в хвое.
Таблица 4.
Сравнительная оценка воздействия опилочно-почвенных субстратов (ОПС и ОПСМ) на содержание азотистых веществ в хвое саженцев сосны и ели, мг г–1 а. с. в.
| Культура | Фракции азота в хвое | Композиция удобрений | ||||
|---|---|---|---|---|---|---|
| Диаммофоска (NH4)2HPO4 | Аммонийная селитра (NH4NO3) | Сульфат аммония (NH4)2SO4 | Мочевина CO(NH2)2 | Контроль: Опилки + + Почва + CaCO3 | ||
| ОПС | ||||||
| Сосна | Общий азот | 17.34 | 17.89 | 19.51 | 21.68 | 14.63 |
| Белковый азот | 13.01 | 12.47 | 13.55 | 14.63 | 8.67 | |
| Доля белкового азота, % | 75 | 69.7 | 69.4 | 67.5 | 59.2 | |
| Ель | Общий азот | 21.68 | 22.22 | 27.1 | 26.59 | 16.72 |
| Белковый азот | 16.26 | 17.89 | 18.43 | 18.97 | 8.67 | |
| Доля белкового азота, % | 75 | 80.5 | 68 | 71.4 | 55.2 | |
| ОПСМ | ||||||
| Сосна | Общий азот | 24.39 | 20.05 | 35.77 | 46.07 | 21.14 |
| Белковый азот | 18.97 | 17.34 | 31.98 | 42.27 | 15.71 | |
| Доля белкового азота, % | 77.8 | 86.5 | 89.4 | 91.8 | 74.3 | |
| Ель | Общий азот | 23.85 | 35.23 | 47.69 | 52.57 | 27.64 |
| Белковый азот | 21.14 | 28.73 | 42.89 | 46.07 | 20.59 | |
| Доля белкового азота, % | 88.6 | 81.5 | 89.8 | 87.6 | 74.5 | |
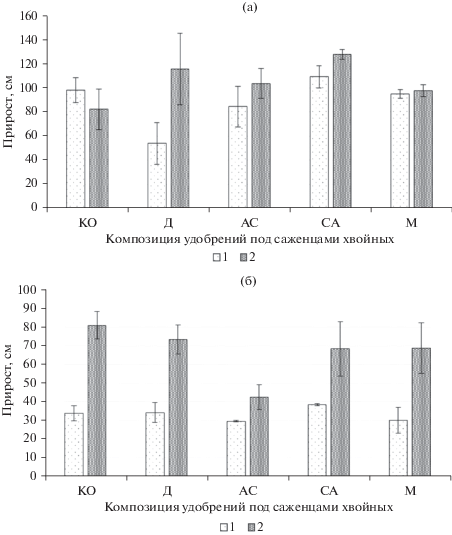
Внесение микопродукта привело к увеличению приростов верхушечной почки главного побега саженцев сосны и ели во всех композициях, за исключением мочевины. В случае микокомпострирования с диаммофоской и аммонийной селитрой прирост увеличился на 45–51% (рис. 3).
Рис. 3.
Прирост верхушечной почки главного побега у саженцев сосны (а) и ели (б) на участках с двумя вариантами опилочно-почвенных субстратов: 1 – ОПС, 2 – ОПСМ; КО –контроль, Д – диаммофоска, АС – аммонийная селитра, СА – сульфат аммония, М – мочевина n = 3.
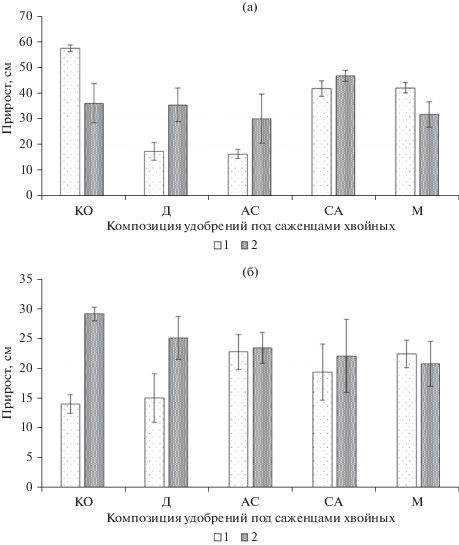
Высота саженцев, произрастающих на ОПС и ОПСМ также была различной (рис. 4), причем саженцы ели на ОПСМ были достоверно выше, чем на ОПС. После совместного компостирования ОПСМ с микродозами диаммофоски саженцы сосны обыкновенной оказались выше максимум на 62 см (53%), чем на участке с ОПС. Саженцы ели сибирской, произрастающие на ОПСМ, были выше на 30–58%, чем саженцы того же возраста на ОПС с микродозами минеральных удобрений. Использование двухфакторного дисперсионного анализа подтвердило достоверное влияние применения микопродукта на прирост и высоту саженцев ели сибирской. Доля влияния этого фактора составила 56%. На прирост сосны обыкновенной более всего повлияли ранее выбранные в ОПС микродозы удобрительных композиций, доля влияния этого фактора 45.5%.
ЗАКЛЮЧЕНИЕ
Модернизированный метод биокомпостирования лигноцеллюлозных отходов лесоперерабатывающих предприятий с использованием дереворазрушающего базидиомицета Trametes versicolor (L.) Lloyd позволил получить инновационный продукт – микопродукт, который был добавлен в ОПС для оптимизации плодородия истощенных/деградированных почв лесных питомников. Применение микопродукта при компостировании ОПС не только оптимизировало процессы разложения и минерализации опилочной массы, но и способствовало активизации биологических процессов в почве, что отразилось на биохимических и морфометрических характеристиках саженцев и на продуктивности почвы под посадками хвойных. Выбранные методы наглядно показали интенсивность протекания микробиологических процессов в почве опытных участков экспериментального хозяйства “Погорельский бор”. Сопряженное использование в ОПС микродоз композиций удобрений с микопродуктом положительным образом повлияло на функционирование почвенного микробного комплекса под хвойными культурами на участках. Отмечены: увеличение микробной биомассы под саженцами хвойных в 2–3 раза, повышение целлюлозоразлагающего потенциала почвы на 50%, возрастающий коэффициент гумификации до 1.25. Это наиболее отчетливо проявляется в конце вегетационного периода, при формировании верхушечных почек. В тот же период в тканях саженцев возрастает напряженность биохимических процессов, что находит свой отклик в содержании белкового азота в хвое сосны (на участках с комплексным использованием мочевины и микопродукта его доля возрастает до 92%). Применение микопродукта сказалось и на оптимизации роста саженцев: у обеих пород увеличился прирост верхушечной почки центрального побега в варианте ОПСМ с микродозами диаммофоски. Также высота саженцев ели во всех вариантах ОПСМ была достоверно выше (p = 0.07), чем высота саженцев, растущих на субстратах только с микродозами минеральных удобрений (ОПС).
Список литературы
Алексеева А.А., Фомина Н.В. Ферментативная активность почвы лесных питомников лесостепной зоны Красноярского края // Вестник КрасГАУ. 2014. № 12. С. 70–75.
Ананьева Н.Д. Микробиологические аспекты самоочищения и устойчивости почв. М.: Наука, 2003. 222 с.
Антонов Г.И., Кондакова О.Э., Голощапова Ю.И. Оптимизация почвенного микробоценоза с использованием биоконверсии отходов лесопереработки при искусственном лесовыращивании // Сб. научных трудов по матер. V междунар. научн. экологической конф., посвященной 95-летию Кубанского ГАУ: “Проблемы рекультивации отходов быта, промышленного и сельскохозяйственного производства”. Краснодар: Кубанский гос. аграрн. университет, 2017. С. 49–52.
Антонов Г.И., Сорокин Н.Д., Барченков А.П., Кондакова О.Э. Оптимизация лесовыращивания с использованием биоконверсии древесно-опилочной массы в условиях Красноярской лесостепи // Лесоведение. 2018. № 1. С. 56–64.
Антонов Г.И., Пашенова Н.В., Гродницкая И.Д. Патент на изобретение № 2681572 от 11.03.2019 Опилочно-почвенный субстрат для оптимизации плодородия почв // ФИЦ КНЦ СО РАН, КНЦ СО РАН
Беловежец Л.А., Волчатова И.В., Медведева С.А. Перспективные способы переработки вторичного лигноцеллюлозного сырья // Химия растительного сырья. 2010. № 2. С. 5–16.
Беседина И.Н., Симкин Ю.Я., Петров В.С. Получение углеродных материалов из отходов окорки лиственницы сибирской. Особенности отходов сухой окорки как сырья для получения углеродных материалов // Химия растительного сырья. 2002. № 2. С. 63–66.
Гирс Г.И., Прокушкин С.Г. К методике определения общего и белкового азота в растительных тканях // В кн.: Физиолого-биохимические методы исследования древесных растений. Красноярск: Институт леса и древесины АН СССР, 1977. С. 16–21.
Гулько А.Е., Хазиев Ф.Х. Фенолоксидазы почв: продуцирование, иммобилизация, активность // Почвоведение. 1992. № 11. С. 55–67.
Дитрих В.И., Андрияс А.А., Пережилин А.И., Корпачев В.П. Оценка объемов и возможные пути использования отходов лесозаготовок на примере Красноярского края // Хвойные бореальной зоны. 2010. Т. XXVII. № 3–4. С. 346–351.
Казеев К.Ш. Колесников С.И., Вальков В.Ф. Биология почв Юга России. Ростов-на-Дону: Изд-во “Центр Валеологии Вузов России”. 2004. 350 с.
Кондакова О.Э. Использование микроорганизмов для выращивания хвойных и улучшения биогенности почв в лесных питомниках Сибири: Автореф. дис… канд. биол. наук / (спец. 03.02.08). Томск: Томский государственный университет, 2019. 24 с.
Кротова И.В., Гродницкая И.Д., Кузина А.Н., Кондакова О.Э., Шишкина И.В. Иссле-дование антибактериальной активности водных экстрактов коры лиственницы сибирской // Вестник КрасГАУ. 2017. № 5. С. 165–169.
Ларченко В.М., Джафаров Т.А. Перспективы и проблемы использования отходов лесопромышленного сектора и древесного сырья в биоэнергетике Красноярского края // Вестник Красноярского гос. аграрн. университета. 2013. № 9. С. 206–210.
Ленскинова Л.В. Получение биоудобрения на основе биодеструкции опилок для оптимизации деградированных почв: Автореф. дис… канд. биол. наук: (спец. 06.01.03). Улан-Удэ: Бурятская гос. сельскохоз. академия, 2003. 22 с.
Медведев С.О., Соболев С.В., Степень Р.А. Возможности рационального использования древесных отходов в Лесосибирском лесопромышленном комплексе: монография. – Красноярск: СибГТУ, 2010. 85 с.
Методы исследования структуры, функционирования и разнообразия детритных пищевых сетей: Методическое руководство / Сост. А.Д. Покаржевский, А.С. Зайцев, К.Б. Гонгальский, А.А. Бобров, Р.О. Бутовский, М.С. Солдатов. М.: ИПЭЭ им. А.Н. Северцова, 2003. 100 с.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Из-во МГУ, 1991. 303 с.
Пашенова Н.В., Лоскутов С.Р., Пермякова Г.В., Анискина А.А. Влияние отвара чистотела на биоконверсию сосновых опилок культурами базидиальных грибов-ксилотрофов: Матер. IV Всерос. конф. “Новые достижения в химии и химической технологии растительного сырья”. (Барнаул, 21–23 апреля 2009 г.) Барнаул: Изд. госуд. алтайского университета, 2009. Кн. 2. С. 39–41.
Прокушкин С.Г. Минеральное питание сосны (на холодных почвах). Новосибирск: Наука, 1982. 189 с.
Рабинович Г.Ю., Ковалев Н.Г., Сульман Э.М. Биоконверсия органического сырья в удобрения и кормовые добавки (Микробиологические аспекты). Тверь, Изд. Твер. гос. техн. университета, 1999. 167 с.
Рабинович М.Л., Болобова А.В., Кондращенко В.И. Теоретические основы биотехнологии древесных композитов. М.: Наука, 2002. Кн. 2: Ферменты, модели, процессы. 342 с.
Раськова Н.В. Активность и свойства пероксидазы и полифенолоксидазы в дерново-подзолистых почвах под лесными биоценозами // Почвоведение. 1995. № 11. С. 1363–1368.
Ребриков Д.Н, Степанова Е.В., Королева О.В., Бударина Ж.И., Захарова М.В., Юркова Т.В., Солонин А.С., Белова О.В., Пожидаева З.А., Леонтьевский А.А. Лакказа лигнолитического гриба Trametes hirsuta: очистка и характеристика фермента, клонирование гена и первичная структура гена // Прикладная биохимия и микробиология. 2006. Т. 42. № 6. с. 645–653.
Степень Р.А., Репях С.М. Альтернативные пути рациональной переработки древесных отходов // Инвестиционный потенциал лесопромышленного комплекса Красноярского края. Красноярск, Изд. Сиб госуд. техн. универитета, 2001. С. 116–121.
Судачкова Н.Е. Метаболизм хвойных и формирование древесины. Новосибирск: Наука, 1977. 224 с.
Ульянова О.А., Чупрова В.В., Луганцева М.В., Кулебакин В.Г. Получение удобрительных композиций и влияние их на содержание и состав органического вещества в черноземе обыкновенном Красноярской лесостепи // Агрохимия. 2007. № 6. С. 42–49.
Ульянова О.А.,Чупрова В.В., Люкшина И.В., Ивченко М.В. Влияние состава органоминеральных композиций на интенсивность процесса минерализации при компостировании // Химия растительного сырья. 2002. № 2. С. 39–45.
Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 2005. 252 с.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biology & Biochemistry. 1978. V. 10. № 3. P. 314–322.
Anderson T.H., Domsch K.H. Application of eco-physiological quotients qCO2 and qD on microbial biomass from soils of different cropping histories // Soil Biology & Biochemistry. 1990. V. 22. P. 251–255.
Arantes V., Milagres A.M., Filley T.R., Goodell B. Lignocellulosic polysaccharides and lignin degradation by wood decay fungi: the relevance of nonenzymatic Fenton-based reactions // Journal of Industrial Microbiology & Biotechnology, 2010. V. 38. P. 541–555.
Datta R., Baraniya D., Molaei A., Kelkar A. Enzymatic Degradation of Lignin in Soil: A Review // Sustainability. 2017. V. 9. P. 1163, Doi: .https://doi.org/10.3390/su9071163
Johnsen A.R., Jacobsen O.S. A quick and sensitive method for the quantification of peroxidase activity of organic surface soil from forests // Soil Biology & Biochemistry. 2008. V. 40. P. 814–821.
Igbokwe P.K., Asadu C.O., Okpe E.C., Okoro S.E. Manufacture of Bio Fertilizer by Composting Sawdust and Other Organic Waste // International Journal of Novel Research in Physics Chemistry & Mathematics., 2015, V. 2. P. 6–15.
Sinsabaugh R.L. Phenol oxidase, peroxidase and organic matter dynamics of soil // Soil Biology & Biochemistry. 2010. V. 42. P. 391–404.
Sparling G.T. The substrate-induced respiration method // Methods in applied soil microbiology & biochemistry. Cambridge, Massachusetts. Academic Press, 1995. P. 397–404.
Дополнительные материалы отсутствуют.