Лесоведение, 2021, № 4, стр. 393-405
Влияние автотранспортного загрязнения на биохимические и морфологические показатели состояния деревьев дуба черешчатого
Н. Ю. Кулакова a, *, А. В. Колесников a, И. Н. Курганова b, Е. В. Шуйская c, А. В. Миронова d, Д. М. Скоробогатова d
a Институт лесоведения РАН
143030 с. Успенское, Московская область, ул. Советская, 21, Россия
b Институт физико-химических и биологических проблем почвоведения РАН
142290 Пущино, ул. Институтская, 2, к. 2, Россия
c Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
d Российский Университет Дружбы народов, Экологический факультет
115093 Москва, Подольское шоссе, 8/5, Россия
* E-mail: nkulakova@mail.ru
Поступила в редакцию 27.01.2020
После доработки 19.08.2020
Принята к публикации 06.04.2021
Аннотация
Воздействие автотранспорта отражается на биохимических и морфологических показателях состояния деревьев городских насаждений. На примере 28 деревьев дуба черешчатого, произрастающих в местах с разным уровнем автотранспортного загрязнения (10–30 м от МКАД и лесопарк Узкое, г. Москва) был проведен комплексный анализ их морфологических показателей и определено содержание пролина, макроэлементов и тяжелых металлов в листьях и ветвях деревьев разных возрастных групп (старовозрастные, >100 лет и молодые, 15–20 лет). В почвенных образцах, отобранных послойно до глубины 1 м в радиусе не более 2 м от дерева, определяли общее содержание Mg, P, K, Ca, Fe, Cu, Zn, Pb, содержание подвижных форм Zn, Cu, Pb, Fe (ацетат-аммонийная вытяжка) и концентрацию ионов Ca2+, Mg2+, Cl–, Na+, ${\text{SO}}_{4}^{{2 - }}$ в водной вытяжке. В соответствии с лесохозяйственной шкалой категорий санитарного состояния деревьев и классификацией роста и развития крон дуба черешчатого, исследуемые деревья были отнесены к трем группам жизненного состояния: наихудшего (группа 1), среднего (группа 2) и наилучшего (группа 3). Отмечены близкие значения концентрации тяжелых металлов в ветвях 100-летних и 10–15-летних деревьев, входящих в группу наихудшего жизненного состояния. Концентрации Zn, Fe, Ca, и S в ветвях деревьев имели тесные отрицательные корреляции с состоянием жизненности деревьев (номером группы), для листьев эти зависимости были менее тесные или отсутствовали. Концентрации K и Р в ветвях деревьев положительно коррелировали с показателями их жизненного состояния, в то время как в листьях этот вид связи не выявлен. Между концентрацией Zn, Fe, Ca, и S и концентрацией Р и K в ветвях деревьев обнаружена тесная отрицательная корреляция, а в листьях – положительная. Увеличение концентрации К и Р в листьях в ответ на увеличение концентрации в них поллютантов является одним из механизмов защиты ассимиляционного аппарата от воздействия автотранспорта.
Автотранспортное загрязнение – важнейший фактор, оказывающий неблагоприятное воздействие на жизнь и развитие деревьев в городах. Автотранспорт является основным источником выбросов в атмосферу Москвы, его вклад достигает 92–95% (Доклад …, 2014). Автотранспорт является источником тяжелых металлов (ТМ) в атмосфере за счет выхлопных газов, истирания шин и тормозных колодок, абразии дорожного покрытия, выдувания дорожной пыли и частиц почвы, накапливающихся вдоль бордюров (Власов, 2015). Применение антигололедных средств на дорогах приводит к засолению придорожных почв (Касимов и др., 2016; Кулакова, Шабанова, 2019).
Усиление автотранспортного загрязнения в городах привело к резкому ухудшению состояния древесных насаждений вдоль крупных автомагистралей (Шевякова и др., 2000; Калашникова, 2003; Шергина, 2007; Joshi, Swami, 2007; Lee et al., 2012; Колмогорова и др., 2012; Бухарина, 2014; Kulakova et al., 2017). Обследование насаждений дуба черешчатого вдоль автомагистралей в Москве показало, что у деревьев одного насаждения, находящихся в нескольких метрах друг от друга, морфологические показатели, отражающие состояние стресса, бывают выражены в разной степени: у некоторых деревьев признаки угнетения практически отсутствуют, у других проявляется тяжелая форма поражения поллютантами (Мучник и др., 2013). Причиной этому могут быть как индивидуальные особенности растений, так и неравномерное загрязнение придорожных почв, формирующихся на исходно перемешанном и насыпном материале и отличающихся особенно большой пестротой.
Воздействие автотранспортного загрязнения морфологически проявляется в некрозах тканей, преждевременном старении и увядании листьев, утолщении и укорачивании корней (Шевякова, 2000). Общее ослабление деревьев способствует их поражению патогенными микроорганизмами, образованию “ведьминых метл”, усыханию ветвей, формированию зонтиковидных и узких крон. Прогнозируемый срок жизни узкокронных деревьев дуба – не более 10–15 лет, а при воздействии неблагоприятных факторов – гораздо меньше (Каплина, Селочник, 2009, 2015).
Ведущий механизм воздействия ТМ на растения – инактивация белков и других макромолекул, выполняющих каталитические и регуляторные функции. ТМ оказывают токсическое действие на рост, развитие, митоз, дыхание, поглощение воды, перенос электронов через мембраны (Титов и др., 2011, 2014), тормозят синтез ДНК, ингибируют процессы фотосинтеза и оттока ассимилятов (Чиркова, 2002). Степень ингибирования тяжелыми металлами физиологических процессов определяется концентрацией металла в окружающей среде и чувствительностью вида. Было показано, что одним из ответов на автотранспортное воздействие и засоление придорожных почв у дуба черешчатого являются неспецифические адаптационные реакции – увеличение содержания пролина в листьях и дисахаров в ветвях деревьев (Кулакова и др., 2018).
Накопление пролина может влиять на стрессоустойчивость различными способами. Известна роль пролина в клеточном гомеостазе, в том числе в поддержании окислительно-восстановительного баланса и энергетического статуса. Пролин может выступать в качестве сигнальной молекулы, быть модулятором пролиферации и гибели клеток (Szabados, Savouré, 2010). Поэтому концентрацию пролина в листьях растений рассматривают как индикатор стрессового состояния (Aslamsup et al., 2011).
Цель представляемого исследования состояла в изучении взаимосвязи между почвенными характеристиками (концентрацией поллютантов, K и Р, значениями рН), биохимическими показателями состояния дерева (концентрацией поллютантов, K и Р в ветвях и листьях, концентрацией пролина в листьях) и морфологическим проявлением стресса. Мы попытались выяснить, как эта взаимосвязь проявляется у деревьев разных возрастных групп. Известно, что деревья разного онтогенетического состояния отличаются стратегией потребления и аккумуляции запасных веществ и, как правило, составляя разные ярусы лесного полога, находятся в разных условиях освещения, что влияет на их способность к восстановлению ассимилирующего аппарата и, соответственно, адаптационные возможности (Павлов, 2006; Sаla et al., 2012; Каплина, Кулакова, 2015). Кроме того, была предпринята попытка выявить параметры загрязнения, являющиеся пограничными для существования дуба черешчатого в городских условиях.
ОБЪЕКТЫ И МЕТОДИКА
Исследовали деревья дуба черешчатого, произрастающие в пределах от 10 до 30 м от Московской кольцевой автодороги (МКАД) (55.59° с.ш., 37.53° в.д.) и в лесопарке Узкое (55.62° с.ш., 37.52° в.д.) на расстоянии более 100 м от крупной автомагистрали (юго-западная часть г. Москвы). Были выбраны деревья разных возрастных групп – старовозрастные (более 100 лет) и молодые (15–20 лет): у МКАД – 10 молодых и 10 старовозрастных деревьев, на территории лесопарка – 8 молодых. Старовозрастные деревья, составляя верхний ярус, имели хорошо освещенные кроны. Насаждения с молодыми деревьями были загущены, кроны деревьев находились в худших, чем у старовозрастных деревьев, условиях освещения.
На каждое из 28 исследованных деревьев составлялась ведомость обследования, содержащая следующую информацию:
(1) Описание жизненного состояния, основанное на признаках, включенных в лесохозяйственную шкалу категорий санитарного состояния (наличие усохших ветвей и побегов, дефолиации листьев) и на классификации роста и развития крон дуба черешчатого (Каплина, Селочник, 2015). Использовались также дополнительные признаки состояния: площадь некрозивных тканей листьев, образование ведьминых метл.
(2) Биохимические и химические показатели дерева (содержание пролина, Na, Mg, P, K, Ca, Fe, Zn в листьях и Na, Mg, P, K, Ca, Fe, Cu, Zn, Pb в ветвях);
(3) данные по анализу почвы в радиусе не более 2 м от дерева (общее содержание Mg, P, K, Ca, Fe, Cu, Zn, Pb; содержание подвижных форм Zn, Cu, Pb, Fe; содержание Ca2+, Mg2+, Cl–, Na+, ${\text{SO}}_{4}^{{2 - }}$ в водной вытяжке из почвы;
(4) фотографии, иллюстрирующие динамику сезонных изменений состояния листьев и кроны;
(5) расстояние от дерева до автомагистрали и особенности рельефа.
Отбор проб почвы производили в мае, после снеготаяния, с глубин 0–10, 10–20, 20–40, 40–60, 60–80 и 80–100 см из 15 скважин. Отбор листьев и ветвей для анализа осуществляли в июне. С каждого дерева отбиралось по 5 тонких (до 1.5 см в диаметре) ветвей с высоты 5–7 м по всей окружности кроны. Отбор листьев для визуальной оценки площади некрозивных тканей производили в августе. Для этой цели использовали также августовские фотографии крон деревьев. Свежие образцы листьев тщательно вытирали ватой, смоченной в дистиллированной воде, ветви обрабатывали влажными ватой и щетками. Почвенные образцы, листья и ветви для химического анализа высушивали при температуре 105°С, листья для определения пролина доводили до воздушно-сухого состояния при комнатной температуре.
Анализ содержания Na, Mg, P, K, Ca, Fe, Cu, Zn, Pb в почвенных образцах, Mg, P, K, Ca, Fe, Zn, S в растительных образцах проводили рентгенфлуоресцентным методом на спектроскане МАКС-GV (“НПО "СПЕКТРОН”, Россия), свинец и медь в растительных образцах определяли атомно-абсорбционным спектрометрическим методом на спектрометре МГА-915МД (ООО “Атомприбор”, Россия). Подвижные формы Fe, Cu, Zn, Pb в почве определяли в ацетатно-аммонийной вытяжке (соотношение почва : раствор = = 1 : 5) на атомно-эмиссионном спектрометре с индуктивносвязанной плазмой Optima-5300DV (Рerkin Elmer, США).
В водной вытяжке из почвы определяли концентрации ионов Ca2+ и Mg2+ – трилонометрическим способом; Na+ – пламенно-фотометрическим методом; хлориды – титриметрическим методом (Воробьева, 1998), сульфаты – методом Комаровского (Гедройц, 1955). Определение рН проводили в водной суспензии почвы (соотношение почва : вода = 1 : 5) потенциометрически на рН-метре-иономере “Эксперт-001” (Россия) с электродами ЭСК-10601/7. Содержание пролина в листьях определяли нингидриновым методом (Bates et al., 1973).
Из отобранного материала каждого дерева формировали три образца: два образца листьев – для химического и биохимического анализа и один образец ветвей для химического анализа.
Статистическая обработка данных включала вычисление коэффициентов корреляции Пирсона (r) и кластерный анализ данных, выполненный в программе Statistica 7. В тексте и таблицах приведены средние значения совокупностей и их доверительные интервалы. Все статистические процедуры выполнялись при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика морфологических параметров состояния древесных насаждений. Согласно классификации, предложенной Н.Ф. Каплиной и Н.Н. Селочник (2015), мы выделяли деревья с тремя типами кроны: (1) раскидистой и наиболее хорошо развитой; (2) зонтиковидной, без нижних раскидистых ветвей, усохших под воздействием неблагоприятных факторов; (3) узкой (протяженной), образованной в основном водяными побегами. По состоянию жизненности деревья обследованных участков были разделены на три группы – наихудшего, среднего и наилучшего жизненного состояния. Деревьям первой группы присваивался номер 1, средним – номер 2, наилучшим – номер 3. В первую группу попали деревья с узкой или зонтиковидной кроной, наличием “ведьминых метл” сухих ветвей и побегов, составляющих от 1/3 до 1/2 части кроны, и с листьями, площадь некрозных тканей у которых в августе, до появления осеннего окрашивания, составляла более 30–40%. В эту группу вошли три молодых узкокронных и два старовозрастных дерева с зонтиковидной кроной на участке у МКАД. В средней группе оказались деревья с небольшим количеством сухих ветвей (менее 1/3 кроны) и площадью некрозных тканей листьев от 10 до 30%. Это были молодые деревья: одно узкокронное из парка, пять деревьев с узкой кроной и три – с зонтиковидной на участке вблизи МКАД. В группу 3 с наилучшим состоянием (отсутствие сухих ветвей, площадь некрозных тканей листьев до 10%, лучше развитые кроны) попали семь деревьев из парка с зонтиковидной формой кроны, шесть старовозрастных деревьев с раскидистой кроной и одно молодое дерево с зонтиковидной кроной на участке у МКАД.
Содержание пролина в листьях деревьев. Среднее содержание пролина в листьях всех исследованных деревьев составило 0.42 ± 0.11 мг г–1 сухого вещества. Это в 1.6 раза выше, чем в экологически чистых условиях Воронежской области (Теллермановское опытное лесничество Института лесоведения РАН – 0.26 мг г–1) и на порядок меньше, чем в листьях старовозрастных деревьев дуба, произрастающих в условиях сильного влияния автотранспорта (автомагистраль Свободный проезд в Москве – 4–6 мг г–1). Корреляция между морфологическим состоянием деревьев, содержанием пролина в листьях и содержанием тяжелых металлов в листьях и ветвях отсутствовала. Мы объясняем этот факт зависимостью содержания пролина от возраста листьев.
Концентрация макро- и микроэлементов в тканях растений незагрязненной среды отражает способность вида к их транслокации и связана с функциями элементов в организме растений (Титов и др., 2014). Мы сравнили полученные нами значения концентрации элементов в ветвях и листьях с имеющимися литературными данными для незагрязненных территорий. Концентрация K в ветвях дуба черешчатого в географических культурах из Молдавии, Украины и России составляет 0.45 ± 0.02% (Тростянецкий лесхоз Сумской области) (Патлай, Гайда, 1993). В исследуемом лесопарке в ветвях молодых деревьев дуба концентрация K выше – 0.56 ± 0.05% (табл. 1). На участке у МКАД в ветвях старовозрастных деревьев содержание K примерно такое же, как на незагрязненных территориях – 0.41 ± 0.13%, а у более молодых 15–20 летних деревьев оно существенно меньше – 0.33 ± 0.07%.
Таблица 1.
Концентрация элементов в ветвях деревьев дуба черешчатого
| Участок, возраст |
Zn, мг кг–1 | Сu, мг кг–1 | Fe, мг кг–1 | Pb, мг кг–1 | S,% | Ca, % | Mg, % | K, % | P, % |
|---|---|---|---|---|---|---|---|---|---|
| МКАД >100 лет |
58.6 ± 16.1 | 13.9 ± 3.9 | 276 ± 109 | 0.87 ± 0.33 | 0.14 ± 0.067 | 1.83 ± 0.35 | 0.038 ± 0.024 | 0.41 ± 0.13 | 0.124 ± 0.016 |
| МКАД 10–15 лет |
58.8 ± 8.9 | 15.6 ± 2.9 | 277 ± 42 | 0.60 ± 0.13 | 0.18 ± 0.02 | 2.08 ± 0.14 | 0.038 ± 0.019 | 0.33 ± 0.05 | 0.119 ± 0.009 |
| Парк 10–15 лет |
42.8 ± 9.6 | 16.9 ± 7.4 | 93 ± 8 | 1.83 ± 1.42 | 0.069 ± 0.003 | 1.55 ± 0.19 | 0.064 ± 0.027 | 0.56 ± 0.05 | 0.138 ± 0.005 |
В листьях деревьев на незагрязненных территориях (Патлай, Гайда, 1993) концентрация K составляла 1.09 ± 0.03%. В листьях молодых деревьев дуба в лесопарке Узкое концентрация K составляла 1.13 ± 0.05% и значимо не отличалась от этих величин, а на участке у МКАД в листьях старовозрастных и молодых деревьев была выше и достигала 1.24–1.26% (табл. 2). Таким образом, на наиболее загрязненных участках концентрация K в листьях дуба черешчатого была выше фоновых значений, а в ветвях – ниже или такая же. Очевидно, повышенная концентрация K в листьях связана с необходимостью поддерживать работу устьиц (Outlaw, 1983) в более запыленных и загазованных условиях, так как недостаток калия, вызывающий закрытие устьиц, тормозит фотосинтез из-за уменьшения диффузии СО2. По данным Н.В. Журковой (2003) у деревьев, растущих вдоль крупных магистралей, увеличивается число устьиц относительно растений в парках. Высказывается предположение, что увеличение концентрации К в листьях в загрязненных условиях связано с усилением транспирации, нарушением скорости водообмена, сокращением оттока питательных элементов из листьев (Бухарина и др., 2007; Бухарина, 2014). Вместе с тем известно, что увеличение концентрации калия уменьшает вязкость цитоплазмы, что способствует синтезу и внутриклеточному переносу веществ. Калий активно участвует во флоэмном транспорте: 70% его находится в растениях в ионной форме, благодаря чему он легко переносится в органы, испытывающие дефицит K (Кузнецов, Дмитриева, 2006). Поэтому увеличение концентрации калия в листьях может служить подтверждением действия механизмов защиты фотосинтезирующего аппарата при общем его дефиците в растительном организме.
Таблица 2.
Концентрация элементов в листьях деревьев дуба черешчатого
| Участок, возраст |
Zn, мг кг–1 | Fe, мг кг–1 | S, % | Ca, % | Mg, % | K, % | P, % |
|---|---|---|---|---|---|---|---|
| МКАД >100 лет |
32.7 ± 2.2 | 269 ± 62 | 0.18 ± 0.02 | 0.86 ± 0.09 | 0.12 ± 0.03 | 1.26 ± 0.07 | 0.27 ± 0.01 |
| МКАД 10–15 лет |
33.6 ± 3.4 | 230 ± 84 | 0.18 ± 0.02 | 0.95 ± 0.16 | 0.18 ± 0.04 | 1.24 ± 0.15 | 0.26 ± 0.02 |
| Парк 10–15 лет |
22.9 ± 1.0 | 100 ± 19 | 0.17 ± 0.02 | 0.69 ± 0.09 | 0.12 ± 0.05 | 1.13 ± 0.14 | 0.23 ± 0.02 |
Концентрация фосфора в ветвях и листьях деревьев дуба на незагрязненных территориях составляла 0.16 ± 0.03 и 0.27 ± 0.02% соответственно (Патлай, Гайда, 1993). В ветвях молодых деревьев дуба в парковой зоне концентрация Р была чуть ниже – 0.14 ± 0.01%, а на участке у МКАД в ветвях старовозрастных и молодых деревьев еще ниже – 0.12 ± 0.02% (табл. 1).
В листьях деревьев дуба в парке и на участке у МКАД значения концентрации Р были близкими к таковым на незагрязненных участках – 0.23 ± 0.02 и 0.25–0.26% соответственно. У деревьев дуба, произрастающих в черте города, имелась тенденция к уменьшению концентрации Р в ветвях относительно деревьев на фоновых участках. Концентрация Р в листьях деревьев, растущих и в экологически чистых условиях, и у автомагистралей, сохранялась на одинаковом уровне, что связано, очевидно, с важной ролью Р в поддержании фотосинтеза.
В литературе отмечают сезонную динамику перераспределения биофильных элементов между побегами и листьями (Бухарина и др., 2007). Весной соотношение концентраций в ветвях и листьях <1, а осенью, когда идет отток питательных веществ из листьев – оно становится >1. Мы полагаем, что в условиях автотранспортного загрязнения в весенне-летний период возникает дефицит K и Р в листьях растений, который покрывается за счет уменьшения концентрации элементов в побегах. Это предположение подтверждает положительная статистически значимая корреляция между отношением концентрации K в ветвях и листьях деревьев и номером группы, характеризующим жизненное состояние деревьев, а также отношением концентрации Р в ветвях и листьях и номером группы (коэффициенты корреляции r = 0.63–0.70; n = 28; р ≤ 0.05). В растениях наихудшего состояния (группа 1) соотношение в ветвях и листьях K и Р было в 1.8 и 1.4 раза меньше, чем в группе наилучших растений (табл. 3), что свидетельствует о более напряженном балансе элементов в первой группе деревьев.
Таблица 3.
Соотношение концентраций K и Р в ветвях и листьях исследуемых деревьев в различных группах по возрасту и жизненному состоянию
| Показатель | Категория | К | Р |
|---|---|---|---|
| Жизненное состояние | Наихудшее (Группа1) | 0.25 ± 0.06 | 0.38 ± 0.07 |
| Среднее (Группа 2) | 0.29 ± 0.05 | 0.47 ± 0.04 | |
| Наилучшее (Группа 3) | 0.44 ± 0.06 | 0.55 ± 0.04 | |
| Возраст | Молодые (15–20 лет), МКАД | 0.30 ± 0.06 | 0.23 ± 0.04 |
| Старовозрастные (>100 лет), МКАД | 0.41 ± 0.07 | 0.22 ± 0.02 |
Формирующийся дефицит K в загрязненных условиях особенно сильно проявляется у молодых растений. Соотношение концентрации калия в ветвях и листьях молодых деревьев составляло 4.1 ± 0.7, а старовозрастных – 3.0 ± 0.6. Тенденций в различном распределении фосфора между побегами и листьями у деревьев разных возрастных групп не обнаружено.
Содержание цинка в ветвях и листьях дуба в незагрязненных лесах Мещеры составляет соответственно 21.0 ± 3.2 и 20.1 ± 1.8 мг кг–1 (Железнова, 2015). В исследованных нами деревьях концентрация Zn в ветвях (табл. 1) была в 2–3 раза выше, в листьях деревьев парка Узкое – приблизительно такая же, а в листьях деревьев у МКАД – в 1.7 раза выше (табл. 2). В Мещере, в условиях дефицита Zn, его концентрация в ветвях и листьях была одинакова, в городских условиях соотношение концентраций изменяется – в ветвях накапливается в 1.8–1.9 раз больше Zn, чем в листьях, что связано, по-нашему мнению, с механизмами защиты ассимиляционного аппарата в условиях избытка элемента.
Концентрация Сu в ветвях деревьев Мещеры составляла 5.05 ± 0.36 мг кг–1 (Железнова, 2015). В ветвях деревьев в Москве концентрация Cu была в 2.8–3.4 раза выше (табл. 1). Концентрация Pb в ветвях дуба в экологически чистых условиях в Великобритании составляла 0.8 мг кг–1, а в Лондоне – 20 мг кг–1 (Warren, Delavault, 1962). Концентрация Pb в ветвях у деревьев в парке очень сильно варьировала (1.83 ± 1.42 мг кг–1) и достигала более высоких значений, чем в ветвях деревьев у МКАД (0.60 и 0.80 мг кг–1 у молодых и старовозрастных деревьев соответственно) (табл. 1), что связано, видимо, с локальным загрязнением Pb почв в парке.
Наибольшие средние значения концентрация Fe в листьях исследованных групп деревьев (278 ± ± 43 мг кг–1) были существенно ниже, чем значения концентрации в условиях контроля в уральской дубраве (528 мг кг–1), что, очевидно, связано с разной подвижностью элемента в почвах. Авторы работы указывают концентрацию 700 мг кг–1 как область избыточных концентраций Fe в листьях (Аминева и др., 2014). Вместе с тем в парке концентрация Fe в ветвях деревьев была в три раза меньше, чем у деревьев у МКАД (93 ± 8 мг кг–1) (табл. 1).
Таким образом, деревья дуба черешчатого на загрязненных автотранспортом почвах накапливают в ветвях и листьях больше поллютантов, чем в экологически чистых условиях.
Кластеры растений по концентрации тяжелых металлов. Кластеный анализ всего массива данных по концентрации ТМ в ветвях растений (рис. 1а), показал его достаточную однородность. Четкого разделения на кластеры и при анализе концентрации ТМ у деревьев разного возраста на участке у МКАД не отмечалось. Вместе с тем, данные только по молодым деревьям, образуют два кластера, соответствующие положению деревьев на двух участках – у МКАД и в лесопарке (рис. 1б).
Рис. 1.
Иерархическая классификация объектов методом одиночной линейной связи с использованием Евклидовa расстояния. а – все деревья; б – молодые деревья у МКАД и в парке; с – старовозрастные, м – молодые деревья у МКАД; п – молодые деревья в парке.
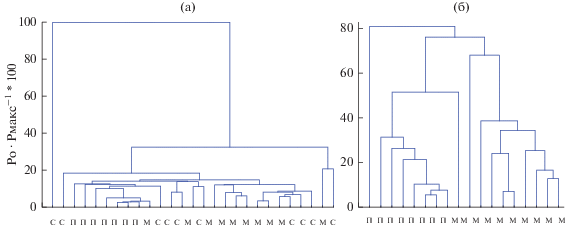
Концентрация Zn, Fe и S в растениях первого кластера (парк) была существенно ниже, чем у растений второго кластера (у МКАД, молодые деревья) (табл. 1). Концентрация K и Р в листьях также была выше у растений участка МКАД, а в ветвях – наоборот – ниже. Старовозрастные деревья занимали промежуточное положение между деревьями первого и второго кластеров, при этом достоверные различия в концентрации элементов между группой старовозрастных и молодых деревьев участка у МКАД при p < 0.05 и n = 10 отсутствовали.
Антагонистическое и синергетическое поступление элементов в растения. При загрязнении почв ТМ возникает дисбаланс между поступлением в растение макро- и микроэлементов из почвы (Кулагин, Нагиева, 2005). Так, Cd подавляет поступление Zn, а избыток Zn в свою очередь подавляет поступление K (Железнова и др., 2017). Повышенное содержание в почве комплекса ТМ, имеющее место при автотранспортном загрязнении, приводит к сложной системе взаимодействий при поглощении ТМ, K и Р растениями. При рассмотрении содержания исследуемых элементов в деревьях дуба черешчатого была обнаружена положительная корреляция между содержанием в ветвях таких элементов, как Zn, Fe, S и Ca и отрицательная – между содержанием этих элементов и концентрацией K и P (табл. 4). Хотя известен антагонизм в поступлении Pb и K, Pb и P в растения (Титов и др., 2007), корреляции между концентрацией этих элементов в ветвях отсутствовали, как не отмечены и тесные зависимости между поступлением Pb и ТМ, что связано, очевидно, с небольшой подвижностью Pb в растениях. Pb перемещается через апопласт, и его поступление в центральный цилиндр корня ограничено, так как блокируется поясками Каспари (Титов и др., 2011). Между поступлением Сu и P, Cu и K корреляционные связи не подтверждались статистически, хотя синергетическое взаимодействие Cu с P отмечалось и в литературе (Кабата-Пендиас, Пендиас, 1989).
Таблица 4.
Коэффициенты корреляции между содержанием различных элементов в листьях и в ветвях
| Zn | Fe | Cu | Pb | Ca | K | S | Mg | P | |
|---|---|---|---|---|---|---|---|---|---|
| Zn | 1 | 0.78* | – | – | 0.63* | 0.60* | 0.45* | 0.47* | 0.71* |
| Fe | 0.80* | 1 | – | – | 0.62* | 0.67* | 0.61* | 0.53* | 0.68* |
| Cu | 0.21 | 0.20 | 1 | – | – | – | – | – | – |
| Pb | 0.22 | –0.05 | –0.02 | 1 | – | – | – | – | – |
| Ca | 0.63* | 0.79* | 0.18 | –0.04 | 1 | 0.55* | 0.40* | 0.63* | 0.67* |
| K | –0.65* | –0.79* | 0.16 | –0.06 | –0.69* | 1 | 0.60* | 0.39* | 0.60* |
| S | 0.86* | 0.93* | 0.24 | 0.04 | 0.76* | –0.75* | 1 | 0.49* | 0.65* |
| Mg | –0.13 | –0.41* | 0.32 | 0.28 | –0.42* | 0.48* | –0.35 | 1 | 0.52* |
| P | –0.55* | –0.68* | 0.29 | –0.11 | –0.64* | 0.80* | –0.70* | 0.65* | 1 |
В листьях концентрация K и Р наоборот положительно коррелировала с концентрацией Zn, Fe, S и Ca, что является одним из механизмов адаптации растений к автотранспортному загрязнению. Между концентрацией K и P в ветвях исследуемых деревьев и их жизненным состоянием выявлена тесная положительная корреляция, а между концентрацией этих элементов в листьях и состоянием деревьев значимая корреляция отсутствовала (табл. 5).
Таблица 5.
Коэффициенты корреляции между содержанием элементов в ветвях и листьях и жизненным состоянием деревьев
| Образец | Zn | Fe | Cа | K | S | Mg | P | Сu | Pb |
|---|---|---|---|---|---|---|---|---|---|
| Ветви | –0.49* | –0.69* | –0.66* | 0.70* | –0.67* | 0.28 | 0.73* | –0.27 | –0.09 |
| Листья | –0.45* | –0.42* | –0.28 | –0.14 | –0.36 | –0.32 | –0.26 | – | – |
Таким образом, деревья дуба черешчатого на загрязненных автотранспортом почвах накапливают меньше K и Р в ветвях и больше K в листьях, чем на незагрязненных территориях. Чем лучше состояние дерева на участке с автотранспортным загрязнением, тем больше K и Р содержится в ветвях.
Чем больше аккумулировалось в ветвях поллютантов, тем хуже было состояние дерева: содержание Zn, Fe, Ca и S в ветвях деревьев отрицательно коррелировало с состоянием деревьев (номером группы) (табл. 5). Корреляция между концентрацией в листьях Zn и Fe и состоянием деревьев была менее тесной, между концентрацией Ca и S и состоянием деревьев – отсутствовала (табл. 5).
Свойства почв в насаждениях дуба черешчатого. Основной фон почвенного покрова изучаемых объектов составляют поверхностно турбированные подзолистые почвы. Несмотря на различное удаление от автомагистрали, средние значения содержания Na, Mg, P, K, Ca, Fe, Cu, Zn и Pb в верхних, наиболее подверженных загрязнению слоях 0–10 и 10–20 см и ниже (до глубины 1 м), достоверно не отличались на участке у автомагистрали и в парке, что объясняется широким диапазоном варьирования значений внутри каждого участка. Несмотря на близость одного из исследуемых участков к МКАД и регулярное поступление антигололедных препаратов, его почвы оказались практически не засолены. Даже в образцах, отобранных после весеннего снеготаяния, концентрация Na+ в профиле почв не превышала 0.9 ммоль-экв 100 г–1 почвы. Это объясняется большим количеством осадков зимой 2016–2017 гг. и вымыванием легкорастворимых солей из профиля почвы.
Почвы участков различались по величине значений рН: в почве у автомагистрали средние величины рН до глубины 1 м имели значение 6.75 ± 0.21 (n = 72), а в парке (на удалении от трассы) они составляли 5.78 ± 0.25 (n = 18). Различия обнаружены и для верхних, более щелочных слоев 0–20 см: 7.36 ± 0.22 (n = 24) и 6.33 ± 0.21(n = 6) соответственно.
Значимая положительная корреляционная связь между содержанием элементов в различных слоях почвы под деревьями и концентрацией этих элементов в ветвях деревьев наблюдается только для содержания Fe в слоях 0–10 см (r = 0.73, n = 24) и 20–40 см (r = 0.41) и содержанием K на глубинах 20–40 и 20–60 см (r = 0.48; 0.47, соответственно, n = 24). В листьях аналогичный тип связи был выявлен только для содержания K на глубине 20–40 см (r = 0.48, n = 24). Низкие значения коэффициентов корреляции или ее отсутствие для других элементов обусловлены влиянием различных свойств почв на подвижность тяжелых металлов, их доступность растениям и способностью растений к их поглощению (Водяницкий, 2009). Важным параметром, влияющим на подвижность ТМ в почве, является величина рН почвенного раствора. Известно, что в щелочной среде ТМ менее подвижны. При уменьшении рН увеличивается растворимость соединений большинства элементов, в том числе Zn, возрастает его мобильность в системе “твердая фаза–раствор” (Черных, Овчаренко, 2002). Тем не менее была выявлена положительная корреляция между содержанием Zn в ветвях и листьях и значениями рН в верхних слоях почвы (табл. 6). Возможно, подвижность Zn в гумусовых горизонтах связана с образованием комплексов с низкомолекулярными органическими веществами (Черных, Овчаренко, 2002).
Таблица 6.
Коэффициенты корреляции между значениями рН верхних горизонтов и концентрацией элементов в ветвях
| Слой почвы, см | Zn | Fe | Са | К | S | Mg | Р |
|---|---|---|---|---|---|---|---|
| 0–10 | 0.50* | 0.67* | 0.47* | –0.67* | 0.57* | –0.45* | –0.61* |
| 10–20 | 0.43* | 0.48* | 0.42* | –0.60* | 0.47* | –0.41* | –0.60* |
| 20–40 | 0.35 | 0.35 | 0.32 | –0.48* | 0.39 | –0.50* | –0.65* |
Высокие отрицательные значения коэффициентов корреляции между содержанием К, Р и Mg в ветвях и значениями рН (табл. 6), вероятно связаны с одинаковым распределением значений рН и содержанием водорастворимых и обменных форм Са и Na в верхних горизонтах почвы из-за применения антигололедных средств и с конкуренцией ионов K+ и Mg2+ с ионами Na+ и Са2+ при поглощении их растениями. Выявлена также отрицательная корреляция между значениями рН и концентрацией Р, которая может быть обусловлена его закреплением в верхних горизонтах почвы в виде малорастворимых фосфатов кальция. Коэффициент корреляции между содержанием общего Р и Са в почве был достаточно высоким – r = 0.77 (n = 72).
Концентрация подвижных форм Zn в почве на глубине 60–80 см значимо коррелировала с его содержанием в ветвях деревьев (r = 0.38; n = 28). На всех остальных глубинах концентрация подвижных форм Zn, Fe, Pb и Cu в почве, определенная в ацетат-аммонийной вытяжке, не имела значимой корреляции с концентрацией этих элементов в ветвях или листьях деревьев. Выявлена отрицательная корреляция между концентрацией подвижных форм Fe в почве (на всех глубинах) и содержанием этого элемента в ветвях, а содержание Fe на глубине 0–10 и 10–20 см демонстрировало отрицательную связь с концентрацией Fe в листьях (r = –0.39 и –0.56, соответственно). Наличие отрицательной корреляции свидетельствует, в частности о возрастании роли фолиарного поглощения ТМ в условиях города (Касимов и др., 2011). Отсутствию положительной корреляции способствует и тот факт, что в горизонтах с наиболее высокой концентрацией тяжелых металлов уменьшается доля сосущих корней деревьев (Кулагин, 2005).
Концентрация поллютантов, K и Р в растениях первой группы в некоторых случаях может служить показателем скорого усыхания деревьев дуба черешчатого. Средняя концентрация Zn, Cu и Ca в ветвях деревьев наихудшего состояния (три молодых и два старовозрастных дерева участка у МКАД) была в 1.4–1.5 раз выше, чем средняя концентрация этих элементов в ветвях деревьев наилучшего состояния, средняя концентрация Fe и S – в 2.5–2.6 раза выше, а K и Р – в 2.2 и в 1.3 раза ниже (табл. 7).
Таблица 7.
Содержание элементов в ветвях деревьев первой группы (в числителе) и отношение содержания к средним значениям из всей совокупности деревьев (в знаменателе)
| Возраст | Номер дерева | Zn, мг кг–1 | Fe, мг кг–1 | Ca, % | K, % | S, % | Mg, % | P, % | Сu, мг кг–1 | Pb, мг кг–1 |
|---|---|---|---|---|---|---|---|---|---|---|
| >100 лет | 1 | $\frac{{69}}{{1.3}}$ | $\frac{{445}}{{2.0}}$ | $\frac{{2.31}}{{1.3}}$ | $\frac{{0.250}}{{0.6}}$ | $\frac{{0.205}}{{1.8}}$ | $\frac{{0.008}}{{0.2}}$ | $\frac{{0.098}}{{0.8}}$ | $\frac{{25.6}}{{1.7}}$ | $\frac{{1.67}}{{2.3}}$ |
| 4 | $\frac{{120}}{{2.2}}$ | $\frac{{647}}{{2.9}}$ | $\frac{{3.07}}{{1.7}}$ | $\frac{{0.046}}{{0.1}}$ | $\frac{{0.396}}{{3.4}}$ | $\frac{{0.000}}{{0.0}}$ | $\frac{{0.079}}{{0.6}}$ | $\frac{{18.6}}{{1.3}}$ | $\frac{{1.78}}{{2.4}}$ | |
| 15–20 лет | 15 | $\frac{{47}}{{0.9}}$ | $\frac{{294}}{{1.3}}$ | $\frac{{1.98}}{{1.1}}$ | $\frac{{0.344}}{{0.8}}$ | $\frac{{0.136}}{{1.2}}$ | $\frac{{0.092}}{{2.1}}$ | $\frac{{0.126}}{{1.0}}$ | $\frac{{17.7}}{{1.2}}$ | $\frac{{0.42}}{{0.6}}$ |
| 17 | $\frac{{64}}{{1.2}}$ | $\frac{{297}}{{1.3}}$ | $\frac{{1.83}}{{1.0}}$ | $\frac{{0.349}}{{0.8}}$ | $\frac{{0.153}}{{1.3}}$ | $\frac{{0.011}}{{0.3}}$ | $\frac{{0.087}}{{0.7}}$ | $\frac{{20.0}}{{1.4}}$ | $\frac{{0.92}}{{1.3}}$ | |
| 17а | $\frac{{84}}{{1.6}}$ | $\frac{{404}}{{1.8}}$ | $\frac{{2.318}}{{1.3}}$ | $\frac{{0.165}}{{0.4}}$ | $\frac{{0.205}}{{1.8}}$ | $\frac{{0.007}}{{0.2}}$ | $\frac{{0.108}}{{0.9}}$ | $\frac{{24.8}}{{1.7}}$ | $\frac{{1.06}}{{1.4}}$ | |
| Средние значения | Все деревья | 65 | 332 | 2.04 | 0.286 | 0.165 | 0.037 | 0.107 | 20.8 | 0.88 |
| Группа 1 | 76 | 417 | 2.3 | 0.23 | 0.22 | 0.02 | 0.10 | 21.3 | 1.17 | |
| Группа 3 | 49 | 162 | 1.7 | 0.51 | 0.09 | 0.06 | 0.14 | 14.0 | 1.23 | |
| Группа1 (Группа3)–1 | 1.5 | 2.6 | 1.4 | 0.4 | 2.5 | 0.4 | 0.7 | 1.5 | 0.9 | |
У старовозрастных деревьев, несмотря на усыхание части нижних ветвей, кроны были достаточно хорошо развиты, а у молодых деревьев из сухих ветвей состояла вся нижняя половина кроны, а иногда и ее большая часть. Это связано с тем, что молодые деревья, в отличие от старовозрастных, хуже освещены и им не хватает запасов ассимилянтов для восстановления кроны. Прогнозируемое время жизни узкокронных деревьев, даже в благоприятных условиях, по наблюдениям исследователей, составляет не более 15 лет (Каплина, Селочник, 2015). Отмеченные высокие значения содержания поллютантов в ветвях и низкие концентрации калия и фосфора могут, по нашему мнению, провоцировать гибель деревьев с неразвитой и плохо освещенной кроной в ближайшее время. Этот вопрос требует дальнейших наблюдений. Прогноз развития старовозрастных деревьев с лучше развитой кроной более оптимистичен.
ЗАКЛЮЧЕНИЕ
Показатели жизненности деревьев дуба черешчатого положительно коррелируют с содержанием в ветвях K и Р и обнаруживают обратную корреляционную связь с содержанием в ветвях Zn, Fe, Ca и S. Коэффициенты корреляции между концентрацией поллютантов в ветвях и морфологическими признаками стресса у исследованных растений располагаются в порядке: rFe > rs > rca > rZn.
Увеличение концентрации поллютантов в ветвях и листьях дуба черешчатого в условиях автотранспортного загрязнения приводит к дисбалансу в поступлении Р и K в растения и перераспределению этих элементов в органах растений – уменьшению концентрации в ветвях и увеличению концентрации в листьях.
Положительная корреляция между концентрацией K и Р в листьях и содержанием в них Zn, Fe и Ca связана, в частности, с механизмами защиты фотосинтезирующего аппарата в условиях автотранспортного загрязнения.
Общее содержание в исследуемых поверхностно турбированных подзолистых почвах Cu, Pb, и Zn и форм Fe, Cu, Pb, растворимых в ацетат-аммонийной вытяжке, не дает представления об аккумуляции этих элементов деревьям дуба черешчатого.
Переход в группу наихудшего состояния у молодых и старовозрастных растений связан с близкими значениями концентраций поллютантов в ветвях и листьях. В среднем значения критических концентраций цинка, железа и меди в ветвях деревьев дуба составляют около 77, 400 и 2000 мг кг–1 для Zn, Fe и Cu соответственно. Однако у молодых деревьев, в силу худшей освещенности их крон, больше вероятность гибели в ближайшие годы.
Список литературы
Аминева, К.З., Уразгильдин Р.В., Сулейманов Р.Р. Эколого–геохимические особенности почв дубовых древостоев и аккумуляция тяжелых металлов в листьях дуба черешчатого (Quercus robur L.) в условиях нефтехимического загрязнения // Известия Самарского НЦ РАН. 2014. 16(5). С. 58–64
Бухарина И.Л. Динамика содержания азота, фосфора и калия в побегах растений городских насаждений // Известия Российской академии наук. Серия биологическая. 2014. № 4. С. 415.
Бухарина И.Л., Поварницина Т.М., Ведерников К.Е. Эколого–биологические особенности древесных растений в урбанизированной среде. Ижевск: Ижевская гос. сельскохозяйственная академия, 2007. 216 с.
Власов Д.В. Геохимия тяжелых металлов и металлоидов в ландшафтах Восточного округа Москвы: Дис. … канд. биол. наук. 25.00.23. М: МГУ им. Ломоносова, 2015. 18 с.
Водяницкий, Ю.Н. Тяжелые и сверхтяжелые металлы и металлоиды в загрязненных почвах. М.: Почвенный институт им. В.В. Докучаева, 2009. 95 с.
Воробьева Л.А. Химический анализ почв. М.: Изд-во МГУ, 1998. 272 с.
Гедройц К.К. Собрание сочинений в трех томах. М.: Сельхгозгиз, 1955. Т. 2. Химический анализ почвы. 628 с.
Доклад о состоянии окружающей среды в городе Москве в 2013 г. / Под ред. Кульбачевского А.О. М.: ЛАРК ЛТД, 2014. 222 с.
Железнова О.С. Комплексная оценка биогеохимической устойчивости экосистем в условиях техногенеза: Дис. … канд. биол. наук. 03.02.08. Петрозаводск. 2015. 297 с.
Железнова О.С., Черных Н.А., Тобратов С.А. Цинк и кадмий в фитомассе древесных растений лесных экосистем: закономерности транслокации, аккумуляции и барьерных механизмов // Вестник Российского университета дружбы народов. Серия: Экология и безопасность жизнедеятельности. 2017. Т. 25. № 2. С. 253–270.
Журкова Н.В. Сравнительный анализ состояния древесных пород в условиях большого города и пригорода // Актуальные проблемы экологии и природопользования. 2003. № 3. С. 47–50.
Кабата-Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях. М.: Мир, 1989. 440 с.
Калашникова О.В. Техногенное загрязнение почв и состояние древесных насаждений в Москве: Автореф. дис. канд. биол. наук. 03.00.27. М: Факультет почвоведения МГУ им. Ломоносова. 2003. 20 с.
Каплина Н.Ф., Кулакова Н.Ю. Содержание неструктурных углеводов в органах дуба черешчатого в условиях южной лесостепи европейской части России // Вестник Поволжского государственного технологического университета. Серия: Лес. Экология. Природопользование. 2015. № 4(28). С. 85–99.
Каплина Н.Ф., Селочник Н.Н. Морфология крон и состояние дуба черешчатого в средневозрастных насаждениях лесостепи // Лесоведение. 2009. № 3. С. 32–42.
Каплина Н.Ф., Селочник Н.Н. Текущее и долговременное состояние дуба черешчатого в трех контрастных типах леса южной лесостепи // Лесоведение. 2015. № 3. С. 191–201.
Касимов Н.С., Власов Д.В., Кошелева Н.Е., Никифорова Е.М. Геохимия ландшафтов Восточной Москвы. М: Из-во АПР, 2016. 276 с.
Касимов Н.С., Кошелева Н.Е., Сорокина О.И., Гунин П.Д., Бажа С.Н., Энх–Амгалан С. Загрязнение почв тяжелыми металлами в промышленных городах Монголии // Аридные экосистемы. 2011. Т. 17. № 4(49). С. 14–31.
Колмогорова Е.Ю., Кайдорина В.А., Неверова О.А. Морфофизическая оценка состояния березы повислой в условиях действия выбросов автотранспорта // Известия высших учебных заведений. Лесной журн. 2012. № 2. С. 20–27.
Кузнецов В.В., Дмитриева Г.Н. Физиология растений. М.: Высш. шк., 2006. 742 с.
Кулагин А.А., Шагиева Ю.А. Древесные растения и биологическая консервация промышленных загрязнителей. М: Наука, 2005. 190 с.
Кулакова Н.Ю., Шабанова Н.П. Засоление почв – одна из проблем городского озеленения / / Актуальные проблемы лесного комплекса / Под общ. редак. Памфилова Е.А. Брянск: БГИТУ. 2019. Вып. 54. 303 с.
Кулакова Н.Ю., Колесников А.В., Шуйская Е.В. Биохимические параметры состояния деревьев дуба черешчатого (Quercus robur L.) в экстремальных условиях произрастания // Мониторинг и оценка состояния растительного мира: Материалы V Междунар. науч. конф. (Минск – Беловежская пуща, 8–12 октября 2018 г.). Минск: Колорград, 2018. С. 174–176.
Мучник Е.Э., Каплина Н.Ф., Кулакова Н.Ю., Селочник Н.Н., Ермолова Л.С. Опыт комплексной оценки состояния московских дубрав // Доклады по экологическому почвоведению. 2013. Вып. 18. № 1. С. 151–164.
Павлов И.Н. Древесные растения в условиях техногенного загрязнения. Улан–Удэ: Изд–во Бурятского НЦ СО РАН, 2006. 370 с.
Патлай И.Н., Гайда Ю.И. Географическая изменчивость биохимических показателей дуба черешчатого // Лесоведение. 1993. № 1. С. 42–52.
Титов А.Ф., Казнина Н.М., Таланова В.В. Тяжелые металлы и растения. Петрозаводск: Карельский НЦ РАН, 2014. 194 с.
Титов А.Ф., Таланова В.В., Казнина Н.М. Физиологические основы устойчивости растений к тяжелым металлам. Петрозаводск: Карельский НЦ РАН, 2011. 78 с.
Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам. Петрозаводск: Карельский НЦ РАН, 2007. 172 с.
Черных Н.А., Овчаренко М.М. Тяжелые металлы и радионуклиды в биогеоценозах. М.: Агроконсалт, 2002. 200 с.
Чиркова Т.В. Физиологические основы устойчивости растений. СПб.: Изд-во Сант-Петербургского университета, 2002. 244 с.
Шевякова Н.И., Кузнецов В.В., Карпачевский Л.О. Причины и механизмы гибели зеленых насаждений при действии техногенных факторов городской среды и создании стресс–устойчивых фитоценозов // Вестник Московского гос. университета леса – Лесной вестник. 2000. № 6. С. 25–33.
Шергина О.В., Михайлова. Т.А. Состояние древесных растений и почвенного покрова парковых и лесопарковых зон г. Иркутска / Отв. ред. Семенов Ю.М. Иркутск: Изд-во Института географии СО РАН, 2007. 200 с.
Aslamsup R., Bostansup N., Mariasup M., Safdar W. A critical review on halophytes: salt tolerant plants // J. Medicinal Plants Research. 2011. V. 5. № 33. P. 7108–7118.
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water–stress studies // Plant & soil. 1973. V. 39. № 1. P. 205–207.
Joshi P.C., Swami A. Physiological responses of some tree species under roadside automobile pollution stress around city of Haridwar, India // The Environmentalist. 2007. V. 27. № 3. P. 365–374.
Kulakova N.Y., Kolesnikov A.V., Baranova A.Y., Golubeva M.V. The study of adaptive capacity of oak (Quércus róbur) to motor transport pollutions // Russian J. Agricultural & Socio–Economic Sciences. 2017. V. 2(62). P. 239–249.
Lee M.A., Davies L., Power S.A. Effects of roads on adjacent plant community composition and ecosystem function: an example from three calcareous ecosystems // Environmental pollution. 2012. V. 163. P. 273–280.
Outlaw W.H., Current Concepts on the role of potassion in stomatol movements // Physiology planta. 1983. V. 59. № 2. P. 302–311.
Sala A., Woodruff D.R., Meinzer F.C. Carbon dynamics in trees: feast or famine? // Tree physiology. 2012. № 32. P. 764–775.
Szabados L., Savouré A. Proline: a Multifunctional Amino Acid // Trends in Plant Science. 2010. V. 15. P. 89–97.
Warren H.V., Delavault R.E. Lead in some food crops and trees // J. Science of Food & Agriculture. 1962. V. 13. № 2. P. 96–98.
Дополнительные материалы отсутствуют.


