Известия РАН. Механика жидкости и газа, 2020, № 4, стр. 35-46
Влияние конвекции на кристаллизацию фосфата кальция в термостате в земных и космических условиях
А. И. Федюшкин *
Институт проблем механики им. А.Ю. Ишлинского РАН
Москва, Россия
* E-mail: fai@ipmnet.ru
Поступила в редакцию 05.11.2019
После доработки 17.12.2019
Принята к публикации 17.12.2019
Аннотация
Проведено математическое моделирование массопереноса при выращивании кристаллов октакальция фосфата Ca8H2(PO4)6 и гидроксиапатита Ca10(OH)2(PO4)6 во время смешивания водных растворов CaCl2 и KH2PO4 + K2HPO4 в буферном растворе KCl с учетом стехиометрического соотношения. Исследования проведены для условий невесомости, микрогравитации и нормальной гравитации. Рассмотрено влияние гравитации (конвекции) на характер переноса компонент реакции при кристаллизации фосфата кальция в термостатированных условиях. Показано, что времена переноса компонент реакции меньше при конвективном перемешивании, чем при чисто диффузионном режиме, но скорость и масса образования фосфата кальция зависят не только от времени и интенсивности конвекции, но и от структуры конвективного перемешивания.
Фосфаты кальция составляют основу костного материала и широко используются в пищевой промышленности. Жизненно важный интерес к производству и свойствам фосфата кальция вызван вследствие оценки их влияния на деятельность желудочно-кишечного тракта и сердца человека.
Ранее проведенные эксперименты на Земле и в космосе по программе EURECA (1992, 1993) по кристаллизации фосфатов кальция из растворов CaCl2 и KH2PO4 + K2HPO4 показали, что размер кристаллов гидроксиапатита, выращенных в условиях невесомости, в десять–сто раз больше, чем у их земных аналогов [1–3]. Такое большое отличие в размерах выращенных кристаллов указывает на то, что процессы массопереноса в космическом и земном экспериментах были различными.
Различие в экспериментальных данных, полученных в земных и космических условиях, говорит о том, что тепломассоперенос компонент реакции был разным, что сказывалось на выращенных кристаллах фосфата кальция. Со времен Бенара и Рэлея явлениям конвективного тепломассопереноса посвящено много работ, например, [4–10]. В [4] детально разобраны диффузионные, конвективные и радиационные механизмы тепломассопереноса для ньютоновских и неньютовских жидкостей, приведены свойства жидкостей, коэффициенты переноса и химических реакций. В монографии [5] также приводятся фундаментальные основы ламинарного и турбулентного конвективного тепломассопереноса для внешних и внутренних задач. Новые достижения в области изучения конвекции вместе с фундаментальными закономерностями для различных случаев, включая фазовые переходы, изложены в [6]. В [7] приводятся особенности конвективных процессов в условиях микрогравитации с численными решениями некоторых задач. В [7] дана классификация конвективного тепломассопереноса и указывается на большое разнообразие задач даже в двумерном модельном примере в зависимости от направления силы тяжести и потоков тепла и массы. В статье [8] приводятся экспериментальные и численные результаты для конвекции в прямоугольной области, подогреваемой сбоку. Рассматривается зависимость концентрационного расслоения от интенсивности конвекции и приводятся различные стационарные структуры течения и распределений тепла и примеси. Фундаментальным закономерностям формирования конвективных структур в объеме при подогреве снизу (задачи Рэлея–Бенара) посвящены исследования [9]. Авторы [9] указывают на зависимости перестройки, бифуркаций и устойчивости различных мод течения от начальных и граничных условий. В статье отмечено то, что нет противоречивых фактов существования преобладающих двумерных валиковых течений. Исследованию устойчивости конвективных течений посвящены работы авторов [10] и их учеников.
Цель данной работы – указать на принципиальную возможность существования конвекции в термостате при кристаллизации из раствора [7, 11]. Ввиду этого можно предположить, что вследствие наличия в термостатированном реакторе конвекции массоперенос при нормальной и пониженной гравитации в данных экспериментах был разным, что являлось причиной различия кристаллов, выращенных в земных и космических условиях [7]. Влияние конвекции появлялось в подобных экспериментах по выращиванию кристаллов белков [12, 13]. В [13] приводится анализ экспериментов по росту кристаллов полупроводников и белков в невесомости, указываются перспективы на выполнение будущих экспериментов.
Поскольку задача нестационарная, требующая больших компьютерных временных затрат, то для выполнения поставленной цели было проведено 2D моделирование. Математическое моделирование основано на численном решении двумерных нестационарных нелинейных уравнений Навье–Стокса для несжимаемой жидкости в приближении Буссинеска и уравнений конвективного переноса тепла и массы для двух компонент роста, находящихся в растворе KCl. Образование фосфатов кальция моделировалось на основе химической реакции между компонентами с учетом выбора скорости химической реакции и с учетом стехиометрического соотношения. Решение данной задачи осуществлялось с помощью конечно-разностного комплекса программ, разработанного автором [14].
В данной работе рассматриваются всевозможные механизмы перемешивания растворов за счет диффузии, тепловой, концентрационной и тепло-концентрационной конвекции с учетом химической реакции и баланса массы. Приводятся результаты параметрических расчетов для разных значений чисел Грасгофа Gr, определяющих интенсивность конвекции, включая условия невесомости, микрогравитации и земные условия. Показано влияние гравитационных условий на динамику и характер образования фосфатов кальция.
1. ПОСТАНОВКА ЗАДАЧИ
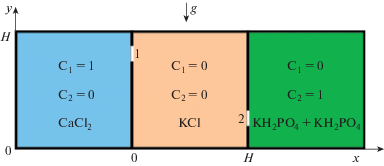
Космические и земные эксперименты проходили в одинаковых и хорошо термостатированных резервуарах, состоящих из трех частей, заполненных различными растворами. Схема расположения резервуаров и начальные концентрации компонент кристаллизации и буферного раствора показаны на рис. 1. Расчетной областью математической модели служит средний квадрат, изображенный на рис. 1.
В левой части находится резервуар, содержащий CaCl2, в правой части находится резервуар, содержащий раствор KH2PO4 + K2HPO4, средняя камера полностью заполнена буферным раствором KCl. Средний резервуар – реактор, где и происходит образование фосфата кальция. После одновременного открытия на вертикальных стенках реактора отверстия “1” – слева и “2” – справа (рис. 1) происходит взаимодействие растворов (CaCl2) – компонента С1 и (KH2PO4 + + K2HPO4) – компонента С2 c образованием продукта реакции – фосфата кальция – компонента С3.
2. МАТЕМАТИЧЕСКАЯ МОДЕЛЬ
В данной модели расчетная область – средняя квадратная область, представленная на рис. 1. Это область, где происходит кристаллизация фосфата кальция из компонентов, поступающих из правого и левого резервуаров через мгновенно открывающиеся в начальный момент отверстия “1” и “2”.
В математической модели были приняты следующие предположения:
1) расчетная область плоская (квадрат со стороной, равной H), вектор силы тяжести g направлен параллельно оси Y, теплофизические свойства растворов и кинетические свойства химической реакции в течение всего процесса предполагаются постоянными;
2) вхождение компонент реакции в реактор с раствором через отверстия “1” и “2” (рис. 1) происходит диффузионным способом;
3) химическая реакция происходит мгновенно при взаимодействии компонент в стехиометрическом соотношении 5/3;
4) не учитывается возможность образования нескольких модификаций фосфатов кальция, моделируется изменение концентраций С1 и С2 с образованием продукта кристаллизации – фосфата кальция с концентрацией С3;
5) рассматривается влияние на конвективный массоперенос только компонент реакции, а осаждение и конвективный перенос фосфата кальция (образовавшихся кристаллов – продукта С3) происходит пассивно (без влияния фосфата кальция на течение расплава), т.е. в данной модели характер и динамика конвективного течения определяются тепловой конвекцией за счет тепловыделения (скрытая теплота кристаллизации) и концентрационной конвекцией компонент кристаллизации (С1 и С2). Диффузией образовавшихся кристаллов С3 пренебрегалось [4, 11].
Математическая модель основана на решении системы двухмерных нестационарных уравнений Навье–Стокса для несжимаемой жидкости в приближении Буссинеска и уравнений переноса тепла и массы, которые в декартовой системе координат, в безразмерном виде, в переменных: $\psi $ – функция тока, $\omega $ – вихрь, T – температура, C1, C2, C3 – концентрации, можно записать в следующем виде [5–7]:
(2.1)
$\frac{{{{\partial }^{2}}\psi }}{{\partial {{x}^{2}}}} + \frac{{{{\partial }^{2}}\psi }}{{\partial {{y}^{2}}}} = - \omega $(2.2)
$\frac{{d\omega }}{{dt}} = \frac{{{{\partial }^{2}}\omega }}{{\partial {{x}^{2}}}} + \frac{{{{\partial }^{2}}\omega }}{{\partial {{y}^{2}}}} + {\text{Gr}}\frac{{\partial T}}{{\partial x}} + {\text{G}}{{{\text{r}}}_{{1C}}}\frac{{\partial {{C}_{1}}}}{{\partial x}} + {\text{G}}{{{\text{r}}}_{{2C}}}\frac{{\partial {{C}_{2}}}}{{\partial x}}$(2.3)
$\frac{{dT}}{{dt}} = \frac{1}{{\Pr }}\left( {\frac{{{{\partial }^{2}}T}}{{\partial {{x}^{2}}}} + \frac{{{{\partial }^{2}}T}}{{\partial {{y}^{2}}}}} \right) + {{f}_{1}}$(2.4)
$\frac{{d{{C}_{1}}}}{{dt}} = \frac{1}{{{\text{S}}{{{\text{c}}}_{1}}}}\left( {\frac{{{{\partial }^{2}}{{C}_{1}}}}{{\partial {{x}^{2}}}} + \frac{{{{\partial }^{2}}{{C}_{1}}}}{{\partial {{y}^{2}}}}} \right) + {{f}_{2}}$(2.5)
$\frac{{d{{C}_{2}}}}{{dt}} = \frac{1}{{{\text{S}}{{{\text{c}}}_{2}}}}\left( {\frac{{{{\partial }^{2}}{{C}_{2}}}}{{\partial {{x}^{2}}}} + \frac{{{{\partial }^{2}}{{C}_{2}}}}{{\partial {{y}^{2}}}}} \right) + {{f}_{3}}$Здесь и далее приняты обозначения: $d{\text{/}}dt = \partial {\text{/}}\partial t + u\partial {\text{/}}\partial x + {v}\partial {\text{/}}\partial y$ – субстанциальная производная, $x$ и $y$ – горизонтальная и вертикальная координаты, t – время, $u = \partial \psi {\text{/}}\partial y$ и ${v} = - \partial \psi {\text{/}}\partial x$ – компоненты вектора скорости в направлении x и y соответственно, T – температура, C1, C2, C3 – концентрации. Задача характеризуется следующими безразмерными параметрами подобия: числами Грасгофа: $\operatorname{Gr} = g{{\beta }_{T}}\Delta {\text{T}}{{H}^{{\text{3}}}}{\text{/}}{{\nu }^{2}}$, Gr1C = ${\text{g}}{{\beta }_{{1C}}}\Delta {{C}_{1}}{{{\text{H}}}^{{\text{3}}}}{\text{/}}{{\nu }^{2}}$, Gr2C = ${\text{g}}{{\beta }_{{2C}}}\Delta {{C}_{2}}{{{\text{H}}}^{{\text{3}}}}{\text{/}}{{\nu }^{2}}$, числом Прандтля $\Pr = \nu {\text{/}}a$ и числами Шмидта: Sc1 = $\nu {\text{/}}{{{\text{D}}}_{{\text{1}}}}$, Sc2 = $\nu {\text{/}}{{D}_{2}}$, где ΔT, $\Delta {{C}_{1}}$, $\Delta {{C}_{2}}$, – характерные масштабы температуры и концентраций, g – ускорение силы тяжести, коэффициенты βT, ${{\beta }_{{1C}}}$, ${{\beta }_{{2C}}}$ – коэффициенты теплового и концентрационного расширения, $\nu $ – кинематической вязкости, a – температуропроводности, D1, D2 – диффузии. В данной работе в уравнениях (2.1)–(2.6) в качестве масштабов длины, скорости и времени выбраны следующие величины: H (высота и ширина расчетной области), ν/H и H2/ν. Следует отметить, что в случае кристаллизации число Грасгофа можно определить как ${\text{Gr}} = {\text{g}}{{\beta }_{T}}q{{{\text{H}}}^{{\text{4}}}}{\text{/}}{{\nu }^{2}}$, где q – поток скрытой теплоты кристаллизации.
В результате кристаллизации количество образующихся кристалликов фосфата кальция мало, поэтому они предполагаются пассивными, не влияющими на течение раствора. Поскольку продукт реакции C3 образуется в результате химической реакции из компонент C1 и C2 в пропорции как 5/3, поэтому правые части уравнений (2.3)–(2.6) были взяты следующего вида:
(2.7)
${{f}_{3}} = - {{k}_{3}} \cdot \delta \cdot 3{{C}_{2}},\quad {{f}_{4}} = {{k}_{4}} \cdot \delta \cdot (5{{C}_{1}} + 3{{C}_{2}})$(2.8)
$\delta = 1{\text{,}}\quad {{C}_{{\text{1}}}} \cdot {{C}_{2}} \ne 0;\quad 0,\quad {{C}_{{\text{1}}}} \cdot {{C}_{2}} = 0$Граничные условия имеют следующий вид:
На всех границах (кроме участков границы “1” и “2”, см. рис. 1) приняты условия прилипания теплоизоляции и непроницаемости
(2.9)
$u = 0,\quad {v} = 0,\quad \frac{{\partial T}}{{\partial n}} = 0,\quad \frac{{\partial {{C}_{i}}}}{{\partial n}} = 0$Предполагается, что поступление компонент в реактор осуществляется диффузионным способом из отверстий “1” и “2” (рис. 1).
(2.12)
${\text{Начальные}}\,\,{\text{условия }}(t = 0){\text{:}}\,u = 0,~\quad v = 0,\quad T = 0,\quad {{C}_{1}} = 0,\quad {{C}_{2}} = 0,\quad {{C}_{3}} = 0$На рис. 1 указаны начальные условия концентраций в трех резервуарах в экспериментах, а также для расчетной области (средняя квадратная область). Моделирование осуществлялось с помощью 2D конечно-разностного пакета программ со скалярным и матричным “МАРЕНА” решением уравнений Навье–Стокса [7, 14].
3. РЕЗУЛЬТАТЫ МАТЕМАТИЧЕСКОГО МОДЕЛИРОВАНИЯ
Отличие результатов космического и земного экспериментов наводят на мысль о том, что в экспериментах по выращиванию фосфата кальция, кроме диффузионного механизма переноса компонент присутствовали и конвективные механизмы перемешивания, несмотря на термостатирование реакторов.
Механизмы появления конвективного переноса могут быть следующими: в процессе диффузионного проникновения компонент C1 и (или) C2 в реактор с буферным водным раствором могут возникать неоднородности плотности и появление концентрационной конвекции, а в результате кристаллизации при образовании фосфата кальция C3 возможны тепловыделение и появление тепловой конвекции.
В данной работе рассмотрены всевозможные конвективные варианты перемешивания, кроме термокапиллярного, поскольку реактор был полностью заполнен раствором, и в нем не было свободной жидкой поверхности. В работе приведены результаты параметрических численных расчетов переноса примеси с учетом диффузии, тепловой конвекции и концентрационной конвекции для следующих значений параметров: k1 = 1, k2 = 1, k3 = 1, k4 = 1, Pr = 7, ${{\operatorname{Sc} }_{1}} = S{{c}_{2}}$ = 25. Параметрические расчеты были проведены для следующих диапазонов чисел Грасгофа: $0 \leqslant {\text{Gr}} \leqslant {{10}^{7}}$, $0 \leqslant {\text{G}}{{{\text{r}}}_{{1C}}} \leqslant {{10}^{5}}$, $0 \leqslant {\text{G}}{{{\text{r}}}_{{2C}}} \leqslant {{10}^{5}}$, где число Gr определяет интенсивность тепловой конвекции, числа ${{\operatorname{Gr} }_{{1C}}}$, ${{\operatorname{Gr} }_{{2C}}}$ – интенсивность концентрационных конвекций, вызванных первой и второй компонентами соответственно. Влияние величин кинетических коэффициентов ki на тепломассоперенос может быть значительным [4, 14], но здесь это не исследовалось, хотя справочные значения этих величин сильно разнятся. Цель расчетов состояла в том, чтобы: 1) показать принципиальную возможность существования различных типов конвекции в термостате при росте кристаллов из раствора, 2) проиллюстрировать влияние конвективного перемешивания в термостате на динамику и характер образования фосфата кальция при разных гравитационных условиях (разных значениях числа Грасгофа).
3.1. Диффузия
Рассматривается случай, когда после открытия заслонок “1” и “2” компоненты реакции C1 и C2 диффузионным способом движутся навстречу друг другу, и при их встрече начинается реакция с образованием фосфата кальция C3. Безразмерное время, необходимое для того, чтобы компоненты C1 и C2 достигли друг друга (т.е. для достижения друг друга со значениями их концентраций, на уровне тысячных долей), составляет приблизительно t = 1.
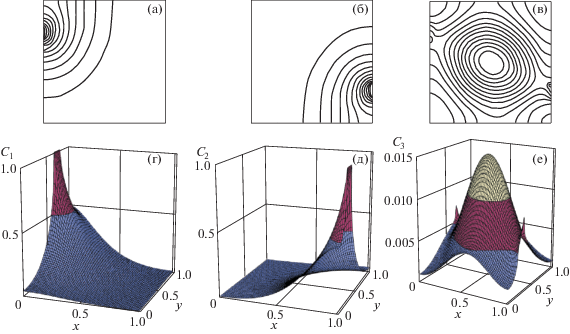
На рис. 2а, 2б, 2в представлены изолинии концентраций C1, C2, C3 для диффузионного случая (конвекция отсутствует: ${\text{Gr}} = {\text{G}}{{{\text{r}}}_{{1C}}} = {\text{G}}{{{\text{r}}}_{{2C}}} = 0$) для безразмерного момента времени t = 2. На рис. 2г, 2д, 2е для этого же случая представлены поля концентрации C1, C2, C3 в виде проекций поверхности их значений (вертикальная координата). Такое представление концентрации позволяет видеть характер распределения значений концентрации во всей области. Диффузионное распределение концентрации C3 имеет куполообразный характер. Эта поверхность поля значений концентрации имеет симметрию относительно линии, соединяющей участки на вертикальных границах с отверстиями “1” и “2” – места источников компонент реакции C1 и C2. Концентрация C3 медленно возрастает со временем и к моменту безразмерного времени t = 2 принимает максимальное значение, равное примерно 0.015, которое расположено в центральной зоне реактора (рис. 2).
3.2. Тепловая конвекция
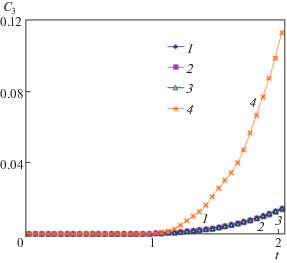
Возникновение тепловой конвекции в данной задаче имеет пороговый характер. То есть, до встречи компонент реакции C1 с C2 и образования фосфата кальция C3, их перенос осуществляется диффузионным способом. И только в процессе реакции между компонентами (C1, C2) и образования C3 возможно выделение скрытой теплоты кристаллизации и вследствие чего появление в растворе градиента температуры и тепловой конвекции. На рис. 3 представлены зависимости максимального значения продукта реакции концентрации C3 от времени для разных чисел Грасгофа. Из данных зависимостей видно, что до безразмерного времени t = 1 перенос диффузионный для всех рассмотренных чисел Грасгофа.
Рис. 3.
Зависимости максимального значения концентрации С3 от времени при тепловой конвекции для разных чисел Грасгофа: 1–4 – Gr = 0, 103, 105, 107.
Следует отметить, что конвективный режим для чисел Грасгофа $0 \leqslant \operatorname{Gr} \leqslant {{10}^{3}}$, с точки зрения распределения концентрации фосфата кальция C3, практически не отличается от диффузионного режима, как при малых временах, так и при больших. Это видно из графиков распределения концентрации C3 в среднем вертикальном сечении (x = 0.5), представленных на рис. 4 для безразмерного времени t = 2 и разных чисел Грасгофа.
Рис. 4.
Распределение концентрации фосфата кальция С3 в среднем вертикальном сечении (x = 0.5) при тепловой конвекции в момент времени t = 2 при разных числах Грасгофа: 1–5 – Gr = 0, 102, 103, 105, 107.
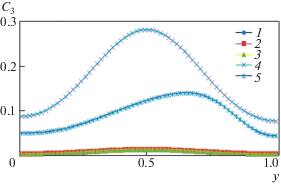
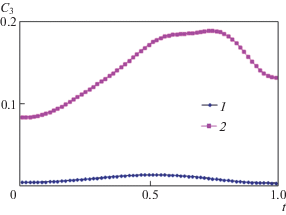
На рис. 4 представлены профили концентрации фосфата кальция C3 для пяти значений числа Грасгофа: Gr = 0, 102, 103, 105, 107, для первых трех значений из них профили совпадают, поэтому на данном рисунке видны только три кривые. Интенсивность тепловой конвекции зависит от времени, т.е. может быть нестационарной. Результаты расчетов показали, что при числе Gr = 105 тепловая конвекция имеет нестационарный характер: вначале возникает вертикальная двухвихревая структура конвекции, которая при увеличении времени меняется на одновихревую и затем снова на двухвихревую, но уже горизонтальную структуру. На рис. 5 представлены профили концентрации C3 для двух моментов времени $t = 2$ и 4 при Gr = 105. Численное моделирование установило сильную зависимость концентрации C3 от времени, что видно на рис. 5.
Рис. 5.
Распределение концентрации фосфата кальция в среднем вертикальном сечении (x = 0.5) при тепловой конвекции (Gr = 105) для двух моментов времени: 1, 2 – t = 2, 4.
Как показывают результаты численных расчетов, при $\operatorname{Gr} > {{10}^{3}}$ тепловая конвекция может интенсифицировать транспорт компонент реакции C1 и C2. Интенсивность транспортировки компонент реакции при наличии только тепловой конвекции в данной задаче зависит от величины тепловыделения и продолжительности химической реакции, а также от структуры конвекции. Структура конвективного перемешивания может быть одно- и многовихревой. Таким образом, образование многовихревых структур может замедлять транспорт компонент реакции друг к другу. В связи с этим важно отметить, что поля концентраций при больших значениях $\operatorname{Gr} > {{10}^{5}}$ и при больших временах (t > 1) изменяются во времени и в пространстве сложным образом, в отличие от диффузионного режима.
3.3. Концентрационная конвекция
В этом разделе рассмотрим случай концентрационной конвекции без учета тепловой конвекции ($\operatorname{Gr} = 0$). В отличие от тепловой конвекции концентрационная конвекция возникает сразу же после открытия шторок “1” и “2” и поступления в реактор компонент C1 и C2. Возникновение конвекции (градиента плотности, отличного от нуля) может быть вызвано изменением концентрации, как одного из компонент, так и одновременным изменением концентрации обоих компонент. Другими словами, в данной задаче может быть два генератора концентрационной конвекции. Интенсивность концентрационной конвекции определяется величинами концентрационных чисел Грасгофа ${{\operatorname{Gr} }_{{1C}}}$ и $G{{r}_{{2C}}}$, значения которых в общем случае не совпадают.
В случае, когда границы реактора с участками поступления компонент C1 и C2 (“1” и “2”) расположены не перпендикулярно вектору силы тяжести (или главному вектору микроперегрузки), концентрационная конвекция появляется при любом значении концентрационного числа Грасгофа, отличном от нуля. В космическом полете вектор микроускорений меняется, поэтому интенсивность конвекции будет отслеживать эти изменения.
На рис. 6 представлены изолинии функции тока и изолинии концентрации для момента времени t = 2 для четырех случаев концентрационной конвекции: а) ${\text{G}}{{{\text{r}}}_{{1C}}}{\text{ = }}1{{0}^{3}}$, ${{\operatorname{Gr} }_{{2C}}} = 0$, б) ${\text{G}}{{{\text{r}}}_{{1C}}}{\text{ = }}0$, ${{\operatorname{Gr} }_{{2C}}}$ = 103, в) ${\text{G}}{{{\text{r}}}_{{1C}}}{\text{ = }}1{{0}^{3}}$, ${{\operatorname{Gr} }_{{2C}}} = 1{{0}^{3}}$, г) ${\text{G}}{{{\text{r}}}_{{1C}}}{\text{ = }}1{{0}^{5}}$, ${{\operatorname{Gr} }_{{2C}}} = 1{{0}^{5}}$. Когда величина одного из концентрационных чисел Грасгофа равна нулю, а величина другого не превышает 105, в области образуется одновихревое конвективное течение с направлением движения по часовой стрелке при ${{\operatorname{Gr} }_{{1C}}} \ne 0$ и ${{\operatorname{Gr} }_{{2C}}} = 0$, и против часовой стрелки при ${\text{G}}{{{\text{r}}}_{{1C}}}{\text{ = }}0$ и ${\text{G}}{{{\text{r}}}_{{2C}}} \ne 0$. С увеличением величины концентрационного числа Грасгофа поле концентрации, за счет наличия конвекции, стратифицируется по вертикали, и вихревая структура конвективного течения стремится к горизонтальному расположению, в отличие от случая тепловой конвекции. При числах Грасгофа, отличных от нуля (${\text{G}}{{{\text{r}}}_{{1C}}} \ne 0$ и ${\text{G}}{{{\text{r}}}_{{2C}}} \ne 0$), вертикальное концентрационное расслоение усугубляется, что уменьшает транспорт друг к другу компонент C1 и C2, необходимых для химической реакции и образования фосфата кальция C3.
Рис. 6.
Изолинии функции тока (I), изотермы (II) и линии равных концентраций (III–V: ${{C}_{1}}$, ${{C}_{2}}$, ${{C}_{3}}$) при концентрационной конвекции: а – Gr1C = 103, Gr2C = 0, б – Gr1C = 0, Gr2C = 103, в – Gr1C = 103, Gr2C = 103, г – Gr1C = 105, Gr2C = 105.

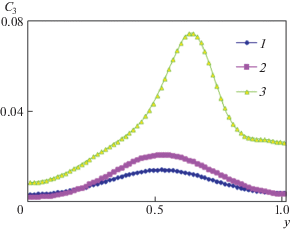
Профили концентрации фосфата кальция C3 в среднем вертикальном сечении (x = 0.5) для трех значений концентрационного числа Грасгофа ${{\operatorname{Gr} }_{{1C}}}$ = 102, 103 и 105 представлены на рис. 7. Сравнение кривых на рис. 7 показывает, что с увеличением концентрационного числа Грасгофа интенсивность переноса реагентов возрастает и, как следствие, увеличивается количество фосфата кальция C3.
3.4. Термо-концентрационная конвекция
Рассмотрим общий случай, когда присутствуют одновременно тепловая и концентрационная конвекция. Данный случай конвективного течения в литературе иногда называют двойной диффузией, изучению которой посвящено много работ, например, конвективному перемешиванию морской воды. Одновременное наличие тепловой и концентрационной конвекции интенсифицирует конвективное течение и в земных условиях увеличивает стратификацию примеси в растворе вследствие образования многовихревого слоистого характера конвективного течения. При конвективном перемешивании возможно наличие слоистых конвективных структур, усугубляющих расслоение компонент в объеме реактора и затрудняющих перенос компонент реакции друг к другу из-за многовихревой структуры течения, например, как на рис. 6в и 6г. Подобные стационарные наблюдаются в задачах конвекции при подогреве сбоку, (например, рис. 2.24 в [7]), а также при подогреве снизу в вертикальных слоях (проникающая естественная конвекция) и в стратифицированных жидкостях.
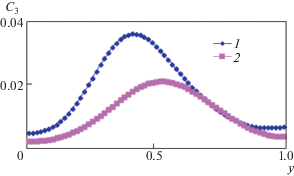
На рис. 8 показаны профили концентрации фосфата кальция ${{C}_{3}}$ в среднем вертикальном сечении (x = 0.5) для термо-концентрационной конвекции, когда присутствует тепловая и концентрационная конвекция, вызванная неоднородностью только одной из компонент, т.е. либо ${\text{Gr}}$ = 105, ${{\operatorname{Gr} }_{{2C}}} = 1{{0}^{3}}$, либо ${\text{Gr = }}1{{0}^{5}}$, ${{\operatorname{Gr} }_{{1C}}} = 1{{0}^{3}}$. Данные результаты в сравнении со случаем только тепловой конвекции (рис. 7) показывают, что учет концентрационной конвекции изменяет распределение фосфата кальция C3.
Рис. 8.
Профили концентрации C3 в среднем вертикальном сечении (x = 0.5) для термо-концентрационной конвекции: 1, 2 – Gr = 105, Gr2C = 103 и Gr = 105, Gr1C = 103.
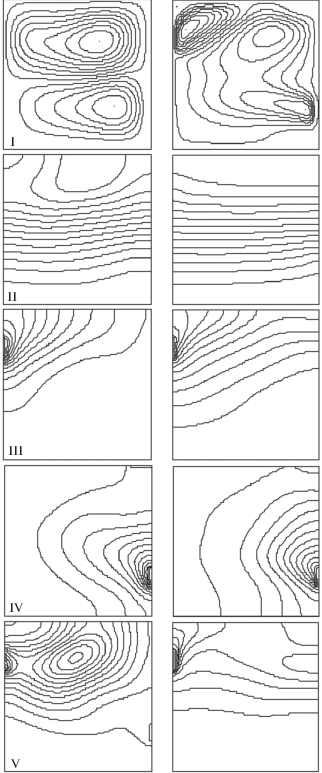
Структура полей скоростей течения, температур и распределения концентраций для термо-концентрационной конвекции для случаев наличия неоднородностей обоих компонент (C1 и C2) представлены на рис. 9. На рис. 9 изображены изолинии функции тока, изотермы и линии равных концентраций при термо-концентрационной конвекции для двух вариантов расчета: слева ${\text{Gr}}$ = 105, ${{\operatorname{Gr} }_{{{\text{1}}C}}} = 1{{0}^{3}}$, ${{\operatorname{Gr} }_{{2C}}} = 1{{0}^{3}}$, справа ${\text{Gr = }}1{{0}^{7}}$, ${{\operatorname{Gr} }_{{{\text{1}}C}}} = 1{{0}^{5}}$, ${{\operatorname{Gr} }_{{2C}}} = 1{{0}^{5}}$. Результаты показывают влияние гравитационных условий на образование и характер распределения фосфата кальция, который существенно отличается от диффузионного характера распределения, как изображено на рис. 1.
Рис. 9.
Изолинии функции тока (I), изотермы (II) и линии равных концентраций (III–V: С1, С2 и С3) при термо-концентрационной конвекции: левый столбец – Gr = 105, Gr1C = 103, Gr2C = 103, правый – Gr = 107, Gr1C = 105, Gr2C = 105.
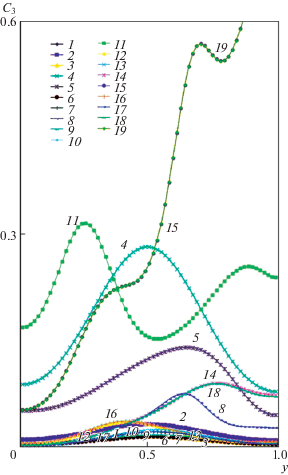
На рис. 10 приводятся профили концентрации фосфата кальция C3 в среднем вертикальном сечении (x = 0.5) для разных значений числа Грасгофа, где приняты обозначения кривых трехзначным числом k, n, m, что соответствует значениям чисел Грасгофа: Gr = 10k, ${\text{G}}{{{\text{r}}}_{{1C}}} = {{10}^{n}}$, ${\text{G}}{{{\text{r}}}_{{2C}}}$ = 10m. На этом же рисунке показан итоговый график с профилями концентрации C3 в среднем вертикальном сечении (x = 0.5) для разных комбинаций тепловой, концентрационной и термо-концентрационной конвекции. Расчетные распределения показывают разнообразие значений фосфата кальция C3 в зависимости от гравитационных условий для момента времени t = 2. Процесс кристаллизации происходит дольше, чем безразмерное время t = 2, и поэтому влияние конвекции на получение фосфата кальция C3 может быть еще более значительным, чем показано на рис. 10.
Рис. 10.
Профили концентрации фосфата кальция C3 в среднем вертикальном сечении (x = 0.5) для разных значений числа Грасгофа Gr = 10k, Gr1C = 10n, Gr2C = 10m, где показатели степеней k, n и m для линий указаны цифрами трехзначного целого числа knm: 1–19 – 000, 200, 300, 500, 700, 020, 030, 050, 002, 003, 005, 023, 032, 033, 055, 503, 530, 533, 555.
ЗАКЛЮЧЕНИЕ
Результаты численного моделирования показали возможные механизмы переноса компонент реакции их перемешивания и осаждения продукта реакции, имеющие место в экспериментах при выращивании фосфата кальция на Земле и в условиях микрогравитации. По отдельности рассмотрены: диффузия, тепловая конвекция, вызванная выделением скрытой теплоты кристаллизации; концентрационная конвекция, вызванная наличием градиентов плотности из-за неоднородного распределения компонентов раствора; а также совместное действие термо-концентрационной конвекции. Сравнение результатов численного моделирования процесса тепломассопереноса при кристаллизации фосфата кальция из раствора с экспериментальными данными указало на конвективный характер переноса компонент реакции и динамику образования фосфата кальция с учетом указанных конвективных явлений переноса.
Установлено, что времена переноса компонент реакции меньше при конвективном перемешивании, чем при чисто диффузионном режиме, но скорость и масса образования фосфата кальция зависят не только от времени и интенсивности конвекции, но и от структуры конвективного перемешивания, поскольку многовихревая структура конвекции может запирать перенос компонент реакции. Результаты численного моделирования показали, что при конвективном перемешивании возможно наличие слоистых конвективных структур, усугубляющих расслоение компонент в объеме реактора и затрудняющих перенос компонент реакции друг к другу из-за многовихревой структуры конвективного течения раствора.
Автор благодарен профессору Института кристаллизации РАН Е.И. Суворовой за полезные замечания, советы и консультации по условиям проведения и результатам земных и космических экспериментов.
Список литературы
Lundager Madsen H.E., Christensson F., Polyak L.E., Suvorova E.I., Kliya M.O., Chernov A.A. Calcium Phosphate Crystallization Under Terrestrial and Microgravity Conditions // J. Crystal Growth. 1995. V. 152. P. 191–202.
Lundager Madsen H.E., Christensson F., Chernov A.A., Polyak L.E., Suvorova E.I. Crystallization of Calcium Phosphate in Microgravity // Adv. Space Res. 1995. V. 16. P. 65–68.
Suvorova E.I., Christensson F., Lundager Madsen H.E., Chernov A.A. Terrestrial and Space-grown HAP and OCP Crystals: Effect of Growth Conditions on Perfections and Morphology // J. Crystal Growth. 1998. V.186. P. 262–274.
Brodkey R.S., Hershey H.C. Transport Phenomena: A Unified Approach. N.Y.: McGraw-Hill, 1988, 847 p.
Гебхарт Б., Джалурия Й., Махаджан Р., Саммакия Б. Свободно-конвективные течения, тепло- и массообмен. В двух книгах. М.: Мир, 1991. 678 с.
Bejan A. Convection Heat Transfer. John Wiley & Sons, Inc., 2013. 658 p.
Полежаев В.И., Белло М.С., Верезуб Н.А., Дубовик К.Г., Лебедев А.П., Никитин С.А., Павловский Д.С., Федюшкин А.И. Конвективные процессы в невесомости. М.: Наука, 1991, 240 с.
Пшеничников А.Ф., Пинягин А.Ю., Полежаев В.И., Федюшкин А.И., Шайдуров Г.Ф. Термо-концентрационная конвекция в прямоугольной области при боковых потоках тепла и массы. УНЦ АН СССР. Препринт. Свердловск, 1985. 53 с.
Гетлинг А.В. Формирование пространственных структур конвекции Рэлея-Бенара // Успехи физических наук. Т. 161. № 9. С. 1–80.
Гершуни Г.З., Жуховицкий Е.М. Конвективная устойчивость несжимаемой жидкости. М.: Наука, 1972. 392 с.
Федюшкин А.И. Влияние гравитации на массоперенос при кристаллизации фосфатов кальция из растворов в термостатированных условиях. Препринт № 1092. М.: ИПМех РАН, 2015. 27 с.
Safronov V.V., Krivonogova N.V., Bezbakh I.Z., Strelov V.I. Temperature-induced nucleation and growth of protein single crystals // J. Molecular Liquids. 2019. V. 284. P. 353–356.
Стрелов В.И., Куранова И.П., Захаров Б.Г., Волошин А.Э. Космическая кристаллизация: результаты и перспективы // Кристаллография. 2014. Т. 59. № 6. С. 863–890.
Федюшкин А.И. Исследование матричного метода решения уравнений конвекции. Комплекс программ “МАРЕНА”. Препринт № 471. М.: ИПМ АН СССР, 1990. 32 с.
Штиллер В. Уравнение Аррениуса и неравновесная кинетика. М.: Мир, 2000. 176 с.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Механика жидкости и газа