Мембраны и мембранные технологии, 2022, T. 12, № 4, стр. 315-319
Полимерный электролит для литиевых аккумуляторов на основе мембраны Nafion и диметилацетамида
Д. Ю. Воропаева a, *, А. Б. Ярославцев a, **
a Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский проспект, 31, Россия
* E-mail: voropaeva@igic.ras.ru
** E-mail: yaroslav@igic.ras.ru
Поступила в редакцию 01.04.2022
После доработки 07.04.2022
Принята к публикации 08.04.2022
- EDN: EYJDCD
- DOI: 10.31857/S2218117222040101
Аннотация
Литиевые аккумуляторы с металлическим анодом являются перспективной заменой литий-ионных аккумуляторов благодаря возможности достижения высоких значений плотности энергии. Существенной проблемой при их конструировании является прорастание дендритов через сепаратор, что делает эти аккумуляторы небезопасными и ограничивает их коммерческое применение. В данной работе получен полимерный электролит на основе катионообменной мембраны Nafion, сольватированной тройной смесью этиленкарбонат – диметилкарбонат – N,N-диметилацетамид, который обладает ионной проводимостью 1.8 мСм см–1 при 25°С и окном электрохимической стабильности 4.1 В. Показано, что симметричная ячейка Li/Li стабильно циклируется в гальваностатическом режиме при плотности тока 0.1 мА см–2 в течение >350 ч.
ВВЕДЕНИЕ
Литиевые аккумуляторы с металлическим анодом рассматриваются в качестве перспективной замены литий-ионных аккумуляторов благодаря высокой теоретической емкости лития (3860 мАч г–1) [1]. Наиболее важной проблемой, ограничивающей их масштабное применение, является прорастание дендритов через сепаратор, пропитанный жидким электролитом [1–3]. Согласно теории пространственного заряда, к прорастанию дендритов приводят низкие числа переноса катиона лития [2, 4], таким образом, использование электролитов с униполярной проводимостью по катионам путем связывания анионов с полимерной матрицей является одним из способов предотвратить образование дендритов [5–7]. Для достижения высоких значений ионной проводимости таких электролитов их сольватируют органическими апротонными растворителями. Такие полимерные электролиты должны обладать подходящей электрохимической стабильностью, высокими числами переноса Li+, высокой ионной проводимостью, термической стабильностью и совместимостью с электродными материалами [8, 9]. Для достижения высоких значений ионной проводимости таких электролитов их сольватируют органическими апротонными растворителями. В большинстве случаев полярные апротонные растворители, обладающие высокой диэлектрической проницаемостью (этиленкарбонат, пропиленкарбонат и др.), характеризуются и высокой динамической вязкостью, не позволяющей обеспечить быстрый ионный транспорт. Поэтому чаще всего используют смеси растворителей, содержащие компоненты с высокой диэлектрической проницаемостью и разбавители, характеризующиеся низкой динамической вязкостью, такие как диметилкарбонат, диэтилкарбонат и др. В качестве такого электролита можно рассматривать мембрану Nafion [10–14]. Однако сольватация этих мембран стандартными органическими карбонатами не обеспечивает достаточную ионную проводимость [15]. Известно, что N,N-диметилацетамид (ДМАА), который имеет высокую диэлектрическую проницаемость (ε = 37.8) и низкую вязкость (η = 1.96 мПа с) [16], применяется как стабилизирующая добавка [17, 18] или как индиви-дуальный растворитель в литий-ионных аккумуляторах [16, 19]. Значения литиевой проводимости мембраны Nafion, сольватированной ДМАА, значительно превосходят таковые для стандартных карбонатных растворителей [15, 20]. Однако есть сообщения о низкой химической стабильности ДМАА в контакте с щелочными металлами [19, 21], а использование смесей ДМАА с этиленкарбонатом повышает стабильность, создавая защитную пленку, которая препятствует взаимодействию ДМАА с металлом [22]. Таким образом, целью данной работы было получить полимерный электролит на основе мембраны Nafion в Li+ форме, сольватированной смесью этиленкарбоната (ЭК) – диметилкарбоната (ДМК) – N,N-диметилацетамида (ДМАА) и охарактеризовать его свойства для применения в литиевых аккумуляторах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мембрана Nafion®-117 (DuPont) была предварительно кондиционирована в соответствии со стандартной методикой [23]. Для получения мембраны в Li+ форме ее помещали в 0.1 M раствор LiOH. Промытые от щелочи пленки выдерживали в течение 12 ч под вакуумом для получения сухих образцов. Ионообменную емкость мембраны определяли методом прямого кислотно-основного титрования. Для этого предварительно взвешенную мембрану в H+ форме помещали в 1.0 М раствор NaCl на 24 ч. Аликвоты раствора титровали 0.01 М NaOH. Точку эквивалентности определяли по изменению цвета универсального индикатора.
Для получения полимерного электролита сухие мембраны выдерживали в растворе ЭК-ДМК-ДМАА (V : V : V = 1 : 1 : 1) в течение 48 ч. Для приготовления раствора были использованы безводные растворители с чистотой >99%. Степень сольватации рассчитывали как отношение числа молекул растворителя к общему числу функциональных групп мембраны, первое из которых определялось по приросту массы после выдержки в растворителях, предполагая, что состав растворителя равен исходному (уравнение (1)). Все работы с полимерным электролитом проводились в сухом перчаточном боксе Vilitek VBOX CHEM в атмосфере аргона.
(1)
$n = \frac{{\frac{{m - {{m}_{0}}}}{{{{m}_{0}}}} \times {{{10}}^{4}}}}{{{\text{ИОЕ}}~{{M}_{{{\text{р - ля}}}}}}},$Дифференциальную сканирующую калориметрию сольватированной мембраны проводили на приборе NETZSCH STA 449F1 в алюминиевых тиглях в атмосфере гелия в диапазоне температур –130…+130°C со скоростью нагрева 10°C/мин.
Ионную проводимость полученных образцов исследовали методом импедансной спектроскопии в диапазоне температур 0…+50°C в атмосфере аргона с использованием симметричной ячейки с электродами из нержавеющей стали в диапазоне частот 10 кГц–3 МГц с амплитудой 81 мВ с использованием импедансметра Elins Z1500 PRO. Для установки и контроля необходимой температуры использовалась климатическая камера Binder MKF115. Значения ионной проводимости были рассчитаны по уравнению (2). Значения энергий активации определяли по наклону температурной зависимости ионной проводимости.
где l – толщина мембраны (см), R – сопротивление (Ом), S – площадь контакта мембрана-электрод (см2).Окно электрохимической стабильности мембраны было определено методом линейной вольтамперометрии с использованием многоканального потенциостата-гальваностата Elins P-20X8. Образец мембраны помещали между электродом из нержавеющей стали (St.St., в качестве рабочего электрода) и литиевым электродом (в качестве электрода сравнения) и собирали в корпус аккумулятора “кнопочного” типа CR2032 (Coin-type cell). Сканирование потенциала проводилось в диапазоне от 0 до 6 В (отн. Li+/Li) со скоростью развертки 1.0 мВ с–1. Гальваностатическое циклирование проводили при плотности тока 0.1 мА см–1 в симметричных ячейках Li/Li “кнопочного” типа CR2032 на многоканальном потенциостате-гальваностате Elins P-20X8. Время одного цикла составляло 1 ч.
ИК спектры мембраны до и после гальваностатического циклирования регистрировали с помощью ИК спектрометра Nicolet iS5 с приставкой SpecacQuest в режиме нарушенного полного внутреннего отражения в диапазоне частот 4000–500 см–1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
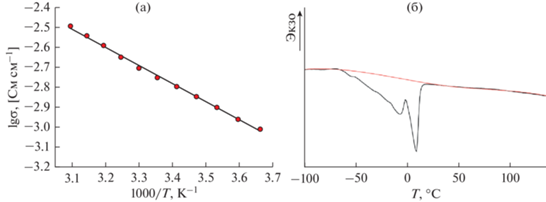
Полученные после сольватации полимерные электролиты представляли собой набухшую на 154% пленку толщиной ~160 мкм. Степень сольватации полученных мембран составляла 19.4 молекул растворителя на одну сульфо-группу мембраны. Температурные зависимости ионной проводимости исследованных образцов подчиняются уравнению Аррениуса и спрямляются в координатах lg σ–1000/T (рис. 1а), а при комнатной температуре ионная проводимость составляет 1.8 мСм см–1, что превосходит значения, характерные для большинства полимерных электролитов, и соответствует требованиям к электролитам в литиевых аккумуляторах [24]. На температурной зависимости ионной проводимости не наблюдается перегибов, что означает постоянство фазового состава электролита в исследуемом температурном диапазоне. Значение энергии активации проводимости, рассчитанное из наклона прямой, составляет 17.5 ± 0.3 кДж моль–1. На кривой ДСК сольватированной мембраны наблюдается 2 эндотермических пика с началом при –57 и –5°С (рис. 1б), которые по данным [25] соответствуют температурам стеклования смеси и полному плавлению смеси растворителей.
Рис. 1.
Температурная зависимость ионной проводимости (а) и кривая ДСК (б) полученного полимерного электролита.
Окно электрохимической стабильности полученного полимерного электролита было определено методом вольтамперометрии с линейной разверткой (рис. 2а). На кривой не наблюдается анодных пиков, а резкий рост плотности тока, соответствующий восстановлению электролита [26], обнаруживается лишь выше 4.1 В относительно Li+/Li. Это указывает на широкое окно электрохимической стабильности полученного электролита, что обеспечивает возможность работы с большинством распространенных катодных материалов, таких как LiCoO2, LiFePO4, LiNixMnyCozO2, LiMn2O4 и др. [27–29].
Рис. 2.
(а) Вольтамперограмма SS/Li ячейки с полученным электролитом и (б) гальваностатическое циклирование симметричной ячейки Li/Li при плотности тока 0.1 мА см–2 в течение 350 ч и выборочные циклы около 150 ч.
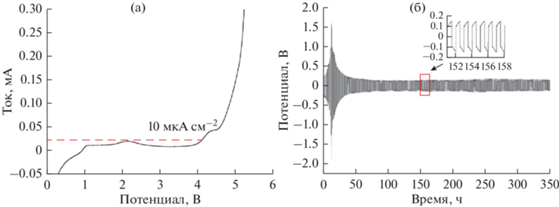
Для дальнейшей оценки стабильности полученного электролита по отношению к литиевым электродам была собрана симметричная ячейка Li/Li и протестирована путем проведения гальваностатического циклирования при плотности тока 0.1 мА см–2 (рис. 2б). На первых циклах происходит повышение напряжения с максимумом ~±1.5 В, которое соответствует восстановлению электролита с формированием на границе раздела с электродом слоя SEI (Solid electrolyte interphase), после чего напряжение равномерно снижается и на 38 цикле выходит на стабильные значения ~±140 мВ, которые сохраняются в течение >300 ч.
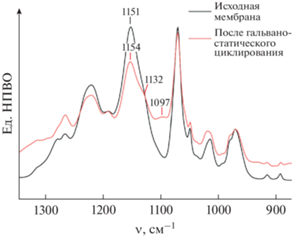
Такое поведение ячейки на начальных циклах связано с частичным восстановлением растворителя и его взаимодействием с металлическим литием. По данным ИК-спектроскопии основные изменения в спектре электролита до и после гальваностатического циклирования наблюдаются в диапазоне частот 1200–1000 см–1 (рис. 3). Так, наблюдается перераспределение интенсивности линий и появление двух новых слаборазрешенных пиков при 1132 и 1097 см–1, которые соответствуют валентным колебаниям связи C–N–C и могут свидетельствовать о присутствии комплексов Li(N(CH3)2)n, образовавшихся в результате взаимодействия ДМАА с металлическим литием [21]. При долгосрочных испытаниях не наблюдалось короткого замыкания или других значительных изменений (рис. 2б), что означает возможность стабильной работы электролита в контакте с металлическим литием без прорастания дендритов.
ЗАКЛЮЧЕНИЕ
Показано, что использование N,N-диметилацетамида в качестве одного из основных компонентов растворителя позволяет получить стабильный электролит на основе мембраны Nafion, характеризующийся широким окном электрохимической стабильности, устойчивый по отношению к литиевому электроду. Полученный полимерный электролит, сольватированный смесью этиленкарбоната – диметилкарбоната – N,N-диметилацетамида показывает ионную проводимость 1.8 мСм см–1 при 25°С и окно электрохимической стабильности 4.1 В (отн. Li/Li+ электрода), а симметричная ячейка Li/Li стабильно циклируется при плотности тока 0.1 мА см–2 в течение >350 ч.
Список литературы
Li H., Xu Z., Yang J., Wang J., Hirano S. // Sustain. Energy Fuels. 2020. V. 4. P. 5469.
Rao X., Lou Y., Zhong S., Wang L., Li B., Xiao Y., Peng W., Zhong X., Huang J. // J. Electroanal. Chem. 2021. V. 897. P. 115499.
Ding P., Lin Z., Guo X., Wu L., Wang Y., Guo H., Li L., Yu H. // Mater. Today. 2021. V. 51. P. 449.
Chazalviel J.-N. // Phys. Rev. A. 1990. V. 42 P. 7355.
Tu Z., Choudhury S., Zachman M.J., Wei S., Zhang K., Kourkoutis L.F., Archer L.A. // Joule. 2017. V. 1. P. 394.
Xu R., Xiao Y., Zhang R., Cheng X., Zhao C., Zhang X., Yan C., Zhang Q., Huang J. // Adv. Mater. 2109. V. 31. P. 1808392.
Chen Y., Li C., Ye D., Zhang Y., Bao H., Cheng H. // J. Memb. Sci. 2021. V. 620. P. 118926.
Isken P., Winter M., Passerini S., Lex-Balducci A. // J. Power Sources. 2013. V. 225. P. 157.
Deng K., Zeng Q., Wang D., Liu Z., Qiu Z., Zhang Y., Xiao M., Meng Y. // J. Mater. Chem. A. 2020. V. 8. P. 1557.
He S., Huang S., Zhao Y., Qin H., Shan Y., Hou X. // ACS Appl. Mater. Interfaces. 2021. V. 13. P. 54069.
Istomina A.S., Yaroslavtseva T.V., Reznitskikh O.G., Kayumov R.R., Shmygleva L.V., Sanginov E.A., Dobrovolsky Y.A., Bushkova O.V. // Polymers (Basel). 2021. V. 13. P. 1150.
Voropaeva D.Y., Novikova S.A., Kulova T.L., Yaroslavtsev A.B. // Ionics. 2018. V. 24. P. 1685.
Voropaeva D.Y., Novikova S.A., Kulova T.L., Yaroslavtsev A.B. // Solid State Ionics. 2018. V. 324. P. 28.
Каюмов Р.Р., Шмыглева Л.В., Евщик Е.Ю., Сангинов Е.А., Попов Н.А., Бушкова О.В., Добровольский Ю.А. // Электрохимия. 2021. Т. 57. № 8. С. 507. (Kayumov R.R., Shmygleva L.V., Evshchik E.Y., Sanginov E.A., Popov N.A., Bushkova O.V., Dobrovolsky Y.A. // Russ. J. Electrochem. 2021. V. 57. P. 911.)
Doyle M., Lewittes M.E., Roelofs M.G., Perusich S.A., Lowrey R.E. // J. Memb. Sci. 2001. V. 184. P. 257.
Faridi M., Naji L., Kazemifard S., Pourali N. // Chem. Pap. 2018. V. 72. P. 2289.
Xu M., Hao L., Liu Y., Li W., Xing L., Li B. // J. Phys. Chem. C. 2011. V. 115. P. 6085.
Bae S.-Y., Shin W.-K., Kim D.-W. // Electrochim. Acta. 2014. V. 125. P. 497.
Walker W., Giordani V., Uddin J., Bryantsev V.S., Chase G.V., Addison D. // J. Am. Chem. Soc. 2013. V. 135. P. 2076.
Voropaeva D., Novikova S., Xu T., Yaroslavtsev A. // J. Phys. Chem. B. 2019. V. 123. P. 10217.
Веденяпина М.Д., Кулова Т.Л., Кудряшова Ю.О., Скундин А.М., Малышев О.Р., Глухов Л.М. // Журн. физической химии. 2020. Т. 94. № 6. С. 947. (Vedenyapina M.D., Kulova T.L., Kudryashova Y.O., Skundin A.M., Malyshev O.R., Glukhov L.M. // Russ. J. Phys. Chem. A. 2020. V. 94. P. 1276.)
Kulova T., Skundin A., Chekannikov A., Novikova S., Voropaeva D., Yaroslavtsev A. // Batteries. 2018. V. 5. P. 11.
Berezina N.P., Timofeev S.V., Kononenko N.A. // J. Memb. Sci. 2002. V. 209. P. 10.
Воропаева Д.Ю., Новикова С.А., Ярославцев А.Б. // Успехи химии. 2020. Т. 89. № 10. С. 1132. (Voropaeva D.Y., Novikova S.A., Yaroslavtsev A.B. // Russ. Chem. Rev. 2020. V. 89 P. 1132.)
Sláma I., Malá J. // Chem. Pap. 1988. V. 42. P. 7.
Li H., Shen X., Hua H., Gao J., Wen Z., Wang X., Peng L., Wu D., Zhang P., Zhao J. // Solid State Ionics. 2020. V. 347. P. 115246.
Tolganbek N., Yerkinbekova Y., Kalybekkyzy S., Bake-nov Z., Mentbayeva A. // J. Alloys Compd. 2021. V. 882. P. 160774.
Ghosh S., Charjee U.B., Bhowmik S., Martha S.K. // J. Energy Power Technol. 2021. V. 4. № 1. P. 59.
Jiang L., Wang Q., Li K., Ping P., Jiang L., Sun J. // Sustain. Energy Fuels. 2018. V. 2. P. 1323.
Дополнительные материалы отсутствуют.
Инструменты
Мембраны и мембранные технологии