Микробиология, 2019, T. 88, № 1, стр. 53-61
Характеристика и особенности C1-метаболизма нового грамположительного факультативного метилотрофа Rhodococcus wratislaviensis
Е. Н. Капаруллина a, *, Ю. А. Троценко a, Н. В. Доронина a
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук
Пущино, Россия
* E-mail: lenokap80@gmail.com
Поступила в редакцию 24.04.2018
После доработки 10.09.2018
Принята к публикации 02.10.2018
Аннотация
Из прибрежной зоны Азовского моря выделен факультативно метилотрофный штамм 2AzMo (ВКМ Ac-2782). Изолят представлен аэробными грамположительными неподвижными палочками. Оптимально растет при 1% NaCl, 28°C и pH 7.5 c 1% СH3OH или 0.3% метиламина в качестве источников углерода и энергии. Использует также широкий спектр полиуглеродных субстратов. Секвенирование гена 16S рРНК штамма 2AzMo выявило сходство с представителями рода Rhodococcus: 99.9% с R. wratislaviensis IEGM 1112T (=NCIMB 13082T), 99.4% с R. imtechensis IEGM 940T (=RKJ300T) и 99.2% с R. koreensis IEGM 962T (=DNP505T). Уровень ДНК‒ДНК гомологии штамма 2AzMo с R. wratislaviensis IEGM 1112T (=NCIMB 13082T) составил 76%, что указывает на его принадлежность к данному виду. Однако в отличие от нашего изолята, типовой штамм R. wratislaviensis IEGM 1112T, а также другие родококки (R. imtechensis IEGM 940T, R. koreensis IEGM 962T, R. opacus IEGM 716T), не растут на метаноле и метиламине. Окисление метанола у Rhodococcus wratislaviensis 2AzMo катализируется алкoгольдегидрогеназой, использующей в качестве искусственного акцептора электронов 4-нитрозо-N,N-диметиланилин, тогда как метиламин окисляется метиламиндегидрогеназой и посредством системы ферментов N-метилглутаматного пути. Ассимиляция образующегося формальдегида осуществляется во фруктозобисфосфатальдолазном варианте рибулозомонофосфатного пути С1-метаболизма. Аммоний ассимилируется восстановительным аминированием α-кетоглутарата и посредством глутаматного цикла.
Наземные и морские экосистемы ‒ источники метанола, метиламина и других С1-соединений, которые являются субстратами для специализированной группы аэробных метилотрофных бактерий (Троценко и соавт., 2010). Метанол ‒ широко распространенное соединение, которое образуется в результате деметилирования пектина клеточных стенок при активном росте клеток растений и является основным летучим органическим метаболитом растений, поскольку его эмиссия в атмосферу составляет более 100 Тг/год (Федоров и соавт., 2011). Метанол выделяется при сжигании биомассы, деградации лигнина, в гидротермальных системах морского дна и при вулканической деятельности (Dorokhov et al., 2015). Кроме того, метанол образуется метанотрофными бактериями при окислении метана и является одним из метаболитов архей (Троценко, Хмеленина, 2008; Chistoserdova, Lidstrom, 2013; Chistoserdova, Kalyuzhnaya, 2018; Enzmann et al., 2018). Способностью к метилотрофии обладают не только грамотрицательные, но и грамположительные прокариоты родов Amicilatopsis, Arthrobacter, Mycobacterium, Bacillus. Известно несколько путей окисления метанола. У большинства грамотрицательных бактерий ключевую роль в окислении метанола до формальдегида играют PQQ-кальций зависимые этанол/метанолдегидрогеназы (MxaFI) (Троценко и соавт., 2010). Однако недавно обнаружены метилотрофы, имеющие лантанидсодержащую метанолдегидрогеназу (XoxF) (Vu et al., 2016; Chu, Lidstrom, 2016). У грамположительных факультативных метилотрофов окисление метанола осуществляется либо НАД+-зависимой формой этого фермента (Bacillus me-thanolicus C1) (Dijkhuizen, Arfman, 1990, Hektor et al., 2002), либо метанол: 4-нитрозо-N,N-диметиланилин (НДМА) оксидоредуктазами (никопротеиновыми метанолдегидрогеназами), как у Amicolatopsis methanolica, Mycobacterium gastri MB19 (Van Ophem et al., 1993, Bystrykh et al., 1993). Известно, что у представителей рода Rhodococcus, растущих на этаноле, также функционируют НАД(Ф)+- и НДМА-зависимые алкогольдегидрогеназы (Van Ophem et al., 1993; Schenkels, Duine, 2000), причем НДМА-зависимые ферменты родококков способны окислять как этанол, так и метанол (Пирог и соавт., 2008).
Среди широкого спектра С1-соединений биогенного и абиогенного происхождения можно выделить также метилированныe амины ‒ восстановленные формы органического азота, которые образуются в природе как побочные продукты разложения белков, аминокислот, некоторых алкалоидов, азотсодержащих пестицидов, присутствуют в растительных и животных тканях как естественные продукты азотного обмена. В морской среде метиламин высвобождается при деградации четвертичных аминов, таких как бетаин, карнитин, холин и N-оксид триметиламина, которые используются в качестве осмолитов многими морскими организмами (Nayak et al., 2015; Suleiman et al., 2016). Метиламин может использоваться путем прямого окисления до формальдегида с помощью метиламиндегидрогеназы – (МАДГ) или метиламиноксидазы – (МАО), или через опосредованные пути, включающие перенос метильных групп на аминокислоты (глутамат, аланин или их кетоаналоги) с последующим окислением соответствующих N-метилированных аминокислот. Этот двустадийный механизм получил название N-метилглутаматного (N-МГ) пути (Троценко и соавт., 2010).
Недавно из прибрежной зоны Азовского моря нами был выделен новый факультативный метилотроф, отнесенный к роду Rhodococcus. Метилотрофные представители рода Rhodococcus до сих пор были неизвестны, хотя родококки распространены повсеместно, и уже валидно описаны 63 вида (http:// www.bacterio.cict.fr/qr/rhodococcus.htm). Детальное исследование путей метаболизма метанола и метиламина у нового метилотрофного родококка представляется актуальным.
Цель работы – таксономическая и метаболическая характеристика нового грамположительного факультативного метилотрофа.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. Штамм 2AzMo (ВКМ Ac-2782) был выделен из песка прибрежной зоны Азовского моря (Крым, Россия) (45°27′25.1′′ с.ш., 36°27′59.7′′ в.д.). Навеску песка (5 г) помещали в колбу Эрленмейера (750 мл) с 200 мл среды “К” и 0.5% (об./об.) метанола. Среда “К” содержала (г/л): KH2PO4 – 2.0; (NH4)2SO4 − 2.0; NaCl – 0.5; MgSO4 · 7H2O – 0.1; FeSO4 · 7H2O – 0.002; pH 7.4. Накопительную и чистую культуру получали, как описано ранее (Kaparullina et al., 2017). Чистоту культуры проверяли световой микроскопией, а также по однородности колоний на агаризованных средах “К” с метанолом и Лурия-Бертани. В качестве референтных использовали типовые культуры родококков (R. wratislaviensis IEGM 1112T = NCIMB 13082T, R. imtechensis IEGM 940T = = RKJ300T, R. koreensis IEGM 962T = DNP505T, R. opacus IEGM 716T), любезно предоставленные руководителем коллекции, академиком РАН И.Б. Ившиной (Институт экологии и генетики микроорганизмов УрО РАН г. Пермь).
Изучение культуральных и физиолого-биохимических свойств изолята. Для изучения морфологии и подвижности клеток штамм 2AzMo выращивали на агаризованных средах “К” и Луриа-Бертани (2% агар “Difco”, США). Наличие оксидазы определяли, используя 1% (в./об.) раствор тетраметил-р-фенилендиамин дигидрохлорида. Активность каталазы выявляли, нанося 3%-ый раствор перекиси водорода на штрих культуры, выращенной на агаризованной среде.
Температурный диапазон роста определяли, выращивая культуру в жидкой среде “К” с метанолом в герметично закрытых флаконах на качалке (120 об./мин) при температуре 4‒43°С. Рост изолята при различных значениях концентрации метанола (0.1‒7.0%, об./об.), солености (0‒7% NaCl) и рН исследовали на среде “К”. Значения рН устанавливали добавлением 1 М NaOH и 5 н HCl, оптимум рН определяли по удельной скорости роста штамма при исходных значениях рН 5.0‒10.0 среды.
При изучении способности изолята использовать различные органические соединения в качестве источника углерода и энергии в минеральную среду вместо метанола вносили 0.05‒0.3% (в./об.) испытуемого вещества, инокулировали ночной культурой и инкубировали 14 сут на качалке при оптимальной температуре. Все летучие вещества вносили в количестве 0.5% по объему среды.
Для определения спектра используемых субстратов и выявления некоторых биохимических свойств исследуемого штамма использовали также API тесты (API 20Е, API 20NЕ; “Biomerieux”, Франция), следуя инструкции производителя. Рост в атмосфере метана, дихлорметана или H2/CO2/O2 и чувствительность к антибиотикам анализировали, как описано ранее (Kaparullina et al., 2017). Образование индола из L-триптофана анализировали с реактивом Сальковского (Gordon, Weber, 1951). Калибровочную кривую строили со стандартными растворами индолилуксусной кислоты.
Микроскопия. Изучение морфологии и подвижности клеток в режиме фазового контраста проводили с помощью оптического микроскопа Nikon Eclipse Ci (“Nikon”, Япония), оснащенного камерой ProgRes SpeedXT core5 (“Jenoptik”, Германия).
Энзимологический анализ проводили в бесклеточном экстракте, как описано ранее (Доронина и соавт., 2018). Активность никопротеиновой метанолдегидрогеназы определяли спектрофотометрически по восстановлению 4-нитрозо-N,N- диметиланилина при 440 нм с метанолом в качестве донора электронов (Van Ophemet et al., 1993). Активность ферментов выражали в наномолях потребленного субстрата или образованного продукта за 1 мин в пересчете на 1 мг белка. Количественное определение белка проводили методом Лоури (Lowry et al., 1951).
RAPD-анализ (метод случайной амплификации полиморфной ДНК) проводили, используя праймеры OPQ1, OPQ6 (Balachandar et al., 2008).
MALDI-TOF/MS анализ. Для получения MALDI спектров бактериальных экстрактов использовали MALDI-TOF Autoflex Speed масс-спектрометр (“Bruker Daltonik GmbH”, Германия), согласно ранее описанной методике (Horneffer et al., 2004).
Выделение и анализ ДНК. ДНК выделяли с использованием набора ZR Fungal/Bacterial DNA MiniPrep (“Zymo Research”, США) в соответствии с рекомендациями фирмы-производителя. Ген 16S рРНК амплифицировали ПЦР, используя универсальные для прокариот праймеры 27f и 1492r (Lane, 1991). Продукты реакции разделяли методом электрофореза в 1%-ом агарозном геле. Выделение и очистку фрагментов ДНК из легкоплавкой агарозы проводили на колонках с использованием набора Zymoclean Gel DNA Recovery Kit (“Zymo Research”, США), согласно инструкции фирмы-производителя. Секвенирование ПЦР-фрагментов проводили с помощью набора реактивов CEQ Dye Terminator Cycle Sequencing kit (“Beckman Coulter”, США) на анализаторе CEQ2000 XL (“Beckman Coulter”, США). Определение Г + Ц состава ДНК и ДНК‒ДНК гибридизацию проводили, как описано ранее (Doronina et al., 2013).
Филогенетический анализ. Предварительный анализ сходства последовательностей гена 16S рРНК проводили по базе данных GeneBank [NCBI] с помощью пакета программ BLAST [http://ncbi.nlm.nih.gov]. Для более точного определения филогенетического положения изолята нуклеотидные последовательности гена 16S рРНК выравнивали c последовательностями референтных штаммов с помощью программы CLUSTAL W (Thompson et al., 1997). Филогенетический анализ выполнен при помощи программы MEGA 5 (Tamura et al., 2011). Филогенетические деревья (филограммы) строили методом присоединения соседей (“neighbor-joining”) (Saitou, Nei, 1987). Статистическую достоверность ветвления оценивали с помощью “bootstrap-анализа” 100 альтернативных филограмм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
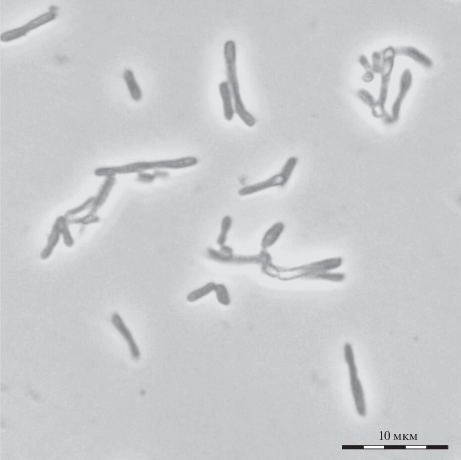
Морфологические, культуральные и физиолого-биохимические свойства изолята. Штамм 2AzMo представлен грамположительными, неподвижными прямыми или ветвящимися палочками (рис. 1). На агаризованной минеральной среде с метанолом колонии желто-коричневые (на среде Лурия-Бертани ‒ кремовые), точечные, с выпуклым профилем, неровным краем и шероховатой поверхностью. Штамм 2AzMo рос в жидкой среде “К” с метанолом или Лурия-Бертани без агрегации клеток и образования пигмента. Строгий аэроб, каталазо- и оксидазоположительный, в витаминах не нуждается. Не рос в атмосфере H2/O2/CO2, метана и дихлорметана. Рост наблюдался на средах с сахарозой, раффинозой, маннитом, аланином, цитратом, инозитом, фруктозой, мальтозой, глюкозой, ацетатом, фенилацетатом, цитратом, глутаматом, сукцинатом, глюконатом, лактозой, малатом, α-кетоглутаратом, пируватом, метиламином, диметиламином, метанолом, этанолом, диметилсульфоксидом, глицерином, формальдегидом, ацетоном, Тween 20, пропанолом, бензолом, гептаном, толуолом. Однако штамм 2AzMo не использовал серин, арабинозу, ксилозу, формиат, ацетамид и триметиламин. Исследуемый штамм не способен к нитратредукции. Не имел активностей лизин- и орнитиндекарбоксилаз, аргининдигидролазы, β-глюко- и β‑галактозидазы. Не гидролизовал желатин, не образовывал сероводород и ацетоин. Уреазоположителен. Синтезировал 6 ± 1 мкг/мл индолпроизводных из L-триптофана. Рос в диапазоне температур 4‒37°C и при рН 4.0‒9.0, оптимально при 28°C и pH 7.5 в присутствии 0.5‒1% метанола и 1% NaCl, но ингибировался 7% NaCl. Чувствителен к гентамицину, стрептомицину, линкомицину, неомицину, тетрациклину, новобиоцину, пенициллину, канамицину, хлорамфениколу, эритромицину и устойчив к оксациллину и налидиксовой кислоте.
Рис. 1.
Морфология клеток штамма 2AzMo, выращенного на метаноле. Фазовый контраст, длина масштабной метки 10 мкм.
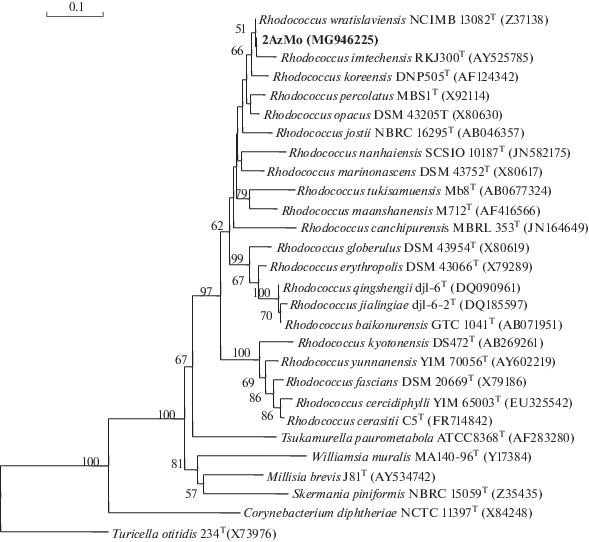
Генотипическая характеристика. Филогенетический анализ нуклеотидных последовательностей гена 16S рРНК показал, что исследуемый штамм 2AzMo имел наибольшее сходство с представителями рода Rhodococcus: 99.9% с R. wratislaviensis IEGM 1112T, 99.4% с R. imtechensis IEGM 940T и 99.2% с R. koreensis IEGM 962T (рис. 2). Поскольку выявлен высокий уровень сходства по 16S рРНК, для определения генотипических различий между штаммом 2AzMo и R. wratislaviensis IEGM 1112T использовали также метод случайно амплифицируемой полиморфной ДНК (RAPD-анализ). Результаты RAPD-анализа показали, что штаммы имеют различные паттерны продуктов амплификации, однако результаты, полученные с использованием MALDI-TOF/MS, выявили идентичность белковых профилей. Наряду с этим, ДНК-ДНК гомология между штаммом 2AzMo и R. wratislaviensis IEGM 1112T составила 76%, что дало основание отнести наш изолят к данному виду.
Рис. 2.
Филограмма, показывающая положение штамма 2AzMo среди представителей рода Rhodococcus и близких родов актинобактерий, по результатам сравнения нуклеотидных последовательностей 16S рРНК. Масштаб соответствует 10 нуклеотидным заменам на каждые 100 нуклеотидов (эволюционным расстояниeм). Корень определен включением последовательности Turicella otitidis 234T (X73976) в качестве внешней группы. Цифрами показана статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа 100 альтернативных деревьев.
Метаболическая характеристика. Результаты энзимологического анализа путей первичного и промежуточного метаболизма клеток R. wratislaviensis 2AzMo, выращенных на метаноле, представлены в табл. 1. В экстрактах клеток не были обнаружены активности классической PQQ-зависимой и НАД+-зависимой метанолдегидрогеназ (МДГ). Вместе с тем выявлено, что исследуемый штамм окислял метанол до формальдегида НДМА-зависимой алкогольдегидрогеназой, использующей в качестве искусственного акцептора электронов НДМА, что, по-видимому, является отличительной чертой этих ферментов у актинобактерий. Однако на основании анализа генома типовой штамм R. wratislaviensis NBRC 100605T (NZ_BAWF01000000) установлено наличие в нем НДМА-зависимой МДГ (WP_037244517). Нами показано, что R. wratislaviensis NBRC 100605T, R. imtechensis IEGM 940T, R. koreensis IEGM 962T, R. opacus IEGM 716T не росли на метаноле и метиламине. По аминокислотным последовательностям НДМА-зависимая метанолдегидрогеназа R. wratislaviensis NBRC 100605T идентична более чем на 90% с таковым ферментом у представителей родов Rhodococcus, Mycobacterium и только на 66% ферментом у Amycolatopsis methanolica (AAF21473). У исследуемого нами штамма 2AzMo выявлены высокие активности дегидрогеназ формальдегида и формиата с искусственным акцептором электронов феназинметосульфатом (ФМС). Энзимологический анализ показал, что в экстрактах клеток отсутствовали активности специфических ферментов серинового и рибулозо-бисфосфатного путей, хотя в геномах некоторых родококков обнаружены последовательности большой субъединицы рибулозо-1,5-бисфосфаткарбоксилазы. Исследуемый штамм реализовал рибулозомонофосфатный путь С1-метаболизма, о чем свидетельствовало наличие активности ключевого фермента этого пути – гексулозофосфатсинтазы (ГФС). Идентичность аминокислотных последовательностей ГФС типового штамма R. wratislaviensis NBRC 100605T (WP_037231807) составляла более 90% с таковыми у штаммов R. opacus (WP_005242427.1), R. jostii (WP_011600601), R. koreensis (WP_072949731) и Rh. erythropolis (WP_094617027). Штамм 2AzMo имел гексокиназу, активную с АТФ и ферменты окислительного пентозофосфатного пути (глюкозо-6-фосфат- и 6-фосфоглюконатдегидрогеназы). Активность альдолазы 2-кето-3-дезокси-6 фосфоглюконата (путь Энтнера‒Дудорова) отсутствовала. Обнаружена активность альдолазы фруктозо-1,6-бисфосфата, следовательно, данный штамм реализовал фруктозобисфосфатальдолазный вариант РМФ-пути. Штамм 2AzMo ассимилировал аммоний восстановительным аминированием α-кетоглутарата и посредством функционирования ферментов глутаматного цикла.
Таблица 1.
Активности ферментов первичного и промежуточного метаболизма в экстрактах клеток штамма R. wratislaviensis 2AzMo, выращенного на метаноле
| Фермент | Кофактор | Активность, нмоль/мин · мг белка* |
|---|---|---|
| Метанолдегидрогеназа | НДМА** | 26 |
| ФМС*** | 0 | |
| НАД+ | 0 | |
| Формальдегиддегидрогеназа | ФМС | 25 |
| НАД+ | 20 | |
| Формиатдегидрогеназа | ФМС | 57 |
| НАД+ | 11 | |
| Гидроксипируватредуктаза | НАДН | 0 |
| НАДФН | 0 | |
| Серин-глиоксилатаминотрансфераза | НАДН | 0 |
| НАДФН | 0 | |
| Гексулозофосфатсинтаза | 112 | |
| Глюкозо-6-фосфатдегидрогеназа | НАД+ | 7 |
| НАДФ+ | 118 | |
| 6-Фосфоглюконатдегидрогеназа | НАД+ | 3 |
| НАДФ+ | 103 | |
| 2-Кето-3-дезокси-6-фосфоглюконатальдолаза | 0 | |
| Фруктозо-1,6-бисфосфатальдолаза | 10 | |
| Рибулозобисфосфаткарбоксилаза | 0 | |
| Гексокиназа | АТФ | 103 |
| Изоцитратдегидрогеназа | НАД+ | 41 |
| НАДФ+ | 9 | |
| Глутаматдегидрогеназа | НАДН | 0 |
| НАДФН | 5 | |
| Глутаматсинтаза | НАДН | 0 |
| НАДФН | 19 | |
| Глутаминсинтетаза | АТФ, Mn2+ | 12 |
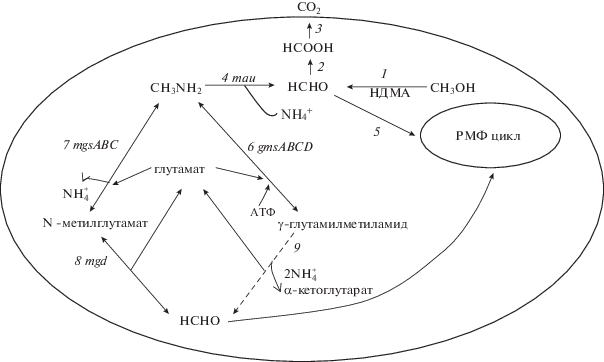
Другим С1-соединением, играющим важную биосферную роль, является метиламин. Результаты энзимологического анализа активностей ферментов путей первичного метаболизма метиламина у исследуемого штамма, выращенного на метиламине, а также на метаноле, представлены в табл. 2. Показано, что R. wratislaviensis 2AzMo реализовал прямой путь окисления метиламина до формальдегида, поскольку имел ФМС-зависимую МАДГ, активность которой в 1.5 раза выше у клеток, выращенных на метиламине, чем на метаноле. Активность другого фермента – оксидазы метиламина ‒ была крайне слабой, что, вероятно, исключает существенный вклад этого пути в окисление метиламина у исследуемого штамма. В геномах некоторых родококков нами выявлены аминдегидрогеназы, аминокислотные последовательности которых лишь на 30‒42% идентичны МАДГ метилотрофных представителей родов Methylopila и Methylobacterium. Обнаружено, что активность НДМА-зависимой алкогольдегидрогеназы с этанолом в клетках, выращенных как на метаноле, так и на метиламине вдвое превышает активность фермента с метанолом (табл. 2). Активность другого фермента метаболизма метиламина, N-метилглутаматдегидрогеназы, катализирующей окислительный распад N-метилглутамата до глутамата и формальдегида, была выше с ФМС, чем c НАД+. Также обнаружена активность N-метилглутаматоксидазы наиболее активной в клетках, выращенных на метиламине. У исследуемого штамма выявили активность γ‑глутамилметиламидлиазы, которая катализирует превращение γ-глутамилметиламида до формальдегида и глутамата. Кроме того, обнаружили высокие активности γ-глутамилметиламидсинтетазы (ГМАС) и N-метилглутаматсинтазы, что свидетельствовало о реализации N-метилглутаматного пути. Поиск гена ГМАС в геномах представителей рода Rhodococcus показал, что, скорее всего, этот фермент аннотирован как глутамат-аммоний лигаза III типа и имеет 43‒45% идентичности по белку ГМАС c представителями рода Methylobacterium. В геноме R. jostii RHA1 обнаружены ферменты ассимиляции триметиламина и диметиламина, а также N-метилглутаматсинтаза, однако непонятно, каким образом может происходить дальнейшее превращение N-метилглутамата у данного штамма. На основании результатов наших исследований представлена схема метаболизма метанола и метиламина у R. wratislaviensis 2AzMo (рис. 3).
Таблица 2.
Активности ферментов в экстрактах клеток штамма R. wratislaviensis 2AzMo, выращенного на метиламине (1) или метаноле (2)
| Фермент | Кофактор | Активность*, нмоль/мин·мг белка |
|
|---|---|---|---|
| 1 | 2 | ||
| Метиламиндегидрогеназа | ФМС | 45 | 27 |
| N-метилглутаматдегидрогеназа | ФМС | 79 | 57 |
| НАД+ | 3 | 1 | |
| Никотинопротеин-метанол дегидрогеназа | НДМА | 21 | 26 |
| Никотинопротеин-этанол дегидрогеназа | НДМА | 55 | 60 |
| Метиламиноксидаза | 5 | 1 | |
| N-метилглутаматоксидаза | 37 | 11 | |
| γ-Глутамилметиламидлиаза | Mn2+ | 50 | Н.о. |
| γ-Глутамилметиламидсинтетаза | АТФ, Mg2+ | 110 | Н.о. |
| N-метилглутаматсинтаза | НАД+ | 321 | Н.о. |
Рис. 3.
Схема окисления метанола и метиламина у Rhodococcus wratislaviensis 2AzMo. 1 – НДМА метанолдегидрогеназа; 2 – формальдегиддегидрогеназа; 3 – формиатдегидрогеназа; 4 – моноаминооксидаза или метиламиндегидрогеназа; 5 – гексулозофосфатсинтаза; 6 – γ-глутамилметиламидсинтетаза; 7 – N-метилглутаматсинтаза; 8 – N- метилглутаматдегидрогеназа; 9 – γ-глутамилметиламидлиаза.
Таким образом, нами впервые представлено доказательство способности родококков к метилотрофии. Исследованные пути метаболизма метанола и метиламина у метилотрофного представителя рода Rhodococcus позволяют раскрыть важную биосферную роль этого микроорганизма и его перспективность в будущем для применения в различных биотехнологиях, в том числе для создания биофильтров и биосенсоров для разложения и детекции поллютантов.
Список литературы
Доронина Н.В., Капаруллина Е.Н., Чемодурова А.А., Троценко Ю.А. Paracoccus simplex sp. nov. – новый факультативный метилотроф, использующий метиламин // Микробиология. 2018. Т. 87. № 5. (в печати).
Doronina N.V., Kaparullina E.N., Chemodurova A.A., Trotsenko Yu.A. Paracoccus simplex sp. nov. ‒ a new facultative methylotroph, utilizing methylamine // Microbiology (Moscow). 2018. V. 87. (In press).
Пирог Т.П., Корж Ю.В., Шевчук Т.А., Тарасенко Д.А. Особенности С2-метаболизма и интенсификация синтеза поверхностно-активных веществ у штамма Rhodococcus erythropolis ЭК-1, растущего на этаноле // Микробиология. 2008. Т. 77. № 6. С. 749‒757.
Pirog T.P., Korzh Yu.V., Shevchuk T.A., Tarasenko D.A. Peculiarities of C2 metabolism and intensification of the synthesis of surface-active substances in Rhodococcus erythropolis EK-1 grown in ethanol // Microbiology (Moscow). 2008. T. 77. C. 665‒673.
Троценко Ю.А., Хмеленина В.Н. Экстремофильные метанотрофы. Отв. ред.:Гальченко В.Ф. Пущино: ОНТИ ПНЦ РАН, 2008. 205 с.
Троценко Ю.А., Доронина Н.В., Торгонская М. Л. Аэробные метилобактерии. Отв. ред.Гальченко В.Ф. Пущино: ОНТИ ПНЦ РАН, 2010. 325 с.
Федоров Д.Н., Доронина Н.В., Троценко Ю.А. Фитосимбиоз аэробных метилобактерий: новые факты и гипотезы // Микробиология. 2011. Т. 80. № 4. С. 435–446.
Fedorov D.N., Doronina N.V., Trotsenko Y.A. Phytosymbiosis of aerobic methylobacteria: New facts and views // Microbiology (Moscow). 2011. T. 80. C. 443‒454.
Balachandar D., Raja P., Sundaram S.P. Genetic and metabolic diversity of pink-pigmented facultative methylotrophs in phyllosphere of tropical plants // Braz. J. Microbiol. 2008. V. 39. P. 68–73.
Bystrykh L.V., Vonck J., Van Bruggen E.F., van Beeumen J, Samyn B., Govorukhina N.I., Arfman N., Duine J.A., Dijkhuizen L. Electron microscopic analysis and structural characterization of novel NADP(H)-containing methanol: N,N'-dimethyl-4-nitrosoaniline oxidoreductases from the gram-positive methylotrophic bacteria Amycolatopsis methanolica and Mycobacterium gastri MB19 // J. Bacteriol. 1993. V. 175. P. 1814‒1822.
Chistoserdova L., Lidstrom M.E. Aerobic methylotrophic prokaryotes // The Prokaryotes / Eds. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin, Heidelberg: Springer, 2013. P. 267–285.
Chistoserdova L., Kalyuzhnaya M.G. Current Trends in Methylotrophy // Trends Microbiol. 2018. pii: S0966-842X(18)30023-4. doi 10.1016/j.tim.2018.01.011
Chu F., Lidstrom M.E. XoxF acts as the predominant methanol dehydrogenase in the type I methanotroph Methylomicrobium buryatense // J. Bacteriol. 2016. V. 198. P. 1317‒1325.
Dijkhuizen L., Arfman N. Methanol metabolism in thermotolerant methylotrophic Bacillus sp. // Microbial growth on C1-compounds / Eds. Andreesen J.R.,Bowien B. FEMS Microbiol. Rev. 1990. V. 87. P. 215–219.
Dorokhov Y.L., Shindyapina A.V., Sheshukova E.V., Komarova T.V. Metabolic methanol: molecular pathways and physiological roles // Physiol. Rev. 2015. V. 95. P. 603‒644.
Doronina N.V., Kaparullina E.N., Trotsenko Y.A. Methylopila musalis sp. nov., an aerobic facultatively methylotrophic bacterium isolated from banana fruit // Int. J. Syst. Evol. Microbiol. 2013. V. 63. P. 1847‒1852.
Enzmann F., Mayer F., Rother M., Holtmann D. Methanogens: biochemical background and biotechnological applications // AMB Express. 2018. V. 8. P. 1‒22.
Gordon S.A., Weber R.P. Colorimetric estimation of indoleacetic acid // Plant Physiol. 1951. V. 26. P. 192–195.
Hektor H.J., Kloosterman H, Dijkhuizen L. Identification of a magnesium-dependent NAD(P)(H)-binding domain in the nicotinoprotein methanol dehydrogenase from Bacillus methanolicus // J. Biol. Chem. 2002. V. 277. P. 46966‒46973.
Horneffer V., Haverkamp J., Janssen H.G., Steeg P.F., Notz R. MALDI-TOF-MS analysis of bacterial spores:wet heat treatment as a new releasing technique for biomarkers and the influence of different experimental parameters and microbiological handling // J. Am. Soc. Mass. Spectrom. 2004. V. 15. P. 1444–1454.
http://www.bacterio.cict.fr/qr/rhodococcus.htm.
Kaparullina E.N., Trotsenko Y.A.,Doronina N.V. Methylobacillus methanolivorans sp. nov., a novel non-pigmented obligately methylotrophic bacterium // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 425‒431.
Lane D.J. 16S/23S rRNA sequencing in nucleic acid techniques in bacterial systematics // Eds. Stackebrandt E., Goodfellow M. Chichester: John Wiley and Sons, 1991. P. 115–175.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the Folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265–275.
Nayak D.D., Marx C.J. Experimental horizontal gene transfer of methylamine dehydrogenase mimics prevalent exchange in nature and overcomes the methylamine growth constraints posed by the sub-optimal N-methylglutamate pathway // Microorganisms. 2015. V. 3. P. 60‒79.
Saitou N., Nei M. The neighbour-joining method: a new method for reconstructing phylogenetic trees // Mol. Biol. Evol. 1987. V. 4. P. 405–425.
Schenkels P., Duine J.A. Nicotinoprotein (NADH-containing) alcohol dehydrogenase from Rhodococcus erythropolis DSM 1069: an efficient catalyst for coenzyme-independent oxidation of broad spectrum of alcohols and interconversion of alcohols and aldehydes // Microbiology (SGM). 2000. V. 146. P. 775–785.
Suleiman M., Zecher K., Yücel O., Jagmann N., Philipp B. Interkingdom cross-feeding of ammonium from marine methylamine-degrading bacteria to the diatom Phaeodactylum tricornutum // Appl. Environ. Microbiol. 2016. V. 82. P. 7113‒7122.
Tamura K., Peterson D., Peterson N., Stecher G., Nei M., Kumar S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods // Mol. Biol. Evol. 2011. V. 28. P. 2731–2739.
Thompson J.D., Gibson T.J., Plewniak F., Jeanmougin, F., Higgins D.G. The ClustalX windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools // Nucl. Acids Res. 1997. V. 25. P. 4876–4882.
Van Ophem P.W., van Beeumen J., Duine J.A. Nicotinoprotein (NAD(P)-containing) alcohol/aldehyde oxidoreductases. Purification and characterization of a novel type from Amycolatopsis methanolica // Eur. J. Biochem. 1993. V. 212. P. 819‒826.
Vu H N., Subuyuj G.A., Vijayakumar S., Good N.M., Martinez-Gomez N.C., Skovran E. Lanthanide-dependent regulation of methanol oxidation systems in Methylobacterium extorquens AM1 and their contribution to methanol growth // J. Bacteriol. 2016. V. 198. P. 1250–1259.
Дополнительные материалы отсутствуют.


