Микробиология, 2019, T. 88, № 1, стр. 19-31
Гексадекан и бактерии-деструкторы: механизмы взаимодействия
И. П. Соляникова a, *, Л. А. Головлёва a
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина Российской академии наук
Пущино, Россия
* E-mail: Innas@ibpm.pushchino.ru
Поступила в редакцию 09.04.2018
После доработки 17.07.2018
Принята к публикации 02.10.2018
Аннотация
В обзоре представлено краткое описание наиболее интересных результатов, полученных при исследовании взаимодействия гидрофобного субстрата, гексадекана, и микробных клеток. Особое внимание уделено трем аспектам этого процесса ‒ (1) взаимодействию бактериальной клетки с гидрофобным субстратом: характеристике клеточной поверхности и конформационным изменениям, происходящим при контакте клетки с нерастворимым субстратом; (2) молекулярным основам разложения гидрофобных соединений на каждом этапе взаимодействия клетки с субстратом: синтезу клеткой диспергирующих компонентов, диспергированию водонерастворимого субстрата, поглощению гидрофобного соединения клеткой и его хранению, регуляции транскрипции генов, как непосредственно вовлеченных в процесс биодеструкции, так и в процессы, взаимосвязанные с ростом на гидрофобных субстратах; (3) синтезу поверхностно-активных веществ бактериями в процессе разложения гидрофобных соединений, разнообразию структуры и условий повышения их выхода, а также биотехнологическому применению.
В настоящее время загрязнение окружающей среды продуктами переработки нефти и ее компонентами представляет одну из самых значительных проблем. Так, по оценкам экспертов, ежегодные потери нефти в результате естественных протечек и как следствие потерь в процессах добычи, переработки и транспортировки достигают 600 тыс. тонн (Kvenvolden, Cooper, 2003). Наиболее серьезные аварии произошли в США в 1989 г. (Exxon Valdez) и в 2010 г. (Petroleum Deepwater Horizon) (Atlas, Hazen, 2011), в Китае в Даляне в июле 2010 г. (Xu et al., 2012). До некоторой степени разложение легких летучих компонентов нефти не представляет собой большой проблемы, хотя нельзя не учитывать относительную устойчивость бензола, толуола, ксилола к микробной деградации и токсичный эффект этих соединений на клетки. На этом фоне разложение более тяжелых фракций нефти может представлять серьезную проблему для человечества и вызывает популяционные изменения в местах, подвергшихся воздействию нефтезагрязнителей. Ряд авторов интерпретируют изменения в микробной экологии, основываясь на данных таксономии и функциональной генетики, а также биологических функциях, выраженных в активности уреазы и дегидрогеназы в почвенных образцах, подвергнутых загрязнениям сырой нефти, дизельного топлива, н-гексадекана и полиароматических углеводородов (ПАУ) (Wu et al., 2014). Одним из последствий этого воздействия отмечается стимулирование активности местной микрофлоры, особенно бактерий, разлагающих алканы, что приводит к убыли этих соединений примерно на 20% за месяц. Особенно наглядно этот эффект проявляется в почвах, загрязненных невысокими концентрациями гексадекана, около 2.5 г/кг сухой почвы. Однако присутствие ПАУ полностью подавляет эту биологическую активность почвы (Wu et al., 2014). Данный обзор посвящен наиболее актуальным направлениям исследований процесса разложения н-алканов (с упором на гексадекан как тестовое соединение) бактериями.
МОРФО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ КЛЕТОК ПРИ АДГЕЗИИ К РАЗЛИЧНЫМ ПОВЕРХНОСТЯМ
Общим свойством всех фракций сырой нефти является их низкая растворимость в воде, что может создавать серьезные проблемы для штаммов, способных использовать подобные гидрофобные соединения в качестве единственного источника углерода и энергии (Cameotra, Singh, 2009). Первым этапом деградации является перенос молекул гидрофобного соединения из гидрофобной фазы на клеточную поверхность для достижения эффективного контакта с клеточной мембраной и дальнейшего переноса через клеточную мембрану внутрь клетки. Несмотря на определенный прогресс в изучении механизмов транспорта н-алканов в клетку и их последующей внутриклеточной ассимиляции, некоторые аспекты этого процесса остаются недостаточно изученными.
Еще в прошлом веке Киршнер описал два возможных типа взаимодействия углеводородов (УВ) с клеткой: (1) адгезию к гидрофобному субстрату и (2) гипотетическую псевдосолюбилизацию, при которой бактерии, разлагающие УВ, поглощают небольшие порции эмульгированной субстанции (Kischner et al., 1980). В настоящее время опубликованы работы, подтверждающие как первую, так и вторую гипотезы (Cameotra, Singh, 2009).
Согласно первой гипотезе, способность разлагать гидрофобные соединения зависит от свойств поверхности микробной клетки (Stenström, 1989; Deziel et al., 1999). Широко распространенная стратегия, используемая бактериями для преодоления проблемы взаимодействия с нерастворимыми субстратами, заключается в формировании биопленки на границе между углеводородами и водой (Klein et al. 2010; Mounier et al., 2014). Klein et al. (2010) сообщили, что разложение гексадекана культурой Marinobacter hydrocarbonoclasticus SP17 происходит за счет образования биопленки на границе алкана и воды. Взаимодействие клеток с алкано-водной фазой исследовалось путем фиксирования изменений механических свойств раздела при адсорбции клеток методом тензиометрии. При помещении клеточной суспензии в тензиометрическую ячейку в присутствии капли н-гексадекана биопленка, окружающая каплю, была видна после 40-часовой инкубации. Было обнаружено, что, достигнув границы раздела гексадекан‒вода, клетки высвобождают поверхностно-активные вещества (ПАВ), что приводит к образованию межфазной вязкоупругой пленки. Выделение этих соединений представляет собой активный процесс, требующий синтеза белка. Было показано, что начальное взаимодействие клетки и гидрофобного соединения не коррелировало со способностью разлагать конкретные алканы, а последующие этапы подвергались дальнейшей регулировке (Klein et al., 2010).
Поскольку превалирует мнение, что для бактерий более физиологично состояние “прикрепленности” к поверхностям, в данном контексте стоит особо отметить несколько работ, отражающих исследования изменения структуры клеток при адгезии к различным поверхностям.
При исследовании особенностей поверхности клеток Escherichia coli, выделенных из проточной воды и осадочных пород, было показано, что клетки штамма из осадочных пород отличались от свободно живущих по гидрофобности (большей), zeta-потенциалу (с более высокой точкой нулевого заряда), поверхностному заряду (менее отрицательному), общей кислотности и составу полимеров внеклеточной субстанции (больше белков и сахаров) (Liang et al., 2016). Авторы обнаружили значительную положительную корреляцию между гидрофобностью и внеклеточными белками у клеток E. coli из осадков, но не у свободно живущего штамма.
Harapanahalli et al. (2015a) указывали на важность состава внеклеточного полимерного матрикса (ВПМ) при адгезии клеток к поверхности, проводя различие между понятиями химического и “механочувствительного” механизмов, относя к последнему комплекс реакций выделения внеклеточной полимерной субстанции при адгезии. Исследуя этапы формирования биопленки культурой Staphylococcus aureus, эти авторы показали влияние адгезии на экспрессию генов icaA, регулирующего выработку компонентов ВПМ, и cidA, ассоциированного с клеточным лизисом и высвобождением внеклеточной ДНК (Harapanahalli et al., 2015b). Из проведенных исследований авто-ры сделали вывод, что сила адгезии модулирует выработку поли-N-ацетилглюкозамина, молекул матрикса, выделение внеклеточной ДНК (в-ДНК) и экспрессию гена icaA, по-видимому, вследствие деформации клеточной стенки. Эти нано-деформации стенки на уровне слоев пептидогликана играют основную роль в определении силы адгезии.
Используя метод атомно-силовой микроскопии (АСМ), Cheng et al. (2011) также исследовали различные факторы, участвующие в адгезии бактерий к поверхности субстратов. Указывая на недостатки термодинамического анализа поверхности, основанного на определении природы адгезивных взаимодействий, таких как взаимодействия Лифшиц-ван-дер-ваальсовые (Lifshitz-van der Waals) и кислотно-основные, авторы приводят обзор данных, полученных с использованием АСМ, основанной на анализе по Пуассону (Poisson analysis). Суммируя литературные данные по различным комбинациям бактериальных штаммов и субстратов, авторы делают заключение, что бактериальная адгезия к субстратам в основном определяется короткими (кислотно-основными) взаимодействиями, и в меньшей степени длинными (Лившица и ван-дер-ваальсовыми) взаимодействиями. Это заключение находится в соответствии с данными анализа поверхностной термодинамики при бактериальной адгезии. По мнению авторов, анализ по Пуассону свидетельствует, что в клеточной адгезии большее значение имеет характеристика дискретных участков бактериальной поверхности, чем отдельные молекулярные взаимодействия. Сила адгезии, возникающая на отдельных участках поверхности, и количество таких участков могут варьировать от штамма к штамму (Chen et al., 2011). Эти же авторы обнаружили микродеформации клеточной поверхности при адгезии бактериальных клеток на твердой поверхности (Chen et al., 2014) и отметили, что адгезия бактерий, являясь одним из важнейших условий их выживания, наблюдается практически ко всем природным и синтетическим поверхностям. Сразу после адгезии бактерии начинают формировать биопленку, в которой они защищены от неблагоприятных воздействий окружающей среды. Изучая с помощью АСМ деформации клеток Staphylococcus aureus дикого и мутантного штаммов, Чен и соавт. сделали заключение, что сила бактериальной адгезии определяется не только составом и структурой бактериальной клеточной поверхности, но и малыми деформациями клеточной поверхности, которые приводят к усилению зоны контакта и, соответственно, возрастанию адгезии (Chen et al., 2014).
Как было указано выше, одним из компонентов структуры биопленок является внеклеточная ДНК (в-ДНК) (Harapanahalli et al., 2015b; Regina et al., 2014). Однако имеется очень мало данных о ее роли в начальной клеточной адгезии. Исследуя влияние в-ДНК на адгезию клеток Staphylococcus xylosus на абиотических поверхностях, Regina и соавт (2014) показали, что удаление в-ДНК клеток S. xylosus обработкой ДНКазой не изменяло их zeta-потенциал, но делало клетки более гидрофильными (Regina et al., 2014). Обработка ДНКазой нарушала адгезию клеток к стеклянной поверхности, при этом в отсутствие ДНКазы адгезивные свойства S. xylosus восстанавливались в течение получаса. Удаление в-ДНК влияло на степень адгезии, но не на ионные взаимодействия. При высокой ионной силе эффект отсутствия в-ДНК не сказывался на адгезии клеток на стекле и карбоксил-активированной поверхности. Авторы также показали, что в-ДНК усиливает адгезию клеток на гидрофобных поверхностях вне зависимости от ионной силы. Проведенные исследования позволили сделать заключение, что свойства в-ДНК как медиатора первоначальной адгезии крайне многообразны и зависят от физико-химических свойств самой поверхности и ионной силы окружающей среды (Regina et al., 2014). Результаты, представленные Klein et al. (2010), показывают, что адсорбция M. hydrocarbonoclasticus SP17 в на границе фаз н-гексадекан‒вода связана с понижением межфазного натяжения. Было обнаружено, что ингибирование синтеза белка предотвращает снижение межфазного натяжения, но не влияет на адсорбцию клеток на границе раздела. Таким образом, адсорбция клеток не оказывает прямого влияния на снижение межфазного натяжения. Более того, когда достигалось равновесие межфазного натяжения, клетки покрывали только 0.3% общей доступной поверхности гексадекана. Был сделан вывод о том, что уменьшение межфазного натяжения, наблюдаемое при адсорбции клеток на границе н-гексадекан‒вода, было вызвано не адсорбцией клеток, а скорее связано с выделяемыми бактериями ПАВ (Klein et al., 2010).
При проверке второй гипотезы в качестве модельного соединения для исследования взаимодействий микробной клетки и гидрофобных соединений использовали гексадекан. Исследования его разложения очень важны, так как он является одним из компонентов нефти и позволяет установить механизмы деструкции УВ и с учетом выявленных особенностей разрабатывать методы очистки окружающей среды от нефтяных загрязнений. Способность разлагать гексадекан характерна для представителей многих классов бактерий, как аэробов, так и анаэробов (табл. 1). На рисунке 1 представлена схема разложения гексадекана штаммом Pseudomonas aeruginosa IASST201, который из 34 проверенных ростовых субстратов при росте на гексадекане синтезировал биофлоккулянт с наивысшей активностью (Pathak et al., 2017).
Рис. 1.
Схема возможных путей деградации н-гексадекана штаммом Pseudomonas aeruginosa IASST201 (Pathak et al., 2017).
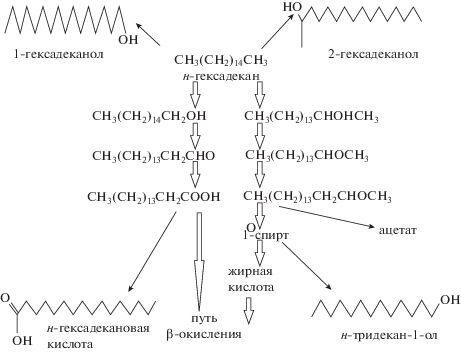
Таблица 1.
Особенности некоторых бактериальных штаммов, способных разлагать гексадекан
| Штамм | Особенности утилизации УВ | Литературный источник |
|---|---|---|
| Acinetobacter beijerinckii ZRS | Продуцент нового внеклеточного эмульсификатора, стабильного в широком диапазоне значений pH, при высокой температуре и высокой концентрации солей (до 5% [в./об.] Na1+ и 24% Ca2+) | Zhao et al., 2016 |
| Acinetobacter sp. штамм DR1 | Исследовано влияние процесса пленкообразования на разложение гексадекана | Kang, Park, 2010 |
| Alcanivorax borkumensis SK2 |
Штамм A. borkumensis способен не только включать, но и модифицировать промежуточные соединения жирных кислот в процессе разложения алканов. Для штамма характерен необычный адаптивный механизм к токсичным органическим растворителям, заключающийся в цис-транс-изомеризации ненасыщенных жирных кислот | Naether et al., 2013 |
| Dietzia штамм DMYR9 | Авторами применена методология поверхностной реакции для статистического проектирования параметров сухого веса для производства биомассы в процессе деградации | Zhou et al., 2013 |
| Gordonia ajoucoccus A2T | Синтез каротиноидов при росте на н-алканах | Kim et al., 2014 |
| Marinobacter hydrocarbonoclasticus SP17 | Обнаружен белок MARHY0478, характерный исключительно для морских бактерий, разрушающих алканы; предположительно входит в семейство алкановых транспортеров, специфичных для морских бактерий | Vaysse et al., 2009 |
| Nocardia farcinica BN26 | Трегалозолипидный тетраэфир обладает антипролиферативной активностью против некоторых клеточных линий опухолей человека | Christova et al., 2015 |
| Pseudomonas aeruginosa PSA5 Rhodococcus sp. NJ2 Ochrobactrum intermedium P2 |
Определена активность алкангидроксилазы, алкогольдегидрогеназы и липазы. Характерен высокий уровень гидрофобности клеточной поверхности. Обнаружены тельца включения, содержащие УВ | Mishra, Singh, 2012 |
| P. aeruginosa NY3 | Определен уровень активности alkB1 и alkB2 генов. Глутаровая кислота значительно увеличивала степень деструкции гексадекана | Nie et al., 2017 |
Разложение линейных алканов в метаногенных условиях является обычным процессом, происходящим в почвах, загрязненных нефтяными продуктами. По данным филогенетического анализа гена 16S р-РНК представители двух филотипов вносят значительный вклад в разложение гексадекана. Один принадлежал к некультивируемым бактериям семейства Syntrophaceae, с 95‒97%-ной гомологией со Smithella propionica, другой был идентифицирован как Methanoculleus receptaculi (>99% идентичности) (Cheng et al., 2013).
Три штамма Acinetobacter sp. не только разлагали гексадекан, но присутствие этого соединения оказывало положительный эффект на разложение данными бактериями фенола, а комбинация фенола и гексадекана приводила к большим скоростям роста штамма на этих субстратах, чем на каждом по отдельности (Sun et al., 2012). Грамотрицательные бактерии рода Acinetobacter являются удобным объектом для исследования, так как, помимо способности разлагать устойчивые токсичные соединения, имеют нитчатые выросты и гидрофобную поверхность клеток, характеризуясь высокой адгезивной способностью к твердым поверхностям и агглютинацией (Hori et al., 2008). Исследование поведения “лысого” мутанта (T1) штамма Acinetobacter sp. Tol 5, лишенного нитчатых выростов, в органическом растворителе, суспендированном в водной среде, показало, что клетки мутанта Т1 прилипают к капелькам гексадекана в виде монослоя на поверхности капли, тогда как клетки дикого типа образуют агрегаты на поверхностях капель. Клетки Т1, адсорбированные на гексадекановых поверхностях, препятствовали слиянию капель, образованных вихревыми потоками, стабилизируя фазу эмульсии. После замены водной фазы свежей чистой водой тест на прикрепление к гидрофобным поверхностям клеток показал, что доля клеток Т1, адсорбированных на поверхности капель углеводородов, отсоединенных во время дальнейшего образования вихревых потоков, указывает на обратимую адсорбцию клеток Т1. Окончательное соотношение прилипающих к каплям УВ клеток к общему числу клеток в тесте отрыва совпало с данными теста на прикрепление (Hori et al., 2008).
На разложение гексадекана штаммом Acinetobacter oleivorans DR1 отрицательно сказывается присутствие хлорида натрия и повышение или понижение оптимальной для роста температуры (Jung et al., 2011). При повышении температуры до 37°С наряду со снижением степени разложения гексадекана наблюдалось ингибирование подвижности клеток и формирования биопленок на границе раздела фаз масло‒вода, что может быть критическим фактором, определяющим способность штамма A. oleivorans DR1 разлагать гексадекан (Jung et al., 2011). Положительная корреляция между формированием биопленок и разложением гексадекана наблюдалась при 30°С, снижение температуры до 25°С нарушало ее. В этих условиях изменение гидрофобности клеток и нарушение синтеза ВПМ под действием температуры не коррелировали с формированием биопленки. Авторы обнаружили, что одним из важных факторов деградации гексадекана являются изменения, происходящие в глиоксилатном метаболическом пути. Как показал протеомный анализ, разложение гексадекана сопровождалось высокой экспрессией белков, участвующих в метаболизме жирных кислот, глюконеогенезе и белков защиты от окислительного стресса. По мнению авторов, полученные данные свидетельствуют о том, что разложение гексадекана у A. oleivorans DR1 сопряжено с начальными этапами формирования биопленки, защитой клеток от окислительного стресса и переключением метаболизма на глиоксилатный путь (Jung et al., 2011).
Большой объем информации посвящен изучению процессов разложения УВ немицелиальными актинобактериями. Показано, что благодаря присутствию миколовых кислот в оболочке Rhodococcus, Gordonia, Mycobacterium и Arthrobacter и коринеформных бактерий, содержащих в клеточной стенке пептидогликан типа B, для них характерна гидрофобность клеточной поверхности, которая обусловливает способность этих бактерий адсорбироваться на тефлоне, стекле и других поверхностях, что коррелирует со способностью разлагать гидрофобные соединения (Bendinger et al., 1993). На примере бактерий рода Rhodococcus показано, что адгезивная способность немицелиальных актинобактерий зависит от внешних факторов, таких как состав среды, уровень хлорида натрия, температура, значение pH среды, что влияет на липидный состав клетки, ее гидрофобность и zeta-потенциал (Рубцова и соавт., 2012).
Способность разлагать гексадекан также показана для штаммов Pseudomonas aeruginosa PSA5, Rhodococcus sp. NJ2 и Ochrobactrum intermedium P2, выделенных из нефтяных осадков (Mishra, Singh, 2012).
МОЛЕКУЛЯРНЫЕ ОСНОВЫ РАЗЛОЖЕНИЯ ГЕКСАДЕКАНА
Информация, касающаяся ферментов разложения длинноцепочечных алканов, особенно у грамположительных бактерий, достаточно ограниченна (Lo Piccolo et al., 2011), хотя аккумуляция данных в последние годы происходит высокими темпами. Это связано с применением молекулярно-биологических методов исследований. Процесс деструкции гексадекана сопровождался индукцией синтеза ферментов алкангидроксилазы и алкогольдегидрогеназы у штамма Rhodococcus sp. NJ2, и липазы у штамма P. aeruginosa PSA5. Особенностью этих бактерий при росте на гексадекане было формирование телец включения, содержащих этот УВ, в концентрации до 60.8 г/л у штамма P. aeruginosa PSA5, 56.1 г/л у Rhodococcus sp. NJ2 и до 51.6 г/л у O. intermedium P2 (Mishra, Singh, 2012). Еще один представитель актинобактерий, штамм R. opacus R7, способен расти на нафталине, о-ксилоле и нескольких длинно- и среднецепочечных н-алканах (Zampolli et al., 2014). При исследовании способности этого штамма разлагать гексадекан и ряд других алканов было показано, что степень разложения н-додекана (C12) составила 88%, н-гексадекана (C16) ‒ 69%, н-эйкозана (C20) ‒ 51%, н-тетракозана (C24) ‒ 78%. Авторы обнаружили, что в случае среднецепочечных н-алканов сначала происходит образование первичного спирта ‒ окисление одной терминальной метильной группы. Этим штамм R. opacus R7 отличался от других родококков, для которых было характерно образование двух спиртовых групп (Zampolli et al., 2014). Система деградации н-алканов была исследована для штамма Gordonia sp. SoCg, способного расти на н-алканах с длиной цепи от C12 (додекан) до C36 (гексатриоконтан) в качестве единственного источника углерода (Lo Piccolo et al., 2011). Авторы обнаружили, что штамм SoCg содержит в своей хромосоме один алк-локус с шестью открытыми рамками считывания (ORF), который имеет 78‒79% идентичности с алкангидроксилазной системой других алканоразрушающих актинобактерий. Количественная обратная транскрипция-ПЦР показала, что гены, кодирующие AlkB (алкан 1-монооксигеназа), RubA3 (rubredoxin), RubA4 (rubredoxin) и RubB (rubredoxin редуктаза), индуцировались как н-гексадеканом, так и н-триаконтаном, которые были выбраны в качестве представителей длинноцепочечных жидких и твердых н-алканов соответственно (Lo Piccolo et al., 2011). Монооксигеназа LadA, катализирующая окисление н-алканов в 1-алканолы, является ключевым ферментом деградации длинноцепочечных алканов (C15‒C36) у штамма Geobacillus thermodenitrificans NG80-2 (Dong et al., 2012). Проведение случайного и сайт-направленного мутагенеза позволило авторам получить ряд мутантов с измененными свойствами монооксигеназы LadA. Было показано, что штамм Pseudomonas fluorescens KOB2Δ1 с мутатным белком LadA рос быстрее дикого штамма. Таким образом, путем изменения одного из ферментов деградации алканов была показана возможность создания штаммов с более высоким потенциалом в целях очистки окружающей среды от нефтезагрязнений.
Ген alkB из Gordonia SoCg был гетерологично экспрессирован в E. coli BL21 и Streptomyces coelicolor M145, и оба хозяина приобрели способность превращать н-гексадекан в 1-гексадеканол, но соответствующий длинноцепочечный спирт не был обнаружен при культивировании штаммов на н-триаконтане. Рекомбинантный штамм S. coelicolor M145-AH, экспрессирующий ген алкоксида из Gordonia, мог расти на н-триаконте в качестве единственного источника углерода. Мутант штамма SoCg с нарушением в гене alkB полностью терял способность расти на н-триаконтане, что указывает на участие системы алканмонооксигеназы AlkB-типа в деградации твердых н-алканов (Lo Piccolo et al., 2011). Помимо штамма Gordonia sp. SoCg (Lo Piccolo et al., 2011), гомологи гена alkB были амплифицированы из психротрофного штамма Rhodococcus sp. Q15 (Whyte et al., 2002) и R. opacus B4 (Sameshima et al., 2008).
Большого внимания заслуживает исследование биодеградации сырой нефти и, соответственно, ее отдельных компонентов бактериями в условиях метаногенеза, так как данная активность приводит к потерям этого природного сырья, с одной стороны, а с другой ‒ позволяет ликвидировать последствия аварийных разливов нефти в анаэробных условиях. Известно, что в анаэробных условиях углеводороды чрезвычайно устойчивы к микробному воздействию, так как для начальной активации и разрыва аполярной C‒H связи надо преодолеть высокий энергетический барьер (Rabus et al., 2016). Как отмечают Рабус и соавт., анаэробная деградация углеводородов включает в себя множество интригующих биохимически беспрецедентных реакций, таких как взаимодействие толуола или н-алканов с фумаратом, O2-независимое гидроксилирование этилбензола и АТФ-зависимые и АТФ-независимые варианты восстановительной деароматизации центрального промежуточного бензоил-СоА (Rabus et al., 2016). Тос и Гииг (Toth, Gieg, 2018) провели работу по установлению механизмов активации углеводородов и идентификации находящихся в месте естественного глубокого залегания нефти микроорганизмов, которые, возможно, способствуют образованию биоразлагаемого масла. Авторы провели мониторинг генов assA и bssA, кодирующих алкилсукцинатсинтазу при разложении алканов и бензилсукцинатсинтазу ‒ алкилбензолов соответственно, а также секвенирование гена 16S рРНК для оценки состава микробного сообщества и изменений активности ферментов в течение 17 мес. Эти гены были выбраны не случайно, так как именно линейные алканы и алкил-замещенные ароматические соединения, как было показано, являются наиболее легко биоразлагаемыми молекулами УВ сырой нефти и других топливных смесей в метаногенных условиях. Было обнаружено образование переходных метаболитов УВ и идентифицированы штаммы, участвующие в этих процессах (Desulfotomaculum, Smithella, Syntrophus, метаногенные археи и представители классов Atribacteria, Cloacimonetes). Результаты этого исследования подтвердили полученные ранее данные, согласно которым добавление фумарата является возможным анаэробным активирующим механизмом для трансформации н-алканов и алкилзамещенных ароматических соединений в метаногенных условиях.
Сравнительный транскриптомный анализ был проведен с использованием клеток штамма Rhodococcus erythropolis PR4, выращенных на гексадекане, дизельном топливе и ацетате (Laczi et al., 2015). Авторы показали увеличение синтеза двух генов, кодирующих алкан-1-монооксигеназу. Наряду с этим при росте клеток на дизельном топливе повышалась транскрипция 8 филогенетически различных генов, кодирующих цитохром P450. При росте R. erythropolis PR4 на синтетической смеси гексадекана, циклопарафина и ароматических соединений наблюдалась индукция генов, кодирующих различные оксигеназы. При этом происходило снижение транскрипции гена, кодирующего синтазуI, участвующую в синтезе жирных кислот, а также генов, участвующих в синтезе сидерофоров, транспорта железа и синтеза экзополисахаридов. Полученные данные указывают на важную роль генов оксигеназ в метаболизме углеводородов.
Транскриптомный профиль генов, участвующих в разложении гексадекана, был исследован у штамма Dietzia cinnamea P4, выделенного из образцов, загрязненных нефтью (Procópio et al., 2013). Аннотирование генома этого штамма позволило выявить гены, участвующие в разложении алканов. Результаты количественной ПЦР в реальном времени однозначно показали, что на ранних стадиях роста штамма D. cinnamea P4 на алканах происходила индукция регуляторного гена alkU (TetR-семейства). В логарифмической фазе роста наблюдалось увеличение уровня транскрипции генов липидного транспорта, а также гена белка, отвечающего за взаимодействие рубредоксина и алканмонооксигеназы, которые, по мнению авторов, также могут находиться под действием регулятора AlkU (Procópio et al., 2013).
С использованием транскриптомного анализа изучали клеточный ответ почвенного штамма Acinetobacter oleivorans DR1, деструктора дизельного топлива и алканов, на внесение гексадекана и механизмы стимулирования разложения гексадекана воздействием красной глины (Jung et al., 2011). Авторы показали, что уровень экспрессии генов, связанных с окислением алканов, был на высоком уровне и без добавления красной глины. Внесение глины в суспензию клеток DR1, разлагающих гексадекан, повышало уровень индукции генов β-окисления и генов, относящихся к защите от окислительного стресса, таких как супероксиддисмутазы, каталазы, глутаредоксина. Это указывало на то, что красная глина поддерживает ответ клеток DR1 на окислительный стресс, возникающий при разложении гексадекана.
Проведенное сравнение данных транскриптомного анализа геномов, полученных из биопленок M. hydrocarbonoclasticus SP17, выращиваемых на н-гексадекане или триолеине, и из планктонных клеток, экспоненциально растущих на ацетате, подтвердили, что рост биопленки на каждом гидрофобном соединении включал различные специфические генетические ответы вместе с набором генов, опосредующих общие механизмы формирования биопленок (Mounier et al., 2014). По данным авторов, рост биопленки на триолеине модулировал экспрессию сотен генов по сравнению с н-гексадеканом. При этом наблюдалось снижением активности процессов, связанных с первичным метаболизмом и обработкой генетической информации.
Таким образом, использование транскриптомного анализа позволяет выявить комплексный ответ клеток на действие гидрофобного соединения как субстрата с учетом не только взаимодействия клетки и субстрата, но и всех опосредованных этим этапом отдаленных последствий.
РОЛЬ БИОПАВ В РАЗЛОЖЕНИИ ГИДРОФОБНЫХ СОЕДИНЕНИЙ
Исследования показали, что важную роль в бактериальной деструкции гидрофобных субстратов играет способность клеток образовывать поверхностно-активные соединения (ПАВ), биосурфактанты (биоПАВ). БиоПАВ представляют собой разнообразную по химическому составу группу соединений. Как правило, их гидрофобная часть представлена длинноцепочечными жирными кислотами, гидроксилированными жирными кислотами или α-алкил-β-гидрокси-жирными кислотами, а гидрофильная часть ‒ углеводами, аминокислотами, пептидами, фосфатами, карбоксикислотами или спиртами (Rosenberg, Ron, 1999). В зависимости от своей химической структуры биоПАВ можно разделить на пять групп: гликолипиды, липопептиды, фосфолипиды, жирные кислоты и полимерные смеси (Rosenberg, Ron, 1999; Mao et al., 2015). Биосурфактанты можно классифицировать как ионные и неионные. Их также подразделяют на низкомолекулярные соединения, снижающие поверхностное натяжение, и высокомолекулярные биоэмульгаторы, которые прочно связываются с поверхностью и не всегда снижают поверхностное натяжение (Rosenberg, Ron, 1999). К наиболее распространенным биоПАВ относятся гликолипиды, состоящие из углеводной головки и липидного хвоста, к ним относят трегалолипиды, софоролипиды и рамнолипиды. Трегалолипиды представляют собой гликолипиды, продуцируемые в основном бактериями родов Mycobacterium, Rhodococcus, Arthrobacter, Nocardia, Gordonia (Rosenberg, Ron, 1999; Christova et al., 2015). К липопептидам относятся сурфактин, грамицидин S и полимиксин (Rosenberg, Ron, 1999). Биосурфактанты микроорганизмов и водорослей, представленные гликолипидами, фосфолипидами, липопептидами, натуральными липидами, жирными кислотами и липополисахаридами, применяются в ряде промышленных производств, таких как пищевая промышленность, фармакология, биоремедиация нефтезагрязненных участков (Paniagua-Michel et al., 2014). Биосурфактанты, обычно используемые для восстановления почвы, включают гликолипиды (например, рамнолипиды, фруктозные липиды, софоролипиды), липопептиды (например, сурфактин, полимиксин) и гуминовые вещества (Mao et al.., 2015). Как наиболее распространенное естественное органическое вещество, гуминовые кислоты (ГК) проявляют амфифильные свойства, которые могут быть использованы в качестве экологически чистых биосурфактантов (Mao et al.., 2015). Роль биоэмульгаторов заключается в увеличении площади поверхности гидрофобных нерастворимых в воде субстратов роста; в повышении биодоступности гидрофобных субстратов за счет увеличения их кажущейся растворимости или десорбирования субстратов с поверхностей, а также регулирования прикрепления и десорбции микроорганизмов с поверхностей (Rosenberg, Ron, 1999). В табл. 2 приведен список некоторых биосурфактантов, синтезируемых бактериями.
Таблица 2.
Биосурфактанты бактериального происхождения
| Класс биосурфактанта | Микробный источник | Литературный источник |
|---|---|---|
| Рамнолипиды | Pseudomonas; Pseudomonas aeruginosa |
Cameotra, Singh, 2009; Arelli et al., 2018 |
| Липопептиды Viscosin, massetolide A, putisolvin, amphisin |
Pseudomonas spp. | Bak et al., 2015 |
| Трегалолипиды (низкомолекулярные, высокомолекулярные) | Rhodococcus sp. Rhodococcus erythropolis EK-1 Nocardia farcinica BN26 |
White et al. 2013; Inaba et al. 2013 Пирог и соавт., 2010 Christova et al., 2015 |
| Эмульгатор, липидный фрагмент которого содержал смесь жирных кислот в молярном соотношении: каприловая кислота 18.85, миристиновая кислота 1.0, пальмитиновая кислота 9.68, пальмитолевая кислота 5.69 и олеиновая кислота 1.26. Полисахаридная часть также содержала смесь сахаров со следующим молярным соотношением: манноза 1.71, галактоза 1.00 и глюкоза 2.96. | Halomonas sp. ANT-3b, антарктическая психротрофная бактерия | Pepi et al., 2005 |
| Комплекс углеводов (41.1%), липидов (47.6%) и белков (11.3%) | Aeribacillus pallidus YM-1 | Zheng et al., 2012 |
| Комплекс белок‒полисахарид‒липид | Methanobacterium thermoautotrophicus | Rosenberg, Ron, 1999 |
| Углевод-белковый комплекс | Bacillus stearothermophilus и Candida lipolytica | Rosenberg, Ron, 1999 |
| Экзополисахариды | Rhodococcus sp. Enterobacter cloacae Paenibacillus spp. |
Urai et al. 2007a, 2007b;
Perry et al. 2007 Hua et al., 2010 Liang, Wang, 2015 |
| Белковый комплекс (биоэмульгатор) | Halomonas eurihalina, Pseudomonas tralucida | Rosenberg, Ron, 1999 |
| Эмульсан (комплекс анионного гетерополисахарида и белка) | Acinetobacter spp. | Rosenberg, Ron, 1999 |
| Комплекс олигосахарида и липида | Paenibacillus sp. | Gudiña et al., 2015 |
| Alasan (комплекс анионного гетерополисахарида и ковалентно связанных аланина и белков) | Acinetobacter radioresistens | Navon-Venezia et al., 1995 |
Известно, что бактерии рода Pseudomonas синтезируют сильнодействующие биосурфактанты, относящиеся к классу липопротеинов, в том числе вискозин, массетолипид А, путизолвин и амфизин (Bak et al., 2015). Действие липопротеинов, синтезируемых псевдомонадами, по эмульсифицирующей способности сопоставимо с действием синтетического ПАВ Tween 80. Cameotra, Singh (2009) исследовали синтез ПАВ и разложение н‑гексадекана штаммом Pseudomonas sp. и показали, что этот штамм, выделенный из почв, загрязненных нефтью, синтезировал ПАВ в виде рамнолипидов, представленных 13 изомерами. Синтез ПАВ позволял культуре эмульгировать гексадекан до размера менее чем 0.22 мкм. Это значительно повышало его доступность для клеток, что было подтверждено микроскопическими исследованиями. Авторы показали, что ПАВ образовывал с гексадеканом эмульсию, что усиливало контакт между этим соединением и клетками штамма-деструктора. Было отмечено поглощение насыщенной биосурфактантами углеводородной капельки, что предполагает механизм, похожий по внешнему виду на активный пиноцитоз, факт, ранее не наблюдавшийся в бактериальных системах для поглощения углеводородов. Таким образом, обсуждаемое исследование проливает свет на механизм поглощения углеводородов у бактерии P. aeruginosa. Синтез ПАВ был показан также и у штаммов P. aeruginosa PSA5, Rhodococcus sp. NJ2 и Ochrobactrum intermedium P2, выделенных из нефтяных осадков, при разложении гексадекана (Mishra, Singh, 2012). Бактерии рода Rhodococcus для снижения поверхностного натяжения и повышения биодоступности гидрофобных соединений синтезируют различные ПАВ: низкомолекулярные трегалолипиды (White et al., 2013; Inaba et al., 2013), высокомолекулярные экзополисахариды (Urai et al., 2007a, 2007b; Perry et al., 2007). При этом концентрация внеклеточных ПАВ может достигать 7 г/л, что было показано для штамма R. erythropolis EK-1, растущего на гексадекане (Пирог и соавт., 2011). Величина поверхностного натяжения минеральной среды с компонентами нефти под действием синтезируемых ПАВ псевдомонад и родококков снижается до значений 26‒36 мН/м (Franzetti et al., 2010; Petrikov et al., 2013). Например, штамм Rhodococcus sp. PLM026 синтезировал трегалолипиды в концентрации до 300 мг/л, что сопровождалось снижением поверхностного натяжения до 29 мН/м (White et al., 2013). Концентрат сукцинилтрегалозолипидов из культуральной жидкости бактерий R. wratislaviensis BN38 и Rhodococcus sp. SD74 снижал поверхностное натяжение до величин 24 и 19 мН/м соответственно (Tuleva et al., 2008; Tokumoto et al., 2009). Величина поверхностного натяжения между н-гексадеканом и суспензией клеток M. hydrocarbonoclasticus SP17 уменьшалась с 38 мН/м до выхода на плато около 18 мН/м за 250 мин культивирования в синтетической морской воде за счет синтеза ПАВ (Klein et al., 2010).
При исследовании влияния монорамнолипида на разложение гексадекана грибом Candida tropicalis было показано, что повышение концентрации монорамнолипида до определенных значений стимулирует разложение гексадекана и оказывает негативное влияние на его деградацию при повышении концентрации до 114 мг/л (Zeng et al., 2011). Возможно, этот эффект связан со снижением биодоступности гексадекана, вызванной образованием мицелл. Авторы отмечают, что присутствие монорамнолипида изменяет свойства клеточной поверхности, что выражается в увеличении ее гидрофобности, снижении zeta-потенциала клеточной поверхности, изменения FT-IR спектра клеточной оболочки (Zeng et al., 2011). Полученные результаты указывают на положительный эффект внесения монорамнолипида на биоремедиацию углеводородов.
В случае, когда синтез биосурфактантов не происходит, может иметь место прямой контакт клеток с капельками углеводородов путем строго-межфазного поглощения углеводородов (Bouchez-Naïtali et al., 2001). Как пример, исследована кинетика разложения гексадекана у 4 штаммов вида Rhodococcus equi, не синтезирующих биосурфактанты (Bouchez-Naïtali et al., 2001). Авторы проводили непрерывное измерение электролитической респирометрии в двухфазной системе, в которой гидрофобной фазой были гексадекан или раствор гексадекана в нетоксичном, но не разлагаемом растворителе, 2,2,4,4,6,8,8-гептаметилнонане, а также силиконовое масло. Удельные скорости роста в короткой экспоненциальной фазе варьировали у штаммов от 0.11 до 0.20 ч‒1 и не зависели от межфазной поверхности в соответствии с очень сильной адсорбцией бактериальных клеток на границе растворителя и водной сред. Скорость деградации при линейном росте не увеличивалась при возрастании межфазной площади, но повышалась при повышении эффективности перемешивания. Эти особенности авторы объясняют формированием многоклеточных хлопьев, обусловленным гидрофобностью клеток штаммов. Хлопьевидный рост наблюдался при росте родококков на гексадекане практически при всех условиях. Результаты показывают, что строгое межфазное поглощение, ограниченное формированием хлопьев, происходящее при умеренной и более высокой плотности клеток и контролируемое эффективностью перемешивания, является общей картиной для роста микроорганизмов, не продуцирующих биосурфактанты, на длинноцепочечных алканах (Bouchez-Naïtali et al., 2001).
Для восстановления загрязненных участков от нефтяных разливов применяют физические, химические или биологические технологии (Agarwa-l, Liu, 2015). Одной из самых быстрых технологий для удаления топливных компонентов и восстановления естественной почвы, осадков или песка считается технология промывки. Однако эффективность данной технологии зависит от использования синтетических ПАВ (Mao et al., 2015). В результате образуются сточные воды, содержащие не только исходный загрязнитель, но и синтетические ПАВ, которые зачастую очень устойчивы к разложению и наносят не меньший вред окружающей среде, чем исходные загрязняющие соединения. Поэтому одним из направлений современной биотехнологии очистки является поиск ПАВ природного происхождения, которые могут служить альтернативой используемым синтетическим ПАВ, благодаря своей высокой биоразлагаемости и меньшей токсичности. В обзорах Paria и Mao и соавт. суммируются данные по применяемым синтетическим и биогенным ПАВ (Paria, 2008; Mao et al., 2015). Авторы отмечают, что биосурфактанты растительного, животного или микробного происхождения могут действовать на гидрофобные загрязнители в качестве поверхностно-активных веществ, то есть путем образования мицелл или усиленного растворения в водных средах без образования мицелл (например, циклодекстрины). Некоторые из этих соединений уже показали свою эффективность, превосходящую или сравнимую с синтетическими поверхностно-активными веществами, такими как Tween 80, Triton X-100 или SDS (Mao et al., 2015). Микробные сурфактанты, рамнолипиды из культур Pseudomonas aeruginosa и софоролипиды из культур Candida bombicola ATCC 22214, наравне с другими ПАВ биологического и химического происхождения, были протестированы в технологии отмывки песка от загрязнителей (Arelli et al., 2018).
Биофлоккулянт, синтезируемый бактериями P. aeruginosa штамм IASST201, растущими на гексадекане, был протестирован на способность извлекать тяжелые металлы (Pathak et al., 2017). Данный биофлоккулянт состоял из углеводных мономеров и белка в соотношеии 89.4 и 6.2%, соответственно, и удалял ионы тяжелых металлов (Ni2+, Zn2+, Cd2+, Cu2+ и Pb2+) из водных растворов в концентрациях 1‒50 мг/л. Наибольшая активность биофлоккулянта наблюдалась с Ni2+ при эффективности биофлокуляции 79.29 ± 0.12% (Pathak et al., 2017).
Таким образом, биосурфактанты и биоэмульгаторы, вырабатываемые микроорганизмами в определенных условиях культивирования, не только способствуют биодеградации гидрофобных соединений, но, выделенные из культуральной жидкости, могут конкурировать с синтетическими ПАВ, заменяя последние в технологиях очистки окружающей среды от различных загрязнителей.
Анализ литературы, посвященной бактериальному разложению гидрофобных соединений, демонстрирует прогресс, достигнутый в изучении различных аспектов деградации гидрофобных субстратов микроорганизмами. (1) В исследованиях процессов разложения бактериями гидрофобных соединений важное место занимает этап взаимодействия бактериальной клетки с гидрофобным субстратом. В первую очередь это касается характеристик клеточной поверхности. Наиболее интересными результатами можно считать данные о конформационных изменениях, происходящих при контакте клетки с нерастворимым субстратом. (2) В последние годы, благодаря применению таких методов, как транскриптомный анализ, ПЦР в реальном времени, двумерный гель-электрофорез, идет интенсивное накопление информации, касающейся не только молекулярных основ разложения конкретных слаборастворимых или нерастворимых соединений. Комплексная оценка позволяет выявить все этапы взаимодействия клетки и субстрата, непосредственно вовлеченные в процесс биодеструкции, а также процессы, связанные с ростом бактерий на гидрофобных субстратах. (3) Не менее важна информация, касающаяся синтеза поверхностно-активных веществ бактериями в процессе разложения гидрофобных соединений, их разнообразия, структуры и условий повышения их биосинтеза, что позволит заменять синтетические ПАВ биосурфактантами, оказывающими менее токсичное влияние на окружающую среду.
Список литературы
Pirog T.P., Шевчук Т.А., Клименко Ю.А. Интенсификация синтеза поверхностно-активных веществ при культивировании Rhodococcus erythropolis EK-1 на гексадекане // Прикл. биохимия и микробиология. 2010. Т. 46. № 6. С. 651‒658.
Pirog T.P., Shevchuk T.A., Klimenko Iu.A. Intensification of surfactant synthesis in Rhodococcus erythropolis EK-1 cultivated on hexadecane // Appl. Biochem. Microbiol. 2010. V. 46. P. 599‒606.
Пирог Т.П., Игнатенко С.В. Масштабирование процесса биосинтеза поверхностно-активных веществ Rhodococcus erythropolis ЭК-1 на гексадекане // Прикл. биохимия и микробиология. 2011. Т. 47. № 4. С. 436‒442.
Pirog T.P., Ignatenko S.V. Scaling of the process of biosynthesis of surfactants by Rhodococcus erythropolis EK-1 on hexadecane // Appl. Biochem. Microbiol. 2011. V. 47. P. 393‒399.
Рубцова Е.В., Куюкина М.С., Ившина И.Б. Влияние условий культивирования на адгезивную активность родококков к н-гексадекану // Прикл. биохимия и микробиология. 2012. Т. 48. № 5. С. 501‒509.
Rubtsova E.V., Kuiukina M.S., Ivshina I.B. Effect of cultivation conditions on the adhesive activity of rhodococci towards n-hexadecane // Appl. Biochem. Microbiol. 2012. V. 48. P. 452‒459.
Agarwal A., Liu Y. Remediation technologies for oil-contaminated sediments // Mar. Pollut. Bull. 2015. V. 101. P. 483–490.
Arelli A., Nuzzo A., Sabia C., Banat I.M., Zanarolia G., Fava F. Optimization of washing conditions with biogenic mobilizing agents for marine fuel-contaminated beach sands // New Biothech. 2018. V. 43. P. 13–22.
Atlas R.M., Hazen T.C. Oil biodegradation and bioremediation: a tale of the two worst spills in U.S. history // Environ. Sci. Technol. 2011. V. 45. P. 6709‒6715.
Bak F., Bonnichsen L., Jørgensen N.O., Nicolaisen M.H., Nybroe O. The biosurfactant viscosin transiently stimulates n-hexadecane mineralization by a bacterial consortium // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 1475‒1483.
Bendinger B., Rijnaarts H.H., Altendorf K., Zehnder A.J. Physicochemical cell surface and adhesive properties of coryneform bacteria related to the presence and chain length of mycolic acids // Appl. Environ. Microbiol. 1993. V. 59. P. 3973‒3977.
Bouchez-Naïtali M., Blanchet D., Bardin V., Vandecasteele J.P. Evidence for interfacial uptake in hexadecane degradation by Rhodococcus equi: the importance of cell flocculation // Microbiology (SGM). 2001. V. 147. P. 2537‒2543.
Cameotra S.S., Singh P. Synthesis of rhamnolipid biosurfactant and mode of hexadecane uptake by Pseudomonas species // Microb. Cell Fact. 2009. V. 8. P. 16. doi 10.1186/1475-2859-8-16
Chen Y., Busscher H.J., van der Mei H.C., Norde W. Statistical analysis of long- and short-range forces involved in bacterial adhesion to substratum surfaces as measured using atomic force microscopy // Appl. Environ. Microbiol. 2011. V. 77. P. 5065‒5070.
Chen Y., Harapanahalli AK., Busscher H.J., Norde W., van der Mei H.C. Nanoscale cell wall deformation impacts long-range bacterial adhesion forces on surfaces // Appl. Environ. Microbiol. 2014. V. 80. P. 637‒643.
Cheng L., Ding C., Li Q., He Q., Dai L.R., Zhang H. DNA-SIP reveals that Syntrophaceae play an important role in methanogenic hexadecane degradation // PLoS ONE. 2013. V. 8. e 66784. doi 10.1371/journal.pone.0066784
Christova N., Lang S., Wray V., Kaloyanov K., Konstantinov S., Stoineva I. Production, structural elucidation, and in vitro antitumor activity of trehalose lipid biosurfactant from Nocardia farcinica strain // J. Microbiol. Biotechnol. 2015. V. 25. P. 439–447.
Deziel E., Comeau Y., Villemur R. Two-liquid-phase bioreactors for enhanced degradation of hydrophobic/toxic compounds // Biodegradation. 1999. V. 10. P. 219–233.
Dong Y., Yan J., Du H., Chen M., Ma T., Feng L. Engineering of LadA for enhanced hexadecane oxidation using random- and site-directed mutagenesis // Appl. Microbiol. Biotechnol. 2012. V. 94. P. 1019‒1029.
Franzetti A., Gandolfi I., Bestetti G., Smyth T.J.P., Banat I.M. Production and applications of trehalose lipid biosurfactants // Eur. J. Lipid Sci. Technol. 2010. V. 112. P. 617–627.
Gudiña E.J., Pereira J.F., Costa R., Evtuguin D.V., Coutinho J.A., Teixeira J.A., Rodrigues L.R. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil // Microb. Cell Fact. 2015. V. 14. P. 14. doi 10.1186/s12934-015-0197-5
Harapanahalli A.K., Younes J.A., Allan E., van der Mei H.C., Busscher H.J. Chemical signals and mechanosensing in bacterial responses to their environment // PLoS Pathog. 2015a. V. 11. e1005057. doi 10.1371/journal.ppat.1005057
Harapanahalli A.K., Chen Y., Li J., Busscher H.J., van der Mei H.C. Influence of adhesion force on icaA and cidA gene expression and production of matrix components in Staphylococcus aureus biofilms // Appl. Environ. Microbiol. 2015b. V. 81. P. 3369‒3378.
Hori K., Watanabe H., Ishii S., Tanji Y., Unno H. Monolayer adsorption of a “bald” mutant of the highly adhesive and hydrophobic bacterium Acinetobacter sp. strain Tol 5 to a hydrocarbon surface // Appl. Environ. Microbiol. 2008. V. 74. P. 2511‒2517.
Hua X., Wu Z., Zhang H., Lu D., Wang M., Liu Y., Liu Z. Degradation of hexadecane by Enterobacter cloacae strain TU that secretes an exopolysaccharide as a bioemulsifier // Chemosphere. 2010. V. 80. P. 951‒956.
Inaba T., Tokumoto Y., Miyazaki Y., Inoue N., Maseda H., Nakajima-Kambe T., Uchiyama H., Nomura N. Analysis of genes for succinoyl trehalose lipid production and increasing production in Rhodococcus sp. strain SD-74 // Appl. Environ. Microbiol. 2013. V. 79. P. 7082–7090.
Jung J., Noh J., Park W. Physiological and metabolic responses for hexadecane degradation in Acinetobacter oleivorans DR1 // J. Microbiol. 2011. V. 49. P. 208–215.
Kang Y.S., Park W. Contribution of quorum-sensing system to hexadecane degradation and biofilm formation in Acinetobacter sp. strain DR1 // J. Appl. Microbiol. 2010. V. 109. P. 1650‒1659.
Kim J.H., Kim S.H., Yoon J.H., Lee P.C. Carotenoid production from n-alkanes with a broad range of chain lengths by the novel species Gordonia ajoucoccus A2(T) // Appl. Microbiol. Biotechnol. 2014. V. 98. P. 3759‒3768.
Kirscher Z.I., Rosenberg E., Gutnic D. Incorporation of 32P and growth of Pseudomonad UP-2 on n-tetracosane // Ap-pl. Environ. Microbiol. 1980. V. 40. P. 1086‒1093.
Klein B., Bouriat P., Goulas P., Grimaud R. Behavior of Marinobacter hydrocarbonoclasticus SP17 cells during initiation of biofilm formation at the alkane-water interface // Biotech. Bioeng. 2010. V. 105. P. 461–468.
Kvenvolden K.A., Cooper C.K. Natural seepage of crude oil into the marine environment // Geo-Mar. Lett. 2003. V. 23. P. 140–146.
Laczi K., Kis Á., Horváth B., Maróti G., Hegedüs B., Perei K., Rákhely G. Metabolic responses of Rhodococcus erythropolis PR4 grown on diesel oil and various hydrocarbons // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 9745‒9759.
Liang X., Liao C., Thompson M.L., Soupir M.L., Jarboe L.R., Dixon P.M. E. coli surface properties differ between stream water and sediment environments // Front. Microbiol. 2016. V. 7. P. 1732.
Liang T.W., Wang S.L. Recent advances in exopolysaccharides from Paenibacillus spp.: production, isolation, structure, and bioactivities // Mar. Drugs. 2015. V. 13. P. 1847‒1863.
Lo Piccolo L., De Pasquale C., Fodale R., Puglia A.M., Quatrini P. Involvement of an alkane hydroxylase system of Gordonia sp. strain SoCg in degradation of solid n-alkanes // Appl. Environ. Microbiol. 2011. V. 77. P. 1204‒1213.
Mao X, Jiang R, Xiao W, Yu J. Use of surfactants for the remediation of contaminated soils: a review // J. Hazard. Mater. 2015. V. 285. P. 419–435.
Mishra S., Singh S.N. Microbial degradation of n-hexadecane in mineral salt medium as mediated by degradative enzymes // Bioresour. Technol. 2012. V. 111. P. 148‒154.
Mounier J., Camus A., Mitteau I., Vaysse P.J., Goulas P., Grimaud R., Sivadon P. The marine bacterium Marinobacter hydrocarbonoclasticus SP17 degrades a wide range of lipids and hydrocarbons through the formation of oleolytic biofilms with distinct gene expression profiles // FEMS Microbiol. Ecol. 2014. V. 90. P. 816‒831.
Naether D.J., Slawtschew S., Stasik S., Engel M., Olzog M., Wick L.Y., Timmis K.N., Heipieper H.J. Adaptation of the hydrocarbonoclastic bacterium Alcanivorax borkumensis SK2 to alkanes and toxic organic compounds: a physiological and transcriptomic approach // Appl. Environ. Microbiol. 2013. V. 79. P. 4282‒4293.
Navon-Venezia S., Zosim Z., Gottlieb A., Legmann R., Carmeli S., Ron E., Rosenberg E. Alasan, a new bioemulsifier from Acinetobacter radioresistens // Appl. Environ. Microbiol. 1995. V. 61. P. 3240–3244.
Nie H., Nie M., Xiao T., Wang Y., Tian X. Hexadecane degradation of Pseudomonas aeruginosa NY3 promoted by glutaric acid // Sci. Total Environ. 2017. V. 575. P. 1423‒1428.
Paniagua-Michel J.de J., Olmos-Soto J., Morales-Guerrero E.R. Algal and microbial exopolysaccharides: new insights as biosurfactants and bioemulsifiers //Adv. Food Nutr. Res. 2014. V. 73. P. 221‒257.
Paria S. Surfactant-enhanced remediation of organic contaminated soil and water // Adv. Colloid Interface Sci. 2008. V. 138. P. 24–58.
Pathak M., Sarma H.K., Bhattacharyya K.G., Subudhi S., Bisht V., La B., Devi A. Characterization of a novel polymeric bioflocculant produced from bacterial utilization of n-hexadecane and its application in removal of heavy metals // Front. Microbiol. 2017. V. 8. Article 170. doi 10.3389/ fmicb.2017.00170
Pepi M., Cesàro A., Liut G., Baldi F. An antarctic psychrotrophic bacterium Halomonas sp. ANT-3b, growing on n-hexadecane, produces a new emulsyfying glycolipid // FEMS Microbiol. Ecol. 2005. V. 53. P. 157‒166.
Perry M.B., MacLean L.L., Patrauchan M.A., Vinogradov E. The structure of the exocellular polysaccharide produced by Rhodococcus sp. RHA1 // Carbohydr. Res. 2007. V. 342. P. 2223–2229.
Petrikov K.V., Delegan Ya.A., Surin A., Ponamoreva O.N., Puntus I.F., Filonov A.E., Boronin A.M. Glycolipids of Pseudomonas and Rhodococcus oil-degrading bacteria used in bioremediation preparations: Formation and structure // Process Biochemistry. 2013. V. 48. P. 931–935.
Procópio L., de Cassia Pereira e Silva M., van Elsas J.D., Seldin L. Transcriptional profiling of genes involved in n-hexadecane compounds assimilation in the hydrocarbon degrading Dietzia cinnamea P4 strain // Braz. J. Microbiol. 2013. V. 44. P. 633‒641.
Rabus R., Boll M., Heider J., Meckenstock R.U., Buckel W., Einsle O., Ermler U., Golding B.T., Gunsalus R.P., Kroneck P.M., Krüger M., Lueders T., Martins B.M., Musat F., Richnow H.H., Schink B., Seifert J., Szaleniec M., Treude T., Ullmann G.M., Vogt C., von Bergen M., Wilkes H. Anaerobic microbial degradation of hydrocarbons: from enzymatic reactions to the environment // J. Mol. Microbiol. Biotechnol. 2016. V. 26. P. 5‒28.
Regina V.R., Lokanathan A.R., Modrzyński J.J., Sutherland D.S., Meyer R.L. Surface physicochemistry and ionic strength affects eDNA’s role in bacterial adhesion to abiotic surfaces // PLoS ONE. 2014. V. 9. e105033. doi 10.1371/journal.pone.0105033
Rosenberg E., Ron E.Z. High- and low-molecularmass microbial surfactants // Appl. Microbiol. Biotechnol. 1999. V. 52. P. 154–162.
Sameshima Y., Honda K., Kato J., Omasa T., Ohtake H. Expression of Rhodococcus opacus alkB genes in anhydrous organic solvents // J. Biosci. Bioeng. 2008. V. 106. P. 199–203.
Stenström T.A. Bacterial hydrophobicity, an overall parameter for the measurement of adhesion potential to soil particles // Appl. Environ. Microbiol. 1989. V. 55. P. 142‒147.
Sun J.Q., Xu L., Tang Y.Q., Chen F.M., Wu X.L. Simultaneous degradation of phenol and n-hexadecane by Acinetobacter strains // Bioresour. Technol. 2012. V. 123. P. 664‒668.
Tokumoto Y., Nomura N., Uchiyama H., Imura T., Morita T., Fukuoka T., Kitamoto D. Structural characterization and surface-active properties of a succinoyl trehalose lipid produced by Rhodococcus sp. SD-74 // J. Oleo Sci. 2009. V. 58. P. 97–102.
Toth C.R.A., Gieg L.M. Time course-dependent methanogenic crude oil biodegradation: dynamics of fumarate addition metabolites, biodegradative genes, and microbial community composition // Front. Microbiol. 2018. V. 8. P. 2610. doi 10.3389/fmicb.2017.02610
Tuleva B., Christova N., Cohen R., Stoev G., Stoineva I. Production and structural elucidation of trehalose tetraesters (biosurfactants) from a novel alkanothrophic Rhodococcus wratislaviensis strain // J. Appl. Microbiol. 2008. V. 104. P. 1703–1710.
Urai M., Yoshizaki H., Anzai H., Ogihara J., Iwabuchi N., Harayama S., Sunairi M., Nakajima M. Structural analysis of an acidic, fatty acid ester-bonded extracellular polysaccharide produced by a pristane-assimilating marine bacterium, Rhodococcus erythropolis PR4 // Carbohydr. Res. 2007a. V. 342. P. 933–942.
Urai M., Yoshizaki H., Anzai H., Ogihara J., Iwabuchi N., Harayama S., Sunairi M., Nakajima M. Structural analysis of mucoidan, an acidic extracellular polysaccharide produced by a pristaneassimilating marine bacterium, Rhodococcus erythropolis PR4 // Carbohydr. Res. 2007b. V. 342. P. 927–932.
Vaysse P.J., Prat L., Mangenot S., Cruveiller S., Goulas P., Grimaud R. Proteomic analysis of Marinobacter hydrocarbonoclasticus SP17 biofilm formation at the alkane-water interface reveals novel proteins and cellular processes involved in hexadecane assimilation // Res. Microbiol. 2009. V. 160. P. 829‒837.
White D.A., Hird L.C., Ali S.T. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026 // J. Appl. Microbiol. 2013. V. 115. P. 744–755.
Whyte L.G., Smits T.H.M., Labbé D., Witholt B., Greer C.W., van Beilen J.B. Gene cloning and characterization of multiple alkane hydroxylase systems in Rhodococcus strains Q15 and NRRL B-16531 // Appl. Environm. Microbiol. 2002. V. 68. P. 5933–5942.
Wu B., Lan T., Lu D., Liu Z. Ecological and enzymatic responses to petroleum contamination // Environ Sci. Process Impacts. 2014. V. 16. P. 1501‒1509.
Xu H.L., Chen J.N., Wang S.D., Liu Y. Oil spill forecast model based on uncertainty analysis: a case study of Dalian oil spill // Ocean Eng. 2012. V. 54. P. 206‒212.
Zampolli J., Collina E., Lasagni M., Di Gennaro P. Biodegradation of variable-chain-length n-alkanes in Rhodococcus opacus R7 and the involvement of an alkane hydroxylase system in the metabolism // AMB Express. 2014. V. 4. P. 73. doi 10.1186/s13568-014-0073-4
Zhao Y.H., Chen L.Y., Tian Z.J., Sun Y., Liu J.B., Huang L. Characterization and application of a novel bioemulsifier in crude oil degradation by Acinetobacter beijerinckii ZRS // J. Basic Microbiol. 2016. V. 56. P. 184‒195.
Zeng G., Liu Z., Zhong H., Li J., Yuan X., Fu H., Ding Y., Wang J., Zhou M. Effect of monorhamnolipid on the degradation of n-hexadecane by Candida tropicalis and the association with cell surface properties // Appl. Microbiol. Biotechnol. 2011. V. 90. P. 1155‒1161.
Zheng C., Li Z., Su J., Zhang R., Liu C., Zhao M. Characterization and emulsifying property of a novel bioemulsifier by Aeribacillus pallidus YM-1 // J. Appl. Microbiol. 2012. V. 113. P. 44‒51.
Zhou X., Xin Z.J., Lu X.H., Yang X.P., Zhao M.R., Wang L., Liang J.P. High efficiency degradation crude oil by a novel mutant irradiated from Dietzia strain by 12C6+ heavy ion using response surface methodology // Bioresour. Technol. 2013. V. 137. P. 386‒393.
Дополнительные материалы отсутствуют.


