Микробиология, 2019, T. 88, № 1, стр. 83-90
Действие низкочастотного импульсного магнитного поля и низкоинтенсивного лазерного излучения на активность оксидоредуктаз и рост микромицетов – активных деструкторов полимерных материалов
И. О. Макаров a, Д. А. Клюев a, В. Ф. Смирнов a, *, О. Н. Смирнова a, Н. А. Аникина a, Н. В. Дикарева a
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 г. Нижний, Новгород, Россия
* E-mail: biodeg@mail.ru
Поступила в редакцию 13.02.2018
После доработки 04.09.2018
Принята к публикации 02.10.2018
Аннотация
Исследовано действие низкочастотного импульсного магнитного поля и низкоинтенсивного лазерного излучения на мицелиальные грибы, активные биодеструкторы различных полимерных материалов. Установлено, что данные факторы по-разному действуют на споры и вегетативный мицелий грибов. Показано, что действие излучений может как стимулировать, так и ингибировать рост грибов. Исследуемые физические факторы имели дозозависимые эффекты на активность внеклеточных оксидоредуктаз грибов (каталазу, пероксидазу); отмечены как увеличение, так и снижение активности ферментов.
Известно, что микроскопические грибы обладают системами высокоактивных окислительных, гидролитических и других ферментов, осуществляющих разнообразные химические превращения сложных субстратов как природного, так и синтетического происхождения, которые зачастую являются труднодоступными или недоступными для других микроорганизмов.
Деструктивной активности микромицетов придается большое значение в области прикладной микробиологии. Повышение уровня деструктивной активности грибов, особенно актуально при разработке технологий, связанных с утилизацией промышленных отходов и очисткой окружающей среды от загрязнений. Напротив, подавление деструктивной активности микромицетов востребовано в области предотвращения процессов биоповреждений промышленных материалов. В связи с этим большое значение придается исследованию воздействия различных факторов (химических, физических), способных регулировать деструктивную активность грибов.
В последнее время в качестве таких факторов используют электромагнитное излучение, например, низкоинтенсивное лазерное излучение (НИЛИ), магнитные поля (МП) различной природы и интенсивности. В ряде работ было продемонстрировано воздействие магнитных полей различной природы на рост микромицетов, показано запаздывание фазы спороношения и/или полное ингибирование процессов спорообразования, а также морфологические изменения клеток грибов (Быстрова с соавт., 2009; Nagy, Fischl, 2004; Treu, Larnoy, 2016).
В работах Manoliu et al. (2005), Potenza et al. (2012), Касатовой с соавт. (2017) продемонстрировано, что магнитное поле может оказывать как положительный, так и отрицательный эффект на грибные оксидоредуктазы, увеличивая или снижая их активность. Также обнаружено, что эффективность воздействия на микроскопические грибы импульсного магнитного поля выше в сравнении с постоянным и переменным полями (Treu, Larnøy, 2016).
Несмотря на то, что накоплен обширный экспериментальный материал о биологических эффектах электромагнитных полей, понимание механизмов их воздействия на биологические системы до сих пор не достаточны (Бинги, Савин, 2003; Новицкая с соавт., 2006). Не в полной мере исследованы зависимость величин биологических биоэффектов (особенно для микромицетов) от характеристик и режима воздействия электромагнитного поля (Hristov, Perez, 2011).
Хотя воздействие магнитных полей на живые объекты изучено сравнительно подробно, в меньшей степени это касается микроорганизмов, воздействие низкоинтенсивных лазерных излучений на микромицеты практически не затрагивается в современных исследованиях.
Существуют отдельные данные, свидетельствующие о том, что лазерное излучение определенных параметров неоднозначно воздействует на рост и развитие микроорганизмов. В частности, рядом исследователей показан стимулирующий эффект воздействия лазерного излучения красного и инфракрасного спектра (Бочков, Хафизов, 2013), в то время как в других исследованиях отмечен его дозозависимый эффект (Долгова с соавт., 2014) и при определенных параметрах ингибирующее действие (Кунин с соавт., 2012). Анализ имеющейся информации позволяет заключить, что исследований, комплексно рассматривающих воздействие лазерного излучения на микроорганизмы, на данный момент крайне мало.
Известно, что процесс биодеструкции промышленных материалов под воздействием грибов имеет энзиматическую природу. В этом процессе принимают участие такие внеклеточные ферменты, как оксидоредуктазы и гидролазы. Поэтому весьма актуальными являются исследования направленные на регулирование энзиматической активности микромицетов под воздействием различных факторов, в том числе физических.
В связи с вышеизложенным целью настоящего исследования было изучить действие электромагнитного излучения низкочастотного импульсного магнитного поля и низкоинтенсивного лазерного излучения на активность внеклеточных оксидоредуктаз (каталазы, пероксидазы) и на рост ряда мицелиальных грибов – деструкторов промышленных материалов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были следующие штаммы мицелиальных грибов, полученные из Всероссийской коллекции микроорганизмов (ИБФМ РАН, Пущино): Penicillium cyclopium Westling ВКМ F-265, Aspergillus niger van Tieghen ВКМ F-1119, Alternaria alternata (Fr.) Keissler ВКМ F-1120. Эти виды микромицетов являются активными биодеструкторами различных промышленных материалов и хорошими продуцентами экзооксидоредуктаз, в частности каталазы и пероксидазы (Пехташева с соавт., 2012).
Линейную скорость роста микромицетов определяли на агаризованной среде Чапека-Докса следующего состава (г/л): NaNO3 – 2.0; KH2PO4 – 0.74; K2HPO4 – 0.3; KCl – 0.5; MgSO4 · 7Н2О – 0.5; FeSO4 · 7Н2О – 0.01; агар – 20.0; сахароза – 30.0.
Рост биомассы определяли при развитии микромицетов в среде Чапека-Докса без агара.
При оценке активности оксидоредуктаз в состав питательной среды Чапека-Докса без агара в качестве индуктора добавляли сосновые опилки в количестве 10.0 г/л.
В качестве физического фактора, воздействующего на грибы, использовали низкочастотное импульсное электромагнитное поле. Для создания поля использовали источник VL 2 (пачки по 20 импульсов длительностью 227 мкс с амплитудой магнитной индукции 1.5 мТл, следующие с частотой 15 Гц) и применяли генератор фирмы “Electro-Biology Inc.” (USA).
Также для воздействия на микромицеты использовался многомодовый полупроводниковый InGaP/GaAs/InGaAs лазер полоскового типа, изготовленный в НИФТИ ННГУ. Режим работы лазера непрерывный, длина волны генерации 980 нм. Изучали воздействие лазера на двух показателях мощности – 0.3 и 0.7 Вт, диапазон мощности выбран нами для исключения влияния теплового эффекта на объекты исследований.
При определении прироста биомассы и активности экзооксидоредуктаз грибы выращивали в колбах Эрленмейера емкостью 500 мл с 250 мл жидкой питательной среды Чапека-Докса при перемешивании (200 об./мин) и температуре 27 ± 2°С. Время культивирования составляло 10 сут, после чего навески мицелия по 300 мг подвергали воздействию: 1) лазерного излучения, время экспозиции для каждой мощности составляло 5 и 10 мин, и 2) электромагнитного поля, время экспозиции составляло 30, 90, 150 и 210 мин. После облучения мицелий помещали в колбы Эрленмейера на доращивание еще на 10 сут в тех же условиях. Затем определяли прирост биомассы и активность ферментов. Контролем служили варианты, не подвергавшиеся воздействию физических факторов.
Активность экзоферментов (каталазы и пероксидазы) грибов в культуральной жидкости определяли спектрофотометрически на приборе UVmini-1240 (Shimadzu, Япония): каталазную – по убыли Н2О2 при длине волны 240 нм (Li, Shellhorn, 2007), пероксидазную – по окислению n-фенилендиамина при длине волны – 535 нм (Nagaraja et al., 2009). За единицу активности каждого фермента принимали изменение оптической плотности реакционной смеси за 1 мин в пересчете на 1 мг белка.
Линейную скорость роста грибов определяли общепринятым методом (Билай, 1982), измеряя ежедневно в течение 10 сут диаметр колоний грибов, растущих на плотной питательной среде.
Все результаты, полученные не менее, чем в трех независимых экспериментах и не менее, чем в 3–5 повторностях, обрабатывали с помощью программ Statistica 10.0 и Microsoft Excel 2007. Оценку достоверности различий средних значений проводили по критерию Стьюдента для уровня вероятности не менее 95%. В таблицах и на рисунках приведены средние значения всех опытов со стандартными ошибками.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе определяли зависимость линейной скорости роста грибов от времени экспозиций действующих факторов. Известно, что эти показатели используют при оценке воздействия различных неблагоприятных факторов на жизнедеятельность грибов (Билай, 1982).
Анализ результатов по воздействию лазерного излучения на линейную скорость роста (рис. 1) показал, что имел место ингибирующий эффект для Aspergillus niger при всех вариантах воздействия, кроме сильного долговременного (0.7 Вт, 10 мин). Для Penicillium cyclopium ингибирование линейной скорости роста наблюдалось только при слабом кратковременном (0.3 Вт, 5 мин) воздействии. У Alternaria alternata практически не отмечалось изменений скорости роста во всех вариантах воздействия. Активацию роста не наблюдали ни в одном эксперименте.
Рис. 1.
Влияние НИЛИ на линейную скорость роста грибов, в % к контролю. Обозначение: 1 – контроль; 2 – 0.3 Вт, 5 мин; 3 – 0.3 Вт, 10 мин; 4 – 0.7 Вт, 5 мин; 5 – 0.7 Вт, 10 мин.

Действие магнитного поля не приводило к существенному изменению скорости роста гриба Alt. alternata. Незначительное ингибирование роста отмечалось для гриба A. niger при экспозиции 30 и 90 мин. У P. cyclopium, напротив, наблюдалось достоверное увеличение линейной скорости роста при экспозиции длительностью 90 и 150 мин (рис. 2).
Рис. 2.
Влияние МП на линейную скорость роста грибов, в % к контролю. Обозначение: 1 – контроль; 2 – 30 мин; 3 – 90 мин; 4 – 150 мин; 5 – 210 мин.

При сравнении действия МП и НИЛИ на линейную скорость роста грибов можно отметить, что наибольшей устойчивостью к действию исследованных факторов обладал гриб Alt. alternata (показатель роста оставался на уровне контроля при всех вариантах воздействия). В случае A. niger имело место ингибирование скорости роста как при воздействии НИЛИ, так и МП. В опытах с P. cyclopium эти факторы имели различные знаки биоэффекта. Все это позволяет говорить о том, что устойчивость микромицетов к действию физических факторов определяется как их природой и интенсивностью воздействия, так и физиолого-биохимическими особенностями микромицетов. Устойчивость гриба Alt. alternata, относящегося к темноокрашенным грибам, к действию исследованных факторов может быть обусловлено высоким содержанием меланина, как известно, повышающим устойчивость живых организмов к действию различных излучений (Жданова, Василевская, 1988).
Следует отметить, что в настоящее время имеются разрозненные исследования в области воздействия магнитных полей на рост мицелиальных грибов. В частности, в работе Treu, Larnøy (2016) было показано, что переменное магнитное поле способно подавлять рост грибов, участвующих в биоповреждении древесины, а постоянное магнитное поле − стимулировать рост микромицетов. В работе Быстровой (2009), также как и в наших экспериментах, эффект воздействия магнитного поля был неоднозначным: в ряде вариантов имело место снижение скорости роста грибов на 15–17%, а в других, напротив, отмечено увеличение скорости роста до 10%.
Рост мицелиальных грибов при действии на них различных физических и химических факторов можно охарактеризовать не только по скорости увеличения их колоний, но и по приросту биомассы при культивировании в жидкой питательной среде.
Полученные нами результаты свидетельствуют о неоднозначности действия низкоинтенсивного лазерного излучения на прирост биомассы грибов. В опытах с Alt. alternata имело место снижение накопления биомассы при всех вариантах воздействия по сравнению с контролем, в то время как накопление биомассы A. niger снижалось только при слабом кратковременном (0.3 Вт, 5 мин) и сильном долговременном (0.7 Вт, 10 мин) воздействии. Для P. cyclopium ингибирующий эффект показан только при сильном долговременном (0.7 Вт, 10 мин) воздействии, в остальных случаях наблюдалось достоверное повышение прироста биомассы (табл. 1).
Таблица 1.
Действие НИЛИ на прирост биомассы микромицетов в глубинных культурах
| A. niger | Alt. alternata | P. cyclopium | ||||
|---|---|---|---|---|---|---|
| прирост, мг | прирост, % | прирост, мг | прирост, % | прирост, мг | прирост, % | |
| Контроль | 217.5 ± 10.2 | 100 | 317.0 ± 13.3 | 100 | 211.5 ± 10.2 | 100 |
| 0.3 Вт, 5 мин | 169.7 ± 9.4 | 78 | 256.8 ± 10.9 | 81 | 234.8 ± 6.1 | 111 |
| 0.3 Вт, 10 мин | 213.2 ± 12.1 | 98 | 234.6 ± 10.4 | 74 | 253.8 ± 15.5 | 120 |
| 0.7 Вт, 5 мин | 254.5 ± 15.5 | 117 | 279.0 ± 16.7 | 88 | 181.9 ± 12.9 | 86 |
| 0.7 Вт, 10 мин | 158.8 ± 9.9 | 73 | 260.0 ± 12.4 | 82 | 294.0 ± 19.4 | 139 |
Действие МП на прирост биомассы также оказалось неоднозначным. Для P. cyclopium имело место снижение прироста биомассы относительно контроля во всех вариантах опыта (30–210 мин). Для A. niger кратковременное воздействие (30 мин) приводило к увеличению биомассы, а более длительное время экспозиции (150 и 210 мин) ингибировало прирост биомассы A. niger. В случае гриба Alt. alternata имело место достоверное снижение прироста биомассы при 30, 150 и 210 мин экспозиции (табл. 2).
Таблица 2.
Действие МП на прирост биомассы микромицетов в погруженных культурах
| A. niger | Alt. alternata | P. cyclopium | ||||
|---|---|---|---|---|---|---|
| прирост, мг | прирост, % | прирост, мг | прирост, % | прирост, мг | прирост, % | |
| Контроль | 180.0 ± 9.4 | 100 | 185.5 ± 7.5 | 100 | 268.0 ± 12.1 | 100 |
| 30 мин | 319.5 ± 12.2 | 213 | 135.4 ± 6.3 | 73 | 91.1 ± 6.9 | 34 |
| 90 мин | 164.5 ± 6.5 | 103 | 200.3 ± 10.2 | 108 | 123.2 ± 8.6 | 46 |
| 150 мин | 40.5 ± 2.8 | 27 | 161.4 ± 9.4 | 87 | 187.6 ± 7.4 | 70 |
| 210 мин | 70.0 ± 3.7 | 47 | 103.9 ± 8.8 | 56 | 179.6 ± 7.2 | 67 |
Сравнение результатов, представленных в табл. 1 и табл. 2, показывает, что одни и те же дозы воздействия исследуемых физических факторов различным образом влияют на прирост биомассы у разных грибов, что связано с физиолого-биохимическими особенностями каждого вида.
Несовпадение результатов влияния исследуемых нами факторов на линейную скорость роста и прирост биомассы может быть связано с тем, что при оценке линейной скорости роста воздействие оказывалось на споровые формы, тогда как при оценке прироста биомассы − на вегетативные формы грибов. Известно, что в спорах грибов и вегетативном мицелии протекание метаболических процессов различно, вследствие чего грибы, находящиеся на различных стадиях роста, будут по-разному реагировать на действие различных факторов окружающей среды, в т.ч. и физических.
Как уже отмечалось выше, оксидоредуктазы играют важную роль в жизнедеятельности микроорганизмов, в том числе микроскопических грибов. Экстрацеллюлярные ферменты участвуют в метаболизме различных субстратов природного и синтетического происхождения. В частности, в работах (Shah, 2008) и (Аникина, 2016) показано участие каталазы и пероксидазы в деструкции эпоксидных компаундов, стиролов, полистиролов, акрилатов. В связи с этим представляло интерес рассмотреть действие исследуемых факторов на активность вышеуказанных ферментов.
Влияние низкоинтенсивного лазерного излучения на активность каталазы (рис. 3) у A. niger и P. cyclopium было дозозависимым и различным: с увеличением мощности и времени воздействия активность каталазы у A. niger возрастала, у P. cyclopium снижалась. У гриба Alt. alternata активность каталазы снижалась при слабом кратковременном (0.3 Вт, 5 мин) и сильном долговременном (0.7 Вт, 10 мин) воздействии. Активность пероксидазы снижалась у всех объектов (по сравнению с контролем) во всех вариантах воздействий, за исключением P. cyclopium при действии лазерного излучения с мощностью 0.3 Вт длительностью 10 мин (рис. 4). Отметим, что в работах (Manteifel, Karu, 2007) и (Fedoseyeva et al., 1984) при исследовании воздействия низкоинтенсивного лазерного излучения на активность оксидоредуктаз дрожжей были получены результаты, свидетельствующие об увеличении активности при низких дозах воздействия и об ее уменьшении при высоких дозах.
Рис. 3.
Влияние НИЛИ на активность каталазы грибов (в ед./мг белка). Обозначение: 1 – контроль; 2 – 0.3 Вт, 5 мин; 3 – 0.3 Вт, 10 мин; 4 – 0.7 Вт, 10 мин.

Рис. 4.
Влияние НИЛИ на активность пероксидазы грибов (в ед./мг белка). Обозначение: 1 – контроль; 2 – 0.3 Вт, 5 мин; 3 – 0.3 Вт, 10 мин; 4 – 0.7 Вт, 10 мин.

В случае воздействия низкочастнотного магнитного поля (рис. 5, рис. 6) имела место временная дозозависимость активности исследуемых ферментов гриба P. cyclopium. При этом, изменение активности пероксидазы и каталазы под действием электромагнитного поля было неодинаково: с увеличением времени воздействия активность пероксидазы снижалось; максимальное ингибирование каталазы наблюдалось при 30 мин экспозиции, а с увеличением времени воздействия ее активность возрастала. Активность исследуемых экзооксидоредуктаз гриба A. niger под влиянием МП оставалась на уровне контроля во всех вариантах опыта. Активность пероксидазы Alt. alternata возрастала при воздействии слабого низкочастотного импульсного магнитного поля длительностью 90 мин и снижалась при 150 мин, в то время как активность каталазы не имела достоверных различий с контролем при всех вариантах воздействия.
Рис. 5.
Влияние МП на активность каталазы грибов (в ед./мг белка). Обозначение: 1 – контроль; 2 – 30 мин; 3 – 90 мин; 4 – 150 мин.
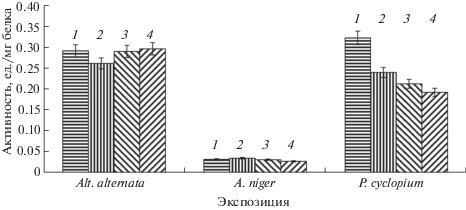
Рис. 6.
Влияние МП на активность пероксидазы грибов (в ед./мг белка). Обозначение: 1 – контроль; 2 – 30 мин; 3 – 90 мин; 4 – 150 мин.

При интерпретации результатов этого блока исследований необходимо отметить работу (Касатова, 2017), в которой также отмечено неоднозначное действие магнитного поля на ферментативную активность гриба Trichoderma virens. После 30- и 90-мин экспозиции активность пероксидазы снижалась, а после 150 мин воздействия – возрастала. Активность каталазы в отличие от наших данных не изменялась при всех воздействиях. Отмеченные различия могут быть связаны со спецификой воздействия магнитного поля, как непосредственно на макромолекулы ферментов, так и на клеточные структуры (Manoliu et al, 2005; Bingi, Rubin, 2007). Изменение активности могло быть обусловлено, как мембранотропным действием МП на клетки грибов, что влияло на выход ферментов в среду культивирования (Watters, Griffiths, 2001), так и непосредственным воздействием МП на активный центр ферментов (Новичкова, Подковкин, 2009).
Такие различия в действии электромагнитных излучений на ферментативную активность грибов могут объясняться их физиолого-биохимическими особенностями, а именно различиями в механизмах адаптации, обеспечивающих их устойчивость или чувствительность к действию физических факторов. Высказанные соображения могут быть подтверждены исследованиями, где при низких дозах воздействия можно наблюдать снижение значений физиолого-биохимических показателей, а затем их возрастание до уровня контроля при более высоких дозах, включающих (индуцирующих) работу адаптационных механизмов.
Таким образом, проведенные исследования показали, что низкочастотное импульсное магнитное поле и низкоинтенсивное лазерное излучение по-разному действует на споры и вегетативный мицелий грибов. Также различные эффекты были отмечены в отношении влияния этих факторов на экстрацеллюлярные каталазу и пероксидазу, которые принимают участие в биодеградации ряда полимерных материалов: имело место, как подавление ферментативной активности, так и ее активация. Наблюдаемое дозозависимое действие исследуемых факторов на жизнедеятельность мицелиальных грибов зависит, как от природы самого фактора, так и от организмов-реципиентов.
Полученные нами результаты могут быть использованы в различных биотехнологических процессах, связанных с жизнедеятельностью мицелиальных грибов, а также при защите различных материалов от биоповреждений и разрушений, вызываемых микромицетами.
Работа выполнена при поддержке стипендии президента Российской Федерации молодым ученым и аспирантам, осуществляющим перспективные научные исследования и разработки по приоритетным направлениям № СП-109.2016.3 и с использованием оборудования ЦКП “Новые материалы и ресурсосберегающие технологии” (ННГУ им. Н.И. Лобачевского).
Список литературы
Билай В.И. Методы экспериментальной микологии. Киев: Наукова думка, 1982. 552 с.
Бинги В.Н., Савин А.В. Физические проблемы действия слабых магнитных полей на биологические системы // Успехи физических наук. 2003. Т. 173. № 3. С. 265–300.
Быстрова Е.Ю., Богомолова Е. В., Гаврилов Ю.М., Панина Л. К., Стефанов В.Е., Сурма С.В., Щеголев Б.Ф. Влияние постоянного магнитного и экранированного геомагнитного полей на развитие колоний микромицетов // Микология и фитопатология. 2009. Т. 43. № 5. С. 438–446.
Долгова Д.Р., Абакумова Т.В., Фомина А.В., Воронова О.С. Функциональное состояние Saccharomyces cerevisiae после фемтосекундного лазерного излучения // Ульяновский медико-биологический журнал. 2014. № 2. С. 58–61.
Жданова Н.Н., Василевская А.И. Меланинсодержащие грибы в экстремальных условиях. Киев: Наукова думка, 1988. 194 с.
Касатова Е.С., Стручкова И.В., Аникина Н.А., Смирнов В.Ф. Действие слабого низкочастотного электромагнитного поля на активность экстрацеллюлярных оксидоредуктаз Trichoderma virens // Микология и фитопатология. 2017. Т. 51 (2). С. 99–103.
Кунин А.А., Коровкина А.Н., Олейник О.И., Мухина Е.Г. Клинико-микробиологическое обоснование применения низкоинтенсивного лазерного излучения в комплексном лечении начальных форм воспалительных заболеваний пародонта // ВНМТ. 2012. № 2. С. 356–358.
Новицкая Г.В., Кочешкова Т.К., Новицкий Ю.И. Влияние слабого постоянного магнитного поля на состав и содержание липидов листьев лука разного возраста // Физиология растений. 2006. Т. 55. № 5. С. 721–781.
Новичкова Е.А., Подковкин В.Г. Анализ действия электромагнитного поля ЛЭП на активность ферментов антиоксидантной защиты в тканях подсолнечника на разных этапах вегетации // Вестник СамГУ. 2009. № 70. С. 183–191.
Пехташева Е.Л., Неверов А.Н., Заиков Г.Е., Стоянов О.В. Биодеструкция и биоповреждения материалов. Кто за это в ответе? // Вестник Казанского технологического университета. 2012. № 8. С. 222–233.
Binhi V.N., Rubin A.B. The fundamental problem magnetobiology // Biomeditsinskie tekhnologii i elektronika. 2007. V. 43. № 5. P. 565−575.
Fedoseyeva G.E., Karu T.I., Letokhov V.S., Lobko V.V., Pomoshnikova N.A., Lyapunova T.S., Meissel M.N. Effect of the He-Ne laser radiation on the reproduction rate and protein synthesis of the yeast // Laser Chemistry. 1984. V. 5. №. 1. P. 27–33.
Hristov J., Perez V.H. Critical analysis of data concerning Saccharomyces cerevisiae free-cell proliferations and fermentations assisted by magnetic and electromagnetic fields // Int. Rev. Chem. Eng. 2011. V. 3. № 1. P. 3–20.
Manoliu A., Oprica L., Olteanu Z., Neacsu I., Rusu I., Creanga D., Bodale I. The magnetosensitivity of some cellulolytic fungi revealed by means of the soluble protein response to electromagnetic field exposure // ANALELE ŞTIINŢIFICE ale Universităţii “Al. I. Cuza” din Iaşi. Biofizică, Fizică medical şi Fizica mediului. 2005. T. 1. P. 77–80.
Manteifel V., Karu T. Prolonged Effects of He-Ne Laser Irradiation on Ultrastructure of Mitochondria in Successive Generations of Yeast Cells // Communicating Current Research and Educational Topics and Trends in Applied Microbiology / Eds. Méndez-Vilas A. Spain: Formatex, 2007. V. 1. P. 21–31.
Nagy P., Fischl G. Effect of static magnetic field on growth and sporulation of some plant pathogenic fungi // Bioelectromagnetics. 2004. V. 25. № 4. P. 316–318.
Potenza L., Saltarelli R., Polidori E., Ceccaroli P., Amicucci A., Zeppa S., Zambonelli A., Stocchi V. Effect of 300 mT static and 50 Hz 0.1 mT extremely low frequency magnetic fields on magnetic Tuber borchii mycelium // Can. J. Microbiol. 2012. V. 58. № 10. P. 1174–1182.
Shah A.A. Biological degradation of plastics: A. Comprehensive review // Biotechnology Advances. 2008. V. 26. P. 246–265.
Treu A., Larnøy E. Impact of a low pulsed electric field on the fungal degradation of wood in laboratory trials // Int. Biodet. Biodeg. 2006. V. 114. P. 244–251.
Watters M.K., Griffiths A. J. F. Teste of a cellular model for constant branch distribution in the filamentous fungus Neurospora crassa // Appl. Environ. Microbiol. 2001. V. 67. P. 1788–1792.
Дополнительные материалы отсутствуют.


