Микробиология, 2019, T. 88, № 1, стр. 62-71
Влияние конститутивной экспрессии гена rapA1 на образование бактериальных биопленок и ростостимулирующую активность ризобий
З. Р. Вершинина a, Л. Р. Хакимова a, А. М. Лавина a, Л. Р. Каримова a, Э. Р. Сербаева b, В. И. Сафронова c, А. И. Шапошников c, Ан. Х. Баймиев a, Ал. Х. Баймиев a, *
a Институт биохимии и генетики – обособленное структурное подразделение ФГБНУ
Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
b ФГБОУ ВО Башкирский государственный университет
Уфа, Россия
c ФГБНУ Всероссийский научно-исследовательский институт
сельскохозяйственной микробиологии
Санкт-Петербург, Россия
* E-mail: baymiev@mail.ru
Поступила в редакцию 26.06.2018
После доработки 03.09.2018
Принята к публикации 02.10.2018
Аннотация
Штаммы ризобий R. leguminosarum Pvu5, VSy12, Thy2, TPr4 и R. galegae 0702 были трансформированы векторной конструкцией pJN105TurboRapA1GFP, обеспечивающей конститутивную экспрессию генов rapA1 и gfp для исследования влияния белка RapA1 на ростостимулирующую активность, образование биопленок и колонизацию корней растений. Показано, что конститутивная экспрессия гена rapA1 повышает эффективность образования биопленок ризобиями на инертных поверхностях и способствует формированию микроколоний на поверхности корней растений. Проведенный анализ выработки ауксинов исходными и трансформированными штаммами показал, что у всех трансформированных штаммов, кроме R. leguminosarum Thy2, наблюдается снижение количества синтезированных ауксинов. Ростостимулирующая активность исходных и трансформированных штаммов не коррелирует с количеством ауксинов, продуцируемых бактериями in vitro.
Клубеньковые бактерии (ризобии), известные как азотфиксирующие микросимбионты бобовых растений, широко используются в качестве основы биопрепаратов в сельском хозяйстве. Огромную роль в выживании этих бактерий в почве и эффективном образовании клубеньков играет способность ризобий колонизировать корни и образовывать биопленки на поверхности корней растений (Fujishige et al., 2006; Amaya-Gómez et al., 2015). Успешное формирование биопленок клубеньковыми бактериями обусловлено целым рядом биотических и абиотических факторов, в том числе ризобиальными экзополисахаридами и Nod-факторами, корневыми экссудатами, pH, температурой и влажностью почвы и другими (Rinaudi, Giordiano, 2010). Несомненно, важную роль на начальных стадиях формирования биопленок играют бактериальные адгезины, которые прикрепляют ризобии к корням. Это позволяет бактериям размножиться в условиях достаточного количества питательных веществ, поставляемых корневыми экссудатами растений. Кроме того, бактериальные адгезины впоследствии обеспечивают стабильность образуемых биопленок (Dardanelli et al., 2003; Russo et al., 2006; Rinaudi, Giordiano, 2010).
Адгезин RapA1, впервые описанный у Rhizobium leguminosarum, относится к внеклеточным белкам, связывающим кальций, и непосредственно принимает участие в колонизации корней растений (Ausmees et al., 2001; Mongiardini et al., 2008; Mongiardini et al., 2009). Ранее было показано, что высокий уровень белков Rap, включая RapA1, в штамме R. leguminosarum 3841 усиливает адгезию этого микросимбионта к корням гороха и способствует повышению числа клубеньков (Frederix et al., 2014). Аналогичные исследования были проведены на растениях фасоли. Было обнаружено, что усиление экспрессии rapA1 в клетках R. leguminosarum PVu5 способствует агрегации бактерий, положительно влияет на образование клубеньков на корнях и, соответственно, на эффективность фиксации азота в целом (Нигматуллина и соавт., 2015). Кроме того, было показано, что тройная симбиотическая система, включающая симбиотрофное растение, его микросимбионт, а также штамм-продуцент белка RapA1, может быть использована при создании эффективных биоудобрений (Хакимова и соавт., 2017).
Хотя ризобии общеизвестны как азотфиксирующие микросимбионты бобовых растений, они могут вступать в ассоциативные взаимоотношения и с небобовыми культурами, такими как рапс, томат, пшеница, рис, подсолнечник, спаржа, колонизируя корни без образования клубеньков и способствуя повышению урожайности за счет различных механизмов, в том числе, защищая растения от фитопатогенных грибов (Вершинина и соавт., 2015).
Для растений томата грибковые заболевания являются основным фактором потери урожая. Благодаря возможности использования ризобий в качестве фунгистатических агентов, их ассоциативным взаимодействиям с растениями томата посвящено достаточно много исследований (Siddiqui et al., 2001; Santillana et al., 2005; Garcia-Fraile et al., 2012; Вершинина и соавт., 2015). Одним из определяющих факторов для формирования успешных симбиотических ассоциаций томата с ризобиями является эффективная (с образованием биопленок) колонизация корней микросимбионтами (Вершинина и соавт., 2015).
Целью работы было получить штаммы ризобий с повышенной экспрессией гена rapA1, изучить их ростостимулирующие свойства на небобовых культурах, исследовать эффективность формирования данными штаммами биопленок на инертных поверхностях и колонизацию корней растений томата обыкновенного сорта Белый налив (Lecopersicum esculentum).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
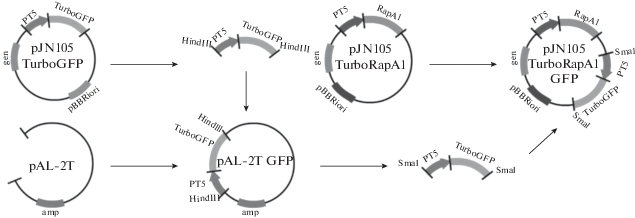
Объекты и материалы исследования. Для получения рекомбинантных штаммов клубеньковых бактерий была использована векторная конструкция pJN105TurboRapA1GFP, созданная на основе полученных ранее векторов pAL-2TGFP и pJN105TurboRapA1 (Нигматуллина и соавт., 2015; Лавина и соавт., 2017). Для этого из плазмиды pAL-2TGFP с помощью рестриктазы SmaI была вырезана последовательность ДНК, содержащая конститутивный промотор фага Т5 и ген GFP. Затем эта последовательность ДНК была клонирована в вектор pJN105TurboRapA1 по сайту рестрикции SmaI (рис. 1).
В качестве объектов были использованы штаммы Rhizobium и Neorhizobium из коллекции клубеньковых и ризосферных бактерий “Симбионт” ИБГ УФИЦ РАН (в скобках указаны растения, из клубеньков которых данные штаммы были выделены):
1. R. leguminosarum Pvu5 (фасоль обыкновенная – Phaseolus vulgaris);
2. R. leguminosarum VSy12 (горошек лесной – Vicia sylvatica);
3. R. leguminosarum Thy2 (клевер розовый, гибридный – Trifolium hybridium);
4. R. leguminosarum TPr4 (клевер луговой – Trifolium pratense);
5. N. galegae (R. galegae) 0702 (козлятник восточный – Galega orientalis).
Филогенетическое положение бактерий было определено с помощью анализа нуклеотидных последовательностей генов 16S рРНК с использованием программы “MegaBlast”.
Работа с ДНК. Выделение бактериальной ДНК, подготовка компетентных клеток и их трансформация, а также электрофорез фрагментов ДНК проводили по Sambrook et al. (1989). Полимеразную цепную реакцию (ПЦР) осуществляли на приборе Терцик МС2 (“ДНК-технология”, Россия) с использованием стандартных наборов для амплификации ДНК (“ДНК-технология”, Россия). Для поиска гена rapA1 были использованы универсальные олигонуклеотидные праймеры, подобранные к кодирующей части гена: rapF (5'-atggctgttcacgcaaccgacgat-3') и rapR (5'-gcggcgggcgttgtttttgattg-3').
Выделение белков из клеток бактерий и Вестерн-блот анализ. Для выделения белков из культуры бактериальных клеток был использован метод, описанный в работе Mongiardini et al. (2008). Перенос белков на PVDF мембрану (“BIO-RAD”, США) для Вестерн-блот анализа проводили согласно методике Towbin et al. (1979) в приборе Mini Trans-Blot® Module 170-3924EDU (“Bio-Rad”, США) при 4°С в течение 1 ч при напряжении 100 V и силе тока 18–22 мА. Для обнаружения белка RapA1 были использованы поликлональные кроличьи антитела, полученные к синтезированной аминокислотной последовательности, соответствующей нуклеотидной последовательности гена rapA1 НПФ “Верта” (Россия). Детекцию первичных связанных с антигеном антител на мембране проводили с помощью вторичных кроличьих антител, меченных пероксидазой хрена HRP Jackson (“Immuno-Research Laboratorie”, США). В качестве хромогена для диагностики был использован DAB (“Cell Marque Corporation”, США).
Оценка накопления биомассы биопленок на инертных поверхностях. Биопленки, которые образуют штаммы на инертных поверхностях, исследовали с применением 96-луночных пластиковых планшетов. Для этого жидкую культуру ризобактерий выращивали в течение 2 сут в стеклянных колбах в жидкой среде YM (масс. % в водном растворе: маннитол – 1, дрожжевой экстракт – 0.04, NaCl – 0.01, MgSO4 – 0.01, K2HPO4 · 3H2O – 0.05) на качалке при 28°С и 140 об./мин до концентрации 108 КОЕ/мл. Затем пипеткой отбирали 10 мкл жидкой культуры, разбавляли 1 : 10 свежей средой YM и помещали в одну из лунок 96-луночного пластикового планшета (полистирол). Планшеты герметизировали лентой Parafilm и инкубировали при 28°С и 140 об./мин в течение 7 сут. После инкубации с помощью пипетки удаляли питательную среду и планктонные клетки. Биопленки промывали стерильной дистиллированной водой и окрашивали 0.1% раствором генциана фиолетового. После инкубации в течение 10–15 мин при комнатной температуре краситель удаляли из лунки. Не связавшийся краситель тщательно смывали дистиллированной водой. Планшеты переворачивали на фильтровальную бумагу и высушивали. Окрашенные лунки микроскопировали с помощью флуоресцентного микроскопа Axio Imager M1 (“Carl Zeiss”, Германия). Для оценки биомассы бактерий связавшийся с биопленками краситель растворяли, добавляя в каждую лунку по 200 мкл этанола. Далее растворы красителя переносили в новый планшет и измеряли оптическую плотность образцов при А590 (l = 0.5 см).
Исследование влияния ризобактерий на развитие корневой системы проростков растений. Ростостимулирующая активность ризобий была исследована на корнях растений томата обыкновенного сорта Белый налив (Lecopersicum esculentum), огурца обыкновенного сорта Апрельский (Cucumis sativus), моркови посевной сорта Тушон (Daucus carota subsp. Sativus) и амаранта багряного сорта Казанский (Amaranthus cruentus). Семена растений стерилизовали в течение 1 мин в 70% спирте, а затем в течение 20 мин в 5% растворе гипохлорита натрия. Далее семена 5 мин выдерживали в суспензии ризобий (1 мл бактериальной суспензии, доведенной до концентрации 105 КОЕ/мл, на 1 г семян). Затем инокулированные семена раскладывали на влажную фильтровальную бумагу в чашки Петри. Часть семян оставили неинокулированными в качестве контроля. Неделю инкубировали при комнатной температуре.
Для определения ростостимулирующего эффекта ризобактерий на корневую систему проростков измеряли длину корня опытных проростков и сравнивали с длиной контрольных проростков.
Оценка способности ризобактерий продуцировать ауксины. Исходные и трансформированные штаммы культивировали в течение 7 сут в жидкой питательной среде MSMN (конечная концентрация бактерий на 7 сут ~109 КОЕ/мл) с добавлением триптофана в качестве предшественника ауксинов согласно методу, описанному в статьях (Jiang et al., 2012; Belimov et al., 2015). Для выделения ауксинов культуральные жидкости и исходные стерильные среды экстрагировали этилацетатом, подкисленным 0.4 Н HCl до рН 3.0. Полученные экстракты выпаривали при 35°C на вакуумном роторном испарителе и растворяли в 0.5 мл 18% ацетонитрила с последующей фильтрацией через нейлоновый мембранный фильтр Spin-X с диаметром пор 0.2 мкм (“Corning”, США). Анализ ауксинов в пробах проводили с помощью системы Waters ACQUITY UPLC H-класса (“Waters”, США) на колонке с обращенной фазой Waters ACQUITY UPLC BEH Shield RP18 (“Waters”, США) с флуоресцентным детектором. Ауксины разделяли 5 мин в линейном градиенте буфера ацетонитрил–вода–уксусная кислота от (1 : 99 : 0.1) до (18 : 82 : 0.1) с последующей 3-минутной изократической элюцией и 3-минутной промывки колонки при соотношении компонентов буфера 80 : 20 : 0.1. Скорость подачи буфера – 0.3 мл/мин.
Исследование характера колонизации бактериями корней растений. Семена томата стерилизовали, как описано выше, и проращивали в течение 1 нед. на влажной фильтровальной бумаге в чашках Петри. Инокуляцию растений проводили согласно методу, описанному в статье Шелудько и соавт. (2010) с небольшими модификациями. Проростки выдерживали при покачивании (25 об./мин) в суспензии ризобий (105 КОЕ/мл) в 50 мМ фосфатносолевом буфере (PBS, рН 7.2). Для приготовления суспензий использовали 2-сут культуры бактерий, выращенных в жидкой среде YM и отмытых от среды PBS. Через 3 ч проростки промывали стерильным PBS и помещали в пробирки, содержащие 10 мл жидкой среды MS (масс. % в водном растворе: соли MS – 0.47, сахароза – 3%, инозитол – 0.01; pH 5.8). Растения выращивали 7 сут при 25°С и естественном освещении. Затем проростки три раза промывали PBS (по 5 мин при покачивании 25 об./мин) и корни нарезали на фрагменты длиной 10–15 мм. Для определения количества адгезированных бактерий фрагменты корней взвешивали и гомогенизировали в 50 мкл жидкой среды YM. Полученный объем разбавляли в 1000 раз, 50 мкл этой суспензии рассевали на агаризованную YM (агар-агар 1.5%) и выращивали в термостате при 28°С в течение 2 сут. Количество адгезированных бактерий определяли по числу выросших колоний. Образование биопленок на поверхности корневых волосков растений определяли с использованием флуоресцентного микроскопа Axio Imager M1 (“Carl Zeiss”, Германия).
Статистическая обработка результатов. Во всех случаях проводили не менее пяти независимых экспериментов как минимум в пяти повторностях. Оценку биомассы биопленок каждого штамма выполняли не менее десяти раз. Каждый раз окрашивали биопленки, сформированные в десяти ячейках полистирольных планшетов. Результаты обрабатывали с использованием пакета Microsoft Office Excel 2010, доверительные интервалы определяли для 95% уровня значимости.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение трансформированных штаммов ризобий и образование биопленок на инертных поверхностях. Методом ПЦР с использованием специфичных праймеров ген rapA1 был выявлен во всех исходных штаммах R. leguminosarum и не обнаружен у N. galegae 0702. Это согласуется с данными работы (Ausmees et al., 2001), где ген rapA1 обнаруживался только у небольшой группы ризобий: R. leguminosarum и R. еtli.
В дальнейшем все исследуемые штаммы: R. leguminosarum Pvu5, R. leguminosarum VSy12, R. leguminosarum Thy2, R. leguminosarum TPr4 и N. galegae 0702 были трансформированы векторной конструкцией pJN105TurboRapA1GFP, обеспечивающей конститутивную экспрессию генов rapA1 и gfp. У трансформированных штаммов не было выявлено никаких изменений фенотипа по сравнению с исходными штаммами, кроме наличия зеленой флуоресцентной метки. Вестерн-блот анализ показал наличие белка RapA1 в трансформированных штаммах и его отсутствие в исходных штаммах (рис. 2). Возможно, отсутствие положительного результата в случае исходных штаммов, содержащих в геноме rapA1, объясняется регулируемой экспрессией данного гена и малым количеством наработки белка, в отличие от конститутивной экспрессии, обеспечиваемой вектором pJN105TurboRapA1GFP.
Рис. 2.
Вестерн-блот анализ продукции белка RapA1 исходными и трансформированными штаммами бактерий: 1 – маркер; 2 – R. leguminosarum Pvu5 + pJN105TurboRapA1GFP; 3 – R. leguminosarum Pvu5; 4 – R. leguminosarum VSy12 + + pJN105TurboRapA1GFP; 5 – R. leguminosarum VSy12; 6 – R. leguminosarum Thy2 + pJN105TurboRapA1GFP; 7 – R. leguminosarum Thy2; 8 – R. leguminosarum TPr4 + pJN105TurboRapA1GFP; 9 – R. leguminosarum TPr4; 10 – R. galegae 0702 + pJN105TurboRapA1GFP; 11 – R. galegae 0702.

Ранее нами было показано, что трансформированные геном rapA1 микросимбионты R. leguminosarum Pvu5 показывают более высокую адгезию к корням макросимбионта – фасоли, способствуют повышению числа образованных азотфиксирующих клубеньков и, как следствие, способствуют увеличению урожайности растений (Нигматуллина и соавт., 2015). Аналогичные результаты были получены на растениях козлятника восточного при трансформации его микросимбинта N. galegae 0702 геном rapA1 (Хакимова и соавт., 2017).
Однако трансформация микросимбионтов R. leguminosarum bv. trifolii R200 и R. etli LP 1003S геном rapA1 не приводила к увеличению количества клубеньков на корнях клевера красного и фасоли обыкновенной соответственно, хотя и увеличивала количество адсорбированных на поверхности корней ризобий. Последнее наблюдалось не только на корнях растений-хозяев, но и в случае использования в экспериментах сои и люцерны. При этом образование биопленок на инертных поверхностях (пластиковых планшетах в частности) для исходных и трансформированных штаммов было одинаковым (Mongiardini et al., 2008).
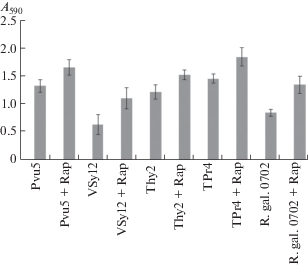
В нашей работе исследование образования биопленок на инертных поверхностях показало, что все трансформированные штаммы образуют более выраженные биопленки по сравнению с дикими штаммами. Различия в относительном количестве биомассы в биопленках показаны на рис. 3. Наибольшую биомассу показал штамм R. leguminosarum TPr4 + rapA1, а наименьшую R. leguminosarum VSy12 + rapA1. Последнее связано с тем, что даже исходный штамм R. leguminosarum VSy12 слабо образует биопленки, в отличие от остальных штаммов. Удивителен тот факт, что rapA1 усиливает образование биопленок N. galegae 0702, хотя данный ген выделен из штаммов R. leguminosarum. Несмотря на результаты более ранних работ, показавших, что rapA1 можно использовать для повышения эффективности образования клубеньков N. galegae (Хакимова и соавт., 2017), тот факт, что конститутивная экспрессия rapA1 в N. galegae приводит к более эффективному формированию биопленок, открывает новые перспективы для использования этого штамма при создании искусственных симбиотических систем с небобовыми растениями.
Рис. 3.
Относительная биомасса биопленок исходных и трансформированных штаммов бактерий после 7 сут культивирования. А590 – оптическая плотность кристаллического фиолетового, десорбированного после окрашивания биопленок, образованных на пластиковых планшетах.
Возможно, положительные результаты по образованию биопленок на инертных поверхностях, полученные в настоящей работе, объясняются использованием вектора широкого круга хозяев pJN105 и сильного конститутивного промотора фага Т5. Ранее в работах, где не было получено значимых различий в формировании биопленок на инертных поверхностях между исходными и трансформированными rapA1 штаммами, были использованы плазмида pRK404A и лактозный оперон (Ausmees et al., 2001; Mongiardini et al., 2008).
Исследование влияния ризобактерий на развитие корневой системы проростков растений. Штаммы R. leguminosarum Pvu5, VSy12, Thy2, TPr4 и N. galegae 0702 изначально были отобраны из коллекции “Симбионт”, как обладающие выраженной ростостимулирующей активностью. При постановке экспериментов в рамках настоящей работы все исходные штаммы стимулировали рост корней проростков огурца. При этом R. leguminosarum VSy12 стимулировал также рост корней проростков томата и амаранта, а R. leguminosarum Pvu5 и N. galegae 0702 – только амаранта; и ни один штамм не проявлял ростостимулирующую активность по отношению к корням моркови (рис. 4).
Рис. 4.
Исследование влияния исходных и трансформированных штаммов бактерий на рост корней растений (мм).
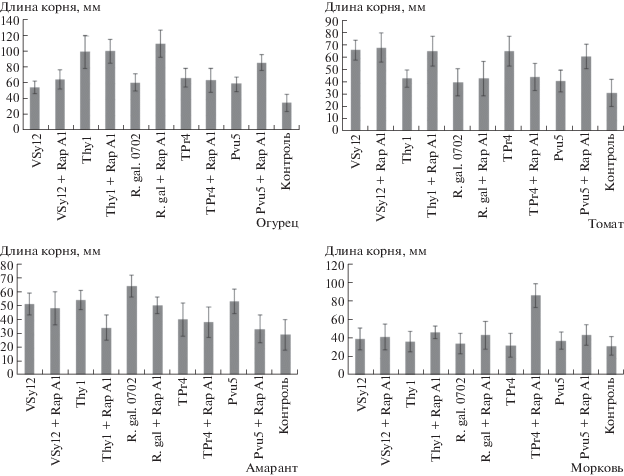
Влияние конститутивной экспрессии гена ra-pA1 в трансформированных штаммах на стимуляцию роста корней растений оказалось неоднозначным. В частности, трансформированный N. galegae оказался в два раза эффективнее, чем исходный штамм, для проростков растений огурца. Небольшое усиление роста корней этого растения наблюдалось также при использовании трансформированного штамма R. leguminosarum Pvu5. В экспериментах с проростками томата проявили ростостимулирующую активность по отношению к корням растений трансформированные rapA1 штаммы R. leguminosarum Thy2, R. leguminosarum TPr4, R. leguminosarum Pvu5, хотя в исходных штаммах подобной активности не наблюдалось. Штамм R. leguminosarum TPr4 + rapA1 единственный проявил ростостимулирующую активность по отношению к корням растений моркови. Однако наблюдались и отрицательные результаты, когда трансформированные штаммы проявляли себя хуже, чем исходные: например, R. leguminosarum TPr4 на растениях томата и R. leguminosarum Thy2, R. leguminosarum Pvu5, N. galegae 0702 на растениях амаранта.
Известна способность многих штаммов ризобий синтезировать ауксины, в частности индолилуксусную кислоту (ИУК), индолилмасляную кислоту (ИМК) и индолилкарбоновую кислоту (ИКК), что непосредственно может стимулировать развитие корневой системы растений, вызывая увеличение массы и размера корней, а также количества боковых отростков (Dazzo, Yanni, 2006). Например, было показано, что инокуляция риса бактериями R. leguminosarum bv. trifolii повышает сухую массу растений и количество зерен, увеличивает содержание N, P, K, и Fe в растительных тканях. Все эти эффекты связаны с аккумуляцией в ризосфере ИУК, физиологическими изменениями в корневой системе и последующим улучшением питания (Biswas et al., 2000).
В настоящей работе были проведены эксперименты по определению способности исходных и трансформированных штаммов продуцировать ауксины. Результаты этих экспериментов представлены в табл. 1. Стоит отметить, что практически все штаммы продуцируют небольшое количество ауксинов, что, вероятнее всего, оказывает влияние на результаты экспериментов по их ростостимулирующей активности. Однако в случае трансформированных штаммов эксперименты показали снижение выработки ауксинов. Наиболее отчетливо оно проявляется для штаммов N. galegae 0702 и R. leguminosarum Pvu5, чем, вероятно, объясняется ухудшение ростостимулирующей активности данных бактерий после трансформации по отношению к корням проростков амаранта. Возможно, снижение биосинтеза ауксинов связано с метаболическими потерями, которые вызваны генетическими манипуляциями с бактериями. Повышение ростостимулирующей активности этих штаммов после трансформации по отношению к корням проростков огурца и томата, вероятно, не связано с ауксинами и требует дальнейшего изучения. Единственным штаммом, у которого после трансформации усилилась выработка ауксинов, был R. leguminosarum Thy2, чем, возможно, объясняется появление de novo ростостимулирующей активности по отношению к корням проростков томата.
Таблица 1.
Продуцирование ауксинов исходными и трансформированными штаммами
| Штамм | Продукция фитогормонов, нг/мл | ||
|---|---|---|---|
| ИМК | ИКК | ИУК | |
| R. leguminosarum VSy12 | 4.05 ± 0.25 | 55.20 ± 3.90 | 34.55 ± 2.65 |
| R. leguminosarum Thy2 | 12.20 ± 1.20 | 60.55 ± 1.35 | 26.40 ± 0.70 |
| R. leguminosarum Pvu5 | 9.65 ± 0.75 | 89.85 ± 4.45 | 64.50 ± 3.30 |
| R. leguminosarum TPr4 | 4.45 ± 0.55 | 92.40 ± 2.30 | 25.50 ± 1.20 |
| R. galegae 0702 | 24.80 ± 2.80 | 56.40 ± 3.70 | 77.95 ± 3.05 |
| R. leguminosarum VSy12 pJN105TurboRapA1GFP | 3.75 ± 0.75 | 54.30 ± 4.10 | 37.65 ± 2.35 |
| R. leguminosarum Thy2 pJN105TurboRapA1GFP | 14.35 ± 1.75 | 96.20 ± 5.40 | 28.15 ± 1.25 |
| R. leguminosarum Pvu5 pJN105TurboRapA1GFP | 3.25 ± 0.45 | 14.25 ± 3.25 | 30.90 ± 3.10 |
| R. leguminosarum TPr4 pJN105TurboRapA1GFP | 11.05 ± 1.95 | 96.00 ± 8.10 | 9.35 ± 0.45 |
| R. galegae 0702 pJN105TurboRapA1GFP | 2.05 ± 0.25 | 0.45 ± 0.45 | 31.55 ± 0.95 |
Исследование характера колонизации бактериями корней растений. В выбранных условиях эксперимента не было выявлено статистически значимых различий в количестве клеток исходных и трансформированных штаммов, адгезированных на поверхности корней растений. Однако трансформированные rapA1 штаммы ризобий образовывали на корнях растений томата клеточные агрегаты и микроколонии, что в случае исходных штаммов наблюдалось реже (рис. 5). Наименее эффективно трансформация геном rapA1 повлияла на характер колонизации растений штаммами N. galegae 0702 и R. leguminosarum VSy12. Последний образует биопленки медленнее, чем остальные штаммы. Что касается N. galegae 0702, то даже исходный штамм отличался способностью образовывать микроколонии на поверхности корней томата. Видимо, в данном случае сыграли роль факторы растительного происхождения, в частности, лектины растений, имеющие сродство к поверхности бактерий (Vershinina et al., 2012). Наиболее ярко выраженная колонизация корней наблюдалась для трансформированных rapA1 штаммов R. leguminosarum TPr4 и R. leguminosarum Pvu5, что согласуется с результатами, полученными на пластиковых планшетах.
Рис. 5.
Иммунофлуоресцентная микроскопия корней проростков томата после обработки исходными и трансформированными штаммами ризобий (стрелками показаны микроколонии и клеточные агрегаты).

Ранее было показано, что белки Rap не только участвуют на ранних этапах прикрепления ризобий к корням растений-хозяев (Нигматуллина и соавт., 2015), но также могут влиять на выработку и состав внеклеточных капсульных и свободных полисахаридов, способствуя формированию более плотной структуры биопленки (Vozza et al., 2016). Существует достаточно много работ, характеризующих кальций-связывающие лектины, подобные Rap, участвующие в колонизации бактериями различных поверхностей и образовании биопленок, с предположением наличия у данных веществ ферментативной активности (Borlee et al., 2010; Berk et al., 2012; Park et al., 2015). Наличие подобной активности у белков Rap в комплексе с содержанием одного или более участков, ответственных за связывание полисахаридов, позволяет бактериям адаптироваться к меняющимся условиям окружающей среды, модулируя состав и строение бактериальной биопленки (Vozza et al., 2016).
Таким образом, впервые в проведенном исследовании были получены штаммы ризобий, трансформированные векторной конструкцией pJN105TurboRapA1GFP, обеспечивающей конститутивную экспрессию генов rapA1 и gfp. Был проведен сравнительный анализ ростостимулирующей активности исходных и трансформированных штаммов и выработки ими ауксинов. Показано, что конститутивная экспрессия rapA1 в штаммах ризобий не только повышает эффективность образования биопленок на инертных поверхностях, но и способствует формированию микроколоний на корнях растений. Полученные данные позволяют сделать вывод, что изучение и использование бактериальных адгезинов открывает новые перспективы для создания искусственных симбиотических систем между ризобиями и небобовыми растениями.
Работа была выполнена с привлечением приборного парка ЦКП “Биомика” Института биохимии и генетики УФИЦ РАН в рамках госзадания (тема № АААА-А16-116020350028-4) при финансовой поддержке грантов Российского фонда фундаментальных исследований № 16-04-00902 А и № 18-34-00033 мол_а. Анализ содержания ауксинов в культуральных жидкостях бактерий выполнен при финансовой поддержке Российского научного фонда (грант № 16-16-00080).
Список литературы
Вершинина З.Р., Благова Д.К., Нигматуллина Л.Р., Лавина А.М., Баймиев А.Х., Чемерис А.В. Ассоциативный симбиоз трансгенных томатов с ризобиями повышает устойчивость растений к Fusarium oxisporum f. sp. lycopersici // Биотехнология. 2015. № 3. С. 42–53.
Кулуев Б.Р., Сафиуллина М.Г. Регуляция роста клеток растяжением в растениях // Успехи современной биологии. 2015. Т. 135. № 2. С. 148–163.
Лавина А.М., Хакимова Л.Р., Вершинина З.Р., Баймиев Ал.Х. Получение рекомбинантных по генам pssA и rosR ризобиальных штаммов, меченных флуоресцентным белком GFP // Вестник Оренбургского гос. ун-та. 2017. № 9 (209). С. 76–81.
Нигматуллина Л.Р., Лавина А.М., Вершинина З.Р., Баймиев Ал.Х. Вклад бактериального адгезина RapA1 в эффективность формирования симбиоза Rhizobium leguminosarum с растениями фасоли // Микробиология. 2015. Т. 84. № 6. С. 705–711.
Nigmatullina L.R., Lavina A.M., Vershinina Z.R., Baymiev Al.K. Role of bacterial adhesin RapA1 in formation of efficient symbiosis of Rhizobium leguminosarum with bean plants // Microbiology (Moscow). 2015. V. 84. P. 804–810.
Хакимова Л.Р., Лавина А.М., Вершинина З.Р., Баймиев А.Х. Использование штаммов-продуцентов адгезина R-apA1 из Rhizobium leguminosarum для создания бинарных биоудобрений // Прикл. биохимия и микробиология. 2017. Т. 53. № 4. С. 400–405.
Khakimova L.R., Lavina A.M., Vershinina Z.R., Baymiev Al.Kh. Usage of strain-producers of adhesin RapA1 from Rhizobium leguminosarum for the creation of binary biofertilizers // Appl. Biochem. Microbiol. 2017. V. 53. P. 453–457.
Шелудько А.В., Широков А.А., Соколова М.К., Соколов О.И., Петрова Л.П., Матора Л.Ю., Кацы Е.И. Колонизация корней пшеницы бактериями Azospirillum brasilense с различной подвижностью // Микробиология. 2010. Т. 79. № 5. С. 696–704.
Sheludko A.V., Shirokov A.A., Sokolova M.K., Sokolov O.I., Petrova L.P., Matora L.Y., Katsy E.I. Wheat root colonization by Azospirillum brasilense strains with different motility // Microbiology (Moscow). 2010. V. 79. P. 688–695.
Amaya-Gómez C.V., Hirsch A.M., Soto M.J. Biofilm formation assessment in Sinorhizobium meliloti reveals interlinked control with surface motility // BMC Microbiol. 2015. V. 15. P. 58.
Ausmees N., Jacobsson K., Lindberg M. A unipolarly located, cell-surface-associated agglutinin RapA belongs to a family of Rhizobium-adhering proteins (Rap) in Rhizobium leguminosarum bv. trifolii // Microbiology (SGM). 2001. V. 147. P. 549–559.
Belimov A.A., Dodd I.C., Safronova V.I., Shaposhnikov A.I., Azarova T.S., Makarova N.M., Davies W., Tikhonovich I.A. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum) // Ann. Appl. Biol. 2015. V. 167. P. 11–25.
Berk V., Fong J.C., Dempsey G.T., Develioglu O.N., Zhuang X., Liphardt J., Chu S. Molecular architecture and assembly principles of Vibrio cholerae biofilms // Science. 2012. V. 337 (6091) P. 236–239.
Biswas J.C., Ladha J.K., Dazzo F.B., Yanni Y.G., Rolfe B.G. Rhizobial inoculation influences seedling vigor and yield of rice // Agron. J. 2000. V. 92. P. 880–886.
Borlee B.R., Goldman A.D., Murakami K., Samudrala R., Wozniak D.J., Parsek M.R. Pseudomonas aeruginosa uses a cyclic-di-GMP-regulated adhesin to reinforce the biofilm extracellular matrix // Mol. Microbiol. 2010. V. 75. P. 827–842.
Dardanelli M., Angelini J., Fabra A. A calcium-dependent bacterial surface protein is involved in the attachment of rhizobia to peanut roots // Can. J. Microbiol. 2003. V. 49. P. 576–582.
Dazzo F.B., Yanni Y.G. The natural rhizobium-cereal crop association as an example of plant-bacterial interaction // Biological Approaches to Sustainable Soil Systems / Eds. Uphoff N., Ball A., Fernandes E., Herren H., Husson O., Laing M., Palm C., Pretty J., Sanchez P., Sanginga N., Thies J. Boca Raton: CRC Press, 2006. Ch. 8. P. 109–127.
Frederix M., Edwards A., Swiderska A., Stanger A., Karunakaran R., Williams A., Abbruscato P., Sanchez-Contreras M., Poole PS., Downie J.A. Mutation of praR in Rhizobium leguminosarum enhances root biofilms, improving nodulation competitiveness by increased expression of attachment proteins // Mol. Microbiol. 2014. V. 93. P. 464–478.
Fujishige N.A., Kapadia N.N., De Hoff P.L., Hirsch A.M. Investigations of Rhizobium biofilm formation // FEMS Microbiol. Ecol. 2006. V. 56. P. 195–206.
García-Fraile P., Carro L., Robledo M., Ramírez-Bahena M.H., Flores-Félix J.D., Fernández M.T., Peix A. Rhizobium promotes non-legumes growth and quality in several production steps: towards a biofertilization of edible raw vegetables healthy for humans // PLoS One. 2012. V. 7. № 5. e38122.
Jiang F., Chen L., Belimov A.A., Shaposhnikov A.I., Gong F., Meng X., Hartung W., Jeschke D.W., Davies W.J., Dodd I.C. Multiple impacts of the plant growth promoting rhizobacterium Variovorax paradoxus 5C-2 on nutrient and ABA relations of Pisum sativum // J. Exp. Bot. 2012 V. 63. P. 6421–6430.
Mongiardini E.J., Perez-Gimenez J., Althabegoiti M.J., Covelli J., Quelas J.I., Lopez-Garcia S.L., Lodeiro A. Overproduction of the rhizobial adhesin RapA1 increases competitiveness for nodulation // Soil Biol. Biochem. 2009. V. 41. P. 2017–2020.
Mongiardini E.J., Ausmees N., Perez-Gimenez J. The rhizobial adhesion protein RapA1 is involved inadsorption of rhizobia to plant roots but not in nodulation // FEMS Microbiol. Ecol. 2008. V.65. P. 279–288.
Park J.H., Jo Y., Jang S.Y., Kwon H., Irie Y., Parsek M.R., Choi S.H. The cabABC operon essential for biofilm and rugose colony development in Vibrio vulnificus // PLoS Pathogens. 2015. V. 11. № 9. e1005192.
Rinaudi L.V., Giordano W. An integrated view of biofilm formation in rhizobia // FEMS Microbiol. Lett. 2010. V. 304. P. 1–11.
Russo D.M., Williams A., Edwards A., Posadas D.M., Finnie C., Dankert M., Downie J.A., Zorreguieta A. Proteins exported via the PrsD-PrsE type I secretion system and the acidic exopolysaccharide are involved in biofilm formation by Rhizobium leguminosarum // J. Bacteriol. 2006. V. 188. P. 4474–4486.
Sambrook J., Fritsch E., Maniatis T. Molecular Cloning: a Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 1626 p.
Santillana N., Arellano C., Zúñiga D. Capacidad del Rhizobium de promover el crecimiento en plantas de tomate (Lycopersicon esculentum Miller) // Ecología Aplicada. 2005. V. 4. P. 47–51.
Siddique I.A., Ehteshamul-Haque S., Zaki M.J., Gaffar A. Effect of benlate on the efficacy of Bradyrhizobium sp. in the control of root rot disease of crop plants // Pakistan J. Sci. Ind. R. 2001. V. 44. № 3. P. 156–158.
Towbin H., Staehelin T., Gordon J. Biochemistry electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: Procedure and some applications // Proc. Natl. Acad. Sci. USA. 1979. V. 76. P. 4350–4354.
Vershinina Z.R., Baymiev An.K., Blagova D.K., Chubukova O.V., Baymiev Al.K., Chemeris A.V. Artificial colonization of non-symbiotic plants roots with the use of lectins // Symbiosis. 2012. V. 56. P. 25–33.
Vozza N.F., Abdian P.L., Russo D.M., Mongiardini E.J., Lodeiro A.R., Molin S., Zorreguieta A. A Rhizobium leguminosarum CHDL-(Cadherin-Like-) lectin participates in assembly and remodeling of the biofilm matrix // Front. Microbiol. 2016. V. 7. P. 1608.
Дополнительные материалы отсутствуют.