Микробиология, 2019, T. 88, № 1, стр. 91-99
Защита БХл850 от действия синглетного кислорода в мембранах серной фотосинтезирующей бактерии Allochromatium vinosum с помощью тушителей
З. К. Махнева a, А. А. Ашихмин a, М. А. Большаков a, А. А. Москаленко a, *
a Институт фундаментальных проблем биологии РАН
142290 Московская обл., Пущино, Россия
* E-mail: lfbv22@gmail.com
Поступила в редакцию 30.07.2018
После доработки 20.09.2018
Принята к публикации 02.10.2018
Аннотация
Исследовано действие синглетного кислорода в системе: мембраны Allochromatium (Alc.) vinosum штамм МГУ−бенгальский розовый−свет (547–600 нм) без тушителя или с тушителем. Показано, что в системе без тушителя наблюдается выцветание полосы БХл850 светособирающего комплекса LH2, и появляется пик поглощения в области 698 нм, принадлежащий 3-ацетил-хлорофиллу, продукту окисления БХл. Изучена эффективность пяти тушителей синглетного кислорода – аскорбата натрия, гистидина, имидазола, тролокса и азида натрия – на нейтрализацию действия синглетного кислорода на бактериохлорофил (БХл) в светособирающих комплексах мембран Alc. vinosum МГУ. Показано, что все они, за исключением азида натрия, успешно нейтрализовали его действие.
Пурпурные фотосинтезирующие бактерии делятся на две группы по возможности их роста в присутствии кислорода: аэробные и анаэробные. К первой из них относятся несерные бактерии, например, Rb. sphaeroides, которая может расти как фототрофно, и тогда в ее клетках (комплексах) накапливается сфероиден, или фотогетеротрофно, в этом случае сфероиден заменяется сфероиденоном, имеющим одну дополнительную кетогруппу (Takaichi, 2009). Во вторую группу входят серные бактерии (Alc. vinosum, T. tepidum и т.д.), которые могут расти только фототрофно. Очевидно, что указанные различия связаны с эволюцией (или ее отсутствием) обеих групп бактерий в условиях увеличивающейся концентрации кислорода в атмосфере и среде обитания. Первая группа смогла приспособиться к подобным условиям и одновременно выработать принципы защиты от окисления активными формами кислорода, в основном синглетного кислорода, а вторая ограничила свой ареал серной бескислородной средой.
БХл является основным пигментом пурпурных фотосинтезирующих бактерий наряду с каротиноидами (дополнительные пигменты), и оба типа пигментов локализованы в пигмент-белковых комплексах. У фотосинтезирующих бактерий в мембране обычно присутствуют три вида комплексов: два светособирающих – LH1 и LH2 и реакционный центр (РЦ). Функция комплексов LH2 и LH1 заключается в поглощении квантов света и передаче этой энергии в виде энергии электронного возбуждения к РЦ, где происходит первичное разделение зарядов (Hoff, Deisenhofer, 1997). Светособирающие комплексы ‒ это основные комплексы в мембранах и на их долю приходится до 99% пигментов. Они построены по общему принципу из низкомолекулярных полипептидов. Основным структурным модулем этих комплексов является так называемый α/β-гетеродимер, состоящий из двух полипептидов, с которым нековалентно связаны молекулы БХл (БХл800 и БХл850 в комплексе LH2 и БХл870−890 в комплексе LH1) и молекула каротиноида (Gabrielsen et al., 2009). У несерных бактерий комплексы LH2 состоят, как правило, из 8‒9, а комплекс LH1 – из 16 пар гетеродимеров соответственно. Комплекс LH2 содержит 24‒27 молекул БХл и 8‒9 молекул каротиноидов, а в LH1 – 32 молекулы БХл и 16 молекул каротиноидов. Недавно было показано, что комплексы LH2 из серных бактерий Alc. vinosum представляют более крупные структуры по сравнению с комплексами из несерных бактерий. Они построены из 12 пар гетеродимеров и содержат 36 молекул БХл и 12 молекул каротиноидов (Niedzwiedzki et al., 2012; Löhner et al., 2015). БХл850 в этих комплексах легко окисляется под действием феррицианида калия или синглетного кислорода по сравнению с комплексами из несерных бактерий (Махнева и соавт., 2016), что, по-видимому, связано с отсутствием как защитных механизмов, так и изменений в структуре, которые приводили бы к уменьшению действия окислителей.
Известно, что после поглощения молекулой БХл энергии кванта света и перехода ее в долгоживущее триплетное состояние происходит ее взаимодействие с молекулой кислорода и образование синглетного кислорода. Последний является сильным окисляющим агентом, который способен окислять не только БХл, но и другие компоненты клетки (Imlay, 2003). В последние годы повысился интерес к влиянию высоких концентраций как кислорода, так и синглетного кислорода, на рост несерных бактерий. С помощью флуоресцентных меток было показано, что синглетный кислород не только выделяется в клетках несерных бактерий на сильном свету в аэробных условиях, но и диффундирует за пределы клетки (Kochevar, 2004; Berghoff et al., 2011; Kim et al., 2013). В цитируемых работах он рассматривается не как окисляющий агент, а как сигнальная молекула, которая способна запустить синтез новых белков в клетке. В принципе прямое определение выделения синглетного кислорода пигмент-белковыми комплексами достаточно сложная задача и, например, для светособирающих бактериальных комплексов она до сих пор не решена. Установлено, что изолированные РЦ могут выделять синглетный кислород с небольшим квантовым выходом (Arellano et al., 2007; Uchoa et al., 2008). Во всех цитируемых работах объектами исследования были несерные бактерии. Работая с серными бактериями, мы пришли к выводу, что светособирающие комплексы могут быть удобным объектом для исследования разных аспектов их взаимодействия с синглетным кислородом.
Цель настоящей работы ‒ оценить, какие тушители способны предотвращать взаимодействие синглетного кислорода с БХл850 светособирающего комплекса LH2 из клеток серной бактерии Alc. vinosum МГУ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. Клетки Alc. vinosum МГУ (старое название Alc. minutissimum) выращивали на среде Ларсена (Кондратьева, 1972).
Для выделения пигмент-содержащих мембран клетки ресуспендировали в 0.05 М Трис-HCl-буфере (рН 8.0) и разрушали на ультразвуковом дезинтеграторе УЗД2-0.1-22 (22 кГц, дважды по 60 с). Неразрушенные клетки и остатки клеточной стенки удаляли методом дифференциального центрифугирования, как описано в работе Moskalenko et al. (2005). Выделенные мембраны хранили при температуре –18°С.
Воздействие синглетным кислородом. Обычно для получения синглетного кислорода используются несколько типов фотосенсибилизаторов, которые различаются по спектрам поглощения в области 400‒800 нм и квантовому выходу (~20‒75%) (Redmond, Gamlin, 1999; Scholz et al., 2013). Мы использовали бенгальский розовый, так как он имеет некоторые преимущества по сравнению с другими красителями. Во-первых, он поглощает в области 440‒580 нм, маскируя каротиноиды, но у него отсутствует поглощение в области продукта окисления БХл (около 700 нм), поэтому этот продукт можно легко зарегистрировать с помощью спектроскопии. Во-вторых, он имеет самый высокий (75%) квантовый выход синглетного кислорода среди других фотосенсибилизаторов (Redmond, Gamlin, 1999; Scholz et al., 2013). В-третьих, он хорошо растворяется в воде. Для облучения образцов с бенгальским розовым использовали комбинацию двух фильтров (СЗС22 + ОС13), которая позволяла выделить узкую область около 550‒580 нм, где присутствует небольшое поглощение БХл и каротиноидов. Бенгальский розовый (конечная концентрация 20 мкМ) добавляли к образцу перед облучением, который затем помещали в 1 см спектрофотометрическую кювету. Все эксперименты с облучением проводились при температуре 24°C в термостатируемой ячейке осветителя ЛЭТИ с лампой КГМ 500 (500 Вт), при этом интенсивность используемого желто-зеленого света составляла (2 мВт/см2).
Анализ пигментов проводили методом ВЭЖХ (Ashikhmin et al., 2014) на колонке Agilent Zorbax SB-C18 (“Agilent”, США). Установка для ВЭЖХ состояла из насоса LC 10ADvp с модулем FCV10 Alvp, который позволял создавать градиент растворителей со стороны низкого давления, детектора с диодной матрицей SPD-M20A и термостата CTO-20AC (“Shimadzu”, Япония). Хроматограммы, а также спектры поглощения отдельных пигментов получали с помощью программы LC-solution (“Shimadzu”, Япония).
Методы спектроскопии. Спектры оптического поглощения мембран регистрировали при комнатной температуре на спектрофотометре Cary 50 (“Varian”, Австралия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
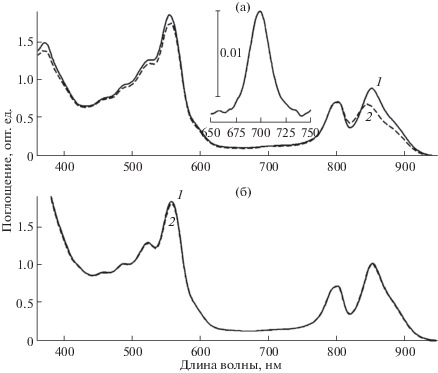
В спектре оптического поглощения мембран из клеток Alc. vinosum МГУ присутствуют пики при 372, 487 (плечи при 460 и 522), 590, 801 и 852 нм, которые принадлежат полосе Соре БХл, каротиноидам, Qx и двум Qy переходам БХл соответственно. Добавление бенгальского розового маскирует максимумы поглощения каротиноидов и Qx переход БХл (рис. 1). При освещении мембран в присутствии бенгальского розового происходит уменьшение полосы Qy БХл850 на 25% и ее одновременное смещение с 852 до 846 нм. Менее чем на 2% выцветает и бенгальский розовый. Максимум 3-ацетил-хлорофилла при 700 нм в спектре поглощения мембран практически не виден и проявляется только на разностных спектрах (рис. 1; спектр 2 и вставка соответственно). Следует отметить, что некоторый эффект (>1/3 от общего выцветания полосы БХл850) вносит непосредственно свет, используемый для облучения. Дело в том, что область, которую вырезают применяемые нами светофильтры, перекрывается с длинноволновыми склонами поглощения каротиноидов. Ранее мы показали, что эти пигменты способны под действием света инициировать фотоокисление БХл (Махнева и соавт., 2016), т.е. фактически они являются фотосенсибилизатором и дополняют работу бенгальского розового.
Рис. 1.
Спектры поглощения мембран до освещения (1) и после 30 мин освещения (2) в присутствии 20 мкМ бенгальского розового: без других добавок (а); +100мМ аскорбата натрия (б). Вставка: часть разностного спектра поглощения “спектр (2) минус спектр (1)”.
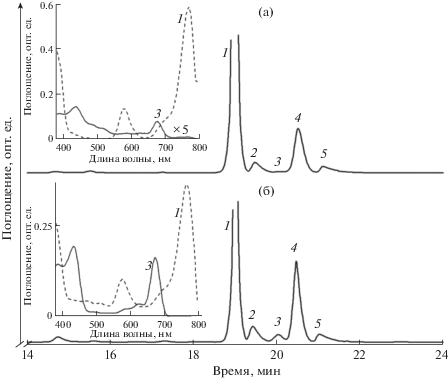
На рис. 2а представлены результаты разделения пигментов из контрольных мембран Alc. vinosum МГУ. Основными пигментами в контрольном образце являются БХл и родопин. В нем также присутствуют следы 3-ацетил-хлорофилла, что связано с отсутствием каких-либо дополнительных мер (анаэробные условия, добавление антиоксидантов) при разрушении клеток и выделении мембран. После облучения образца в присутствии бенгальского розового на хроматограмме появляется заметный пик 3-ацетил-хлорофилла (рис. 2б), что полностью совпадает со спектральными данными. В растворителях максимум поглощения и БХл и 3-ацетил-хлорофилла смещается в синюю область до 770 и 678 нм соответственно (рис. 2, вставка).
Рис. 2.
Частичные хроматограммы ВЭЖХ пигментов из контрольных мембран (а) и мембран после 30 мин освещения в присутствии 20 мкМ бенгальского розового (б). Идентификация пиков: 1 – БХл, 2 – дидегидрородопин, 3 – 3‑ацетил-хлорофилл, 4 – родопин, 5 – спириллоксантин. Вставка на (а) – спектры поглощения БХл (1) и 3-ацетил-хлорофилла (3, увеличен в 5 раз). Вставка на (б) – спектры поглощения БХл (1) и 3-ацетил-хлорофилла (3).
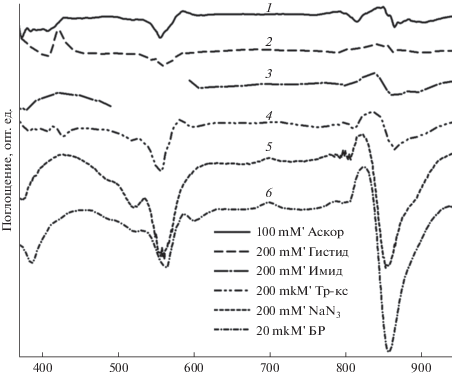
Понятно, что если заблокировать синглетный кислород, то процесс окисления БХл должен прекратиться. На рис. 1б представлены результаты подобного эксперимента в присутствии аскорбата натрия. Хорошо видно, что уменьшение (окисление) полос поглощения БХл в ближней ИК области фактически отсутствует. В разностном спектре поглощения изменения не превышают 0.02 опт. ед. (рис. 3, спектр 1), что составляет около 2%. Однако аскорбат натрия является редокс-агентом, который может восстанавливать, например, цитохром, и поэтому его действие не совсем специфично. Другие тушители синглетного кислорода (гистидин, имидазол и тролокс) действуют также, как аскорбат натрия (рис. 3, спектры 2‒4). Изменения в ИК области полос поглощения БХл в их присутствии колеблются в пределах 0.005‒0.045 опт. ед. Для сравнения там же приведен разностный спектр окисления БХл в мембранах после освещения в присутствии бенгальского розового без каких-либо добавок (рис. 3, спектр 6). В этом спектре наблюдаются минимум при 858 нм и максимум при 824 нм, первый из них соответствует уменьшению полосы БХл850 при окислении, а второй – смещению этой полосы в коротковолновую область. Отметим, что в присутствии тушителей выцветают более длинноволновые формы БХл (минимум при 865 нм; рис. 3, спектры 3 и 4). Одновременно в процессе освещения наблюдается небольшое выцветание полосы поглощения бенгальского розового в области 550‒570 нм (рис. 3).
Рис. 3.
Разностные спектры поглощения “спектр (2) минус спектр (1)” (см. рис. 1) в присутствии: 1 – 100 мМ аскорбата натрия, 2 – 200 мМ гистидина, 3 – 200 мМ имидазола, 4 ‒ 200 мкМ тролокса, 5 ‒ 200 мМ NaN3, 6 – без добавок. Спектры сдвинуты по оси ординат, разрыв в спектре 3 (491‒524 нм) связан с удаленными большими шумами.
Все указанные тушители демонстрируют четкую зависимость уменьшения окисления БХл850 от увеличения концентрации агента (рис. 4). Максимальный эффект был достигнут при концентрации тролокса – 0.2 мМ, аскорбата 100 мМ, гистидина 100‒200 мМ и имидазола – 200 мМ.
Рис. 4.
Выцветание полосы БХл850 в присутствии 20 мкМ бенгальского розового в зависимости от количества добавленного тушителя: 1 – аскорбат натрия (мМ), 2 – гистидин (мМ), 3 – тролокс (мкМ), 4 – имидазол (мМ). Выцветание полосы БХл850 в присутствии 20 мкМ бенгальского розового без добавок (5).
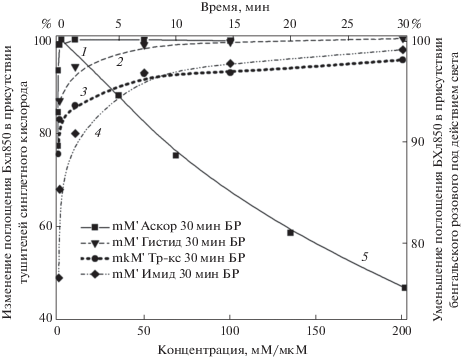
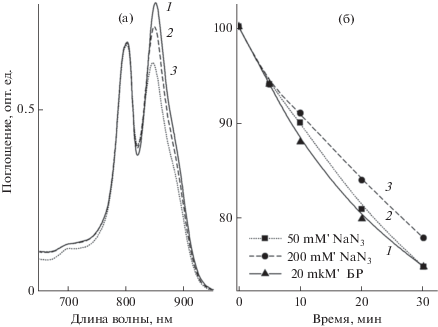
Данные, полученные с NaN3 (рис. 3, спектр 5 и рис. 5), полностью контрастируют с описанными выше результатами для других тушителей: при концентрации 50 мМ NaN3 практически никак не замедляет фотоокисление БХл850 (рис. 5, кривая 2), а при увеличении концентрации NaN3 до 200 мМ отмечено только небольшое уменьшение (~3‒5%) этого эффекта после 30 мин освещения. Этот факт не вписывается в общую концепцию и остается непонятным. Ранее было неоднократно показано, что NaN3 способен тушить синглетный кислород в системе Н2О2‒NaOCl (Bancirova, 2011) или в мицеллах и липосомах (Miyoshi, Tomita, 1979, Musbat et al., 2013). Причем эффективность тушения напрямую зависит от типа структур, в которые встраиваются мишени синглетного кислорода: в липосомах NaN3 не взаимодействует с гидрофобными мишенями, а в мицеллах он эффективен с обоими типами мишеней (гидрофобными и гидрофильными) (Musbat et al., 2013). Исследуемые нами мембраны похожи на липосомы, они состоят из двойного слоя липидов, который пронизывают пигмент-белковые комплексы, содержащие БХл (гидрофобная мишень сингетного кислорода). В нашей работе NaN3 не препятствовал окислению БХл850 и, соответственно, наши данные совпадают с результатами работы Musbat et al. (2013). Однако остается не ясным, почему NaN3 не может взаимодействовать с синглетным кислородом сразу после образования последнего в гидрофильной фазе.
Рис. 5.
(а) ‒ Спектры поглощения мембран до освещения (1) и после 30 мин освещения в присутствии 20 мкМ бенгальского розового и 50 мМ NaN3 (2) и 200 мМ NaN3 (3); (б) ‒ выцветание полосы БХл850 в присутствии 20 мкМ бенгальского розового (1), +50 мМ NaN3 (2) и +200 мМ NaN3 (3) в зависимости от времени освещения (0–30 мин).
Синглетный кислород является сильным деструктирующим фактором, который способен окислять разные компоненты клетки, такие как липиды, белки и пигменты. Его действие обычно проверялось на модельных системах, на которых проще оценить образование новых продуктов. Например, при взаимодействии синглетного кислорода с диазокрасителями в зависимости от типа растворителя в молекулах красителей происходило образование гидрокси- или кетогрупп с возможной их последующей модификацией (Bortolus, Monti, 1989). У растительных каротиноидов типа β-каротина (а также лютеина и зеаксантина) под действием синглетного кислорода в растворителях происходило расщепление молекулы пигмента на фрагменты разной длины и образование соответствующего эндопероксида с молекулярной массой в пределах 192‒416 (Rame et al., 2012). Понятно, что если бы подобный процесс происходил в наших образцах, то это привело бы к уменьшению поглощения в основной полосе каротиноидов (рис. 3) и появлению новых продуктов на хроматограммах ВЭЖХ, чего ранее мы не фиксировали (Махнева и соавт., 2009). БХл в модельных системах легко окисляется с образованием нескольких типов окисленных продуктов, включая бесцветные соединения, соединения с открытым кольцом типа билинов, хлорины и бактериохлорины (Smith, Calvin, 1966; Limantara et al., 2006). Основными продуктами окисления являются хлорины с преобладанием 3-ацетил-хлорофилла. Последний также преобладает в наших образцах, и его легко обнаружить спектрофотометрически (рис. 1 и 3) или ВЭЖХ (рис. 2). Образование указанного продукта связано с особенностью структуры молекулы БХл, у которой во втором имидазольном кольце в положении 7‒8 присутствуют два свободных протона. Если они не участвуют в образовании водородной связи с аминокислотными остатками полипептидов, то при окислении происходит их отрыв от молекулы БХл с образованием двойной связи, которая изменяет систему сопряженных двойных связей. При этом длинноволновая полоса поглощения пигмента смещается на ~155 или ~90 нм в синюю область в комплексах или растворителе соответственно (рис. 1 и 2). Очевидно, что БХл в наших образцах является основной мишенью для синглетного кислорода.
В настоящей работе исследована эффективность пяти тушителей синглетного кислорода – аскорбата натрия, гистидина, имидазола, тролокса и азида натрия – на нейтрализацию действия синглетного кислорода на БХл в светособирающих комплексах мембран Alc. vinosum МГУ, и все они, за исключением азида натрия, показали свою эффективность. Указанные тушители, наряду с другими: β-каротин, α-токоферол, аскорбиновая кислота, кверцитин, бутилгидроксианизол, бутилгидрокситолуен, тетрабутилгидрохинон, бетаин, 1,4-диазабицикло[2.2.2]октан и т.д. – широко используются в опытах с синглетным кислородом (Gutiérrez et al., 2001; Dad et al., 2006; Yettella, Min, 2008; Fatima et al., 2016; Wendel et al., 2016). Например, в работе Fatima et al. (2016) наиболее эффективными были β-каротин, α-токоферол, аскорбиновая кислота и кверцитин. Авторы регистрировали выцветание нитрозодиметиланилина в присутствии синглетного кислорода, который генерировался в системе (H2O2 + HOCl → HCl + H2O + 1O2). Результаты цитируемой работы (в части совпадающих тушителей) отличаются от полученных нами данных. При одинаковых концентрациях тушителей в нашей работе тролокс (0.1 мМ) был эффективнее в ~2.8 раза, аскорбат (0.1 мМ) – в ~1.6 раза, имидазол (50 мМ) – в ~2 раза и гистидин (50 мМ) – в ~1.9 раза по сравнению с данными Fatima et al. (2016). Такие различия достаточно сложно объяснить, возможно, они связаны с тем, что в этой работе (Fatima et al., 2016) в состав реакционной смеси входила перекись водорода (200 мМ), которая могла дополнительно окислять нитрозодиметиланилин. Ранее мы показали, что перекись действует на БХл Alc. vinosum МГУ также, как химический окислитель или синглетный кислород (Москаленко, 1974).
Долгое время синглетный кислород считался сильным повреждающим фактором, способным нарушать работу отдельных компартментов клетки (Gorman, Rodgers, 1992). Однако в последние годы его также рассматривают как сигнальную молекулу (Kochevar, 2004; Glaeser, Klug, 2004; Berghoff et al., 2011). Понятно, что в первом случае на клетку воздействуют “кислородный стресс”, т.е. высокие концентрации синглетного кислорода. Они генерируются за счет внешнего фактора или после разрушения отдельных пигмент-белковых комплексов и появления мономерного БХл, который является сильным сенсибилизатором синглетного кислорода. Впервые этот эффект наблюдался в работе (Griffith et al., 1955) и был ошибочно приписан защитной функции каротиноидов. Низкие концентрации синглетного кислорода могут образовываться непосредственно в клетке (Berghoff et al., 2011). Время жизни синглетного кислорода резко возрастает при переходе от воды к фосфолипидам (мембранам) и предполагается, что при тесном контакте клеток друг с другом он может переходить (диффундировать) от клетки к клетке (Maisch et al., 2007).
В настоящее время существует несколько методов определения генерации или присутствия синглетного кислорода в образце: 1). Прямое определение синглетного кислорода по его фосфоресценции при 1260 нм. Этим методом показано выделение синглетного кислорода реакционными центрами бактерий (Arellano et al., 2007; Uchoa et al., 2008). 2). Косвенное определение синглетного кислорода с помощью ловушек типа гистидина или имидазола. Основано на эффекте связывания образовавшегося синглетного кислорода ловушкой и уменьшения общей концентрации кислорода в ячейке, которая измеряется с помощью электрода Кларка (Kraljic, Mohsni, 1978). 3). Использование флуоресцентных ловушек типа Singlet Oxygen Sensor Green (SOSG), которые, связывая синглетный кислород, переходят во флуоресцирующую форму с испусканием в области 510‒550 нм (Berghoff et al., 2011), т.е. для их детектирования можно использовать стандартный спектрофлуориметр. Однако для SOSG, как и для других датчиков на основе флуоресцеина, существует как возможность фоторазложения, так и прямой генерации синглетного кислорода (Kim et al., 2013).
Таким образом, в работе изучено действие синглетного кислорода на мембраны Alc. vinosum МГУ, который генерировался бенгальским розовым под действием света (547‒600 нм), без тушителя и в присутствии тушителей синглетного кислорода. В системе без тушителя происходило выцветание полосы БХл850 светособирающего комплекса LH2, и появлялся пик поглощения в области 698 нм, принадлежащий окисленному продукту 3‑ацетил-хлорофиллу. Изучена эффективность пяти тушителей синглетного кислорода – аскорбата Na, гистидина, имидазола, тролокса и NaN3 – на нейтрализацию действия синглетного кислорода на бактериохлорофил (БХл) светособирающих комплексов в мембранах Alc. vinosum МГУ, и все они, за исключением азида натрия, успешно нейтрализовали это действие.
Примененный в данной работе подход является простым методом детектирования синглетного кислорода по изменениям в спектре поглощения мембран Alc. vinosum МГУ. Они будут использованы при исследовании разных аспектов взаимодействия синглетного кислорода с пигментами фотосинтезирующих бактерий.
Работа выполнена при частичной поддержке РФФИ (проекты № 18-04-00684_а; 18-34-00416_мол_а; 17-04-00929_а). Представленные на рис. 1‒3 результаты получены в рамках государственного задания № АААА-А17-117030110140-5.
Список литературы
Кондратьева Е.Н. Фотосинтезирующие бактерии и бактериальный фотосинтез. М.: Изд-во МГУ, 1972. С. 75. Kondratyeva Ye.N. Photosynthesizing Bacteria. USSR Academy of Sciences Publishers, Moscow. 1972. P. 75. (in Russian).
Махнева З.К., Ашихмин А.А., Большаков М.А., Москаленко А.А. Образование 3-ацетил-хлорофилла в светособирающих комплексах пурпурных бактерий при химическом окислении // Биохимия. 2016. Т. 81. № 2. С. 282‒294.
Makhneva Z.K., Ashikhmin A.A., Bolshakov M.A., Moskalenko A.A. 3-Acetyl-chlorophyll formation in light harvesting complexes of purple bacteria by chemical oxidation // Biochemistry (Moscow). 2016. V. 81. P. 176‒186.
Махнева З.К., Большаков М.А., Ашихмин А.А., Ерохин Ю.Е., Москаленко А.А. Влияние синего света на стабильность структуры антенных комплексов из Allochromatium minutissimum с разным содержанием каротиноидов // Биол. мембраны. 2009. Т. 26. № 3. С. 188−193.
Makhneva Z.K., Bolshakov M.A., Ashikhmin A.A., Erokhin Y.E., Moskalenko A.A. Influence of blue light on the structure stability of antenna complexes from Allochromatium minutissimum with different content of carotenoids // Biochemistry-Moscow Supplement Series A: Membrane and Cell Biology. 2009. V. 3. № 2. P. 123–127.
Москаленко А.А. Пигмент-белковые комплексы и их взаимодействие в структурах фотосинтетического аппарата бактерий и растений. Дисс. … докт. биол. наук в форме научного доклада. ИПФС РАН. Пущино. 1993. 37 с.
Arellano J.B., Yousef Y.A., Melø T.B., Mahamad S.B., Cogdell R.J., Naqvi K.R. Formation and geminate quenching of singlet oxygen in purple bacterial reaction center // J. Photochem. Photobiol. 2007. V. 87. P. 105‒112.
Ashikhmin A., Makhneva Z., Moskalenko A. The LH2 complexes are assembled in the cells of purple sulfur bacterium Ectothiorhodospira haloalkaliphila with inhibition of carotenoid biosynthesis // Photosynth. Res. 2014. V. 119. P. 291–303.
Bancirova M. Sodium azide as a specific quencher of singlet oxygen during chemiluminescent detection by luminol and Cypridina luciferin analogues // Luminescence. 2011. V. 26. P. 685‒688.
Berghoff B.A., Glaeser J., Nuss A.M., Zobawa M., Lottspeich F., Klug G. Anoxygenic photosynthesis and photooxidative stress: a particular challenge for Roseobacter // Environ. Microbiol. 2011. V. 13. P. 775‒791.
Bortolus P., Monti S. Physical quenching and chemical reaction of singlet molecular oxygen with Azo dyes // J. Organic. Chem. 1989. V. 54. P. 534‒540.
Dad S., Bisby R.H., Clark I.P., Parker A.W. Formation of singlet oxygen from solutions of vitamin E // Free Radic. Res. 2006. V. 40. P. 333‒338.
Fatima K., Masood N., Luqman S. Quenching of singlet oxygen by natural and synthetic antioxidants and assessment of electronic UV/Visible absorption spectra for alleviating or enhancing the efficacy of photodynamic therapy // Biomed. Res. Therapy. 2016. V. 3. P. 514‒527.
Gabrielsen M., Gardiner A.T., Cogdell R.J. Peripheral complexes of purple bacteria // Advances in Photosynthesis and Respiration / Eds. Hunter C.N., Daldal F., Thurnauer M.C., Beatty J.T. The Purple Phototrophic Bacteria. Dordrecht: Springer, 2009. V. 28. P. 135‒153.
Glaeser J., Klug G. Photo-oxidative stress in Rhodobacter sphaeroides: protective role of carotenoids and expression of selected genes // Microbiology (SGM). 2005. V. 151. P. 1927‒1938.
Gorman A.A., Rodgers M.A.J. Current perspectives of singlet oxygen detection in biological environments // J. Photochem. Photobiol. 1992 B: Biol. V. 14. P. 159‒176.
Griffith M., Sistrom W.R., Cohen-Bazire G., Stanier R.Y. Functions of carotenoids in photosynthesis // Nature. 1955. V. 176. P. 1211‒1214.
Gutiérrez I., Criado S., Bertolotti S., Norman A., Garcia N. Dark and photoinduced interactions between trolox, a polar-solvent-soluble model for vitamin E, and riboflavin // J. Photochem. Photobiol. 2001. V. 62. P. 133‒139.
Hoff A.J., Deisenhofer J. Photophysics of photosynthesis. Structure and spectroscopy of reaction centers of purple bacteria // Physics Rep. 1997. V. 287. P. l‒247.
Imlay J.A. Pathways of oxidative damage // Annu. Rev. Microbiol. 2003. V. 57. P. 395‒418.
Kim S., Fujitsuka M., Majima T. Photochemistry of singlet oxygen sensor green // J. Phys. Chem. B. 2013. V. 117. P. 13985‒13992.
Kochevar I.E. Singlet oxygen signaling: from intimate to global // Sci. STKE. 2004. V. 2004. P. 1‒3.
Kraljic I., Mohsni S.EL. A new method for the detection of singlet oxygen in aqueous solutions // Photochem. Photobiol. 1978. V. 28. P. 577‒581.
Krieger-Liszkay A., Trebst A. Tocopherol is the scavenger of singlet oxygen produced by the triplet states of chlorophyll in the PSII reaction centre // J. Exp. Botany. 2006. V. 57. P. 1677‒1684.
Limantara L., Koehler P., Wilhelm B., Robert J., Porra R.J., Scheer, H. Photostability of bacteriochlorophyll a and derivatives: potential sensitizers for photodynamic tumor therapy // Photochem. Photobiol. 2006. V. 82. P. 770‒780.
Löhner A., Carey A.M., Hacking K., Picken N., Kelly S., Cogdell R., Köhler J. The origin of the split B800 absorption peak in the LH2 complexes from Allochromatium vinosum // Photosynth. Res. 2015. V. 123. P. 23‒31.
Maisch T., Baier J., Franz B., Maier M., Landthaler M., Szeimies R.M., Bäumler W. The role of singlet oxygen and oxygen concentration in photodynamic inactivation of bacteria // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 7223–7228.
Miyoshi N., Tomita G. Quenching of singlet oxygen by sodium azide in reversed micellar systems // Z. Naturforsch. 1979. V. 34b. P. 339‒343.
Moskalenko A.A., Makhneva Z.K., Fiedor L., Scheer H. Effects of carotenoid inhibition on the photosynthetic RC–LH1 complex in purple sulphur bacterium Thiorhodospira sibirica // Photosynth. Res. 2005. V. 86. P. 71–80.
Musbat L., Weitman H., Ehrenberg B. Azide quenching of singlet oxygen in suspensions of microenvironments of neutral and surface charged liposomes and micelles // Photochem. Photobiol. 2013. V. 89. P. 253‒258.
Niedzwiedzki D.M., Bina D., Picken N., Honkanen S., Blankenship R.E., Holten D., Cogdell R.J. Spectroscopic studies of two spectral variants of light-harvesting complex 2 (LH2) from the photosynthetic purple sulfur bacterium Allochromatium vinosum // Biochim. Biophys. Acta. 2012. V. 1817. P. 1576–1587.
Ohara K., Kikuchi K., Origuchi T., Nagaoka S. Singlet oxygen quenching by trolox C in aqueous micelle solutions // J. Photochem. Photobiol. 2009. B. V. 97. P. 132‒137.
Rame F., Birtic S., Cuiné S., Christian Triantaphylidés C., Ravanat J.L., Havaux M. Chemical quenching of singlet oxygen by carotenoids in plants // Plant Physiol. 2012. V. 158. P. 1267‒1278.
Redmond R.W., Gamlin J.N. A compilation of singlet oxygen yields from biologically relevant molecules // Photochem. Photobiol. 1999. V. 70. P. 391‒475.
Scholz M., Roman Dedic R., Breitenbach T., Hala J. Singlet oxygen-sensitized delayed fluorescence of common watersoluble photosensitizers // Photochem. Photobiol. Sci. 2014. V. 13. P. 1203‒1212.
Smith J.R., Calvin M. Studies on the chemical and photochemical oxidation of bacteriochlorophyll // J. Am. Chem. Soc. 1966. V. 88. P. 4500‒4506.
Takaichi S. Distribution and biosynthesis of carotenoids // The Purple Phototrophic Bacteria / Eds. Daldal F., Thurnauer M.C., Beatty J.T., Hunter C.N. New York: Springer, 2009. P. 97‒117.
Uchoa A.F., Knox P.P., Turchielle R., Seifullina N.Kh., Baptista S.M. Singlet oxygen generation in the reaction centers of Rhodobacter sphaeroides // Eur. Biophys. 2008. V. 37. P. 843‒850.
Wendel M., Nizinski S., Gierszewski M., Prukala D., Sikorski M., Starzak K., Wybraniec S., Burdzinski G. Chemical quenching of singlet oxygen by betanin // Photochem. Photobiol. Sci. 2016. V. 15. P. 872‒878.
Yettella R.R., Min D.B. Quenching mechanisms and kinetics of trolox and ascorbic acid on the riboflavin-photosensitized oxidation of tryptophan and tyrosine // J. Agric. Food Chem. 2008. V. 56. P. 10887‒10892.
Дополнительные материалы отсутствуют.


