Микробиология, 2019, T. 88, № 2, стр. 144-153
Метакрилатредуктазная активность анаэробных бактерий Anaeromyxobacter dehalogenans и Denitrovibrio acetiphilus
О. В. Архипова a, *, Е. Н. Бирюкова a, Т. Н. Абашина a, Г. В. Хохлова a, В. В. Ашин a, Г. В. Микулинская b
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН,
ФИЦ Пущинский научный центр биологических исследований РАН
142290 Пущино, Россия
b Филиал Института биоорганической химии им. академиков М.М. Шемякина
и Ю.А. Овчинникова
142290 Пущино, Россия
* E-mail: aroksan@gmail.com
Поступила в редакцию 12.05.2018
После доработки 21.11.2018
Принята к публикации 30.11.2018
Аннотация
Для анаэробных ацетатокисляющих грамотрицательных бактерий-носителей генов-гомологов метакрилатной редокс системы Anaeromyxobacter dehalogenans 2CP-1Т (класс Deltaproteobacteria) и Denitrovibrio acetiphilus DSM 12809Т (класс Deferribacteres) впервые показана периплазматическая метакрилатвосстанавливающая активность. Акрилатредуктазная активность у A. dehalogenans и D. acetiphilus не выявлена. Также показана способность A. dehalogenans и D. acetiphilus восстанавливать фумарат: у A. dehalogenans периплазматический фумаратредуктазный процесс, у D. acetiphilus – внутриклеточный. У D. acetiphilus обнаружена нитратредуктазная активность периплазматической и внутриклеточной локализации. Обсуждаются варианты соответствия между редуктазными активностями и генами гипотетических белков в геномах A. dehalogenans и D. acetiphilus.
Выделенный в чистую культуру Geobacter sulfurreducens AM-1 обладает уникальным свойством использовать неприродное соединение метакрилат (ненасыщенное синтетическое токсичное соединение, присутствующее в отходах метакрилатных производств) в качестве терминального акцептора электронов (Галушко и соавт., 1994). Причем G. sulfurreducens AM-1 на акрилате в качестве акцептора электронов не растет (Галушко и соавт., 1994). Ранее была показана периплазматическая локализация процесса восстановления метакрилата в изобутират в клетках G. sulfurreducens AM-1 (Галушко и соавт., 1996). Ферментный комплекс, восстанавливающий метакрилат, состоит из двух хромопротеидов: флавинсодержащей метакрилатредуктазы Mrd (50 кДа) и ее физиологического донора электронов – тетрагемового цитохрома с Mcc (30 кДа) (Mikoulinskaia et al., 1999). Оба компонента метакрилатной редокс системы Mrd и Mcc были получены в чистом виде, их свойства изучены (Mikoulinskaia et al., 1999). Недавно был секвенирован геном G. sulfurreducens AM-1, и описан оперон, содержащий гены mrd и mcc (Arkhipova et al., 2015).
При описании оперона метакрилатной редокс системы было обнаружено, что несколько анаэробных микроорганизмов имеют гены с высокой степенью гомологии mrd и mcc, организованные в единый оперон, как у G. sulfurreducens AM-1 (Arkhipova et al., 2015). В геномах Anaeromyxobacter dehalogenans 2CP-1 (класс Deltaproteobacteria) и Denitrovibrio acetiphilus DSM 12809 (класс Deferri-bacteres) были обнаружены наиближайшие гомологи генов метакрилатной редокс системы G. sulfurreducens AM-1 (Arkhipova et al., 2015). Было показано, что продукты генов-гомологов mrd и mcc A. dehalogenans и D. acetiphilus, как и Mrd и Mcc G. sulfurreducens AM-1, имеют консервативные участки и синтезируются с отщепляемыми сигнальными последовательностями (Arkhipova et al., 2015), обеспечивающими периплазматическую локализацию обоих белков. Эти факты позволяют предполагать способность A. dehalogenans и D. acetiphilus расти на метакрилате в качестве терминального акцептора электронов или обладать метакрилатвосстанавливающей активностью. К началу исследований экспериментально подтвержденного наличия метакрилатного типа дыхания у бактерий, кроме G. sulfurreducens AM-1, не было. Предварительные попытки обнаружить у бактерий A. dehalogenans и D. acetiphilus рост на ацетате и метакрилате/акрилате не были успешными. Отсутствие роста на метакрилате не является причиной, по которой наличие метакрилатвосстанавливающей активности нельзя рассматривать как дыхательную активность. Метакрилатное дыхание у G. sulfurreducens AM-1 – процесс, требующий присутствия и слаженной работы ферментов ЦТК и цепи переноса электронов (Mikoulinskaia et al., 1999). Пока неизвестно, какие звенья не работают у A. dehalogenans и D. acetiphylus для того, чтобы рост, например, на таких субстратах как ацетат + + метакрилат состоялся. Однако известен факт наличия метакрилатвосстанавливающей активности у Wolinella succinogenes, хотя при этом организм на метакрилате в качестве субстрата не растет (Gross et al., 2001).
Типовые штаммы A. dehalogenans 2CP-1 (Sanford et al., 2002) и D. acetiphilus DSM 12809 (Myhr, Torsvik, 2000) были выделены в чистую культуру на рубеже тысячелетий. Оба организма способны к анаэробному дыханию путем сочетания окисления ацетата и восстановления нитрата. Кроме того, A. dehalogenans использует в качестве донора электронов водород, а в качестве акцепторов – галогенфенолы, растворимые и аморфные ионы железа, нитрат, нитрит, фумарат, гуминовые вещества, кислород (Sanford et al., 2002). Геномы обоих организмов известны (Thomas et al., 2008; Kiss et al., 2010).
Цель нашей работы – поиск метакрилатредуктазной активности и определение ее локализации у анаэробных бактерий A. dehalogenans и D. acetiphilus – обладателей генов-гомологов компонентов метакрилатной редокс системы. Для достижения поставленной цели необходимо было исключить, что восстановление метакрилата является побочной активностью другой редуктазы. В связи с этим были также протестированы активности дыхательных редуктаз, восстанавливающих: акрилат – природный аналог метакрилата (Curson et al., 2014), фумарат, используемый в качестве субстрата-акцептора для роста A. dehalogenans, и нитрат, используемый в качестве субстрата-акцептора для роста D. acetiphilus.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследований служили чистые культуры бактерий Anaeromyxobacter dehalogenans 2CP-1 и Denitrovibrio acetiphilus DSM 12809, полученные из коллекции культур DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Germany).
Культивирование бактерий проводили в пробирках Хангейта или в 100 мл флаконах при 37°С в минеральной среде, приготовленной в соответствии с принципами анаэробного культивирования (Галушко и соавт., 1996; Архипова и соавт., 2009), следующего состава (г/л): NaCl – 0.9; MgCl2 – 0.2; СaCl2 – 0.1; NH4Cl – 1.0; К2НРО4 – 0.029; КН2PО4 – 0.015; рН 7.0. На каждый литр среды добавляли 10 мл раствора микроэлементов, включающего (г/л): нитрилотриуксусную кислоту – 12.8; FeSO4 · · 7H2O – 0.5, MnCl2 · 4H2O – 0.1, CoCl2 · 6H2O – 0.17, СaCl2 · 2H2O – 0.1, ZnCl2 – 0.01, СuCl2 – 0.01, H3BO3 – 0.01, Na2MoO4 · 2H2O – 0.01, NaCl – 1, Na2SeO3 – 0.017, NiCl2 – 0.5, Na2WO4 – 0.1. На 1 литр среды вносили 5 мл раствора витаминов, содержащего (мг/л): биотин – 2.0, фолиевую кислоту – 2.0, пиридоксин – 10.0, тиамин-HCl – 5.0, рибофлавин – 5.0, никотиновую кислоту – 5.0, пантотеновую кислоту – 5.0, цианкобаламин – 0.1, p-аминобензойную кислоту – 5.0, липоевую кислоту – 5.0. Среда содержала субстраты роста: 33.4 мМ ацетат (ацетат натрия трехводный в качестве донора для обеих культур) и 23.8 мМ фумарат (в качестве акцептора для A. dehalogenans 2CP-1) или 8.2 мМ NaNO3 (в качестве акцептора для D. acetiphilus DSM 12809), а также цистеин и сульфид (50 мг/л каждого) в качестве восстановителя.
Подготовку суспензии клеток осуществляли, как описано ранее (Архипова и соавт., 2009). Культуру, выросшую до концентрации 0.025 г (сырой биомассы) в 100 мл среды культивирования, аэробно центрифугировали при 10 000 g в течение 30 мин при 4°С, и осадок промывали 100 мМ Mes-NaOH буфер (рН 6.0) с последующим центрифугированием при 2500 g в течение 15 мин. Полученный осадок клеток ресуспендировали в том же буфере.
Активности редуктаз измеряли при 578 нм по скорости обесцвечивания восстановленного дитионитом бензилвиологена (ε578 = 8.65 мМ–1 см–1) (Zeikus et al., 1977; Craske, Ferguson, 1986; Галушко и соавт., 1996; Mikoulinskaia et al., 1999) на двулучевых спектрофотометрах UV-160 или UV-1800 (“Shimadzu”, Япония) в анаэробных условиях. Реакционная смесь содержала 100 мМ Mes-NaOH буфер (рН 6.0), 2 мМ бензилвиологена, 10 мМ субстрата (один из четырех возможных: метакрилат, акрилат, фумарат, NaNO3) и 0.05–0.1 мг белка клеток бактерий. Реакцию начинали добавлением субстрата. При измерении внутриклеточных редуктаз в реакционной смеси присутствовал 0.01% бромид цетилтриметиламмония. За единицу редуктазной активности принято 2 мкМ бензилвиологена, окисленного в течение 1 мин.
Фракцию периплазматических белков получали согласно предложенному ранее методу (Van der Westen et al., 1978), примененному нами в работах (Галушко и соавт., 1996; Mikoulinskaia et al., 1999; Архипова и соавт., 2009). Клетки суcпендировали в растворе (1 г сырой биомассы в 10 мл раствора), содержащем 50 мМ Трис и 50 мМ ЭДТА, рН которого был доведен до 9.0 добавлением Na2CO3. Периплазматические белки переходили в раствор после инкубации суспензии клеток в течение 20 мин при 37°С и постоянном перемешивании на магнитной мешалке. Обработанные буфером клетки осаждали центрифугированием при 10 000 g в течение 30 мин и температуре 4°С.
Для получения клеточных гомогенатов осажденные после обработки щелочным буфером с ЭДТА клетки разрушали на ультразвуковом дезинтеграторе CPX130 (Cole-Parmer, Vernon Hills, IL, США) при мощности 75 Вт в течение 1 мин (2 сессии по 30 с).
Количество белка определяли спектрофотометрически при 595 нм по методу Брэдфорд (Bradford, 1976). В качестве стандарта использовали бычий сывороточный альбумин. Пробы целых клеток и клеток после экстракции периплазматических белков готовили, как описано ранее (Архипова и соавт., 2009). Суспензии целых клеток и клеток после экстракции периплазматических белков разводили концентрированным NaOH, чтобы конечная концентрация щелочи была 0.2 н, кипятили на водяной бане в течение 30 мин с последующим центрифугированием при 10 000 g. Полученный таким образом супернатант использовали для определения количества белка.
ПААГ-электрофорез в денатурирующих условиях выполняли для разделения белков по их молекулярным массам (Laemmli, 1970). Белки разделяли в 12% полиакриламида на пластинках (10 × 7 см) при помощи аппарата для электрофореза Mini Protean II (“Bio-Rad”, Великобритания).
Документирование гелей осуществляли с использованием ChemiDoc Touch Imaging system (“Bio-Rad”, Великобритания) и компьютерной программы Image Lab.
Молекулярные массы обнаруженных белков после ДСН-электрофореза определяли по графику, построенному по значениям электрофоретической подвижности Rf (ось абсцисс) и массы lg M (ось ординат) белков-маркеров. Молекулярные массы использованных в опытах белков-маркеров составляли: 14.4, 18.4, 25.0, 35.0, 45.0, 66.2, 166.0 кДа (“Thermo Scientific”, Литва).
РЕЗУЛЬТАТЫ
Активности терминальных редуктаз дыхательных цепей бактерий A. dehalogenans и D. acetiphilus. Активности метакрилатредуктазы, акрилатредуктазы, фумаратредуктазы и нитратредуктазы были измерены в суспензиях целых клеток A. dehalogenans и D. acetiphilus. Все ферментативные активности определяли в двух вариантах: в присутствии пермеабилизующего внутренние мембраны детергента ЦТАБ (бромид цетилтриметиламмония) и без него (рис. 1). ЦТАБ известен своим свойством увеличивать проницаемость мембран, его используют для выявления активности внутриклеточных ферментов без разрушения бактериальных клеток (Seitz, Cypionka, 1986; Szewzyk, Pfennig, 1987). Кроме того, ЦТАБ, являясь катионным детергентом, денатурирует белки при непосредственном контакте с ними (Helenius, Simons, 1975).
Рис. 1.
Редуктазная активность A. dehalogenans 2CP-1 (а) и D. acetiphilus DSM 12809 (б), мкМ мин–1 на 1 мг белка. РДА – редуктазная активность.
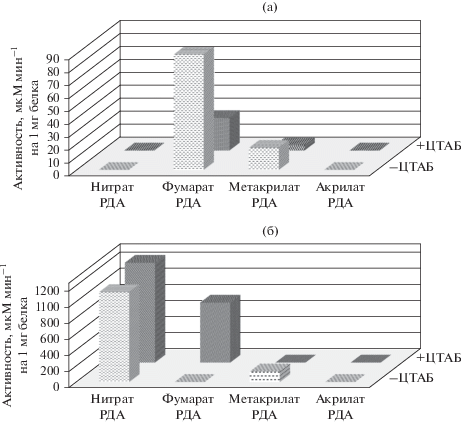
Для клеток A. dehalogenans были показаны процессы восстановления фумарата и метакрилата, при этом добавление ЦТАБ снижало скорость восстановления этих субстратов (рис. 1а). Клетки D. acetiphilus были способны восстанавливать нитрат, фумарат и метакрилат, причем добавление ЦТАБ подавляло активность восстановления метакрилата, а фумаратредуктазная активность, напротив, выявлялась только в присутствии ЦТАБ (рис. 1б). Скорость восстановления нитрата оставалась приблизительно одинаковой в присутствии и отсутствие ЦТАБ.
Таким образом, оба организма обладают метакрилатвосстанавливающей активностью, локализованной, по всей видимости, в периплазме. Для клеток A. dehalogenans, выращенных на ацетате и фумарате, определена фумаратредуктазная активность. Локализована эта фумаратредуктазная активность, вероятнее всего, в периплазме. Для клеток D. acetiphilus, выращенных на ацетате и нитрате, выявлена нитратредуктазная активность и в цитоплазме, и в периплазме. Она, по-видимому, свойственна двум разным ферментным системам: одна из них локализована в периплазме, другая – внутри клетки. Кроме того, у D. acetiphilus обнаружена внутриклеточная фумаратредуктазная активность. Акрилатредуктазная активность в клетках исследуемых организмов выявлена не была.
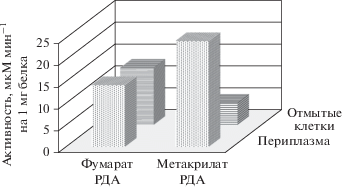
Локализация процессов восстановления фумарата и метакрилата в клетках A. dehalogenans. Исследование локализации процессов восстановления фумарата и метакрилата у A. dehalogenans осуществили путем разделения периплазматической и внутриклеточной фракций согласно методу (Van der Westen et al., 1978), уже примененному нами ранее (Mikoulinskaia et al., 1999). Эти эксперименты подтвердили наличие метакрилат- и фумаратвосстанавливающих активностей в периплазме (рис. 2). Метакрилатредуктазную активность в гомогенате “отмытых клеток” A. dehalogenans не обнаружили.
Рис. 2.
Активность дыхательных редуктаз в клеточных фракциях A. dehalogenans 2CP-1, мкМ мин–1 на 1 мг белка. “Периплазма” – периплазматический экстракт. “Отмытыте клетки” – клеточная фракция, оставшаяся после получения периплазматического экстракта. РДА – редуктазная активность.
Для сравнения белков по их количеству и молекулярной массе белковые фракции нативных клеток A. dehalogenans, клеток после обработки щелочным буфером с ЭДТА (“отмытые клетки”) и периплазматического экстракта (“периплазма”) были разделены электрофоретически (рис. 3). Кроме того, в периплазматическом экстракте были обнаружены, среди прочих, две белковых полосы, молекулярная масса которых, рассчитанная по логарифму подвижности, составила 53 и 29 кДа. Функции этих периплазматических белков неизвестны. Однако значения их молекулярных масс близки ожидаемым для зрелых белков-гомологов Mrd и Mcc из A. dehalogenans 2CP-1 (табл. 1) (Arkhipova et al., 2015; Архипова и соавт., 2017) и молекулярным массам компонентов метакрилатной редокс системы G. sulfurreducens AM-1, которые выявляются на электрофореграммах как мажорные полосы (Mikoulinskaia et al., 1999).
Рис. 3.
Электрофореграмма белков клеточных фракций A. dehalogenans 2CP-1: 1 – маркеры молекулярной массы; 2 – нативные клетки; 3 – клеточная фракция, оставшаяся после получения периплазматического экстракта (“отмытые клетки”), 4 – периплазматический экстракт (“периплазма”). Цифры слева – значения молекулярной массы белков-маркеров, кДа. Цифры справа – значения молекулярной массы белков периплазмы в кДа, рассчитанные по логарифму подвижности; жирный шрифт соответствует мажорным белкам.
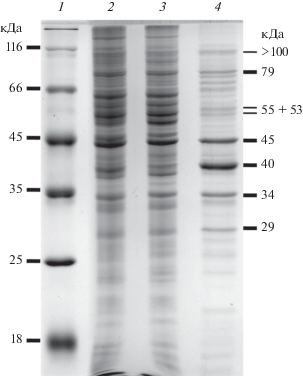
Таблица 1.
Гомологи Mrd и Mcc Anaeromyxobacter dehalogenans 2CP-1
| Белок- гомолог | Номер в GenBank | Предполагаемая функция | Длина (амк), Mr незрелого белка (кДа) |
Тип отщепляемого сигнального пептида, длина (амк) |
Гем- связывающие участки CXXCH |
Tat мотив |
|---|---|---|---|---|---|---|
| Mcc | WP_012633121.1 (бывший YP_002492268.1) |
Гипотетический белок A2cp1_1860 |
221 амк 22.9 кДа |
Sec (24) | 7 | – |
| Mrd | WP_012633122.1 (бывший YP_002492269.1) |
Флавоцитохром с | 515 амк 55.6 кДа |
Tat (38) | – | RRAMLK |
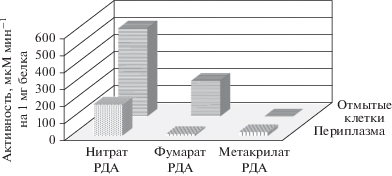
Локализация процессов восстановления нитрата, фумарата и метакрилата в клетках Denitrovibrio acetiphilus. Эксперименты, основанные на разделении белков периплазматической и внутриклеточной фракций D. acetiphilus, подтвердили наличие метакрилат- и нитратвосстанавливающих активностей в “периплазме”, а фумарат- и нитратвосстанавливающих активностей – внутри клетки (рис. 4). Метакрилатредуктазная активность в гомогенате “отмытых клеток” D. acetiphilus не была обнаружена.
Рис. 4.
Активности дыхательных редуктаз в клеточных фракциях D. acetiphilus DSM 12809; мкМ мин–1 на 1 мг белка. “Периплазма” – периплазматический экстракт. “Отмытые клетки” – клеточная фракция, оставшаяся после получения периплазматического экстракта. РДА – редуктазная активность.
Для сравнения белков по их количеству и молекулярной массе белковые фракции нативных клеток D. acetiphilus, клеток после обработки щелочным буфером с ЭДТА (“отмытые клетки”) и периплазматического экстракта (“периплазма”) были разделены электрофоретически. На электрофореграмме (рис. 5) в периплазматической фракции были обнаружены среди прочих две мажорных белковых полосы, молекулярная масса которых, рассчитанная по логарифму подвижности, составила 51 и 28 кДа. По молекулярной массе эти белки близки зрелым гомологам Mrd и Mcc из D. acetiphilus (табл. 2) (Arkhipova et al., 2015; Архипова и соавт., 2017), а также периплазматическим белкам из A. dehalogenans (рис. 3).
Рис. 5.
Электрофореграмма белков клеточных фракций D. acetiphilus DSM 12809: 1 – маркеры молекулярной массы; 2 – нативные клетки; 3 – клеточная фракция, оставшаяся после получения периплазматического экстракта (“отмытые клетки”), 4 – периплазматический экстракт (“периплазма”). Цифры слева – значения молекулярной массы белков-маркеров, кДа. Цифры справа – значения молекулярной массы белков периплазмы в кДа, рассчитанные по логарифму подвижности; жирный шрифт соответствует мажорным белкам.
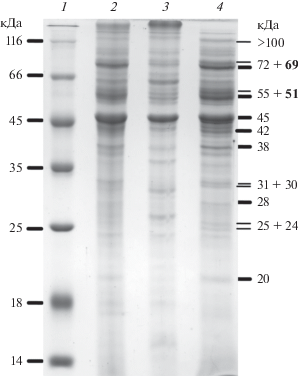
Таблица 2.
Гомологи Mrd и Mcc Denitrovibrio acetiphilus DSM 12809
| Белок- гомолог | Номер в GenBank | Предполагаемая функция | Длина (амк), Mr незрелого белка (кДа) |
Тип отщепляемого сигнального пептида, длина (амк) |
Гем- связывающие участки CXXCH |
Tat мотив |
|---|---|---|---|---|---|---|
| Mcc | WP_013011783.1 (бывший YP_003505238.1) | Гипотетический белок Dacet_2522 |
208 амк 22.9 кДа |
Sec (18) | 7 | – |
| Mrd | WP_013011784.1 (бывший YP_003505239.1) | Флавоцитохром с | 507 амк 55.0 кДа |
Tat (40) | – | RRGLLQ |
ОБСУЖДЕНИЕ
Общность таксонов Geobacter, Anaeromyxobacter и Denitrovibrio. Наличие у A. dehalogenans и D. acetiphilus оперонов высокой степени гомологии оперону метакрилатной редокс системы G. sulfurreducens AM-1 обусловливает обнаруженную у этих организмов способность восстанавливать метакрилат (рис. 1, 2, 4). Эта функция у A. dehalogenans и D. acetiphilus не является неспецифической активностью внутриклеточной фумаратредуктазы. В отличие от метакрилатредуктазного комплекса G. sulfurreducens AM-1, восстанавливающего природный аналог метакрилата – акрилат (Mikoulinskaia et al., 1999), клетки A. dehalogenans и D. acetiphilus не имели активности акрилатредуктазы (рис. 1).
Присутствие метакрилатной редокс системы – не единственное сходство между организмами таких различных таксонов как Geobacter, Anaeromyxobacter и Denitrovibrio (Shi et al., 2014). Во-первых, все три организма являются грамотрицательными ацетатокисляющими анаэробами (Галушко и соавт., 1994; Myhr, Torsvik, 2000; Sanford et al., 2002). Во-вторых, для этих организмов характерно высокое разнообразие элементов дыхательных цепей: электронтранспортных компонентов, цитохромов (Methė et al., 2003; Thomas et al., 2008; Kiss et al., 2010; Denton et al., 2013). Такая особенность представителей родов Geobacter и Anaeromyxobacter обеспечивает их функциональность как электротрофов (Lovley, 2010; Strycharz et al., 2010), принимающих электроны для восстановления терминальных акцепторов электронов напрямую от электрода, так и экзоэлектрогенов (Logan, 2009; Strycharz et al., 2010), переносящих электроны на твердые электроды. Кроме того, для представителей этих трех родов показаны общие механизмы переноса электронов через мембраны с участием полигемовых цитохромов с (Nissen et al., 2012; Shi et al., 2014). В-третьих, бактерии Geobacter, Anaeromyxobacter и Denitrovibrio представляют интерес для биоремедиации природных систем как деструкторы отходов антропогенного происхождения и природных соединений, вызывающих серьезные заболевания (Галушко и соавт., 1994; Sanford et al., 2007; Denton et al., 2013). Бактерии родов Geobacter и Anaeromyxobacter вовлечены в процессы очистки от радиоактивных металлов и органических загрязнений (Lovley, 2010; Strycharz et al., 2010).
Соответствие между активностями терминальных редуктаз и гипотетическими белками A. dehalogenans и D. acetiphilus. Для соотнесения выявленных редуктазных активностей с конкретными белками мы проанализировали геномы A. dehalogenans 2CP-1 и D. acetiphilus DSM 12809. Гомологи Mrd и Mcc A. dehalogenans и D. acetiphilus, по всей видимости, являются компонентами единой редокс системы, поскольку их гены организованы в одну транскрипционную единицу, также как у G. sulfurreducens AM-1 (Arkhipova et al., 2015). Гипотетические белки-гомологи Mrd WP_012633122.1 (бывший YP_002492269.1) из A. dehalogenans и WP_013011784.1 (бывший YP_003505239.1) из D. acetiphilus имеют сходные молекулярные массы зрелых белков (51–52 кДа) и отщепляемые сигнальные пептиды типа Tat. Эти характеристики присущи метакрилатредуктазе из G. sulfurreducens AM-1 (табл. 1, 2). Гипотетические цитохромы с-гомологи Mcc WP_012633121.1 (бывший YP_002492268.1) из A. dehalogenans и WP_013011783.1 (бывший YP_003505238.1) из D. acetiphilus) имеют также сходные молекулярные массы зрелых белков (25.5–26 кДа) и отщепляемые сигнальные пептиды типа Sec, подобно Mcc из G. sulfurreducens AM-1 (табл. 1, 2).
Присутствующие в геномах обеих бактерий гомологичные гены белков Mrd (GenBank accession № WP_012633122.1 и WP_013011784.1), обладают, вероятнее всего, метакрилатредуктазной активностью, для проявления которой необходимо присутствие гомолога Mcc. Наличие у незрелых гомологов Mrd и Mcc отщепляемых сигнальных пептидов типов Tat и Sec свидетельствует о периплазматической локализации этих белков. Разные типы сигнальных пептидов – свидетельство разных путей биогенеза обоих белков. Незрелый белок цитохрома с с секреторной последовательностью типа Sec переносится через мембрану до приобретения им третичной структуры (Bagos et al., 2010), а присоединение к протеину гемов с происходит уже в периплазме. Белок гомолога Mrd с сигнальной последовательностью типа Tat переносится через мембрану после фолдинга (Bagos et al., 2010). Созревание гомологов Mrd и Mcc разными путями – возможное объяснение отсутствия метакрилатредуктазной активности внутри клеток A. dehalogenans и D. acetiphilus. Для восстановления метакрилата оба белка-гомолога Mrd и Mcc должны уже быть зрелыми, а этим условиям они удовлетворяют, находясь в периплазме.
Фумаратредуктазная активность у A. dehalogenans локализована в периплазме, и нельзя исключить, что ею обладает гомолог Mrd. Помимо гомологичной Mrd последовательности, в геноме A. dehalogenans 2CP-1 есть только один периплазматический флавопротеин, который может обладать фумаратредуктазной активностью. Это белок (GenBank accession № ACL67011.1) с молекулярной массой 63.4 кДа, имеющий отщепляемую сигнальную последовательность типа Tat. Зрелый белок имеет массу 54.5 кДа. Интересно, что этот белок имеет существенное сходство с последовательностью гомолога Mrd этой же бактерии. Что касается D. acetiphilus, нам удалось выявить две последовательности, которые могут кодировать цитоплазматическую фумаратредуктазу (WP_013011266.1 и WP_013010243.1). Обе они относительно невелики, 231 и 235 аминокислот, обе соответствуют железо-серным белкам.
Ответственность за периплазматическую нитратредуктазную активность D. acetiphilus, наиболее вероятно, несет молибдоптеринсодержащая оксидоредуктаза (WP_013009440.1), обладающая консервативным доменом связывания молибдата MopB, а также доменом NapA, характерным для нитратредуктаз типа Nas-Nap. Этот белок с молекулярной массой 88.7 кДа обладает отщепляемой сигнальной последовательностью типа Tat (31 амк) для транслокации в периплазму и участвует в окислении хинола с помощью тетрагемового мембраносвязанного цитохрома с. У A. dehalogenans имеется аналог этого белка (WP_012632314.1) с молекулярной массой 83.5 кДа и отщепляемым сигнальным пептидом типа Tat из 29 аминокислот. Кроме того, в геномах обеих бактерий обнаружены гены мультисубъединичной нитратредуктазы Nar (№ WP_012633042–012633045.1 для A. dehalogenans и № WP_013011334–013011337.1 для D. acetiphilus), располагающейся с внутренней стороны цитоплазматической мембраны. Несмотря на наличие в геноме A. dehalogenans генов редуктаз обоих типов Nap (периплазматичекая WP_012632314.1) и Nar (внутриклеточная Nar № WP_012633042–012633045.1), нитратредуктазная активность для A. dehalogenans не была показана ни для целых клеток, ни во фракциях “периплазмы” или “отмытых клеток”. Можно предположить, что обе нитратредуктазы A. dehalogenans являются индуцибельными ферментами, синтезируемыми при росте на нитрате в качестве акцептора электронов.
Кроме того, в геноме D. acetiphilus было обнаружено множество периплазматических флавопротеинов, которые могут обладать редуктазной активностью. Но очевидно, ни один из них не является ни фумарат-, ни акрилатредуктазой.
К вопросу о гипотезе происхождения метакрилатной редокс системы. Метакрилатная редокс система G. sulfurreducens использует в качестве субстрата не только метакрилат, но и природный акрилат (Mikoulinskaia et al., 1999). Однако акрилатредуктазная активность у A. dehalogenans и D. acetiphilus (рис. 1) не была обнаружена. Таким образом, гипотеза о происхождении метакрилатной редокс системы от редуктазного комплекса, использующего в качестве субстрата токсичное природное соединение акрилат (Arkhipova et al., 2015), представленными результатами не подтверждена.
У исследуемых грамотрицательных ацетат-окисляющих анаэробов обнаружены активности дыхательных редуктаз. Высокие уровни выявлены для фумаратредуктазных активностей. Именно фумаратредуктазы и сукцинатдегидрогеназы являются ближайшими биохимически охарактеризованными гомологами компонентов метакрилатредуктазной редокс системы (Архипова, Акименко, 2005; Arkhipova et al., 2015; Архипова и соавт., 2017). Эти факты дают основания предполагать, что возникновение метакрилатредуктазной активности – это боковая ветвь общего эволюционного древа анаэробных флавоцитохромов, восстанавливающих природные субстраты.
Обращает на себя внимание периплазматическая локализация чужеродной для клетки метакрилатредуктазной активности. Возможно, возникновение этой системы в периплазме является эволюционным преимуществом, связанным со способностью богатых периплазматическими цитохромами ацетатокисляющих анаэробов быть как электротрофами, так и экзоэлектрогенами.
Биохимическое подтверждение существования новых метакрилатных редокс систем у бактерий разных таксонов открывает новые биотехнологические горизонты. Вовлечение этих бактерий или их отдельных ферментных систем в процессы деградации неприродных отходов – перспективное и экологически оправданное направление исследований.
Работа выполнена при поддержке гранта РФФИ № 17-04-01068 “Анаэробная ферментная система, восстанавливающая метакрилат”. Авторы признательны профессору Ф.А. Кондрашову (Institute of Science and Technology Austria) за помощь в приобретении культур в DSMZ.
Список литературы
Архипова О.В., Акименко В.К. Ненасыщенные органические кислоты – терминальные акцепторы редуктазных цепей анаэробных бактерий // Микробиология. 2005. Т. 74. № 6. С. 725–737.
Arkhipova O.V., Akimenko V.K. Unsaturated organic acids as terminal electron acceptors for reductase chains of anaerobic bacteria // Microbiology (Moscow). 2005. V. 74. P. 629–639.
Архипова О.В., Трошина О.Ю., Микулинская Г.В. Пространственная модель анаэробной метакрилатредуктазной системы // Вестн. ТвГУ. Сер.: Биология и экология. 2017. № 2. С. 306–323.
Архипова О.В., Чувочина М.С., Трутко С.М. Цитохромы с анаэробного метакрилатредуктора Geobacter sulfurreducens AM-1 // Микробиология. 2009. Т. 78. № 3. С. 334–341.
Arkhipova O.V., Chuvochina M.S., Trutko S.M. Cytochromes c of the anaerobic methacrylate reducer Geobacter sulfurreducens AM-1 // Microbiology (Moscow). 2009. V. 78. P. 296–303.
Галушко А.С., Микулинская (Архипова) О.В., Лауринавичюс К.С., Образцова А.Я., Акименко В.К. Периплазматическая локализация метакрилатредуктазы строго анаэробной бактерии штамм АМ-1 // Микробиология. 1996. Т. 65. № 4. С. 495–498.
Galushko A.S., Mikulinskaya O.V., Laurinavichus K.S., Obraztsova A.Ya., Akimenko V.K. Periplasmic location of methacrylate reductase in cells of the strictly anaerobic bacterial strain AM-1 // Microbiology (Moscow). 1996. V. 65. P. 432–435.
Галушко А.С., Образцова А.Я., Штаркман Н.Б., Лауринавичюс К.С., Акименко В.К. Анаэробная ацетатокисляющая бактерия, трансформирующая метакриловую кислоту // ДАН. Сер. биол. 1994. Т. 335. № 3. С. 382–384.
Galushko A.S., Obraztsova A.Ya., Shtarkman N.B., Laurinavichus K.S., Akimenko V.K. An anaerobic acetate-oxidizing bacterium capable of transforming methacrylic acid // Dokl. Biol. Sci. 1994. V. 335. P. 122–123.
Arkhipova O.V., Meer M., Mikoulinskaia G.V., Zakharova M.V., Galushko A.S., Akimenko V.K., Kondrashov F.A. Recent origin of the methacrylate redox system in Geobacter sulfurreducens AM-1 through horizontal gene transfer // PLoS One. 2015. V. 10. № 5. e0125888. doi 10.1371/journal.pone.0125888
Bagos P.G., Nikolaou E.P., Liakopoulos T.D., Tsirigos K.D. Combined prediction of Tat and Sec signal peptides with hidden Markov models // Bioinform. 2010. V. 26. P. 2811–2817. doi 10.1093/bioinformatics/btq530
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248–254.
Craske A., Ferguson S.J. The respiratory nitrate reductase from Paracoccus denitrificans. Molecular characterisation and kinetic properties // Eur. J. Biochem. 1986. V. 158. P. 429–436.
Curson A.R.J., Burns O.J., Voget S., Daniel R., Todd J.D., McInnis K., Wexler M., Johnston A.W.B. Screening of metagenomic and genomic libraries reveals three classes of bacterial enzymes that overcome the toxicity of acrylate // PLoS One. 2014. V. 9. № 5. e97660. doi 10.1371
Denton K., Atkinson M.M., Borenstein S.P., Carlson A., Carroll T., Cullity K., DeMarsico C., Ellowitz D., Gialtouridis A., Gore R., Herleikson A., Ling A.Y., Martin R., McMahan K., Naksukpaiboon P., Seiz A., Yearwood K., O’Neill J., Wiatrowski H. Identification of a possible respiratory arsenate reductase in Denitrovibrio acetiphilus, a member of the phylum Deferribacteres // Arch. Microbiol. 2013. V. 195. P. 661–670. doi 10.1007/s00203-013-0915-5
Gross R., Simon J., Kröger A. Periplasmatic methacrylate reductase activity in Wolinella succinogenes // Arch. Microbiol. 2001. V. 176. P. 310–313.
Helenius A., Simons K. Solubilization of membranes by detergents // BBA. 1975. V. 415. P. 29–79.
Kiss H., Lang E., Lapidus A., Copeland A., Nolan M., Del Rio T.G., Chen F., Lucas S., Tice H., Cheng J.-F., Han C., Goodwin L., Pitluck S., Liolios K., Pati A., Ivanova N., Mavromatis K., Chen A., Palaniappan K., Land M., Hauser L., Chang Y.-J., Jeffries C.D., Detter J.C., Brettin T., Spring S., Rohde M., Göker M., Woyke T., Bristow J., Eisen J.A., Markowitz V., Hugenholtz P., Nikos C., Kyrpides N.C., Klenk H.-P. Complete genome sequence of Denitrovibrio acetiphilus type strain (N2460T) // Stand. Genomic Sci. 2010. V. 2. P. 270–279. doi 10.4056/sigs.892105
Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature. 1970. V. 227. P. 680–685.
Logan B. Exoelectrogenic bacteria that power microbial fuel cells // Nature Rev. Microbiol. 2009. V. 7. P. 375–383. doi 10.1038/nrmicrо2113
Lovley D.R. Powering microbes with electricity: direct electron transfer from electrodes to microbes // Env. Microbiol. Rep. 2010. doi 10.1111/j.1758-2229.2010.00211.x
Methe B.A., Nelson K.E., Eisen J.A., Paulsen I.T., Nelson W., Heidelberg J.F., Wu D., Wu M., Ward N., Beanan M.J., Dodson R.J., Madupu R., Brinkac L.M., Daugherty S.C., DeBoy R.T., Durkon A.S., Gwinn M., Kolonay J.F., Sullivan S.A., Haft D.H., Selengut J., Davidsen T.M., Zafar N., White O., Tran B., Romero C., Forberger H.A., Weidman J., Khouri H., Feldblyum T.V., Utterback T.R., Van Aken S.E., Lovley D.R., Frazer C.M. Genome of Geobacter sulfurreducens: metal reduction in subsurface environments // Science. 2003. V. 302. P. 1967–1969.
Mikoulinskaia (Arkhipova) O., Akimenko V., Galushko A., Thauer R., Hedderich R. Cytochrome c-dependent methacrylate reductase from Geobacter sulfurreducens AM-1 // Eur. J. Biochem. 1999. V. 263. P. 346–352.
Myhr S., Torsvik T. Denitrovibrio acetiphilus, a novel genus and species of dissimilatory nitrate-reducing bacterium isolated from an oil reservoir model column // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 1611–1619.
Nissen S., Liu X., Chourey K., Hettich R.L., Wagner D.D., Pfiffner S.M., Loffler F.E. Comparative c-type cytochrome expressionanalysis in Shewanella oneidensis strain MR-1 and Anaeromyxobacter dehalogenans strain 2CP-C grown with soluble and insoluble oxidized metal electron acceptors // Biochem. Soc. Trans. 2012. V. 40. P. 1204–2010.
Sanford R.A., Cole J.R., Tiedje J.M. Characterization and description of Anaeromyxobacter dehalogenans gen. nov., sp. nov., an aryl-halorespiring facultative anaerobic myxobacterium // Appl. Environ. Microbiol. 2002. V. 68. P. 893–900.
Sanford R.A., Wu Q., Sung Y., Thomas S.H., Amos B.K., Prince E.K., Löffler F.E. Hexavalent uranium supports growth of Anaeromyxobacter dehalogenans and Geobacter spp. with lower than predicted biomass yields // Environ. Microbiol. 2007. V. 9. P. 2885–2893.
Seitz H.-J., Cypionka H. Chemolithotrophic growth of Desulfovibrio desulfuricans with hydrogen coupled to ammoniofication of nitrate or nitrite // Arch. Microbiol. 1986. V. 146. P. 63–67.
Shi L., Fredrickson J.K., Zachara J.M. Genomic analyses of bacterial porin-cytochrome gene clusters // Front Microbiol. 2014. V. 5. Article 657. doi 10.3389/fmicb.2014.00657
Strycharz S.M., Gannon S.M., Boles A.R., Franks A.E., Nevin K.P., Lovley D.R. Reductive dechlorination of 2-chlorophenol by Anaeromyxobacter dehalogenans with an electrode serving as the electron donor // Environ. Microbiol. Rep. 2010. V. 2. P. 289–294. doi 10.1111 /j.1758-2229.2009.00118.x
Szewzyk R., Pfennig N. Complete oxidation of catechol by the strictly anaerobic sulfate-reducing Desulfobacterium catecholicum sp. nov. // Arch. Microbiol. 1987. V. 147. P. 163–168.
Thomas S.H., Wagner R.D., Arakaki A.K., Skolnick J., Kirby J.R., Shimkets L.J., Sanford R.A., Löffler F.E. The mosaic genome of Anaeromyxobacter dehalogenans strain 2CP-C suggests an aerobic common ancestor to the delta-Proteobacteria // PLoS One. 2008. V. 3. № 5. e2103. https://doi.org/10.1371/journal.pone.0002103.
Van der Westen H.M., Mayhew S.G., Veeger C. Separation of hydrogenase from intact cells of Desulfovibrio vulgaris // FEBS Lett. 1978. V. 86. P. 122–126.
Zeikus J.G., Fuchs G., Kenealy W., Thauer R.K. Oxidoreductases involved in cell carbon synthesis of Methanobacterium thermoautotrophicum // J. Bacteriol. 1977. V. 132. P. 604–613.
Дополнительные материалы отсутствуют.


