Микробиология, 2019, T. 88, № 2, стр. 207-216
Способность актинобактерий родов Dietzia, Gordonia и Rhodococcus аккумулировать ионы никеля
Л. В. Литвиненко *
Институт экологии и генетики микроорганизмов Уральского отделения
Российской академии наук – филиал Пермского федерального исследовательского центра
Уральского отделения Российской академии наук
614081 Пермь, Россия
* E-mail: lkostina@list.ru
Поступила в редакцию 29.06.2017
После доработки 30.10.2018
Принята к публикации 30.11.2018
Аннотация
Исследована способность актинобактерий родов Dietzia, Gordonia и Rhodococcus из Региональной профилированной коллекции алканотрофных микроорганизмов (акроним коллекции ИЭГМ, www.iegm.ru/iegmcol) аккумулировать ионы никеля. Обсуждаются основные физико-химические факторы, определяющие условия поглощения никеля. Отобраны штаммы с высокой (до 95%) аккумулирующей активностью, устойчивые к повышенным (до 10.0 мМ) концентрациям ионов никеля.
Интерес многих микробиологов направлен на проблемы загрязнения окружающей среды, в том числе такими опасными ксенобиотиками, как тяжелые металлы (ТМ). Прежде всего, внимание привлекают металлы, которые наиболее широко и в значительных объемах используются в производственной деятельности. В результате, они накапливаются во внешней среде и, учитывая их биологическую активность и токсические свойства, представляют серьезную опасность. К таким металлам относится никель. Для извлечения никеля из промышленных сточных вод возможно использование бактерий, обладающих устойчивостью к его высоким концентрациям, а также способностью активно аккумулировать никель из объектов окружающей среды. В настоящее время достаточно подробно изучены и описаны механизмы гомеостаза микроорганизмов в отношении никеля (Hausinger, Zamble, 2007), а также белки с молекулярной массой 10–50 кДа, отвечающие за регуляцию ионов Ni2+ в микробных клетках (Nies, 2007; Choudhary, Sar, 2009). Никель, как и другие ТМ, способен неспецифически связываться с внеклеточными метаболитами бактерий, образуя с ними нерастворимые или слаборастворимые комплексы в виде фосфатов, сульфатов, сульфидов и других солей, а также специфически связываться с поверхностными структурами клеточной стенки (Костина и соавт., 2010).
Никель также может взаимодействовать с микробными клетками грамположительных и грамотрицательных бактерий, аккумулируясь в них транспортными системами различной специфичности, в том числе относящимися к двухкомпонентным сигналпроводящим системам (Permina et al., 2006). Так, никель проникает через клеточную оболочку с помощью HoxN, NixA, NicT и NhlF белков (Fulkerson, Mobley, 2000; Hebbeln, Ei-tinger, 2004). Известно, что гены устойчивости к ионам Ni2+ локализованы на бактериальных плазмидах (Сиунова и соавт., 2002; Silver, Phung, 1996). Для Ralstonia metallidurans составлен каталог генов, отвечающих за устойчивость бактериальных клеток к никелю и ряду других ТМ (Mergeay et al., 2003).
В настоящее время имеется обширная информация о большой экологической значимости немицелиальных актинобактерий класса Actinobacteria, занимающего доминирующее положение в экстремальных местообитаниях и обладающего широкими метаболическими возможностями. Несмотря на то, что биология алканотрофных актинобактерий в последнее время находится в центре внимания исследователей, работы, касающиеся кинетики потребления ТМ клетками актинобактерий единичны (Ившина и соавт., 2002; Пешкур, Ившина, 2003; Dabbs, Sole, 1988; Mirimanoff, Wilkinson, 2000; Bell et al., 2004).
Цель настоящего исследования – изучить возможности использования актинобактерий родов Dietzia, Gordonia и Rhodococcus для биоаккумуляции никеля.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были 64 штамма актинобактерий, хранящихся в Региональной профилированной коллекции алканотрофных микроорганизмов (ИЭГМ, № 768 во Всемирной федерации коллекций культур; www.iegm.ru/iegmcol) и принадлежащие к виду Dietzia maris, 2 видам Gordonia: G. rubripertincta и G. terrae, а также 7 видам рода Rhodococcus: R. erythropolis, R. fascians, “R. longus”; R. opacus, R. qingsheengii, R. rhodochrous и R. ruber (табл. 1).
Таблица 1.
Перечень штаммов, использованных в работе
| Род | Вид | Номер штамма в коллекции ИЭГМ |
|---|---|---|
| Dietzia | maris | ИЭГМ 45, ИЭГМ 55Т, ИЭГМ 166, ИЭГМ 291, ИЭГМ 317 |
| Gordonia | rubripertincta | ИЭГМ 95Т, ИЭГМ 96, ИЭГМ 105, ИЭГМ 106, ИЭГМ 128 |
| terrae | ИЭГМ 143Т, ИЭГМ 144, ИЭГМ 146, ИЭГМ 147, ИЭГМ 151, ИЭГМ 157 | |
| Rhodococcus | erythropolis | ИЭГМ 185, ИЭГМ 186, ИЭГМ 201, ИЭГМ 256, ИЭГМ 266, ИЭГМ 268, ИЭГМ 269, ИЭГМ 270, ИЭГМ 708 |
| fascians | ИЭГМ 34, ИЭГМ 38, ИЭГМ 39, ИЭГМ 170, ИЭГМ 278 | |
| “longus” | ИЭГМ 27, ИЭГМ 28, ИЭГМ 29, ИЭГМ 31, ИЭГМ 32, ИЭГМ 33, ИЭГМ 68, ИЭГМ 69 | |
| opacus | ИЭГМ 56, ИЭГМ 57, ИЭГМ 59, ИЭГМ 61, ИЭГМ 246, ИЭГМ 716T, ИЭГМ 717 | |
| qingsheengii | ИЭГМ 267 | |
| rhodochrous | ИЭГМ 62Т, ИЭГМ 63, ИЭГМ 64, ИЭГМ 65, ИЭГМ 646, ИЭГМ 647 | |
| ruber | ИЭГМ 73, ИЭГМ 77, ИЭГМ 84, ИЭГМ 93, ИЭГМ 172, ИЭГМ 223, ИЭГМ 224, ИЭГМ 225, ИЭГМ 226, ИЭГМ 231, ИЭГМ 235, ИЭГМ 327 |
Культивирование актинобактерий. Для изучения способности актинобактерий аккумулировать ионы ТМ использовали жидкую минеральную среду следующего состава (г/л): KH2PO4 – 1.0; (NH4)2HPO4 – 1.5; MgSO4 · 7H2O – 0.2; FeSO4 · · 7H2O – 0.01; ZnSO4 · 7H2O – 0.002. Компоненты питательной среды растворяли в водном растворе сульфата никеля (NiSO4 · 7H2O) в концентрации 1.25–10.0 мМ, приготовленного на бидистиллированной воде. В качестве единственного источника углерода и энергии использовали или/или ацетат аммония – 2.0 г/л, глюкозу – 5.0 г/л, н-гексадекан или н-додекан, в концентрации 3.0 об. %.
Посевным материалом служили бактериальные культуры, предварительно выращенные в мясопептонном бульоне (МПБ) в течение 2 сут. Клеточную биомассу отделяли центрифугированием (20 мин, 5000 g), после чего дважды отмывали деионизированной водой. Осажденные клетки ресуспендировали и использовали как инокулят, который вносили в водный раствор минеральной среды, содержащей соль никеля, в количестве, обеспечивающем начальную концентрацию клеток 3.0 × 109 кл./мл, (что соответствовало 1 об. %). Актинобактерии выращивали в условиях периодического культивирования в колбах Эрленмейера объемом 250 мл на орбитальном шейкере (120–160 об./мин) при температуре 18–28°С в течение 2 сут. Пробы для измерений отбирали через 1, 3, 6, 9, 12, 22, 24 и 48 ч. Параллельно отбирали пробы для определения содержания внутриклеточного белка модифицированным для актинобактерий методом Лоури (Горина, Яковлева, 1980) с помощью двулучевого спектрофотометра Lambda EZ210 (UV/Vis) (“Perkin-Elmer”, США) при λ = = 750 нм. В этих определениях клеточную биомассу отделяли центрифугированием (20 мин, 5000 g) в стационарной центрифуге, после чего дважды отмывали деионизированной водой.
Определение физиологической активности. Физиологическое состояние бактериальных культур контролировали по изменению их оптической плотности и приросту биомассы. Оптическую плотность (ОП600) измеряли спектрофотометрически (λ = 600 нм) с помощью спектрофотометра Lambda EZ201 (UV/Vis) (“Perkin-Elmer”, США). Накопление биомассы определяли весовым методом. Образцы (10 мл) культуры фильтровали через предварительно взвешенные нитроцеллюлозные мембранные фильтры с размером пор 0.2 мкм (“Владисард”), промывали 0.5%-ным раствором NaCl, фильтры высушивали при температуре 105°С до постоянного веса. Вес сухой биомассы рассчитывали в г/л. Чистоту культур и число жизнеспособных клеток определяли методом прямого высева аликвот культур на МПА и микроскопически, просматривая препараты в фазово-контрастном микроскопе Axiostar plus (“Carl Zeiss”, Германия). Дыхательную активность бактериальных клеток оценивали с помощью респирометра Micro-Oxymax® (“Columbus Instruments”, Ohio, США).
При изучении поглощения никеля бактериальными клетками использовали живые и инактивированные автоклавированием (0.5 атм., 20 мин) клетки. Контролем служили: 1) неинокулированная питательная среда, содержащая ионы Ni2+ и 2) бактериальные культуры, выращенные в питательной среде без никеля. О поглощающей способности клеток актинобактерий судили по снижению концентрации Ni2+ в среде, что определяли по формуле: (Снач – Скон/Снач) × 100%, где Снач – исходная; Скон – конечная концентрация ТМ в среде культивирования. Одновременно регистрировали количество Ni2+, поглощенного клеточной биомассой. Для этого образец культуры центрифугировали (5000 g, 20 мин), клетки тщательно отмывали (до отсутствия ионов ТМ в промывных водах) бидистиллированной водой и разрушали ультразвуком (23 кГц, 0.7 А) с помощью низкочастотного диспергатора Soniprep 150 (“Sanyo”, Япония) в течение 15 мин в условиях охлаждения суспензии. Гомогенаты клеток центрифугировали (5000 g, 20 мин). В полученных супернатантах определяли содержание ионов Ni2+ диметилглиоксимным методом спектрофотометрически при длине волны λ = 470 нм (Лурье, 1984). Коэффициент биоаккумуляции рассчитывали по формуле: Свнутр/Свнеш, где Свнутр – количество внутриклеточного металла, мкг/г массы сухих клеток; Свнеш – количество металла в культуральной жидкости, мкг/мл.
Статистическая обработка. Эксперименты проводили в трехкратной повторности. Результаты обрабатывали традиционными методами с помощью пакета компьютерных программ Statistica, версия 6.0 для Windows (“StatSoft Inc.”, 2001), и Excel 2007 (“Microsoft Inc.”, 2007). Для решения отдельных задач применяли кластерный анализ с использованием метода древовидной кластеризации. Критериями оценки явились показатели взвешенного среднего числа пары группы, расстояние (S) между которыми рассчитывали по формуле City-block Manhattan distance, позволяющей снизить влияние отдельных больших различий между объектами на рассчитываемое расстояние.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
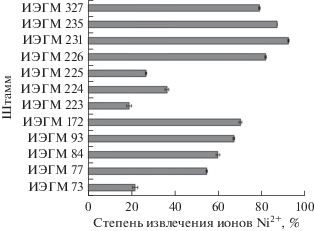
Способность актинобактерий аккумулировать ионы Ni2+. В результате проведенных исследований нами обнаружено, что используемые в работе бактериальные штаммы обладают различной способностью к поглощению никеля. Следует отметить, что адаптационные механизмы неспецифической устойчивости алканотрофных актинобактерий к ионам ТМ были описаны нами ранее (Костина и соавт., 2010; Ившина и соавт., 2013). Большинство (43) бактериальных штаммов извлекали из среды культивирования от 20 до 60% ионов Ni2+ при исходной концентрации металла от 0.6 до 2.5 мМ. Полученные данные, представленные в виде процентного показателя степени извлечения ионов Ni2+ (рис. 1), подвергались обработке методом кластерного анализа. Дендрограмма на рис. 1 иллюстрирует распределение исследуемых бактериальных штаммов по кластерам в зависимости от степени поглощения ионов никеля из среды культивирования. Как следует из дендрограммы, исследуемые штаммы оказались объединены в четыре группы А, Б, В и Г, имеющие внутригрупповой показатель сходства, не превышающий 30 усл. ед. Необходимо отметить, что для большинства (44) исследуемых штаммов аккумуляция ионов Ni2+ различалась не более чем на 10%.
Рис. 1.
Дендрограмма, иллюстрирующая способность исследуемых штаммов актинобактерий аккумулировать ионы Ni2+ (1.25 мМ).

Первую группу (А) составляют штаммы, проявляющие низкую аккумулирующую активность ионов Ni2+ на уровне от 15 до 22%. Эта группа представлена, в основном, тремя видами актинобактерий рода Rhodococcus: “R. longus”, R. opacus и R. qingsheengii (до 3 штаммов каждого вида в группе), и характеризуется высокой степенью их сходства по исследуемому признаку (расстояние между штаммами на построенной диаграмме не превышает 10 усл. ед.). Помимо вышеперечисленных видов в состав данной группы входят отдельные штаммы – представители видов G. rubripertincta, G. terrae, R. erythropolis, R. rhodochrous и R. ruber.
Вторая группа (Б) обладает средней (23–38%) аккумулирующей способностью, тогда как группа В характеризуется высоким (40–60%) уровнем аккумулирующей способности в отношении ионов никеля.
Группа Г включает 12 штаммов актинобактерий, относящихся, в основном, к видам G. rubripertincta, R. fascians, R. rhodochrous и R. ruber. Представители данной группы проявляют наиболее высокую (66–95%) металлаккумулирующую активность и характеризуются внутригрупповым показателем сходства 19–25 усл. ед.
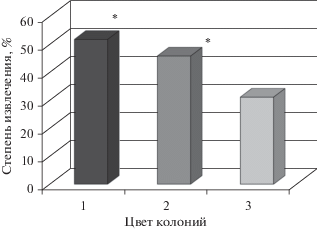
Необходимо отметить, что данные группы объединяют все исследуемые в работе виды актинобактерий, и степень сходства внутри групп составляет от 18 до 22 усл. ед. (рис. 1). Представители видов D. maris, G. rubripertincta, R. rhodochrous и R. ruber, имеющие красно-оранжевый недиффундирующий пигмент, а также R. fascians с ярко-желтой окраской бактериальных колоний, характеризуются более выраженной степенью извлечения ионов ТМ. В среднем они извлекают из среды культивирования от 40 до 50% ионов Ni2+ (рис. 2), что достоверно (p < 0.05) отличает их по этому признаку от представителей видов R. erythropolis, “R. longus”, R. opacus и R. qingsheengii, образующих колонии кремового и телесно-палевого цвета, и извлекающих из среды культивирования от 15 до 30% ионов никеля. Высокая степень извлечения никеля пигментированными штаммами актинобактерий согласуется с известными литературными данными (Ившина и соавт., 2002; Gadd, 1990) и свидетельствует об участии пигментов в процессе биологической сорбции ионов ТМ. Известно (Ившина и соавт., 2013), что для пигментированных форм актинобактерий характерна повышенная жизнеспособность при воздействии неблагоприятных факторов окружающей среды, в частности, пониженной температуры, влиянии антимикробных соединений и ряда других.
Рис. 2.
Степень извлечения никеля (1.25 мМ) в зависимости от пигментирования клеток актинобактерий. 1 – красно-оранжевые (D. maris, G. rubripertincta, G. terrae, R. rhodochrous и R. ruber – 34 культуры); 2 – желтые (R. fascians – 5 культур); 3 – кремовые и палевые (R. erythropolis, “R. longus”, R. opacus и R. qingsheengii – 25 культур) колонии. * Статистически достоверно (p < 0.05) от непигментированных актинобактерий.
Следует отметить, что строгой корреляции между видовой принадлежностью актинобактерий и их способностью аккумулировать ионы Ni2+ нами не выявлено. Установлено, что штаммы актинобактерий в пределах одного вида по способности аккумулировать никель отличаются друг от друга в 1.4–4.8 раза (табл. 2), как, например, штаммы, принадлежащие видам G. rubripertincta, R. rhodochrous и R. ruber. При этом изменений в концентрации никеля в вариантах абиотического контроля нами не обнаружено.
Таблица 2.
Поглощение никеля (1.25 мМ) клетками актинобактерий в присутствии глюкозы
| Род, вид | Количество штаммов | Степень извлечения Ni2+, % | |
|---|---|---|---|
| минимальная | максимальная | ||
| D. maris | 5 | 30.8 ± 0.63 | 44.2 ± 0.08 |
| G. rubripertincta | 5 | 18.0 ± 0.07 | 72.1 ± 0.08 |
| G. terrae | 6 | 17.1 ± 0.10 | 42.0 ± 0.10 |
| R. erythropolis | 9 | 21.5 ± 0.16 | 57.4 ± 0.05 |
| R. fascians | 5 | 29.6 ± 0.23 | 74.0 ± 0.16 |
| “R. longus” | 8 | 16.6 ± 0.34 | 44.0 ± 0.08 |
| R. opacus | 7 | 19.1 ± 0.08 | 42.0 ± 0.30 |
| R. qingsheengii | 1 | 15.1 ± 0.11 | 15.1 ± 0.11 |
| R. rhodochrous | 6 | 17.6 ± 0.30 | 78.0 ± 0.12 |
| R. ruber | 12 | 19.1 ± 0.57 | 92.2 ± 0.16 |
| Абиотический контроль | 0.6 ± 0.05 | ||
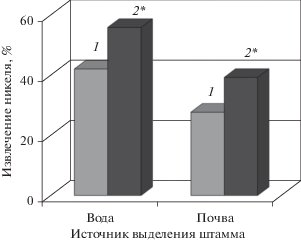
Возможно, неоднородность актинобактерий по способности извлечения из среды никеля связана с их экологической приуроченностью. На рис. 3 представлены данные по влиянию зависимости от источника выделения чистых культур алканотрофных актинобактерий (64 штамма) на их способности аккумулировать из среды ионы Ni2+. Штаммы, выделенные из загрязненных нефтью сред, как водных, так и почвенных, по способности к извлечению никеля из среды культавирования на 10–15% превышают выделенные из незагрязненных субстратов.
Рис. 3.
Зависимость способности штаммов актинобактерий к извлечению никеля (1.25 мМ) от загрязненности источника их выделения. Варианты опыта: 1 – штаммы, выделенные из незагрязненных сред (25 штаммов); 2 – штаммы, выделенные из сред, загрязненных нефтью (36 штаммов). * Отличия статистически достоверны при p < 0.05.
Видовая неоднородность алканотрофных актинобактерий в отношении извлечения ионов Ni2+ из среды показана на примере штаммов вида R. ruber. Как видно из рис. 4, наиболее высокую (60% и более) аккумулирующую активность демонстрируют штаммы R. ruber ИЭГМ 93, ИЭГМ 172, ИЭГМ 226, ИЭГМ 231, ИЭГМ 235 и ИЭГМ 327, тогда как, минимальную (менее 30%) способность извлекать ионы Ni2+ проявили штаммы R. ruber ИЭГМ 73, ИЭГМ 223 и ИЭГМ 225.
Динамика процесса поглощения никеля клетками актинобактерий. В следующей серии экспериментов изучали пути поступления никеля в клетки бактерий, а также основные закономерности процессов его накопления живыми и мертвыми клетками. Отметим, что как пассивное накопление никеля, так и его активный транспорт были аналогичны для 10 изученных нами видов актинобактерий. На рис. 5 представлены типичные результаты опытов с живыми и автоклавированными клетками на примере штамма R. ruber ИЭГМ 231 – наиболее активного биоаккумулятора никеля. Установлено, что уровень аккумуляции ионов никеля мертвыми клетками существенно (в 9.4 раз) ниже, чем клетками развивающейся культуры. Было отмечено, что в варианте использования живых клеток степень поглощения Ni2+ резко увеличивалась в течение первых трех часов эксперимента, а затем снижалась. При использовании инактивированных клеток степень извлечения ионов Ni2+ оставалась практически постоянной в течение всего эксперимента и составляла около 9.0%. Так как степень аккумулирующей активности для живых клеток в ходе эксперимента достигала 92.2%, можно заключить, что до 83.2% аккумулирующей активности приходится на способность концентрировать ионы Ni2+ энергозависимым образом, то есть биоаккумулированием. При этом увеличение времени взаимодействия клеток с ионами никеля до 48 ч не приводит к возрастанию его содержания в бактериальных клетках. Достигнутый уровень аккумуляции или не изменяется, или уменьшается, то есть никель вновь поступает из клеток в среду культивирования в результате адаптации или гибели бактериальных клеток (в зависимости от конкретного штамма актинобактерий), при этом концентрация никеля в бактериальных клетках снижается до уровня, который характерен для процесса биосорбции (6.0–19.0%). Следующей закономерностью является установленная зависимость уровня аккумуляции никеля от его исходной концентрации и источника углерода в среде культивирования. Как видно из табл. 3, аккумулирующая активность прямо зависит от концентрации ионов Ni2+ в среде культивирования. Согласно полученным данным, родококки при росте на углеводородсодержащих питательных средах, а также на глюкозе более эффективно извлекают ионы Ni2+ по сравнению с ростом на ацетате аммония в качестве единственного источника углерода и энергии. Несмотря на то, что уровни извлечения никеля клетками родококков при их росте в среде с углеводородами или глюкозой были сопоставимы, временной промежуток, в котором фиксировался максимум поглощения Ni2+ клетками, в среде с глюкозой был в 12–24 раза короче. Это позволяет проводить экспресс исследования по поиску актинобактерий – активных биоаккумуляторов ТМ.
Рис. 5.
Степень извлечения никеля (1.25 мМ) из среды живыми (1) и мертвыми (2) клетками R. ruber ИЭГМ 231 по сравнению с абиотическим контролем (3).
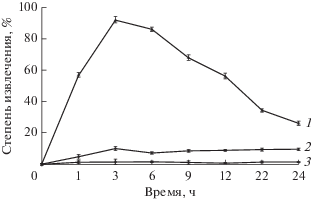
Таблица 3.
Влияние источника углерода в среде культивирования на извлечение ионов Ni2+ (мг/г биомассы) клетками R. ruber ИЭГМ 231
| Исходная концентрация Ni2+, мг/100 мл (мМ) | Источник углерода | |||
|---|---|---|---|---|
| ацетат аммония | н-додекан | н-гексадекан | глюкоза | |
| 35.2 (0.6) | 27.2 ± 0.39 | 33.2 ± 0.80 | 35.2 ± 0.03 | 35.2 ± 0.08 |
| 76.3 (1.3) | 47.9 ± 1.31 | 66.0 ± 1.25 | 75.3 ± 0.67 | 70.3 ± 0.12 |
| 146.7 (2.5) | 36.2 ± 2.24 | 98.6 ± 3.64 | 134.2 ± 1.61 | 119.3 ± 1.64 |
| 293.4 (5.0) | 53.7 ± 3.40 | 113.6 ± 4.75 | 159.6 ± 5.52 | 136.1 ± 6.45 |
| 586.9 (10.0) | 64.5 ± 3.40 | 177.8 ± 2.58 | 214.8 ± 4.00 | 183.7 ± 5.63 |
Изучение влияния таких параметров, как возраст культуры, исходная концентрация клеток актинобактерий, температура культивирования и диапазон активной кислотности на эффективность процесса аккумуляции никеля клетками актинобактерий описан нами ранее (Костина и соавт., 2013). Таким образом, исследованные нами штаммы актинобактерий обладают способностью поглощать из среды культивирования от 9 до 215 мг никеля на 1 г сухой биомассы, что позволяет рассматривать актинобактерии рода Rhodococcus по их способности к биосорбции ионов никеля как конкурентоспособные при сравнении с достаточно широким кругом микроорганизмов (Beolchini et al., 2009; Wang, Chen, 2009).
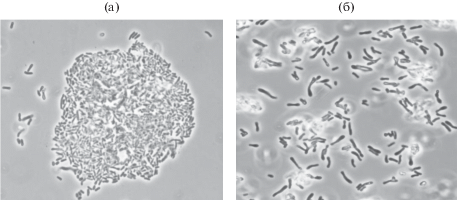
Микроскопические исследования обнаружили морфологические изменения клеток штамма R. ruber ИЭГМ 231 при их культивировании в среде, содержащей никель (рис. 6а): наблюдается образование больших конгломератов, а также уменьшение размера клеток в 2 раза (до 2.5–3.5 мкм) по сравнению с контролем (без ионов Ni2+) и практически отсутствуют V-образные делящиеся клетки. По нашему мнению, ионы никеля ингибируют процесс деления бактериальных клеток, так как количество делящихся клеток в среде с никелем снижается в 6 раз по сравнению с контролем. Для актинобактерий рода Rhodococcus экспоненциальной фазы роста при культивировании их в среде без никеля характерно присутствие палочковидных клеток длиной от 5.0 до 7.0 мкм и шириной 0.5–0.9 мкм, располагающихся единично, V‑образно или палисавидно с большим количеством V-образных делящихся клеток (рис. 6б).
Рис. 6.
Клетки R. ruber ИЭГМ 231 в световом микроскопе после 1 сут инкубирования в присутствии никеля (ув. ×1000). Варианты опыта: а – минеральная среда с Ni2+ (2.5 мМ); б – контроль (среда без добавления ионов ТМ).
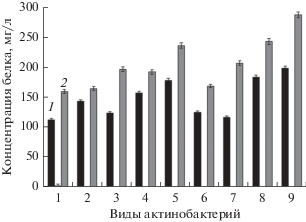
Физиолого-биохимические исследования показали, что при инкубировании актинобактерий в среде, содержащей ионы никеля, через 24 ч культивирования происходит заметное повышение (в 1.2–2.0 раза) содержания внутриклеточного белка по сравнению с контролем (без ионов Ni2+) (рис. 7). Подобная закономерность выявлена для всех исследованных в работе бактериальных культур. При этом внутривидовые различия по содержанию белка в клетках культивируемых в течении 24 ч в среде, содержащей ионы Ni2+, не превышают 14%. Полученные результаты подтверждают высказанное ранее предположение, что отмеченное повышение белкового синтеза является проявлением одного из механизмов адаптации бактерий к металлическому стрессу, в результате которого связывание ТМ с функциональными группами белковых молекул способствует снижению токсического эффекта, вызываемого ионами ТМ (Костина и соавт., 2010).
Рис. 7.
Влияние ионов Ni2+ на содержание внутриклеточного белка. Варианты опыта: 1 – контроль (среда без внесения ионов ТМ); 2 – среда, содержащая ионы Ni2+ (2.5 мМ) через 24 ч культивирования. Виды актинобактерий: 1 – D. maris (5); 2 – G. rubripertincta (5); 3 – G. terrae (6); 4 – R. erythropolis (9); 5 – R. fascians (5 штаммов); 6 – “R. longus” (8); 7 – R. opacus (7); 8 – R. rhodochrous (6); 9 – R. ruber (12 штаммов).
Еще одним параметром влияния никеля на физиолого-биохимические процессы жизнедеятельности клеток актинобактерий было изменение их дыхательной активности, что было исследовано на примере штамма R. ruber ИЭГМ 231 (рис. 8). Интенсивность дыхания определяли по параметрам потребления бактериями кислорода и выделению углекислого газа в динамике развития бактериального штамма. Как видно из рис. 8, дыхательная активность клеток родококков была в 1.5–2.0 раза ниже при инкубировании в среде, содержащей ионы Ni2+, по сравнению с ростом в минеральной среде, не содержащей ионы ТМ. При этом содержание О2 и СО2 в абиотическом контроле практически не изменялось и не превышало 200 мкл.
Рис. 8.
Влияние ионов Ni2+ на дыхательную активность клеток R. ruber ИЭГМ 231 (ОП600 = 2.0). Параметры измерений: а – аккумуляция кислорода, мкл; б – скорость потребления кислорода, мкл/мин; в – выделение углекислого газа, мкл; г – скорость выделения углекислого газа, мкл/мин. Варианты опыта: 1 – бактериальная культура в среде без внесения ионов ТМ; 2 – бактериальная культура в среде, содержащей Ni2+ (2.5 мМ); 3 – абиотический контроль.
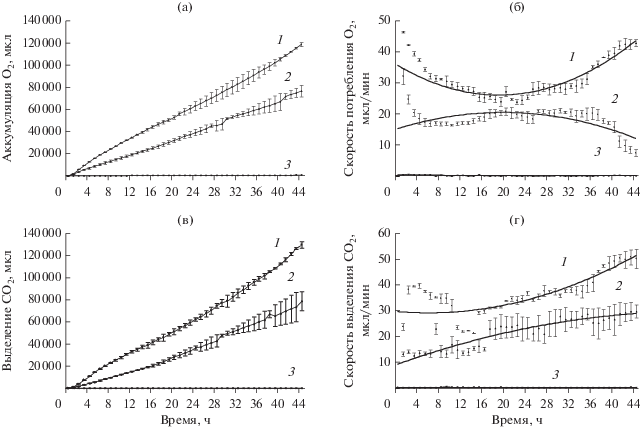
Общее потребление О2 клетками родококков в среде без внесения ионов ТМ составило 5.97 × × 10–4 мкл на клетку, тогда как в среде, содержащей ионы Ni2+, 3.85 × 10–4 мкл на клетку. Выделение CO2 в среду культивирования составило 1298.2 ± 29.25 мкл на мл среды, тогда как в среде, содержащей ионы Ni2+, составило 778.5 ± 8.67 мкл на мл среды. Контрольные показатели (среда без внесения бактериальной культуры) во всех вариантах проведенных измерений были близки к нулю (рис. 8). Кумулятивное потребление О2 и выделение СО2 клетками родококков при высокой оптической плотности развивающейся бактериальной культуры (ОП600 = 2.0) в 1.5–1.7 раз выше, чем при культивировании в среде, содержащей ионы ТМ. Как видно из рис. 8, полиномиальная аппроксимация более всего соответствует описанию взаимосвязи между концентрацией клеток Rhodococcus и их респираторной активностью. Используя полиномиальную аппроксимацию второго порядка, было показано, что дальнейшее инкубирование не приводит к интенсификации дыхательной активности, что, возможно, связано с ограничением роста бактериальной культуры.
Динамика потребления О2 и выделения СО2 клетками родококков показана на рис. 8б, 8г. Средняя скорость (18.5 ± 3.66 мкм/мин) потребления кислорода в среде, содержащей ионы Ni2+, достигалась к 3.5 ч инкубации и поддерживалась в течение 34 ч с последующим снижением на 60% к концу инкубации. Можно отметить, что постоянная интенсивная респирация клеток родококков в присутствии ионов Ni2+ показала высокую активность и стабильность. Скорость потребления О2 в среде без добавления ионов ТМ достигала 31.6 ± 6.07, что в 1.7 раз превышает таковую в среде с ионами Ni2+. Максимальная скорость потребления кислорода (21.2 и 46.5 мкм/мин) была зафиксирована через 29 ч и 1 ч инкубирования в среде, содержащей ионы Ni2+ и без внесения ТМ соответственно. Основываясь на данных, полученных при изучении динамики респирации (см. рис. 8б), и количестве жизнеспособных клеток, установлено, что скорость потребления кислорода составляла 0.18–0.32 мкл мин–1/мг сухих клеток.
Подобные результаты получены при изучении скорости выделения СО2 (рис. 8г), так средняя скорость составила 21.6 ± 5.82 и 36.5 ± 7.71 мкл/мин в среде, содержащей Ni2+, и без ТМ соответственно. Максимальная скорость выделения СО2 в обоих вариантах опыта зафиксирована к 44 ч инкубирования. Следует отметить, что изменение дыхательной активности в абиотическом контроле не превышало 0.5 мкл мин–1. Полученные результаты свидетельствуют о подавлении дыхательной активности клеток родококков (в 1.7–2.0 раза) при выращивании в среде, содержащей ионы Ni2+, по сравнению с таковой без внесения ионов ТМ.
По нашим данным, представители актинобактерий разных родов по способности аккумулировать ионы никеля распределяются в следующий порядок: Rhodococcus > Gordonia > Dietzia. В результате проведенных скрининговых исследований по изучению металлаккумулирующей способности чистых культур алканотрофных актинобактерий выявлены количественные различия в степени поглощения ионов Ni2+ из среды культивирования. Отобраны штаммы, являющиеся наиболее активными биоаккумуляторами никеля: G. rubripertincta ИЭГМ 95Т, ИЭГМ 105; R. fascians ИЭГМ 39; R. rhodochrous ИЭГМ 62Т, ИЭГМ 64, ИЭГМ 646; R. ruber ИЭГМ 84, ИЭГМ 93, ИЭГМ 172, ИЭГМ 226, ИЭГМ 231, ИЭГМ 235, ИЭГМ 327, извлекающие из среды от 60 до 95% ионов ТМ. Эти штаммы имеют практическую значимость и могут быть использованы для биотехнологической очистки природных и сточных вод, загрязненных высокими концентрациями ионов ТМ.
Исследования выполнены в рамках Комплексной программы 18-4-8-21 и государственного задания (№ госрегистрации темы: 01201353247).
Список литературы
Горина И.А., Яковлева В.И. Быстрый метод определения содержания белка в клетках микроорганизмов // Прикл. биохимия и микробиология. 1980. Т. 16. № 6. С. 936–937.
Ившина И.Б., Куюкина М.С., Костина Л.В. Адаптационные механизмы неспецифической устойчивости алканотрофных актинобактерий к ионам тяжелых металлов // Экология. 2013. № 2. С. 115–123.
Ivshina I.B., Kuyukina M.S., Kostina L.V. Adaptive mechanisms of nonspecific resistance to heavy metal ions in alkanotrophic actinobacteria // Rus. J. Ecol. (Ekologiya). 2013. P. 115–123.
Ившина И.Б., Пешкур Т.А., Коробов В.П. Эффективное извлечение цезия клетками бактерий рода Rhodococcus // Микробиология. 2002. Т. 71. № 3. С. 418–423.
Ivshina I.B., Peshkur T.A., Korobov V.P. Efficient uptake of cesium ions by Rhodococcus cells // Microbiology (Moscow). 2002. V. 71. P. 357–361.
Костина Л.В., Куюкина М.С., Ившина И.Б. Биосорбция, аккумуляция и способы извлечения тяжелых металлов. LAP Lambert Academic Publishing, 2010. 254 с.
Костина Л.В., Куюкина М.С., Ившина И.Б. Извлечение ионов тяжелых металлов клетками Rhodococcus ruber ИЭГМ 231 // Вестн. Пермского гос. ун-та. Серия Биология. 2013. Вып. 2. С. 42–48.
Лурье А. Аналитическая химия промышленных вод. М.: Химия, 1984. 448 с.
Пешкур Т.А., Ившина И.Б. Особенности аккумуляции цезия бактериальными клетками Rhodococcus ruber при росте на н-гексадекане // Экология. 2003. № 1. С. 84–86.
Peshkur T.A., Ivshina I.B. Specific accumulation of cesium by Rhodococcus ruber cells grown on n-hexadecane // Rus. J. Ecol. (Ekologiya). 2003. P. 65–67.
Сиунова Т.В., Кочетков В.В., Валидов Ш.З., Сузина Н.Е., Боронин А.М. Продукция феназиновых антибиотиков у штамма Pseudomonas aureofaciens, содержащего плазмиду резистентности к кобальту и никелю // Микробиология. 2002. Т. 71. № 6. С. 778–785.
Siunova T.V., Kochetkov V.V., Validov Sh.Z., Suzina N.E., Boronin A.M. The production of phenazine antibiotics by the Pseudomonas aureofaciens strain with plasmid-controlled resistance to cobalt and nickel // Microbiology (Moscow). 2002. V. 71. P. 670–676.
Bell J.M.L., Philp J.C., Kuyukina M.S., Ivshina I.B., Dunbar S.A., Cunningham C.J., Anderson P. Methods evaluating vanadium tolerance in bacteria isolated from crude oil contaminated land // J. Microbiol. Methods. 2004. V. 58. P. 87–100.
Beolchini F., Dell’Anno A., De Propris L., Ubaldini S., Cerrone F., Danovaro R. Auto- and heterotrophic acidophilic bacteria enhance the bioremediation efficiency of sediments contaminated by heavy metals // Chemosphere. 2009. V. 74. P. 1321–1326.
Choudhary S., Sar P. Characterization of a metal resistant Pseudomonas sp. isolated from uranium mine for its potential in heavy metal (Ni2+, Co2+, Cu2+, and Cd2+) sequestration // Biores. Technol. 2009. V. 100. P. 2482–2492.
Dabbs E.R., Sole G.J. Plasmid-borne resistance to arsenate, arsenite, cadmium, and chloramphenicol in a Rhodococcus species // Mol. Gen. Genom. 1988. V. 211. P. 148–154.
Fulkerson J.F., Mobley L.T. Membrane topology of the NixA nickel transporter of Helicobacter pylori: two nickel transport-specific motifs within transmembrane helices II and III // J. Bacteriol. 2000. V. 182. P. 1722–1730.
Gadd G.M. Metal tolerance // Microbiology of extreme environments / Ed. Edwards C. Open University Press, Milton Keynes, 1990. P. 178–210.
Hausinger R.P., Zamble D.B. Microbial physiology of nikel and cobalt // Molecular Microbiology of Heavy Metals / Eds. Nies D.H., Silver S. Berlin: Springer-Verlag, 2007. P. 287–320.
Hebbeln P., Eitinger T. Heterologous production and characterization of bacterial nikel/cobalt permeases // FEMS Microbiol. Lett. 2004. V. 230. P. 129–135.
Mergeay M., Monchy S., Vallaeys T., Auquier V., Benotmane A., Bertin P., Taghavi S., Dunn J., van der Lelie D., Wattiez R. Ralstonia metallidurans, a bacterium specifically adapted to toxic metals: towards a catalogue of metal-responsive genes // FEMS Microbiol. Rev. 2003. V. 27. P. 385–410.
Mirimanoff N., Wilkinson K.J. Regulation of Zn accumulation by a freshwater gram-positive bacterium (Rhodococcus opacus) // Environ. Sci. Technol. 2000. V. 34. P. 616–622.
Nies D.H. Bacterial transition metal homeostasis // Molecular Microbiology of Heavy Metals / Eds. Nies D.H., Silver S. Berlin: Springer-Verlag, 2007. P. 117–142.
Permina E.A., Kazakov A.E., Kalinina O.V., Gelfand M.S. Comparative genomics of regulation of heavy metal resistance in Eubacteria // BMC Microbiol. 2006. V. 6. P. 49–60.
Silver S., Phung L.T. Bacterial heavy metal resistance: new surprises // Annu. Rev. Microbiol. 1996. V. 50. P. 753–789.
Wang J., Chen C. Biosorbents for heavy metals removal and their future // Biotechnol. Advances. 2009. V. 27. P. 195–226.
Дополнительные материалы отсутствуют.