Микробиология, 2019, T. 88, № 2, стр. 129-136
Бактериальная адгезия и образование биопленок в присутствии хитозана и его производных
Т. В. Полюдова a, b, *, Б. Ц. Шагдарова c, В. П. Коробов a, d, В. П. Варламов c
a Институт экологии и генетики микроорганизмов Уральского отделения Российской академии наук –
филиал Пермского федерального исследовательского центра УрО РАН
614081 Пермь, Россия
b Пермский государственный аграрно-технологический университет
им. академика Д.Н. Прянишникова
614990 Пермь, Россия
c Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
d Пермский национальный исследовательский политехнический университет
614990 Пермь, Россия
* E-mail: poludova@iegm.ru
Поступила в редакцию 23.08.2018
После доработки 21.11.2018
Принята к публикации 30.11.2018
Аннотация
Изучено влияние хитозана и его производных на адгезию и формирование биопленок бактериями c диаметрально противоположными свойствами поверхностей клеток. Показано, что обработка поверхности полистирола хитозаном или его кватернизированным производным существенно снижают ее гидрофобность, что приводит к более чем четырехкратному подавлению адгезии к ней бактерий Mycobacterium smegmatis. Напротив, бактерии Escherichia coli, обладающие относительно гидрофильной поверхностью клеток, проявляли большее сродство к поверхности полистирола в присутствии хитозана. Впервые продемонстрирована возможность ингибирования процесса формирования биопленок M. smegmatis хитозаном, антимикобактериальные свойства которого многократно усиливаются после его кватернизации. В то же время, повышение гидрофобности кватернизированного хитозана приводит к снижению эффективности его действия на бактерии E. coli, обладающие относительно гидрофильной поверхностью. Хитозан в сукцинилированной форме с отрицательно заряженными сайтами в структуре практически не проявляет антибактериальных свойств за счет снижения способности связывания с клетками-мишенями.
Антибактериальные свойства хитозана являются объектом перманентного внимания микробиологов на протяжении ряда последних лет. На основе этого природного полимера изготавливаются антимикробные пленки и покрытия, эффективно подавляющие рост грамположительных и грамотрицательных бактерий, а также дрожжей и плесневых грибов (Siripatrawan, 2010; Tang et al., 2010). Одним из уникальных свойств хитозана является его высокая способность сорбироваться на различных материалах, благодаря чему он используется в качестве композитного элемента для получения биосовместимых пленок и покрытий имплантируемых устройств, сочетающих в себе антимикробные свойства и высокую биосовместимость (Casettari et al., 2012; Чащин, 2013). Известно, что одной из актуальных проблем современной медицины являются инфекции, связанные с использованием долговременных медицинских устройств, обусловленные способностью бактерий к быстрому образованию биопленок на поверхностях различных материалов (Koo et al., 2017). Прикрепившиеся к поверхностям имплантируемых устройств бактерии и дрожжи способны вызывать острые и хронические инфекции, характерной особенностью которых является образование биопленок, в которых бактериальные клетки защищены от иммунных систем организма хозяина и антибиотических препаратов.
Антимикробное действие растворимого хитозана на планктонные системы микроорганизмов изучены достаточно хорошо. Вместе с тем, следует отметить, что выраженная эффективность антибактериальных препаратов в отношении планктонных клеток не всегда реализуется при их действии на клеточные элементы биопленок.
Первичным этапом формирования биопленок бактериями является их адгезия к атакуемой поверхности. Учитывая высокую сорбционную активность хитозана и его производных, важно понимать особенности колонизации бактериями с разными фенотипами абиотических поверхностей в присутствии аминированных полисахаридов.
Целью настоящей работы было изучение адгезии и формирования биопленок бактриями E. coli АТСС 25922 и M. smegmatis mc2 155 на твердой гидрофобной поверхности полистирола в присутствии хитозана и его производных.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования явились бактерии Escherichia coli АТСС 25922 и Mycobacterium smegmatis mc2 155, которые культивировали на жидкой среде LB, содержащей (г/л): триптон (“Fluka”, США) – 10, дрожжевой экстракт (“BD”, США) – 5, KCl (“Реахим”, Россия) – 6.4. Определение степени гидрофобности поверхностей бактерий проводили с помощью МАТН-теста (Microbial Adhesion to Hydrocarbons) с н-гексадеканом (Rosenberg et al., 1980).
В работе использовали высокомолекулярный крабовый хитозан в форме гидрохлорида с молекулярной массой (ММ) 200 кДа и степенью дезацетилирования (СД) 87%, производимый ООО “Биопрогресс” (Россия), кватернизированный хитозан – положительно заряженное производное со степенью замещения (СЗ) 98%, полученный на основе хитозана с ММ 20 кДа с применением глицидилтриметиламмония хлорида методом алкилирования (Шагдарова и соавт., 2016), и сукцинилированный хитозан – отрицательно заряженное производное со степенью замещения остатками янтарной кислоты >45%, полученный на основе хитозана с ММ 130 кДа (Свирщевская и соавт., 2016).
Определение минимальной ингибирующей (МИК) и минимальной бактерицидной концентраций (МБК) препаратов хитозана проводили методом серийных разведений в микропланшетах, согласно рекомендациям Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute (CLSI), США) и высокоэффективным методом Flash microbiocide (Кононова и соавт., 2017).
Для изучения интенсивности адгезии бактерий к полистиролу 2.7 мл суспензии отмытых бактериальных клеток (108 КОЕ/мл) в питательной среде LB вносили в полистироловые чашки Петри (диаметр 36 мм). Влияние хитозана на активность адгезионного процесса исследовали, добавляя в инкубационную среду 0.3 мл водного раствора хитозана или его кватернизированного и сукцинилированного производных в исходных концентрациях 1 мг/мл. В контрольном варианте к бактериальной суспензии добавляли 0.3 мл воды. Абиотическим контролем служили растворы хитозанов в стерильной среде LB. Чашки Петри инкубировали 30 мин при 37°С. Затем жидкую часть содержимого удаляли, чашки трижды промывали 3 мл стерильной воды и окрашивали 0.1% раствором генцианвиолета в течение 10 мин. Несвязавшийся краситель несколько раз отмывали стерильной водой до прекращения окрашивания промывных вод. Поверхность высушенных чашек Петри просматривали на микровизоре “Ломо” (Россия) с иммерсией при увеличении ×1000. Количество связавшихся с поверхностью клеток определяли после просмотра не менее чем 20 полей зрения, рассчитывая среднее количество адгезированных бактерий в поле зрения микровизора.
Для определения уровня гидрофобности поверхности полистирола чашек Петри после их инкубации с растворами хитозана и его производных в стерильной среде LB жидкость удаляли аспирацией и трижды промывали 3 мл воды. После высушивания при комнатной температуре определяли уровень гидрофобности полученных поверхностей путем измерения краевого угла смачивания по модифицированному методу сидячей капли (Фролова, Городский, 1986). На подготовленные поверхности чашек Петри наносили несколько капель дистиллированной воды объемом 10 мкл, затем в течение 60 с после контакта с поверхностями фотографировали профиль полученных капель, используя цифровую фотокамеру “Nikon D90”. На полученных фотографиях, используя программное обеспечение GIMP 2.0, вручную измеряли радиус (r) и высоту (h) капель. Контактные углы (θ,°) вычисляли по формуле θ = = 2 × arctg(h/r).
Рост биопленок в присутствии хитозана и его производных исследовали при культивировании бактерий в плоскодонных полистироловых планшетах (“Медполимер”, Россия). В лунки планшетов вносили среду LB, проводили серию двукратных разведений исходных растворов хитозанов, а затем вносили по 10 мкл инокулума бактерий (107 КОЕ/мл) и инкубировали при 37°С в течение 24 ч (E. coli) и 72 ч (M. smegmatis). Жизнеспособность клеток в сформированных биопленках оценивали по окрашиванию раствором тиазолил тетразолия бромида при концентрации 0.1 мг/мл (“Sigma”, США), который вносили в количестве 100 мкл в лунки планшетов с промытыми биопленками. После инкубации при 37°С в течение 4 ч образовавшийся формазан экстрагировали 20%-ным раствором твина 80, приготовленным на 50%-ном этаноле, в течение 2 ч. Оптическую плотность экстрактов измеряли на планшетном спектрофотометре Benchmark Plus (“Biorad”, США) при длине волны 570 нм.
Морфология клеток M. smegmatis mc2 155 после культивирования в течение 72 ч в среде LB в полистироловых чашках Петри в присутствии кватернизированного хитозана была исследована с использованием атомно-силовой микроскопии (АСМ). Биопленки микобактерий трижды промывали стерильной деионизированной водой, фиксировали 2.5% глутаральдегидом в течение 1 ч, а затем трижды отмывали водой и высушивали. Поверхность чашек Петри исследовали на микроскопе AFM Nano DST (“Pacific nanotechnology”, США). Все представленные AСМ-изображения являются репрезентативными для большого количества полученных изображений. Клетки микобактерий, инкубированные в полистироловых чашках Петри в среде LB без хитозана в течение 72 ч, использовали в качестве положительного контроля.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что микобактерии и клетки кишечной палочки обладают принципиальными различиями в строении клеточной стенки. Особенность этих различий заключается еще и в выраженных отличиях уровней гидрофобности их поверхностей. Особые характеристики микобактерий во многом обусловлены строением их клеточной стенки, содержащей миколовые кислоты, которые придают клеточной поверхности гидрофобность и способность к использованию гидрофобных субстратов, определяя адаптационные возможности. Известно, что липиды оболочки микобактерий составляют более 60% их сухой массы, что определяет нестандартность тинкториальных, физиологических и экологических свойств всех представителей рода Mycobacterium (Zhiguo, Jeroen De Buck, 2010). Напротив, грамотрицательные бактерии обладают значительно более гидрофильной поверхностью и, кроме того, имеют различные надмембранные образования, включая жгутики, пили или фимбрии, которые, как правило, участвуют в адгезии, опосредуя взаимодействия бактерий с различными поверхностями (Werneburg, Thanassi, 2018).
Экспериментально установлено, что более 80% популяции бактерий M. smegmatis mc2 155, выращенных на среде LB, обладают выраженным сродством к н-гексадекану. В то же время, гидрофобность бактерий E. coli АТСС 25922 едва достигала 2–4%. В связи с этим, следует отметить, что поверхностный заряд и гидрофобность бактерий могут являться определяющими факторами интенсивности их первичной адгезии на твердых поверхностях (Dunne, 2002), а также чувствительности к тем или иным антибактериальным соединениям (Silhavy et al., 2010).
Определением минимальной подавляющей (МПК) и минимальной бактерицидной концентраций (МБК) хитозана и его производных показано, что бактерии M. smegmatis mc2 155 являются более чувствительными к этим соединениям, по сравнению с E. coli АТСС 25922 (табл. 1).
Таблица 1.
Минимальные подавляющая и бактерицидная концентрации хитозана и его производных в отношении бактерий E. coli АТСС 25922 и M. smegmatis mc2 155, мкг/мл
| Бактерии | Хитозан | Хитозан кватернизированный | Хитозан сукцинилированный | |||
|---|---|---|---|---|---|---|
| МПК | МБК | МПК | МБК | МПК | МБК | |
| M. smegmatis mc2 155 | 80 | 160 | 1.25 | 2.5 | 2500 | – |
| E. coli АТСС 25922 | 80 | 600 | 300 | 1250 | – | – |
Представленные в табл. 1 данные свидетельствуют о том, что МПК хитозана для изученных бактерий оказалась одинаковой, однако использование метода “Flash microbiocide” позволило установить бактерицидные концентрации этого соединения, которые существенно различались для E. coli АТСС 25922 и M. smegmatis mc2 155. Производное хитозана, полученное путем алкилирования и обладающее большей степенью замещения аминогрупп на четвертичные аммониевые (до 98%) (Шагдарова и соавт., 2016), проявляло наиболее выраженное антимикробное действие на микобактерии с существенным снижением МПК и МБК. Однако важно отметить, что кватернизированный хитозан обладал меньшей антибактериальной активностью в отношении E. coli АТСС 25922, по сравнению с хитозаном в форме гидрохлорида с ММ 200 кДа, СД 95%. Вероятно, данный эффект может быть связан с увеличением гидрофобности молекул кватернизированного хитозана, что приводит к возрастанию антибактериального эффекта в отношении бактерий M. smegmatis mc2 155 и снижает его в отношении относительно гидрофильных бактерий E. coli АТСС 25922.
Сукцинилирование хитозана приводит к появлению в его структуре отрицательно заряженных сайтов, что сопровождается подавлением его антибактериального действия за счет снижения способности связывания с клетками-мишенями. Абсолютная устойчивость к сукцинилхитозану обнаружена у E. coli, по-видимому, из-за выраженных анионных свойств поверхностных структур этих бактерий.
Внесение хитозана и его производных в среду инкубации бактерий существенно влияло на их адгезионные свойства. При этом сродство бактерий E. coli и M. smegmatis к полистиролу в присутствии хитозанов значительно различалось. Наибольшим сродством к полистиролу обладали бактерии M. smegmatis mc2 155, количество которых в поле зрения микроскопа достигало 20 клеток, после 30 мин инкубации их суспензий в полистироловых чашках Петри. Этот же показатель для бактерий E. coli АТСС 25922 составлял всего лишь 1–2 клетки в поле зрения микроскопа (рис. 1).
Рис. 1.
Адгезия бактерий E. coli АТСС 25922 (1) и M. smegmatis mc2 155 (2) на поверхности полистирола в присутствии хитозана и его производных через 30 мин инкубации. По оси абсцисс: 1 – контроль; 2 – хитозан; 3 – кватернизированный хитозан; 4 – сукцинилхитозан. 1 – E. coli ATCC 25822, 2 – M. smegmatis mc2 155.
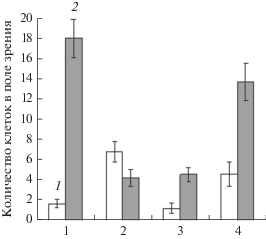
Наличие хитозана и его кватернизированного производного в среде инкубации бактерий приводило к резкому уменьшению числа адгезированных микобактерий, в то время как внесение сукцинилхитозана лишь незначительно снижало количество сорбирующихся на поверхности полистирола клеток M. smegmatis mc2 155.
Другая картина наблюдалась при внесении изучаемых аминированных полисахаридов в среду инкубации бактерий E. coli АТСС 25922. Так, присутствие в среде хитозана и сукцинилхитозана способствовало адгезии бактерий на поверхности полистирола, в то время как кватернизированный хитозан, практически не изменял адгезионных свойств кишечной палочки на поверхности этого полимера. Выявленный эффект, по-видимому, обусловлен изменением физико-химических параметров поверхностей полистирола после сорбции на них молекул хитозана и его производных.
Проведенные исследования показали, что краевой угол смачивания поверхностей полистирола, предобработанных растворами хитозанов в питательной среде LB, существенно уменьшается как при обработке хитозаном, так и его кватернизированным производным. В то же время, предобработка поверхности полистирола сукциноилхитозаном, практически, не вызывала изменений контактного угла смачивания (табл. 2). Таким образом, сорбция хитозана на поверхности полистирола, снижая его гидрофобные свойства, приводила к значительному уменьшению сорбции клеток микобактерий. В то же время, более гидрофильная поверхность полистирола, полученная после предобработки хитозаном, характеризовалась существенным повышением адгезионной активности бактерий E. coli АТСС 25922. Однако прямой зависимости интенсивности адгезии E. coli от изменения степени гидрофобности поверхности модифицированного хитозаном полистирола обнаружено не было. Это связано, вероятно, с тем, что основная роль на ранней стадии колонизации поверхностей грамотрицательными бактериями принадлежит не гидрофобным и электростатическим силам, а надмембранным структурам – жгутикам, пилям или фимбриям, согласованное взаимодействие которых находится под контролем нескольких регуляторных систем, специфически реагирующих на изменение условий среды (Rossi et al., 2018).
Таблица 2.
Характеристика гидрофобности поверхности полистирола после наслоения растворов хитозанов в среде LB течение 30 мин
| Исследуемый фактор | Контактный угол смачивания, град |
|---|---|
| Контроль | 45 ± 2.48 |
| Хитозан | 11 ± 0.72* |
| Хитозан кватернизированный | 14 ± 0.44* |
| Сукцинилхитозан | 54 ± 1.41* |
Выявленное влияние хитозана и его производных на адгезию бактерий к поверхности полистирола, по-видимому, может существенно сказываться и на формировании на ней бактериальных пленок. Длительное культивирование бактерий M. smegmatis сопровождалось формированием выраженных биопленок на поверхности полистирола. Однако бактерии E. coli практически не формировали биопленочных сообществ и выявлялись, преимущественно, в планктонной форме. Как представлено на рис. 2а, незначительное ингибирование формирования слабых биопленок E. coli наблюдалось лишь под действием хитозана и его кватернизированной формы, но только при использовании их в высоких концентрацях (250 и 500 мкг/мл).
Рис. 2.
Биомасса биопленок E. coli АТСС 25922 через 24 ч культивирования (а) и M. smegmatis mc2 155 через 72 ч культивирования (б) в присутствии хитозана и его производных: 1 – контроль; 2 – сукцинилхитозан; 3 – кватернизированный хитозан; 4 – хитозан.
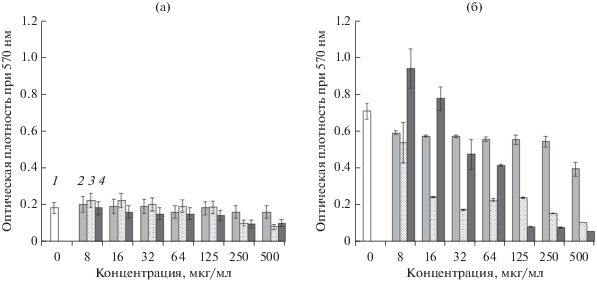
Наиболее чувствительными к присутствию хитозанов в среде оказались процессы формирования биопленок микобактериями (рис. 2б). Так, хитозан в сукцинилированной форме заметно снижал интенсивность формирования биопленок этих бактерий. При концентрации этого производного хитозана в среде роста, равной 500 мкг/мл, наблюдалось значительное подавление биопленкообразования, примерно на 45% по сравнению с контролем. Более низкое содержание сукцинилхитозана (8–250 мкг/мл) в среде приводило к снижению биомассы пленок примерно на 20%. Присутствие в среде кватернизированного производного также существенно ингибировало рост прикрепленных к полистиролу микобактерий во всем диапазоне исследованных концентраций этого соединения.
Обращает на себя внимание тот факт, что низкие концентрации хитозана в среде культивирования стимулировали образование биопленок микобактериями, однако повышение его содержания приводило к значительному ингибированию этого процесса. При расчете концентраций хитозана и его производных, подавляющих формирование биопленок M. smegmatis и E. coli на 50% по сравнению с максимально возможным (IC50), установлено, что наибольшим ингибирующим эффектом обладал кватернизированный хитозан (табл. 3).
Таблица 3.
Концентрации хитозана и его производных (мкг/мл), подавляющие формирование биопленок M. smegmatis и E. coli на 50% по сравнению с максимально возможным (IC50)
| Хитозан | E. coli АТСС 25922 | M. smegmatis mc2 155 |
|---|---|---|
| Хитозан | 204 ± 12.5 | 71 ± 3.5 |
| Хитозан кватернизированный | 268 ± 24.0 | 12 ± 2.4 |
| Сукцинилхитозан | – | 555 ± 40.5 |
Таким образом, наиболее выраженное антибактериальное и ингибирующее развитие биопленок действие было обнаружено для кватернизированной формы хитозана в отношении бактерий M. smegmatis mc2 155. При атомно-силовом сканировании биопленок микобактерий, сформированных в течение 24 ч в присутствии 500 мкг/мл кватернизированного хитозана, выявлено практически полное отсутствие сорбированных на полистироле клеток M. smegmatis (рис. 3б). Бактериальные клетки с выраженными нарушениями их структур были сосредоточены, главным образом, на образующих агломераты частицах хитозана сферической формы с диаметром 0.6–6 мкм. Сорбированные бактериальные клетки имели существенные отличия по морфометрическим показателям при сравнении с клетками контрольной культуры (рис. 3а).
Рис. 3.
АСМ изображения клеток M. smegmatis mc2 155, закрепленных на полистироле и прокультивированных в среде LB в течение 24 ч: а – контроль; б – бактерии в присутствии 500 мкг/мл кватернизированного хитозана.

При инкубации бактерий на поверхности полистирола в присутствии кватернизированного хитозана не обнаруживалось ни увеличения размеров бактерий, ни их деления, а также формирования жгутов и мицелиоподобных структур, характерных для формирующихся на твердых поверхностях биопленок M. smegmatis (рис. 3а). Кроме того, значительно возрастала шероховатость и неоднородность поверхности микобактериальных клеток, инкубированных в присутствии хитозана в течение суток.
Таким образом, проведенные исследования показали, что внесение в среду роста микобактерий как хитозана, так и его кватернизированного производного препятствует образованию биопленок этих бактерий. В меньшей степени этот эффект проявлялся и на бактериях E. coli АТСС 25922, обладающих слабой адгезионной активностью по отношению к полистиролу и большей резистентностью к хитозану и его формам. Сорбция хитозана на поверхности полистирола значительно подавляла бактериальную адгезию, а микобактерии, сорбированные на микросферах хитозана, подвергались выраженному антибактериальному действию, которое приводило к заметному изменению морфометрических характеристик. Важно отметить, что сукцинилированный хитозан, обладающий существенными отличиями физико-химических характеристик, не оказывал выраженного антибактериального действия и практически не проявлял подавляющих адгезию и формирование биопленок свойств в отношении изученных бактерий, для проявления которых большое значение имеет наличие катионных группировок, отсутствующих в структуре сукцинилированного хитозана (Свирщевская и соавт., 2016).
Таким образом, результаты представленных исследований демонстрируют возможность предотвращения адгезии и биопленкообразования микобактерий крабовым хитозаном в форме гидрохлорида с ММ 200 кДа и степенью дезацетилирования 87%, а также его кватернизированным производным, путем внесения хитозанов в среду или посредством предварительного покрытия ими поверхности полистирола. Другими авторами также была показана эффективность предобработки различных поверхностей хитозаном с целью снижения адгезии на них стафилококков, клебсиелл и кандид, в то же время в ряде работ не представлены характеристики использованных форм хитозана (Carlson et al., 2008; Goy et al., 2009; Campana et al., 2017). Вместе с тем, все исследованные в работе формы хитозана не обладали антиадгезионным и подавляющим развитие биопленок E. сoli действием. Биологическая активность хитозана в отношении грамотрицательных бактерий зависит от физико-химических характеристик применяемых производных хитозана. Так, низкомолекулярный хитозан (50 кДа) эффективно ингибирует адгезию грамотрицательных бактерий и формирование ими биопленок (Campana et al., 2017). Высокомолекулярные формы хитозана, содержащие остатки этилхлоркарбоната, напротив, активируют адсорбцию и формирование биопленок E. coli (Shang et al., 2011). Антибактериальное действие изучаемых соединений на грамотрицательные бактерии, вероятно, зависит не только от физико-химических характеристик, а также и от дополнительных условий, например, от уровня кислотности среды культивирования (Helander et al., 2001). В то же время, считается, что бактерии грамотрицательной группы более устойчивы к антибактериальному действию хитозана и его производных (Goy et al., 2009). Однако присутствие хитозана в среде, по-видимому, может сенсибилизировать бактерии к действию других внешних антибактериальных агентов (Helander et al., 2001).
Представленные в настоящем исследовании биологические эффекты новых производных хитозана, полученных путем алкилирования с использованием глицидилтриметиламмония хлорида и сукцинилирования хитозана остатками янтарной кислоты, представляют собой высокий практический интерес, поскольку высокомолекулярный крабовый хитозан в форме гидрохлорида и его новое кватернизированное производное может быть использовано для ингибирования адгезии и образования биопленок микобактерий. В то же время выявлено, что хитозан и его сукцинилированная форма могут усилить адгезию бактерий E. coli на полимерных поверхностях. Это свойство может быть также использовано и для повышения бактериальной адсорбции при управляемом культивировании биопленок в различных биотехнологических процессах.
Работа выполнена в рамках государственного задания (№ госрегистрации темы 01201353249) и поддержана Комплексной программой исследований УРО РАН, проект № 18-7-8-8.
Список литературы
Свирщевская Е.В., Зубарева А.А., Бойко А.А., Шустова О.А., Гречихина М.В., Шагдарова Б.Ц., Варламов В.П. Анализ токсичности и биосовместимости производных хитозана с различными физико-химическими свойствами // Прикл. биохимия и микробиология. 2016. Т. 52. № 5. С. 467–475.
Svirshchevskaya E.V., Zubareva A.A., Boiko A.A., Shustova O.A., Grechikhina M.V., Shagdarova B.T., Varlamov V.P. Analysis of toxicity and biocompatibility of chitosan derivatives with different physico-chemical properties // Appl. Biochem. Microbiol. 2016. V. 52. P. 483–490.
Филиппова О.Е., Корчагина Е.В. Хитозан и его гидрофобные производные: получение и агрегация в разбавленных водных растворах // Высокомолекулярные соединения. Серия А. 2012. Т. 54. № 7. С. 1130–1152.
Чащин И.С. Структура и свойства хитозановых пленок и покрытий, получаемых из растворителей на основе диоксида углерода под высоким давлением. Автореферат дис. … канд. физ.-мат. наук, 19.06.2013. Москва: Московский гос. ун-т им. М.В. Ломоносова, 3013. 23 с.
Лабораторные работы и задачи по коллоидной химии / Под ред. Фролова Ю.Г., Гродского А.С. М.: Химия, 1986. 216 с.
Шагдарова Б.Ц., Ильина А.В., Варламов В.П. Антибактериальная активность алкилированных и ацилированных производных низкомолекулярного хитозана // Прикл. биохимия и микробиология. 2016. Т. 52. № 2. С. 237–241.
Shagdarova B.T., Il’ina A.V., Varlamov V.P. Antibacterial activity of alkylated and acylated derivatives of low-molecular weight chitosan // Appl. Biochem. Microbiol. 2016. V. 52. P. 222–225.
Campana R., Casettari L., Ciandrini E., Illum L., Baffone W. Chitosans inhibit the growth and the adhesion of Klebsiella pneumoniae and Escherichia coli clinical isolates on urinary catheters // Int. J. Antimicrob. Agents. 2017. V. 50. P. 135–141.
Carlson R.P., Taffs R., Davison W.M., Stewart P.S. Anti-biofilm properties of chitosan-coated surfaces // J. Biomater. Sci. Polym. 2008. V. 19. P. 1035–1046.
CLSI. Performance standards for antimicrobial susceptibility testing; twenty-second informational supplement. CLSI document M100-S22. Wayne, PA: Clinical and Laboratory Standards Institute. 2012.
Dunne W.M. Bacterial adhesion: Seen any good biofilms lately? // Clin. Microbiol. Rev. 2002. V. 15. P. 155–166.
Goy R.C., de Britto D., Assis O.B.G. A review of the antimicrobial activity of chitosan // Polímeros: Ciência e Tecnologia. 2009. V. 19. P. 241–247.
Helander I.M., Nurmiaho-Lassila E.L., Ahvenainen R., Rhoades J., Roller S. Chitosan disrupts the barrier properties of the outer membrane of Gram-negative bacteria // Int. J. Food Microbiol. 2001. V. 71. P. 235–244.
Koo H., Allan R.N., Howlin R.P., Stoodley P., Hall-Stoodley L. Targeting microbial biofilms: current and prospective therapeutic strategies // Nature Rev. Microbiol. 2017. V. 15. P. 740–755.
Rosenberg M., Gutnick D., Rosenberg E. Adherence of bacteria to hydrocarbons: A simple method for measuring cell-surface hydrophobicity // FEMS Microbiol. Lett. 1980. V. 9. P. 29–33.
Rossi E., Paroni M., Landini P. Biofilm and motility in response to environmental and host-related signals in Gram-negative opportunistic pathogens // J. Appl. Microbiology. 2018. V. 125. P. 1587–1602. doi 10.1111/jam.14089
Shang B.B., Sha J., Liu Y., Tu Q., Man-Lin L., Wang J.Y. Synthesis of a new chitosan derivative and assay of Escherichia coli adsorption // J. Pharm. Anal. 2011. V. 1. P. 39–45.
Silhavy T.J., Kahne D., Walker S. The bacterial cell envelope // Cold Spring Harb. Perspect. Biol. 2010. P. 1–17. doi 10.1101/ cshperspect.a000414
Siripatrawan U., Harte B.R. Physical properties and antioxidant activity of an active film from chitosan incorporated with green tea extract // Food Hydrocoll. 2010. V. 24. P. 770–775.
Tang H., Zhang P., Kieft T.L., Ryan S.J., Baker S.M., Wiesmann W.P., Rogel S. Antibacterial action of a novel functionalized chitosan-arginine against Gram-negative bacteria // Acta Biomaterialia. 2010. V. 6. P. 2562–2571.
Theapsak S., Watthanaphanit A., Rujiravanit R. Preparation of chitosan-coated polyethylene packaging films by DBD plasma treatment // ACS Appl. Mater. Interfaces. 2012. V. 4. P. 2474–2482.
Werneburg G.T, Thanassi D.G. Pili assembled by the chaperone/usher pathway in Escherichia coli and Salmonella // EcoSal Plus. 2018. V. 8 (1). doi 10.1128/ecosalplus.ESP-0007-2017
Zhiguo H., De Buck J. Cell wall proteome analysis of Mycobacterium smegmatis strain MC2 155 // BMC Microbiol. 2010. V. 10 (121). doi 10.1186/1471-2180-10-121
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


