Микробиология, 2019, T. 88, № 2, стр. 175-183
Биопленкообразование моно- и смешанных культур штаммов Alcaligenes faecalis 2 и Rhodococcus ruber gt 1
А. С. Зорина a, *, Ю. Г. Максимова a, b, В. А. Демаков a, b
a Институт экологии и генетики микроорганизмов УрО РАН,
Пермский федеральный исследовательский центр УрО РАН
614081 Пермь, Россия
b Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
* E-mail: cjcyf_92@mail.ru
Поступила в редакцию 11.06.2018
После доработки 01.11.2018
Принята к публикации 30.11.2018
Аннотация
Изучали биопленкообразование моно- и смешанных культур штаммов нитрилгидролизующих бактерий Alcaligenes faecalis 2 и Rhodococcus ruber gt 1. Образование биопленок оценивали методом их окраски кристаллическим фиолетовым, по энергетическому статусу клеток биопленок и массивности полимерного матрикса. Разработан количественный метод оценки массивности полимерного матрикса по флуоресценции биопленок, окрашенных konA-тетраметилродамином. Среда культивирования, разработанная для выращивания смешанной биопленки Al. faecalis 2 и R. ruber gt 1, включает ацетамид и глюкозу в качестве источников углерода. Показано, что в смешанной биопленке Al. faecalis 2 выступает в качестве первичного колонизатора, а R. ruber gt 1 – микроорганизма-спутника. В сравнении с биопленками монокультур, в смешанной биопленке наблюдалось возрастание массивности полимерного матрикса, а также увеличение биопленкообразования у монокультур Al. faecalis 2 и R. ruber gt 1 при добавлении культуральной жидкости второго штамма. При внесении токсичного субстрата ацетонитрила в планктонные и биопленочные культуры одноразово каждые сутки наблюдалась адаптация к нему бактерий, что фиксировалось по большему количеству выживших клеток, по сравнению с вариантами внесения ацетонитрила каждые 10 мин, и было связано, главным образом, с нитрилгидратазной активностью R. ruber gt 1, трансформирующего ацетонитрил в нетоксичный ацетамид. Полученные результаты демонстрируют перспективность использования бинарной биопленки амидазосодержащей бактерии Al. faecalis 2 и штамма R. ruber gt 1 с высокой нитрилгидратазной активностью в качестве биокатализатора для получения акриловой кислоты или основы биофильтра для очистки сточных вод от нитрилов.
Микроорганизмы существуют во всех слоях биосферы и приспособились к экстремальным условиям существования за счет имеющихся у них разнообразных механизмов адаптации. Одним из таких механизмов является биопленкообразование (Muruzović et al., 2018). Большинство микроорганизмов в природе существуют в прикрепленном состоянии, в биопленках, которые представляют собой сообщества микроорганизмов, адгезированных на поверхности раздела фаз и окруженных полимерным матриксом собственного производства.
В формировании биопленки важную роль играют подвижность клеток, белки клеточной мембраны, внеклеточные полисахариды и сигнальные молекулы. Поскольку все молекулы имеют свойство накапливаться у границы раздела фаз, прикрепленные бактерии лучше снабжаются субстратами, чем планктонные клетки в жидкой среде. Таким образом, первоначальное прикрепление клеток к поверхности может быть следствием их направленного движения, обусловленного хемотаксисом. Биопленкообразование рассматривается как незаменимый механизм адаптации микроорганизмов к неблагоприятным условиям окружающей среды. Клетки микроорганизмов, развивающихся в виде биопленок, имеют ряд преимуществ перед планктонными клетками: они окружены внеклеточным полисахаридным матриксом, который защищает их от различных негативных условий окружающей среды, таких как УФ-излучение, недостаток питательных веществ, резкие изменения значений рН, высушивание (Marić et al., 2007; Matsumoto-Nakano, 2018). Важно отметить устойчивость бактерий биопленок к антибиотикам и другим противомикробным веществам за счет формирования клеток-персистеров и диффузионного барьера, создаваемого экзополисахаридным матриксом, что является причиной неэффективности анти-биотикотерапии и представляет значительную медицинскую проблему (Dufour et al., 2012; Kumara et al., 2017; Omar et al., 2017; Ju et al., 2018; Iliadisa et al., 2018). Функционируя в качестве диффузионного барьера, полисахаридный матрикс защищает клетки также от высоких концентраций субстрата, что особенно важно в случае использования клетками токсичных субстратов и развития в присутствии ингибиторов роста (Rittmann, 2018).
В местах естественного обитания микроорганизмы существуют, как правило, в виде мультивидовых сообществ, что отражено в исследованиях физиологических особенностей клеток в составе мультивидовых биопленок (Ножевникова и соавт., 2015). Отмечается, что в ряде случаев взаимодействие микроорганизмов в многовидовой биопленке влияет на ее общую функциональность и/или окружающую среду, что приводит к увеличению биопленкообразования, усилению устойчивости к антибактериальным агентам, вирулентности или способности к деградации загрязняющих веществ (Burmølle et al., 2014; Chen et al., 2015; Røder et al., 2015). В связи с этим нужно отметить, что прямая экстраполяция результатов лабораторных экспериментов с моновидовыми биопленками на сложные природные биопленки будет неточной (Burmølle et al., 2014).
Некоторые особенности мультивидовых биопленок, отличающие их как от моновидовых биопленок, так и от планктонных культур, определяют их преимущества в процессах биотрансформации и биокатализа. В области биотехнологического применения интерес к конструированию смешанных микробных биопленок связан с возможностью создания биокаталитических систем, осуществляющих многоступенчатые превращения веществ и обладающих большой устойчивостью. Однако при получении таких биопленок с “распределением ролей” составляющих их микроорганизмов, обладающих определенными биотехнологически значимыми свойствами, исследователи сталкиваются с рядом проблем. Во-первых, питательная среда должна быть адаптирована для всех видов микроорганизмов, входящих в состав биопленки. Во-вторых, микроорганизмы в биопленке могут различаться как скоростью роста, так и требованиями к носителю вследствие различных гидрофобно/гидрофильных свойств поверхности клеток. В-третьих, возможен антагонизм между различными видами микроорганизмов, образующих биопленки. В связи с этим при конструировании бинарной или мультивидовой биопленки для биотехнологических целей необходим экспериментальный подбор штаммов, условий роста, носителей и сред культивирования.
Биопленки могут быть полезны как биокатализаторы и в органическом синтезе, и в биотехнологиях, направленных на поддержание экологической безопасности окружающей среды. Биопленки микроорганизмов используют при производстве этанола и уксусной кислоты, в технологиях очистки сточных вод, при биоремедиации загрязненных почв (Dufour et al., 2012; Bakar et al., 2018; Carrel et al., 2018).
Одним из направлений биокатализа, широко применяемого в промышленности, является ферментативный гидролиз нитрилов карбоновых кислот до соответствующих амидов и карбоновых кислот. Ферментативный гидролиз нитрилов, в отличие от химического, протекает в более мягких условиях, а ферменты, катализирующие этот процесс, способны трансформировать широкий диапазон сложных субстратов и обладают большим потенциалом для химического энантио- и региоселективного синтеза (Chen et al., 2009).
В настоящее время известно множество штаммов микроорганизмов, способных осуществлять гидролиз нитрилов в одну или две стадии. Прямой гидролиз нитрила до кислоты катализирует фермент нитрилаза (КФ 3.5.5.1). Последовательный гидролиз нитрила до амида и далее до карбоновой кислоты осуществляется нитрилгидратазой (КФ 4.2.1.84) и амидазой (КФ 3.5.1.4), гены которых чаще всего экспрессируются в одном опероне. Ферментативный гидролиз нитрилов широко применяется в промышленности для получения акриламида и никотиновой кислоты (Chen et al., 2009; Дебабов, Яненко, 2011). Нитрилазная активность в норме невысока, а нитрилгидролизирующие бактерии, способные к двустадийному гидролизу нитрилов, обычно бывают селекционированы в направлении увеличения либо нитрилгидратазной, либо амидазной активности. Поэтому для конверсии нитрила в карбоновую кислоту без загрязнения остаточным амидом, а также для целей очистки среды от нитрильных загрязнений, используют смешанные суспензионные культуры таких бактерий (Kohyama et al., 2006, 2007). Получение их биопленочных культур представляется перспективным.
В работе An et al. (2018) были получены смешанные бактериальные биопленки, состоящие из нитрилгидролизующего Rhodococcus rhodochrous BX2 и обладающего повышенной способностью к биопленкообразованию Bacillus mojavensis M1. Нами предложена бинарная биопленка на основе штаммов Al. faecalis 2 и R. ruber gt 1, обладающих выраженной амидазной и высокой нитрилгидратазной активностями соответственно, что может быть использовано для целей биокатализа или полной минерализации токсичных нитрилов.
Целью работы было оценить физиологические характеристики нитрилгидролизующих бактерий Al. faecalis 2 и R. ruber gt 1 в составе моно- и бинарных биопленок на основании изучения динамики роста биопленок, энергетического статуса клеток, определения массивности полимерного матрикса и устойчивости бактерий к токсичному субстрату, а также взаимного влияния штаммов на их рост и биопленкообразование.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. Штаммы Al. faecalis 2, обладающий выраженной амидазной активностью, и R. ruber gt 1 с высокой нитрилгидратазной активностью были выделены из активного ила коммунально-бытовых биологических очистных сооружений (Демаков и соавт., 2015) и антропогенно-загрязненной почвы Пермского края (Максимов и соавт., 2003) соответственно, и селекционированы в лаборатории молекулярной микробиологии и биотехнологии ИЭГМ УрО РАН. Культуры бактерий выращивали в колбах объемом 50 мл на шейкере со скоростью вращения 120 об./мин при 30°С на минимальной солевой среде N следующего состава (г/л): КН2РО4 – 1.0, К2НРО4 ∙ 3Н2О – 3.7, NaCl – 0.5, MgSO4 ∙ 7Н2О – 0.5, FeSO4 ∙ 7Н2О – 0.005, CoCl2 ∙ ∙ 6Н2О – 0.01; рН 7.2–7.4. В качестве источника углерода для R. ruber gt 1 использовали глюкозу в концентрации 0.1%, в качестве источника азота – 0.01 М NH4Cl. Для Al. faecalis 2 в качестве источника углерода и азота использовали 0.1 М ацетамид. При выращивании смешанной культуры и бинарной биопленки Al. faecalis 2 и R. ruber gt 1 в минеральную основу вносили глюкозу в концентрации 0.1%, 0.1 М ацетамид и 0.01 М NH4Cl.
Рост бактерий в биопленках. В лунки полистерольного плоскодонного 96-луночного планшета (“Медполимер”, Санкт-Петербург, Россия) вносили 150 мкл синтетической минеральной среды N и инокулировали 10 мкл суспензии нитрилгидролизующих бактерий, содержащей (2.0 ± 0.2) × 108 КОЕ/мл. Для изучения влияния штаммов нитрилгидролизующих бактерий друг на друга вносили 25 мкл культуральной жидкости (КЖ) предварительно выращенных штаммов. Бесклеточную КЖ получали центрифугированием 2-х, 4-х и 7-ми суточных бактериальных культур и фильтрацией надосадочной жидкости через мембранный фильтр MillexⓇ-GS (“Merck Millipore Ltd”, Ирландия) с размером пор 0.22 мкм.
После 1–7 сут инкубации в термостате при 30°С планктонные клетки удаляли из лунок декантацией, отмывали биопленку 200 мкл калий-фосфатного буфера дважды и определяли биопленкообразование, массивность полимерного матрикса, энергетический статус клеток биопленок.
Образование биопленок определяли методом их окрашивания 0.1% кристаллическим фиолетовым в течение 40 мин в темноте, удаляли краситель, отмывали биопленку 1 раз калий-фосфатным буфером и экстрагировали краситель 200 мкл 96% этанола. Биопленкообразование оценивали по оптической плотности раствора красителя при 540 нм на планшетном ридере Infinite M1000 pro (“TECAN”, Швейцария).
Определение массивности полимерного матрикса. Биопленки, выращенные в лунках черного непрозрачного планшета (“Nunc”, Дания), окрашивали 150 мкл водного раствора konA-тетраметилродамина (500 мкг/мл) в течение 40 мин в темноте, удаляли краситель, отмывали биопленку 1 раз 150 мкл 0.9% NaCl. В качестве контроля краситель вносили в пустую лунку, удаляли и отмывали, как описано выше. Массивность полимерного матрикса оценивали по интенсивности флуоресценции биопленки на планшетном ридере Infinite M1000 pro (“TECAN”, Швейцария) при λ возбуждения/испускания 555/580 нм.
Оценка энергетического статуса клеток. К биопленкам добавляли 150 мкл диметилсульфоксида (ДМСО) и экстрагировали АТФ в течение 15 мин на льду. Концентрацию АТФ определяли, используя стандартный набор реактивов (ATP Bioluminescent Assay Kit, “Sigma”). Пробы разводили в 10 раз деионизированной водой, смешивали 100 мкл образца с 100 мкл реагента, содержащего люциферин и люциферазу светляков. Интенсивность свечения измеряли на планшетном ридере Infinite M1000 pro (“TECAN”, Швейцария). Количество АТФ пересчитывали по калибровочной кривой.
Влияние ацетонитрила на биопленки и суспензионную культуру оценивали при внесении этого токсиканта на 7 сут роста культур в количестве 4.68 ммоль 10 раз с периодичностью 10 мин или 1 сутки при 25°С и постоянном перемешивании на шейкере со скоростью вращения 120 об./мин. По окончании эксперимента экстрагировали АТФ из клеток и определяли их энергетический статус, как описано выше.
Количество жизнеспособных клеток (число КОЕ) определяли при высеве на плотную агаризованную среду LB.
Концентрацию уксусной кислоты и ацетамида, образующихся при трансформации ацетонитрила клетками, определяли методом ГХ на хроматографе GC-2014 (“Shimadzu”, Япония) с колонкой Полисорб-1 длиной 2 м. В качестве газа-носителя использовали азот, скорость потока составляла 35 мл/мин при 180°C.
Статистическую обработку проводили с использованием t-критерия Стьюдента, различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
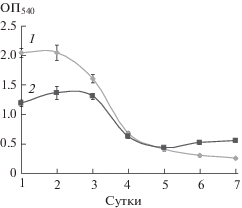
Биопленкообразование клеток Al. faecalis 2 и смешанной культуры Al. faecalis 2 и R. ruber gt 1. Для культивирования бактерий была использована оптимизированная нами минеральная среда с глюкозой и ацетамидом в качестве источников углерода. Штамм Al. faecalis 2 потребляет ацетамид как источник углерода и при росте на нем проявляет максимальную амидазную активность вследствие индуцибельного характера амидазы этого штамма (Максимова и соавт., 2017), но не растет на глюкозе. Родококк может потреблять и глюкозу, и ацетамид, но за счет разницы в скоростях роста алкалигенес в периодической культуре накапливает биомассу ранее, чем родококк. На использованной нами среде возможно нарастить биомассу обоих штаммов. Биопленку Al. faecalis 2 и бинарную биопленку бактерий выращивали в лунках полистирольного плоскодонного 96-луночного планшета в течение 1–7 сут (рис. 1). Показано, что на начальном этапе роста в смешанной культуре алкалигенес конкурирует с родококком за субстрат – ацетамид, что выражается в снижении биопленкообразования смешанной культурой, по сравнению с монокультурой. По мере исчерпания количества ацетамида в среде объем биопленки снижается, что связано с естественным процессом отмирания биопленки.
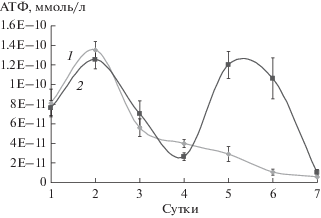
Основной рост клеток R. ruber gt 1 в смешанной биопленке приходится на 5–6 сут культивирования, что соответствует увеличению общего содержания АТФ (рис. 2). Биопленкообразование монокультуры R. ruber gt 1 было изучено ранее и результаты опубликованы в статье Максимовой и соавт. (2015). Наибольшее количество АТФ в моновидовой биопленке Al. faecalis 2, как и ожидалось, наблюдали на 2-е сут культивирования, что соответствует ее максимальной оптической плотности. При этом график, отражающий содержание АТФ в клетках бинарной биопленки, имеет два пика, соответствующие максимуму роста Al. faecalis 2 и R. ruber gt 1.
Рис. 2.
Энергетический статус клеток биопленок Al. faecalis 2 (1) и биопленок смешанной культуры (2).
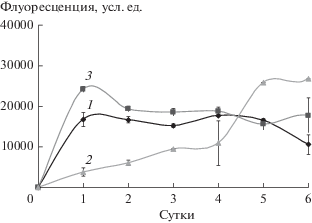
Наблюдаемые закономерности биопленкообразования бинарной культуры Al. faecalis 2 и R. ruber gt 1 подтверждаются данными определения массивности полимерного матрикса биопленок (рис. 3). Флуоресцирующий краситель тетраметилродамин, конъюгированный с конканавалином А, связывается с α-маннопиранозильными и α-глюкопиранозильными мономерами полисахаридов и может использоваться в микроскопии для окрашивания полимерного матрикса биопленок (Baird et al., 2012). На основании того, что полисахариды являются основным компонентом внеклеточного матрикса, нами была разработана методика количественной оценки его содержания в биопленках. Максимальное значение флуоресценции при развитии биопленки в смешанной культуре наблюдалось на первые сутки культивирования и составляло 24233 усл. ед. свечения, что на 36% больше максимального значения, наблюдаемого у моновидовой биопленки Al. faecalis 2. Вероятно, это связано с влиянием R. ruber gt 1 на биопленкообразующую способность Al. faecalis 2, которое детально будет рассмотрено далее.
Рис. 3.
Массивность полимерного матрикса клеток биопленок Al. faecalis 2 (1), R. ruber gt 1 (2) и биопленок смешанной культуры (3).
Таким образом, динамика роста бинарной биопленки была охарактеризована по: 1) общему биопленкообразованию, оцененному по оптической плотности экстрагированного красителя кристаллического фиолетового; 2) массивности полимерного матрикса, определенному по уровню флуоресценции после окраски konA-тетраметилродамином; и 3) общему содержанию АТФ в клетках. Так как подсчет числа колониеобразующих единиц в биопленке имеет большую погрешность, связанную с неравномерной агрегацией клеток в биопленке, предложено комплексное описание других ее параметров. Так, кристаллический фиолетовый окрашивает и жизнеспособные, и мертвые клетки, а также полимерный матрикс, что дает представление об общей массивности биопленки; содержание АТФ в клетках свидетельствует о количестве жизнеспособных клеток и их физиологическом состоянии; краситель konA-тетраметилродамин окрашивает полисахариды, что позволяет судить о массивности полимерного матрикса. Таким образом, комплексная оценка на основе трех предложенных параметров может характеризовать успешность функционирования бинарной биопленки, используемой в биотехнологических целях.
Влияние ацетонитрила на энергетический статус и каталитическую активность клеток нитрилгидролизующих бактерий в суспензионных и биопленочных культурах. Ацетонитрил был выбран в качестве токсичного субстрата для изучения его влияния на нитрилгидролизующие бактерии, поскольку он широко используется в качестве растворителя и является распространенным загрязнителем окружающей среды. Энергетический статус планктонных клеток и клеток биопленки в монокультуре Al. faecalis 2 был определен при внесении ацетонитрила в их культуры через каждые 10 мин или 1 раз в сутки (табл. 1). При многократном внесении ацетонитрила каждые 10 мин большинство клеток в суспензии и биопленке погибали, при этом после десятикратного внесения ацетонитрила его конечный объем в два раза превысил объем планктонной культуры и объем среды, в которой развивались биопленки. По содержанию уксусной кислоты в смешанной культуре (66 г/л в планктонной культуре и 17 г/л в биопленочной культуре) можно предположить, что R. ruber gt 1 некоторое время после первых циклов внесения ацетонитрила сохранял жизнеспособность и нитрилгидратазную активность и трансформировал ацетонитрил в ацетамид. Далее ацетамид полностью трансформировался клетками Al. faecalis 2, обладающими более высокой амидазной активностью, чем R. ruber gt 1, в уксусную кислоту до тех пор, пока концентрация вносимого ацетонитрила не увеличилась до максимально допустимой для сохранения жизнеспособности бактерий. Очевидно, клетки не успевают адаптироваться к высокой концентрации токсичного субстрата и погибают, что подтверждается снижением количества АТФ на порядок для монокультуры Al. faecalis 2 и на два порядка для смешанной культуры. Биопленки как моно-, так и смешанной культур более устойчивы к воздействию ацетонитрила, вносимого каждые 10 мин, что подтверждается менее выраженным снижением содержания АТФ в клетках – в 3 раза для монокультуры и на порядок для бинарной биопленки. При проведении аналогичного эксперимента с частотой внесения ацетонитрила 1 раз в сутки было показано, что большинство суспендированных клеток и клеток в составе биопленок выживают. Количество АТФ в клетках Al. faecalis 2 снижалось и в планктонной культуре, и в биопленках, но оставалось достаточно высоким для выживания Al. faecalis 2. В смешанной культуре при внесении ацетонитрила наблюдалось некоторое увеличение количества АТФ, что может быть следствием разобщения энергетического и конструктивного метаболизма в результате стрессового состояния микробных клеток. Меньшее повреждающее действие ацетонитрила на смешанную культуру связано с нитрилгидратазной активностью R. ruber gt 1. Родококк трансформирует часть токсичного субстрата до ацетамида, снижая тем самым его негативное влияние на всю ассоциацию в целом.
Таблица 1.
Влияние ацетонитрила на энергетический статус клеток монокультур Al. faecalis 2 и смешанных культур Al. faecalis 2 и R. ruber gt 1 в условиях их планктонного и биопленочного роста
| Вариант опыта | Содержание АТФ, ммоль/л | ||
|---|---|---|---|
| биопленка | суспензия | ||
| Внесение ацетонитрила каждые 10 мин, 10 раз | |||
| Контроль без воздействия ацетонитрила | Al. faecalis 2 | (5.0 ± 0.3) × 10–10 | (3.8 ± 1.0) × 10–9 |
| Al. faecalis 2 + R. ruber gt 1 | (4.5 ± 1) × 10–9 | (1.1 ± 0.1) × 10–8 | |
| При воздействии ацетонитрила | Al. faecalis 2 | (1.6 ± 0.2) × 10–10 | (1.3 ± 0.1) × 10–10 |
| Al. faecalis 2 + R. ruber gt 1 | (2.0 ± 0.1) × 10–10 | (3.8 ± 0.5) × 10–10 | |
| Внесение ацетонитрила 1 раз в сутки, 10 раз | |||
| Контроль без воздействия ацетонитрила | Al. faecalis 2 | (1.0 ± 0.1) × 10–11 | (8.2 ± 0.8) × 10–12 |
| Al. faecalis 2 + R. ruber gt 1 | (3.7 ± 0.1) × 10–11 | (2.4 ± 0.4) × 10–10 | |
| При воздействии ацетонитрила | Al. faecalis 2 | (6.5 ± 0.4) × 10–12 | (6.4 ± 0.5) × 10–12 |
| Al. faecalis 2 + R. ruber gt 1 | (9.0 ± 0.7) × 10–11 | (3.1 ± 0.9) × 10–10 | |
Взаимное влияние бактерий R. ruber gt 1 и Al. faecalis 2 на биопленкообразование и рост в периодической культуре. При оценке взаимного влияния бактерий R. ruber gt 1 и Al. faecalis 2 на их ростовые характеристики было показано, что Al. faecalis 2 в планктонной культуре к 5 сут культивирования размножались немного лучше в монокультуре на среде с ацетамидом, чем в смешанной культуре на аналогичной среде: 7.1 × 108 против 2.9 × 108 КОЕ/мл. Культура R. ruber gt 1 при одинаковой величине засева в среде, содержащей ацетамид и глюкозу, к 7 сут культивирования достигала ОП540 = 7.02 ед. и 3.0 × 107 КОЕ/мл, по сравнению с ОП540 = 3.40 ед. и 1.0 × 107 КОЕ/мл в среде с глюкозой. Эта разница связана с присутствием дополнительного источника углерода в среде.
На следующем этапе работы изучали взаимное влияние на динамику роста и энергетический статус клеток нитрилгидролизующих бактерий R. ruber gt 1 и Al. faecalis 2 КЖ их 4- и 7-сут культур, которые добавляли на этапе засева планктонных и биопленочных культур. Оценка влияния бактерий R. ruber gt 1 на биопленкообразование Al. faecalis 2 показала, что энергетический статус клеток Al. faecalis 2 при добавлении КЖ родококка достоверно не изменялся (рис. 4), тогда как биопленкообразование Al. faecalis 2 на 3–7 сут роста было достоверно выше при добавлении культуральной жидкости R. ruber gt 1 (рис. 5). Следовательно, культуральная жидкость R. ruber gt 1, содержащая метаболиты и аутоиндукторы, вызывает повышенное биопленкообразование Al. faecalis 2, связанное не с увеличением количества жизнеспособных клеток в биопленке за счет их более быстрого деления или более эффективной адгезии на начальном этапе формирования биопленки, а с усиленной выработкой полимерного матрикса, приводящей к увеличению общего объема биопленки.
Рис. 4.
Энергетический статус клеток биопленок Al. faecalis 2 при добавлении культуральной жидкости 4-х (1) и 7-ми (2) сут культуры R. ruber gt 1 и без дополнительных добавок (3).
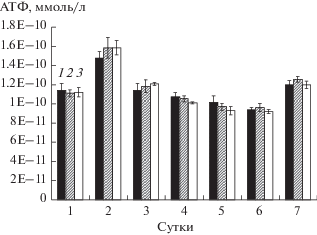
Рис. 5.
Динамика роста биопленок Al. faecalis 2 при добавлении культуральной жидкости 4-х (1) и 7‑ми (2) сут культуры R. ruber gt 1 и без дополнительных добавок (3).
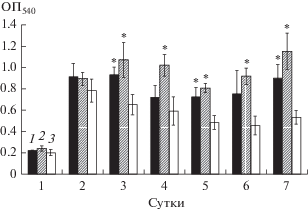
Биопленкообразование R. ruber gt 1 увеличивалось в ряду: 1) биопленки без воздействия; 2) с воздействием культуральной жидкости 2-сут культуры Al. faecalis 2; 3) с воздействием культуральной жидкости 4-сут культуры Al. faecalis 2 (рис. 6). Общее содержание АТФ в клетках биопленки R. ruber gt 1 увеличивалось по сравнению с контролем только на 2 и 3 сут при воздействии КЖ 2-сут культуры Al. faecalis 2 (рис. 7). Увеличение уровня биопленкообразования у обоих штаммов под воздействием метаболитов штаммов-партнеров можно объяснить присутствием веществ, обладающих антагонистической активностью и вызывающих стрессовый ответ – биопленкообразование, либо влияющих на экспрессию генов ферментов, участвующих в синтезе веществ полимерного матрикса; либо имеющих функции универсальных аутоиндукторов биопленкообразования. Есть сведения, что антибиотики в субингибиторных концентрациях стимулируют синтез полисахаридных компонентов внеклеточного полимерного матрикса (Плакунов и соавт., 2017). Известно, что Al. faecalis продуцирует антибиотики, ингибирующие рост как грамотрицательных, так и грамположительных бактерий (Zahir et al., 2013; Xu et al., 2015; Bahadou et al., 2018). В то же время, об антагонистической активности родококков информации нет. Сигнальные молекулы системы кворум-сенсинга, обозначаемые как аутоиндуктор 2, являются универсальным связующим звеном между грамположительными и грамотрицательными бактериями. Они также важны для формирования структурированных биопленок, особенно в мультивидовых сообществах природной среды (Li et al., 2012). Кроме того, диффундируемый сигнальный фактор (diffusible signal factor, DSF), являющийся жирной кислотой, идентифицируется у множества видов и, по-видимому, также опосредует межвидовые взаимодействия в мультивидовых биопленках. Механизмы, лежащие в основе кооперации, разнообразны, и включают изменения состава внеклеточного матрикса (Elias et al., 2012). Увеличение экскреции внеклеточных полимеров может быть конкурентным ответом на сосуществование видов в мультивидовой биопленке (Ren, 2014). Поэтому образование более массивного матрикса может быть следствием как антагонистических, так и синергических отношений, и более детально этот вопрос будет изучен в наших последующих работах.
Рис. 6.
Динамика роста биопленок R. ruber gt 1 при добавлении культуральной жидкости 2-х (1) и 4-х (2) сут культуры Al. faecalis 2 и без дополнительных добавок (3).
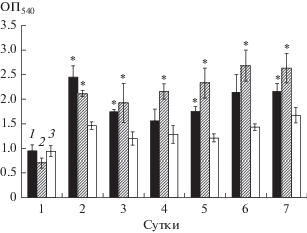
Рис. 7.
Энергетический статус клеток биопленок R. ruber gt 1 при добавлении культуральной жидкости 2-х (1) и 4-х (2) сут культуры Al. faecalis 2 и без дополнительных добавок (3).
Таким образом, было показано, что различия в скорости роста нитрилгидролизующих бактерий Al. faecalis 2 и R. ruber gt 1 влияют на распределение ролей в их бинарных биопленках. Скорость роста Al. faecalis 2 в периодической культуре выше, чем R. ruber gt 1, в результате чего при развитии бинарной биопленки Al. faecalis 2 выступает в качестве первичного колонизатора, а R. ruber gt 1 – микроорганизма-спутника, что фиксируется как наличие двух пиков на графике, отражающем содержание АТФ в клетках при росте смешанной биопленки. Показано положительное взаимное влияние штаммов Al. faecalis 2 и R. ruber gt 1 на их биопленкообразование. Данные штаммы образуют более массивные биопленки в смешанной культуре, а в монокультуре – при внесении культуральной жидкости другого штамма-партнера. Эти особенности роста Al. faecalis 2 и R. ruber gt 1 в совокупности с их амидазной и нитрилгидратазной активностью могут быть использованы при создании реактора на основе биопленок для получения акриловой кислоты или очистки сточных вод от соединений нитрилов, а бинарные биопленки изученных штаммов могут выполнять функции биокатализатора этого процесса.
Работа выполнена в рамках государственного задания, номер госрегистрации темы 01201353249.
Список литературы
Дебабов В.Г., Яненко А.С. Биокаталитический гидролиз нитрилов // Обзорный журнал по химии. 2011. Т. 1. № 4. С. 376–394.
Демаков В.А., Васильев Д.М., Максимова Ю.Г., Павлова Ю.А., Овечкина Г.В., Максимов А.Ю. Бактерии активного ила биологических очистных сооружений, трансформирующие цианопиридины и амиды пиридинкарбоновых кислот // Микробиология. 2015. Т. 84. № 3. С. 369–378.
Demakov V.A., Vasil’ev D.M., Maksimova Yu.G., Pavlova Yu.A., Ovechkina G.V., Maksimov A.Yu. Activated sludge bacteria transforming cyanopyridines and amides of pyridinecarboxylic acids // Microbiology (Moscow). 2015. V. 84. P. 433–441.
Максимова Ю.Г., Гарина А.А., Васильев Д.М., Максимов А.Ю. Оптимизация среды культивирования амидазосодержащих бактерий // Вестн. Пермского ун-та. Сер. биол. 2017. № 2. С. 193–199.
Максимова Ю.Г., Максимов А.Ю., Демаков В.А. Биопленки нитрилгидролизующих бактерий: динамика роста, устойчивость к токсичным веществам и биотехнологический потенциал // Биотехнология. 2015. № 4. С. 39–51.
Maksimova Yu.G., Maksimov A.Yu., Demakov V.A. Biofilms of nitrile-hydrolyzing bacteria: dynamics of growth, resistance to toxic substances, and biotechnological potential // Appl. Biochem. Microbiol. 2016. V. 52. № 8. P. 739–749.
Максимов А.Ю., Кузнецова М.В., Овечкина Г.В., Козлов С.В., Максимова Ю.Г., Демаков В.А. Влияние нитрилов и амидов на рост и нитрилгидратазную активность штамма Rhodococcus sp. gt 1 // Прикл. биохимия и микробиология. 2003. Т. 39. № 1. С. 63–68.
Maksimov A.Yu., Kuznetsova M.V., Ovechkina G.V., Kozlov S.V., Maksimova Yu.G., Demakov V.A. Effects of nitriles and amides on the growth and nitrile hydratase activity of the Rhodococcus sp. strain gt1 // Appl. Biochem. Microbiol. 2003. V. 39. № 1. P. 55–59.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. Мультивидовые биопленки в экологии, медицине и биотехнологии // Микробиология. 2015. Т. 84. № 6. С. 623–644.
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. Multi-species biofilms in ecology, medicine, and biotechnology // Microbiology (Moscow). 2015. V. 84. P. 731–750.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Управление формированием микробных биопленок: Анти- и пробиопленочные агенты // Микробиология. 2017. Т. 86. № 4. С. 402–420.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. Controlling of microbial biofilms formation: anti- and probiofilm agents // Microbiology (Moscow). 2017. V. 86. P. 423–438.
An X., Cheng Y., Huang M., Sun Y., Wang H., Chen X., Wang J., Li D., Li C. Treating organic cyanide-containing groundwater by immobilization of a nitrile-degrading bacterium with a biofilm-forming bacterium using fluidized bed reactors // Environ. Pollution. 2018. V. 237. P. 908–916.
Bahadou S.A., Ouijja A., Karfach A., Tahiri A., Lahlali R. New potential bacterial antagonists for the biocontrol of fire blight disease (Erwinia amylovora) in Morocco // Microb. Pathog. 2018. V. 117. P. 7–15.
Baird F.J., Wadsworth M.P., Hill J.E. Evaluation and optimization of multiple fluorophore analysis of a Pseudomonas aeruginosa biofilm // J. Microbiol. Meth. 2012. V. 90. P. 192–196.
Bakar S.N.H.A., Hasan H.A., Mohammad A.W., Abdullah S.R.S., Haan T.Y, Ngteni R., Yusof K.M.M. A review of moving-bed biofilm reactor technology for palm oil mill effluent treatment // J. Cleaner Production. 2018. V. 171. P. 1532–1545.
Burmølle M., Ren D., Bjarnsholt T., Sørensen S.J. Interactions in multispecies biofilms: do they actually matter // Trends Microbiol. 2014. V. 22. P. 84–91.
Carrel M., Morales V.L., Beltran M.A., Derlon N., Kaufmann R., Morgenroth E., Holzner M. Biofilms in 3D porous media: Delineating the influence of the pore network geometry, flow and mass transfer on biofilm development // Water Res. 2018. V. 134. P. 280–291.
Chen D., Zhao T., Doyle M.P. Single- and mixed-species biofilm formation by Escherichia coli O157:H7 and Salmonella, and their sensitivity to levulinic acid plus sodium dodecyl sulfate // Food Control. 2015. V. 57. P. 48–53.
Chen J., Zheng R.C., Zheng Y.G., Shen Y.C. Microbial transformation of nitriles to high-value acids or amides // Adv. Biochem. Eng. Biotechnol. 2009. V. 113. P. 33–77.
Dufour D., Leung V., Levesque C.M. Bacterial biofilm: structure, function, and antimicrobial resistance // Endodontic Topics. 2012. V. 22. P. 2–16.
Elias S., Banin E. Multi-species biofilms: living with friendly neighbors // FEMS Microbiol. Rev. 2012. V. 36. P. 990–1004.
Iliadisa I., Daskalopouloua A., Simõesb M., Giaourisa E. Integrated combined effects of temperature, pH and sodium chloride concentration on biofilm formation by Salmonella enterica ser. Enteritidis and Typhimurium under low nutrient food-related conditions // Food Res. Int. 2018. V. 107. P. 10–18.
Ju X., Li J., Zhu M., Lu Z., Lv F., Zhu X., Bie X. Effect of the luxS gene on biofilm formation and antibiotic resistance by Salmonella serovar Dublin // Food Res. Int. 2018. V. 107. P. 385–393.
Kohyama E., Dohi M., Yoshimura A., Yoshida T., Nagasawa T. Remaining acetamide in acetonitrile degradation using nitrile hydratase- and amidase-producing microorganisms // Appl. Microbiol. Biotechnol. 2007. V. 74. P. 829–835.
Kohyama E., Yoshimura A., Aoshima D., Yoshida T., Kawamoto H., Nagasawa T. Convenient treatment of acetonitrile-containing wastes using the tandem combination of nitrile hydratase and amidase-producing microorganisms // Appl. Microbiol. Biotechnol. 2006. V. 72. P. 600–606.
Kumara A., Alama A., Ranib M., Ehteshamc N.Z., Hasnain S.E. Biofilms: Survival and defense strategy for pathogens // Int. J. Med. Microbiol. 2017. V. 307. P. 481–489.
Li Y.-H., Tian X. Quorum sensing and bacterial social interactions in biofilms // Sensors. 2012. V. 12. P. 2519–2538.
Marić S., Vraneš J. Characteristics and significance of microbial biofilm formation // Periodicum Biologorum. 2007. V. 109. № 2. P. 1–7.
Matsumoto-Nakano M. Role of Streptococcus mutans surface proteins for biofilm formation // Jap. Dental Sci. Rev. 2018. V. 54. P. 22–29.
Muruzović M.Ž., Mladenović K.G., Čomić L.R. In vitro evaluation of resistance to environmental stress by planktonic and biofilm form of lactic acid bacteria isolated from traditionally made cheese from Serbia // Food Biosci. 2018. V. 23. P. 54–59.
Omar A., Wright J.B., Schultz G., Burrell R., Nadworny P. Microbial biofilms and chronic wounds // Microorganisms. 2017. V. 5. P. 1–15.
Ren D. Synergistic interactions in multispecies biofilms. PhD thesis. University of Copenhagen. 2014.
Rittmann B.E. Biofilms, active substrata, and me // Water Res. 2018. V. 132. P. 135–145.
Røder H.L., Raghupathi P.K., Herschend J., Brejnrod A., Knøchel S., Sørensen S.J., Burmølle M. Interspecies interactions result in enhanced biofilm formation by co-cultures of bacteria isolated from a food processing environment // Food Microbiol. 2015. V. 51. P. 18–24.
Xu Y.Y., Wang X., Zhang K.Q., Li G.H. Bioactive constituents from the bacteirium Alcaligenes faecalis YMF 3.175 // Appl. Biochem. Microbiol. 2015. V. 51. P. 52–57.
Zahir I., Houari A., Bahafid W., Iraqui M., Ibnsouda S. A novel Alcaligenes faecalis antibacterial-producing strain isolated from a Moroccan tannery waste // Afr. J. Microbiol. Res. 2013. V. 7. № 47. P. 5314–5323.
Дополнительные материалы отсутствуют.