Микробиология, 2019, T. 88, № 2, стр. 224-229
Фаговые частицы в подземных льдах Арктики
Н. А. Сургучева a, *, С. Н. Филиппова a, Е. Е. Куликов a, А. В. Брушков b, В. В. Рогов c
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова,
геологический факультет
119991 Москва, Россия
c Московский государственный университет им. М.В. Ломоносова,
географический факультет
119991 Москва, Россия
* E-mail: natshasur@rambler.ru
Поступила в редакцию 01.08.2018
После доработки 29.11.2018
Принята к публикации 30.11.2018
Аннотация
Древние подземные льды Арктики разного генезиса и геологического возраста впервые исследованы на наличие бактериофагов. Методом электронной микроскопии фаговые частицы обнаружены во всех образцах льда. Доминирующим морфотипом были частицы из группы хвостатых фагов. Выявлена корреляция численности интактных микробных клеток и фаговых частиц. Наибольшее обилие фаговых частиц, как показал прямой микроскопический подсчет, зафиксировано в нативных расплавах образцов реликтового повторно-жильного льда (ПЖЛ). Отмечена зависимость наличия и численности фаговых частиц от генезиса подземного льда. Установлено, что фаги, как неотъемлемая часть микробных сообществ, сохраняются в экстремально низкотемпературных условиях древних подземных льдов.
Общепризнанно, что бактериофаги – самая многочисленная форма жизни на Земле. В настоящее время они обнаружены при исследовании различных, в том числе и экстремальных, сред обитания, где играют ключевую роль в регуляции численности и состава микробных сообществ (Säwström et al., 2008). Наименее изученной среди экстремально низкотемпературных сред обитания является криолитозона Арктики. Это область сплошного распространения многолетнемерзлых пород, вызывающая в последние годы особый интерес в связи с освоением природных ресурсов Арктического региона. В криолитозоне Арктики широко распространены подземные льды, представляющие в мерзлых толщах пород уникальные геоморфологические самостоятельные образования различного генезиса, сформировавшиеся в течение тысячелетий.
Исследования последних лет показали, что ледяные включения в мерзлых грунтах являются наиболее благоприятной средой для сохранения микроорганизмов (Katayama et al., 2007; Курчатова и соавт., 2011). Микробные популяции разной степени обилия выявлены исследователями жильных льдов полярных регионов Аляски, Юкона, Канадской Арктики (Katayama et al., 2007; Lacelle et al., 2011; Roland et al., 2012).
В то же время, наличие жизнеспособной микрофлоры предусматривает и возможность сохранения фаговой составляющей микробных сообществ. В хорошо изученных водных средах обитания арктических полярных экосистем наблюдается высокая степень активности бактериофагов в бактериальных сообществах. При этом в морских льдах Арктики зафиксировано рекордное обилие вирусов, как показал прямой подсчет – 9 × 106–3 × 108 частиц/мл. Эта величина в 10‒100 раз больше, чем концентрация вирусов в окружающей морской воде (Maranger et al., 1994).
Электронно-микроскопическое изучение фагов исследованных полярных экосистем показало, что в них преобладают бактериофаги из морфологических семейств Siphoviridae, Myoviridae, Podoviridae (Borriss et al., 2003).
Что касается сведений о фаговой составляющей микробных сообществ подземных льдов Арктики, то они практически отсутствуют. В то же время следует отметить, что подземные льды представляют собой древние закрытые экосистемы, в настоящее время мало или вовсе не изученные. Недавно нами были получены первые результаты по биоразнообразию бактериофагов в исследованном образце древнего жильного льда (Филиппова и соавт., 2016). В настоящее время растет практический интерес к исследованиям такого рода. Предполагаемое глобальное потепление климата делает актуальным изучение экологических последствий оттаивания вечной мерзлоты – своеобразного хранилища микробно-вирусных сообществ. В результате таяния арктических ледников, а также вытаивания ледовых скоплений вечной мерзлоты происходит контаминация окружающей среды их микрофлорой. Поэтому нельзя исключить возможности возникновения опасных инфекций неизвестной природы за счет активации древней микрофлоры и возможности переноса бактериофагами сохраненных в их геноме древних факторов вирулентности и патогенности. Известен также путь перенесения фагами детерминант резистентности бактерий к антибиотикам (Lavysh et al., 2016). Поэтому мониторинг структуры и состояния фаговой составляющей микробных сообществ подземных льдов необходим для оценки потенциальных рисков биоопасности Арктического региона.
Целью нашей работы было исследование образцов древних подземных льдов криолитозоны России на наличие в них фагов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были нативные образцы подземных льдов: 1) древние толщи повторно-жильных льдов (ПЖЛ), формировавшиеся по морозобойным трещинам в течение геологически длительного времени; 2) инъекционный лед – результат внутригрунтового промерзания и кристаллизации подземных вод; 3) пластовый лед, генезис которого остается в настоящее время остро дискуссионным (табл. 1).
Таблица 1.
Описание образцов подземных льдов
| Место отбора | Тип льда | Геологический возраст | Описание |
|---|---|---|---|
| Обнажение ледового комплекса в верхней части 50-м террасы Мамонтовой горы (Центральная Якутия) | ПЖЛ (верхний ярус) | Плейстоцен 13‒19 тыс. лет |
Лед с тонкими прожилками грунтовых примесей. Структура зернистая, пузырчатая. Цвет молочно-белый |
| ПЖЛ (нижний ярус) | Плейстоцен 40‒46 тыс. лет |
Лед непрозрачный, мутно-серого цвета, содержит многочисленные цепочки пузырьков | |
| Тазовский п-ов, в районе
нефтяного месторождения
Песцовое (Западная Сибирь). Образец взят из керна скважины бугра пучения на глубине 13 м |
Инъекционный лед | 5–5.4 тыс. лет | Лед слоистый, с прослоями суглинка и многочисленными включениями минеральных частиц; толщина слоев льда 5‒7 см |
| П-ов Гыдан (Карское море), береговое обнажение мыса Черный, на глубине 5.5 м (Западная Сибирь) | Пластовый лед | ~ 40‒25 тыс. лет | Лед слоистый, прозрачный с протяженными цепочками газовых пузырьков |
Образцы для исследования отобраны в ходе экспедиционных работ 2016 г. сотрудниками геологического и географического факультетов МГУ им. М.В. Ломоносова. Датировка льдов приведена в публикациях (Vasilchuk et al., 2004; Белова, 2014; Васильчук и соавт., 2014).
В полевых условиях образцы льда ненарушенной структуры отбирали с помощью стерилизованных спиртом и обожженных в пламени инструментов. Поверхностный слой льда счищали на глубину до 5 см. Для удаления чужеродной микрофлоры поверхность отобранных монолитов обрабатывали пламенем газовой горелки, а затем помещали в предварительно простерилизованные пакеты и хранили в мерзлом состоянии при температуре, близкой к естественной (‒5°С). Транспортировку проб в лабораторию осуществляли в термоконтейнерах с хладагентами. Образцы до проведения экспериментов хранили при температуре ‒20°С.
В связи с особыми требованиями к соблюдению асептического отбора образцов (и риском возможной контаминации посторонней микрофлорой в процессе отбора, а также в ходе дальнейших исследований) проведены контрольные эксперименты в полевых и лабораторных условиях по методике с использованием маркерного штамма дрожжей Yarrowia lipolytica Y-3603, меченного красным флуоресцентным белком, с высокой численностью клеток (108 кл./мл). Об эффективности соблюдения условий асептического отбора проб судили по результатам прямого микроскопического учета клеток дрожжей в образцах и при посевах на агаризованные питательные среды (Brouchkov et al., 2017).
Прямое определение живых и мертвых клеток. Оценку общей численности бактерий проводили методом люминесцентной микроскопии с использованием флуоресцентного красителя: акридинового оранжевого (“Mathesoi, Coleman & Ball Manufacture Chemistry”). Для дифференциации неповрежденных (интактных) и мертвых клеток по зеленой или красной эпифлуоресценции соответственно использовали краситель Live/Dead Baclight (“Invitrogen”).
Прямой подсчет фаговых частиц в электронном микроскопе. Препараты расплавов льда наносили на сетки с формваровой пленкой-подложкой, укрепленной углеродом, контрастировали 2% фосфорно-вольфрамовой кислотой (Бирюзова и соавт., 1963), затем просматривали в электронном микроскопе JEM-100CXII (“JEOL”, Япония) и производили прямой подсчет фаговых частиц в тех образцах, где это было возможно.
Выявление бактериофагов из негативных зон (бляшек) на колониях фагочувствительных бактерий. В качестве фагочуствительных бактерий использовали колонии аэробных гетеротрофных бактерий, выделенных из образцов пластового льда. Высев образца талого льда производили на агаризованную питательную среду Plate count agar (“Difco”) в 3-х повторностях. Инкубацию бактерий осуществляли при температурах 20 и 28°С в течение 5‒10 сут. Клеточную морфологию изолятов бактерий изучали методом фазово-контрастной микроскопии (AXIOPLAN, “CarlZeiss”, Германия). Фаги детектировали в материале, взятом из негативных зон колоний лизогенного изолята, методом электронной микроскопии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
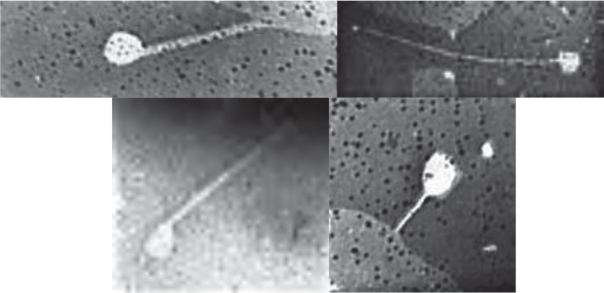
Исследование повторно-жильных льдов (ПЖЛ). В результате проведенных исследований в образцах ПЖЛ выявлено значительное количество фаговых частиц, относящихся к группе хвостатых фагов, как свободных, так и сорбированных на различных структурах (рис. 1). Обнаруженные фаговые частицы различались размерами и формой головок и хвостов. Наблюдали головки как круглой, так и овальной формы, хвосты – от коротких до довольно длинных, прямые или изогнутые, иногда конусовидной формы.
Рис. 1.
Разнообразие фаговых частиц, выявленных в нативных образцах плейстоценового ПЖЛ ледового комплекса Мамонтовой горы (Центральная Якутия): а–з – верхний ярус (13‒19 тыс. лет); и–о – нижний ярус (~40‒46 тыс. лет). Масштабная метка – 50 нм.

При прямом подсчете в электронном микроскопе определена численность фаговых частиц (ФЧ): в образце ПЖЛ верхнего яруса – порядка 108 ФЧ/мл, а в ПЖЛ нижнего яруса – 109 ФЧ/мл. Высокая численность фаговых частиц в образцах жильного льда коррелировала с довольно высокими показателями численности интактных клеток в образцах (табл. 2).
Таблица 2.
Численность клеток и фаговых частиц в образцах ПЖЛ разного геологического возраста ледового комплекса Мамонтовой горы
| Образцы | Общая численность микробных клеток (краситель акридиновый оранжевый), кл./мл | Число “живых” клеток (краситель Live-Dead), кл./мл | Число фаговых частиц (ФЧ/мл) |
|---|---|---|---|
| ПЖЛ (верхний ярус) | (2.7 ± 0.5) × 107 | (2.6 ± 0.2) × 106 | 7.2 × 108 |
| ПЖЛ (нижний ярус) | (5.1 ± 0.4) × 106 | (2.6 ± 0.2) × 105 | 1.0 × 109 |
В исследованных образцах была отмечена редкая встречаемость мертвых микробных клеток, что свидетельствует о сохранении интактности микроорганизмов в жильных льдах. Это может расцениваться как косвенное подтверждение гипотезы об увеличении выживаемости бактерий, несущих фаговые лизогены, в затрудняющих рост условиях, таких как низкая температура и труднодоступность источников питания (Paul, 2008). В этих же образцах была отмечена высокая численность ФЧ. При этом сообщество выявленных ФЧ было представлено фагами только хвостатого морфотипа. По мнению исследователей пермафроста Аляски такая ограниченность разнообразия фаговых частиц и их высокая концентрация указывают на стабильность среды обитания виробактериального сообщества и изоляцию от окружающей среды (Colangelo-Lillis et al., 2016).
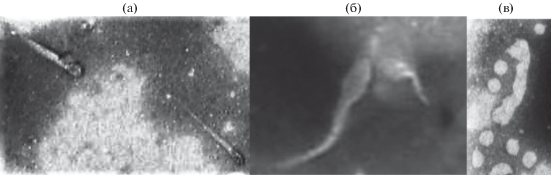
Исследование инъекционного льда. Расплавы инъекционного льда отличались значительной замутненностью из-за высокого содержания частиц грунта. После отстаивания в течение 2‒4 ч для приготовления препаратов использовали просветленный верхний слой. При исследовании отстоев расплавов льда наблюдали редкие фагоподобные частицы (рис. 2). Помимо хвостатых фагов, в препаратах присутствовали и частицы других морфотипов. Показатель достаточно высокой численности интактных клеток в этом образце – (1.7 ± 0.2) × 106 кл./мл, давал основание предполагать присутствие фаговых частиц различной морфологии и в значительном количестве. Однако корректно подсчитать их не было возможности из-за вероятной сорбции на коллоидных включениях суглинка (табл. 1) и их последующего осаждения при отстаивании. В то же время, возможно, именно благодаря сорбции ФЧ на органоминеральных структурах в этом образце нами было выявлено большее разнообразие фаговых морфотипов (Harvey, Ryan, 2004).
Рис. 2.
Фаговые частицы, выявленные в расплавах нативных образцов инъекционного льда: а, б – хвостатый морфотип; в – сферический морфотип. Масштабная метка – 50 нм.
Исследование пластового льда. Расплав образца пластового льда визуально выглядел прозрачным. При исследовании в электронном микроскопе фаговые частицы не были обнаружены. Показатель численности интактных клеток в образце оказался достаточно низким – (3.0 ± 0.4) × 104 кл./мл. Известно, что большинство фагов не реплицируются, если концентрация клеток бактерии-хозяина ниже 103–105 кл./мл (Wiggins, Alexander, 1985). При значении численности клеток бактерии-хозяина ниже 105 кл./мл не выявлялся также и внутриклеточный фаг (Steward et al., 1992; Weinbauer, Peduzzi, 1994). Поэтому отсутствие свободных фаговых частиц в образце пластового льда, вероятно, объясняется низкой численностью интактных бактериальных клеток, что, скорее всего, связано с формированием данного образца пластового льда из воды атмосферных осадков или грунтовых вод, обедненных микроорганизмами (Леин и соавт., 2003). Однако на бактериальных колониях одного из изолятов аэробных гетеротрофных бактерий, выделенных из образца пластового льда, в зоне активного роста колоний были отмечены точечные фаговые бляшки. Колонии изолята оранжевые, гладкие, блестящие, клетки – палочковидные (1 × 0.4 мкм), V-образной группировки, неподвижные. При изучении материала, отобранного из негативных зон, были обнаружены свободные и сорбированные на фрагментах клеточного лизиса хвостатые фаговые частицы, сходные по морфологии с сифовирусами (рис. 3).
Рис. 3.
Фаговые частицы из бляшек в зоне активного роста колонии лизогенной бактерии, выделенной из образца пластового льда. Масштабная метка – 50 нм.
Таким образом, с целью обнаружения вирусов бактерий – бактериофагов впервые были исследованы уникальные образцы древних подземных льдов Арктики разного генезиса и различного геологического возраста, изолированные под вечной мерзлотой. Установлено, что фаги – неотъемлемая часть микробных сообществ – сохраняются в экстремальных низкотемпературных условиях подземных льдов. Представленная работа содержит новый материал по экологии, которым можно воспользоваться при составлении арктических программ.
Работа выполнена при частичной поддержке гранта РФФИ № 16-05-00296 и в рамках госзадания № 0104-2018-0029.
Список литературы
Белова Н.Г. Пластовые льды юго-западного побережья Карского моря. М.: МАКС Пресс, 2014. 180 с.
Бирюзова В.И., Боровягин В.Л., Гилев В.П., Киселев М.А., Тихоненко А.С., Ченцов Ю.С. Электронно-микроскопические методы исследования биологических объектов / Под ред. Франка Г.М. М.: Изд-во АН СССР, 1963. 200 с.
Васильчук Ю.К., Буданцева Н.А., Васильчук А.К., Йошикава К., Подборный Е.Е., Чижова Ю.Н. Изотопный состав ледяного ядра позднеголоценового булгунияха на месторождении Песцовое в долине реки Евояха на юге Тазовского полуострова // Криосфера Земли. 2014. Т. 18. № 1. С. 47‒58.
Курчатова А.Н., Рогов В.В. Подземный лед как среда обитания микроорганизмов // Материалы 4-ой конференции геокриологов России. М.: Университетская книга, 2011. С. 345‒350.
Леин А.Ю., Лейбман М.О., Саввичев А.С., Миллер Ю.М., Пименов Н.В. Изотопно-биохимические особенности подземного пластового льда полуостровов Югорского и Ямал // Геохимия. 2003. Т. 41. № 10. С. 1084‒1104.
Lein A.Yu., Leibman M.O., Savvichev A.S., Miller Yu.M., Pimenov N.V. Isotopic and biogeochemical characteristics of tabular ground ice on the Yugorskii and Yamal peninsulas // Geochem. Int. 2003. V. 41. P. 993‒1012.
Филиппова С.Н., Сургучева Н.А., Сорокин В.В., Акимов В.Н., Карнышева Э.А., Брушков А.В., Андерсен Д., Гальченко В.Ф. Бактериофаги низкотемпературных систем Арктики и Антарктики // Микробиология. 2016. Т. 85. № 3. С. 337‒346.
Filippova S.N., Surgucheva N.A., Sorokin V.V., Akimov V.N., Karnysheva E.A., Brushkov A.V., Andersen D., Gal’chenko V.F. Bacteriophages in Arctic and Antarctic low-temperature systems // Microbiology. 2016. V. 3. P. 359‒367.
Borriss M., Helmke E., Hanschke R., Schweder T. Isolation and characterization of marine psychrophilic phage-host systems from Arctic sea ice // Extremophiles. 2003. V. 7. P. 377‒384.
Brouchkov A., Kabilov M., Filippova S., Baturina O., Rogov V., Galchenko V., Mulyukin A., Fursova O., Pogorelko G. Bacterial community in ancient permafrost alluvium at the Mammoth Mountain (Eastern Siberia) // Gene. 2017. V. 636. P. 48‒53.
Colangelo-Lillis J., Eicken H., Carpenter S.D., Deming J.W. Evidence for marine origin and microbial-viral habitability of sub-zero hypersaline aqueous inclusions within permafrost near Barrow Alaska // FEMS Microbiol. Ecol. 2016. V. 92. fiw053. doi 10.1093/femsec/fiw053
Harvey R.W., Ryan J.N. Use of PRD1 bacteriophage in groundwater viral transport, inactivation and attachment studies // FEMS Microbiol. Ecol. 2004. V. 49. P. 3‒16.
Katayama T., Tanaka M., Moriizumi J., Nakamura T., Brouchkov A., Douglas T.A., Fukuda M., Tomita F., Asano K. Phylogenetic analysis of bacteria preserved in a permafrost ice wedge for 25000 years // Appl. Environ. Microbiol. 2007. V. 73. P. 2360‒2363.
Lacelle D., Radtke K., Clark J.D., Fisher D., Lauriol B., Utting N., Whyte L.G. Geomicrobiology and occluded O2‒CO2‒Ar gas analyses provide evidence of microbial respiration in ancient terrestrial ground ice // Earth Planet Sci. Lett. 2011. V. 306. P. 46‒54.
Lavysh D., Sokolova M., Minakhin L., Yakunina M., Artamonova T., Kozyavkin S., Makarova K., Koonin E., Severinov K. The genome of AR9, a giant transducing Bacillus phage encoding two multisubunit RNA polymerases // Virology. 2016. V. 495. P. 185‒196.
Maranger R., Bird DF., Juniper S.K. Viral and bacterial dynamics in Arctic sea ice during the spring algal bloom near Resolute, N.W.T., Canada // Mar. Ecol. Prog. 1994. Ser. 111. P. 121‒127.
Paul J.H. Prophages in marine bacteria: dangerous molecular time bombs or the key to survival in the seas? // ISME J. 2008. V. 2. P. 579‒589.
Säwström C., Lisle J., Anesio A.M., Priscu J.C., Layborn-Parry J. Bacteriophage in polar inland waters // Extremophiles. 2008. V. 12. P. 167‒175.
Steward G.F., Wikner J., Cochlan W.P., Smith D.C., Azam F. Estimation of virus production in the sea // Marine Microbial Food Nets. 1992. V. 6. P. 79‒90.
Vasilchuk Y.K., Kim J.-Ch., Vasilchuk A.C. AMS14C dating and stable isotope plots of Late Pleistocene ice-wedge // Nucl. Instr. Meth. Phys. Res. B 223‒224. 2004. P. 650‒654. doi 10.1016/j.nimb.2004.04.120
Weinbauer M.G., Peduzzi P. Frequency, size and distribution of bacteriophages in different marine bacterial morphotypes // Marine Ecol. Progr. Ser. 1994. V. 108. P. 11‒20.
Wiggins B.A., Alexander M. Minimum bacterial density for bacteriophage replication: Implication for significance of bacteriophages in natural ecosystems // Appl. Environ. Microbiol. 1985. V. 49. P. 19‒23.
Wilhelm R.C., Radtke K.J., Mykytszuk N.C.S., Greer C.W., Whyte L.G. Life at the wedge: the activity and diversity of arctic ice wedge microbial communities // Astrobiology. 2012. V. 12. P. 347‒360.
Дополнительные материалы отсутствуют.


