Микробиология, 2019, T. 88, № 3, стр. 318-327
Аэробная биодеградация жидких моторных топлив в условиях экстремальной кислотности
А. Е. Иванова a, *, А. Ю. Канатьева b, А. А. Курганов b
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: a.e.ivanova@mail.ru
Поступила в редакцию 02.10.2018
После доработки 26.12.2018
Принята к публикации 01.02.2019
Аннотация
Исследована биодеградация некоторых видов жидких нефтяных моторных топлив и топливных смесей, содержащих в составе биодизельное топливо (метиловые эфиры жирных кислот рапсового масла), аэробными ацидофильными актинобактериями Mycobacterium sp. AGS10. Показано, что штамм AGS10 использует авиационный керосин Джeт А-1 в качестве единственного источника углерода и энергии в условиях высокой кислотности. За 21 сут культивирования при температуре 30°С и рН 2.5 численность бактерий возрастала с 4.2 × 106 до 7.0 × 108 кл./мл, а степень деструкции растворимой в гексане части топлива составила 90.4%. Исследуемые бактерии также утилизируют компоненты зимнего дизельного топлива, в том числе С8–С20н-алканы, изо-алканы и ароматические соединения. В тех же условиях инкубации общее потребление углеводородов составило 99.4%, при этом изменение соотношения (изо-С19 (пристан) + изо-С20 (фитан))/(н-С17 + н-С18) от 1.21 в контрольном образце до 2.39 в опытном, где имела место бактериальная деструкция, указывало на предпочтительное использование бактериями нормальных алканов по сравнению с изопреноидами. В период с 4 до 12 сут потребилось более 90% углеводородов дизеля, а численность бактериальной популяции увеличилась на три порядка. В топливных смесях, содержащих биодизельное топливо, штамм AGS10 потреблял как углеводородные, так и кислородсодержащие (растительного происхождения) компоненты, при этом предпочтительно бактерии использовали углеводороды, а соотношение между нефтяным дизельным топливом и биодизельным топливом в составе смеси изменялось со временем.
Жидкие нефтяные моторные топлива находят широкое применение в двигателях внутреннего сгорания, в том числе на различных видах транспорта и в газотурбинных двигателях. Ограниченность запасов сырой нефти, а также высокие экологические риски, связанные с крупномасштабным производством, использованием в подвижных механизмах, развитой инфраструктурой хранения и распределения углеводородных топлив, стимулируют поиск и распространение альтернативных видов топлива. Целью этих исследований и разработок является расширение сырьевой базы за счет новых топлив из возобновляемых ресурсов для частичной замены топлив, вырабатываемых из ископаемого сырья.
Одним из перспективных видов альтернативного топлива является биодизельное топливо (БД), которое в последние десятилетия во всем мире приобретает все большее распространение. БД, состоящее из моноалкиловых (чаще всего метиловых или этиловых) эфиров длинноцепочечных жирных кислот, получают преимущественно путем основной переэтерификации одноатомными спиртами растительных масел (рапсового, соевого, подсолнечного, хлопкового, пальмового, касторового, арахисового и других, менее распространенных видов масел), представляющих собой смешанные триглицериды жирных кислот, а также животных жиров и рыбьего жира (Ma, Hanna, 1999; Pinto et al., 2005; Demirbas, Balat, 2006; Canoira et al., 2010). Для производства БД могут использоваться также отработанные растительные масла и жиры в составе сточных вод коммунального хозяйства и пищевого производства (Suehara et al., 2005).
БД может служить топливом в чистом виде, но обычно применяют его смеси с минеральным дизельным топливом (ДТ), в котором процентное содержание метиловых эфиров жирных кислот (МЭЖК) составляет от 2 до 20% по объему в зависимости от принятых в стране использования стандартов (Knothe et al., 2005), поскольку при этом не требуется модификация двигателей внутреннего сгорания. Другая причина использования именно топливных смесей связана с недостаточной морозостойкостью 100% БД, температура помутнения которого составляет около –3°С, что превышает аналогичный показатель как для летнего дизельного топлива (–5°С), так и, тем более, для зимнего (–25°С). К достоинствам БД, наряду с высокой теплотворной способностью, можно отнести хорошие смазочные свойства, высокую температуру воспламенения и цетановое число, почти полное отсутствие в его составе серы, полициклических ароматических углеводородов и металлов (Knothe, Steidley, 2005; Huang et al., 2012). С заменой минерального топлива на БД сокращаются выбросы в окружающую среду СО2, СО, SO2, углеводородов, сажи и т.п. (Pinto et al., 2005; Knothe et al., 2005). Кроме того, по сравнению с углеводородным дизельным топливом, БД имеет меньшую токсичность для живых организмов и довольно легко подвергается микробной деструкции (Zhang et al., 1998; Lapinskiene et al., 2006; Silva et al., 2012), поскольку образующие его эфиры жирных кислот являются природными соединениями, распространенными в окружающей среде (Mudge, Pereira, 1999). Учитывая вышесказанное, БД можно рассматривать как энергоэффективную, сравнительно безопасную и экологичную горючую смесь.
Окисление органических загрязнителей аэробными микроорганизмами является важным фактором, обеспечивающим их удаление из окружающей среды. Изучение процесса биодеградации необходимо, чтобы предвидеть возможные риски и определить наиболее подходящую стратегию восстановления загрязненных объектов.
Все нефтяные моторные топлива представляют собой сложные смеси, состоящие преимущественно из углеводородов разной молекулярной массы и химического строения. В то же время углеводородные топлива сильно различаются по составу, что не может не сказываться на их биоразлагаемости. Например, в бензине, получаемом из относительно легких фракций нефти, идентифицировано более 200 индивидуальных углеводородов, основная часть которых представлена ароматическими соединениями (50%) и изо-алканами (35%) с числом атомов углерода от 4–5 до 10 (Marchal et al., 2003). С увеличением числа атомов углерода в молекуле и протяженности ряда углеводородов сложность химического состава топлива резко возрастает. В более тяжелых среднедистиллятных топливах, таких как дизельное топливо (ДТ), обнаружены уже тысячи соединений с числом атомов углерода от 8–12 до 25–27, главным образом, насыщенные углеводороды (более 60%), арены (около 39%), алкены (1–2%) и гетероциклические соединения (Bacha et al., 1998; Olson et al., 1999; Marchal et al., 2003). Многие авторы отмечают, что бензин легче подвергается биодеструкции, чем дизельное топливо; особенно трудно окисляется тяжелая фракция последнего (Marchal et al., 2003; Chemlal et al., 2013). Однако во всех видах топлива присутствуют соединения, отличающиеся высокой устойчивостью к микробному воздействию, среди которых метилированные антеизо-алканы, триметилалканы с четвертичным атомом углерода, декалины и др. (Marchal et al., 2003; Prince et al., 2008). Деградацию подобных соединений могут обеспечить кооперация членов микробного сообщества, кометаболизм или уникальные метаболические способности его представителей (Solano-Serena et al., 2000; Marchal et al., 2003).
В последние годы в связи с коммерциализацией БД возрос интерес к изучению биодеструкции топливных смесей, содержащих его в своем составе. Сообщалось, что добавление БД стимулирует биодеградацию топливных смесей за счет кометаболической трансформации углеводородов (Zhang et al., 1998; Mudge, Pereira, 1999). Однако по некоторым данным (Owsianiak et al., 2009) эффект от присутствия БД может быть и обратным. В работах (Prince et al., 2007, 2008) обнаружено, что в сходных условиях культивирования скорости биодеградации индивидуальных углеводородов топливной смеси с содержанием БД 20 об. % и бензина существенно не различались. Другие авторы (DeMello et al., 2007; Prince et al., 2008) отмечали, что в морских и пресноводных микрокосмах МЭЖК БД разлагались с той же скоростью, что и н-алканы дизельного топлива, но быстрее, чем другие компоненты дизеля. Присутствие БД способствовало диспергированию минерального дизельного топлива, но не влияло на состав смеси остаточных (после биодеструкции) углеводородов после продолжительной инкубации (DeMello et al., 2007). Вместе с тем в хронически загрязненных сайтах БД может действовать как биосурфактант, способствуя мобилизации сорбированных в пористых средах полициклических углеводородов каменноугольной смолы (Taylor, Jones, 2001) и сырой нефти (Miller, Mudge, 1997; Pereira, Mudge, 2004), в том числе тяжелой нефти (Fernandez-Alvarez et al., 2007). Таким образом, на основании приведенных литературных данных трудно сделать однозначный вывод о влиянии БД на биодеградацию углеводородов.
На биодеструкцию, наряду с составом, количеством и другими характеристиками загрязнителя и биологическими особенностями организмов-деструкторов, оказывают воздействие внешние абиотические факторы среды обитания микроорганизмов. Очевидно, что в экосистемах с экстремальными значениями одного или нескольких физико-химических параметров (температура, рН, соленость и др.) дальнейшую судьбу загрязняющего вещества определяют экстремофильные микроорганизмы (Margesin, Shinner, 2001), однако многие аспекты этой проблемы слабо исследованы. Несмотря на актуальность изучения биодеградации разных видов моторного топлива и широкое освещение этого вопроса в научной литературе, сведения о возможности протекания подобного процесса в области экстремально низких значений рН отсутствуют.
Целью настоящей работы было изучить биодеградацию нефтяных моторных топлив, авиационного керосина и зимнего дизельного топлива, а также смесей, содержащих БД и товарное дизельное топливо, аэробными углеводородокисляющими бактериями Mycobacterium sp. AGS10 в условиях высокой кислотности.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериальный штамм и условия культивирования. В работе использовали ранее выделенный нами штамм ацидофильных микобактерий, обозначенный Mycobacterium sp. AGS10, который имеет 98% сходства по нуклеотидной последовательности гена 16S рРНК с Mycobacterium florentinum и способен к деструкции индивидуальных углеводородов разного химического строения (Иванова и соавт., 2016, 2017).
Бактерии культивировали в герметично закрытых флаконах с жидкой минеральной средой (Иванова и соавт., 2013) и моторным топливом (0.4–1.0 об. %) в качестве единственного источника углерода и энергии. Соотношение объемов питательной среды и газовой фазы было достаточным, чтобы исключить лимитацию по кислороду. Бактерии выращивали в течение 14–21 сут в статических условиях при температуре 30°С и начальном рН 2.5. Инокулятом (5 об. %) служила культура, которую инкубировали в течение 7 сут в среде со скваланом, 2,6,10,15,19,23-гексаметилтетракозаном (“Merck”, Германия; степень чистоты 98.5%), внесенным в концентрации 0.05 об. %. Для хроматографического анализа использовали второй последовательный пересев на соответствующий субстрат.
Характеристика образцов нефтепродуктов и биодизеля. В экспериментах по биодеградации в качестве источника углерода для бактерий были использованы два типа нефтепродуктов, авиакеросин и ДТ, а также топливные смеси ДТ с БД.
Авиационный керосин, Джет А-1 (Jet A-1) (нефтеперерабатывающий завод (НПЗ) Зунг Куат, Вьетнам) получен путем переработки нефти месторождения Белый Тигр. Данный нефтепродукт представляет собой прозрачную бесцветную жидкость с характерным запахом, имеет плотность при 15°С 0.780 г/см3, кинематическую вязкость при ‒20°С 8.0 мм2/с, температуру замерзания ‒47°С. Это легкое топливо высокой степени очистки от серы: 10% топлива отгоняется при температуре до 200°С, 90% – при температуре не выше 300°С, содержание общей серы составляет 0.2 мас. %. По спецификации производителя, объемные доли (%) насыщенных углеводородов (н-, изо- и циклоалканов), ароматических углеводородов (главным образом, метилированных производных бензола и нафталина) и олефинов составляют 82.4, 17.0 и 0.6 соответственно.
Зимнее дизельное топливо 3.0–0.2 (Ачинский НПЗ Восточной нефтяной компании, Красноярский край, РФ), полученное в результате переработки западно-сибирской нефти, представляет собой жидкость соломенно-желтого цвета с плотностью и кинематической вязкостью при 20°С 0.835 г/см3 и 5.0 мм2/с соответственно. Топливо имеет температуру застывания ‒35°С, цетановое число – 51 ед., содержание общей серы – 0.2 маc. %. Основу данного нефтепродукта составляют нормальные парафины и ароматические соединения, наряду с которыми присутствуют разветвленные, циклические (в основном производные циклогексана) и непредельные углеводороды, а также некоторые другие соединения нефтяного происхождения.
Биодизельное топливо (БД) представляет собой метиловые эфиры жирных кислот, полученные путем переэтерификации рапсового масла. Состав БД был определен ранее (Канатьева и соавт., 2014). Основные его компоненты – метилолеат (58.5%) и метиллинолеат (18.1%). Минорные компоненты, в сумме составляющие 23.4% смеси, представлены главным образом изомерами метиловых эфиров диеновых и триеновых (с двойными связями в молекуле) и дииновых (с тройными связями) кислот.
Для составления топливных смесей с БД в качестве углеводородного компонента использовали товарное дизельное топливо (ДТ) Евро-5 (ПАО “Нефтяная компания “Лукойл”). Топливо представляет собой жидкость с плотностью 0.823 г/см3 (при 15°С) и кинематической вязкостью 2.77 мм2/с (при 40°С), имеет цетановое число 51.0, содержит 4.4 мас. % полициклических ароматических углеводородов и 9.1 мг/кг общей серы (по данным производителя); 38 об. % топлива отгоняется при температуре менее 250°С, 96 об. % – не выше 350°С.
Аналитические методы исследования. Численность микобактерий определяли с помощью эпифлуоресцентной микроскопии в разбавленных клеточных суспензиях на поликарбонатных фильтрах с диаметром пор 0.2 мкм (“Millipore”, США) с 4,6-диамино-2-фенилиндолом (DAPI) в качестве красителя, как описано ранее (Иванова и соавт., 2017).
После инкубации 2 мл исследуемой пробы помещали в виалу с 2 мл гексана, взбалтывали в течение 10 мин и отстаивали 2 ч. В результате жидкость разделялась на два слоя, нижний из которых представлял собой неорганическую фазу, а верхний – гексан с растворенными в нем органическими соединениями. Пробу для хроматографического анализа объемом 0.6 мкл отбирали из верхней органической фазы.
Углеводороды и МЭЖК моторных топлив детектировали с помощью двумерной хроматографической системы GC-2010 Plus (“Shimadzu”, Япония) с неполярной (ПМС) и полярной (ПЭГ) колонками, которые находились в независимых термостатах, как описано в работе (Канатьева и соавт., 2014). На выходе первой колонки установлен пламенно-ионизационный детектор (ПИД), на выходе второй – масс-спектрометрический детектор GCMS-QP2010 Ultra с квадрупольным фильтром. Переключение потока осуществляли с помощью пневматического переключателя Динса (Deans switch), расположенного внутри термостата первой колонки. Условия разделения компонентов пробы детально описаны в работе (Канатьева и соавт., 2014). В случае использования масс-детектора, идентификацию соединений, входящих в состав исследуемых образцов, проводили путем сравнения полученных масс-спектров с данными библиотек масс-спектров NIST 08, NIST 08s, NIST 11 и Willey 9.
Степень биодеградации топлив оценивали по изменению содержания детектируемых соединений в биодеградированном субстрате по сравнению со стерильным контролем без микроорганизмов, инкубируемым в тех же условиях, как описано ранее (Иванова и соавт., 2018).
Статистический анализ данных. Представленные в работе результаты отражают усредненные величины по трем независимым сериям экспериментов при трехкратной повторности измерений. Статистическую обработку полученных данных проводили по общепринятой методике (Ашмарин, Воробьев, 1962). Для оценки достоверности различий использовали t-критерий Стьюдента с расчетом 95% доверительного интервала.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Биодеградация компонентов нефтяных моторных топлив ацидофильными бактериями Mycobacterium sp. AGS10
Биодеградация авиационного керосина. В настоящей работе изучали возможность деструкции авиационного керосина Джeт А-1 в качестве единственного источника углерода и энергии культурой бактерий штамма AGS10. Из рис. 1а видно, что топливо Джeт А-1 имеет очень легкий состав. В углеводородном профиле контрольного образца топлива идентифицированы С7–С12н-алканы (рис. 1а).
Рис. 1.
Хроматограмма гексанового экстракта авиакеросина Джeт А-1 до (а) и после биодеградации (б) штаммом AGS10 в течение 21 сут инкубации при температуре 30°С и рН 2.5. Идентифицированные углеводороды: С7–С12н-алканы.
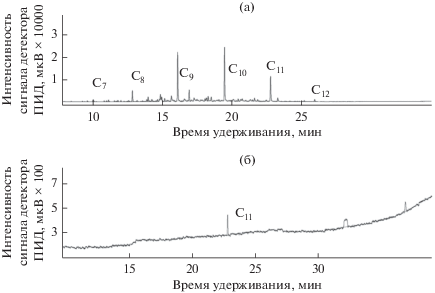
Ранее было показано, что штамм AGS10 эффективно использует С9–С21н-алканы в составе углеводородсодержащих смесей (Иванова и соавт., 2014, 2017), имеющих значительно более тяжелый состав, чем Джет А-1. В том числе биодеструкция технического керосина штаммом AGS10 за 20 сут культивирования при рН 2.5 и температуре 30°С составила 96% (Иванова и соавт., 2017). С другой стороны, некоторые из присутствующих в составе авиакеросина соединений, такие как низшие алканы (С6–С9), производные бензола и тетралина, известны как растворители, способные повреждать мембраны и быть токсичными для бактерий (Sikkema et al., 1994). Тем не менее, штамм AGS10 способен расти и утилизировать компоненты Джeт А-1 в условиях высокой кислотности: за 21 сут культивирования при рН 2.5 численность клеток бактерий возросла с 4.2 × 106 до 7.0 × × 108 кл./мл, а деструкция топлива составила 90.8% (рис. 1б).
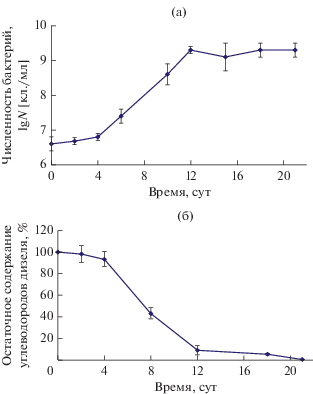
Биодеградация зимнего дизельного топлива. На рис. 2 представлено изменение численности клеток штамма AGS10 в процессе использования углеводородного дизельного топлива. В контрольном образце содержание зимнего дизельного топлива оставалось практически неизменным на протяжении всего периода инкубации (данные не показаны). В пробе с бактериями за 21 сут инкубации при температуре 30°С и рН 2.5 потребление углеводородов дизеля составило 99.4% (рис. 2б), при этом численность популяции бактерий увеличилась с 4.2 × 106 до 2.0 × 109 кл./мл (рис. 2а). В период с 4 до 12 сут культивирования, когда скорость биодеградации дизельного топлива была максимальной, рост численности бактерий коррелировал со скоростью потребления дизеля. Затем происходило замедление процесса деструкции углеводородов дизельного топлива на фоне отсутствия заметных изменений в численности микробной популяции.
Рис. 2.
Рост (а) и степень деструкции (б) углеводородов зимнего дизельного топлива штаммом AGS10 в течение 21 сут инкубации при температуре 30°С и рН 2.5.
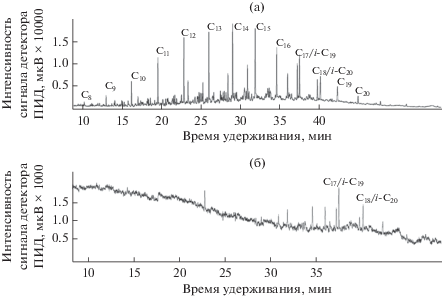
Как видно из сравнения рис. 1а и 3а, авиационный керосин Джeт А-1 и зимнее дизельное топливо имеют свои уникальные профили распределения компонентов на хроматограммах. По сравнению с авиакеросином для дизельного топлива характерно более широкое и равномерное распределение нормальных предельных углеводородов состава С8–С20, при этом наибольшую интенсивность имеют пики более длинноцепочечных С11–С16н‑алканов. Среди идентифицированных углеводородов дизельного топлива также представлены тяжелые изопреноиды, пристан и фитан, которых нет в авиационном керосине. Для контрольного образца дизельного топлива отношение концентрации изо-С19/изо-С20 составляет 1.50, а отношение (изо-С19 + изо-С20)/(н-С17 + н-С18) – 1.21.
В биодеградированном зимнем дизельном топливе н-алканы и изопреноиды, пристан и фитан, практически полностью элиминированы, также как и многие неидентифицированные компоненты этого нефтепродукта, пики которых на хроматограмме располагаются в промежутках между пиками нормальных алканов (рис. 3б). В составе данного нефтепродукта, по литературным данным (Prince et al., 2008; Болотник, 2017), эти пики могут принадлежать предельным разветвленным углеводородам, циклоалканам и ароматическим соединениям. Отношение концентрации изо-С19/изо-С20 сохраняется на прежнем уровне (1.54 против 1.50 в контроле), тогда как отношение (изо-С19 + изо-С20)/(н-С17 + н-С18) возрастает до 2.39, что указывает на большую устойчивость изопреноидов, по сравнению с нормальными алканами, к биодеструкции в экстремально кислых средах и согласуется с данными других авторов (Prince et al., 2008), полученными для нейтрофильных бактерий.
Рис. 3.
Хроматограмма алифатической фракции контрольного (а) и биодеградированного (б) образцов зимнего дизельного топлива. Условия инкубации штамма AGS10: 21 сут при температуре 30°С и рН 2.5. Идентифицированные углеводороды: С8–С20н-алканы с соответствующей длиной углеродной цепи; i-С19 и i-С20 – пристан и фитан соответственно.
Таким образом, в условиях высокой кислотности (рН 2.5) штамм AGS10 способен к эффективной деструкции как легкого по составу нефтяного моторного топлива (авиакеросин), так и более тяжелого зимнего дизельного топлива, содержащего смесь углеводородов С8–С20 различного строения.
Биодеградация топливных смесей, содержащих углеводородный дизель и БД, ацидофильными бактериями Mycobacterium sp. AGS10
Модельные топливные смеси получали путем последовательного разбавления чистого БД товарным ДТ. В результате были приготовлены топливные смеси, содержащие 20 и 5% (по объему) МЭЖК, обозначенные БД20 и БД5 соответственно. Для сравнения в экспериментах по биодеградации использовали также чистый БД (БД100) и товарное ДТ.
Как уже отмечалось, углеводородные моторные топлива и БД выполняют одну и ту же функцию, но сильно различаются по своему происхождению и составу. Показано (Канатьева и соавт., 2014), что двумерная газовая хроматография с вырезанием пиков и масс-спектрометрическим детектированием позволяет успешно обнаружить метиловые эфиры жирных кислот БД в нефтяном ДТ, т.к. углеводороды различного строения в составе ДТ удерживаются на второй (полярной) колонке значительно меньше кислородсодержащих полярных компонентов БД. Основными компонентами БД, полученного на основе рапсового масла, являются метилолеат (метиловый эфир октадецен-9-овой кислоты) и метиллинолеат (метиловый эфир октадекадиен-9,12-овой кислоты); в его состав в небольшом количестве также входят изомеры метиловых эфиров других диеновых, предельных (гептадекановая) и триеновых кислот. Все эти компоненты являются высококипящими и могут быть успешно отделены от углеводородной составляющей топливной смеси при использовании хроматографической колонки длиной 60 м и соответствующего программирования температуры, что подтверждается приведенными ниже результатами.
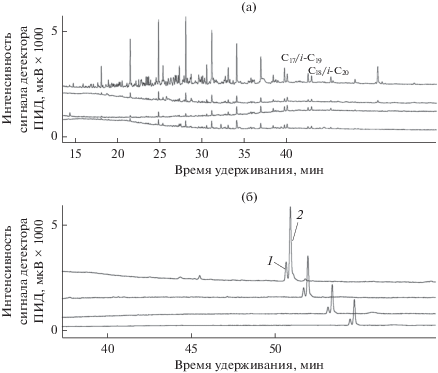
Хроматограммы образцов ДТ (рис. 4а) и БД100 (рис. 4б) показывают динамику изменений в составе и содержании этих видов топлив в ходе культивирования со штаммом бактерий AGS10. Для ДТ она в целом согласуется с ранее полученными результатами: в течение первых 9 сут потребляется более 80% топлива. В то же время компоненты БД100 расходуются значительно медленнее: к концу 9-х сут инкубации бактерии утилизируют только 62% МЭЖК. К 16-м сут эксперимента биодеструкция обоих топлив достигает 100% (данные не показаны).
Рис. 4.
Хроматограммы гексановых экстрактов ДТ (а) и БД100 (б), биодеградированных штаммом AGS10 при температуре 30°С и рН 2.5. Хроматограммы (сверху вниз): 0, 3, 6, 9 сут инкубации. 1 – метиллинолеат, 2 – метилолеат.
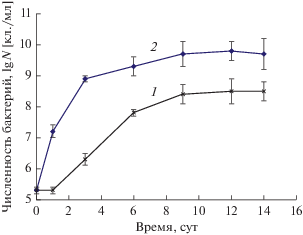
С другой стороны, кривые роста штамма AGS10 в среде с чистым ДТ и БД100, приведенные на рис. 5, свидетельствуют о том, что в среде с ДТ экспоненциальная фаза роста культуры наступает медленнее, и в стационарной фазе численность клеток бактерий существенно ниже, чем в среде с БД100.
Рис. 5.
Рост штамма AGS10 в течение 14 сут инкубации при температуре 30°С и рН 2.5. 1 – ДТ, 2 – БД100.
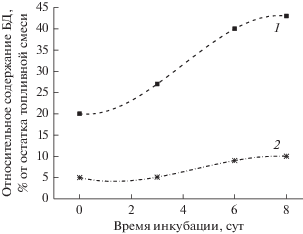
На рис. 6 представлены хроматограммы разделения гексанового экстракта топливных смесей БД20 (а) и БД5 (б). Как видно из рисунка, большая скорость расходования углеводородных компонентов по сравнению с МЭЖК подтверждается и для топливных смесей. По истечении 9 сут для обеих смесей наблюдалось практически полное потребление бактериями углеводородной части, в то время как пик МЭЖК оставался неизменным. Интересно, что к этому моменту доля БД в топливной смеси (относительное содержание) возросла ровно вдвое независимо от его содержания в исходной смеси (рис. 7).
Рис. 6.
Хроматограммы гексановых экстрактов топливных смесей БД20 (а) и БД5 (б), биодеградированных штаммом AGS10 при температуре 30°С и рН 2.5. Хроматограммы (сверху вниз): 0, 6, 9 сут инкубации.
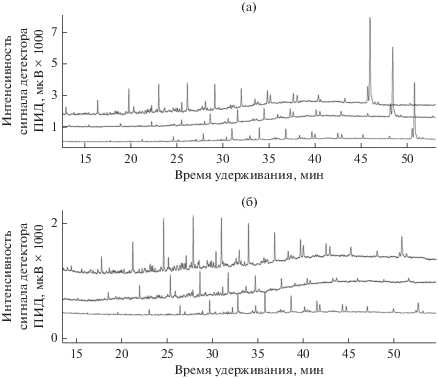
Рис. 7.
Изменение относительных количеств МЭЖК в составе топливной смеси в зависимости от продолжительности эксперимента для топливных смесей БД20 (1) и БД5 (2).
Изменения величины соотношения (изо-С19 + + изо-С20)/(н-С17 + н-С18) для различных видов топлив в ходе эксперимента представлены в табл. 1. К 9-м сут культивирования значение этого индекса для чистого ДТ возрастало почти вдвое, с 0.62 до 1.20, но менялось незначительно для топливных смесей БД20 и БД5 (с 0.62 до 0.71–0.72 соответственно).
Таблица 1.
Изменение величины соотношения (изо-С19 + изо-С20)/(н-С17 + н-С18) для различных видов топлива в зависимости от продолжительности эксперимента
| Время эксперимента, сут | (изо-С19 + изо-С20)/(н-С17 + н-С18) | ||
|---|---|---|---|
| ДТ | БД20 | БД5 | |
| 0 | 0.62 | 0.62 | 0.62 |
| 3 | 0.63 | 0.65 | 0.70 |
| 6 | 0.64 | 0.67 | 0.71 |
| 9 | 1.20 | 0.71 | 0.72 |
Таким образом, в ходе биодеструкции происходит разнонаправленное изменение профилей углеводородной и полярной составляющих топливных смесей. Увеличение времени эксперимента до 16 сут показало, что активное потребление компонентов БД из топливных смесей начиналось только после исчерпания углеводородного источника питания бактерий (данные не показаны). Статистически значимых отличий в скорости потребления углеводородного компонента (ДТ) в составе топливных смесей по сравнению с чистым ДТ не обнаружено.
Иными словами, наблюдается интересный феномен: в топливных смесях с БД при наличии “легко усваиваемого субстрата”, МЭЖК, исследуемые бактерии в первую очередь утилизируют более трудно окисляемые углеводороды ДТ. На настоящий момент у нас нет объяснения столь необычному пищевому предпочтению штамма AGS10. Можно предположить, что это обусловлено более высокой молекулярной массой компонентов БД, образованием токсичных продуктов при гидролизе компонентов БД по сложноэфирной связи (в частности – метилового спирта), либо накоплением жирных кислот (при рН 2.5 они присутствуют в наиболее токсичной для бактерий недиссоциированной форме). Также возможно, что специфику протекания процесса деструкции определяют условия инкубации – экстремально низкие значения рН среды.
Приведенные результаты свидетельствуют о высоком катаболическом потенциале штамма AGS10 в отношении разных по происхождению и составу жидких моторных топлив. Уникальность исследуемого процесса биодеструкции заключается в том, что он осуществляется в условиях высокой кислотности (рН 2.5), в которых активное функционирование большинства известных углеводородокисляющих микроорганизмов невозможно. Дальнейшие исследования, направленные на изучение биодеструкции культурой бактерий Mycobacterium sp. AGS10 топливных смесей различного состава и высоко устойчивых к биодеструкции углеводородов могут быть полезны в разработке подходов для биоремедиации загрязненных объектов с экстремально низкими значениями рН.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (проект № 18-29-05009 МК).
Список литературы
Ашмарин И.П., Воробьев А.А. Статистические методы в микробиологических исследованиях. Л.: Гос. Изд-во мед. лит-ры, 1962. 180 с.
Болотник Т.А. Новые подходы к определению ракетных керосинов в объектах окружающей среды и растениях методом хромато-масс-спектрометрии // Дис. … канд. хим. наук, 21.06.2017. Москва: ФГБОУ ВО МГУ им. М.В. Ломоносова, 2017. 160 с.
Иванова А.Е., Кизилова А.К., Кравченко И.К., Канатьева А.Ю., Курганов А.А., Беляев С.С. Окисляющая углеводороды ацидофильная термотолерантная ассоциация бактерий из серных карт // Микробиология. 2013. Т. 82. № 4. С. 464–473.
Ivanova A.E., Kizilova A.K., Kanat’eva A.Yu., Kravchenko I.K., Kurganov A.A., Belyaev S.S. A hydrocarbon-oxidizing acidophilic thermotolerant bacterial association from sulfur blocks // Microbiology (Moscow). 2013. V. 82. P. 482–489.
Иванова А.Е., Сухачева А.Е., Канатьева А.Ю., Кравченко И.К., Курганов А.А. Углеводородокисляющий потенциал и гены биодеградации н-алканов новой ацидофильной ассоциации микобактерий из серных карт // Микробиология. 2014. Т. 83. № 6. С. 667–676.
Ivanova A.E., Sukhacheva M.V., Kanat’eva A.Yu., Kravchenko I.K., Kurganov A.A. Hydrocarbon-oxidizing potential and the genes for n-alkane biodegradation in a new acidophilic mycobacterial association from sulfur blocks // Microbiology (Moscow). 2014. V. 83. P. 764–772.
Иванова А.Е., Соколова Д.Ш., Канатьева А.Ю. Биодеградация углеводородов и образование поверхностно-активных соединений ацидофильными микобактериями // Микробиология. 2016. Т. 85. № 3. С. 300–308.
Ivanova A.E., Sokolova D.Sh., Kanat’eva A.Yu. Hydrocarbon biodegradation and surfactant production by acidophilic mycobacteria // Microbiology (Moscow). 2016. V. 85. P. 317–324.
Иванова А.Е., Канатьева А.Ю., Курганов А.А., Селифанова М.В., Пурыгин П.П. Аэробная биодеградация адамантанов в условиях высокой кислотности // Микробиология. 2017. Т. 86. № 3. С. 307–316.
Ivanova A.E., Kanat’eva A.Yu., Kurganov A.A., Selifanova M.B., Purygin P.P. Aerobic degradation of adamantanes at highly acidic conditions // Microbiology (Moscow). 2017. V. 86. P. 330–337.
Иванова А.Е., Борзенков И.А. Аэробная биодеградация компонентов сырой нефти ацидофильными бактериями // Микробиология. 2018. Т. 87. № 4. С. 344–355.
Ivanova A.E., Borzenkov I.A. Aerobic biodegradation of crude oil components by acidohilic mycobacteria // Microbiology (Moscow). 2018. V. 87. P. 453–462.
Канатьева А.Ю., Курганов А.А., Якубенко Е.Е. Применение двумерной газовой хроматографии-масс-спектрометрии для определения примесей биодизельного топлива в углеводородных топливах // Нефтехимия. 2014. Т. 54. № 6. С. 471–477.
Kanat’eva A.Yu., Kurganov A.A., Yakubenko E.E. Application of two-dimensional gas chromatography-mass-spectrometry to determination of biodiesel impurities in hydrocarbon fuels // Pet. Chem. 2014. V. 54. P. 459–465.
Bacha J., Blondis L., Freel J., Hemighaus G., Hoekman K., Hogue N., Horn J., Lesnini D., McDonald C., Nikanjam M., Olsen E., Scott B., Sztenderowicz M. Diesel Fuels Technical Review. Chevron U.S.A., Richmond, 2007. 69 p.
Canoira L., Galean J.G., Alcantara R., Lapuerta M., Garcia-Contreras R. Fatty acid methyl esters (FAMEs) from castor oil: production process assessment and synergistic effects in its properties // Renewable Energy. 2010. V. 35. P. 208–217.
Chemlal R., Abdi N., Lounici H., Drouiche N., Pauss A., Mameri N. Modeling and qualitative study of diesel biodegradation using biopile process in sandy soil // Int. Biodeterior. Biodegrad. 2013. V. 78. P. 43–48.
DeMello J.A., Carmichael C.A., Peacock E.E., Nelson R.K., Arey J.S., Reddy C.M. Biodegradation and environmental behavior of biodiesel mixtures in the sea: an initial study // Mar. Pollut. Bull. 2007. V. 54. P. 894–904.
Demirbas M.F., Balat M. Recent advances on the production and utilization trends of bio-fuels: a global perspective // Energy Convers. Manage. 2006. V. 47. P. 2371–2381.
Fernandez-Alvarez P., Vila J., Garrido J.M., Grifoll M., Feijoo G., Lema J.M. Evaluation of biodiesel as bioremediation agent for the treatment of the shore affected by the heavy oil spill of the prestige // J. Hazard. Mater. 2007. V. 147. P. 914–922.
Gallego J.L.R., Loredo J., Llamas J.F., Vazquez F., Sanchez J. Bioremediation of diesel-contaminated soils: evaluation of potential in situ techniques by study of bacterial degradation // Biodegradation. 2001. V. 12. P. 325–335.
Huang D., Zhou H., Lin L. Biodiesel: an alternative to conventional fuel // Energy Procedia. 2012. V. 16. P. 1874–1885.
Knothe G., Gerpen J.V., Krahl J. The Biodiesel Handbook. Illinois: AOCS Press, 2005. 275 p.
Knothe G., Steidley K.R. Lubricity of components of biodiesel and petrodiesel. The origin of biodiesel lubricity // Energy & Fuels. 2005. V. 19. P. 1192–1200.
Lapinskiene A., Martinkus P., Rebzdaite V. Eco-toxicological studies of diesel and biodiesel fuels in aerated soil // Environ. Pollut. 2006. V. 142. P. 432–437.
Ma F., Hanna M.A. Biodiesel production: a review // Bioresource Technol. 1999. V. 70. P. 1–15.
Marchal R., Penet S., Solano-Serena F., Vandecasteele J.P. Gasoline and diesel oil biodegradation // Oil & Gas Sci. Technol. 2003. V. 58. P. 441–448.
Margesin R., Schinner F. Biodegradation and bioremediation of hydrocarbons in extreme environments // Appl. Microbiol. Biotechnol. 2001. V. 56. P. 695–700.
Miller N.J., Mudge S.M. The effect of biodiesel on the rate of removal and weathering characteristics of crude oil within artificial sand columns // Spill Sci. Technol. 1997. V. 4. P. 17–33.
Mudge S.M., Pereira G. Stimulating the biodegradation of crude oil with biodiesel: preliminary results // Spill Sci. Technol. Bull. 1999. V. 5. P. 353–355.
Olson J.J., Mills G.L., Herbert B.E., Morris P.J. Biodegradation rates of separated diesel components // Environ. Toxicol. Chem. 1999. V. 18. P. 2448–2453.
Owsianiak M., Chrzanowski L., Szulc A., Staniewski J., Olszanowski A., Olejnik-Schmidt A.K., Heipieper H.J. Biodegradation of diesel/biodiesel blends by consortium of hydrocarbon degraders: effect of the type of blend and the addition of biosurfactants // Bioresour. Technol. 2009. V. 100. P. 1497–1500.
Pereira M.G., Mudge S.M. Cleaning oiled shores: laboratory experiments testing the potential use of vegetable oil biodiesels // Chemosphere. 2004. V. 54. P. 297–304.
Pinto A.C., Guarieiro L.L.M., Rezende M.J.C., Ribeiro N.M., Torres E.A., Lopes W.A., Pereira P.A.P., Andrade J.B. Biodiesel: an overview // J. Braz. Chem. Soc. 2005. V. 16. P. 1313–1330.
Prince R.C., Haitmanek C., Lee C.C. The primary aerobic biodegradation of biodiesel B20 // Chemosphere. 2008. V. 71. P. 1446–1451.
Prince R.C., Parkerton T.F., Lee C. The primary aerobic biodegradation of gasoline hydrocarbons // Environ. Sci. Technol. 2007. V. 41. P. 3316–3321.
Sikkema J., de Bont A.M., Poolman B. Interactions of cyclic hydrocarbons with biological membranes // J. Biol. Chem. 1994. V. 269. P. 8022–8028.
Silva G.S., Marques E.L.S., Dias J.C.T., Lobo I.P., Gross E., Brendel M., da Cruz R.S., Rezende R.P. Biodegradability of soy biodiesel in microcosm experiments using soil from the Atlantic Rain Forest // Appl. Soil. Ecol. 2012. V. 55. P. 27–35.
Solano-Serena F., Marchal R., Casaregola S., Vasnier C., Lebeault J.M., Vandecasteele J.P. A Mycobacterium strain with extended degradation capacities for gasoline hydrocarbons // Appl. Environ. Microbiol. 2000. V. 66. P. 2392–2399.
Suehara K., Kawamoto Y., Fujii E., Kohda J., Nakano Y., Ya-no T. Biological treatment of wastewater discharged from biodiesel fuel production plant with alkali-catalyzed transesterification // J. Biosci. Bioeng. 2005. V. 100. P. 437–442.
Zhang X., Peterson C.L., Reece D., Moller G., Haws R. Biodegradability of biodiesel in the aquatic environments // Trans. ASAE. 1998. V. 41. P. 1423–1430.
Дополнительные материалы отсутствуют.


