Микробиология, 2019, T. 88, № 3, стр. 358-366
Термофильные бактерии в донных осадках озера Байкал, ассоциированных с разгрузкой углеводородов
О. Н. Павлова a, *, А. В. Ломакина a, А. С. Новикова a, С. М. Черницына a, Т. А. Ханаева a, Т. В. Погодаева a, А. В. Хабуев a, Т. И. Земская a
a Лимнологический институт СО РАН
664033 Иркутск, Россия
* E-mail: pavlova@lin.irk.ru
Поступила в редакцию 25.10.2018
После доработки 24.12.2018
Принята к публикации 01.02.2019
Аннотация
Проведено исследование, направленное на выявление термофильных микроорганизмов в низкотемпературных осадках оз. Байкал, ассоциированных с выходом газонасыщенных флюидов. В накопительных культурах из донных осадков трех различных районов озера (метановый и нефте-метановый сип, грязевой вулкан) на основе анализа фрагментов гена 16S рРНК из библиотеки клонов выявлены термофильные представители порядка Clostridiales. В накопительной культуре с пробами донных отложений из фонового района оз. Байкал термофильные прокариоты не обнаружены. Наличие термофильных микроорганизмов в районах разгрузки углеводородов может быть следствием их миграции по зонам разломов на поверхность дна озера вместе с газосодержащим минерализованным флюидом. В отличие от холодных морских осадков, где эндоспоры термофильных бактерий принадлежат строгим анаэробам, обеспечивающим свой метаболизм за счет ферментации органических субстратов или сульфатредукции, в осадках оз. Байкал, ассоциированных с выходами газонасыщенных флюидов обнаружены факультативно анаэробные термофильные прокариоты.
Термофильные прокариоты – особая группа микроорганизмов, оптимальная температура роста которых составляет >50°С. Термофилы, как правило, ассоциированы с пластовыми водами нефтяных месторождений, подземными водными резервуарами, глубинными горнодобывающими шахтами, высокотемпературными горизонтами, находящимися под океанической корой в районах современной подводной вулканической активности (Bonch-Osmolovskaya et al., 2012). Вместе с тем, эндоспоры термофильных анаэробных бактерий (ТАБ) обнаружены в холодных почвах и холодных морских осадках (Isaksen et al., 1994; Müller et al., 2014; Volpi et al., 2017; Chakraborty et al., 2018). Низкая температура in situ морских донных отложений не может обеспечить рост и развитие термофильных прокариот. Появление эндоспор ТАБ в низкотемпературных средах может быть следствием либо их пассивного рассеивания в океане, либо поступления вместе с газонасыщенными флюидами из глубинных слоев в водную толщу и последующего осаждения в поверхностных осадках (Hubert et al., 2009). В холодных донных отложениях из отдаленных географических мест, связанных с океанскими течениями, выявлены одни и те же филотипы анаэробных термофильных бактерий, имеющие филогенетическое сходство с микроорганизмами из морских нефтяных пластов и высокотемпературных осадков, находящихся под океанической корой (Hubert et al., 2010; De Rezende et al., 2013; Volpi et al., 2017; Chakraborty et al., 2018).
Донные осадки озера Байкал характеризуются стабильно низкими температурами (3.1–5.7°С) (Kozhov, 1963). Вместе с тем, расположение оз. Байкал в тектонически активной зоне обусловливает наличие в озере разгрузок нефте- и газосодержащих флюидов, залежей газовых гидратов, часть из которых связана с деятельностью грязевых вулканов (Кузьмин и соавт., 2001; Конторович и соавт., 2007; Хлыстов и соавт., 2017). Как правило, такие районы характеризуются повышенными тепловыми потоками, связанными с восходящими по разломам гидротермальными флюидами (Голубев, 1979; Дучков и соавт., 1999; Van Rensbergen et al., 2002). Аномально повышенный вынос тепла (более 100–200 мВт/м2) зафиксирован вдоль Посольского разлома (Van Rensbergen et al., 2002; Klerkx et al., 2006; Naudts et al., 2012). Подводная возвышенность Посольская Банка, граничащая с Посольским разломом, характеризуется обширными залежами газовых гидратов и глубоководными выходами метана. В донных осадках Посольской Банки выявлено наличие конвективной флюидной петли, обусловливающей состав микробных сообществ, отличный от таковых в других газогидратных районах (Klerkx et al., 2006; Naudts et al., 2012; Черницына и соавт., 2016).
На основе геологических данных, структуры, выявленные в Среднем Байкале в районе Кукуйского каньона, были определены как грязевые вулканы. Выход флюидов приурочен, в первую очередь, к разрывным нарушениям, имеющим глубокие корни, активность которых во многом связана с сейсмической активностью байкальской впадины (Cuylaerts et al., 2012; Khlystov et al., 2013). Измерение теплового потока (29–121 мВт/м2) и картирование газовых гидратов в районе Кукуйского каньона позволило выявить особый тип ассоциации тепловых аномалий вблизи гидратобразующих слоев (Poort et al., 2012).
Район м. Горевой Утес характеризуется как нефте-метановый сип, где наблюдаются выходы газа, нефти и глубинных вод, мигрирующих по коллекторам нижнего сейсмокомплекса (с глубины ~4 км) до проницаемой зоны разломов, где в результате вертикальной миграции они поступают на поверхность дна (Конторович и соавт., 2007).
Очевидно, что в районах озера Байкал, ассоциированных с выходом газонасыщенных флюидов и характеризующихся повышенными тепловыми потоками, могут действовать те же механизмы, что и в океане, обеспечивающие поступление термофильных микроорганизмов вместе с углеводородсодержащими флюидами.
Цель работы – выявление термофильных микроорганизмов в газонасыщенных осадках оз. Байкал в сравнении с фоновым районом.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Районы исследования и отбор проб. Донные осадки отобраны в трех районах оз. Байкал: (1) метановый сип “Посольская Банка” (ПБ), (2) грязевой вулкан “К-2” в районе Кукуйского каньона (К-2), (3) нефте-метановый сип “Горевой Утес” (ГУ). В качестве фоновой станции осадки отобраны в районе Академического хребта (4) (АХ) (рис. 1). Пробы донных осадков отбирали с помощью гравитационной трубы с борта НИС “Г.Ю. Верещагин”. Характеристика станций пробоотбора и краткое описание исследуемых донных отложений приведены в табл. 1.
Рис. 1.
Схема расположения исследуемых районов: 1 – метановый сип “Посольская Банка”; 2 – грязевой вулкан “К-2”; 3 – нефте-метановый сип “Горевой Утес”; 4 – Академический хребет.

Таблица 1.
Характеристики станций пробоотбора
| Место отбора проб/год | Глубина осадка для получения накопительных культур, см | Краткая характеристика осадка |
|---|---|---|
| Метановый сип “Посольская Банка”/2012 | 0–2 | 0–30 см – восстановленный темно-серый диатомовый алевропелитовый ил с примесью алеврита и прослоями гидротроилита; 30–150 см – серая газонасыщенная алевритистая глина; 30–80 см – трещины дегазации; 80–150 см – газовые гидраты (до 97% объемного содержания) |
| Грязевой вулкан “K-2”/2013 | 10–15 | 0–64 см – востановленный серый диатомовый алевропелитовый ил, газонасыщенный; 64–146 см – серая глина с прямыми и наклонными слоями газовых гидратов, на глубине 64–67 и 96–105 см газовые гидраты гранулированной формы |
| Нефте-метановый сип “Горевой Утес”/2016 | 15 | 0–143 см – газонасыщенный алеврито-пелитовый ил, пропитанный нефтью; 143–306 см – глина с вертикальными или слабонаклоненными каналами разгрузок диаметром до 5 мм, трещины скола и дегазации 1–2 мм |
| Академический хребет/2015 | 5–10 | 0–5 см – окисленный слой; 5–320 см – восстановленный серый диатомовый алевропелитовый ил с прослоями гидротроилита |
Химический состав поровых вод донных осадков определяли по методике, описанной в работе (Погодаева и соавт., 2007) на базе приборного центра коллективного пользования физико-химического ультрамикроанализа ЛИН СО РАН.
Культивирование. Для получения накопительных культур, образцы донных осадков (10 см3) асептически отбирали из центральной части керна и сразу помещали во флаконы объемом 116 мл, содержащие 50 мл стерильной анаэробной минеральной среды следующего состава (г/л): NaCl – 0.03; NH4Cl – 0.033; KH2PO4 – 0.033; MgCl2 ⋅ ⋅ 6H2O – 0.033; CaCl2 ⋅ 2H2O – 0.033; NaHCO3 – 1; резазурин – 0.001; Na2S ⋅ 9H2O – 0.3; 1 мл раствора витаминов; 1 мл раствора микроэлементов (Практикум по микробиологии, 2005). Флаконы закрывали резиновыми пробками и алюминиевыми колпачками, продували очищенным от кислорода азотом и встряхивали на орбитальном шейкере (15 мин, 200 об./мин). Полученную суспензию переносили шприцом (10 мл) во флаконы с минеральной средой (30 мл) указанного выше состава, содержащей дрожжевой экстракт (1 г/л) и газовую смесь H2/CO2 (80/20). Конечный pH среды составлял 7.0. Культивирование проводили в темноте при температуре 60°C без перемешивания.
Исследование морфологии микроорганизмов проводили методами трансмиссионной и флуоресцентной микроскопии. Для трансмиссионной электронной микроскопии образцы суспендировали в стерильной воде, суспензию наносили на медные сетки, покрытые формваровой пленкой, и высушивали. Полученные препараты просматривали на трансмиссионном электронном микроскопе Leo 906E (“Zeiss”, Германия) на базе приборного центра коллективного пользования физико-химического ультрамикроанализа ЛИН СО РАН.
Для изучения морфологии микроорганизмов методом эпифлуоресцентной микроскопии к препарату, обезвоженному в серии растворов этанола, добавляли рабочий раствор флуорохромного красителя 4,6-диамино-2-фенилиндола до конечной концентрации 0.5 мкг/мл, выдерживали 3 мин. Исследование проводили с помощью эпифлуоресцентного микроскопа Axio Imager M1 (“Zeiss”).
Молекулярные методы идентификации. ДНК из накопительных культур выделяли согласно модифицированной методике ферментативного лизиса с последующей фенол-хлороформной экстракцией (Sambrook et al., 1989). Гены 16S рРНК амплифицировали с использованием универсальных бактериальных праймеров (27F, 1350R) (Lane, 1991). Клонирование и трансформацию полученных фрагментов гена 16S рРНК осуществляли с помощью набора реагентов pGEM-T Easy Vector Systems (“Promega”, США) в соответствии с протоколом производителя.
Реакцию Сэнгера с использованием реактива BigDye Terminator Kit v. 3.1 (“Applied Biosystems”) и анализ ее продуктов на генном анализаторе ABI 3130х1 осуществляли в Центре коллективного пользования “Геномика” СО РАН (г. Новосибирск).
Первичный анализ сходства полученных нуклеотидных последовательностей генов 16S рРНК из накопительных культур с известными последовательностями из GenBank проводили после выравнивания в программе ClustalW с помощью программного пакета BLAST (www.ncbi.nlm.nih.gov/ blast). Филогенетическое дерево строили по методу ближайших соседей (neighbor-joining), используя кластерный метод и алгоритм Kimura’s two parameters, реализованному в программе MEGA 6 (Tamura et al., 2011). Полученные в работе последовательности фрагментов гена 16S рРНК депонированы в базе данных GenBank под номерами: MH107331, MH159723, MH159724, MH555074–MH555082, MK183756–MK183759, MK183694–MK183695.
РЕЗУЛЬТАТЫ
Накопительные культуры термофильных бактерий получены из донных осадков метанового сипа ПБ, грязевого вулкана К-2 и нефте-метанового сипа ГУ. При культивировании донных осадков фоновой станции АХ получить термофильную накопительную культуру не удалось.
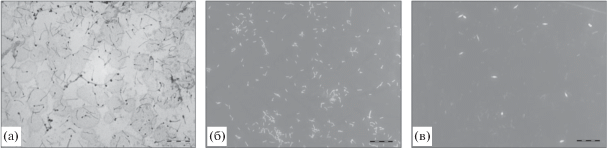
С помощью эпифлуоресцентной и трансмиссионной электронной микроскопии в накопительной культуре ПБ выявлены палочки размером 0.3–0.5 × 1.8–3 мкм с терминально расположенными спорами, одиночные палочки, не содержащие спор, а также тонкие нитевидные клетки со спорами (рис. 2а). По морфологии клетки в исследуемой накопительной культуре имели некоторое сходство с представителями рода Thermaerobacter и Planifilum (Spanevello, Patel, 2015; Yu et al., 2015). В накопительной культуре из осадка грязевого вулкана К-2 обнаружены тонкие палочки 2–3 × 0.2 мкм (рис. 2б), в то время как в накопительной культуре ГУ – тонкие неспорообразующие палочки 2–3 × 0.2 мкм и веретеновидные клетки с центрально расположенной спорой (рис. 2в).
Рис. 2.
Морфология клеток в накопительных культурах из метанового сипа ПБ (а), грязевого вулкана К-2 (б), нефте-метанового сипа ГУ (в); (а) – трансмиссионная электронная микроскопия, (б, в) – эпифлуоресцентная микроскопия. Масштабная линейка – 10 мкм.
Исследованные осадки различались по литологии (табл. 1) и химии поровых вод. Анализ состава поровых вод кернов донных осадков метанового сипа ПБ, грязевого вулкана К-2 и нефте-метанового сипа ГУ свидетельствует о поступлении в донные отложения минерализованного флюида, который насыщает их ионами, не характерными для фоновых районов (Погодаева и соавт., 2007). Так, в поровых водах керна ПБ, в слоях осадка, вмещающих газовые гидраты, в значительных количествах обнаружены ацетат-ионы (до 22 мг/л), хлорид-ионы (до 24 мг/л), ионы аммония (до 4 мг/л) и ионы железа (до 9 мг/л). В составе поровых вод осадков керна К-2 обнаружены ионы брома (до 10 мг/л), отсутствующие в фоновых районах, а также повышенное содержание ионов хлора (до 30 мг/л) и ионов аммония (до 5 мг/л). Исследование состава поровых вод керна ГУ показало трехкратное (против фонового) превышение минерализации, достигаемое, в основном, за счет повышения (до 300 мг/л) концентрации гидрокарбонат-ионов (${\text{HCO}}_{3}^{ - }$) и ацетат-ионов. Химический состав поровых вод из керна АХ характерен для типичных байкальских осадков (Погодаева и соавт., 2007; Pogodaeva et al., 2017), что отражает отсутствие подтоков флюидов и других седиментологических процессов.
Для проведения анализа клональной библиотеки накопительной культуры из поверхностного осадка метанового сипа ПБ были отобраны 35 клонов с фрагментами последовательностей гена 16S рРНК. В библиотеке генов 16S рРНК накопительной культуры численно преобладали (28 клонов) последовательности термофильных бактерий рода Thermaerobacter, имеющие 97–99% сходства с таковыми бактерий Thermaerobacter marianensis (Acc. no NR074944), T. nagasakiensis (NR024776), T. subterraneus (EU214630) и T. litorales (NR043281). Представители рода Thermaerobacter выделены из осадков Марианской впадины (10 897 м), морских гидротермальных выходов и прибрежных гидротермальных областей полуострова Сацума, префектуры Кагосима, Япония (Spanevello, Patel, 2015). Минорные клонированные последовательности принадлежали термофильным актиномицетам, представителям рода Planifilum (97–99% сходства) семейства Thermoactinomycetaceae и представителям рода Symbiobacterium (97% сходства) семейства Symbiobacteriaceae (рис. 3).
Рис. 3.
Филогенетическое дерево, основанное на последовательностях гена 16S рРНК, показывающее положение термофильных бактерий из осадков оз. Байкал. Полученные последовательности на филогенетическом дереве выделены жирным шрифтом. Масштабная линейка показывает эволюционное расстояние, соответствующее 1 нуклеотидной замене на каждые 100 нуклеотидов. Цифрами показана достоверность ветвления, установленная с помощью “bootstrap” – анализа альтернативных деревьев.
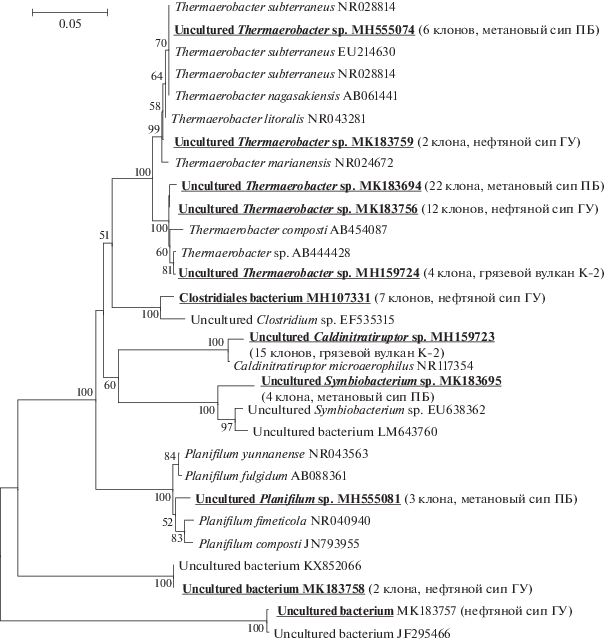
Библиотека (24 клона) накопительной культуры из донных осадков нефте-метанового сипа ГУ, согласно анализу фрагментов гена 16S рРНК, состояла из последовательностей термофильных бактерий рода Thermaerobacter (97–99% сходства, 14 клонов) и последовательностей, которые на 97% были гомологичны некультивируемым термофильным ацидофилам рода Clostridium sp. (EF535315), изолированным из почвы (7 клонов). Среди минорных компонентов библиотеки (3 клона) выявлялись представители некультивируемых бактерий (JF295466, KX852066) (рис. 3).
В библиотеке накопительной культуры донных осадков K-2 (19 клонов) численно преобладали последовательности Caldinitratiruptor microaerophilus (97–99% сходства, 15 клонов) (рис. 3). Представитель рода Caldinitratiruptor (семейство Symbiobacteriaceae, филум Firmicutes), впервые выделенный из термального источника Франции, является нитратредуцирующим микроаэрофильным термофилом. Ветвь Symbiobacterium включает только два термофильных вида, оптимальный рост которых наблюдается при совместном культивировании с термофильной бактерий Geobacillus sp. (Fardeau et al., 2010). Остальные 4 последовательности были наиболее близки гену Thermaerobacter marianensis (NR074944, 93–96% сходства).
ОБСУЖДЕНИЕ
Проведенные исследования накопительных культур из осадков оз. Байкал, ассоциированных с выходами углеводородов, показали, что в них, как и в холодных морских осадках, обнаруживаются термофильные микроорганизмы, присутствие эндоспор которых в низкотемпературных морских осадках является известным фактом, о чем свидетельствует значительное количество опубликованных работ (Isaksen et al., 1994; Hubert et al., 2009, 2010; De Rezende et al., 2013; Müller et al., 2014; Volpi et al., 2017; Chakraborty et al., 2018). Для пресноводных озер, в частности, глубоководных осадков оз. Байкал, подобное явление ранее не регистрировалось. Вероятно, в оз. Байкал действуют схожие механизмы поступления термофильных прокариот из зоны генерации углеводородов вместе с газонасыщенными флюидами, выявленными для холодноводных морских осадков. О поступлении глубинных минерализованных флюидов в исследуемые осадки, за исключением осадков АХ, свидетельствуют oб аномалии состава поровых вод. Данная гипотеза подтверждается отсутствием термофилов в накопительных культурах с донными осадками фонового района – Академического хребта, где признаки нахождения грязевых вулканов или газовых гидратов прежде не регистрировались.
Еще одним вероятным источником появления термофилов в поверхностных осадках может быть их поступление из термальных источников, расположенных в области Байкальского рифта. Термальные источники Байкальской рифтовой зоны являются наиболее частыми объектами исследования термофильных прокариот. В них выявлены представители филумов Proteobacteria, Firmicutes, Nitrospirae, Planctomycetes, Deinococcus-Thermus, Atribacteria (OP9), Chloroflexi (Белькова и соавт., 2005; Жилина и соавт., 2005; Лаврентьева и соавт., 2009; Калашников и соавт., 2014; Раднагуева и соавт., 2016; Sokolova et al., 2005; Lebedeva et al., 2010; Kovaleva et al., 2015; Rozanov et al., 2017). Благодаря сложной системе градиентно-конвективных течений, обусловливающих общую циркуляцию водных масс, охватывающих все три котловины оз. Байкал (Верболов, 1996), термофильные прокариоты могли бы быть занесены из наземных гидротерм и захоронены в поверхностных осадках.
Библиотеки генов 16S рРНК накопительных культур термофильных бактерий из донных осадков оз. Байкал характеризовались небольшим разнообразием. Во всех библиотеках наиболее представленными были последовательности организмов рода Thermaerobacter. Род Thermaerobacter насчитывает пять таксономически узаконенных видов (List of prokaryotic names with in nomenclature; http://www.bacterio.net/thermaerobacter.html). В настоящее время таксономический статус рода Thermaerobacter остается неопределенным. Род Thermaerobacter может представлять собой очень глубокую группу внутри филума Firmicutes или потенциально новый филум. Определен полный геном типового штамма T. marianensis (7p75aT) (Han et al., 2010). Хан и соавторы отмечают отсутствие в базах данных филотипов представителей рода Thermaerobacter, изолированных из природных местообитаний, что свидетельствует о довольно редком выявлении представителей этого рода в естественных биоценозах.
Обнаруженые в донных осадках Арктики и Мексиканского залива эндоспоры термофильных бактерий принадлежат представителям семейств Peptococcaceae, Clostridiaceae, Bacillaceae и Thermoanaerobacteraceae, обеспечивающим свой метаболизм за счет ферментации органических субстратов или сульфатредукции (Hubert et al., 2010; Müller et al., 2014; Chakraborty et al., 2018). В накопительных культурах донных осадков оз. Байкал выявлены в основном факультативно анаэробные термофильные бактерии. Представитель рода Caldinitratiruptor, последовательности которого детектированы в накопительных культурах из осадков грязевого вулкана, при окислении глюкозы может использовать кислород или нитрат, восстанавливая последний до нитрита. Несмотря на то, что немногочисленные представители рода Thermaerobacter описаны как строгие аэробные гетеротрофы (Spanevello, Patel, 2015), у чистой культуры Thermaerobacter sp. PB12/4term, из донных осадков метанового сипа ПБ, выявлена способность к миксотрофному росту за счет окисления водорода (Павлова и соавт., 2017).
Необходимы дальнейшие исследования низкотемпературных поверхностных осадков оз. Байкал как фоновых, так и ассоциированных с разгрузкой углеводородов, для выявления причины появления в них термофильных прокариот.
ФИНАНСИРОВАНИЕ РАБОТЫ
Исследования выполнены в рамках государственного задания по теме 0345-2019-0007 (проведение экспедиционных работ), 0345-2018-0001 (литологические исследования, определение химии поровых вод) и гранта РФФИ № 16-04-00181_а (микробиологические, молекулярно-биологические исследования).
Список литературы
Белькова Н.Л., Парфенова В.В., Суслова М., Ан Т.С., Тадзаки К. Биоразнообразие и активность микробного сообщества горячего источника Котельниковский (оз. Байкал) // Известия РАН. Сер. Биол. 2005. Т. 32. № 6. С. 664–671.
Belkova N.L., Parfenova V.V., Suslova M.Yu., Ahn T.S., Tazaki K. Biodiversity and activity of the microbial community in the Kotelnikovsky hot springs (Lake Baikal) // Biology Bulletin (Moscow). 2005. V. 32. P. 549–555.
Верболов В.И. Течения и водообмен в Байкале // Водные ресурсы. 1996. Т. 23. № 4. С. 413–423.
Голубев В.А. Тепловой поток через впадину оз. Байкал // Докл. АН СССР. 1979. Т. 245. № 6. С. 1333–1336.
Дучков А.Д., Лысак С.В., Голубев В.А, Дорофеева Р.П., Соколова Л.С. Тепловой поток и геотемпературное поле Байкальского региона // Геология и геофизика. 1999. Т. 40. № 3. С. 287–303.
Жилина Т.Н., Кевбрин В.В., Турова Т.П., Лысенко А.М., Кострикина Н.А., Заварзин Г.А. Сlostridium alkalicellum sp. nov. ‒ облигатно алкалофильный целлюлозолитик из содового озера прибайкалья // Микробиология. 2005. Т. 74. № 5. С. 642–653.
Zhilina T.N., Kevbrin V.V., Tourova T.P., Lysenko A.M., Kostrikina N.A., Zavarzin G.A. Clostridium alkalicellum sp. nov., an obligately alkaliphilic cellulolytic bacterium from a soda lake in the Baikal Region // Microbiology (Moscow). 2005. V. 74. P. 557–566.
Калашников А.М., Гайсин В.А., Сухачева М.В., Намсараев Б.Б., Пантелеева А.Н., Нуянзина-Болдарева Е.Н., Кузнецов Б.Б., Горленко В.М. Аноксигенные фототрофные бактерии микробных сообществ термального источника Горячинск (Прибайкалье) // Микробиология. 2014. Т. 83. № 4. С. 484–499.
Kalashnikov A.M., Gaisin V.A., Sukhacheva M.V., Namsaraev B.B., Panteleeva A.N., Nuyanzina-Boldareva E.N., Kuznetsov B.B., Gorlenko V.M. Anoxygenic phototrophic bacteria from microbial communities of Goryachinsk // Microbiology (Moscow). 2014. V. 83. P. 407–421.
Конторович А.Э., Каширцев В.А., Москвин В.И., Бурштейн Л.М., Земская Т.И., Калмычков Г.В., Костырева Е.А., Хлыстов О.М. Нефтегазоносность отложений оз. Байкал // Геология и геофизика. 2007. Т. 48. № 12. С. 1346–1356.
Kontorovich A.E., Kashirtsev V.A., Moskvin V.I., Burshtein L.M., Zemskaya T.I., Kostyreva E.A., Kalmychkov G.V., Khlystov O.M. Petroleum potential of Baikal deposits // Russian Geol. Geophys. (Novosibirsk). 2007. V. 12. P. 1046–1053.
Кузьмин М.И., Карабанов Е.Б., Каваи Т., Вильямс Д.Ф., Бычинский В.А., Кербер Е.В., Кравчинский В.А., Безрукова Е.В., Прокопенко А.А., Хурсевич Г.К., Гвоздков А.Н., Гелетий В.Ф., Калмычков Г.В., Горегляд А.В., Антипин В.С., Хомутова М.Ю., Сошина Н.М., Иванов Е.В., Хурсевич Г.К., Ткаченко Л.Л., Солотчина Е.П., Иошида Н., Гвоздков А.Н. Глубоководное бурение на Байкале – основные результаты // Геология и геофизика. 2001. Т. 42. № 1–2. С. 8–34.
Kuzmin M.I., Karabanov E.B., Kawai T., Williams D., Bychinsky V.A., Kerber E.V., Kravchinsky V., Bezrukova E., Prokopenko A.A., Geletii V.F., Kalmychkov G.V., Goreglyad A.V., Antipin V.S., Khomutova M.Yu., Soshina N.M., Ivanov E.V., Khursevich G.K., Tkachenko L.L., Solotchina E.P., Ioshida N., Gvozdkov A.N. Deep drilling on Lake Baikal: Main results // Russian Geol. Geophys. (Novosibirsk). 2001. V. 42. P. 8–34.
Лаврентьева Е.В., Шагжина А.П., Бабасанова О.Б., Дунаевский Я.Е., Намсараев З.Б., Бархутова Д.Д. Изучение двух алкалотермофильных бактерий рода Anoxybacillus как продуцентов внеклеточных протеиназ // Прикл. биохимия и микробиология. 2009. Т. 45. № 5. С. 538–543.
Lavrenteva E.V., Shagzhina A.P., Babasanova O.B., Dunaevsky Y.E., Barkhutova D.D., Namsaraev Z.B. The study of two alkaliphilic thermophile bacteria of the Anoxybacillus genus // Appl. Biochem. Microbiolol. 2009. V. 45. P. 484–488.
Павлова О.Н., Букин С.В., Горшков А.Г., Ханаева Т.А., Земская Т.И. Микроорганизмы озера Байкал: от психрофильных углеводородокисляющих аэробов до термофильных миксотрофов // I Российский микробиологический конгресс / Под. ред. Решетиловой Т.А. М.: ООО “ИД “Вода: химия и экология”, 2017. С. 68–69.
Погодаева Т.В., Земская Т.И., Голобокова Л.П., Хлыстов О.М., Минами Х., Сакагами Х. Особенности химического состава поровых вод донных отложений различных районов озера Байкал // Геология и геофизика. 2007. Т. 48. № 11. С. 1144–1160. Pogodaeva T.V., Zemskaya T.I., Golobokova L.P., Khlystov O.M., Minami H., Sakagami H. Chemical composition of pore waters of bottom sediments in different Baikal basins // Russian Geol. Geophys. (Novosibirsk). 2007. V. 48. P. 886–900.
Практикум по микробиологии / Под ред. Нетрусова А.И. М.: Академия, 2005. 608 с.
Раднагуруева А.А., Лаврентьева Е.В., Будагаева В.Г., Бархутова Д.Д., Дунаевский Я.Е., Намсараев Б.Б. Органотрофные бактерии горячих источников Байкальской рифтовой зоны // Микробиология. 2016. Т. 85. № 3. С. 347–360.
Radnagueva A.A., Lavrentieva E.V., Budagaeva V.G., Barkhutova D.D., Namsaraev B.B. Organotrophic bacteria of the Baikal Rift Zone hot springs // Microbiology (Moscow). 2016. V. 85. P. 367–378.
Хлыстов О.М., Минами Х., Хачикубо А., Ямашита С., Де Батист М., Наудс Л., Хабуев А.В., Ченский А.Г., Губин Н.А., Воробьева С.С. Возраст грязевой брекчии грязевых вулканов Академического хребта озера Байкал // Геодинамика и тектонофизика. 2017. Т. 8. № 4. С. 923–932.
Khlystov O.M., Minami H., Hachikubo A., Yamashita S., De Batist M., Nauds L., Khabuev A.V., Chenskiy A.G., Gubin N.A., Vorobyeva S.S. Age of mud breccia from mud volcanoes in Academician Ridge, Lake Baikal // Geodyn. Tectonophys. 2017. V. 8. P. 923–932.
Черницына С.М., Мамаева Е.В., Ломакина А.В., Погодаева Т.В., Галачьянц Ю.П., Букин С.В., Пименов Н.В., Хлыстов О.М., Земская Т.И. Филогенетическое разнообразие микробных сообществ в донных отложениях Посольской банки, оз. Байкал // Микробиология. 2016. Т. 85. № 6. С. 652–662.
Chernitsyna S.M., Mamaeva E.V., Lomakina A.V., Pogodaeva T.V., Galach’yants Yu.P., Bukin S.V., Pimenov N.V., Khlystov O.M., Zemskaya T.I. Phylogenetic diversity of microbial communities of the Posolsk Bank bottom sediments, Lake Baikal // Microbiology (Moscow). 2016. V. 85. P. 672–680.
Bonch-Osmolovskaya E.A. Metabolic diversity of thermophilic prokaryotes – what’s new? // Extremophiles: Microbiology and Biotechnology / Ed. Anitori R. Beaverton: Horizon Press, 2012. P. 109–130.
Chakraborty A., Ellefson E., Li C., Gittins D., Brooks J.M., Bernard B.B., Hubert C.R.J. Thermophilic endospores associated with migrated thermogenic hydrocarbons in deep Gulf of Mexico marine sediments // ISME J. 2018. V. 12. P. 1895–1906.
Cuylaerts M., Naudts L., Casier R., Khabuev A.V., Belousov O.V., Kononov E.E., Khlystov O., De Batist M. Distribution and morphology of mud volcanoes and other fluid flow-related lake-bed structures in Lake Baikal, Russia // Geo-Mar. Lett. 2012. V. 32. P. 383–394.
De Rezende J.R., Kjeldsen K.U., Hubert C.R.J., Finster K., Loy A., Jørgensen B.B. Dispersal of thermophilic Desulfotomaculum endospores into Baltic Sea sediments over thousands of years // ISME J. 2013. V. 7. P. 72–84.
Fardeau M.-L., Barsotti V., Cayol J.-L., Guasco S., Michotey V., Joseph M., Bonin P., Ollivier B. Caldinitratiruptor microaerophilus, gen. nov., sp. nov. isolated from a French hot spring (Chaudes-Aigues, Massif Central): a novel cultivated facultative microaerophilic anaerobic thermophile pertaining to the Symbiobacterium branch within the Firmicutes // Extremophiles. 2010. V. 14. P. 241–247.
Han C., Gu W., Zhang X., Lapidus A., Nolan M., Copeland A., Lucas S., Del Rio T.G., Tice H., Cheng J.F., Tapia R., Goodwin L., Pitluck S., Pagani I., Ivanova N., Mavromatis K., Mikhailova N., Pati A., Chen A., Palaniappan K., Land M., Hauser L., Chang Y.-J., Jeffries C.D., Schneider S., Rohde M., Göker M., Pukall R., Woyke T., Bristow J., Eisen J.A., Markowitz V., Hugenholtz P., Kyrpides N.C., Klenk H.-P., Detter J.C. Complete genome sequence of Thermaerobacter marianensis type strain (7p75a) // Stand. Genom. Sci. 2010. V. 3. P. 337–345.
Hubert C., Loy A., Nickel M., Arnosti C., Baranyi C., Brüchert V., Ferdelman T., Finster K., Christensen F.M., De Rezende J.R., Vandieken V., Jørgensen B.B. A constant flux of diverse thermophilic bacteria into the cold Arctic seabed // Science. 2009. V. 325. P. 1541–1544.
Hubert C., Arnosti C., Brüchert V., Loy A., VandiekenV., Jørgensen B.B. Thermophilic anaerobes in Arctic marine sediments induced to mineralize complex organic matter at high temperature // Environ. Microbiol. 2010. V. 12. P. 1089–1104.
Isaksen M.F., Bak F., Jørgensen B.B. Thermophilic sulfate-reducing bacteria in cold marine sediment // FEMS Microbiol. Ecol. 1994. V. 14. P. 1–8.
Khlystov O.M., De Batist M., Shoji H., Hachikubo A., Nishio S., Naudt, L. Gas hydrate of Lake Baikal: discovery and varieties // J. Asian. Earth Sci. 2013. V. 62. P. 162–166.
Klerkx J., De Batist M., Poor J., Hus R., VanRensbergen P., Khlystov O.M., Granin N. Tectonically controlled methane escape in Lake Baikal. Advances in the geological storage of carbon dioxide // NATO Sci. Ser. IV. Earth Environ. Sci. 2006. V. 65. P. 203–219.
Kovaleva O.L., Merkel A.Y., Novikov A.A., Baslerov R.V., Toshchakov S.V., Bonch-Osmolovskaya E.A. Tepidisphaera mucosa gen. nov., sp. nov., a moderately thermophilic member of the class Phycisphaerae in the phylum Planctomycetes, and proposal of a new family, Tepidisphaeraceae fam. nov., and a new order, Tepidisphaerales ord. nov. // Int. J. Syst. Evol. Microbiol. 2015. V. 65. P. 549–555.
Kozhov M. Geography and hydrology of Baikal // Lake Baikal and Its Life. Monographiae Biologicae. Springer: Dordrecht, 1963. V. 11. P. 5–55.
Lane D.J. 16S/23S rRNA sequencing // Nucleic Acid Techniques in Bacterial Systematics / Eds. Stackebrandt E., Goodfellow M. New York: John Wiley & Sons, 1991. P. 115–175.
Lebedeva E.V., Of S., Zumbragel S., Kruse M., Shagzhina A., Lücker S., Maixner F., Lipski A., Daims H., Spieck E. Isolation and characterization of a moderately thermophilic nitrite-oxidizing bacterium from a geothermal spring // FEMS Microbiol. Ecol. 2010. V. 75. P. 195–204.
Müller A.L., De Rezende J.R., Hubert C.R.J., Kjeldsen K.U., Lagkouvardos I., Berry D., Jørgensen B.B., Loy A. Endospores of thermophilic bacteria as tracers of microbial dispersal by ocean currents // ISME J. 2014. V. 8. P. 1153–1165.
Naudts L., Khlystov O., Granin N., Chensky A., Poort J., De Batist M. Stratigraphic and structural control on the distribution of gas hydrates and active gas seeps on the Posolsky Bank, Lake Baikal // Geo-Mar. Lett. 2012. V. 32. P. 395–406.
Pogodaeva T.V., Lopatina I.N., Khlystov O.M., Egorov A.V., Zemskaya T.I. Background composition of pore waters in Lake Baikal bottom sediments // J. Great Lakes Res. 2017. V. 43. P. 1030–1043.
Poort J., Khlystov O.M., Naudts L., Duchkov A.D., Shoji H., Nishio S., De Batist M., Hachikubo A., Kida M., Minami H., Manakov A.Y., Kulikova M.V., Krylov A.A. Thermal anomalies associated with shallow gas hydrates in the K-2 mud volcano, Lake Baikal // Geo-Mar. Lett. 2012. V. 32. P. 407–417.
Rozanov A.S., Bryanskaya A.V., Kotenko A.V., Peltek S.E. Draft genome sequence of Thermoactinomyces sp. Gus2-1 isolated from the hot-spring Gusikha in Bargusin Valley (Baikal Rift Zone, Russia) // Genomics Data. 2017. V. 11. P. 1–2. https://doi.org/https://doi.org/10.1016/j.gdata.2016.11.014.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning. A Laboratory Manual. New York: Cold Spring Harbor, 1989. V. 2. 545 p.
Sokolova T.G., Kostrikina N.A., Chernyh N.A., Kolganova T.V., Tourova T.P., Bonch-Osmolovskaya E.A. Thermincola carboxydiphila gen. nov., sp. nov., a novel anaerobic, carboxydotrophic, hydrogenogenic bacterium from a hot spring of the Lake Baikal area // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 2069–2073.
Spanevello M.D., Patel B.K.C. Thermaerobacter // Bergey’s Manual of Systematics of Archaea and Bacteria / Ed. Whitman W.B. 2015. https://doi.org/https://doi.org/10.1002/ 9781118960608.gbm00730.
Tamura K., Peterson D., Peterson N., Stecher G., Nei M., Kumar S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods // Mol. Biol. Evol. 2011. V. 28. P. 2731–2739.
Van Rensbergen P., De Batist M., Klerkx J., Hus R., Poort J., Vanneste M., Granin N., Khlystov O., Krinitsky P. Sublacustrine mud volcanoes and methane seeps caused by dissociation of gas hydrates in Lake Baikal // Geology. 2002. V. 30. P. 631–634.
Volpi M., Lomstein B.A, Sichert A., Roy H., Jorgensen Bo B., Kjeldsen K.U. Identity, abundance, and reactivation kinetics of thermophilic fermentative endospores in cold marine sediment and seawater // Front. Microbiol. 2017. V. 8. P. 131. https://doi.org/10.3389/fmicb.2017.00131
Yu Z., Wu C., Yang G.Q., Zhou S.G. Planifilum caeni sp. nov., a novel member of Thermoactinomycete isolated from sludge compost // Curr. Microbiol. 2015. V. 70. P. 135–140.
Дополнительные материалы отсутствуют.


