Микробиология, 2019, T. 88, № 3, стр. 288-296
Новый подход к выявлению защитной роли Esherichia coli в отношении грамположительных бактерий при действии антибиотиков на бинарные биопленки
В. К. Плакунов a, *, Ю. А. Николаев a, А. В. Ганнесен a, Д. С. Чемаева a, М. В. Журина a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук, Институт микробиологии им. С.Н. Виноградского
119071 Москва, Россия
* E-mail: plakunov@inmi.ru
Поступила в редакцию 03.12.2018
После доработки 10.01.2019
Принята к публикации 01.02.2019
Аннотация
Получены бинарные биопленки, включающие грамположительные бактерии Micrococcus thailandicus НВ и Kocuria rhizophila штамм 4А-2Ж, а также грамотрицательные бактерии Escherichia coli К-12 и штамм ET12567 pRAG56, содержащий в составе плазмиды фермент аминогликозидфосфотрансферазу, инактивирующую канамицин. Разработан новый кинетический метод избирательного выявления метаболически активных грамположительных бактерий в составе бинарных биопленок с E. coli, основанный на различиях в скорости восстановления акцептора электронов 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромида (МТТ). Установлено, что изученные штаммы E. coli не оказывали защитного эффекта при действии антибиотиков ванкомицина и оксациллина на грамположительные бактерии в составе формирующихся бинарных биопленок. Однако защитный эффект обнаружен в случае предформированных бинарных биопленок: рост грамположительных бактерий в бинарных биопленках наблюдался при тех концентрациях антибиотиков оксациллина и канамицина, при которых этот рост практически полностью подавлен в моновидовых биопленках данных бактерий. Наличие защитного эффекта подтверждено несколькими методами (динамика восстановления МТТ, денситометрическая оценка окрашивания биопленок, измерение оптической плотности экстрактов МТТ, подсчет числа КОЕ).
Управление формированием микробных биопленок представляет собой важнейшее направление исследований этих сообществ, включающее не только борьбу с “вредными” биопленками микроорганизмов, вызывающих инфекционные болезни, а также биокоррозию технологических материалов, но и стимуляцию формирования “полезных” биопленок, актуальную для биотехнологических процессов. Комплекс этих проблем рассмотрен в нашем недавнем обзоре (Плакунов и соавт., 2017). Отсутствие серьезных успехов в борьбе с формированием биопленок, в первую очередь, объясняется тем, что в природных и искусственных экосистемах биопленки представляют собой мультивидовые сообщества (Ножевникова и соавт., 2015), тогда как поиск антибиопленочных агентов (в том числе антибиотиков) ведется, как правило, с использованием моновидовых вариантов. В результате антибиопленочные агенты, подобранные в опытах in vitro, во многих случаях оказываются неэффективными при испытаниях in vivo. Это объясняется более высокой устойчивостью микроорганизмов в мультивидовых биопленках к биоцидам (и стрессовым факторам) по сравнению с моновидовыми аналогами (Стрелкова и соавт., 2013). Данное явление обнаружено давно, однако механизмы этой устойчивости практически не изучены (Leriche et al., 2003; Burmølle et al., 2006; Lopes et al., 2012; Lee et al., 2014; Sanchez-Vizuete et al., 2015). Теоретически устойчивость к биоцидам может быть обусловлена двумя основными причинами: во-первых, созданием барьера для диффузии биоцида внутрь биопленки за счет компонентов внеклеточного полимерного матрикса (ВПМ), образуемого одним или несколькими членами биопленочного сообщества, и, во-вторых, инактивацией биоцида одним или несколькими микроорганизмами, входящими в состав биопленочного сообщества (рис. 1).
Рис. 1.
Схема основных механизмов защиты микроорганизмов от действия антибиотиков в мультивидовых биопленках (на примере грамотрицательной E. coli и грамположительного S. aureus): 1 ‒ создание барьера ВПМ для диффузии антибиотиков в биопленку, благодаря которому антибиотик не проникает внутрь биопленки, либо проникает, но не достигает клеток; 2 ‒ инактивация антибиотиков под воздействием модифицирующих ферментов грамотрицательных бактерий.
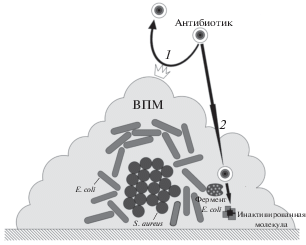
Цель данной работы – изучение механизмов защитного эффекта в бинарных биопленках, проявляемого менее чувствительной к антибиотикам грамотрицательной бактерией Esherichia coli в отношении более чувствительных грамположительных бактерий.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Использованные бактерии. В качестве чувствительных к антибиотикам микроорганизмов использовали грамположительные бактерии: Kocuria rhizophila 4А-2Ж, изолированную из пластовых вод Ромашкинского нефтяного месторождения, т.е. экотопа, где она, как можно полагать, не контактировала с антибиотиками, а также Micrococcus thailandicus НВ, изолированный из загрязненной нефтепродуктами почвы. В качестве менее чувствительных к антибиотикам микроорганизмов нами проверены грамотрицательные бактерии – модели условно патогенных бактерий из коллекции лаборатории нефтяной микробиологии Института микробиологии ФИЦ Биотехнологии РАН: Pseudomonas aeruginosa РАО1; 2 штамма Escherichia coli ‒ К-12 и штамм ET12567 pRAG56, содержащий в составе плазмиды фермент аминогликозидфосфотрансферазу, инактивирующую канамицин; Pseudomonas chlororaphis 449, Chromobacterium violaceum ATCC 31532 (штамм WT). Бактерии хранили при температуре 4–5°С (кроме C. violaceum, которую хранили при комнатной температуре) на столбиках (5 мл) полужидкой среды LB (“Sigma”) под вазелиновым маслом. В качестве инокулята в опытах с биопленками использовали 24 ч культуры, выращенные в жидкой среде LB на качалке (150 об./мин) при 30°С, как указано в предыдущих работах (Мартьянов и соавт., 2015; Ганнесен и соавт., 2015).
Получение генно-инженерного штамма E. coli. Dam-негативный штамм-аналог штамма E. coli ET12567 с генотипом ara-4,leuB6,fhuA31,lacY1,tsx78, glnV44,galK2,galT22,mcrA,dcm-6,hisG4,rfbD1.R (zgb210:: Tn10) TetS,endA1,rspL136 (StrR)dam13::Tn9 (CamR) xylA-5,mtl-1,thi-1,mcrB1,hsdR2 (New England Biolabs ®) был приобретен в виде замороженной биомассы компетентных к трансформации клеток (каталожный номер C2925I на сайте https://international.neb.com). Биомассу хранили при ‒80°С. Плазмида pRAG56, содержащая гены аминогликозидфосфотрансферазы, зеленого и красного флуоресцирующих белков, была взята из коллекции Лаборатории микробиологии, сигналов и микроокружения LMSM EA4312 Университета Руана, Франция. Трансформацию производили методом теплового шока по протоколу производителя (https://international.neb.com/products/ c2925-dam-dcm-competent-e-coli). Трансформированный штамм хранили при ‒80°С. Для работы клетки из условий с температурой ‒80°С переносили на жидкую среду LB, содержавшую 200 мкг/мл канамицина и инкубировали 24 ч при 37°С. Затем на чашках Петри с агаризованной средой LB с той же концентрацией канамицина получали отдельные колонии, которые использовали в работе для получения культур.
Получение и изучение биопленок. С целью предварительного подбора оптимального сочетания микроорганизмов в бинарных биопленках использовали метод формирования биопленок-колоний (Si et al., 2016). Для получения моновидовых биопленок на поверхность плотной питательной среды LB наносили по 20 мкл суспензий 24 ч культур, разбавленных жидкой питательной средой LB до условной (светопоглощение + светорассеяние) оптической плотности (ОП), равной 1.0 при 540 нм. Для получения бинарных биопленок в стерильных пробирках предварительно смешивали разбавленные суспензии (ОП = 2.0) в соотношении 1 : 1 и наносили на поверхность среды также в количестве 20 мкл. После нанесения культур чашки Петри инкубировали 48 ч при 30°С и оценивали рост бактерий визуально, а также путем высева из бинарных биопленок-колоний на плотную среду LB. В контрольных экспериментах мы показали, что двукратное увеличение плотности популяции бактерий в посевном материале (возникающее при формировании бинарных биопленок) не влияет на чувствительность к используемым антибиотикам планктонных культур исследуемых бактерий в жидкой среде LB и их моновидовых биопленок, выращиваемых на фильтрах из стекловолокна (Плакунов и соавт., 2016).
Определение метаболически активных бактерий в биопленках. Для количественного определения жизнеспособных бактерий в моновидовых и бинарных биопленках использовали разработанный нами метод с применением фильтров из стекловолокна (Whatman GF/F, диаметр пор 0.6–0.8 мкм) размером 2.5 × 2.5 см (Плакунов и соавт., 2016).
В случае изучения действия антибиотиков на биопленки, находящиеся в стадии формирования, по 50 мкл суспензий моновидовых и бинарных культур, разведенных как описано в предыдущем разделе, наносили на фильтры, помещенные на поверхность плотной среды LB без добавок (контроль), а также на фильтры, помещенные на поверхность плотной среды LB, содержащей разные концентрации исследуемых антибиотиков. Чашки c фильтрами инкубировали 24 ч при 30°С. Для оценки количества метаболически активных бактерий в биопленках, каждый фильтр пинцетом снимали с поверхности плотной среды и инкубировали в 5 мл 0.1% раствора МТТ в LB в темноте при 30°С до полного проявления окрашивания (30‒60 мин). Оптимальное время окрашивания устанавливали путем экстракции образовавшегося формазана диметилсульфоксидом (ДМСО) и измерения ОП экстракта в динамике процесса окрашивания. Каждый фильтр помещали в пробирку с 3 мл ДМСО квалификации “х. ч.” и выдерживали в темноте при комнатной температуре до полной экстракции образовавшегося формазана. Оптическую плотность раствора формазана измеряли при 595 нм на фотоколориметре КФК-2МП.
В случае изучения действия антибиотиков на предформированные биопленки фильтры с нанесенными суспензиями разбавленных (как в предыдущем случае) культур сначала помещали на поверхность чашек с плотной средой LB без антибиотика, инкубировали 5‒6 ч при 30°С (или 24 ч при комнатной температуре, 24‒25°C) для предформирования биопленок (Стрелкова и соавт., 2012), а затем переносили фильтры на чашки с исследуемыми концентрациями антибиотиков (контрольная чашка антибиотика не содержала) и инкубировали еще 24 ч при 30°С. Окрашивание фильтров проводили как в предыдущем случае.
Новый кинетический метод выявления защитного действия. Как мы установили, скорость восстановления МТТ изучаемыми грамположительными бактериями заметно выше, чем скорость его восстановления штаммами E. coli. Поэтому измерение краткосрочной динамики восстановления МТТ может быть использовано для преимущественного выявления метаболически активных (жизнеспособных) клеток грамположительных бактерий в составе бинарных биопленок, содержащих E. coli. С этой целью после инкубации с антибиотиками (как в предыдущем разделе методики) фильтры обрабатывали в течение 10 с 0.01% раствором МТТ (т.е. разбавленным в 10 раз по сравнению со стандартной методикой) и помещали на фильтровальную бумагу. Процесс развития окраски фиксировали видеокамерой в течение нескольких минут, фотографии использовали для денситометрической оценки скорости восстановления МТТ. При наличии защитного эффекта скорость окрашивания в бинарной биопленке превышала суммарную скорость окрашивания моновидовых биопленок (поскольку в моновидовых биопленках рост грамположительных бактерий при использованных концентрациях антибиотиков был сильно подавлен). Фильтры быстро промывали дистиллированной водой и помещали в ДМСО для экстракции. Дальнейшие измерения проводили, как в стандартных экспериментах.
Определение числа КОЕ. Для определения КОЕ использовали разработанную в лаборатории методику (Плакунов и соавт., 2016). С этой целью фильтры с выращенными биопленками стерильно диспергировали стеклянной палочкой в 10 мл 1% раствора NaCl и подвергали интенсивному встряхиванию на смесителе Vortex-ZX3. После оседания фрагментов фильтра готовили 10-кратные разведения в стерильном 1% растворе NaCl и высевали по 50 мкл на чашки Петри со средой LA. Пробы инкубировали 48 ч при 30°С, после чего подсчитывали число колоний.
Статистическая обработка результатов. Статистическую обработку результатов проводили с использованием программного пакета OriginLab 8.6. Поскольку тест на нормальность закона варьирования данных в наших экспериментах дал отрицательный результат, для оценки достоверности различий применяли непараметрический U-критерий Манна–Уитни–Вилкоксона при р < 0.05. Для графического отображения полученных закономерностей использовали алгоритм выбора типичного эксперимента (Paulson, 2008). Выравнивание графиков производили с помощью функции В-spline.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Подбор микроорганизмов для формирования бинарных биопленок. Путем высевов на плотную среду LB было установлено, что в условиях наших экспериментов использованные грамположительные бактерии практически не выживают в бинарных биопленках-колониях в процессе их формирования совместно с бактериями рода Pseudomonas, а также с C. violaceum, вероятно, из-за воздействия образуемых этими грамотрицательными партнерами антибактериальных веществ (феназинов и виолацеина). Хотя в природных условиях при низких плотностях микробных популяций выживание грамположительных бактерий в таких сочетаниях с грамотрицательными бактериями вполне возможно (Yang et al., 2011), для количественных лабораторных опытов использование популяций с низкой плотностью методически непригодно. Наилучшими партнерами в наших экспериментах оказались штаммы E. coli, не вызывающие подавления роста изучаемых грамположительных бактерий. Поэтому в дальнейших исследованиях именно они были использованы для получения бинарных биопленок с грамположительными бактериями. Один из типичных примеров с пигментированной культурой K. rhizophila 4А-2Ж приведен на рис. 1S. Аналогичная ситуация (доказанная путем высевов на плотную среду LB) характерна для M. thailandicus НВ (не показано).
Действие антибиотиков на формирующиеся биопленки. Известно, что микробные биопленки в стадии формирования наиболее чувствительны к биоцидам (Стрелкова и соавт., 2012; Плакунов и соавт., 2017). Поэтому для разработки стратегии борьбы с биопленками важно установить, может ли защитный эффект E. coli проявляться на начальных этапах формирования бинарных биопленок. С этой целью биопленки-колонии формировали на плотной среде, содержащей антибиотик в концентрации, практически полностью подавляющей рост планктонных культур изучаемых грамположительных бактерий.
В предварительных опытах с колониями-биопленками в стадии формирования антибиотик ванкомицин в концентрации 10 мкг/мл полностью подавлял рост моновидовой биопленки K. rhizophila, но существенно не влиял на рост моновидовой биопленки E. coli. Высевы на плотную среду LB, как из зоны, соответствующей моновидовой биопленке, так и из зоны бинарной биопленки не позволили обнаружить жизнеспособные клетки K. rhizophila 4А-2Ж. По такой же схеме были проведены эксперименты с оксациллином (5 мкг/мл). И в этом случае высевы из зоны, соответствующей моновидовой и бинарной колонии-биопленке не позволили обнаружить наличие жизнеспособных клеток K. rhizophila 4А-2Ж. Таким образом, результатов, которые бы свидетельствовали о наличии защитного эффекта в экспериментах с формирующимися биопленками получено не было.
Действие антибиотиков на предформированные биопленки. Отсутствие защитного эффекта в случае формирующихся биопленок могло быть связано с тем, что проявление ингибиторного действия антибиотиков опережает формирование бинарной биопленки. Поэтому в дальнейших экспериментах мы осуществляли предформирование бинарных биопленок на фильтрах, помещенных на плотную среду LB без антибиотика, а затем переносили эти биопленки на среду LB, содержащую разные концентрации изучаемого антибиотика. В первой серии экспериментов для формирования моновидовых и бинарных биопленок в качестве грамположительного и грамотрицательного партнеров использовали, соответственно, M. thailandicus НВ и E. coli ET12567 pRAG56. В качестве антибиотика использовали канамицин, поскольку данный штамм E. coli устойчив к этому антибиотику. В этих экспериментах высевы на плотную среду из моновидовых и бинарных биопленок обнаруживали некоторый рост Micrococcus thailandicus НВ при всех использованных в опытах с биопленками концентрациях канамицина (до 100 мкг/мл). Рост планктонной культуры грамположительного партнера полностью подавлялся при концентрации антибиотика 0.5‒1 мкг/мл.
Качественно присутствие метаболически активных клеток на фильтрах оценивали кинетически по скорости окрашивания МТТ. Как показано нами в контрольных (без антибиотиков) экспериментах, клетки использованных грамположительных бактерий обладают значительно более высокой скоростью восстановления этого акцептора электронов по сравнению с клетками E. coli. На рис. 2 представлены результаты на примере M. thailandicus НВ и E. coli ET12567 pRAG56.
Рис. 2.
Сравнение динамики восстановления 0.01% раствора МТТ моновидовыми и бинарной предформированными биопленками. 1 ‒ моновидовая биопленка E. coli ET12567 pRAG56; 2 ‒ моновидовая биопленка M. thailandicus НВ; 3 ‒ бинарная биопленка данных бактерий.
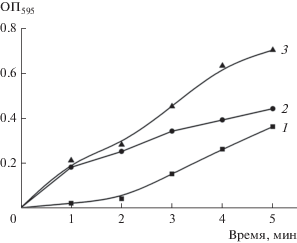
Как следует из данных, приведенных на рис. 2, наибольшие различия в скоростях восстановления МТТ наблюдаются через 1‒3 мин инкубации, поэтому для выявления защитного эффекта в бинарных биопленках был выбран период инкубации, равный 2 мин (т.е. в середине этого интервала). В отсутствие антибиотиков скорость восстановления МТТ в бинарной биопленке должна быть равна сумме скоростей восстановления МТТ в моновидовых биопленках (в реальных экспериментах суммарная скорость несколько ниже, вероятно, в связи с конкуренцией партнеров за акцептор). Наличие защитного эффекта в присутствии антибиотика должно проявляться в накоплении в составе бинарной биопленки большего количества жизнеспособных клеток грамположительного партнера, по сравнению с моновидовой биопленкой, а, следовательно, скорость восстановления МТТ в бинарной биопленке в этом случае должна быть выше суммы скоростей восстановления МТТ в моновидовых биопленках. Эксперименты показали, что данный эффект действительно имеет место (рис. 2S).
Можно видеть, что в бинарной биопленке восстановление МТТ протекает со скоростью, характерной для грамположительного микроорганизма M. thailandicus НВ, значительно превышающей скорость восстановления МТТ в моновидовой его биопленке. Это указывает на более высокое содержание жизнеспособных клеток M. thailandicus НВ в бинарной биопленке по сравнению с моновидовой.
Для количественной оценки защитного эффекта в кратковременных экспериментах проведено денситометрическое определение интенсивности восстановления МТТ. Результаты представлены на рис. 3. По данным денситометрии, оптическая плотность (измеряемая как “яркость”) окрашивания бинарной биопленки в 1.4 раза (по площади пика) превышает суммарную оптическую плотность окраски моновидовых биопленок. Поскольку окрашивание МТТ характеризует, в первую очередь, количество жизнеспособных клеток грамположительной бактерии M. thailandicus НВ, полученные результаты свидетельствуют о наличии значительного защитного эффекта, оказываемого грамотрицательной бактерией E. coli ET12567 pRAG56 в отношении грамположительной бактерии M. thailandicus НВ, предохраняющей последнюю от ингибиторного действия канамицина.
Рис. 3.
Метаболическая активность бактерий (в присутствии 25 мкг/мл канамицина), измеренная денситометрически на фильтрах, представленных на рис. 2S. 1 ‒ моновидовая биопленка M. thailandicus НВ (площадь пика 820 126 пикселей); 2 ‒ бинарная биопленка M. thailandicus НВ + E. coli ET12567 pRAG56 (площадь пика 2041 954 пикселей); 3 ‒ моновидовая биопленка E. coli ET12567 pRAG56 (площадь пика 620 941 пикселей).
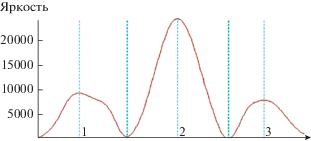
Для оценки величины защитного эффекта в длительных экспериментах измеряли оптическую плотность (при 595 нм) экстракта формазана после восстановления 0.1% МТТ, извлеченного с фильтров с предформированными биопленками. Исходные биопленки были предформированы 24 ч при комнатной температуре, контрольные (без канамицина), а также биопленки в присутствии канамицина ‒ инкубированы еще 24 ч при 30°С (рис. 4).
Рис. 4.
Метаболическая активность бактерий при действии канамицина на моновидовые и бинарную предформированные биопленки (по оси Y указана оптическая плотность экстракта формазана при 595 нм). А ‒ моновидовая биопленка M. thailandicus НВ; Б ‒ моновидовая биопленка E. coli ET12567 pRAG56; В ‒ бинарная биопленка M. thailandicus НВ + E. coli ET12567 pRAG56. 1 ‒ исходная биопленка; 2 ‒ контроль без канамицина; 3‒5 ‒ в присутствии канамицина (3 – 25 мкг/мл; 4 – 50 мкг/мл; 5 – 100 мкг/мл).
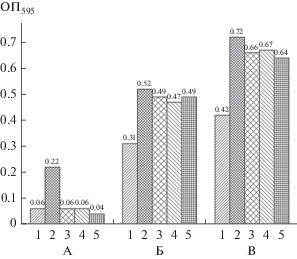
Результаты, представленные на рис. 4, показывают, что оптическая плотность экстрактов формазана в бинарной биопленке превышает сумму оптических плотностей экстрактов, полученных из моновидовых биопленок. Поскольку образование формазана является индикатором наличия жизнеспособных бактерий, а культура E. coli ET12567 pRAG56 нечувствительна к канамицину, избыточное количество формазана свидетельствует о том, что в бинарной биопленке присутствует больше жизнеспособных клеток культуры M. thailandicus НВ, чем при тех же концентрациях канамицина в моновидовой биопленке данной культуры. Эти результаты коррелируют с результатами, полученными кинетическим методом, и подтверждают вывод о том, что в бинарной биопленке проявляется защитный от действия канамицина эффект грамотрицательной культуры E. coli ET12567 pRAG56 на грамположительную культуру M. thailandicus НВ. Этот вывод подтвержден определением числа КОЕ после диспергирования (рис. 5 и 3S).
Рис 5.
Число КОЕ в моновидовых (А, В) и бинарной (Б, Г) предформированных биопленках M. thailandicus НВ (А, Б) и E. coli ET12567 pRAG56 (В, Г). 1 – исходная биопленка; 2 – контроль без канамицина; 3‒5 – в присутствии канамицина (3 ‒ 25 мкг/мл; 4 – 50 мкг/мл; 5 – 100 мкг/мл).
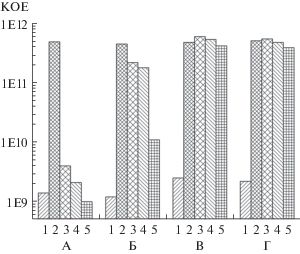
Можно видеть, что количество жизнеспособных клеток M. thailandicus НВ в бинарной биопленке приблизительно на 2 порядка превышает количество жизнеспособных клеток в моновидовой биопленке, что свидетельствует о наличии защитного эффекта со стороны E. coli ET12567 pRAG56.
Для проверки, не связан ли защитный эффект со спецификой антибиотика и использованных бактерий, мы проверили другой антибиотик – оксациллин, а также другую пару микроорганизмов: грамположительный K. rhizophila 4А-2Ж и грамотрицательный E. coli К-12, обладающий природной устойчивостью к оксациллину.
Постановку эксперимента осуществляли по той же схеме. Количество метаболически активных клеток на фильтрах оценивали кинетически по скорости окрашивания МТТ (рис. 4S).
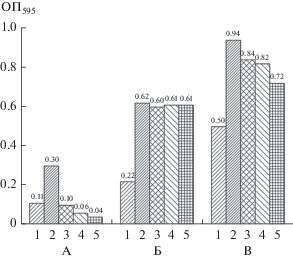
Данные по оптической плотности (измеряемой как “яркость”) окраски фильтров, представленные на рис. 6, показывают, что в бинарной биопленке количество формазана в 1.65 (по площади пика) выше, чем в сумме моновидовых биопленок. Таким образом, в данном эксперименте обнаружен заметный защитный эффект в отношении K. rhizophila 4А-4Ж, проявляемый в бинарной биопленке со стороны E. coli K-12. Следует отметить, что аналогичный по величине защитный эффект обнаружен нами и при более низких концентрациях оксациллина (5 и 10 мкг/мл), причем во всех этих случаях рост E. coli K-12 в моновидовых ее биопленках не зависел от присутствия оксациллина. Для альтернативной количественной оценки содержания метаболически активных клеток формазан экстрагировали и измеряли оптическую плотность экстрактов (рис. 7).
Рис. 6.
Количество метаболически активных клеток, измеренное денситометрически на фильтрах, представленных на рис. 4S. 1 ‒ моновидовая биопленка K. rhizophila 4А-2Ж (площадь пика 954 901 пикселей); 2 ‒ бинарная биопленка K. rhizophila 4А-2Ж + E. coli K-12 (площадь пика 3117 775 пикселей); 3 ‒ моновидовая биопленка E. coli K-12 (площадь пика 930 690 пикселей).
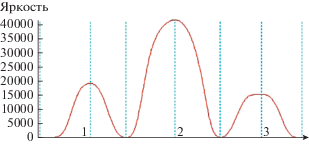
Рис. 7.
Метаболическая активность бактерий при действии канамицина на моновидовые и бинарную предформированные биопленки (указана оптическая плотность экстракта формазана при 595 нм). А ‒ моновидовая биопленка K. rhizophila 4А-2Ж; Б ‒ моновидовая биопленка E. coli K-12; В ‒ бинарная биопленка K. rhizophila 4А-2Ж + E. coli K-12. 1 ‒ исходная биопленка; 2 ‒ контроль без оксациллина; 3‒5 – в присутствии оксациллина (3 – 5 мкг/мл; 4 – 10 мкг/мл; 5 – 25 мкг/мл).
Данные, приведенные на рис. 7, показывают, что оптическая плотность экстрактов формазана в бинарной биопленке превышает сумму оптических плотностей экстрактов, полученных из моновидовых биопленок так же, как и в предыдущем случае (рис. 4). Это превышение является статистически достоверным, хотя оно имеет меньший масштаб, чем в ранее изученной паре партнеров.
Наличие защитного эффекта подтверждено определением числа КОЕ после диспергирования предформированных и инкубированных в присутствии оксациллина моновидовых и бинарной биопленок изучаемых бактерий. Данные представлены на рис. 5S.
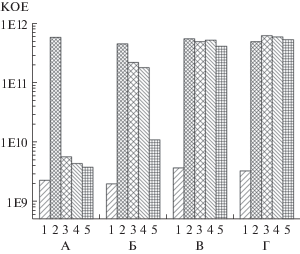
Благодаря различной окраске колоний изучаемых бактерий, наличие повышенного содержания клеток K. rhizophila 4А-2Ж в бинарной биопленке заметно уже визуально. Количественая оценка числа КОЕ приведена на рис. 8. Результаты подсчета КОЕ показывают, что в бинарной биопленке число жизнеспособных клеток K. rhizophila 4А-2Ж более чем на порядок превышает их число в моновидовой биопленке, что свидетельствует о проявлении защитного эффекта E. coli K-12. Хотя определение КОЕ в случае биопленок связано с методическими трудностями из-за возможности неполного диспергирования ВПМ и формирования микроколоний из агрегатов клеток, тем не менее, корреляция данных оценки количества жизнеспособных клеток в биопленках по реакции с МТТ с подсчетом КОЕ свидетельствует о достоверности полученных результатов.
Рис. 8.
Число КОЕ в моновидовых (А, В) и бинарной (Б, Г) предформированных биопленках K. rhizophila 4А-2Ж (А, Б) и E. coli К-12 (В, Г). 1 – исходная биопленка; 2 – контроль без оксациллина; 3‒5 – в присутствии оксациллина (3 ‒ 5 мкг/мл; 4 – 10 мкг/мл; 5 – 25 мкг/мл).
Подводя итог, можно утверждать, что новый, предложенный нами кинетический метод, основанный на восстановлении МТТ метаболически активными клетками микроорганизмов, позволяет просто и надежно выявить наличие защитного эффекта против действия использованных антибиотиков, оказываемого грамотрицательными бактериями E. coli в отношении изученных грамположительных бактерий. Качественная визуальная оценка защитного эффекта полностью коррелирует с его количественным измерением методами денситометрии, спектрофотометрии и определения числа КОЕ.
Для механизма этого явления можно предложить несколько гипотез. Прежде всего, необходимо отметить, что защитный эффект в бинарных биопленках нельзя объяснить простым суммированием плотности популяций и толщины ВПМ двух комбинируемых микроорганизмов, поскольку для синтеза ВПМ грамположительной бактерией необходим ее рост при использованных концентрациях антибиотиков, при которых этот рост в моновидовой биопленке подавлен почти полностью. И, как мы уже упоминали, само по себе двукратное увеличение плотности исходной популяции при формировании биопленки на чувствительность бактерий к данным антибиотикам практически не влияет.
Нами использованы два типа штаммов E. coli: штамм К-12 с природной устойчивостью к оксациллину и штамм ET12567 pRAG56 с приобретенной устойчивостью к канамицину (наличие фермента, инактивирующего антибиотик). Устойчивость E. coli К-12 к оксациллину определяется тремя механизмами: барьером диффузии, формируемым наружной мембраной клетки, системой экскреции этого антибиотика, а также наличием β-лактамазы (Mazzariori et al., 2000). Первые два механизма не могут внести существенный вклад в защитный эффект в биопленках (в соответствии со схемой на рис. 1). Поскольку у штамма дикого типа E. coli К-12 активность β-лактамазы невелика (Normark et al., 1977), основную роль должен играть барьер диффузии, формируемый ВПМ биопленки E. coli. В случае штамма ET12567 pRAG56 определяющую роль, по-видимому, играет деградация антибиотика канамицина, хотя барьерная функция ВПМ также может вносить определенный вклад в защитный механизм.
Обнаруженный защитный эффект может объяснять малую эффективность антибиотикотерапии в случае заболеваний, вызываемых формированием мультивидовых биопленок либо самими патогенными микроорганизмами, либо патогенными микроорганизмами и их малочувствительными к антибиотикам сапротрофными спутниками.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена за счет средств Министерства науки и высшего образования Российской Федерации.
Список литературы
Ганнесен А.В., Журина М.В., Веселова М.А., Хмель И.А., Плакунов В.К. Регуляция процесса формирования биопленок Pseudomonas chlororaphis в системе in vitro // Микробиология. 2015. Т. 84. № 3. С. 281–290.
Gannesen A.V., Zhurina M.V., Veselova M.A., Khmel’ I.A., Plakunov V.K. Regulation of biofilm formation by Pseudomonas chlororaphis in an in vitro system // Microbiology (Moscow). 2015. V. 84. P. 319–327.
Мартьянов С.В., Журина М.В., Эль-Регистан Г.И., Плакунов В.К. Активирующее действие азитромицина на формирование бактериальных биопленок и борьба с этим явлением // Микробиология. 2015. Т. 84. № 1. С. 27‒36.
Mart’yanov S.V., Zhurina M.V., El’Registan G.I., Plakunov V.K. Activation and prevention of formation of bacterial biofilms by azithromycin // Microbiology (Moscow). 2014. V. 83. № 6. P. 723–731.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. Мультивидовые биопленки в экологии, медицине и биотехнологии // Микробиология. 2015. Т. 84. № 6. С. 623–644.
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. Multispecies biofilms in ecology, medicine, and biotechnology // Microbiology (Moscow). 2015. V. 84. P. 731–750.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Управление формированием микробных биопленок: анти- и пробиопленочные агенты (обзор) // Микробиология. 2017. Т. 86. № 4. С. 402‒420.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. Controlling of microbial biofilms formation: anti- and probiofilm agents // Microbiology (Moscow). 2017. V. 86. P. 423–438.
Стрелкова Е.А., Журина М.В., Плакунов В.К., Беляев С.С. Стимуляция антибиотиками процесса формирования бактериальных биопленок // Микробиология. 2012. Т. 81. № 2. С. 282–285.
Strelkova E.A., Zhurina M.V., Plakunov V.K., Belyaev S.S. Stimulation of biofilm formation by antibiotics // Microbiology (Moscow). 2012. V. 81. P. 259–262.
Burmølle M., Webb J.S., Rao D., Hansen L.H., Sørensen S.J., Kjelleberg S. Enhanced biofilm formation and increased resistance to antimicrobial agents and bacterial invasion are caused by synergistic interactions in multispecies biofilms // Appl. Environ. Microbiol. 2006. V. 72. P. 3916‒3923.
Lee K.W., Periasamy S., Mukherjee M., Xie C., Kjelleberg S., Rice S.A. Biofilm development and enhanced stress resistance of a model, mixed-species community biofilm // ISME J. 2014. V. 8. P. 894‒907.
Leriche V., Briandet R., Carpentier B. Ecology of mixed biofilms subjected daily to a chlorinated alkaline solution: spatial distribution of bacterial species suggests a protective effect of one species to another // Environ. Microbiol. 2003. V. 5. P. 64‒71.
Lopes S.P., Ceri H., Azevedo N.F., Pereira M.O. Antibiotic resistance of mixed biofilms in cystic fibrosis: impact of emerging microorganisms on treatment of infection // Int. J. Antimicrob. Agents. 2012. V. 40. P. 260–263.
Mazzariol A., Cornaglia G., Nikaido H. Contributions of the AmpC beta-lactamase and the AcrAB multidrug efflux system in intrinsic resistance of Escherichia coli K-12 to beta-lactams // Antimicrob. Agents Chemother. 2000. V. 44. P.1387–1390.
Normark S., Edlund T., Grundström T., Bergström S., Wolf-Watz H. Escherichia coli K-12 mutants hyperproducing chromosomal beta-lactamase by gene repetitions // J. Bacteriol. 1977. V. 132. P. 912–922.
Paulson D.S. Biostatistics and Microbiology. Springer Science + Business Media. LLS, USA, 2008. 216 p.
Sanchez-Vizuete P., Orgaz B., Aymerich S., Le Coq D., Briandet R. Pathogens protection against the action of disinfectants in multispecies biofilms // Front. Microbiol. 2015. V. 6. P. 705. https://doi.org/10.3389/fmicb.2015.0070
Si T., Li B., Zhang K., Xu Y., Zhao H., Sweedler J.V. Characterization of Bacillus subtilis colony biofilms via mass spectrometry and fluorescence imaging // J. Proteome Res. 2016. V. 15. P. 1955–1962.
Yang L., Liu Y., Wu H., Hóiby N., Molin S., Song Z.J. Current understanding of multi-species biofilms // Int. J. Oral. Sci. 2011. V. 3. P. 74–81.
Дополнительные материалы отсутствуют.


