Микробиология, 2019, T. 88, № 3, стр. 372-374
Новый способ детекции токсигенных цианобактерий на основе мультиплексной полимеразной цепной реакции
С. И. Сиделев *
Ярославский государственный университет им. П.Г. Демидова,
Региональный центр экологической безопасности водных ресурсов
150057 Ярославль, Россия
* E-mail: Sidelev@mail.ru
Поступила в редакцию 03.12.2018
После доработки 21.12.2018
Принята к публикации 01.02.2019
Массовое развитие цианобактерий в пресноводных водоемах всего мира вызывает ряд негативных последствий, среди которых наиболее опасным является отравление человека токсинами. Цианотоксины относятся к четырем группам веществ: гепатотоксины микроцистины (МС), гепато- и цитотоксин цилиндроспермопсин (CYN), а также нейротоксины: анатоксин-а (ANA) и сакситоксины (SXT). Идентификация токсигенных цианобактерий при экологическом мониторинге цветения водоемов является необходимым этапом при принятии решений, таких как изменения технологии обработки питьевой воды на водопроводных станциях или временный запрет рекреационного использования водоема. Микроскопическая идентификация токсичных цианобактерий в водоемах невозможна из-за присутствия морфологически идентичных токсигенных и нетоксигенных штаммов одного вида. Метод ПЦР позволяет решить эту проблему, так как эти штаммы отличаются лишь наличием или отсутствием кластера генов, кодирующих ферменты, ответственные за нерибосомальный синтез молекул внутриклеточных цианотоксинов. Метод позволяет диагностировать токсигенные цианобактерии в водоемах задолго до того, как содержание цианотоксинов превысит предельно допустимый уровень. На сегодняшний момент разработано несколько десятков праймеров, комплементарных к специфическим участкам генов биосинтеза разных типов цианотоксинов (Molecular Tools…, 2017). В одном и том же водоеме часто одновременно развиваются как гепато-, так и нейротоксигенные цианобактерии, поэтому разработка мультиплексной ПЦР для их детекции является актуальной задачей. В сообщении впервые предлагается способ одновременной идентификации гепато- и нейротоксигенных цианобактерий в пробах из природных водоемов.
Выделение ДНК из клеток токсигенных штаммов цианобактерий и природных проб осуществляли с помощью набора реагентов Diatom DNA Prep 200 (“Лаборатория “Изоген”, Россия) согласно инструкции фирмы-производителя. Выбор подходящих для целей данного исследования праймеров осуществляли исходя из сходства температур их плавления и максимальных различий в размерах образуемых ими ампликонов. В итоге, для мультиплексной ПЦР были отобраны четыре пары праймеров, специфичных к генам синтеза МС, CYN, ANA и SXT (табл. 1). Их специфичность и эффективность надежно доказана как на чистых культурах токсин-продуцирующих цианобактерий, так и на пробах из природных водоемов (Hisbergues et al., 2003; Ballot et al., 2010; Rantala-Ylinen et al., 2011; Baron-Sola et al., 2012). ПЦР проводили с использованием готовых реакционных смесей GenPak PCR Core (“Лаборатория “Изоген”, Россия) или Dream Taq PCR Master Mix (“Thermo Scientific”, США) с добавлением 1 мкл каждого из праймеров (10 пкмоль) и 2 мкл ДНК (исходные концентрации 10–87 нг/мкл) в объеме 50 мкл. Программа амплификации включала следующие этапы: предварительная денатурация ДНК при 95°С в течение 3 мин, затем 37 циклов амплификации – 95°С в течение 30 с, 58°С в течение 30 с и 72°С в течение 1 мин, последний этап – элонгация при 72°С в течение 10 мин. Продукты ПЦР детектировали методом электрофореза в 1.5% агарозном геле в УФ-свете после окрашивания бромистым этидием. Для разработки мультиплексной ПЦР использовали как ДНК токсин-продуцирующих штаммов цианобактерий, так и ДНК, изолированную из планктона природных водоемов, в которых ранее нами было установлено молекулярными и химическими методами присутствие продуцентов цианотоксинов (табл. 2). В работе использовали следующие токсигенные штаммы: МС-продуцирующий штамм Microcystis aeruginosa (PCC 7806) (предоставлен Э. Диттманн, Университет Потсдама), CYN-продуцирующий штамм Aphanizomenon sp. (10E9) и SXT-продуцирующий штамм Aphanizomenon sp. (AB59) (предоставлены Д. Фастнер, Федеральное Агентство Окружающей Среды, Берлин).
Таблица 1.
Характеристика праймеров
| Праймер | Ген-мишень | Последовательность
нуклеотидов праймера (5' → 3') |
Размер
ПЦР-продукта (п.н.) |
Температура отжига, °С | Ссылка |
|---|---|---|---|---|---|
| sxtaf | stxA | GCG-TAC-ATC-CAA-GCT-GGA-CTC-G | ~650 | 55 | Ballot et al., 2010 |
| sxtar | GTA-GTC-CAG-CTA-AGG-CAC-TTG-C | ||||
| CpbF2 | аоаB | CAC-CAT-TGG-CTA-TGT-AGA-AGC-T | 550 | 54 | Baron-Sola et al., 2012 |
| CpbR2 | TAT-TGG-CTG-TGA-AAG-AGA-GGT-C | ||||
| anaC-genF | anaC | TCT-GGT-ATT-CAG-TCC-CCT-CTA-T | 366 | 58 | Rantala-Ylinen et al., 2011 |
| anaC-genR | CCC-AAT-AGC-CTG-TCA-TCA-A | ||||
| mcyA-Cd 1F | mcyA | AAA-ATT-AAA-AGC-CGT-ATC-AAA | ~300 | 59 | Hisbergues et al., 2003 |
| mcyA-Cd 1R | AAA-AGT-GTT-TTA-TTA-GCG-GCT-CAT |
Таблица 2.
Список водоемов, из планктона которых была выделена ДНК для проведения мультиплексной ПЦР
| Водоем | Наличие гена в ДНК | Присутствие цианотоксина в пробе | Метод химического анализа |
Ссылка |
|---|---|---|---|---|
| Рыбинское водохранилище | sxtA | Сакситоксины | ELISA | Sidelev et al., 2016 |
| Оз. Неро | aoaB | Цилиндроспермопсин | LC/MS-MS | Babanazarova et al., 2015 |
| Цимлянское водохранилище | anaC | Анатоксин-а | LC/MS-MS | Sidelev et al., 2015 |
| Куршский залив | mcyA | Микроцистины | ELISA | Semenova et al., 2017 |
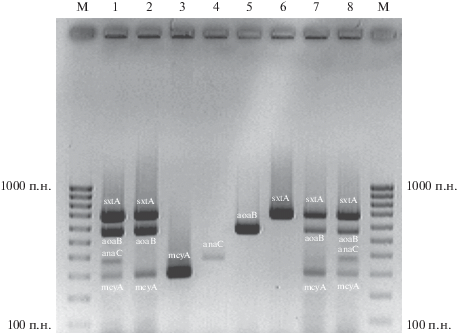
Полученные результаты исследования представлены на рис. 1. Отдельно проводились мультиплексные ПЦР с ДНК, выделенной из чистых культур цианобактерий (дорожки 1, 2) и планктона природных водоемов (дорожки 7, 8). Была проверена возможность одновременной амплификации в одной пробирке генов биосинтеза цианотоксинов с тремя (дорожки 2, 7) и четырьмя (дорожки 1, 8) парами праймеров. Во всех вариантах был получен положительный результат: на электрофореграмме видны четкие полосы, соответствующие специфическим участкам генов sxtA, aoaB, anaC и mcyA (рис. 1, дорожки 1, 2, 7, 8). Для сравнения приведены результаты амплификации этих же генов в отдельных ПЦР-пробирках (рис. 1, дорожки 3–6). Таким образом, разработан простой и удобный в использовании вариант одновременной детекции в природных пробах всех основных групп гепато- и нейротоксигенных цианобактерий на основе мультиплексной ПЦР. Полученные результаты могут использоваться для отечественных молекулярных тест-систем по идентификации токсигенных цианобактерий в пробах из природных водоемов, в том числе источников хозяйственно-питьевого водоснабжения.
Рис. 1.
Результаты мультипраймерной амплификации специфических участков генов биосинтеза сакситоксинов (sx-tA), цилиндроспермопсина (aoaB), анатоксина-а (anaC) и микроцистинов (mcyA). М – маркер молекулярной массы; дорожки 1‒2 – одновременная амплификация четырех и трех генов соответственно в одной ПЦР-пробирке с внесением смеси ДНК чистых культур цианобактерий-продуцентов токсинов; дорожка 3 – амплификация гена mcyA в отдельной ПЦР-пробирке; дорожка 4 – амплификация гена anaC в отдельной ПЦР-пробирке; дорожка 5 – амплификация гена aoaB в отдельной ПЦР-пробирке; дорожка 6 – амплификация гена sxtA в отдельной ПЦР-пробирке; дорожки 7‒8 – одновременная амплификация трех и четырех генов соответственно в одной ПЦР-пробирке с внесением ДНК планктона природных водоемов.
Исследование финансировалось грантом Президента № МК-1284.2013.5, подготовка сообщения осуществлена при поддержке РФФИ (проект № 18-04-01069-а) и гранта ЯрГУ № OP-2G-08/2018.
Список литературы
Babanazarova O.V., Sidelev S.I., Fastner J. Northern expansion of Cylindrospermopsis raciborskii (Nostocales, Cyanoprokaryota) observed in shallow highly eutrophic lake Nero (Russia) // Int. J. Algae. 2015. V. 17. P. 131–141.
Ballot A., Fastner J., Wiedner C. Paralytic shellfish poisoning toxin-producing cyanobacterium Aphanizomenon gracile in Northeast Germany // Appl. Environ. Microbiol. 2010. V. 76. P. 1173–1180.
Barón-Sola Á., Ouahid Y., Campo F. Detection of potentially producing cylindrospermopsin and microcystin strains in mixed populations of cyanobacteria by simultaneous amplification of cylindrospermopsin and microcystin gene regions // Ecotoxicol. Environ. Saf. 2012. V. 75. P. 102–108.
Hisbergues M., Christiansen G., Rouhiainen L., Sivonen K., Börner T. PCR-based identification of microcystin-producing genotypes of different cyanobacterial genera // Arch. Microbiol. 2003. V. 180. P. 402–410.
Molecular Tools for Detection and Quantification of Toxigenic Cyanobacteria / Eds. Kurmayer R., Sivonen K., Wilmotte A., Salmaso N. Hoboken NJ: Wiley, 2017. 402 p.
Rantala-Ylinen A., Känä S., Wang H., Rouhiainen L., Wahlsten M., Rizzi E., Berg K., Gugger M., Sivonen K. Anatoxin-a synthetase gene cluster of the cyanobacterium Anabaena sp. strain 37 and molecular methods to detect potential producers // Appl. Environ. Microbiol. 2011. V. 77. P. 7271–7278.
Semenova A.S., Sidelev S.I., Dmitrieva O.A. Experimental investigation of natural populations of Daphnia galeata G.O. Sars from the Curonian Lagoon feeding on potentially toxigenic cyanobacteria // Biol. Bull. 2017. V. 44. P. 538–546.
Sidelev S.I., Golokolenova T.B., Chernova E.N., Russkikh Y.V. Analysis of phytoplankton in Tsimlyansk Reservoir (Russia) for the presence of cyanobacterial hepato- and neurotoxins // Microbiology. 2015. V. 84. P. 828–837.
Sidelev S.I., Korneva L.G., Solovyeva V.V., Zubishina A.A., Pligin D.N. Molecular genetic identification and seasonal succession of toxigenic cyanobacteria in phytoplankton of the Rybinsk Reservoir (Russia) // Inland Water Biol. 2016. V. 9. P. 368–374.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


