Микробиология, 2019, T. 88, № 3, стр. 345-357
Разнообразие и физиолого-биохимические свойства гетеротрофных бактерий, изолированных из эпилитических биопленок озера Байкал
Е. В. Суханова a, *, Ю. Р. Штыкова a, М. Ю. Суслова a, О. С. Пестунова a, Т. Я. Косторнова a, И. В. Ханаев a, Е. А. Зименс a, Г. В. Подлесная a, В. В. Парфенова a
a Лимнологический институт СО РАН
664033 Иркутск, Россия
* E-mail: sukhanovalena17@gmail.com
Поступила в редакцию 06.12.2017
После доработки 06.12.2018
Принята к публикации 22.01.2019
Аннотация
Впервые из эпилитических биопленок озера Байкал изолировано 170 штаммов гетеротрофных бактерий, которые идентифицированы по фрагменту гена 16S рРНК, и изучены их физиолого-биохимические свойства. Филогенетическим анализом определено 59 филотипов; показано, что три штамма предположительно являются новыми прокариотическими таксонами. Разнообразие культивируемого сообщества биопленок представлено 4 филами и 32 родами бактерий: Proteobacteria (51%), Firmicutes (30%), Actinobacteria (15%) и Bacteroidetes (4%). Доминирующими отмечены Aeromonas, Pseudomonas и Bacillus. В эпилитических биопленках показано более высокое разнообразие культивируемого микробного сообщества, по сравнению с водной толщей озера, нейстона и губок. Кроме того, среди изолированных штаммов обнаружены представители 10 родов, ранее не детектированных в экосистеме озера Байкал – Actinobacteria (Microcella, Pseudoclavibacter, Glaciihabitans, Plantibacter, Sanguibacter), Proteobacteria (Devosia, Roseomonas, Hydrogenophaga, Iodobacter, Rhizobium), из них Glaciihabitans spp. ВА-51-09, ВА-73-09 и Rhizobium sp. ВА-57-09 являются новыми прокариотическими таксонами. Выявлены статистически значимые различия между частотой встречаемости штаммов, изолированных из обрастаний стальной пластины и естественного субстрата, а также на питательных средах с различным составом органических веществ. Отмечено, что большинство выделенных штаммов родов Aeromonas, Pseudomonas и Bacillus проводили деструкцию шести различных полимерных субстратов, что предполагает их активное участие в разложении органических веществ в биопленке и экосистеме озера Байкал в целом.
Известно, что 95‒99% микроорганизмов в природных биотопах существуют в виде биопленок, так как это облегчает доступ питательных веществ к ним, способствует кооперации организмов и защищает клетки от негативного воздействия окружающей среды (Costerton et al., 1987). Биопленки являются одним из видов микробных консорциумов, играющих важную роль в биосферных биогеохимических процессах. Биопленки – это пространственно и метаболически структурированные сообщества, заключенные во внеклеточный полимерный матрикс, расположенные на границе раздела фаз (Costerton et al., 1987; Stoodley, 2002; Николаев, Плакунов, 2007).
В водной среде биопленки представлены несколькими типами в зависимости от субстрата, на котором они формируются: эпилитические (на поверхности камней), эпипсаммические (прикрепленные к частицам осадков), эпиксильные (на мертвом растительном материале), эпифитные (на живых растениях), морской или озерный снег (на органических и неорганических частицах), биообрастания (на искусственных поверхностях) (Romaní et al., 2016). Эпилитические биопленки по сравнению с другими биопленками имеют сложную гетерогенную структуру, с более богатым видовым составом, высокой численностью бактерий и биомассой водорослей и мало зависимы от сезонных колебаний (Romaní, Sabater, 2001; Bartrons et al., 2012).
Изучение состава и структуры мультивидовых биопленок и, в особенности, механизмов взаимоотношений входящих в них микроорганизмов, становится приоритетным направлением исследований микробных сообществ в экологии, медицине и биотехнологии (Николаев, Плакунов, 2007; Ножевникова и соавт., 2015).
В настоящее время проводят большое количество исследований разнообразия и структуры бактериального сообщества в эпилитических биопленках пресноводных экосистем с помощью молекулярно-генетических методов, особенно отдельных физиологических групп, например, таких как азотфиксирующие бактерии и т.д. (Debroas et al., 2009; Bartrons et al., 2012; Vila-Costa et al., 2014). Сообщество биопленок разных водоемов зависит от многих факторов, например, от типа субстрата или состава и количества органических веществ в воде (Lang et al., 2015). Так, показано, что в олиготрофных озерах основными бактериальными таксонами являются Bacteroidetes и Cyanobacteria, а затем Alpha-, Beta-, Gama- и Deltaproteobacteria, Chlorobi, Planctomycetes и Verrucomicrobia (Bartrons et al., 2012). Для биопленок из мезотрофных озер характерны представители филы Actinobacteria, затем следуют Alpha- и Betaproteobacteria и в меньшей степени встречаются Bacteroidetes (Debroas et al., 2009).
Классические методы микробиологии, такие как культивирование, для изучения сообщества биопленок в настоящее время редко применяют, так как данный метод дает неудовлетворительные результаты из-за невозможности полного диспергирования внеклеточного полимерного матрикса (Ножевникова и соавт., 2015). Встречается мало данных о составе культивируемого сообщества эпилитических биопленок пресноводных экосистем, в частности, имеются сведения о разнообразии культивируемых аэробных аноксигенных фототрофных бактерий в эпилитических биопленках рек Японии (Hirose et al., 2016).
С 2000 года на Байкале проводятся исследования процессов формирования сообществ гидробионтов на разных геологических породах в экосистеме озера (Timoshkin et al., 2003), которые показали, что развитие и активность организмов зависят от химического состава породы и ее структуры, а также отмечена большая избирательность заселения различных субстратов (Парфенова и соавт., 2008a). Таксономическое разнообразие культивируемых микроорганизмов по морфологическим и физиолого-биохимическим показателям в биопленках было представлено 7 родами: Pseudomonas, Flavobacterium, Methylobacterium, Alcaligenes, Aureobacterium, Streptococcus и Bacillus (Мальник, 2010). В результате исследования суммарной ДНК биопленок было получено 20 нуклеотидных последовательностей фрагмента гена 16S рРНК, которые принадлежали 5 филам бактерий: Bacteroidetes, Proteobacteria (Alpha-, Beta-, Gamma-), Cyanobacteria, Verrucomicrobia, Firmicutes (Мальник, 2010). Впервые методом пиросеквенирования участка гена 16S рРНК изучены бактериальные сообщества воды и биопленки, сформированной на искусственном субстрате в озере Байкал (Парфенова и соавт., 2013). Показано высокое таксономическое разнообразие бактериальных сообществ биопленок, которое представлено 3 филами бактерий: Bacteroidetes, Proteobacteria и Cyanobacteria (Парфенова и соавт., 2013).
Дополнительно, некоторые штаммы, полученные в данном исследовании, проявляли антагонистическую активность против условно-патогенных микроорганизмов (Зименс и соавт., 2014). В геномах бактерий, выделенных из эпилитических биопленок, обнаружены гены поликетидсинтазы PKS и нерибосомной пептидсинтетазы NRPS, которые ответственны за синтез антибиотиков, биосурфактантов и цитостатиков (Суханова и соавт., 2017; Sukhanova et al., 2018). Показано высокое разнообразие генов вторичных метаболитов в геномах рода Bacillus.
Исходя из полученных результатов очевидно, что необходимо продолжать дальнейшие исследования по изучению состава и структуры микробного сообщества эпилитических биопленок озера Байкал, как молекулярными, так и классическими методами микробиологии.
Целью настоящей работы было изучить разнообразие и физиолого-биохимические свойства гетеротрофных бактерий, изолированных из эпилитических биопленок озера Байкал.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Пробоподготовка и отбор проб. Объектами исследования стали образцы биопленок, сформированных на различных твердых субстратах в литоральной зоне южной котловины озера Байкал, залив Лиственничный (51°51′46.3′′ N, 104°50′47.1′′ Ε). Для работы взяты заранее подготовленные пластины толщиной от 0.5 до 1 см из следующих горных пород и минералов: габбро, уртит, мрамор, гранит, слюда и кварц. В качестве искусственного субстрата использовали стальную пластину. Для контроля использовали фоновый субстрат – валуны, находящиеся в непосредственной близости от зоны проведения эксперимента. Пластины были погружены на глубину 7–8 м водолазами ЛИН СО РАН в 2011 году и экспонированы в естественных условиях озера в течение года.
Отбор пластин проводили в стерильные емкости с байкальской водой и транспортировали в лабораторию при температуре 7‒10°С. В асептических условиях с поверхности твердых субстратов соскабливали обрастания (перифитон) площадью 2 см2, которые использовали для культивирования на питательных средах.
Изолирование гетеротрофных бактерий и изучение их морфологических и физиолого-биохимических свойств. Перифитон суспендировали в 50 мл стерильной байкальской воды, встряхивали 30 мин на шейкере при 120 об./мин, затем полученную суспензию разбавляли, добавляя аликвоту 1 мл в 100 мл стерильной байкальской воды. Высев проводили по 1 мл в 3 повторностях, используя метод прямого глубинного посева на твердые питательные среды: 0.01% ПДС, РПА/10, R2A/10 (при 4‒7°С), R2A, NSY, TSA, PCA, МПА (при 37°С). На всех использованных средах проводили подсчет выросших колоний. Для выделения чистых культур использовали питательные среды c различным содержанием органических веществ: R2A – 2.5 г (“Fluka Analytical”, США), NSY – 3 г (г/л: питательный бульон – 1, соевый пептон – 1, дрожжевой экстракт – 1, агар – 15), PCA – 8.5 г (“HiMedia”, Индия) и TSA – 20 г (“HiMedia”, Индия). Длительность инкубации посевов составила 5–7 дней при 20–22°С.
Для создания коллекции отсевали колонии с различной морфологией. Чистые культуры получали методом истощающего штриха. Морфологию клеток и тинкториальные свойства исследовали с помощью световой микроскопии на микроскопе Axiostar plus ×100 (“Carl Zeiss Light Microscopy”, Германия).
У выделенных штаммов исследовали способность утилизировать органические субстраты, используя метод посева уколом на агаризованные питательные среды с крахмалом, обезжиренным молоком, желатином, яичным желтком и трибутирином. Учет результатов проводили по наличию вокруг колоний зон продуктов гидролиза (Практикум по микробиологии, 2005). Для определения фосфатазной активности использовали стандартный набор реагентов ALKALINE PHOSPHATASE FL (“Vital Development Corporation”, Россия), содержащий n-нитрофенилфосфат.
Молекулярно-генетическая идентификация штаммов. Выделение ДНК из суточных культур микроорганизмов проводили с помощью набора ДНК-Сорб В (ФГУН ЦНИИ эпидемиологии Роспотребнадзора, Москва). Полученную матрицу использовали в полимеразную цепную реакцию, целевые ампликоны фрагмента гена 16S рРНК получали на консервативных бактериальных праймерах 27L (5'-AGAGTTTGATCATGGCTCAG-3') и 1542R (5'-AAGGAGGTGATCCAGCCS-3') (Brosius et al., 1981). Нуклеотидные последовательности фрагментов гена 16S рРНК определяли на автоматическом секвенаторе ABI PRISM 310 Genetic Analyzer ABI310A (“Perkin Elmer”, США) в центре “Геномика” СО РАН (г. Новосибирск). Сравнительный анализ полученных последовательностей с опубликованными ранее осуществляли с помощью пакета программ FASTA и BLAST. Нуклеотидные последовательности 170 штаммов зарегистрированы в GenBank под номерами: HF548373–HF548401, HF678874–HF678990, HF947322–HF947328, LT555292, LT601385–LT601400.
Филогенетический анализ и выравнивание полученных нуклеотидных последовательностей проводили с использованием программы Mega6. Дерево строили методом Maximum-Likelihood, модель Kimura 2-parameter. Бутстреп поддержка была рассчитана на 1000 реплик.
Статистический анализ. Сравнение частоты встречаемости штаммов на различных субстратах и средах проведено с использованием критерия Хи-квадрат Пирсона. При уровне значимости ≤0.01 различия приняты статистически достоверными.
РЕЗУЛЬТАТЫ
Изоляция штаммов гетеротрофных бактерий. В результате микробиологических исследований эпилитических биопленок средние значения численности выросших колоний на среде R2A составили 5.6 × 105 КОЕ/см2, на NSY – 4.9, PCA – 3.3 и TSA – 1.9 (×105 КОЕ/см2). Получена коллекция гетеротрофных бактерий из 170 штаммов: на среде R2A ‒ 64, PCA – 50, NSY – 36 и TSA – 20. Количество изолированных штаммов составило: на стальной пластине – 35, на природном валуне (фон) – 31, слюде – 22, габбро – 22, уртите – 20, граните – 17, кварце – 16 и мраморе – 7 (табл. 1).
Таблица 1.
Разнообразие микроорганизмов, изолированных из эпилитических биопленок озера Байкал
| Таксономический состав | Искусственный субстрат | Горные породы | Минералы | Фоновый субстрат | ||||
|---|---|---|---|---|---|---|---|---|
| стальная пластина | габбро | гранит | мрамор | уртит | кварц | слюда | природный валун | |
| Proteobacteria | 22 | 12 | 9 | 4 | 13 | 13 | 10 | 10 |
| Brevundimonas | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Devosia | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Roseomonas | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Rhizobium | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Sphingomonas | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Achromobacter | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Hydrogenophaga | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Iodobacter | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Massilia | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Aeromonas | 14 | 5 | 1 | 2 | 6 | 0 | 2 | 0 |
| Pseudomonas | 3 | 4 | 8 | 2 | 7 | 11 | 5 | 5 |
| Stenotrophomonas | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 |
| Serratia | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 2 |
| Yersinia | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Firmicutes | 5 | 6 | 5 | 1 | 5 | 2 | 7 | 18 |
| Bacillus | 3 | 4 | 5 | 1 | 5 | 2 | 6 | 16 |
| Staphylococcus | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 |
| Virgibacillus | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Paenibacillus | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 2 |
| Actinobacteria | 6 | 4 | 1 | 2 | 2 | 1 | 4 | 2 |
| Kocuria | 2 | 0 | 0 | 0 | 1 | 1 | 0 | 0 |
| Microbacterium | 2 | 1 | 0 | 0 | 0 | 0 | 1 | 0 |
| Pseudoclavibacter | 0 | 2 | 0 | 0 | 0 | 0 | 1 | 0 |
| Rhodococcus | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Pseudarthrobacter | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Glaciihabitans | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 |
| Plantibacter | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Microcella | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| Brachybacterium | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Streptomyces | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Sanguibacter | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Micrococcus | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Bacteroidetes | 2 | 0 | 2 | 0 | 0 | 0 | 1 | 1 |
| Flavobacterium | 1 | 0 | 2 | 0 | 0 | 0 | 1 | 0 |
| Pedobacter | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Всего штаммов | 35 | 22 | 17 | 7 | 20 | 16 | 22 | 31 |
| Всего родов | 15 | 11 | 5 | 5 | 5 | 5 | 12 | 8 |
Структура гетеротрофного микробного сообщества эпилитических биопленок. Идентификация штаммов по результатам анализа фрагмента гена 16S рРНК определила 32 рода бактерий, относящихся к 4 филам: Proteobacteria (51%), Firmicutes (30%), Actinobacteria (15%) и Bacteroidetes (4%).
В биопленках исследуемых субстратов фила Proteobacteria представлена тремя классами и 14 родами: Alphaproteobacteria (Brevundimonas, Devosia, Roseomonas, Rhizobium, Sphingomonas), Betaproteobacteria (Achromobacter, Hydrogenophaga, Iodobacter, Massilia), Gammaproteobacteria (Aeromonas, Pseudomonas, Stenotrophomonas, Serratia, Yersinia). Доминирующими среди данной филы были рода: Pseudomonas – 48% и Aeromonas – 31%. Остальные указанные рода представлены в единичном количестве – от 1 до 4%.
Фила Firmicutes представлена 4 родами бактерий: Bacillus, Staphylococcus, Virgibacillus и Paenibacillus. Доминирующим среди представителей данного филума отмечен род Bacillus (88%), остальные рода встречались от 2.5 до 7%.
Для филы Actinobacteria показано биоразнообразие из 12 родов бактерий: Kocuria (22%), Microbacterium (15%), Pseudoclavibacter (11%) и Rhodococcus (7%). Такие рода как Pseudarthrobacter, Glaciihabitans, Plantibacter, Microcella, Brachybacterium, Streptomyces, Sanguibacter и Micrococcus представлены в единичном количестве (по 4.2%).
Всего 6 штаммов из 170 идентифицированы как представители филы Bacteroidetes: Flavobacterium – 4 и Pedobacter – 2.
Филогенетическое разнообразие культивируемых гетеротрофных бактерий в эпилитических биопленках. В результате филогенетического анализа последовательностей фрагмента гена 16S рРНК 170 штаммов гетеротрофных бактерий было определено 59 различных филотипов: для филы Proteobacteria – 20 (Alpha- – 5; Beta- – 4 и Gamma- – 11); Firmicutes – 18; Actinobacteria – 16 и Bacteroidetes – 5 (рис. 1).
Рис. 1.
Филогенетическое дерево, построенное по результатам сравнения последовательностей фрагментов гена 16S рРНК (длиной 870 п.н.) штаммов, изолированных из эпилитических биопленок оз. Байкал. В круглых скобках указан субстрат, на котором был получен штамм, и номер последовательности в GenBank; жирным шрифтом указано количество последовательностей данного филотипа. Бутстреп-анализ был проведен для 1000 реплик; масштаб соответствует 50 замен на 1000 п.н.
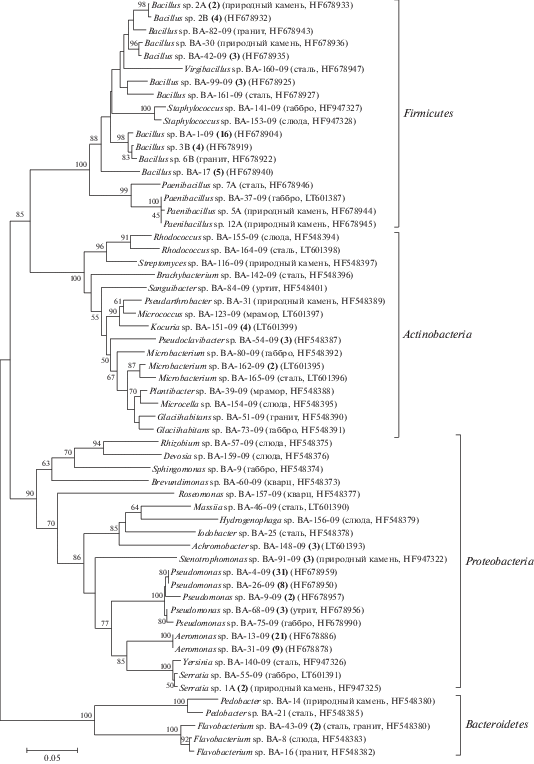
Всего получено 42 последовательности рода Bacillus, для которых показано высокое разнообразие филотипов (11 шт.). Филотип Bacillus sp. ВА-1-09 встречался на всех исследованных субстратах, идентифицировано 16 последовательностей этого филотипа. На природном валуне (фоновый) встречались шесть различных филотипов рода Bacillus, из них два были представлены только на этом субстрате: Bacillus spp. 2А и ВА-30 (рис. 1).
Для представителей рода Pseudomonas было получено 44 последовательности, которые распределились на пять филотипов (рис. 1). Филотип Pseudomonas sp. ВА-4-09 был представлен на всех исследованных субстратах, получена 31 последовательность этого филотипа (рис. 1).
В результате молекулярного анализа определено 30 последовательностей рода Aeromonas, на филогенетическом дереве они образовали два близких кластера. Для филотипа Aeromonas sp. ВА-13-09 идентифицирована 21 последовательность. Филотипы для других родов бактерий были представлены в единичных количествах (рис. 1).
Таким образом, обнаружены часто встречающиеся филотипы в эпилитических биопленках озера Байкал: Bacillus sp. ВА-1-09, Pseudomonas sp. ВА-4-09 и Aeromonas sp. ВА-13-09.
В результате изучения культивируемого сообщества эпилитических биопленок получено следующее разнообразие бактерий на различных субстратах: стальная пластина – 15 родов (20 филотипов), габбро – 11 родов (16 филотипов), слюда – 12 родов (15 филотипов), природный валун – 8 родов (15 филотипов), гранит – 5 родов (10 филотипов), уртит – 5 родов (8 филотипов), мрамор и кварц по 5 родов и 6 филотипов (табл. 1).
Высокое разнообразие штаммов получено на стальной пластине (искусственный субстрат). Это единственный субстрат, в биопленках которого доминировали представители рода Aeromonas (14 шт.). На природном валуне (фон) преимущественно встречались штаммы рода Bacillus (18 шт.). Статистически значимые различия выявлены между частотой встречаемости штаммов в культивируемом сообществе обрастаний стальной пластины и биопленок природного валуна (фон). Между частотой встречаемости штаммов в культивируемом сообществе биопленок минералов и горных пород по представителям филумов статистически значимых различий не выявлено, разнообразие отмечено только по родовым признакам (табл. 1).
В результате изучения культивируемого сообщества эпилитических биопленок озера Байкал показано, что на всех использованных средах определены представители родов Aeromonas, Pseudomonas и Bacillus. Наибольшее разнообразие бактерий получено на среде R2A – 21 род (Flavobacterium, Sphingomonas, Massilia, Glaciihabitans, Pseudoclavibacter, Serratia, Rhizobium, Brevundimonas, Streptomyces, Staphylococcus, Microcella, Rhodococcus, Hydrogenophaga, Roseomonas, Microbacterium, Devosia, Kocuria, Paenibacillus), затем на PCA – 17 (Pedobacter, Iodobacter, Pseudoclavibacter, Pseudarthrobacter, Paenibacillus, Plantibacter, Kocuria, Yersinia, Staphylococcus, Brachybacterium, Stenotrophomonas, Rhodococcus, Microbacterium, Serratia), NSY – 10 (Pedobacter, Flavobacterium, Microbacterium, Achromobacter, Sanguibacter, Stenotrophomonas, Kocuria) и на богатой питательной среде TSA – 6 родов (Virgibacillus, Microbacterium и Micrococcus). Между частотой встречаемости штаммов на используемых питательных средах выявлены статистически значимые различия.
Идентификация штаммов с низким процентом гомологии. В результате сравнительного анализа полученных последовательностей было показано, что две последовательности актинобактерии (73-09 и 51-09) и одна альфапротеобактерии (57-09) имели низкую гомологию с ближайшими культивируемыми гомологами. Для их идентификации был проведен филогенетический анализ нуклеотидных последовательностей гена 16S рРНК с ближайшими родственниками (рис. 2).
Рис. 2.
Филогенетическое дерево, построенное по результатам сравнения последовательностей фрагментов гена 16S рРНК (длиной 1398 п.н.) штаммов, изолированных из эпилитических биопленок оз. Байкал. Последовательности, полученные в данной работе, выделены жирным шрифтом. В круглых скобках указаны номера последовательностей в GenBank. Бутстреп-анализ был проведен для 1000 реплик; масштаб соответствует 50 замен на 1000 п.н.
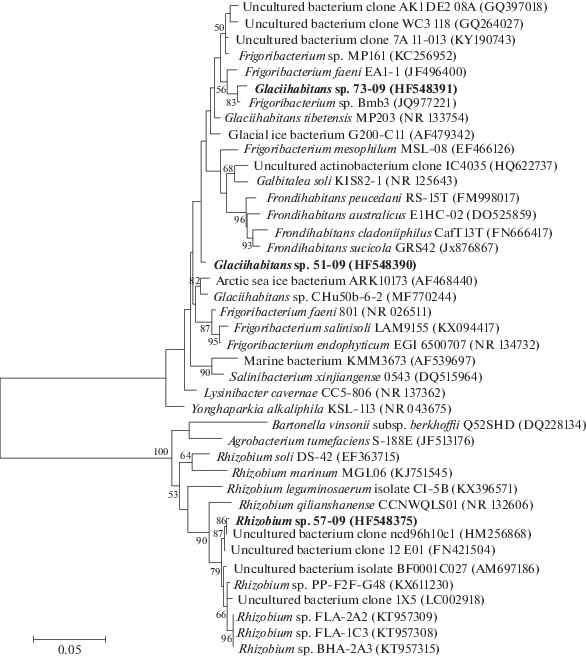
BLAST-анализ последовательности гена 16S рРНК штамма 57-09 показал, что гомология с ближайшим типовым штаммом составила 96% к Rhizobium qilianshanense CCNWQLS01 (NR_132606). Другие ближайшие культивируемые родственники имели гомологию 98‒99%, например, Rhizobium sp. PP-F2F-G48 (KX611230), изолированный из филлосферы Galium album и Rhizobium sp. FLA-2A2 (KT957309) из проса. Авторы отмечают эти штаммы как новые прокариотические таксоны. Остальные ближайшие гомологи являются некультивируемыми бактериями с гомологией 99% (Rhizobium/Agrobacterium group). По результатам филогенетического анализа байкальская последовательность образовала отдельную ветвь с некультивируемой бактерией (клон 12 Е01), выделенной из филлосферы Arabidopsis thaliana (рис. 2) (Delmotte, 2009). По результатам проведенного анализа можно отметить, что штамм Rhizobium sp. 57-09, выделенный из эпилитических биопленок озера Байкал, является новой таксономической единицей в данном роде.
BLAST-анализ последовательности гена 16S рРНК штамма 51-09 показал, что максимальная гомология составила 98% с ближайшими культивируемыми родственниками: Glaciihabitans sp. CHu50b-6-2 (MF770244), выделенного из осадков, бактерия G200-C11 (AF479342), изолированная из 200-летнего льда ледника (Гулия, Китай) и последовательности типового штамма Glaciihabitans tibetensis MP203 (NR_133754). G. tibetensis MP203 выделен из замороженной ледниковой воды (Тибет, Китай) и является единственным типовым штаммов в этом роде (Li et al., 2014). Интересно отметить, что последовательности ближайших некультивируемых бактерий составили гомологию от 97.7%. Последовательность гена 16S рРНК штамма 51-09 образовала на древе самостоятельную ветвь (рис. 2). По результатам проведенного анализа можно предположить, что штамм 51-09 может относиться к новому таксону (вид, род) бактерий, который еще не описан.
Сравнительный анализ последовательности гена 16S рРНК штамма 73-09 показал, что ближайшие культивируемые представили с гомологией 99% Frigoribacterium sp. Bmb3 (JQ977221), изолирован из корней субнивальных растений (Тянь-Шаня, Китай) и Frigoribacterium faeni EA1-1 (JF496400), изолированный из почвы (Китай: внутренняя Монголия, Вушен) с гомологией 98%. Другие культивируемые представители имели гомологию от 97.7%. Гомология к некультивируемым представителям составила от 98%. Ближайшим типовым видом является Glaciihabitans tibetensis MP203 (NR_133754) с гомологией 97.7%. Филогенетический анализ показал, что последовательность штамма 73-09 образует отдельную ветку с высокой бутстреп поддержкой, поэтому может являться новой таксономической единицей.
Физиолого-биохимические свойства штаммов гетеротрофных бактерий из эпилитических биопленок. По результатам проведенного анализа показано, что в культивируемом сообществе биопленок преобладают штаммы, гидролизующие крахмал (79%) и обезжиренное молоко (71%), на среде с яичным желтком образовали зоны 58%, и 59% штаммов обладали активностью щелочной фосфатазы в отношении n-нитрофенилфосфат (табл. 2).
Таблица 2.
Доля штаммов гетеротрофных бактерий, утилизирующих органические субстраты, %
| Таксономическое положение бактерий | Количество штаммов | Протеаза | Липаза | Амилаза | Фосфатаза | ||
|---|---|---|---|---|---|---|---|
| казеин | желатина | лецитин | трибутирин | крахмал | Нитрофенил-фосфат | ||
| Proteobacteria | 93 | 79 | 84 | 83 | 9 | 83 | 74 |
| Pseudomonas spp. | 44 | 79 | 86 | 86 | 10 | 81 | 55 |
| Aeromonas spp. | 30 | 96 | 100 | 93 | 15 | 100 | 93 |
| Actinobacteria | 22 | 16 | 4 | 4 | 4 | 60 | 24 |
| Firmicutes | 49 | 84 | 12 | 51 | 0 | 86 | 45 |
| Bacillus spp. | 42 | 84 | 16 | 49 | 0 | 86 | 58 |
| Всего штаммов | 170 | 71 | 48 | 58 | 5 | 79 | 59 |
Интересно отметить, что представители филы Proteobacteria (Aeromonas, Pseudomonas) проводили деструкцию шести различных полимерных субстратов (табл. 2). Штаммы филы Firmicutes в основном расщепляли крахмал (86%) и обезжиренное молоко (84%). Наименьшее количество культур, способных утилизировать тестируемые субстраты, определено для представителей филы Actinobacteria, которые преимущественно проводили деструкцию крахмала (60%) (табл. 2).
ОБСУЖДЕНИЕ
Структура и разнообразие гетеротрофных бактерий, выделенных из эпилитических биопленок озера Байкал. Исследования показали, что культивируемое сообщество гетеротрофных микроорганизмов водной толщи озера Байкал, нейстонной пленки и эпилитических биопленок имеют одинаковую структуру, которая определяется следующими филами бактерий Proteobacteria (Alpha-, Beta- и Gamma-), Firmicutes, Actinobacteria и Bacteroidetes, для нейстонной пленки отмечено дополнительно наличие филы Deinoccocus-Thermus (Галачьянц и соавт., 2016). Отличительной особенностью состава биопленочных сообществ от нейстонной пленки и водной толщи является обнаружение разных родов внутри данных фил (Белькова и соавт., 2003; Парфенова и соавт., 2006; Лаптева и соавт., 2007; Парфенова и соавт., 2008а; Парфенова и соавт., 2008б; Белых и соавт., 2013; Zakharova et al., 2013; Галачьянц и соавт., 2016). Например, только в эпилитических биопленках были детектированы следующие рода бактерий: Alphaproteobacteria (Devosia, Roseomonas, Rhizobium); Betaproteobacteria (Achromobacter, Hydrogenophaga, Iodobacter); Gammaproteobacteria (Stenotrophomonas, Serratia, Yersinia); Firmicutes (Virgibacillus, Paenibacillus); Actinobacteria (Kocuria, Microbacterium, Pseudoclavibacter, Glaciihabitans, Plantibacter, Brachybacterium, Sanguibacter, Microcella). Можно предположить, что эти бактерии способны адгезироваться к твердым субстратам и взаимодействовать с друг другом или другими организмами, а также для их жизнедеятельности необходимо большое количество легкоусвояемых органических веществ, которых в биопленках больше, чем в воде. Кроме того, известно, что бациллы и другие бактерии способны выделять полисахариды, которые и образуют структуру биопленки. Отмечено, что помимо представителей протеобактерий и бацилл, в культивируемом сообществе эпилитических биопленок большую долю составили актинобактерии, что отличает биопленку от других микробных сообществ озера Байкал. Известно, что актинобактерии играют важную роль в разложении органических веществ, таких, как целлюлоза и хитин, и таким образом принимают участие в круговороте органических веществ и в углеродном цикле.
Доминирующими представителями среди культивируемого микробного сообщества эпилитических биопленок были бактерии родов Aeromonas, Pseudomonas и Bacillus. Бациллы и псевдомонады являются повсеместно распространенными, принимают активное участие в деструкционных процессах, протекающих в оз. Байкал, обладают большим биологическим потенциалом и выраженной приспособляемостью к разнообразным условиям внешней среды. Известно, что культивируемые псевдомонады составляют в среднем 80% от всех гетеротрофов в оз. Байкал, а род Bacillus – 20% (Максимова, Максимов, 1989; Павлова и соавт., 2003; Павлова, 2004; Суслова, 2010). Пространственное распределение бактерии рода Bacillus в оз. Байкал характеризуется доминированием в основном в придонных слоях водной толщи. При сравнении пространственного распределения бацилл в воде и в донных осадках озера установлено, что спорообразующие бактерии преобладают в донных осадках как по количественному составу, так и по видовому разнообразию (Суслова, 2007).
Доминирование культивируемых псевдомонад наблюдали в поверхностном слое воды в мае, они составляли 84% от количества гетеротрофов, и в ноябре, когда численность составляла 93% на глубине 7 и 14 м, а 96% ‒ в поверхностном слое (Павлова, 2004).
Представители рода Aeromonas ранее не изучены в толще воды и осадках озера Байкал. Aeromonas spp. являются повсеместными бактериями, широко распространенными в водной среде (Craveiro et al., 2015).
Кроме того, показано, что среди изолированных штаммов получены представители 10 родов, ранее не отмеченных в Байкале: Actinobacteria (Microcella, Pseudoclavibacter, Glaciihabitans, Plantibacter, Sanguibacter), Proteobacteria (Devosia, Roseomonas, Hydrogenophaga, Iodobacter, Rhizobium) (Белькова и соавт., 2003; Парфенова и соавт., 2006; Лаптева и соавт., 2007; Парфенова и соавт, 2008а; Парфенова и соавт, 2008б; Белых и соавт., 2013; Zakharova et al., 2013). Интересно отметить, что при классическом культивировании гетеротрофных бактерий из эпилитических биопленок озера Байкал, обнаружены штаммы альфапротеобактерий и актинобактерий как новые таксоны, которые еще не описаны. Полученные результаты свидетельствуют о том, что классическая микробиология необходима при исследовании новых объектов (экологических ниш) в совокупности с методами молекулярной биологии. Такие комплексные исследования дают более полное представление о микробном разнообразии, а также позволяют расширить таксономическое разнообразие культивируемых бактерий.
Разнообразие по субстратам. В результате исследований были получены статистические значимые различия между разнообразием культивируемого сообщества природного валуна и искусственного субстрата (стальная пластина). Многими авторами отмечается избирательность заселения организмов различных субстратов (Timoshkin et al., 2003; Парфенова и соавт., 2008a; Мальник, 2010). Известны различия в структуре биопленок природных субстратов и конструкций трубопровода (Romani et al., 2016). В нашем исследовании на стальной пластине доминировали представители рода Aeromonas, что ранее отмечали другие авторы для искусственных субстратов в пресных водоемах даже при низких температурах (Craveiro et al., 2015). Таким образом, показано отличие эпилитических биопленок от биообрастаний искусственных поверхностей.
Разнообразие по средам. На всех используемых средах определены представители родов Aeromonas, Pseudomonas и Bacillus, что может свидетельствовать об их высокой адаптации к любым условиям окружающей среды. Возможно, поэтому они являются доминирующими в культивируемом сообществе не только эпилитических биопленок, но и в других биотопах (осадки, толща воды и т.д.).
В результате исследований показаны различия в разнообразии культивированных микроорганизмов на питательных средах с различной концентрацией органических компонентов. Таким образом, для получения более высокого разнообразия культивируемых бактерий необходимо использовать среды с различным содержанием органических и минеральных соединений. Высокое разнообразие культивируемых бактерий из эпилитических биопленок показано для среды R2A, кроме того на данной среде количество колоний в среднем было выше, чем на остальных используемых средах (5.6 × 105 КОЕ/см2). На среде PCA культивировано больше бактерий, чем на минимальной NSY, по-видимому, за счет содержания в данной среде дрожжевого экстракта и моносахарида декстрозы. Минимальное число выросших колоний и низкое разнообразие бактерий отмечено для среды TSA. По-видимому, для эффективного культивирования гетеротрофов из различных биотопов олиготрофных мест обитаний необходимо использовать питательные среды, содержащие не только низкие концентрации органических веществ, но минеральные и витаминные (0.624 г) компоненты, как в среде R2A. Таким образом, несмотря на то, что богатые питательные среды содержат необходимые органические компоненты для роста и развития микроорганизмов, высокая их концентрация является лимитирующим фактором для развития гетеротрофных микроорганизмов, адаптированных к специфичным экологическим условиям Байкала даже в биопленках, где достаточное количество органического вещества, по сравнению с водной толщей оз. Байкал.
Физиолого-биохимические свойства гетеротрофных бактерий, изолированных из эпилитических биопленок оз. Байкал. Ранее изучение ферментативной активности у 200 природных штаммов Pseudomonas, изолированных из различных мест обитаний Байкала (донные осадки, вода) показало, что наиболее активные бактерии рода Pseudomonas выделены из мелководной зоны Южного Байкала и донных осадков, менее активны бактерии, изолированные из воды Северной котловины озера (Павлова, 2004). Меньшую активность культур, выделенных из северной части Байкала, можно объяснить малым содержанием органического вещества, преобладанием низких температур (Павлова, 2004). Для мелководной зоны характерна более высокая температура, чем в пелагиали Северного Байкала. Возможно, этот факт косвенно определяет биохимическую активность тестируемых штаммов, выделенных из этой зоны. Большая активность бактерий, выделенных из донных осадков, объясняется тем, что содержание лабильного органического вещества в них составляет 20‒25% от общего количества органического углерода (Сорг) (Павлова, 2004).
Также ранее установлено, что бактерии рода Bacillus, изолированные из озера Байкал, обладали множественной ферментативной активностью (Суслова, 2007). Показано, что активность исследуемых штаммов зависела от места выделения бактерий. Наиболее активные бактерии рода Bacillus были изолированы из донных осадков, менее активные ‒ из водной толщи озера (Суслова, 2007).
Следовательно, полученные в данной работе результаты по ферментативной активности для бактерий родов Bacillus и Pseudomonas из эпилитических биопленок литоральной зоны оз. Байкал сопоставимы с результатами, полученными ранее для бактерий этих родов, выделенных из осадков мелководной зоны Южной котловины озера. Важно отметить, что практически все штаммы рода Aeromonas (93‒100%), полученные в данном исследовании, могут использовать пять основных анализируемых субстратов. Для рода Aeromonas такие исследования не проводились, данные результаты получены впервые.
Для группы актинобактерий отмечена слабая способность к деструкции органических субстратов, некоторые представители способны проводить гидролиз крахмала.
Сравнивая способность гетеротрофных бактерий, изолированных из различных экологических условий озера (вода, губки, нейстон), к утилизации органики, можно отметить, что из эпилитических биопленок выделено наибольшая доля штаммов, расщепляющих крахмал, чем из других сообществ (табл. 3). Кроме того, высокая доля штаммов, культивированных из эпилитических биопленок, сопоставимая с таковой из губок, гидролизировали обезжиренное молоко и яичный желток (табл. 3). Доля штаммов из эпилитических биопленок, обладающих фосфатазной активностью, была сопоставима с долей штаммов, изолированных из нейстона (табл. 3).
Таблица 3.
Сравнительный анализ доли штаммов, выделенных из различных биотопов оз. Байкал, утилизирующих органические субстраты
| Субстрат/фермент | Доля активных штаммов (%) от общего количества протестированных изолятов | ||||
|---|---|---|---|---|---|
| эпилитические биопленки* | в нейстоне** | в водной толще*** | вода‒биотический субстрат (губка)*** | вода‒абиотический субстрат (камни)**** | |
| Желатин/протеаза | 48 | 39 | 20‒45 | 50‒95 | 30‒45 |
| Казеин/протеаза | 71 | 39 | 10‒30 | 50‒95 | 25‒45 |
| Нитрофенилфосфат/ фосфатаза |
59 | 57 | 80‒85 | 40‒45 | 10‒30 |
| Трибутирин/липаза | 5 | 9 | 50‒85 | 10‒50 | 25 |
| Лецитин/липаза | 59 | 36 | 10‒20 | 25‒75 | 20‒50 |
| Крахмал/амилаза | 79 | 43 | Н.д. | Н.д. | 35‒55 |
Ранее отмечено, что некоторые штаммы из коллекции эпилитических биопленок обладали антагонистической активностью в отношении условно-патогенных микроорганизмов (Зименс и соавт., 2014). Для штаммов рода Bacillus sp. и Paenibacillus sp. отмечена множественная активность (подавление роста тест-культур различных таксономических групп, грибов, грамположительных и грамотрицательных бактерий) с большими зонами лизиса (12‒17 мм) (Зименс и соавт., 2014). В геномах бактерий, выделенных из эпилитических биопленок, обнаружены гены PKS и NRPS, которые ответственны за синтез антибиотиков, биосурфактантов и цитостатиков (Суханова и соавт., 2017; Sukhanova et al., 2018). Показано высокое разнообразие генов вторичных метаболитов в геномах рода Bacillus.
Таким образом, из эпилитических биопленок литоральной зоны оз. Байкал изолированы 170 штаммов гетеротрофных микроорганизмов, которые были идентифицированы по фрагменту гена 16S рРНК и изучены их физиолого-биохимические свойства. Разнообразие культивируемого сообщества биопленок представлено 4 филами и 32 родами бактерий: Proteobacteria (51%), Firmicutes (30%), Actinobacteria (15%) и Bacteroidetes (4%). Филогенетический анализ нуклеотидных последовательностей фрагмента гена 16S рРНК определил их разнообразие в количестве 59 филотипов. Доминирующими отмечены Aeromonas, Pseudomonas и Bacillus. В эпилитических биопленках показано более высокое разнообразие культивируемого микробного сообщества по сравнению с водной толщей озера, нейстона и губок. Кроме того, среди изолированных штаммов обнаружены представители 10 родов, ранее не отмеченных в озере Байкал: Actinobacteria (Microcella, Pseudoclavibacter, Glaciihabitans, Plantibacter, Sanguibacter), Proteobacteria (Devosia, Roseomonas, Hydrogenophaga, Iodobacter, Rhizobium), из которых Glaciihabitans sp. ВА-51-09, ВА-73-09 и Rhizobium sp. ВА-57-09 являются новыми прокариотическими таксонами. Выявлены статистически значимые различия между частотой встречаемости штаммов, изолированных из обрастаний стальной пластины и биопленок естественного субстрата. Отмечено, что большинство выделенных штаммов родов Aeromonas, Pseudomonas и Bacillus проводили деструкцию шести различных полимерных субстратов, что предполагает их активное участие в разложении органических веществ в биопленке и экосистеме оз. Байкал в целом.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках государственного задания по теме № 0345-2016-0003 (AAAA-A16-116122110061-6) “Микробные и вирусные сообщества в биопленках пресноводных экосистем: таксономическое разнообразие, особенности функционирования и биотехнологический потенциал” и при финансовой поддержке РФФИ в рамках научного проекта № 18-34-00443.
Список литературы
Белых М.П., Суханова Е.В., Белькова Н.Л. Особенности культивируемых гетеротрофных микроорганизмов литоральной зоны озера Байкал // Известия ИГУ. Серия “Биология. Экология”. 2013. Т. 6. № 3. С. 20–26.
Белькова Н.Л., Парфенова В.В., Косторнова Т.Я., Денисова Л.Я., Зайчиков Е.Ф. Характеристика биоразнообразия микробного сообщества водной толщи озера Байкал // Микробиология. 2003. Т. 72. № 2. С. 239–249.
Bel’kova N.L., Parfenova V.V., Kostornova T.Ya., Denisova L.Ya., Zaichikov E.F. Microbial biodiversity in the water of Lake Baikal // Microbiology (Moscow). 2003. V. 72. P. 203–212.
Галачьянц А.Д., Белькова Н.Л., Суханова Е.В., Романовская В.А., Гладка Г.В., Бедошвили Е.Д., Парфенова В.В. Разнообразие и физиолого-биохимические свойства гетеротрофных бактерий, выделенных из нейстона озера Байкал // Микробиология. 2016. Т. 85. № 5. С. 568–579.
Galach’yants A.D., Bel’kova N.L., Sukhanova E.V., Romanovskaya V.A., Gladka G.V., Bedoshvili E.D., Parfenova V.V. Diversity and physiological and biochemical properties of heterotrophic bacteria isolated from Lake Baikal neuston // Microbiology (Moscow). 2016. V. 85. P. 604–613.
Зименс Е.А., Суханова Е.В., Штыкова Ю.Р., Парфенова В.В., Белькова Н.Л. Антагонистическая активность гетеротрофных микроорганизмов из биопленок на твердых субстратах литоральной зоны озера Байкал // Известия ИГУ. Серия “Биология. Экология”. 2014. Т. 7. С. 91–98.
Лаптева Н.А., Белькова Н.Л., Парфенова В.В. Пространственное распределение и видовой состав простекобактерий в озере Байкал // Микробиология. 2007. Т. 76. № 4. С. 545–551.
Lapteva N.A., Bel’kova N.L., Parfenova V.V. Spatial distribution and species composition of prosthecate bacteria in Lake Baikal // Microbiology (Moscow). 2007. V. 76. P. 480–486.
Максимова Э.А. Микробиология вод Байкала / Максимова Э.А., Максимов В.Н. – Иркутск: Иркутский ун-т, 1989. 165 с.
Мальник В.В. Микробное сообщество биопленок на поверхности раздела фаз “вода–твердое тело” литоральной зоны оз. Байкал. Автореферат дисс. … канд. биол. наук. Улан-Удэ. 2010. 22 с.
Николаев Ю.А., Плакунов В.К. Биопленка ‒ “город микробов” или аналог многоклеточного организма? // Микробиология. 2007. Т. 76. № 2. С. 149–163.
Nikolaev Yu.A., Plakunov V.K. Biofilm ‒ “City of microbes” or an analogue of multicellular organisms? // Microbiology (Moscow). 2007. V. 76. P. 125–138.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. Мультивидовые биопленки в экологии, медицине и биотехнологии // Микробиология. 2015. Т. 84. № 6. С. 623–644.
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. Multi-species biofilms in ecology, medicine, and biotechnology // Microbiology (Moscow). 2015. V. 84. P. 623–644.
Павлова О.Н., Дрюккер В.В., Косторнова Т.Я., Никулина И.Г. Особенности распространения бактерий рода Pseudomonas в озере Байкал // Сиб. Экол. журн. 2003. Т. 3. С. 267–272.
Павлова О.Н. Бактерии рода Pseudomonas в микробном сообществе озера Байкал. Автореферат дисс. … канд. биол. наук. Иркутск. 2004 г. 20 с.
Парфенова В.В., Мальник В.В., Бойко С.М., Шевелева Н.Г., Логачева Н.Ф., Евстигнеева Т.Д., Сутурин Н.А., Тимошкин О.А. Сообщества гидробионтов, развивающиеся на поверхности раздела фаз: вода – горные породы в озере Байкал // Экология. 2008а. Т. 39. № 3. С. 211–216.
Parfenova V.V., Mal’nik V.V., Boiko S.M., Sheveleva N.G., Logacheva N.F., Evstigneeva T.D., Suturin A.N., Timoshkin O.A. Communities of hydrobionts developing at the water-rock interface in Lake Baikal // Russ. J. Ecol. 2008a. V. 39. P. 198–204.
Парфенова В.В., Теркина И.А., Косторнова Т.Я., Никулина И.Г., Черных В.И., Максимова Э.А. Микробное сообщество пресноводных губок оз. Байкал // Известия РАН. Сер. биол. 2008б. Т. 35. № 4. С. 435–445.
Parfenova V.V., Terkina I.A., Kostornova T.Ya., Nikulina I.G., Chernykh V.I., Maksimova, E.A. Microbial community of freshwater sponges in Lake Baikal // Biol. Bull. 2008b. V. 35. P. 374–379.
Парфенова В.В., Гладких А.С., Белых О.И. Сравнительный анализ биоразнообразия бактериальных сообществ планктона и биопленки в озере Байкал // Микробиология. 2013. Т. 82. № 1. С. 94–105.
Parfenova V.V., Gladkikh A.S., Belykh O.I. Comparative analysis of biodiversity in the planktonic and biofilm bacterial communities in Lake Baikal // Microbiolgy (Moscow). 2013. V. 82. P. 91‒101.
Парфенова В.В., Белькова Н.Л., Денисова Л.Я., Зайчиков Е.Ф., Максименко С.Ю., Захарова Ю.Р., Поддубняк Н.Ю., Моложавая О.А., Никулина И.Г. Изучение видового состава культивируемых гетеротрофных микроорганизмов // Биология внутренних вод. 2006. № 1. С. 8–15.
Практикум по микробиологии: Учеб. пособие для студ. вузов / Под ред. Нетрусова А.И. М.: Академия, 2005. 608 с.
Суслова М.Ю. Распространение и разнообразие спорообразующих бактерий рода Bacillus в водных экосистемах. Дисс. … канд. биол. наук. Иркутск. 2007. 163 с.
Суслова М.Ю., Захарова Ю.Р., Сороковикова Е.Г., Парфёнова В.В., Павлова О.Н., Бедошвили Е.Д. Роль спорообразующих бактерий рода Bacillus в цикле кремния в экосистеме озера Байкал // Успехи наук о жизни. 2010. № 2. С. 178–180.
Суханова Е.В., Зименс Е.А., Парфенова В.В., Белых О.И. Разнообразие генов поликетидсинтаз в геномах гетеротрофных микроорганизмов, выделенных из эпилитических биопленок озера Байкал // Вестн. Моск. ун-та. Сер. 16. Биология. 2017. № 4. С. 246–252.
Sukhanova E.V., Zimens E.A., Parfenova V.V., Belykh O.I. Diversity of polyketide synthase genes in the genomes of heterotrophic microorganisms isolated from epilithic biofilms of lake Baikal // Moscow University Biol. Sci. Bull. 2017. V. 72. P. 211–217.
Bartrons M., Catalan J., Casamayor E.O. High bacterial diversity in epilithic biofilms of oligotrophic mountain lakes // Microb. Ecol. 2012. V. 64. P. 860–869.
Brosius J., Dull T.J., Sleeter D.D., Noller H.F. Gene organization and primary structure of a ribosomal RNA operon from Escherichia coli // J. Mol. Biol. 1981. V. 148. P. 107–127.
Craveiro S., Alves-Barroco C., Barreto Crespo M.T., Barreto A.S., Semedo-Lemsaddek T. Aeromonas biofilm on stainless steel: efficiency of commonly used disinfectants // Int. J. Food Sci. Technol. 2015. V. 50. P. 851–856.
Costerton J.W., Cheng K.J., Geesey G.G., Ladd T.I., Nickel J.C., Dasgupta M., Marrie T.J. Bacterial biofilms in nature and disease // Annu. Rev. Microbiol. 1987. V. 41. P. 435–464.
Delmotte N., Knief C., Chaffron S., Innerebner G., Roschitzki B., Schlapbach R., von Mering C., Vorholt J.A. Community proteogenomics reveals insights into the physiology of phyllosphere bacteria // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 16428–16433.
Debroas D., Humbert J.F., Enault F., Bronner G., Faubladier M., Cornillot E. Metagenomic approach studying the taxonomic and functional diversity of the bacterial community in a mesotrophic lake (Lac du Bourget France) // Environ. Microbiol. 2009. V. 11. P. 2412–2424.
Hirose S., Matsuura K., Haruta S. Phylogenetically diverse aerobic anoxygenic phototrophic bacteria isolated from epilithic biofilms in Tama river, Japan // Microbes Environ. 2016. V. 31. P. 299–306.
Lang J.M., McEwan R.W., Benbow M.E. Abiotic autumnal organic matter deposition and grazing disturbance effects on epilithic biofilm succession // FEMS Microbiol. Ecol. 2015. V. 91. I. 6. pii: fiv060. https://doi.org/10.1093/femsec/fiv060
Li A.H., Liu H.C., Xin Y.H., Kim S.G., Zhou Y.G. Glaciihabitans tibetensis gen. nov., sp. nov., a psychrotolerant bacterium of the family Microbacteriaceae, isolated from glacier ice water // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 579–587.
Romaní A.M., Sabater S. Structure and activity of rock and sand biofilms in a Mediterranean stream // Ecology. 2001. V. 82. P. 3232–3245.
Romaní A.M., Guasch H., Dolors Balaguer M. Aquatic Biofilms. Ecology, Water Quality and Wastewater Treatment Caister. Norfolk, UK: Academic Press, 2016. 230 p.
Stoodley P., Sauer K., Davies D.G., Costerton J.W. Biofilms as complex differentiated communities // Annu. Rev. Microbiol. 2002. V. 56. P. 187–209.
Sukhanova E., Zimens E., Kaluzhnaya O., Parfenova V., Belykh O. Epilithic biofilms in Lake Baikal: screening and diversity of PKS and NRPS genes in the genomes of heterotrophic bacteria // Polish J. Microbiol. 2018. V. 67. P. 501–516.
Timoshkin O.A., Suturin A.N., Maximova N.V., Semi-turkina N.A., Galkin, A.N., Kulikova N.V., Khanaev I.V., Ropstorf P. Rock preferences and microdistribution peculiarities of Porifera and Gastropoda in the shallow littoral zone of Lake Baikal (East Siberia) as evidenced by underwater macrophotograph analysis // Berliner Palaeobiologische Abhandlungen. Berlin. 2003. V. 4. P. 193–200.
Vila-Costa M., Bartrons M., Catalan J., Casamayor E.O. Nitrogen-cycling genes in epilithic biofilms of oligotrophic high-altitude lakes (central Pyrenees, Spain) // Microb. Ecol. 2014. V. 68. P. 60‒69.
Zakharova Yu.R., Galachyants Yu.P., Kurilkina M.I., Likhoshvay A.V., Petrova D.P., Shishlyannikov S.M., Ravin N.V., Mardanov A.V., Beletsky A.B., Likhoshway Ye.V. The structure of microbial community and degradation of diatoms in the deep near-bottom layer of Lake Baikal // PLoS One. 2013. V. 8. e59977.
Дополнительные материалы отсутствуют.


