Микробиология, 2019, T. 88, № 3, стр. 253-271
Механизмы деления бактериальной клетки
А. Д. Ведяйкин a, b, Е. В. Пономарева a, b, М. А. Ходорковский a, С. Н. Борхсениус b, И. Е. Вишняков a, *
a Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
b Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: innvish@gmail.com
Поступила в редакцию 30.11.2018
После доработки 25.01.2019
Принята к публикации 01.02.2019
Аннотация
Несмотря на большое количество исследований, до сих пор есть пробелы в понимании того, каким образом бактериальная клетка делится. В настоящем обзоре описаны основные механизмы, обеспечивающие деление бактериальной клетки и координирующие этот процесс в пространстве и времени. Внимание, главным образом, уделено хорошо изученным модельным микроорганизмам – грамотрицательной бактерии Escherichia coli и грамположительной Bacillus subtilis. Кроме того, рассматриваются гипотетические модели деления клеток микоплазм, не имеющих клеточной стенки и утративших большинство генов, кодирующих гомологи известных компонентов, входящих в состав бактериальной дивисомы. В связи с тем, что бактериальный аппарат деления является перспективной мишенью для новых антибиотиков, его исследование представляет не только фундаментальный, но и практический интерес, и поэтому изучение механизмов деления бактериальной клетки является одной из приоритетных задач современной молекулярной микробиологии.
Одним из фундаментальных процессов, обеспечивающих размножение как прокариотических, так и эукариотических клеток, является деление (цитокинез). Цитокинез осуществляется совокупностью белков, образующих аппарат деления. Деление согласовано в пространстве и времени с другими процессами в клетке, в том числе с репликацией ДНК (удвоением генетического материала) и сегрегацией нуклеоидов (распределением между дочерними клетками). У большинства бактерий деление начинается с формирования сократительного Z-кольца, состоящего из полимеров белка FtsZ (Haeusser, Margolin, 2016). Z-кольцо является своеобразным каркасом, на котором формируется полноценный аппарат деления – так называемая дивисома. Значительная часть белков, входящих в состав дивисомы, отвечает за ремоделирование клеточной стенки в области формирующейся септы.
Изучение бактериального деления представляет фундаментальный и практический интерес. Существуют значительные пробелы в понимании процесса цитокинеза у бактерий, включая хорошо изученный, модельный микроорганизм – Escherichia coli. При этом аппарат деления в целом, и белок FtsZ в частности, считаются перспективными мишенями для новых антибактериальных агентов (Araujo-Bazan et al., 2016; Wang et al., 2016). В отечественной литературе работы, посвященные делению бактерий, немногочисленны; то же касается и обзорных статей (Прозоров, 2005; Вишняков, Борхсениус, 2007). В зарубежной литературе за последнее время опубликовано большое количество новых экспериментальных данных, полученных, в том числе, с помощью методов флуоресцентной микроскопии сверхвысокого разрешения, что позволило существенно скорректировать представления о бактериальном делении (Lutkenhaus, Du, 2017).
В обзоре рассматриваются механизмы деления бактериальной клетки на примере бактерий нескольких видов. Кроме наиболее изученной в этом отношении E. coli, обсуждаются детали цитокинеза у таких видов, как Bacillus subtilis, Streptococcus pneumoniae, а также у микоплазм, не имеющих клеточной стенки и утративших большинство генов, кодирующих гомологи известных компонентов, входящих в состав дивисомы. Обсуждаются различные аспекты бактериального деления: расположение генов деления в геномах бактерий, структура и состав дивисомы, роль регуляторных систем в позиционировании Z-кольца, свойства белков FtsZ в условиях in vitro. Следует отметить, что в данном обзоре не приведены данные по механизмам деления представителей другого обширного домена микроорганизмов – Archaea. У архей имеются оригинальные типы деления клеток, отсутствующие у бактерий (Lindas et al., 2008). Особенности цитокинеза у бактерий, архей и эукариот подробно описываются и сравниваются в обзоре (Balasubramanian et al., 2012).
ГЕНЫ ДЕЛЕНИЯ В БАКТЕРИАЛЬНОМ ГЕНОМЕ
В середине XX века в геноме E. coli были открыты локусы, содержащие гены, ответственные за процесс деления, в том числе за септообразование – формирование перегородки между дочерними клетками (Hirota et al., 1968). Ключевой вклад в открытие этих генов внесли исследования на температуро-чувствительных штаммах в сочетании с фаговой трансдукцией: бактерии с определенными мутациями в указанных генах оказывались неспособными к делению при повышении температуры окружающей среды выше критической и образовывали вытянутые клетки-филаменты. Гены, в которых были картированы мутации, стали обозначать аббревиатурой fts (от англ. filamentous temperature-sensitive mutants – температуро-чувствительные мутанты, образующие филаменты). Важно отметить, что у некоторых мутантов процессы репликации и сегрегации ДНК нарушены не были, что позволило связать соответствующие этим мутациям гены именно с цитокинезом, а не с репликацией или сегрегацией нуклеоидов. Среди них были идентифицированы гены ftsA, ftsQ, ftsL, ftsZ и другие. Ген ftsZ кодирует гомолог тубулина эукариот, ключевой белок деления бактерий FtsZ. FtsZ стал первым выявленным белком бактериального цитоскелета (de Boer, 2016).
Было показано, что большинство генов, отвечающих за процесс деления, расположено компактно в составе так называемого кластера dcw (англ. division and cell wall ‒ деление и клеточная стенка) в районе 2 минуты на хромосоме E. coli, что стало существенным прорывом в понимании устройства аппарата деления бактериальной клетки (Lutkenhaus, 1990). Схематически кластер dcw нескольких видов бактерий представлен на рис. 1. Среди указанных генов, как известно на настоящий момент, ftsL, ftsW, ftsQ, ftsA, ftsZ относятся к генам деления, играющим структурную и регуляторную роль; ftsI, mraY, murC, murD, murE, murG, ddlB отвечают за синтез клеточной стенки (Scheffers, Pinho, 2005; Lutkenhaus et al., 2012); lpxC связан с синтезом липида A; mraZ и mraW относятся к регуляторам транскрипции кластера dcw (Eraso et al., 2014).
Рис. 1.
Схематическое расположение генов, связанных с делением, в кластере dcw на примере нескольких видов бактерий. Стрелками обозначены гены деления и синтеза клеточной стенки, а также транскрипционных регуляторов кластера dcw, серыми прямоугольниками – области генома в составе кластера, не содержащие генов деления.
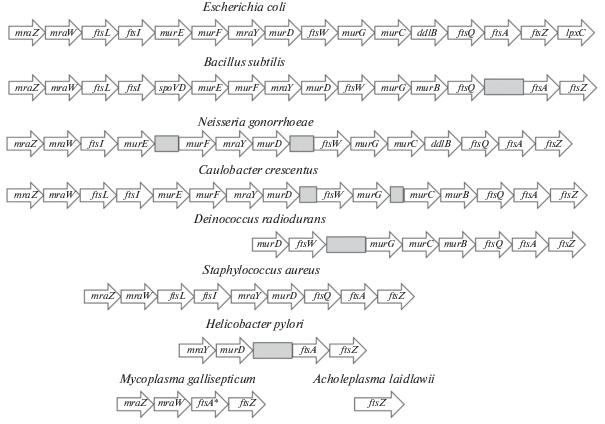
Кластер dcw в том или ином виде присутствует в геномах большинства изученных бактерий, что говорит о его высокой консервативности. Гены, входящие в его состав, являются критически важными для бактериальной клетки. Самым консервативным геном кластера является ftsZ – он обычно присутствует даже в геномах бактерий, которые утратили почти все содержимое кластера dcw (Helicobacter pylori, Mycoplasma gallisepticum, Acholeplasma laidlawii). В то же время часть генов, связанных с делением, обычно располагается вне кластера dcw: например, ftsK, ftsN и некоторые другие (Carrion et al., 1999).
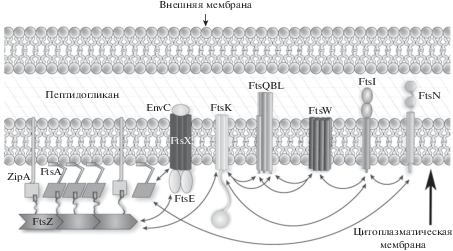
СТРУКТУРА И СОСТАВ ДИВИСОМЫ E. coli
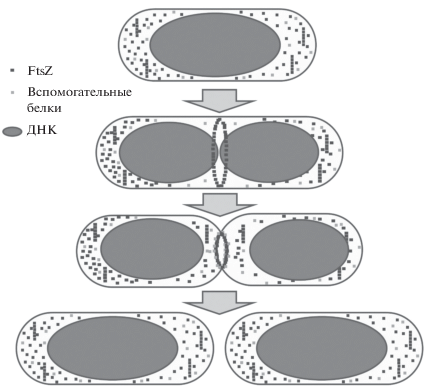
Процессом деления бактерий управляет особая многокомпонентная молекулярная машина – дивисома, которая обычно представляет собой кольцеобразную структуру, обеспечивающую формирование септы (перегородки) между дочерними клетками (Rowlett, Margolin, 2015). Среди белков E. coli, имеющих отношение к процессу деления, порядка двадцати входят в состав дивисомы. На рис. 2 представлена схема, в общих чертах иллюстрирующая процесс бинарного деления бактерий. После репликации ДНК и сегрегации нуклеоидов в освободившемся пространстве посередине клетки происходит формирование Z-кольца (или прото-кольца), состоящего из филаментов (линейных полимеров) и, по-видимому, пучков филаментов ключевого белка деления FtsZ, а также из якорных белков FtsA и ZipA, обеспечивающих прикрепление филаментов FtsZ к внутренней цитоплазматической мембране клетки. Затем Z-кольцо обрастает множеством дополнительных белков, в результате чего формируется зрелая дивисома, которая обеспечивает формирование септы и разделение клетки надвое.
Рис. 2.
Схема бинарного деления бактериальной клетки. В процессе деления происходит репликация ДНК и сегрегация (распределение по будущим дочерним клеткам) нуклеоидов, после чего посередине клетки происходит сборка Z‑кольца, состоящего в основном из полимеров белка FtsZ. Вслед за этим Z-кольцо обрастает вспомогательными белками, которые обеспечивают формирование септы и последующее разделение клеток.
FtsZ считают ключевым белком деления бактериальной клетки. Он первым привлекается в сайт деления и выступает (в комплексе с якорными белками) в качестве своеобразного каркаса для других белков дивисомы. Ген ftsZ впервые был идентифицирован в ходе изучения температурно-чувствительных мутантов штамма K-12 E. coli (Lutkenhaus et al., 1980). До этого мутации, связанные с геном ftsZ, ошибочно относили к гену ftsA. Кроме более точного картирования ftsZ на бактериальной хромосоме, в указанной работе было показано морфологическое различие между клетками штаммов, мутантных по генам ftsA и ftsZ: если в первом случае наблюдали клетки-филаменты с незавершенными септами, то во втором случае септы полностью отсутствовали. Это позволило авторам предположить, что продукт гена ftsZ вовлекается в процесс образования септы на более ранней стадии, чем ftsA, однако реальная ситуация оказалась несколько сложнее. Действительно, в работе 1985 г. было показано, что FtsZ первым среди белков FtsA, FtsI, FtsQ и FtsZ вовлекается в процесс деления и, таким образом, инициирует процесс образования септы (Begg, Donachie, 1985). Однако на сегодняшний день известно, что FtsZ, FtsA и ZipA начинают включаться в Z-кольцо примерно в одинаковое время, т.к. формирование Z-кольца невозможно как без полимеров FtsZ, так и без якорных белков FtsA и ZipA, прикрепляющих Z-кольцо к мембране, функции которых, впрочем, частично перекрываются (Haeusser, Margolin, 2016). В работе 2002 г. было показано, что для сборки и стабилизации Z-кольца в бактерии E. coli необходим хотя бы один из двух белков, ZipA или FtsA, тогда как для дальнейших этапов септообразования и, соответственно, вовлечения в этот процесс других белков (например, FtsK) требуется наличие обоих белков (Pichoff, Lutkenhaus, 2002).
Позже было показано, что во многих видах, в том числе в E. coli, FtsZ является жизненно необходимым белком. Мутации в гене ftsZ E. coli, нарушающие функцию белка, являются летальными для клетки (Beall, Lutkenhaus, 1991; Dai, Lutkenhaus, 1991). Известно, что гомологи FtsZ есть как у грамотрицательных, так и у грамположительных бактерий; также они встречаются в клетках некоторых видов архей и в пластидах эукариот (Erickson et al., 2010; TerBush et al., 2013). Интересно отметить, что в геномах некоторых бактерий (например, хламидий и нескольких микоплазм) ftsZ отсутствует (Bernander, Ettema, 2010; Miyagishima et al., 2014).
В конце 1991 г. впервые методом иммуно-электронной микроскопии было показано, что белок FtsZ в делящихся клетках E. coli концентрируется посередине клетки и образует так называемое Z-кольцо (Bi, Lutkenhaus, 1991). Следует отметить, что FtsZ стал первым элементом цитоскелета, обнаруженным у бактерий. В дальнейшем формирование Z-кольца было подтверждено с использованием флуоресцентной микроскопии, как при помощи иммунофлуоресценции в фиксированных клетках, так и с использованием флуоресцентных белков слияния, экспрессируемых в живых клетках (Addinall et al., 1996; Ma et al., 1996). В настоящее время известно, что линейные полимеры FtsZ каким-то образом собираются в кольцевую структуру на цитоплазматической поверхности внутренней мембраны в месте будущей септы. В ходе формирования септы Z-кольцо сокращается, образуя более плотную структуру (Vedyaykin et al., 2016). Сборка кольца является первым этапом и, одновременно, лимитирующей стадией всего процесса септообразования (Erickson et al., 2010).
Значительный интерес представляет организация протофиламентов FtsZ в составе Z-кольца. Для ее изучения в последние годы были использованы несколько методов, в том числе флуоресцентная микроскопия сверхвысокого разрешения и криоэлектронная томография. Разработка методов микроскопии сверхвысокого разрешения (англ. super-resolution microscopy) стала одним из наиболее важных достижений последнего десятилетия в области флуоресцентной микроскопии. Эти методы активно применяются для исследования внутренней организации бактериальной клетки. Возлагаются надежды на то, что они позволят выявить, каким именно образом протофиламенты FtsZ формируют Z-кольцо, а также прояснить роль FtsZ в процессе деления. Среди этих методов наиболее привлекательными представляются метод локализационной микроскопии SMLM (англ. Single-Molecule Localization Microscopy – одномолекулярная локализационная микроскопия) (Betzig et al., 2006), микроскопии структурированной засветки (SIM) и микроскопии на основе подавления спонтанного испускания (STED). Такие методы были использованы для визуализации FtsZ и других белков дивисомы в клетках E. coli, B. subtilis, Caulobacter crescentus, S. pneumoniae и других видов (Fu et al., 2010; Buss et al., 2013; Holden et al., 2014; Turnbull et al., 2014; Jacq et al., 2015; Lyu et al., 2016; Vedyaykin et al., 2016). Это позволило более тщательно рассмотреть и уточнить организацию дивисомы и проследить за процессом деления бактерий в целом. Данные, полученные с использованием методов флуоресцентной микроскопии, говорят о том, что Z-кольцо представляет собой неоднородную и относительно слабо упорядоченную структуру. Этот результат находится в противоречии с данными, полученными с использованием другого современного метода ‒ криоэлектронной томографии (Szwedziak et al., 2014). Они свидетельствуют о том, что Z-кольцо состоит из выровненных друг относительно друга протофиламентов FtsZ, которые образуют существенно более однородную структуру, чем это было показано методами флуоресцентной микроскопии. В целом, ультраструктура Z-кольца по-прежнему вызывает споры, но при этом понимание того, каким образом оно устроено, имеет большое значение для описания функций FtsZ в составе дивисомы.
В настоящее время существуют две основные модели, описывающие роль Z-кольца в бактериальном делении. Первая модель рассматривает Z‑кольцо как каркас для вспомогательных белков, в особенности тех, которые вовлечены в синтез клеточной стенки. В рамки этой модели хорошо укладывается довольно неоднородная структура Z-кольца, визуализированная с использованием современных методов микроскопии сверхвысокого разрешения (Turnbull et al., 2014; Jacq et al., 2015). Другая модель предполагает существование так называемой сократительной роли Z-кольца, что хорошо подтверждается результатами in vitro исследований. Например, было показано, что FtsZ в искусственных мембранных пузырьках, имитирующих клетку (липосомах) способен формировать Z-кольцо и обеспечивать сжатие мембраны липосомы вплоть до полного разделения (Osawa, Erickson, 2013). Кроме того, эта модель косвенно подтверждается данными криоэлектронной томографии: было показано, что Z‑кольцо состоит из выровненных друг относительно друга филаментов FtsZ и представляет собой практически непрерывную структуру (Szwedziak et al., 2014). В пределах этой непрерывной структуры возможно проскальзывание филаментов FtsZ друг относительно друга, при этом, как предполагают, сокращение Z-кольца оказывается энергетически выгодным, что приводит к формированию сократительной силы, распределенной по всей окружности септы (Horger et al., 2008). Однако в случае неоднородной структуры Z-кольца также возможно формирование сократительной силы, например, за счет изменения кривизны филаментов FtsZ (Erickson, Osawa, 2017). Следует отметить, что в настоящее время наиболее важной ролью Z‑кольца считается именно привлечение в сайт деления вспомогательных белков (Coltharp, Xiao, 2017). Одним из аргументов против сократительной роли Z-кольца выступает величина сократительной силы, генерируемой при его сжатии (обычно не более 100 пН). Это намного меньше, чем требуется для сжатия относительно жесткой оболочки бактериальной клетки (Coltharp, Xiao, 2017). Другой аргумент, ставящий под сомнение роль сократительной силы, связан с тем, что FtsZ покидает сайт деления до полного формирования септы (Soderstrom et al., 2014). Еще один аргумент против такой роли Z-кольца строится на том, что у бактерий, искусственно лишенных клеточной стенки (так называемая L-форма), FtsZ перестает быть жизненно необходимым (Errington, 2017). Тем не менее, результаты, полученные на липосомах, убедительно свидетельствуют в пользу сократительной роли FtsZ в составе Z-кольца, поэтому обе модели могут сосуществовать в бактериальной клетке. Интересным объектом для изучения в данном контексте представляются клетки микоплазм, сохранившие белок FtsZ, но при этом не имеющие клеточной стенки и большинства белков-партнеров FtsZ. Возможно, у микоплазм сократительная роль FtsZ в существенно большей степени выражена, чем, например, у E. coli.
После сборки Z-кольца в дивисому E. coli вовлекается около 20 вспомогательных белков, в том числе FtsB, FtsL и FtsQ, каждый из которых имеет короткий N-концевой цитоплазматический домен, один трансмембранный домен и большего размера периплазматический домен (рис. 3). Точная функция этих белков на настоящий момент до конца неясна, однако предполагают, что они функционируют как связующее звено между Z-кольцом и комплексом белков, синтезирующих пептидогликан в составе клеточной стенки (Lutkenhaus et al., 2012; Haeusser, Margolin, 2016). FtsI и FtsW являются частью этого комплекса. FtsK представляет собой ДНК-транслоказу с трансмембранным доменом, содержащим 4 трансмембранных сегмента, слитых с доменом ДНК-транслоказы длинным линкером. Основная роль FtsK связана с процессом сегрегации ДНК, в том числе с разделением так называемых димеров хромосом, образующихся при гомологической рекомбинации между растущими дочерними цепями ДНК (Steiner et al., 1999). FtsK вместе с комплексом белков ZapA, ZapB и MatP, а также системой нуклеоидной окклюзии (белок SlmA) помогает координировать деление с процессом сегрегации нуклеоидов (Mannik et al., 2017). FtsK взаимодействует с несколькими белками дивисомы, в том числе с FtsZ, FtsB, FtsL и FtsQ. Одна из других возможных ролей FtsK в процессе деления может быть связана с его трансмембранным доменом, который, как считают, может участвовать в разрешении мембраны на финальном этапе цитокинеза (Lutkenhaus et al., 2012). FtsN является последним белком деления, вовлекаемым в дивисому. Его вовлечение в комплекс, по-видимому, является своеобразным сигналом окончания формирования зрелой дивисомы, после чего осуществляются процесс септообразования и разделение дочерних клеток (Lutkenhaus et al., 2012).
СТРУКТУРА И СОСТАВ ДИВИСОМЫ ДРУГИХ ВИДОВ БАКТЕРИЙ
FtsZ является высококонсервативным белком, тогда как другие элементы дивисомы различных бактерий отличаются между собой в большей степени. Отдельно сто́ит рассмотреть структуру дивисомы другого модельного микроорганизма, грамположительной бактерии B. subtilis, относящейся к Firmicutes. Эту ветвь бактерий считают эволюционно близкой к микоплазмам. Одно из важных отличий B. subtilis от E. coli ‒ способность формировать эндоспоры, устойчивые к неблагоприятным условиям окружающей среды. В нормальных условиях B. subtilis делится бинарно, тогда как в стрессовых условиях (например, при недостатке питательных веществ) формирует споры. При этом в оба процесса вовлечен белок FtsZ (Er-rington, Wu, 2017). Интересно отметить, что в ходе споруляции FtsZ формирует на раннем этапе два Z-кольца, одно из которых в дальнейшем разбирается, а другое участвует в образовании эндоспоры.
Как и в случае дивисомы E. coli, в B. subtilis FtsZ прикрепляется к мембране посредством двух якорных белков, один из которых – FtsA – гомологичен соответствующему белку E. coli, тогда как гомолог другого – SepF – отсутствует в E. coli и, по-видимому, является функциональным аналогом белка ZipA (Duman et al., 2013). Функция FtsA не исчерпывается только прикреплением Z-кольца к мембране. FtsA способен in vitro самостоятельно формировать полимерные структуры, а также участвовать в передаче сигналов между различными компонентами дивисомы. В отличие от E. coli, в B. subtilis мутации гена ftsA не являются летальными, хотя и приводят к существенному нарушению деления. SepF, в отличие от белка ZipA E. coli, не имеет трансмембранного домена, вместо него присутствует амфипатическая спираль. Более того, in vitro SepF способен формировать полимеры, в том числе кольца с диаметром около 50 нм. Кроме обеспечения крепления к мембране, SepF стимулирует сборку Z-кольца посредством пучкования протофиламентов FtsZ. Предполагают, что дополнительная связь Z-кольца с мембраной может осуществляться через белок EzrA, трехмерная структура которого позволяет говорить о его родстве с другим эукариотическим белком цитоскелета – спектрином (Errington, Wu, 2017). ZapA является небольшим белком, который стимулирует сборку олигомеров FtsZ. Белок GpsB участвует как в удлинении клеток, так и в клеточном делении. GpsB взаимодействует с основным ферментом, синтезирующим пептидогликан – PBP1. Считают, что он участвует в перемещении этого белка между комплексами удлинения и деления. FtsL – битопический мембранный белок с коротким экстрацитоплазматическим спиралевидным доменом. Он таргетируется несколькими механизмами регулирования клеточного деления. FtsW – интегральный белок; предполагают, что он является гликозилтрансферазой, и, таким образом, вовлечен в синтез клеточной стенки. Pbp2B является пенициллин-связывающим белком, монофункциональной (класс B) транспептидазой, использующейся для синтеза пептидогликана в септальной области.
В целом можно говорить о высокой степени сходства дивисом E. coli и B. subtilis. Следует отметить, что бактерии B. subtilis способны чрезвычайно легко образовывать так называемую L-форму, в которой клетки лишены клеточной стенки. Для перехода B. subtilis в L-форму требуется всего одна или две мутации (Mercier et al., 2014). L-формы требуют осмопротекторной среды, чтобы предотвратить их осмотический лизис; из-за отсутствия жесткой клеточной стенки они характеризуются плеоморфностью. Примечательно, что L-форма может переносить полное удаление многих генов, которые в норме необходимы для роста и деления, включая ftsZ, а также полный набор гомологов mreB. Предполагают, что бактерии в L-форме делятся за счет формирования мембранных выпячиваний, для образования которых требуется лишь усиленный синтез мембраны.
В клетках большинства кокковидных бактерий FtsZ также формирует сократительное кольцо. У клеток некоторых видов, например, у Streptococcus pneumoniae (Jacq et al., 2015), FtsZ влияет не только на септообразование, но и на постоянный рост клеточной стенки, в отличие от палочковидных бактерий, где эту функцию выполняет белок MreB или его гомологи (Ouzounov et al., 2016). В таких случаях Z-кольца присутствуют в клетке в течение всего жизненного цикла бактерии; более того, иногда встречаются двойные Z-кольца. В названной работе использование микроскопии сверхвысокого разрешения позволило впервые продемонстрировать утолщение Z-кольца в процессе цитокинеза.
Другой интересный пример организации процесса деления можно наблюдать в клетках актиномицетов – бактерий, формирующих мицелий, подобно грибам. В отличие от большинства бактерий, у актиномицетов (например, рода Streptomyces) деление не является жизненно важным процессом, так как оно не требуется во время вегетативного роста в форме гиф (Jakimowicz, van Wezel, 2012). Однако деление, основанное на формировании Z-кольца, является совершенно необходимым для споруляции актиномицетов, и механизм образования септы очень похож на таковой у палочковидных и кокковидных бактерий.
Совершенно уникальный механизм, обеспечивающий деление вдоль, а не поперек клетки, демонстрирует один из симбионтов червей – бактерия “Candidatus Thiosymbion hypermnestrae” (Leisch et al., 2016). Этот симбионт живет на поверхности эпителия нематод, прикрепляясь к нему одним из своих полюсов. Организация деления вдоль длинной оси клетки является выгодной для бактерии, потому что позволяет дочерним клеткам оставаться прикрепленными к поверхности организма-хозяина.
Кроме бактерий, обладающих “полноценной” дивисомой, существуют виды, вовсе лишенные гена ftsZ. Чрезвычайно интересный механизм деления демонстрируют, например, хламидии (Liechti et al., 2014). Эти грамотрицательные облигатные внутриклеточные паразиты практически лишены клеточной стенки. Некоторые из хламидий являются клинически важными патогенами, вызывающими среди прочих заболеваний трахому, инфекции мочеполовых путей и пневмонию. Хламидии делятся бинарно, однако при этом механизм деления атипичен и не зависит от гомологов FtsZ. Долгое время считалось удивительным, что деление хламидий ингибируется производными пенициллина, вызывая образование аберрантных форм, способных выжить в присутствии антибиотика (Jacquier et al., 2015). Парадокс чувствительности хламидий к пенициллину в отсутствие детектируемого пептидогликана (клеточной стенки) был назван хламидийной аномалией. Недавние исследования показали, что пептидогликан все же экстрагируется из клеток по крайней мере одного из видов Chlamydiales, при этом типичные компоненты пептидогликана накапливаются в области сайта деления хламидий. Вероятно, хламидии синтезируют клеточную стенку только во время деления (Pilhofer et al., 2013). В настоящее время обсуждается возможность участия в формировании дивисомы таких белков хламидий, как MreB (в клетках E. coli и B. subtilis данный белок направляет синтез клеточной стенки в ходе роста клетки) и RodZ (участвует в поддержании формы клетки E. coli и напрямую взаимодействует с MreB). Тем не менее, механизмы деления хламидий на настоящий момент остаются загадочными и требуют дальнейшего изучения.
СТРУКТУРА И СВОЙСТВА БЕЛКА FtsZ
В основе формирования Z-кольца лежит способность FtsZ полимеризоваться, подобно другим белкам цитоскелета. Установлено, что FtsZ проявляет ГТФазную активность, сопряженную с полимеризацией, и, по-видимому, является эволюционным предшественником тубулина, обладая довольно высокой гомологией по отношению к этому белку (de Boer et al., 1992; RayChaudhuri, Park, 1992). В 1998 г. была опубликована статья, в которой описывалась кристаллическая структура FtsZ одного из прокариотических организмов – археи Methanococcus jannaschii (Lowe, 1998). Эти данные дополнительно подтвердили гипотезу о родстве FtsZ и тубулина: оказалось, что, несмотря на незначительную гомологию первичной структуры, эти два белка имеют похожие вторичную и третичную структуры. В настоящее время известна кристаллическая структура FtsZ нескольких видов бактерий, включая E. coli. Во всех вариантах FtsZ демонстрирует высокое сходство третичной структуры между собой: N-концевой (ГТФ-связывающий) и C-концевой домены соединены спиралью H5; на C-конце присутствует неструктурированный домен, основная функция которого, по-видимому, заключается в связывании белка FtsZ с многочисленными белками-партнерами (Gardner et al., 2013).
Многие свойства FtsZ, в том числе его способность к полимеризации, стали известны благодаря in vitro исследованиям. В частности, было показано, что в присутствии ГТФ белок FtsZ E. coli способен формировать протяженные филаменты (Mukherjee, Lutkenhaus, 1994). Аналогичным образом были исследованы мутантные белки FtsZ. Важно отметить, что концентрация FtsZ, использованная в работе in vitro (6 мкМ) была ниже оценочной концентрации FtsZ in vivo (10 мкМ). Это позволило авторам предположить, что в клетке FtsZ также способен к самостоятельной полимеризации.
Другой значительный шаг в понимании механизмов работы FtsZ связан с обнаружением способности полимеров данного белка генерировать силу, которая может использоваться для сокращения септы. В работе 2008 г. удалось создать FtsZ, способный самостоятельно связываться с мембраной (без таких посредников, как ZipA и FtsA): к C-концу молекулы FtsZ была добавлена амфипатическая спираль, напрямую взаимодействующая с липидным бислоем (Osawa et al., 2008). Кроме того, полученный белок был слит с флуоресцентным белком с целью визуализации структур, формируемых FtsZ. Затем с использованием суспензии из липосом (искусственных мембранных пузырьков), белка слияния и ГТФ были сформированы вытянутые везикулы, моделирующие мембрану бактерий. В некоторых везикулах FtsZ образовывал кольца на наружной стороне. Кроме того, молекулы FtsZ проникали внутрь везикул в количестве, достаточном для самостоятельного формирования множественных колец с их внутренней стороны. Эти кольца затем спонтанно сливались в более плотные кольца – аналог Z-колец в делящихся клетках бактерий. Самое удивительное, что сформированные кольца демонстрировали способность к сжатию, что приводило к образованию у везикул структур, напоминающих формирующиеся септы бактерий, хотя продемонстрировать полноценное сокращение, приводящее к делению, авторам не удалось. Таким образом, было показано, что FtsZ в составе Z-кольца без каких-либо дополнительных белков способен генерировать сократительную силу, достаточную для сжатия мембраны. Позже этой же группе исследователей удалось продемонстрировать, что FtsZ с амфипатической спиралью, взаимодействующей с мембраной, в одиночку не способен закончить деление везикул, а без нее, но в присутствии FtsA* (гиперфункционального мутантного FtsA, способного компенсировать отсутствие белка ZipA), способен обеспечить образование законченной перегородки между “дочерними” везикулами (Osawa, Erickson, 2013).
МЕХАНИЗМЫ РЕГУЛЯЦИИ БАКТЕРИАЛЬНОГО ДЕЛЕНИЯ
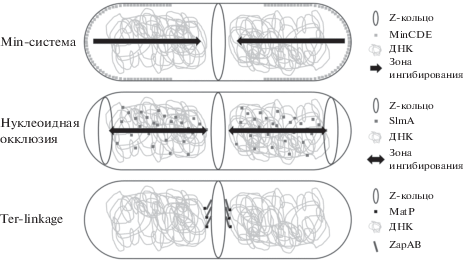
В настоящее время известно несколько механизмов регуляции бактериального деления, связанных с белком FtsZ. Механизмы отрицательной регуляции (Min-система, нуклеоидная окклюзия) связаны с ингибированием полимеризации FtsZ в любом месте клетки, кроме сайта деления. Механизмы положительной регуляции (например, Ter-linkage), наоборот, способствуют сборке филаментов FtsZ в области будущей септы. Все они в совокупности влияют на правильное позиционирование Z-кольца и обеспечивают согласование цитокинеза с другими процессами в клетке, например, с репликацией и сегрегацией ДНК, а также с механизмом, блокирующим деление при SOS-ответе (рис. 4).
Рис. 4.
Системы позиционирования сайта деления в клетках E. coli. Представлены основные компоненты каждой из систем, а также их влияние в целом на позиционирование Z-кольца. Min-система предотвращает формирование Z-кольца вблизи полюсов, ограничивая его положение серединой клетки; нуклеоидная окклюзия ингибирует сборку Z-кольца вблизи нуклеоидов; Ter-linkage является единственным механизмом положительной пространственной регуляции сборки Z-кольца вблизи региона ter бактериальной хромосомы, между нуклеоидами будущих дочерних клеток.
Полвека назад были открыты мутации, приводящие к формированию в популяции E. coli так называемых мини-клеток (Adler et al., 1967). Авторы предположили, что в норме в клетке существует некоторый механизм (позже названный Min-системой), препятствующий образованию септы вблизи полюсов клетки. Действительно, впоследствии было показано, что Min-система является механизмом отрицательной регуляции и напрямую ингибирует полимеризацию FtsZ (Hu et al., 1999). При этом регуляция септообразования осуществляется в пространстве и времени, согласуя цитокинез с размером клетки: деление не начинается, пока клетка не достигла определенной длины.
В 1999 г. метод флуоресцентной микроскопии в сочетании с использованием белков слияния позволил совершить прорыв в понимании молекулярного механизма работы Min-системы (Hu, Lutkenhaus, 1999). Было показано, что регуляция положения Z-кольца в клетке E. coli основана на периодической осцилляции белка MinC (ингибитора сборки Z-кольца) между полюсами клетки под влиянием двух других белков – MinD и MinE, в результате чего эффективная концентрация MinC оказывается минимальной посередине бактериальной клетки, где и формируется Z-кольцо (рис. 5). Следует отметить, что именно возможность использования данного метода в экспериментах in vivo позволила наблюдать осцилляции. Расшифровка механизма работы Min-системы сделала ее главным кандидатом на роль регулятора, определяющего положение Z-кольца в клетке. Но, в целом, это справедливо лишь для нормально делящихся клеток. Другие системы пространственной (и временной) регуляции цитокинеза начинают играть существенную роль, в основном, в стрессовых условиях (Lutkenhaus, Du, 2017). Кроме регуляции пространственного положения Z-кольца, Min-система может влиять на процесс сегрегации нуклеоидов. Показано, что в популяции клеток с инактивированной Min-системой имеются дефекты в разрешении димеров хромосом (Lutkenhaus, Du, 2017).
Рис. 5.
Схема, отражающая динамическое поведение белков MinC, MinD и MinE (осцилляции от одного полюса к другому), входящих в состав Min-системы E. coli. При связывании АТФ конформация белка MinD меняется таким образом, что он связывается с цитоплазматической мембраной вблизи одного из полюсов клетки, дополнительно привлекая туда белок MinC – ингибитор FtsZ. Кроме того, MinD связывается с белком MinE, стимулируя сборку MinE кольца вблизи полюса клетки. MinE индуцирует АТФазную активность MinD, что приводит к разборке полярной структуры, формируемой белками MinC и MinD.
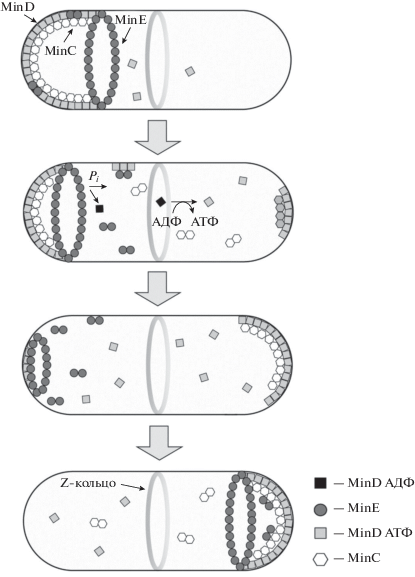
В клетках B. subtilis Min-система образована двумя белками, MinC и MinD, при этом они статично локализуются на полюсах, а не осциллируют, как в случае E. coli (Marston et al., 1998). Эффект работы Min-системы от этого не меняется. Min-система присутствует в клетках и других палочковидных бактерий (например, Neisseria spp., Aquifex spp. и др.). Но, например, в клетках Caulobacter crescentus отсутствуют гомологи известных белков Min-системы. Вместо них выявлен белок MipZ, чьи функции напоминают работу MinD, однако в отличие от последнего, MipZ напрямую ингибирует полимеризацию FtsZ вблизи полюсов клетки (Thanbichler, Shapiro, 2006). Во многих бактериях Min-система отсутствует, что обычно приводит к несимметричному делению или требует участия других регуляторов (Rowlett, Margolin, 2013).
Нуклеоидная окклюзия (НО) – это механизм отрицательной регуляции септообразования, препятствующий сборке функционально активной дивисомы над нуклеоидом с целью избежать разрывов бактериальной хромосомы (Bernhardt, de Boer, 2005) (рис. 4). Как и Min-система, НО участвует не только в пространственной, но и во временной регуляции сборки Z-кольца, то есть согласует цитокинез с репликацией ДНК и сегрегацией нуклеоидов. Эта система начинает оказывать заметное влияние на процесс деления в стрессовых условиях, например, в состоянии SOS-ответа. Само явление нуклеоидной окклюзии (англ. nucleoid occlusion) было известно достаточно давно, однако его молекулярный механизм был установлен лишь в 2004 г. в клетках B. subtilis (Wu, Errington, 2004). Авторы предположили, что белок YyaA, ингибирующий полимеризацию FtsZ и сборку Z-кольца, неспецифично связывается с ДНК, в результате чего формирование Z-кольца оказывается невозможным над нуклеоидом. Позже было показано, что все же существуют сайты связывания этого белка, относительно равномерно распределенные по бактериальной хромосоме (Tonthat et al., 2011).
В 2005 г. был сделан большой шаг в понимании принципов функционирования механизма НО у E. coli (Bernhardt, de Boer, 2005). Двойные мутанты с дефектами в работе Min-системы и НО оказывались неспособными к делению и образовывали вытянутые формы с нетипичным распределением FtsZ в клетке. В результате был открыт белок Sl-mA, который, как и YyaA B. subtilis, ассоциирован с ДНК и ингибирует сборку Z-кольца над хромосомой. В отсутствие ДНК SlmA слабо ингибирует полимеризацию FtsZ, но эта активность резко усиливается при взаимодействии с молекулой ДНК, содержащей сайт связывания SlmA (Cho et al., 2011). В начале цитокинеза редуплицированные нуклеоиды разделяются и смещаются к полюсам клетки (вместе с ингибитором септообразования SlmA), освобождая, таким образом, в ее центральной области место для сборки Z-кольца.
Так, на примере двух видов бактерий был установлен механизм НО – явления, которое сегодня рассматривается в качестве второго по важности после Min-системы механизма регуляции положения Z-кольца в бактериальной клетке. Интересно, что в работе данного механизма в E. coli и B. subtilis задействованы два неродственных белка, хотя принципы работы систем довольно близки; это говорит, по-видимому, о независимом возникновении данных систем пространственно-временной регуляции. Механизм НО присутствует и в клетках других видов бактерий (Wu, Errington, 2011), в том числе и у кокковидных бактерий, у которых отсутствует Min-система. В этих клетках НО играет основную роль отрицательного регулятора позиционирования Z-кольца.
Было показано, что в E. coli даже при выключении двух отрицательных регуляторных систем (Min-системы и нуклеоидной окклюзии) в определенных условиях Z-кольцо все равно занимает правильную позицию между нуклеоидами с достаточно хорошей точностью, что косвенно указывает на существование дополнительного механизма пространственной регуляции деления (Mannik et al., 2012). Таким механизмом может быть связь Z-кольца с терминальной областью хромосомы (англ. Ter-linkage) (Mannik, Bailey, 2015). В отличие от нуклеоидной окклюзии и Min-системы, Ter-linkage является положительным регулятором сборки Z-кольца (рис. 4). В основе работы данного регулятора лежит топологическая связь Ter-региона хромосомы с дивисомой. Белок MatP связывается с особыми повторяющимися последовательностями ДНК, находящимися только в области Ter-региона. С белком MatP, в свою очередь, связываются белки ZapA и ZapB, которые стимулируют полимеризацию FtsZ, в том числе пучкование однонитевых филаментов. Удаление одного из компонентов Ter-linkage нарушает точность размещения Z-кольца посередине клетки и резко увеличивает частоту, с которой формируются Z-кольца вблизи полюсов в клетках, в которых нарушена работа Min-системы и механизма НО. По-видимому, Ter-linkage помогает позиционированию Z-кольца, способствуя его локализации посередине клетки (Lutkenhaus, Du, 2017).
Cистемы, отвечающие за пространственную регуляцию сборки структур FtsZ, присутствуют в клетках подавляющего большинства видов бактерий, однако механизмы их работы и белки, входящие в их состав, неодинаковы. В последнее время идентифицированы несколько белков – положительных регуляторов образования Z-кольца у бактерий, не имеющих НО и/или Min-систему. Эти белки локализуются посередине клетки и/или между нуклеоидами и способствуют формированию Z-колец в данной области. Одним из первых обнаруженных положительных регуляторов образования Z-кольца является система, состоящая из пары белков SsgA-SsgB, функционирующая в клетках Streptomyces coelicolor (Willemse et al., 2011). Эта бактерия способна расти вегетативно в форме мицелия. Мутации, приводящие к инактивации FtsZ в клетках S. coelicolor, не являются летальными. В результате было показано, что комплекс SsgA-SsgB локализуется между нуклеоидами независимо от FtsZ, то есть именно этот комплекс является топологическим маркером для сборки Z-кольца. SsgA рекрутирует SsgB в области между нуклеоидами, после чего SsgB, вероятно, способствует полимеризации FtsZ, а также служит в качестве якорного белка для Z-колец, связывая их с мембраной.
Другой положительный регулятор сборки Z‑кольца, белок PomZ, является АТФазой семейства ParA и участвует в позиционировании Z-кольца в одном из представителей δ-протеобактерий, известном своей способностью к социальному поведению, в том числе формированию плодовых тел – Myxococcus xanthus (Treuner-Lange et al., 2013). Бактерии M. xanthus, у которых отсутствует PomZ, демонстрируют классические признаки аберрантного позиционирования Z-кольца, включая филаментацию и образование мини-клеток. PomZ локализуется посередине клетки в отсутствие FtsZ, поэтому, как и комплекс SsgA-SsgB, считается пространственным регулятором цитокинеза.
В клетках Streptococcus pneumoniae трансмембранный белок, называемый LocZ (англ. Localizing at midcell of FtsZ) или MapZ (англ. Mid-cell-anchored protein Z), также локализуется посередине клетки и способствует позиционированию Z-кольца (Fleurie et al., 2014). Клетки, лишенные LocZ/MapZ, жизнеспособны, но имеют дефекты формы; встречаются и мини-клетки S. pneumoniae. MapZ/LocZ локализуется в виде колец на сайтах деления до привлечения туда FtsZ. Было показано, что MapZ напрямую взаимодействует с FtsZ. После формирования Z-кольца посередине клетки, MapZ/LocZ постепенно перемещается в будущие сайты деления. В совокупности эти данные указывают на участие LocZ/MapZ в сборке структур FtsZ посередине клетки. Более того, MapZ формирует стабильную кольцевую структуру, которая действует как трек для тредмиллинга FtsZ в клетках стрептококков (Li et al., 2018). Гомологи LocZ/MapZ присутствуют в стрептококках, лактококках и энтерококках. Вероятно, в клетках этих микроорганизмов они также принимают участие в позиционировании Z-кольца.
В настоящее время установлена роль белка FtsZ при SOS-ответе – стрессовом состоянии бактериальной клетки, при котором она перестает делиться вследствие повреждения ДНК (Lutkenhaus, 1983). Явление SOS-ответа было открыто в середине XX века, когда было показано, что после облучения клеток E. coli ультрафиолетом происходит активация некоего механизма, который приводит к филаментации клеток (вследствие остановки их деления) и увеличению скорости рекомбинации не только бактериальной, но и вирусной ДНК (Weigle, 1953; Janion, 2008). В настоящее время известно, что при повреждении ДНК белок RecA в комплексе с однонитевой ДНК, появляющейся при возникновении разрывов ДНК, осуществляет протеолиз белка LexA, который в результате покидает операторную область генов SOS-ответа, в результате чего происходит активация их экспрессии. Как отмечено выше, при наступлении SOS-ответа происходит блокирование процесса деления, что является защитным механизмом клетки и позволяет устранить повреждения ДНК. Было показано, что среди генов, экспрессирующихся при SOS-ответе, представлен ген белка-ингибитора SulA, блокирующего деление при активации SOS-ответа; мишенью для SulA является непосредственно белок FtsZ (Holland, Jones, 1985). Механизм ингибирования заключается в связывании молекулами SulA молекул белка FtsZ. Считают, что в результате такого связывания происходит истощение пула свободных мономеров FtsZ, способных участвовать в циклах полимеризации/деполимеризации, что эквивалентно снижению эффективной концентрации FtsZ в клетке и приводит к разборке полимеров FtsZ, в том числе Z-кольца. Следует отметить, что механизмы активации и развития SOS-ответа неплохо изучены, в отличие от процесса восстановления деления клеток после окончания этого состояния. Между тем изучение этого процесса представляется важным, так как SOS-ответ в настоящее время рассматривают в качестве одного из ключевых механизмов возникновения устойчивости к антибиотикам (Qin et al., 2015). Блокирование активации SOS-ответа, как и восстановления клеток после этого состояния, представляются перспективными способами контроля бактериальных инфекций.
МЕХАНИЗМЫ ДЕЛЕНИЯ МИКОПЛАЗМ
Если механизмы деления E. coli и некоторых других видов бактерий довольно хорошо изучены, то с представителями класса Mollicutes, собирательно называемыми микоплазмами, ситуация обстоит сложнее. Информация о механизмах деления микоплазм носит в значительный степени гипотетический характер. Микоплазмы – самые маленькие бактерии, способные к росту на искусственных питательных средах (Browning, Citti, 2014; Борхсениус и соавт., 2016). Они являются патогенами эукариот и вызывают серьезные заболевания человека, животных и растений. Mycoplasma hominis, Ureaplasma urealiticum, M. genitalium могут вызывать заболевания мочеполовой системы человека; M. pneumoniae является возбудителем одной из форм атипичной пневмонии; M. gallisepticum и M. mycoides вызывают респираторные заболевания птиц; Acholeplasma laidlawii и различные виды фитоплазм поражают растения. В целом микоплазмы являются высокоспециализированными факультативными паразитами. Тем не менее, описаны случаи передачи инфекции между различными видами животных и даже от животных к человеку. Кроме того, микоплазмы являются одними из главных контаминантов клеточных культур (Windsor et al., 2010).
В отличие от вирусов, микоплазмы способны к самостоятельному росту, хотя сильная редуцированность геномов делает их зависимыми от метаболических путей хозяина. С другой стороны, микоплазмы лишены клеточной стенки, которая является характерной чертой подавляющего большинства бактерий. Впрочем, хламидии (Liechti et al., 2014) и L-формы “классических” видов бактерий, в том числе E. coli и B. subtilis (Errington, 2017) также лишены клеточной стенки. Клетки микоплазм характеризуются малым размером (обычно около 0.5‒1.0 мкм) и большим разнообразием форм. Например, большинство клеток в популяции A. laidlawii имеют форму, близкую к шарообразной; M. gallisepticum при прикреплении к субстрату принимают грушевидную форму; клетки Spiroplasma citri представляют собой спираль (Browning, Citti, 2014). Даже в пределах одного вида для микоплазм характерен значительный полиморфизм. Многие микоплазмы (например, Mycoplasma mobile, M. gallisepticum), будучи прикрепленными к субстрату, обладают подвижностью, которая основана на активности так называемой терминальной органеллы, состоящей из адгезинов и цитоскелет-подобных белков (Mizutani et al., 2018).
Сравнительно простая организация клеток позволяет рассматривать микоплазмы в качестве модели “минимальной” клетки. Микоплазмы произошли, по-видимому, от грамположительных бактерий, их клостридийной ветви (Борхсениус и соавт., 2016). Считают, что у микоплазм существенно редуцирован набор генов благодаря паразитическому образу жизни. Лаборатория Крейга Вентера известна несколькими исследованиями, посвященными созданию клетки с минимальным геномом. В 2010 г. в этой лаборатории впервые была получена клетка M. mycoides с полностью de novo синтезированным геномом (Gibson et al., 2010). Впоследствии геном M. mycoides был успешно редуцирован примерно в два раза, до 531 000 п.о., что даже меньше, чем размер самого маленького известного бактериального генома M. genitalium (примерно 583 000 п.о.) (Hutchison et al., 2016). Это позволило авторам не только получить клетку с наименьшим геномом, но и переосмыслить значимость многих генов, считавшихся жизненно необходимыми, в том числе ftsZ, который также был удален.
Механизмы деления хорошо изученных видов бактерий, включая E. coli, предполагают формирование дивисомы, основной функцией которой считают синтез и ремоделирование клеточной стенки в области септы. Даже в клетках хламидий во время цитокинеза происходит синтез септального пептидогликана (Liechti et al., 2014). Каркасом для дивисомы в большинстве случаев выступает Z-кольцо, образованное полимерами белка FtsZ. Z-кольцо предположительно является источником сократительной силы. Так как ген белка FtsZ присутствует в большинстве видов микоплазм, априори лишенных клеточной стенки, можно предположить, что единственной возможной ролью FtsZ в микоплазменной клетке является именно сокращение мембраны в сайте деления. Действительно, для M. hominis было показано, что FtsZ локализуется в области перетяжки между делящимися клетками (Vishnyakov et al., 2009). Для клеток Spiroplasma poulsonii также было продемонстрировано, что белок FtsZ локализуется в области перетяжки, но при этом каким-то образом обеспечивает деление вдоль клетки, что редко встречается у бактерий (Ramond et al., 2016). Вовлеченность белка FtsZ в процесс деления в названной работе была дополнительно подтверждена использованием специфичного по отношению к FtsZ антибиотика, который действительно приводил к замедлению цитокинеза. Впрочем, механизм вовлечения FtsZ в процесс деления S. poulsonii остается неясным. В целом, данных о структурах, формируемых белком FtsZ в клетках микоплазм, на сегодняшний день явно недостаточно для каких-либо далеко идущих выводов о его функции в микоплазменной клетке, так как сократительная роль Z-кольца в бактериальной клетке до сих пор является предметом дискуссии. Тем не менее, на вероятной активной роли FtsZ в разделении клеток микоплазм может базироваться одна из гипотетических моделей, описывающих цитокинез микоплазменной клетки (рис. 6).
Рис. 6.
Гипотетические модели деления клеток представителей класса Mollicutes. Первая модель предполагает формирование классического Z-кольца; вторая модель основывается на подвижности некоторых видов микоплазм, благодаря чему происходит “растаскивание” дочерних клеток с последующим “схлопыванием” мембран на образующейся перетяжке; третья модель связана с вероятным наличием у микоплазм механизма избыточного синтеза мембран, стимулирующего неравномерное деление клеток наподобие процесса, характерного для L-форм бактерий.
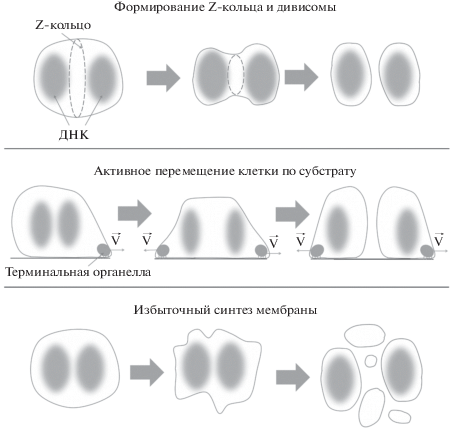
У некоторых видов микоплазм (например, M. mobile, U. urealiticum) ген ftsZ вообще отсутствует. Более того, показано, что ftsZ в микоплазменной клетке можно удалить, хотя это и приводит к замедлению деления и/или нарушению морфологии клеток (Lluch-Senar et al., 2010). Изначально предполагали, что не только ftsZ, но и другие гены, входящие в состав кластера dcw микоплазм, являются жизненно необходимыми, так как не удавалось обнаружить встраивание глобальных транспозонов в этот кластер (Hutchison et al., 1999). Однако в 2010 г. из генома M. genitalium удалось выбить ген ftsZ (Lluch-Senar et al., 2010). При этом мутантные клетки оказались не только жизнеспособными, но и демонстрировали кинетику роста, аналогичную клеткам дикого типа. У M. mycoides также удалось удалить ген ftsZ, хотя морфология и, предположительно, процесс деления клеток оказались при этом серьезно нарушены (Hutchison et al., 2016). Вышеописанные наблюдения ставят под сомнение роль FtsZ в делении микоплазм, а также делают необходимым поиск возможных альтернативных механизмов цитокинеза.
В качестве альтернативы “классическому” делению может выступать механизм, основанный на подвижности некоторых видов микоплазм. Среди аргументов в его пользу используется, в частности, синтетическая летальность механизма подвижности в штамме M. genitalium, лишенном гена ftsZ. В клетках этого штамма гораздо реже, чем в штамме дикого типа, накапливаются мутации, приводящие к инактивации подвижности (Balish, 2014). Предполагается, что во время цитокинеза происходит дупликация терминальной органеллы, после чего две дочерние терминальные органеллы двигаются в противоположных направлениях, в результате чего клетка расщепляется надвое (рис. 6). Впрочем, такой механизм не может являться общим для всех микоплазм, так как существуют микоплазмы, не обладающие подвижностью вкупе с отсутствием в клетке FtsZ (например, U. urealyticum, U. parvum), поэтому должны существовать и другие механизмы, обеспечивающие цитокинез у таких клеток.
Здесь мы подходим к третьей гипотетической модели деления микоплазменных клеток, которая основывается на данных, полученных для делящихся L-форм бактерий. Деление L-форм осуществляется за счет механизма избыточного синтеза мембран, стимулирующего неравномерное разделение клеток (Mercier et al., 2013). Механизмы деления, характерные для L-форм бактерий, могут быть применимы и к микоплазмам (рис. 6), хотя в этом контексте выглядит удивительным тот факт, что большинство микоплазм сохранили ген ftsZ. Данная модель пока воспринимается с некоторой долей скептицизма (Errington, 2017) и требует дополнительного подтверждения.
FtsZ КАК МИШЕНЬ ДЛЯ НОВЫХ АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ
Быстрое появление у клинически значимых видов бактерий устойчивости к используемым антибиотикам делает жизненно необходимой разработку новых антибактериальных препаратов. В последние несколько лет FtsZ, ключевым образом влияющий на деление бактериальной клетки, рассматривают в качестве перспективной мишени для антибиотиков (Panda et al., 2016). В настоящее время описаны как природные, так и синтетические ингибиторы бактериального деления, таргетирующие белок FtsZ.
Известно, что ген ftsZ является жизненно необходимым для многих видов бактерий, включая E. coli. При этом белки FtsZ бактерий и тубулины эукариот обладают высоким уровнем структурной гомологии. Тубулин является молекулярной мишенью для антимитотических лекарственных веществ (таксол, винкристин и винбластин), которые широко используются в противораковой терапии. Эти вещества ингибируют функцию тубулинов посредством связывания с хорошо охарактеризованными участками тубулиновой молекулы. Считается, что подобные вещества могут быть использованы и для подавления функции FtsZ.
Было обнаружено несколько природных алкалоидов – ингибиторов FtsZ (Hurley et al., 2016). Сангвинарин представляет собой полициклический алкалоид, который подавляет сборку протофиламентов FtsZ посредством блокирования его полимеризации. Этот алкалоид также ингибирует эукариотический тубулин, что усложняет его использование в качестве антибиотика. Берберин является структурно сходным с сангвинарином алкалоидом, ингибирует ГТФазную активность FtsZ и влияет на его полимеризацию. Предполагают, что он связывается с молекулой FtsZ вблизи кармана связывания ГТФ. Взаимодействие берберина с тубулином не показано, однако он связывается со множеством других белков в клетках эукариот, что также осложняет его использование в качестве антибактериального препарата.
Другая группа ингибиторов FtsZ – полифенолы (Hurley et al., 2016). Плюмбагин ингибирует ГТФазную активность FtsZ. Предсказанный сайт связывания плюмбагина расположен вблизи C-концевого домена FtsZ в области спирали H7, пространственно удаленной от ГТФ-связывающего домена, что вызывает вопросы по поводу механизма его действия. Ресвератрол также известен своей антимикробной активностью, что объясняется, в том числе подавлением синтеза FtsZ на уровне транскрипции. Семейство хризофентинов ингибирует ГТФазную активность FtsZ E. coli и Staphylococcus aureus; молекулярное моделирование (докинг) показало, что эти соединения, взаимодействуя с FtsZ, закрывают большую часть сайта связывания ГТФ в молекуле белка.
Еще одна группа природных ингибиторов FtsZ – фенилпропаноиды и терпеноиды. Предполагается, что почти все фенилпропаноиды, описанные как ингибиторы FtsZ, взаимодействуют, по меньшей мере, с одним остатком петли T7 молекулы FtsZ (Hurley et al., 2016). Фенилакриламид обладает антибактериальной активностью против S. aureus и Streptococcus pyogenes. Производные ванилина 3а и 4u ингибируют FtsZ Mycobacterium tuberculosis. Скополетин – аналог кумарина – подавляет ГТФазную активность и сборку FtsZ в протофиламенты. Куркумин, напротив, увеличивает ГТФазную активность и тем самым дестабилизирует процесс полимеризации FtsZ, снижая время жизни полимеров.
Другой интересный механизм ингибирования FtsZ демонстрируют антибиотики природного происхождения – ацилдепсипептиды (Hurley et al., 2016). Механизм их действия основан на неконтролируемой активации протеазы ClpP грамположительных бактерий; в норме ClpP участвует в деградации FtsZ, поддерживая его концентрацию в клетке на необходимом уровне. Биохимические и структурные данные показывают, что ацилдепсипептиды взаимодействуют с АТФазным доменом ClpP, что, в конечном итоге, приводит к неконтролируемой протеолитической активности этой протеазы.
Кателин-подобный антимикробный пептид (CRAMP) (Panda et al., 2016) играет важную роль в качестве защитного механизма млекопитающих. Недавно было показано, что часть пептида CRAMP (GEKLKKIGQKIKNFFQKL) ингибирует деление клеток B. subtilis и E. coli путем связывания с молекулой FtsZ. CRAMP нарушает вторичную структуру FtsZ, связываясь c C-концевым доменом вблизи петли T7. При этом CRAMP ингибирует ГТФазную активность FtsZ in vitro, а также подавляет образование и нарушает локализацию Z-кольца в клетках B. subtilis.
Кроме природных ингибиторов, описано несколько синтетических веществ, имеющих своей мишенью FtsZ. Например, вещество PC190723 ингибирует пролиферацию S. aureus in vitro с минимальной ингибирующей концентрацией (МИК) около 1 мкг/мл (Stokes et al., 2013). Биохимические, структурные, генетические данные позволяют заключить, что PC190723 и его аналоги действительно таргетируют FtsZ. Довольно мощный ингибитор FtsZ, производный от тиазола оранжевого, изобретательно названный “Вещество 1” (Sun et al., 2017), характеризуется широким спектром антибактериальной активности, подавляя рост метициллин-устойчивого золотистого стафилококка, ванкомицин-резистентного энтерококка и клинически значимого штамма E. coli NDM-1. Результаты in vitro и in vivo исследований показали, что это соединение нарушает динамическую сборку белка FtsZ в филаменты и образование Z-кольца за счет стимулирования полимеризации FtsZ. Более того, “Вещество 1” не проявляет активности в отношении тубулина и демонстрирует низкую цитотоксичность на клетках млекопитающих. МИК для разных видов бактерий оценивается на уровне 1 мкг/мл. Для сравнения, в отношении золотистого стафилококка ампициллин имеет МИК около 4 мкг/мл, ципрофлоксацин – 0.5 мкг/мл, тетрациклин – 2 мкг/мл (Rubin et al., 2011). Таким образом, представленные здесь ингибиторы FtsZ демонстрируют антибактериальную активность, сопоставимую с таковой широко используемых антибиотиков.
ЗАКЛЮЧЕНИЕ
Механизмы деления клеток большинства бактерий основаны на формировании белком FtsZ консервативной структуры – Z-кольца. Основной ролью FtsZ считается привлечение в сайт деления вспомогательных белков, что приводит к образованию дивисомы, осуществляющей процесс цитокинеза. Большая часть информации о бактериальном делении получена при изучении модельного объекта E. coli, однако за последнее время были получены новые интересные данные о процессе деления клеток других видов бактерий, которые вносят существенный вклад в понимание механизмов бактериального деления в целом. Например, были исследованы бактерии, не имеющие канонического Z-кольца, а также хламидии, в которых дивисома образуется и без белка FtsZ. Во многом загадочным представляется процесс деления клеток микоплазм. В связи с тем, что бактериальный аппарат деления рассматривают в качестве мишени для новых антибиотиков, его исследование еще долго будет считаться одной из приоритетных задач современной молекулярной микробиологии.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена за счет гранта Российского научного фонда (проект № 17-74-20065).
Список литературы
Борхсениус С.Н., Чернова О.А., Чернов В.М., Вишняков И.Е. Микоплазмы в биологии и медицине начала XXI века. СПб.: Наука, 2016. 333 с.
Вишняков И.Е., Борхсениус С.Н. Белок FtsZ и цитокинез у бактерий // Цитология. 2007. Т. 49. № 5. С. 421‒429.
Vishnyakov I.E., Borchsenius S.N. FtsZ and bacterial cell division // Cell and Tissue Biology. 2007. V. 1. № 3. P. 206‒214.
Вишняков И.Е., Борхсениус С.Н., Басовский Ю.И., Левицкий С.А., Лазарев В.Н., Снигиревская Е.С., Комиссарчик Я.Ю. Локализация белка деления FtsZ в клетках микоплазмы // Цитология. 2009. Т. 51. № 3. С. 247–256.
Vishnyakov I.E., Borchsenius S.N., Basovskii Y.I., Levitskii S.A., Lazarev V.N., Snigirevskaya E.S., Komissarchik Y.Y. Loca-lization of division protein FtsZ in Mycoplasma hominis // Cell and Tissue Biology. 2009. V. 3. № 3. P. 254‒262.
Прозоров А.А. Клеточный цикл бактерий: репликация ДНК, распределение нуклеоидов, деление // Микробиология. 2005. Т. 74. № 4. С. 437‒451.
Prozorov A.A. The bacterial cell cycle: DNA replication, nucleoid segregation, and cell division // Microbiology. 2005. V. 74. P. 375‒387.
Addinall S.G., Bi E., Lutkenhaus J. FtsZ ring formation in fts mutants // J. Bacteriol. 1996. V. 178. P. 3877‒3884.
Adler H.I., Fisher W.D., Cohen A., Hardigree A.A. Miniature Escherichia coli cells deficient in DNA // Proc. Natl. Acad. Sci. USA. 1967. V. 57. P. 321‒326.
Araujo-Bazan L., Ruiz-Avila L.B., Andreu D., Huecas S., Andreu J.M. Cytological profile of antibacterial FtsZ inhi-bitors and synthetic peptide MciZ // Front. Microbiol. 2016. V. 7. P. 1558.
Balasubramanian M.K., Srinivasan R., Huang Y., Ng K.H. Comparing contractile apparatus-driven cytokinesis me-chanisms across kingdoms // Cytoskeleton (Hoboken). 2012. V. 69. P. 942‒956.
Balish M.F. Mycoplasma pneumoniae, an underutilized model for bacterial cell biology // J. Bacteriol. 2014. V. 196. P. 3675‒3682.
Beall B., Lutkenhaus J. FtsZ in Bacillus subtilis is required for vegetative septation and for asymmetric septation during sporulation // Genes Dev. 1991. V. 5. P. 447‒455.
Begg K.J., Donachie W.D. Cell shape and division in Escherichia coli: experiments with shape and division mutants // J. Bacteriol. 1985. V. 163. P. 615‒622.
Bernander R., Ettema T.J. FtsZ-less cell division in archaea and bacteria // Curr. Opin. Microbiol. 2010. V. 13. P. 747‒752.
Bernhardt T.G., de Boer P.A. SlmA, a nucleoid-associated, FtsZ binding protein required for blocking septal ring assembly over chromosomes in E. coli // Mol. Cell. 2005. V. 18. P. 555‒564.
Betzig E., Patterson G.H., Sougrat R., Lindwasser O.W., Olenych S., Bonifacino J.S., Davidson M.W., Lippincott-Schwartz J., Hess H.F. Imaging intracellular fluorescent proteins at nanometer resolution // Science. 2006. V. 313. № 5793. P. 1642‒1645.
Bi E.F., Lutkenhaus J. FtsZ ring structure associated with division in Escherichia coli // Nature. 1991. V. 354. № 6349. P. 161‒164.
Browning G.F., Citti C. Mollicutes: Molecular Biology and Pathogenesis. Norfolk, UK: Horizon Scientific Press, 2014. P. 350.
Buss J., Coltharp C., Huang T., Pohlmeyer C., Wang S.C., Hatem C., Xiao J. In vivo organization of the FtsZ-ring by ZapA and ZapB revealed by quantitative super-resolution microscopy // Mol. Microbiol. 2013. V. 89. P. 1099‒1120.
Carrion M., Gomez M.J., Merchante-Schubert R., Dongarra S., Ayala J.A. mraW, an essential gene at the dcw cluster of Escherichia coli codes for a cytoplasmic protein with me-thyltransferase activity // Biochimie. 1999. V. 81. P. 879‒888.
Coltharp C., Xiao J. Beyond force generation: Why is a dynamic ring of FtsZ polymers essential for bacterial cytokinesis? // Bioessays. 2017. V. 39. P. 1‒11.
Dai K., Lutkenhaus J. ftsZ is an essential cell division gene in Escherichia coli // J. Bacteriol. 1991. V. 173. P. 3500‒3506.
de Boer P., Crossley R., Rothfield L. The essential bacterial cell-division protein FtsZ is a GTPase // Nature. 1992. V. 359. № 6392. P. 254‒256.
de Boer P.A. Classic Spotlight: Discovery of ftsZ // J. Bacteriol. 2016. V. 198. P. 1184.
Duman R., Ishikawa S., Celik I., Strahl H., Ogasawara N., Troc P., Lowe J., Hamoen L.W. Structural and genetic ana-lyses reveal the protein SepF as a new membrane anchor for the Z ring // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. E4601‒4610.
Eraso J.M., Markillie L.M., Mitchell H.D., Taylor R.C., Orr G., Margolin W. The highly conserved MraZ protein is a transcriptional regulator in Escherichia coli // J. Bacteriol. 2014. V. 196. P. 2053‒2066.
Erickson H.P., Anderson D.E., Osawa M. FtsZ in bacterial cytokinesis: cytoskeleton and force generator all in one // Microbiol. Mol. Biol. Rev. 2010. V. 74. P. 504‒528.
Erickson H.P., Osawa M. FtsZ Constriction force ‒ curved protofilaments bending membranes // Subcell Biochem. 2017. V. 84. P. 139‒160.
Errington J. Cell wall-deficient, L-form bacteria in the 21st century: a personal perspective // Biochem. Soc. Trans. 2017. V. 45. P. 287‒295.
Errington J., Wu L.J. Cell cycle machinery in Bacillus subtilis // Prokaryotic Cytoskeletons: Filamentous Protein Polymers Active in the Cytoplasm of Bacterial and Archaeal Cells / Eds. Löwe J., Amos L.A. Cham: Springer Int. Publ., 2017. P. 67‒101.
Fleurie A., Lesterlin C., Manuse S., Zhao C., Cluzel C., Lavergne J.P., Franz-Wachtel M., Macek B., Combet C., Kuru E., VanNieuwenhze M.S., Brun Y.V., Sherratt D., Grangeasse C. MapZ marks the division sites and positions FtsZ rings in Streptococcus pneumoniae // Nature. 2014. V. 516. № 7530. P. 259‒262.
Fu G., Huang T., Buss J., Coltharp C., Hensel Z., Xiao J. In vivo structure of the E. coli FtsZ-ring revealed by photoactivated localization microscopy (PALM) // PLoS One. 2010. V. 5. P. e12682.
Gardner K.A., Moore D.A., Erickson H.P. The C-terminal linker of Escherichia coli FtsZ functions as an intrinsically disordered peptide // Mol. Microbiol. 2013. V. 89. P. 264‒275.
Gibson D.G., Glass J.I., Lartigue C., Noskov V.N., Chuang R.Y., Algire M.A., Benders G.A., Montague M.G., Ma L., Moodie M.M., Merryman C., Vashee S., Krishnakumar R., Assad-Garcia N., Andrews-Pfannkoch C., Denisova E.A., Young L., Qi Z.Q., Segall-Shapiro T.H., Calvey C.H., Parmar P.P., Hutchison C.A., 3rd, Smith H.O., Venter J.C. Creation of a bacterial cell controlled by a chemically synthesized genome // Science. 2010. V. 329. № 5987. P. 52‒56.
Haeusser D.P., Margolin W. Splitsville: structural and functional insights into the dynamic bacterial Z ring // Nat. Rev. Microbiol. 2016. V. 14. P. 305‒319.
Hirota Y., Ryter A., Jacob F. Thermosensitive mutants of E. coli affected in the processes of DNA synthesis and cellular division // Cold Spring Harb. Symp. Quant. Biol. 1968. V. 33. P. 677‒693.
Holden S.J., Pengo T., Meibom K.L., Fernandez Fernandez C., Collier J., Manley S. High throughput 3D super-resolution microscopy reveals Caulobacter crescentus in vivo Z-ring organization // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 4566‒4571.
Holland I.B., Jones C. The role of the FtsZ protein (SfiB) in UV-induced division inhibition and in the normal Escherichia coli cell division cycle // Ann. Inst. Pasteur Microbiol. 1985. V. 136A. № 1. P. 165‒171.
Horger I., Velasco E., Mingorance J., Rivas G., Tarazona P., Velez M. Langevin computer simulations of bacterial protein filaments and the force-generating mechanism during cell division // Phys. Rev. E Stat. Nonlin Soft Matter Phys. 2008. V. 77. № 1. Pt 1. P. 011902.
Hu Z., Lutkenhaus J. Topological regulation of cell division in Escherichia coli involves rapid pole to pole oscillation of the division inhibitor MinC under the control of MinD and MinE // Mol. Microbiol. 1999. V. 34. P. 82‒90.
Hu Z., Mukherjee A., Pichoff S., Lutkenhaus J. The MinC component of the division site selection system in Escherichia coli interacts with FtsZ to prevent polymerization // Proc. Natl. Acad. Sci. USA. 1999. V. 96. P. 14819‒14824.
Hurley K.A., Santos T.M., Nepomuceno G.M., Huynh V., Shaw J.T., Weibel D.B. Targeting the bacterial division protein FtsZ // J. Med. Chem. 2016. V. 59. P. 6975‒6998.
Hutchison C.A., Chuang R.-Y., Noskov V.N., Assad-Garcia N., Deerinck T.J., Ellisman M.H., Gill J., Kannan K., Karas B.J., Ma L., Pelletier J.F., Qi Z.-Q., Richter R.A., Strychalski E.A., Sun L., Suzuki Y., Tsvetanova B., Wise K.S., Smith H.O., Glass J.I., Merryman C., Gibson D.G., Venter J.C. Design and synthesis of a minimal bacterial genome // Science. 2016. V. 351. № 6280. aad6253.
Hutchison C.A., Peterson S.N., Gill S.R., Cline R.T., White O., Fraser C.M., Smith H.O., Venter J.C. Global transposon mutagenesis and a minimal Mycoplasma genome // Science. 1999. V. 286. № 5447. P. 2165‒2169.
Jacq M., Adam V., Bourgeois D., Moriscot C., Di Guilmi A.M., Vernet T., Morlot C. Remodeling of the Z-ring nanostructure during the Streptococcus pneumoniae cell cycle revealed by photoactivated localization microscopy // MBio. 2015. V. 6. e01108-15.
Jacquier N., Viollier P.H., Greub G. The role of peptidoglycan in chlamydial cell division: towards resolving the chlamydial anomaly // FEMS Microbiol. Rev. 2015. V. 39. P. 262‒275.
Jakimowicz D., van Wezel G.P. Cell division and DNA segregation in Streptomyces: how to build a septum in the middle of nowhere? // Mol. Microbiol. 2012. V. 85. P. 393‒404.
Janion C. Inducible SOS response system of DNA repair and mutagenesis in Escherichia coli // Int. J. Biol. Sci. 2008. V. 4. P. 338‒344.
Leisch N., Pende N., Weber P.M., Gruber-Vodicka H.R., Verheul J., Vischer N.O.E., Abby S.S., Geier B., den Blaauwen T., Bulgheresi S. Asynchronous division by non-ring FtsZ in the gammaproteobacterial symbiont of Robbea hypermnestra // Nature Microbiol. 2016. V. 2. P. 16182.
Li Y., Shao S., Xu X., Su X., Sun Y., Wei S. MapZ forms a stable ring structure that acts as a nanotrack for FtsZ treadmilling in Streptococcus mutans // ACS Nano. 2018. https://doi.org/10.1021/acsnano.8b02469
Liechti G.W., Kuru E., Hall E., Kalinda A., Brun Y.V., VanNieuwenhze M., Maurelli A.T. A new metabolic cell-wall labelling method reveals peptidoglycan in Chlamydia trachomatis // Nature. 2014. V. 506. № 7489. P. 507‒510.
Lindas A.C., Karlsson E.A., Lindgren M.T., Ettema T.J., Bernander R. A unique cell division machinery in the Archaea // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 18942–18946.
Lluch-Senar M., Querol E., Piñol J. Cell division in a minimal bacterium in the absence of ftsZ // Mol. Microbiol. 2010. V. 78. P. 278‒289.
Lowe J. Crystal structure determination of FtsZ from Methanococcus jannaschii // J. Struct. Biol. 1998. V. 124. P. 235‒243.
Lutkenhaus J. Regulation of cell division in E. coli // Trends Genet. 1990. V. 6. P. 22‒25.
Lutkenhaus J., Du S. E. coli cell cycle machinery // Subcell Biochem. 2017. V. 84. P. 27‒65.
Lutkenhaus J., Pichoff S., Du S. Bacterial cytokinesis: From Z ring to divisome // Cytoskeleton (Hoboken). 2012. V. 69. P. 778‒790.
Lutkenhaus J.F. Coupling of DNA replication and cell division: sulB is an allele of ftsZ // J. Bacteriol. 1983. V. 154. P. 1339‒1346.
Lutkenhaus J.F., Wolf-Watz H., Donachie W.D. Organization of genes in the ftsA-envA region of the Escherichia coli genetic map and identification of a new fts locus (ftsZ) // J. Bacteriol. 1980. V. 142. P. 615‒620.
Lyu Z., Coltharp C., Yang X., Xiao J. Influence of FtsZ GTPa-se activity and concentration on nanoscale Z-ring structure in vivo revealed by three-dimensional Superresolution imaging // Biopolymers. 2016. V. 105. P. 725‒734.
Ma X., Ehrhardt D.W., Margolin W. Colocalization of cell division proteins FtsZ and FtsA to cytoskeletal structures in living Escherichia coli cells by using green fluorescent protein // Proc. Natl. Acad. Sci. USA. 1996. V. 93. P. 12998‒13003.
Mannik J., Bailey M.W. Spatial coordination between chromosomes and cell division proteins in Escherichia coli // Front. Microbiol. 2015. V. 6. P. 306.
Mannik J., Bailey M.W., O’Neill J.C., Mannik J. Kinetics of large-scale chromosomal movement during asymmetric cell division in Escherichia coli // PLoS Genet. 2017. V. 13. e1006638.
Mannik J., Wu F., Hol F.J., Bisicchia P., Sherratt D.J., Keymer J.E., Dekker C. Robustness and accuracy of cell division in Escherichia coli in diverse cell shapes // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 6957‒6962.
Marston A.L., Thomaides H.B., Edwards D.H., Sharpe M.E., Errington J. Polar localization of the MinD protein of Bacillus subtilis and its role in selection of the mid-cell division site // Genes Dev. 1998. V. 12. P. 3419‒3430.
Mercier R., Kawai Y., Errington J. Excess membrane synthesis drives a primitive mode of cell proliferation // Cell. 2013. V. 152. P. 997‒1007.
Mercier R., Kawai Y., Errington J. General principles for the formation and proliferation of a wall-free (L-form) state in bacteria // Elife. 2014. V. 3. https://doi.org/10.7554/eLife.04629
Miyagishima S.Y., Nakamura M., Uzuka A., Era A. FtsZ-less prokaryotic cell division as well as FtsZ- and dynamin-less chloroplast and non-photosynthetic plastid division // Front. Plant Sci. 2014. V. 5. P. 459.
Mizutani M., Tulum I., Kinosita Y., Nishizaka T., Miyata M. Detailed analyses of stall force generation in Mycoplasma mobile gliding // Biophys. J. 2018. V. 114. P. 1411‒1419.
Mukherjee A., Lutkenhaus J. Guanine nucleotide-dependent assembly of FtsZ into filaments // J. Bacteriol. 1994. V. 176. P. 2754‒2758.
Osawa M., Anderson D.E., Erickson H.P. Reconstitution of contractile FtsZ rings in liposomes // Science. 2008. V. 320. № 5877. P. 792‒794.
Osawa M., Erickson H.P. Liposome division by a simple bacterial division machinery // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 11000‒11004.
Ouzounov N., Nguyen J.P., Bratton B.P., Jacobowitz D., Gitai Z., Shaevitz J.W. MreB orientation correlates with cell diameter in Escherichia coli // Biophys. J. 2016. V. 111. P. 1035‒1043.
Panda D., Bhattacharya D., Gao Q.H., Oza P.M., Lin H.Y., Hawkins B., Hibbs D.E., Groundwater P.W. Identification of agents targeting FtsZ assembly // Future Med. Chem. 2016. V. 8. P. 1111‒1132.
Pichoff S., Lutkenhaus J. Unique and overlapping roles for ZipA and FtsA in septal ring assembly in Escherichia coli // EMBO J. 2002. V. 21. P. 685‒693.
Pilhofer M., Aistleitner K., Biboy J., Gray J., Kuru E., Hall E., Brun Y.V., VanNieuwenhze M.S., Vollmer W., Horn M., Jensen G.J. Discovery of chlamydial peptidoglycan reveals bacteria with murein sacculi but without FtsZ // Nat. Commun. 2013. V. 4. P. 2856.
Qin T.T., Kang H.Q., Ma P., Li P.P., Huang L.Y., Gu B. SOS response and its regulation on the fluoroquinolone resistance // Ann. Transl. Med. 2015. V. 3. P. 358.
Ramond E., Maclachlan C., Clerc-Rosset S., Knott G.W., Lemaitre B. Cell division by longitudinal scission in the insect endosymbiont Spiroplasma poulsonii // MBio. 2016. V. 7. № 4. e00881-16.
RayChaudhuri D., Park J.T. Escherichia coli cell-division gene ftsZ encodes a novel GTP-binding protein // Nature. 1992. V. 359. № 6392. P. 251‒254.
Rowlett V.W., Margolin W. The bacterial Min system // Curr. Biol. 2013. V. 23. P. R553‒556.
Rowlett V.W., Margolin W. The bacterial divisome: ready for its close-up // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2015. V. 370. № 1679. pii: 20150028.
Rubin J.E., Ball K.R., Chirino-Trejo M. Antimicrobial susceptibility of Staphylococcus aureus and Staphylococcus pseudintermedius isolated from various animals // Can. Vet. J. 2011. V. 52. P. 153‒157.
Scheffers D.J., Pinho M.G. Bacterial cell wall synthesis: new insights from localization studies // Microbiol. Mol. Biol. Rev. 2005. V. 69. P. 585‒607.
Soderstrom B., Skoog K., Blom H., Weiss D.S., von Heijne G., Daley D.O. Disassembly of the divisome in Escherichia coli: evidence that FtsZ dissociates before compartmentalization // Mol. Microbiol. 2014. V. 92. P. 1‒9.
Steiner W., Liu G., Donachie W.D., Kuempel P. The cytoplasmic domain of FtsK protein is required for resolution of chromosome dimers // Mol. Microbiol. 1999. V. 31. P. 579‒583.
Stokes N.R., Baker N., Bennett J.M., Berry J., Collins I., Czaplewski L.G., Logan A., Macdonald R., Macleod L., Peasley H., Mitchell J.P., Nayal N., Yadav A., Srivastava A., Haydon D.J. An improved small-molecule inhibitor of FtsZ with superior in vitro potency, drug-like properties, and in vivo efficacy // Antimicrob. Agents Chemother. 2013. V. 57. P. 317‒325.
Sun N., Lu Y.J., Chan F.Y., Du R.L., Zheng Y.Y., Zhang K., So L.Y., Abagyan R., Zhuo C., Leung Y.C., Wong K.Y. A Thiazole orange derivative targeting the bacterial protein FtsZ shows potent antibacterial activity // Front. Microbiol. 2017. V. 8. P. 855.
Szwedziak P., Wang Q., Bharat T.A., Tsim M., Lowe J. Architecture of the ring formed by the tubulin homologue FtsZ in bacterial cell division // Elife. 2014. V. 3. e04601.
TerBush A.D., Yoshida Y., Osteryoung K.W. FtsZ in chloroplast division: structure, function and evolution // Curr. Opin. Cell Biol. 2013. V. 25. P. 461‒470.
Thanbichler M., Shapiro L. MipZ, a spatial regulator coordinating chromosome segregation with cell division in Caulobacter // Cell. 2006. V. 126. P. 147‒162.
Tonthat N.K., Arold S.T., Pickering B.F., Van Dyke M.W., Liang S., Lu Y., Beuria T.K., Margolin W., Schumacher M.A. Molecular mechanism by which the nucleoid occlusion factor, SlmA, keeps cytokinesis in check // EMBO J. 2011. V. 30. P. 154‒164.
Treuner-Lange A., Aguiluz K., van der Does C., Gomez-Santos N., Harms A., Schumacher D., Lenz P., Hoppert M., Kahnt J., Munoz-Dorado J., Sogaard-Andersen L. PomZ, a ParA-like protein, regulates Z-ring formation and cell division in Myxococcus xanthus // Mol. Microbiol. 2013. V. 87. P. 235‒253.
Turnbull L., Strauss M.P., Liew A.T.F., Monahan L.G., Whitchurch C.B., Harry E.J. Super-resolution imaging of the cytokinetic Z ring in live bacteria using fast 3D-structured illumination microscopy (f3D-SIM) // J. Visual. Exp.: JoVE. 2014. № 91. P. 51469.
Vedyaykin A.D., Vishnyakov I.E., Polinovskaya V.S., Khodorkovskii M.A., Sabantsev A.V. New insights into FtsZ rearrangements during the cell division of Escherichia coli from single-molecule localization microscopy of fixed cells // MicrobiologyOpen. 2016. V. 5. P. 378‒386.
Wang H., Xie L., Luo H., Xie J. Bacterial cytoskeleton and implications for new antibiotic targets // J. Drug. Target. 2016. V. 24. P. 392‒398.
Weigle J.J. Induction of mutations in a bacterial virus // Proc. Natl. Acad. Sci. USA. 1953. V. 39. P. 628‒636.
Willemse J., Borst J.W., de Waal E., Bisseling T., van Wezel G.P. Positive control of cell division: FtsZ is recruited by SsgB during sporulation of Streptomyces // Genes Dev. 2011. V. 25. P. 89‒99.
Windsor H.M., Windsor G.D., Noordergraaf J.H. The growth and long term survival of Acholeplasma laidlawii in media products used in biopharmaceutical manufacturing // Biologicals. 2010. V. 38. P. 204‒210.
Wu L.J., Errington J. Coordination of cell division and chromosome segregation by a nucleoid occlusion protein in Bacillus subtilis // Cell. 2004. V. 117. P. 915‒925.
Wu L.J., Errington J. Nucleoid occlusion and bacterial cell division // Nat. Rev. Microbiol. 2011. V. 10. P. 8‒12.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология