Микробиология, 2019, T. 88, № 4, стр. 450-457
Исследование элементного состава покоящихся и прорастающих спор грибов
И. С. Мысякина a, *, В. В. Сорокин a, И. К. Дорофеева a, Д. А. Бокарева b
a ФИЦ Биотехнологии РАН, Институт микробиологии им. С.Н. Виноградского
119071 Москва, Россия
b НИЦ Курчатовский институт
123098 Москва, Россия
* E-mail: myssiakina@inmi.ru
Поступила в редакцию 05.02.2019
После доработки 12.02.2019
Принята к публикации 01.04.2019
Аннотация
Исследован элементный состав и определены соотношения элементов К/Са и P/S, которые, согласно рабочей гипотезе, отражают особенности физиологического состояния покоящихся (“споры 0”) и прорастающих спор грибов (“споры П”). Объектами исследования были представители мицелиальных грибов, различающихся скоростью выхода спор из состояния экзогенного покоя в условиях отсутствия питательных веществ в среде реактивации. Уровень углерода в “спорах 0” коррелировал с содержанием клеточных липидов. Соотношение К/Са в “спорах 0” Aspergillus tamarii и Cunninghamella echinulata оказалось ниже, чем в “спорах 0” Aspergillus sydowii и Umbelopsis ramanniana. В покоящихся спорах аспергиллов отношение P/S было ниже, чем у зигомицетовых грибов, а в быстро прорастающих спорах штаммов A. tamarii и C. echinulata этот показатель был в 1.5–1.75 раза ниже, чем в медленно прорастающих спорах штаммов A. sydowii и U. ramanniana. Таким образом, на основании низкого отношения К/Са и P/S в покоящихся спорах грибов можно прогнозировать их более быстрый выход из состояния покоя, что особенно важно для мицелиальных грибов – синтетиков ряда соединений, используемых в биотехнологических процессах, а также для клинически значимых штаммов.
Состояние покоя у микроорганизмов является стратегией выживания в условиях, неблагоприятных для роста (Lennon, Jones, 2011). У мицелиальных грибов существует несколько типов покоя, из которых в качестве основных рассматривают два – конститутивный и экзогенный. Конститутивный покой (эндогенный, глубокий) отличается сложной многоступенчатой регуляцией процессов прорастания (цитоплазматическая регуляция) и только появления воды в среде недостаточно для перехода спор в стадию биоза (Феофилова, 2003). Второй тип покоя – экзогенный, отличается более простой системой регуляции, и для начала прорастания достаточно удалить из среды лимитирующий фактор, которым чаще всего является отсутствие экзогенной воды. Этот тип покоя свойствен вегетативным спорам грибов, например, конидиям и спорангиоспорам. Способность спор грибов к прорастанию и скорость этого процесса определяются состоянием внутриклеточных компонентов и метаболических систем и зависят от факторов внешней среды. Особый интерес представляет изучение изменений содержания биогенных элементов в спорах, характеризующихся экзогенным типом покоя и помещенных для прорастания в голодную среду. Проведенные ранее исследования показали, что в этих условиях споры некоторых аскомицетовых и зигомицетовых грибов способны к прорастанию (Мысякина и соавт., 2016а).
Одним из методов, позволяющих анализировать состояние ионного гомеостаза в различных биологических объектах, является метод рентгеновского микроанализа (Stewart et al., 1980; Pitryuk et al., 2002; Nagata, 2004). В частности, этим методом были выявлены различия в содержании отдельных биогенных элементов и их попарных соотношений (S, P, Ca и K; Ca/K и P/S) в клетках различных микроорганизмов (Bacillus cereus, Micrococcus luteus, Saccharomyces cerevisiae, Mucor hiemalis), различающихся метаболической активностью и пролиферативной способностью в ряду: вегетативные клетки–жизнеспособные покоящиеся формы–нежизнеспособные клетки (Мулюкин и соавт., 2002), а также в ряду молодые–старые споры (Mysyakina et al., 2014). Выявленные различия в содержании и соотношении биогенных элементов в покоящихся формах отражали изменения их ионного гомеостаза и уровня метаболизма при переходе клеток в анабиотическое состояние и могут быть использованы для разработки критериев диагностики физиологического состояния микроорганизмов. С помощью метода рентгеновского микроанализа можно определять соотношения элементов в отдельных клетках (в т.ч. в спорах), что позволяет получать статистически достоверные показатели, характеризующие состояние культуры в целом.
Цель настоящей работы – исследовать элементный состав, соотношения отдельных элементов и их изменения в процессе выхода спор представителей аскомицетовых и зигомицетовых грибов из состояния экзогенного покоя в условиях отсутствия питательных веществ и солей в среде (в дистиллированной воде).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Микроорганизмы. В качестве объектов исследования были выбраны штаммы из коллекции ВКМ РАН, характеризующиеся разной скоростью роста на плотных средах (Мысякина и соавт., 2016а).
(1) ВКМ F-64 – Aspergillus tamarii (Kita 1913) характеризуется достаточно высокой скоростью роста: диаметр колоний на 7 сут роста при температуре 25°С достигает 70 мм.
(2) ВКМ F-441 – Aspergillus sydowii (Bainier et R. Sartory 1913) Thom et Church 1926 является одним из медленно растущих среди аспергиллов: диаметр колоний на 7 сут роста при температуре 25°С не превышает 30 мм.
(3) ВКМ F-582 – Umbelopsis ramanniana (Moeller 1903) W. Gams 2003 (синонимы: Mucor ramannianus Moeller 1903; Mortierella ramanniana (Moeller 1903) Linnemann 1941 var. ramanniana) имеет невысокую для зигомицетовых грибов скорость роста: диаметр колонии не превышает 40 мм через 5 сут культивирования на сусло-агаре при 25°С.
(4) ВКМ F-663 – Cunninghamella echinulata (Thaxter 1891) Thaxter 1905 относится к быстрорастущим штаммам, колонии которого достигают диаметра 70 мм за 4 сут культивирования на сусло-агаре при 25°С.
Получение спор. Культуры мицелиальных грибов выращивали в стеклянных матрасах на поверхности агаризованного сусла (7°Б) в течение 12 сут при температуре 28°С. Споры смывали 150 мл стерильной дистиллированной воды с поверхности культур, фильтровали через капроновый фильтр для удаления обрывков мицелия; суспензию спор центрифугировали в течение 10 мин при 3500 об./мин.
Осажденные споры промывали 20 мл деионизованной воды, центрифугировали; процедуру повторяли дважды. Часть споровой суспензии (“споры 0”) использовали для приготовления образцов для дальнейшего исследования непосредственно после отмывания, а другую часть (“споры П”) после центрифугирования помещали в стерильную дистиллированную воду, инкубировали при 28°С на качалке (130 об./мин) и наблюдали за процессом прорастания. После того, как число набухших и проросших (с появившейся ростовой трубкой) спор приближалось к 100 и 60% соответственно, суспензию центрифугировали в течение 10 мин при 3500 об./мин. Промытые споры ресуспендировали в 20 мл деионизованной воды, 5 мкл споровой суспензии наносили на медные сетки (диаметр 3 мм) с карбонизированной формваровой пленкой, препараты высушивали на воздухе в течение 1 сут при комнатной температуре и напыляли углеродом под углом 90°.
Электронно-микроскопическое исследование и рентгеновский микроанализ препаратов проводили на микроскопе JEM-1400 (“Jeol”, Япония), оснащенном микроанализатором (“Oxford Instruments”, Великобритания), при ускоряющем напряжении 80 кэВ; угол наклона образца – 15°. Спектры анализировали с применением программы AZtec (“Oxford Instruments”, Великобритания).
Экстракцию липидов из сухой биомассы спор проводили по методу Фолча (Folch et al., 1957), количество липидов определяли гравиметрически.
Экстракцию и определение относительного количества трегалозы в спорах методом ГЖХ осуществляли, как описано ранее (Мысякина и соавт., 2016б).
Статистическую обработку проводили с использованием пакета программ Microsoft® Office Excel® 2007. Повторность опытов – 5–8.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
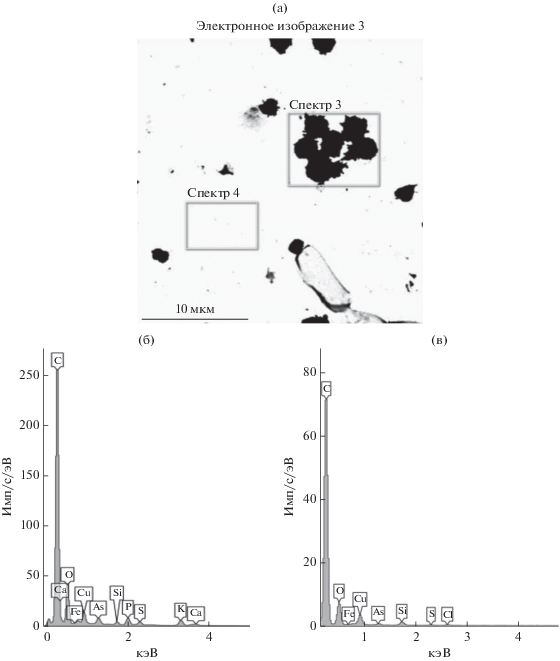
Метод рентгеновского микроанализа позволяет проводить быстрое определение элементного состава микробных объектов, как отдельных клеток, так и их скоплений, что дает возможность характеризовать состояние споровой популяции в целом. Поскольку исследуемые образцы представляли собой споры на сетках для электронной микроскопии с нанесенной формваровой пленкой, напыленной углеродом, для получения достоверной информации по содержанию углерода измерения элементного состава проводили как на участках, содержащих споры, так и на участках, свободных от клеток (фон); содержание углерода для спор получали из разности этих значений (пример на рис. 1).
Рис. 1.
Электронно-микроскопическое изображение препарата суспензии спор Aspergillus sydowii ВКМ F-441 (а) и содержание элементов на участках скопления спор (б – спектр 3) и фона (в – спектр 4).
На рис. 2 и 3 представлены отдельные примеры изображений покоящихся и прорастающих конидий A. tamarii ВКМ F-64 и спорангиоспор C. echinulata ВКМ F-663, клетки которых использовали для изучения их элементного состава. Набухшие и проросшие “споры П” быстро прорастающих штаммов (C. echinulata ВКМ F-663 и A. tamarii ВКМ F-64) использовали для приготовления образцов через 5 ч их инкубации в стерильной дистиллированной воде, а медленно прорастающих (A. sydowii ВКМ F-441 и U. ramanniana ВКМ F-582) – через 20 ч.
Наибольший интерес, c нашей точки зрения, представляли следующие элементы: углерод как главный биогенный элемент; кальций как вторичный клеточный эффектор и стабилизатор биомакромолекул и мембран; калий, участвующий в создании трансмембранного потенциала, водном обмене и поддержании осмотического давления клетки; сера – компонент белков, и фосфор, входящий в состав нуклеотидов (АТФ и др.), нуклеиновых кислот, фосфолипидов и энергетических эквивалентов. Соотношения К/Са и P/S, согласно нашему предположению, должны отражать особенности эндогенного элементного состава покоящихся и прорастающих спор у представителей мицелиальных грибов, различающихся по скорости выхода из состояния экзогенного покоя в условиях отсутствия питательных веществ в среде инкубирования.
В спорах исследуемых мицелиальных грибов помимо вышеупомянутых элементов, которым было уделено основное внимание (углерод, фосфор, сера, кальций и калий), были детектированы также кислород (от 1.5 до 10.4%), магний (0.2–09%), кремний (0.2–0.4%), хлор (0.2–0.5%), железо (0.1–0.6%), мышьяк (0.1–1.0%) и ряд других минорных элементов.
Содержание углерода, фосфора, серы, калия и кальция в покоящихся и прорастающих спорах аскомицетовых и зигомицетовых грибов представлены в табл. 1.
Таблица 1.
Содержание углерода, фосфора, серы, калия и кальция в покоящихся (“споры 0”) и прорастающих (“споры П”) спорах аскомицетовых и мукоровых грибов с различной скоростью выхода из состояния экзогенного покоя
| Микроорганизм | “Споры 0” | “Споры П” | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Элементы, % от суммы | ||||||||||||
| С | P | S | К | Са | Mg | С | P | S | К | Са | Mg | |
| A. sydowii ВКМ F-441 | 78.12 ± ± 0.32 | 0.72 ± ± 0.4 | 0.24 ± ± 0.05 | 0.62 ± ± 0.2 | 0.30 ± ± 0.15 | Сл.* | 70.02 ± 0.15 | 0.1 ± 0.01 | 0.17 ± 0.01 | 0.07 ± 0.01 | Сл.* | Сл.* |
| A. tamarii ВКМ F-64 | 49.62 ± ± 2.8 | 1.76 ± ± 0.21 | 0.88 ± ± 0.11 | 1.15 ± ± 0.17 | 0.66 ± ± 0.09 | 0.5 ± ± 0.07 | 60.18 ± ± 2.99 | 2.67 ± ± 0.25 | 1.25 ± ± 0.1 | 2.03 ± ± 0.34 | 0.69 ± ± 0.06 | 0.64 ± ± 0.03 |
| U. ramanniana ВКМ F-582 | 52.64 ± ± 10.09 | 6.01 ± ± 1.83 | 0.67 ± ± 0.16 | 2.19 ± ± 0.52 | 0.89 ± ± 0.31 | 0.58 ± ± 0.19 | 40.19 ± ± 8.01 | 3.64 ± ± 1.7 | 0.85 ± ± 0.18 | 1.09 ± ± 0.44 | 0.57 ± ± 0.24 | 0.33 ± ± 0.15 |
| C. echinulata ВКМ F-663 | 37.28 ± ± 4.87 | 1.84 ± ± 0.45 | 0.42 ± ± 0.11 | 1.42 ± ± 0.52 | 1.75 ± ± 1.24 | 0.24 ± ± 0.05 | 37.74 ± ± 7.71 | 2.95 ± ± 0.57 | 0.57 ± ± 0.13 | 2.21 ± ± 0.52 | 3.13 ± ± 0.61 | 0.23 ± ± 0.04 |
Наиболее высокое относительное содержание углерода отмечено в покоящихся спорах медленно прорастающих грибов A. sydowii и U. ramanniana, по сравнению со спорами быстро прорастающих A. tamarii и C. echinulata (табл. 1). Очевидно, что высокий уровень углерода в спорах может коррелировать с уровнем основных резервных соединений, характерных для покоящихся клеток и необходимых как источник энергии в процессе выхода из состояния покоя, главным образом, липидов. Удельное содержание липидов в сухой массе спор было выше именно в спорах медленно прорастающих штаммов: у A. sydowii и U. ramanniana оно составляло 30–40% от веса сухой биомассы, а у быстро прорастающих спор A. tamarii и C. echinulata – 10–20%. Отметим, что содержание основного углевода покоя – трегалозы, имеющей функции химических шаперонов, было, напротив, больше в быстро прорастающих спорах A. tamarii и C. echinulata, где оно достигало 5.62 и 8.87% от веса сухой биомассы, а в медленно прорастающих спорах A. sydowii и U. ramanniana – 2.47 и 0.34% соответственно (Мысякина и соавт., 2016b). Таким образом, отмечена корреляция количества трегалозы со скоростью прорастания покоящихся форм.
Ранее нами было показано, что процесс прорастания спор сопровождался изменениями в составе резервных и мембранных липидов, а также в составе жирных кислот (Мысякина и соавт., 2018). В частности, отмечено, что у C. echinulata, U. ramanniana и A. sydowii снижалось относительное содержание фосфатидилхолина (ФХ) – одного из массивных фосфолипидов мембран. В литературе есть сведения о взаимодействии различных ионов с мембранными структурами в живых объектах и модельных системах (Hodgkin, Horowicz, 1959; Träuble, Eibl, 1974; Song et al., 2014; Friedman, 2018). Показано, что полярные головные группы липидных мембран могут напрямую взаимодействовать с ионами, что, в свою очередь, может влиять на свойства мембран, в частности, на фазовые переходы липидов (Träuble, Eibl, 1974), мембранный потенциал (Hodgkin, Horowicz, 1959) и динамику гидратационного слоя (Song et al., 2014). Конкретные взаимодействия, кроме того, зависят от липидного состава мембран. Многие из липидов, которые обычно формируют биологические мембраны, являются цвиттерионными (ФХ, ФЭА) или заряженными (ФС, КЛ). Ионы Na+, K+, Cl– наиболее распространены в биологически значимых электролитах, а двухвалентные катионы – Са2+ и Mg2+, могут катализировать слияние мембран (Portis et al., 1979; Wilschut et al., 1980) или модифицировать структуру мембран вследствие связывания одновременно с несколькими анионными сайтами.
С нашей точки зрения, сравнение попарных соотношений отдельных элементов могут быть более показательными, чем сравнение их индивидуальных уровней. В покоящихся спорах аспергиллов отношение P/S было ниже, чем у зигомицетовых грибов (табл. 2), но при этом в быстро прорастающих спорах штаммов A. tamarii и C. echinulata этот показатель был в 1.5–1.75 раза ниже, чем в медленно прорастающих спорах штаммов A. sydowii и U. ramanniana. Таким образом, на основании сравнительно низкого отношения P/S в покоящихся спорах можно прогнозировать их более быстрый выход из состояния покоя. Другой особенностью является то, что в дальнейшем процессе выхода из состояния покоя соотношение P/S у быстро прорастающих спор штаммов A. tamarii и C. echinulata практически не изменялось, а у медленно выходящих из состояния покоя спор штаммов A. sydowii и U. ramanniana – снижалось в 2 и 5 раз соответственно (табл. 2).
Таблица 2.
Соотношение элементов P/S и К/Са в покоящихся (“споры 0”) и прорастающих (“споры П”) спорах аскомицетовых и мукоровых грибов с различной скоростью выхода из состояния экзогенного покоя
| Микроорганизм | Соотношение элементов | |||
|---|---|---|---|---|
| P/S | К/Са | |||
| “cпоры 0” | “cпоры П” | “cпоры 0” | “cпоры П” | |
| A. sydowii ВКМ F-441 | 3.06 | 0.59 | 2.08 | – * |
| A. tamarii ВКМ F-64 | 2.0 | 2.14 | 1.74 | 2.94 |
| U. ramanniana ВКМ F-582 | 8.97 | 4.28 | 2.46 | 1.91 |
| C. echinulata ВКМ F-663 | 5.12 | 5.22 | 0.91 | 0.75 |
Соотношение К/Са в покоящихся “спорах 0” A. tamarii и C. echinulata также оказалось ниже, чем в “спорах 0” A. sydowii и U. ramanniana. Четкой зависимости в изменениях соотношения К/Са в процессе прорастания у конидий A. tamarii обнаружить не удалось, однако у медленно прорастающих спор представителей A. sydowii и U. ramanniana наблюдалось снижение отношения К/Са в клетках в процессе выхода из состояния покоя. По-видимому, этот вопрос требует дальнейших исследований. Известно, что кальций играет важную регуляторную роль в процессах передачи сигнала, прорастания спор, роста и морфогенеза, он может быть токсичен для клеток, и его концентрация зависит от функционирования ряда транспортеров и экспрессии генов, регулирующих кальциевый гомеостаз (Warwar, Dickman, 1996; Prithviraj et al., 1998; Osherov, May, 2001; Pittman, 2011; Dinamarco et al., 2012).
Исследования элементного состава, а также мембранно-ионных взаимодействий в прорастающих спорах грибов важны для понимания влияния на структуру мембранного бислоя и, тем самым, на взаимодействие мембран с другими молекулами, включая белки, в том числе ферменты, и другие соединения, синтез которых (в основном из эндогенных ресурсов) начинается в процессе выхода спор из состояния экзогенного покоя.
Мицелиальные грибы являются одними из основных объектов, используемых для биологического синтеза. В частности, к их числу относится малоизученный представитель зигомицетов U. ramanniana, один из штаммов которого был использован в настоящей работе. По мнению зарубежных авторов, он представляется весьма перспективным с точки зрения биохимии и биотехнологии, поскольку толерантен к фунгицидам беномильной группы и является олеогенным. Экспрессия гена диацилглицерин О-ацилтрансферазы 2А (diacylglycerol O-acyltransferase 2A; DGAT2A) из U. ramanniana в семенах сои увеличивала количество масла, не снижая при этом других важных параметров. По некоторым оценкам это увеличение продукции масла может дать дополнительную прибыль более 1 млрд долл. США к ежегодной продажной стоимости соевых культур (Lardizabal et al., 2008; Grigoriev et al., 2014).
Полученные в настоящей работе данные, совокупно с нашими ранними результатами (Mysyakina et al., 2014), свидетельствуют о значимости исследований элементного состава, в частности соотношения P/S, в покоящихся и прорастающих спорах грибов для оценки их физиологического состояния, а также как показателя потенциальной скорости выхода спор из состояния покоя, что особенно важно для использования мицелиальных грибов в биотехнологической практике.
Список литературы
Мулюкин А.Л., Сорокин В.В., Лойко Н.Г., Сузина Н.Е., Дуда В.И., Воробьева Е.А., Эль-Регистан Г.И. Сравнительное изучение элементного состава вегетативных и покоящихся клеток микроорганизмов // Микробиология. 2002. Т. 71. № 1. С. 37–48.
Muliukin A.L., Sorokin V.V., Loǐko N.G., Suzina N.E., Duda V.I., Vorob’eva E.A., El’-Registan G.I. Comparative study of the elemental composition of vegetative and dormant microbial cells // Microbiology (Moscow). 2002. V. 71. P. 31–40.
Мысякина И.С., Кочкина Г.А., Иванушкина Н.Е., Бокарева Д.А., Феофилова Е.П. Прорастание спор мицелиальных грибов в связи с экзогенным покоем // Микробиология. 2016a. Т. 85. № 3. С. 269–274.
Mysyakina I.S., Kochkina G.A., Ivanushkina N.E., Bokareva D.A., Feofilova E.P. Germination of spores of mycelia fungi in relation to exogenous dormancy // Microbiology (Moscow). 2016a. V. 85. P. 290–294.
Мысякина И.С., Усов А.И., Бокарева Д.А., Феофилова Е.П. Содержание трегалозы в покоящихся и прорастающих спорах мицелиальных грибов // Известия Уфимского научного центра РАН. 2016b. № 3 (1). С. 143–145.
Мысякина И.С., Сергеева Я.Э., Бокарева Д.А. Особенности липидного состава спор зигомицетовых и аскомицетовых грибов при выходе из состояния экзогенного покоя // Микробиология. 2018. Т. 87. № 1. С. 42–49.
Mysyakina I.S., Sergeeva Ya.E., Bokareva D.A. Lipid composition of the spores of zygomycetous and ascomycetous fungi during cessation of the exogenous dormancy state // Microbiology (Moscow). 2018. V. 87. P. 51–59.
Феофилова Е.П. Торможение жизненной активности как универсальный биохимический механизм адаптации микроорганизмов к стрессовым воздействиям // Прикл. биохимия и микробиология. 2003. Т. 39. № 1. С. 1–24.
Feofilova E.P. Deceleration of vital activity as a universal biochemical mechanism ensuring adaptation of microorganisms to stress factors: A review // Appl. Biochem. Microbiol. 2003. V. 39. P. 1–18.
Dinamarco T.M., Freitas F.Z., Almeida R.S., Brown N.A., dos Reis T.F., Ramalho L.N.Z., Savoldi M., Goldman M.H.S., Bertolini M.C., Goldman G.H. Functional characterization of an Aspergillus fumigatus calcium transporter (PmcA) that is essential for fungal infection // PLoS One. 2012. V. 7. Iss. 5. e37591.
Folch G., Lees M., Sloane-Stanley G.H. A simple method for the isolation and purification of total lipids from animal tissues // J. Biol. Chem. 1957. V. 226. P. 497–509.
Friedman R. Membrane–ion interactions // J. Membrane Biol. 2018. V. 251. P. 453–460.
Grigoriev I.V., Nikitin R., Haridas S., Kuo A., Ohm R., Otillar R., Riley R., Salamov A., Zhao X., Korzeniewski F., Smirnova T., Nordberg H., Dubchak I., Shabalov I. MycoCosm portal: gearing up for 1000 fungal genomes // Nucleic Acids Res. 2014. V. 42. Database issue. D699–D704.
Hodgkin A.L., Horowicz P. The influence of potassium and chloride ions on the membrane potential of single muscle fibres // J. Physiol. (Lond.). 1959. V. 148. P. 127–160.
Lardizabal K., Effertz R., Levering C., Mai J., Pedroso M.C., Jury T., Aasen E., Gruys K., Bennett K. Expression of Umbelopsis ramanniana DGAT2A in seed increases oil in soybean // Plant Physiol. 2008. V. 148. P. 89–96.
Lennon J.T., Jones S.E. Microbial seed banks: the ecological and evolutionary implications of dormancy // Nature Rev. Microbiol. 2011. V. 9. P. 119–130.
Mysyakina I.S., Sergeeva Ya.E., Sorokin V.V., Ivashechkin A.A., Kostrikina N.A., Feofilova E.P. Lipid and elemental composition as indicators of the physiological state of sporangiospores in Mucor hiemalis cultures of different ages // Microbiology. 2014. V. 83. P. 110–118.
Nagata T. X-ray microanalysis of biological specimens by high voltage electron microscopy // Prog. Histochem. Cytochem. 2004. V. 39. P. 185–319.
Osherov N., May G.S. The molecular mechanisms of conidial germination // FEMS Microbiol. Lett. 2001. V. 199. P. 153–160.
Pitryuk A.V., Pusheva M.A., Sorokin V.V. Elemental composition of extremely alkaliphilic anaerobic bacteria // Microbiology (Moscow). 2002. V. 71. P. 30–36.
Pittman J.K. Vacuolar Ca2+ uptake // Cell Calcium. 2011. V. 50. P. 139–146.
Portis A., Newton C., Pangborn W., Papahadjopoulos D. Studies on the mechanism of membrane fusion: evidence for an intermembrane Ca2+-phospholipid complex, synergism with Mg2+, and inhibition by spectrin // Biochemistry. 1979. V. 18. P. 780–790.
Prithviraj B., Mandal K., Singh U.P. Calcium and calmodulin modulate fungal spore germination // Indian Phytopathol. 1998. V. 51. P. 319–323.
Song J., Franck J., Pincus P., Kim M.W., Han S. Specific ions modulate diffusion dynamics of hydration water on lipid membrane surfaces // J. Am. Chem. Soc. 2014. V. 136. P. 2642–2649.
Stewart M., Somlyo A.P., Somlyo A.V., Shuman H., Lindsay J.A., Murrell W.G. Distribution of calcium and other elements in cryosectioned Bacillus cereus T spores, determined by high-resolution scanning electron probe x-ray microanalysis // J. Bacteriol. 1980. V. 143. P. 481–491.
Träuble H., Eibl H. Electrostatic effects on lipid phase transitions: membrane structure and ionic environment // Proc. Natl. Acad. Sci. USA. 1974. V. 71. P. 214–219.
Warwar V., Dickman M.B. Effects of calcium and calmodulin on spore germination and appressorium development in Colletotrichum trifolii // Appl. Environ. Microbiol. 1996. V. 62. P. 74–79.
Wilschut J., Duzgunes N., Fraley R., Papahadjopoulos D. Studies on the mechanism of membrane fusion: kinetics of calcium ion induced fusion of phosphatidylserine vesicles followed by a new assay for mixing of aqueous vesicle contents // Biochemistry. 1980. V. 19. P. 6011–6021.
Дополнительные материалы отсутствуют.