Микробиология, 2019, T. 88, № 4, стр. 417-425
Молекулярные механизмы стрессового ответа цианобактерии Planktothrix agardhii на воздействие 4-трет-октилфенола
Т. Б. Зайцева a, *, Н. Г. Медведева a, **
a ФГБУН Санкт-Петербургский научно-исследовательский центр экологической безопасности РАН
197110 Санкт-Петербург, Россия
* E-mail: zaytseva.62@list.ru
** E-mail: ngmedvedeva@gmail.com
Поступила в редакцию 12.02.2019
После доработки 27.02.2019
Принята к публикации 29.03.2019
Аннотация
Исследованы молекулярные механизмы стрессового ответа Planktothrix agardhii, являющейся одним из доминантных представителей цианобактерий в водоемах Северо-Запада РФ и других регионов в период их “цветения”, на воздействие 4-трет-октилфенола (ОФ) – гормоноподобного ксенобиотика антропогенного происхождения. Под воздействием ОФ происходит увеличение проницаемости клеточных мембран P. agardhii, одной из причин которого является окисление мембранных липидов в условиях окислительного стресса, вызванного генерацией активных форм кислорода. В ответ на окислительный стресс, вызванный октилфенолом, у P. agardhii отмечено дозозависимое увеличение активности антиоксидантов ферментативной и неферментативной природы, что свидетельствует об активирующей экспрессию генов стрессовых регулонов функции ОФ. Благодаря схожести структур 4-трет-октилфенола и природных микробных ауторегуляторов – алкилрезорцинов, контролирующих развитие микробных популяций, ОФ при попадании в объекты окружающей среды может имитировать их функции, вмешиваясь в процесс коммуникации микробных клеток в популяции, что может негативно сказываться на сукцессии и стабильности функционирования микробных сообществ.
Октилфенол (ОФ) – 4-(1,1,3,3-тетраметилбутил)фенол – известный ксенобиотик антропогенного происхождения, входящий в группу фенольных ксеноэстрогенов. Наряду с другими алкилфенолами, октилфенол относится к основным гормоноподобным загрязнителям окружающей среды и может быть причиной серьезных репродуктивных аномалий у живых организмов, вызывая у них феминизацию, снижение фертильности, гермафродитизм. Следует отметить, что среди алкилфенолов 4-трет-ОФ обладает наивысшей эстрогенной активностью (Sheikh et al., 2017).
ОФ широко используется в различных отраслях промышленности, в том числе при производстве неионогенных поверхностно-активных соединений – октилфенолэтоксилатов (ОФЭО), которые широко применяются в фармацевтической, горнодобывающей, нефтедобывающей и целлюлозно-бумажной промышленности, входят в состав красок, полимеров, пестицидов, текстильных изделий, а также используются в быту в составе моющих средств (Sheikh et al., 2017).
В окружающую среду октилфенол попадает, в основном, в результате неполной трансформации ОФЭО и детектируется во всех экосистемах (Acir, Guenther, 2018). В результате сброса бытовых и промышленных стоков, более всего октилфенолами загрязнены поверхностные воды как пресноводных, так и морских экосистем (Staniszewska et al., 2016).
Накапливаясь в продуктах питания – рыбе, моллюсках, мясе, ОФ попадает в организм человека и оказывает негативное влияние не только на его репродуктивный процесс, но и, в целом, на здоровье. Известно, что наряду с другими гормоноподобными ксенобиотиками – бисфенолом А и нонилфенолом, октилфенол может быть причиной возникновения у человека онкологических заболеваний (Staniszewska et al., 2016).
В силу этих причин октилфенол и его прекурсор ОФЭО включены в Список веществ, представляющих особую опасность для Балтийского моря, и Список приоритетных опасных веществ Водной Рамочной директивы ЕС (Acir, Guenther, 2018). Однако в Российской Федерации, в европейских странах (за исключением Норвегии), США, странах Азии до сих пор не установлены ограничения на производство и использование ОФ.
Октилфенол токсичен для водных организмов и оказывает на них неблагоприятное воздействие в концентрациях, превышающих 6 мкг/л (Environmental risk…, 2005). Острая и хроническая токсичность ОФ выявлена по отношению к рыбам, беспозвоночным, водорослям (Zaytseva et al., 2015b; Acir, Guenther, 2018).
Однако данные по влиянию ОФ на микроводоросли – первичные продуценты в водных экосистемах – весьма малочисленны. Известно, что октилфенол вызывает ингибирование роста ряда цианобактерий и зеленых водорослей (Zhou et al., 2013; Zaytseva et al., 2015b). При низких концентрациях поллютанта отмечена стимуляция роста некоторых токсигенных штаммов Microcystis aeruginosa. ОФ может вызывать повышенную продукцию клетками цианобактерий Microcystis aeruginosa и Planktothrix agardhii и увеличение экскреции в среду таких метаболитов, как альготоксины и одорирующие вещества (Zaytseva et al., 2015а, 2015b).
Отметим, что до настоящего времени исследователи фокусировали свое внимание только на изучении токсических эффектов ОФ в отношении микроорганизмов, в том числе микроводорослей, не принимая во внимание схожесть его химической структуры с гексилрезорцином – известным микробным ауторегулятором роста и развития культур микроорганизмов из класса алкилоксибензолов (АОБ). Являясь активным началом ауторегуляторных факторов d1 ряда бактерий и дрожжей, АОБ контролируют стадийность развития микроорганизмов (Бухарин и соавт., 2005), образование покоящихся форм бактерий и дрожжей (Эль-Регистан и соавт., 2006), оказывают влияние на фенотипическую диссоциацию микробных популяций (Милько и соавт., 2005). В зависимости от степени гидрофобности АОБ оказывают антистрессовое, протектирующее (метилрезорцин С7-АОБ) или стресс-потенцирующее (гексилрезорцин С12-АОБ) действие на клетки дрожжей Saccharomyces cerevisiae (Конаныхина и соавт., 2008).
Отмечена способность АОБ модифицировать структуру ферментных белков, что приводит к повышению их стабильности и изменению каталитической активности в сторону как активации (С7-АОБ), так и ингибирования (С12-АОБ) (Николаев и соавт., 2008).
Дозозависимое действие гексилрезорцина на повышение экспрессии генов стрессовых регулонов (rpoS, SOS-ответа) Escherichia coli до такой же величины, что и при действии естественных стрессоров, свидетельствует о его сигнальной функции как внеклеточных алармонов – сигналов тревоги (Голод и соавт., 2009).
В силу схожести структуры 4-трет-октилфенола с химической структурой микробного аутоиндуктора гексилрезорцина можно предположить, что клетки цианобактерий будут реагировать на ОФ как на сигнал тревоги, активируя стрессовые регулоны защиты клетки от стресса.
Целью настоящей работы было изучить молекулярные механизмы стрессового ответа цианобактерии Planktothrix agardhii на воздействие 4-трет-октилфенола.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве объекта исследования использовали альгологически чистую культуру цианобактерии Planktothrix (=Oscillatoria) agardhii Gom Anagnostidis et Komarek (CALU 1113) из коллекции Биологического института СПбГУ (Россия).
Цианобактерию выращивали в течение 14 сут на среде BG-11 (Rippka et al., 1979) в статических условиях в колбах Эрленмейера объемом 250 мл; объем среды составлял 100 мл. Культивирование проводили при температуре 25 ± 2°С и освещенности 1000 лк, при световом режиме свет–темнота (12 ч : 12 ч). В качестве инокулята (10 об. %) использовали культуру логарифмической фазы роста, выращенную в указанных выше условиях.
4-Трет-октилфенол (“Sigma-Aldrich”, США) вносили в питательные среды в концентрациях 5 × 10–4–4.0 мг/л в виде растворов в диметилсульфоксиде (0.02 об. %).
Рост цианобактерии контролировали по изменению веса сухой биомассы (г с.б.).
Об изменении проницаемости клеточных оболочек цианобактерии судили по “утечке” из клеток в среду метаболитов, имеющих полосы поглощения в ультрафиолетовой области (220–350 нм) (Fenderson et al., 1990), используя спектрофотометр Genesys 10uv scanning (“Thermo Spectronic”, США). Проницаемость выражали в усл. ед./г с.б.
Содержание малонового диальдегида (МДА) оценивали по количеству продукта его реакции с тиобарбитуровой кислотой (Zutshi et al., 2014) и выражали в мM/г с.б.
Для определения каталазной активности использовали спектрофотометрический метод, основанный на определении скорости разложения перекиси водорода каталазой исследуемого образца. Активность каталазы выражали в U/мг с.б. (Аеby, 1984).
Общую активность супероксиддисмутазы (СОД) выявляли по способности фермента ингибировать фотохимическое восстановление нитросинего тетразолия (Giannopolitis, Ries, 1972). Оптическую плотность измеряли при длине волны 560 нм на спектрофотометре Genesys 10uv scanning (“Thermo Spectronic”, США). Концентрацию СОД выражали в U/мг с.б.
Содержание восстановленного глутатиона определяли спектрофотометрически, используя в качестве субстрата 5,5-дитио-бис-2 нитробензойную кислоту (Gao, Tam, 2011). Оптическую плотность измеряли при 412 нм спектрофотометрически. Концентрацию ГЛУ определяли по калибровочной кривой. Количество восстановленного глутатиона выражали в мкг/мг с.б.
Содержание пролина в биомассе цианобактерий определяли спектрофотометрически при 520 нм (Bates et al., 1973) и выражали в мкг/г с.б.
Содержание каротиноидов оценивали по оптической плотности их экстрактов при длинах волн 453, 644 и 663 нм. Экстракцию каротиноидов проводили 90% ацетоном при 4°С в течение 24 ч. Концентрацию каротиноидов рассчитывали по уравнению, предложенному в работе Parsons и Strickland (Parsons, Strickland, 1963), и выражали в мг/г с.б.
Содержание экзополисахаридов (ЭПС) определяли с использованием антронового метода (Herbert et al., 1971).
Микроцистины экстрагировали из клеток цианобактерии 50%-ным метанолом после трехкратного замораживания–размораживания биомассы. Надосадочную жидкость отделяли центрифугированием при 10 000 об./мин в течение 5 мин. Концентрацию микроцистинов определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на хроматографе HP1090 (“Hewlett-Packard”, США) с диодно-матричным детектором (длина волны 238 нм, разрешение 1.2 нм). Условия хроматографирования: колонка Luna (“Phenomenex”, Великобритания), температура – 35°C, скорость потока – 1 мл/мин, детекция – 238 нм, элюенты – 30%-ный ацетонитрил (растворитель А) и 50%-ный ацетонитрил (растворитель Б), подкисленные 0.1%-ным раствором трихлоруксусной кислоты; объем пробы – 0.2 мл. В работе использован стандартный раствор микроцистина dm-RR (“Sigma-Aldrich”, США).
Полученные данные представлены как среднее значение ± стандартное отклонение трех независимых повторов каждого варианта с тремя параллельными повторностями в каждом. Значимость различий между вариантами выявляли с помощью критерия Стьюдента, различия считались значимыми при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Октилфенол, вносимый одновременно с инокулятом, в концентрациях, не превышающих 1.0 мг/л, не влиял на рост цианобактерии P. agardhii. Ингибирование роста (50%), определенное через 4 сут культивирования, было выявлено при содержании ОФ в среде 2.0 ± 0.2 мг/л. Наибольшая степень подавления роста P. agardhii октилфенолом наблюдалась в конце лаг-фазы – начале экспоненциальной фазы роста культуры (рис. 1).
Рис. 1.
Влияние октилфенола, вносимого вместе с инокулятом, на рост цианобактерии P. agardhii. Концентрации вносимого ОФ: 1 – контроль (без ОФ); 2 – 1.0 мг/л; 3 – 2.0 мг/л; 4 – 4.0 мг/л ОФ.
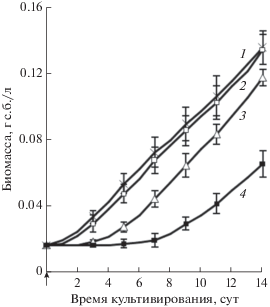
Под действием ОФ изменялся характер роста цианобактерии: наблюдалось удлинение лаг-фазы, снижалась удельная скорость роста, уменьшался выход биомассы (табл. 1). Следует отметить, что эти изменения имели дозозависимый характер.
Снижение скорости роста клеток является характерным и чаще всего используемым на практике признаком стрессового состояния микробной популяции (Николаев, 2004). Любое стрессорное воздействие приводит к изменению функционирования бактериальной клетки, запуская те или иные механизмы адаптации.
Первой линией защиты клеток от внешних стрессорных факторов являются их избирательно проницаемые мембраны (Gerken et al., 2012). Учитывая свойство нонилфенолов и алкилрезорцинов вызывать окислительный стресс у микроорганизмов (Голод и соавт., 2009; Gao, Tam, 2011; Medvedeva et al., 2017), можно предположить, что октилфенол также вызовет повышение уровня активных форм кислорода (АФК) в клетках P. agardhii и, как следствие, усиление перекисного окисления мембранных липидов. Важным маркером, характеризующим окислительное повреждение мембран, является малоновый диальдегид (МДА) – продукт перекисного окисления жирных кислот мембранных липидов (Wan et al., 2015).
В наших экспериментах внесение октилфенола в ростингибирующих концентрациях вместе с инокулятом индуцировало значительное (до 100%) увеличение в клетках P. agardhii уровня МДА. Содержание МДА снижалось в течение культивирования и возрастало с увеличением концентрации ОФ в среде, что свидетельствует о дозозависимой генерации свободных радикалов (рис. 2a). Наибольшее увеличение содержания МДА при внесении 2.0 и 4.0 мг/л октилфенола – в 1.6 и в 2 раза соответственно, коррелировало со степенью ингибирования роста цианобактерии (рис. 2a).
Рис. 2.
Влияние октилфенола, вносимого вместе с инокулятом, на уровень малонового диальдегида (а) и проницаемость клеточных оболочек (б) цианобактерии P. agardhii. Концентрации вносимого ОФ: 1 – контроль (без ОФ); 2 – 2 мг/л; 3 – 4 мг/л.
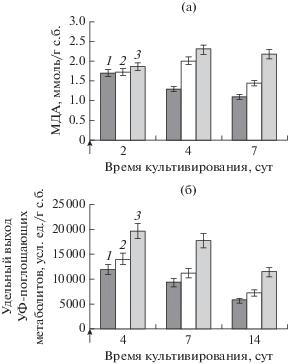
В результате перекисного окисления мембранных липидов изменяется структурная организация мембран, увеличивается мембранная проницаемость, что может приводить к “вытеканию” цитоплазматического содержимого клетки (Liu et al., 2013). Удельный выход из клеток цианобактерии P. agardhii метаболитов, поглощающих в УФ-области, как маркер проницаемости мембран был максимальным в начале культивирования в контрольных и опытных вариантах и по мере роста культуры снижался. При этом стимулирующий эффект от воздействия октилфенола изменялся в процессе культивирования, достигая наибольших значений к 14 сут – 127% (2 мг/л ОФ) и 200% (4 мг/л ОФ). Следует отметить, что уровень удельного выхода метаболитов положительно коррелировал с концентрацией вносимого поллютанта (рис. 2б).
В следующей серии экспериментов было показано, что действие ОФ на клетки P. agardhii приводит к дозозависимому увеличению активности антиоксидантной (ферментативной и неферментативной) системы защиты клеток от повреждающего действия АФК, что свидетельствует об активирующей стрессовые регулоны функции октилфенола.
Большое значение в ферментативной антиоксидантной системе водорослей имеют активности супероксиддисмутазы, катализирующей превращение ${\text{O}}_{2}^{ - }$ в кислород О2 и перекись водорода Н2О2, и каталазы, разлагающей перекись водорода с образованием воды и молекулярного кислорода (Wan et al., 2015).
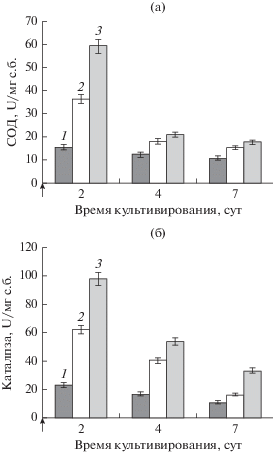
Наши исследования показали, что в вариантах внесения ОФ активности СОД и каталазы у P. agardhii значительно – от 1.5 до 4.5 раз превышали их контрольные уровни на протяжении всего времени культивирования и положительно коррелировали с концентрацией внесенного ОФ. Наибольшее увеличение активностей СОД и каталазы в присутствии октилфенола отмечено на 2-е сутки роста цианобактерии, далее по мере роста культуры стимулирующее влияние ОФ на синтез антиоксидантных ферментов снижалось (рис. 3).
Рис. 3.
Влияние ОФ, вносимого вместе с инокулятом, на активность ферментов супероксиддисмутазы (а) и каталазы (б) цианобактерией P. agardhii. Концентрации вносимого ОФ: 1 – контроль (без ОФ); 2 – 2 мг/л; 3 – 4 мг/л.
Учитывая важную роль системы неферментативной антиоксидантной защиты клеток от повреждающего действия АФК, было изучено влияние ОФ на синтез ряда неферментативных антиоксидантов: восстановленного глутатиона, каротиноидов, пролина, микроцистинa и полисахаридов.
Глутатион является наиболее распространенным низкомолекулярным тиолом у большинства живых организмов от бактерий до млекопитающих, выполняющим важнейшую антиоксидантную функцию в клетках, снижая уровень АФК (Октябрьский, Смирнова, 2012). Другая роль глутатиона может быть связана с его участием в контроле функционирования К+ выходных каналов бактериальных клеток (Booth et al., 1996). Наряду с глутатионом, система неферментативной антиоксидантной защиты клетки P. agardhii включает в себя каротиноиды, аминокислоту пролин, микроцистин и экзополисахариды. Являясь антиоксидантами, каротиноиды гасят возбужденные состояния триплетного хлорофилла, предотвращая образование высокого уровня АФК и защищая светособирающие пигменты в антенных комплексах от фотоокислительных повреждений (Domonkos et al., 2013). Множественные антиоксидантные функции пролина заключаются в подавлении образования свободных радикалов, вызывающих окисление мембранных липидов, а также в регуляции окислительно-восстановительного баланса клетки (Zutshi et al., 2014).
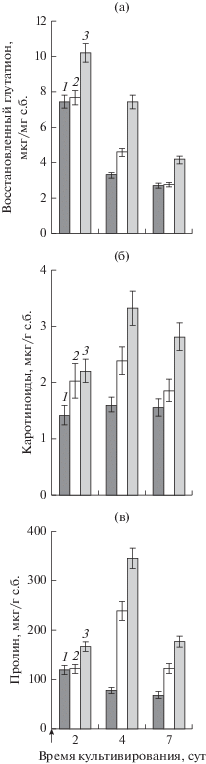
Подобно активностям антиоксидантных ферментов СОД и каталазы, ОФ стимулировал у цианобактерии P. agardhii и синтез низкомолекулярных антиоксидантов. Отмечена положительная корреляция концентрации ОФ с увеличением содержания восстановленного глутатиона, каротиноидов и пролина, концентрации которых в присутствии ОФ возрастали в 2.3, 2.1 и 4.5 раз соответственно (рис. 4).
Рис. 4.
Влияние ОФ, вносимого вместе с инокулятом, на синтез восстановленного глутатиона (а), каротиноидов (б) и пролина (в) цианобактерией P. agardhii. Концентрации вносимого ОФ: 1 – контроль (без ОФ); 2 – 2 мг/л; 3 – 4 мг/л.
Отметим, что увеличение активности ферментативной и неферментативной антиоксидантных систем в условиях окислительного стресса было ранее выявлено при изучении влияния другого алкилфенола – нонилфенола, на микроводоросли, в том числе на P. agardhii (Gao, Tam, 2011; Medvedeva et al., 2017).
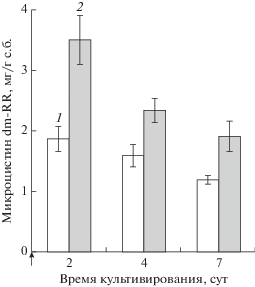
Стимуляция синтеза альготоксина микроцистина – “ловушки” свободных радикалов (Hernando et al., 2018), также является ответом цианобактерии P. agardhii на окислительный стресс, индуцируемый внесением в культуру октилфенола. Ранее мы показали, что штамм P. agardhii CALU 1113 синтезирует ряд микроцистинов, основным из которых является деметилированный микроцистин RR – dm-RR (Zaytseva et al., 2015а). Под влиянием ОФ удельная продуктивность P. agardhii по этому альготоксину возросла до 2 раз (рис. 5).
Рис. 5.
Влияние ОФ, вносимого вместе с инокулятом, на удельную продуктивность цианобактерии P. agardhii по микроцистину dm-RR. Концентрации вносимого ОФ: 1 – контроль (без ОФ); 2 – 4 мг/л.
Антиоксидантные свойства были выявлены также у экзополисахаридов (ЭПС) микроводорослей (Trabelsi et al., 2016), повышенный синтез которых рассматривается как адаптивная реакция этих микроорганизмов в ответ на различные неблагоприятные условия (El-Sheekh et al., 2012; Medvedeva et al., 2017). Выявленное в работе увеличение синтеза ЭПС, вызванное ОФ, имело время- и дозозависимый характер: под влиянием ОФ продуктивность биомассы P. agardhii по ЭПС возрастала до 6.5 раз. Причем наибольшее увеличение синтеза ЭПС было зафиксировано в опытных вариантах в конце лаг-фазы и начале экспоненциальной фазы роста в варианте максимального ингибирования роста культуры (рис. 6).
Рис. 6.
Влияние ОФ, вносимого вместе с инокулятом, на продуктивность P. agardhii по экзополисахаридам. Концентрации вносимого ОФ: 1 – контроль (без ОФ); 2 – 2 мг/л; 3 – 4 мг/л.
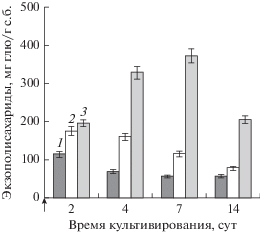
Таблица 1.
Влияние октилфенола на параметры роста Р. agardhii
| Параметр | Контроль | Октилфенол, мг/л | ||
|---|---|---|---|---|
| 1.0 | 2.0 | 4.0 | ||
| Длительность лаг-фазы, сут | 0.75 ± 0.11 | 0.8 ± 0.1 | 3.5 ± 0.4 | 6.5 ± 0.6 |
| Удельная скорость роста, μ, сут–1 | 0.26 ± 0.01 | 0.26 ± 0.02 | 0.25 ± 0.03 | 0.19 ± 0.01 |
| Биомасса, г с.б./л (14 сут) | 0.14 ± 0.02 | 0.14 ± 0.01 | 0.12 ± 0.01 | 0.07 ± 0.01 |
Гормоноподобный ксенобиотик – 4-трет-октилфенол, широко используемый в различных производствах, при попадании в водные экосистемы оказывает негативное влияние на живые организмы вследствие нарушения иммунонейроэндокринного гомеостаза и проявляет токсическое действие на гидробионты. Октилфенол ингибирует рост Planktothrix agardhii, являющейся одним из доминантных представителей цианобактерий в водоемах Северо-Запада России и других регионов в период их “цветения”. Повышение концентрации ОФ в среде выше критического уровня (>1.0 мг/л) индуцировало окислительный стресс и приводило к ингибированию роста, увеличению продолжительности лаг-фазы и снижению скорости роста. Уровень ЕС50 октилфенола (4 сут культивирования) для P. agardhii составил 2 мг/л.
Результатом окислительного стресса, развивающегося под воздействием ОФ, было увеличение проницаемости клеточных мембран P. agardhii, одной из причин которого является окисление мембранных липидов, вызванное генерацией активных форм кислорода. Окислительный стресс, вызванный ОФ, индуцировал включение ферментативных (повышенная активность каталазы, супероксиддисмутазы) и неферментативных (стимуляция синтеза глутатиона, каротиноидов, пролина, микроцистина, экзополисахаридов) механизмов антиоксидантной защиты клеток, что свидетельствует об активирующей экспрессию генов стрессовых регулонов функции октилфенола. Благодаря схожести структур 4-трет-октилфенола и природных микробных ауторегуляторов – алкилрезорцинов, контролирующих развитие микробных популяций, ОФ при попадании в объекты окружающей среды может имитировать их функции, вмешиваясь в процесс коммуникации микробных клеток в популяции, что может негативно сказываться на сукцессии и стабильности функционирования микробных сообществ.
Список литературы
Бухарин О.В., Гинцбург А.Л., Романова Ю.М., Эль-Регистан Г.И. Механизмы выживания бактерий. М: Медицина, 2005. 367 с.
Голод Н.А., Лойко Н.Г., Лобанов К.В., Миронов А.С., Воейкова Т.А., Гальченко В.Ф., Николаев Ю.А., Эль-Регистан Г.И. Роль микробных ауторегуляторов – алкилоксибензолов, в контроле экспрессии стрессовых регулонов // Микробиология. 2009. Т. 78. № 6. С. 731–741.
Golod N.A., Loiko N.G., Lobanov K.V., Mironov A.S., Voieikova T.A., Gal’chenko V.F., Nikolaev Yu.A., El’-Registan G.I. Involvement of alkylhydroxybenzenes, microbial autoregulators, in controlling the expression of stress regulons // Microbiology (Moscow). 2009. V. 78. P. 678–688.
Конаныхина И.А., Шаненко Е.Ф., Лойко Н.Г., Николаев Ю.А., Эль-Регистан Г.И. Регулирующее действие микробных алкилоксибензолов различной структуры на стрессовый ответ дрожжей // Прикл. биохимия и микробиология. 2008. Т. 44. № 5. С. 571–575.
Konanykhina I.A., Shanenko E.F., Loiko N.G., Nikolaev Yu.A., El’-Registan G.I. Regulatory effect of microbial alkyloxybenzenes of different structure on the stress response of yeast // Appl. Biochem. Microbiol. 2008. V. 44. P. 518–522.
Милько Е.С., Хабибуллин С.С., Николаев Ю.А., Козлова A.Н., Эль-Регистан Г.И. Динамика роста и состава популяций смешанных культур R-, S- и М-диссоциантов Pseudomonas aeruginosa // Микробиология. 2005. Т. 74. № 4. С. 475–482.
Mil’ko E.S., Khabibullin S.S., Nikolaev I.A., Kozlova A.N., El’-Registan G.I. Dynamics of the growth and population composition of mixed cultures of R-, S-, and M-dissociants of Pseudomonas aeruginosa // Microbiology (Moscow). 2005. V. 74. P. 408–414.
Николаев Ю.А. Внеклеточные факторы адаптации бактерий к неблагоприятным условиям среды // Прикл. биохимия и микробиология. 2004. Т. 40. № 4. С. 387–397. Nikolaev Yu.A. Extracellular factors of bacterial adaptation to unfavorable environmental conditions // Appl. Biochem. Microbiol. 2004. V. 40. P. 327–336.
Николаев Ю.А., Лойко Н.Г., Степаненко И.Ю., Шаненко Е.Ф., Мартиросова Е.И., Плакунов В.К., Козлова А.Н., Борзенков И.А., Коротина О.А., Родин Д.С., Крупянский Ю.Ф., Эль-Регистан Г.И. Изменения физико-химических свойств белков, модифицированных алкилоксибензолами // Прикл. биохимия и микробиология. 2008. Т. 44. № 2. С. 159–167.
Nikolaev Yu.A., Loiko N.G., Stepanenko I.Yu., Shanenko E.F., Martirosova E.I., Plakunov V.K., Kozlova A.N., Borzenkov I.A., Korotina O.A., Rodin D.S., Krupyanskii Yu.F., El’-Registan G.I. Changes in physicochemical properties of proteins, caused by modification with alkylhydroxybenzenes // Appl. Biochem. Microbiol. 2008. V. 44. P. 143–150.
Октябрьский О.Н., Смирнова Г.В. Изменения редокс-потенциала в культурах бактерий при стрессах // Микробиология. 2012. Т. 81. № 2. С. 147–158.
Oktyabrskii O.N., Smirnova G.V. Redox potencial changes in bacterial cultures under stress conditions // Microbiology (Moscow). 2012. V. 81. P. 131–142.
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. № 4. С. 446–456.
El’-Registan G.I., Muliukin A.L., Nikolaev I.A., Suzina N.E., Gal’chenko V.F., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology (Moscow). 2006. V. 75. P. 380–389.
Acir I.-H., Guenther K. Endocrine-disrupting metabolites of alkylphenol ethoxylates – A critical review of analytical methods, environmental occurrences, toxicity, and regulation (Review) // Sci. Total Environ. 2018. V. 635. P. 1530–1546.
Aeby H. Catalase in vitro // Methods Enzymol. 1984. V. 105. P. 121–126.
Bates L.S., Walderen R.D., Teare I.D. Rapid determination of free proline for water stress studies // Plant Soil. 1973. V. 39. P. 205–207.
Booth I.R., Jones M.A., McLaggan D., Nikolaev Y., Ness L.S., Wood C.M., Miller S., Totemeyer S., Ferguson G.P. Bacterial ion channels // Handbook of Biological Physics / Eds. Konings W.N., Kaback H.R., Lolkema J.S. Amsterdam: Elsevier Science, 1996. P. 693–729.
Domonkos I., Kis M., Gombos Z., Ughy B. Carotenoids, versatile components of oxygenic photosynthesis // Prog. Lipid. Res. 2013. V. 52. P. 539–561.
El-Sheekh M.M., Khairy H.M., El-Shenody R. Algal production of extra and intra-cellular polysaccharides as an adaptive response to the toxin crude extract of Microcystis aeruginosa // Iranian J. Environ. Health. Sci. Eng. 2012. V. 9 (1). 10 p.
Environmental Risk Evalution Report: 4-tert-Octylphenol / Eds. Brooke D., Johnson I., Mitchell R.J., Watts C. Wales: Env. Agency, 2005. 218 p.
Fenderson B.A., Eddy E.M., Hakomori S. Glycoconjugate expression during embryogenesis and its biological significance // Bioassays. 1990. V. 12. P. 173–179.
Gao Q.T., Tam N.F.Y. Growth, photosynthesis and antioxidant responses of two microalgal species, Chlorella vulgaris and Selenastrum capricornutum, to nonylphenol stress // Chemosphere. 2011. V. 82. P. 346–354.
Gerken H.G., Donohoe B., Knoshaug E.P. Enzymatic cell wall degradation of Chlorella vulgaris and other microalgae for biofuels production // Planta. 2013. V. 237. P. 239–253.
Giannopolitis C.N., Ries S.K. Superoxide dismutase I. Occurrence in higher plants // Plant Physiol. 1977. V. 59. P. 309–314.
Herbert D., Phipps P.J., Stange R.E. Chapter III. Chemical analysis of microbial cells // Methods Microbiol. 1971. V. 5 (Part B). P. 209–344.
Hernando M., Minaglia M.C.C., Malanga G., Houghton C., Andrinolo D., Sedan D., Rosso L., Giannuzzi L. Physiological responses and toxin production of Microcystis aeruginosa in short-term exposure to solar UV radiation // Photochem. Photobiol. Sci. 2018. V. 17. P. 69–80.
Liu Y., Dai X., Wei J. Toxicity of the xenoestrogen nonylphenol and its biodegradation by the alga Cyclotella caspia // J. Environ. Sci. 2013. V. 25. P. 1662–1671.
Medvedeva N., Zaytseva T., Kuzikova I. Cellular responses and bioremoval of nonylphenol by the bloom-forming cyanobacterium Planktothrix agardhii 1113 // J. Mar. Syst. 2017. V. 171. P. 120–128.
Parsons T.R., Strickland J.D.H. Discussion of spectrophotometric determination of marine-plant pigments with revised equations for ascertaining chlorophylls and caro-tenoids // J. Mar. Res. 1963. V. 21. P. 155–163.
Rippka R., Deruelles J., Waterbury J.B., Herdman M., Stanier R.Y. Genetic assignments, strain histories and properties of pure cultures of cyanobacteria // J. Gen. Microbiol. 1979. V. 111. P. 1–61.
Sheikh I.F., Tayubi I.A., Ahmad E., Ganaie M.A., Bajouh O.S., AlBasri S.F., Abdulkarim I.M.J., Beg M.A. Computational insights into the molecular interactions of environmental xenoestrogens 4-tert-octylphenol, 4-nonylphenol, bisphenol A (BPA), and BPA metabolite, 4-methyl-2, 4-bis(4-hydroxyphenyl) pent-1-ene (MBP) with human sex hormone-binding globulin // Ecotoxicol. Environ. Saf. 2017. V. 135. P. 284–291.
Staniszewska M., Nehring I., Mudrak-Cegiołka S. Changes of concentrations and possibility of accumulation of bisphenol A and alkylphenols, depending on biomass and composition, in zooplankton of the Southern Baltic (Gulf of Gdansk) // Environ. Pollut. 2016. V. 213. P. 489–501.
Trabelsi L., Chaieb O., Mnari A., Abid-Essafi S., Aleya L. Partial characterization and antioxidant and antiproliferative activities of the aqueous extracellular polysaccharides from the thermophilic microalgae Graesiella sp. // BMC Complem. Altern. Med. 2016. V. 16. P. 210–219.
Wan J., Guo P., Peng X., Wen K. Effect of erythromycin exposure on the growth, antioxidant system and photosynthesis of Microcystis flos-aquae // J. Hazard. Mater. 2015. V. 283. P. 778–786.
Zaytseva T.B., Milman B.L., Lugovkina N.V., Chernova E.N., Russkikh I.V., Sataeva S.M., Medvedeva N.G. Effect of octyl- and nonylphenols on the growth, photosynthetic activity and toxin production of cyanobacteria Plankto-thrix agardhii // Hydrobiol. J. 2015a. V. 51. № 6. P. 36–47.
Zaytseva T.B., Medvedeva N.G., Mamontova V.N. Peculiarities of the effect of octyl- and nonylphenols on the growth and development of microalgae // Inland Water Biol. 2015b. V. 8. P. 406–413.
Zhou G.-J., Peng Fu-Q., Yang B., Ying G.-G. Cellular responses and bioremoval of nonylphenol and octylphenol in the freshwater green microalgae Scenedesmus obliquus // Ecotoxicol. Environ. Saf. 2013. V. 87. P. 10–16.
Zutshi S., Bano F., Ningthoujam M., Habib K., Fatma T. Metabolic adaptation to arsenic-induced oxidative stress in Hapalosiphon fontinalis-339 // Int. J. Innov. Res. Sci. Eng. Technol. 2014. V. 3. P. 9386–9394.
Дополнительные материалы отсутствуют.


