Микробиология, 2019, T. 88, № 5, стр. 519-531
Растительно-микробные взаимодействия с участием Quorum sensing регуляции
Ю. В. Зайцева a, *, А. В. Сидоров a, О. А. Маракаев a, И. А. Хмель b
a Ярославский государственный университет им. П.Г. Демидова
150003 Ярославль, Россия
b Институт молекулярной генетики РАН
123182 Москва, Россия
* E-mail: zjv9@mail.ru
Поступила в редакцию 08.02.2019
После доработки 21.02.2019
Принята к публикации 27.03.2019
Аннотация
Quorum sensing (QS) – это механизм межклеточной коммуникации бактерий, зависящий от плотности их популяции. QS активирует экспрессию сотен бактериальных генов, многие из которых играют важную роль в растительно-микробных взаимодействиях. В обзоре представлены последние научные достижения в области изучения роли бактериальных QS систем коммуникации в растительно-микробнoм сигналинге. Основное внимание сконцентрировано на наиболее изученных в этом отношении QS системах грамотрицательных бактерий, функционирующих с участием N-ацил-гомосеринлактонов (АГЛ). Рассмотрены эффекты влияния АГЛ и АГЛ-синтезирующих бактерий на рост, развитие и устойчивость растений. Описаны сигнальные функции растительных метаболитов, способных активировать или ингибировать бактериальные QS системы, тем самым регулируя QS-зависимые модели поведения в ассоциированных с растениями микробных сообществах. Рассмотрены возможные способы деградации АГЛ в ризосфере. Приведены данные о перспективах практического применения механизмов QS регуляции для защиты растений.
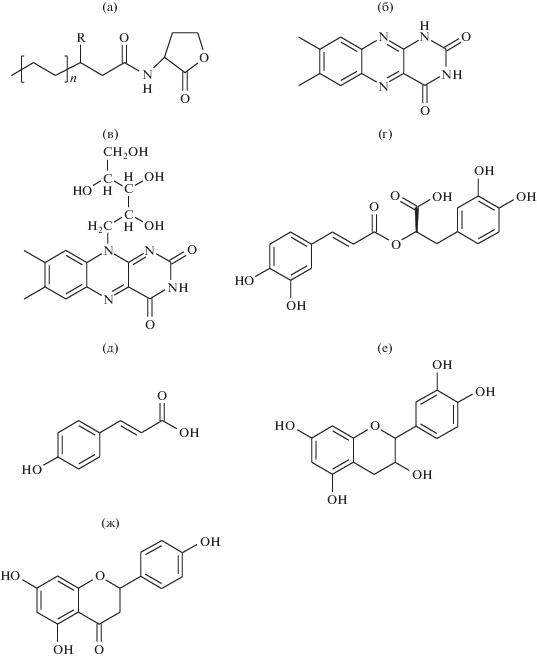
Межклеточная сигнализация с помощью низкомолекулярных метаболитов обнаружена у большинства живых организмов, в том числе у микроорганизмов (Хохлов, 1988). Открытие бактериальной межклеточной сигнализации типа плотностной регуляции, или quorum sensing (QS), показало, что одноклеточные прокариотические организмы обладают сложными механизмами координации их поведения в ответ на изменения условий среды (Fuqua et al., 1994). QS – это механизм межклеточной коммуникации бактерий, который зависит от плотности популяции бактериальных клеток. Функционирование QS систем основано на взаимодействии низкомолекулярных сигнальных молекул (аутоиндукторов), легко диффундирующих из клеток в среду и обратно, с рецепторными регуляторными белкками. Несмотря на широкое разнообразие идентифицированных за это время бактериальных сигнальных молекул, основным и наиболее изученным классом аутоиндукторов большинства грамотрицательных бактерий являются N-ацил-гомосеринлактоны (АГЛ) (Fuqua et al., 1994; Зайцева, 2014). Молекула АГЛ состоит из лактонного кольца и ацильной боковой цепи. Специфичность действия АГЛ определяется количеством атомов углерода в боковых цепях (от С4 до С16) и присутствием дополнительных группировок (оксо-, гидрокси-) в положении С3 (рис. 1а).
Рис. 1.
АГЛ (а) и АГЛ-миметики (б–ж): молекула N-ацил-гомосеринлактона (АГЛ), где n варьирует от 0 до 6, R = O, OH (а); люмихром (б); рибофлавин (в); розмариновая кислота (г); р-кумаровая кислота (д); катехин (е); нарингенин (ж).
Биосинтез АГЛ осуществляется ферментами АГЛ-синтазами LuxI-типа. По мере того, как популяция бактерий численно увеличивается и достигает критического уровня, АГЛ накапливаются до необходимого порогового значения и связываются с соответствующими рецепторными белками LuxR-типа (регуляторы транскрипции), образуя комплексы, регулирующие экспрессию определенных генов (Fuqua et al., 1994; Зайцева, 2014).
Большинство работ, посвященных изучению QS, в основном ориентировано на установление структуры аутоиндукторов этих систем. Значительный прогресс был достигнут в идентификации рецепторных белков, с которыми они связываются, что в результате приводит к изменению программ экспрессии генов. Не так давно стало известно, что эти бактериальные сигналы могут восприниматься эукариотическими организмами, сосуществующими в симбиозе с микробными сообществами (McDougald et al., 2007; Hartmann et al., 2014; Schikora et al., 2016; Gregor et al., 2018).
Растения постоянно подвергаются колонизации бактериями. Изучение почвенных бактерий показало, что система QS чаще встречается у ризосферных бактерий (Elasri et al., 2001). Коммуникация ассоциированных с растениями бактерий посредством АГЛ имеет решающее значение при взаимодействии патогенов и симбионтов с растением-хозяином. QS активирует экспрессию сотен бактериальных генов, многие из которых играют важную роль в растительно-микробных взаимодействиях, в том числе генов, ответственных за формирование биопленок, фиксацию азота, синтез гидролитических ферментов, экзополисахаридов, токсинов, а также подвижность клеток и конъюгацию (Gonzalez, Marketon, 2003; Von Bodman et al., 2003). Так как симбиотические и патогенные микроорганизмы используют QS-регуляцию с целью, соответственно, колонизации или инфицирования организма хозяина, не удивительно, что эукариотические организмы сформировали механизмы, позволяющие им воспринимать бактериальные сигналы QS, реагировать на них, а также манипулировать бактериальной межклеточной сигнализацией (Rowe et al., 2018). Механизмы обнаружения бактериальных аутоиндукторов системы QS организмом-хозяином и последствия этих межорганизменных взаимодействий остаются пока слабо изученными.
Цель данного обзора – обобщить имеющуюся на сегодняшний день информацию о роли бактериальных систем quorum sensing в формировании и функционировании растительно-микробных сообществ. Исследования механизмов QS-коммуникации при растительно-микробных взаимодействиях будут рассмотрены с позиции двусторонней сигнализации. С одной стороны, это сигнальные для микроорганизмов функции растительных метаболитов, химическая и ферментативная деградация АГЛ; с другой – влияние бактериальных аутоиндукторов ситем QS на жизнедеятельность растений.
СИГНАЛЬНЫЕ ФУНКЦИИ РАСТИТЕЛЬНЫХ МЕТАБОЛИТОВ
Растения синтезируют различные соединения, которые могут влиять на QS-зависимые модели поведения в ассоциированном микробном сообществе. Такая интерференция может включать в себя синтез ингибиторов QS – метаболитов растений, разрушающих бактериальные QS пути (Fray et al., 1999; Asfour, 2018). Стратегия подавления QS систем получила название quorum quenching (QQ) (Grandclement, 2016).
Поскольку различные бактериальные патогены используют QS-регуляцию для индукции экспрессии генов, связанных с вирулентностью, устойчивостью к антибиотикам и образованием биопленок, поиск ингибиторов QS стал одной из актуальных задач современной микробиологии и биомедицины (Khmel, Metlitskaia, 2006; Kalia et al., 2019). Растения и их метаболиты привлекают внимание исследователей как источник новых эффективных и безопасных средств против QS (Koh et al., 2013; Asfour, 2018).
Первыми идентифицированными анти-QS-соединениями были галогенированные фураноны из красной водоросли Delisea pulchra (Hentzer et al., 2002). Они ингибируют экспрессию QS-контролируемых генов вирулентности у патогенов растений и животных путем конкурентного связывания с белками LuxR-типа, увеличивая скорость протеолитической деградации этих рецепторов и, таким образом, эффективно разрушая бактериальные QS-каскады (Manefield et al., 2002; Koch et al., 2005). Высвобождение галогенированных фуранонов на поверхности водорослевых талломов изменяет состав ассоциированной с ними микробиоты, смещая его из сообщества с доминированием грамотрицательных бактерий (распространенных в морской среде) к сообществу с преобладанием грамположительных бактерий. Кроме того, D. pulchra использует эти ингибиторы QS для снижения концентрации бактериальных клеток, тем самым предотвращая образование бактериальных биопленок на поверхности водорослей (Givskov et al., 1996; Gram et al., 1996). Это стало одним из первых доказательств того, что QS сигнальные молекулы, производимые эукариотами, выполняют важные функции в растительно-микробных взаимодействиях.
Водоросли не являются уникальными в своей способности воздействовать на бактериальные QS-системы. Описан широкий спектр растительных метаболитов, способных ингибировать QS-регуляцию у бактерий (рис. 3а). Основные группы этих соединений включают простые фенолы, хиноны, сапонины, флавоноиды, кумарины, алкалоиды, терпеноиды и полиацетилены (Fray, 2002; Маркова, 2014; Asfour, 2018; Kalia et al., 2019). Механизм и эффективность ингибирующего действия этих соединений определяется различиями их структуры и химического состава. Так, например, молекулярные механизмы QQ растительных метаболитов могут заключаться в: подавлении синтеза АГЛ (Rudrappa, Bais, 2008; Vandeputte et al., 2011; Sarkar et al., 2015); конкуренции с бактериальными сигнальными молекулами за связывание с рецепторными белками (Zhu, Sun, 2008); снижении экспрессии QS-контролируемых генов (Vandeputte et al., 2010; Vandeputte et al., 2011; Fournier-Larente et al., 2016; Ouyang, J. et al., 2016).
Рис. 2.
Механизмы ферментативной деградации АГЛ: гидролиз АГЛ под действием лактоназ (а), ацилаз (б) и восстановление кетогруппы под действием редуктаз (в).
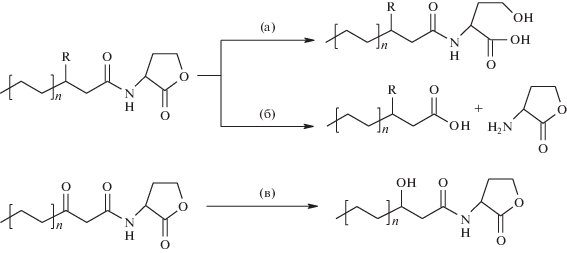
Рис. 3.
Механизмы QS-коммуникации, возникающие при различных взаимодействиях между растениями и бактериями: растения синтезируют ингибиторы QS (а); растения синтезируют активаторы QS, АГЛ-мимикрия (б); генетическая модификация растений генами АГЛ-лактоназ (в); генетическая модификация растений генами АГЛ-синтаз (г); синтез АГЛ-деградирующих ферментов бактериями, ассоциированными с растением (д); влияние АГЛ и АГЛ-синтезирующих бактерий на процессы жизнедеятельности растений (е); гидролиз АГЛ растительными ферментами (ж). Стрелками показаны QS-механизмы симбиотических взаимоотношений между растением и ассоциированными с ним бактериями; перечеркнутые стрелки обозначают механизмы ингибирования QS как возможные способы защиты растения от фитопатогенов.
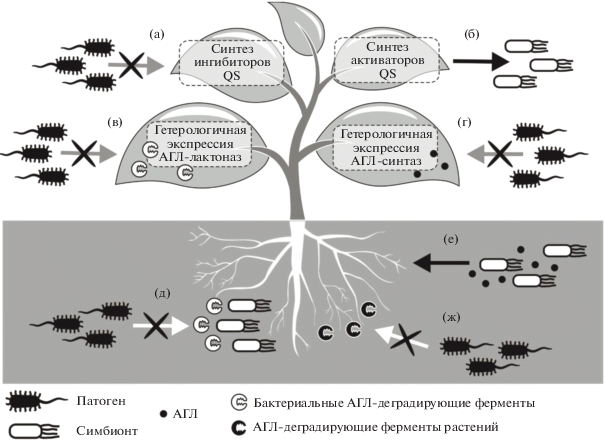
Особый интерес представляют растительные метаболиты, которые могут взаимодействовать с рецепторами АГЛ и активировать транскрипцию целевых генов. Способность таких соединений замещать АГЛ при взаимодействии с рецепторными белками получило название АГЛ-мимикрии (Teplitski et al., 2000). Растительные метаболиты, имитирующие сигнальные молекулы бактерий, могут быть важными регуляторами взаимодействий между высшими растениями и ассоциированной микробиотой.
Первым идентифицированным эукариотическим соединением, структурно отличным от АГЛ, но при этом способным активировать бактериальную QS-систему, было производное рибофлавина – люмихром (рис. 1б, 1в) (Rajamani et al., 2008). Люмихром и рибофлавин, вероятно, непосредственно взаимодействуют с АГЛ-связывающим карманом репортерного белка LasR у Pseudomonas aeruginosa (АГЛ-рецептор LuxR-типа) (Ahumedo et al., 2010). Такие соединения называют АГЛ-миметиками (рис. 3б). Позднее были идентифицированы еще несколько растительных метаболитов, в основном фенольной природы, являющихся потенциальными АГЛ-миметиками. Розмариновая кислота, представляющая собой производное фенилпропаноида, стимулировала активность регулятора транскрипции RhlR у Pseudomonas aeruginosa (рис. 1г) (Corral-Lugo et al., 2016a, 2016b). Предшественник лигнина р-кумаровая кислота, секретируемая корнями растений, может формировать р-кумароил-гомосеринлактон, особый QS-сигнал, который воспринимается некоторыми бактериями (рис. 1д) (Schaefer et al., 2008). Флавоноиды катехин и нарингенин, содержащиеся во многих видах растений, также показали активность в качестве QS-миметиков (рис. 1е, 1ж) (Vandeputte et al., 2010; Vikram et al., 2010). Интересно отметить, что синтез АГЛ-миметиков активируется у растений под воздействием QS сигналов ризобактерий. Так, бактериальные АГЛ стимулировали образование флавоноидов у люцерны усеченной (Medicago truncatula) (Mathesius et al., 2003), а заражение растений штаммом P. aeruginosa PAO1 индуцировало секрецию розмариновой кислоты корнями (Corral-Lugo et al., 2016a). Эти результаты убедительно свидетельствуют о способности растений распознавать бактериальные сигналы и отвечать на них посредством синтеза АГЛ-миметиков.
Динамика синтеза и секреции АГЛ-миметиков является еще одним важным, но пока недостаточно изученным аспектом их функционирования. Предполагается, что синтез и секреция АГЛ-миметиков растениями зависят от присутствия бактерий, способных синтезировать АГЛ. Воздействие наномолекулярных количеств АГЛ на проростки М. truncatula привело к появлению QS-активности их экссудатов и экстрактов (Mathesius et al., 2003). Было обнаружено, что синтез и секреция АГЛ-миметиков зависят также от возраста растения (Gao et al., 2003). Многие QS-активные вещества, содержащиеся в экстрактах семян и проростков, на последующих этапах развития растения не обнаруживались. Это говорит о том, что растение прекращает их синтез, а первоначально секретируемые АГЛ-миметики впоследствии деградируются или инактивируются. Индуцированный синтез или секреция QS-активных соединений на разных этапах развития растения может оказаться важным аспектом растительно-микробных взаимодействий.
ДЕГРАДАЦИЯ АГЛ В РИЗОСФЕРЕ
Ассоциированные с растениями бактерии могут синтезировать АГЛ. В естественных условиях АГЛ обнаруживаются в прикорневой зоне и на поверхности листьев растений (Schuhegger et al., 2006; Rajamani et al., 2008; Dulla, Lindow, 2009). На синтез сигнальных молекул, их стабильность и распределение влияют многие факторы окружающей среды. В ризосфере концентрация АГЛ зависит от адсорбции на частицах почвы, гидролиза лактонного кольца при фотокаталитическом окислении, температуры и значения рН окружающей среды. Так, период полураспада АГЛ может составлять от нескольких часов при высоких значениях рН и температуры (20°C) до нескольких дней при низких значениях рН и температуры (4°C) (Delalande et al., 2005). В щелочных условиях молекулы АГЛ менее стабильны вследствие расщепления лактонного кольца, в кислых условиях этот процесс обратим (Horswill et al., 2007). Кроме того, в водной среде 3-оксо-C12-АГЛ из Pseudomonas aeruginosa может подвергаться конденсации Кляйзена, что приводит к формированию производного пирролидин-2,4-диона, обладающего антибактериальной активностью в отношении некоторых грамположительных бактерий (Kaufmann et al., 2005). В то же время, в отношении грамотрицательных бактерий такого эффекта не наблюдалось. По-видимому, 3-оксо-АГЛ могут быть преобразованы из сигнала для коммуникации в “оружие” против других микроорганизмов, обеспечивая тем самым конкурентное преимущество для синтезирующих их бактерий и способствуя их выживанию.
Еще одним фактором деградации молекул АГЛ в ризосфере является их гидролиз растительными и бактериальными QQ ферментами (рис. 3д, 3ж). Бактерии используют различные ферменты, которые могут ингибировать функционирование QS других микроорганизмов (рис. 2). Первый фермент, способный гидролизовать АГЛ, был выделен из штамма Bacillus sр. 240B1 (Dong et al., 2000). Этот фермент обладал лактоназной активностью, то есть был способен инактивировать сигналы АГЛ путем гидролиза лактонного кольца (рис. 2а) (Dong et al., 2000). Позднее у штамма Ralstonia sр. XJ12B был обнаружен фермент, обладающий ацилазной активностью и способный гидролизовать амидную связь АГЛ с высвобождением гомосеринлактона и соответствующей жирной кислоты (рис. 2б) (Lin et al., 2003). Бактерии рода Rhodococcus обладают сразу тремя типами ферментов, инактивирующих АГЛ: лактоназами, ацилазами и редуктазами (Uroz et al., 2005; Park et al., 2006). В настоящее время АГЛ-деградирующие ферменты обнаружены как у грамположительных, так и у грамотрицательных бактерий, включая Agrobacterium (Carlier et al., 2003), Streptomyces (Vanjildorj et al., 2009), Arthrobacter (Vanjildorj et al., 2009), Pseudomonas (Sio et al., 2006), Klebsiella (Vanjildorj et al., 2009), Comamonas (Uroz et al., 2007), Shewanella (Morohoshi et al., 2008), Sphingomonas (Morohoshi et al., 2017), Enterobacter (Rajesh, Rai, 2015), Ochrobactrum sp. (Gregor et al., 2018), Brucella (Terwagne et al., 2013), Actinobacter sp. (Kalia et al., 2019), Microbacterium spp. (Jung et al., 2009) и др. Интересно отметить, что ферменты, инактивирующие АГЛ, обнаружены, в том числе, и у АГЛ-продуцирующих штаммов, которые, вероятно, могут использовать их для регуляции собственных QS систем.
Некоторые растения, по-видимому, также способны синтезировать ферменты, разрушающие бактериальные АГЛ (рис. 3ж) (Delalande et al., 2005; Ortiz-Castro et al., 2008). Исследования показали, что АГЛ в прикорневой зоне растений менее стабильны, чем в свободной почве. Показано, что деградация АГЛ растительными ферментами – процесс видоспецифичный. Разрушение АГЛ было быстрым в ризосфере двудольных растений, таких как лядвенец рогатый (Lotus corniculatus), клевер луговой (Trifolium pratense) и пахиризус вырезной (Pachyrhizus erosus), и медленным (или оно отсутствовало) в ризосфере однодольных, таких как пшеница мягкая (Triticum aestivum), кукуруза сахарная (Zea mays), ячмень обыкновенный (Hordeum vulgare) (Delalande et al., 2005; Gotz et al., 2007). Зависимость этой активности от температуры позволила авторам предположить, что наблюдаемая деградация была ферментативной. Биохимическая природа этих ферментов на сегодняшний день не установлена.
ВЛИЯНИЕ АГЛ НА РОСТ, РАЗВИТИЕ И УСТОЙЧИВОСТЬ РАСТЕНИЙ
Первое исследование влияния бактериальных АГЛ на процессы жизнедеятельности растений было опубликовано в 2003 году (Mathesius et al., 2003). Протеомный анализ показал, что обработка корней M. truncatula двумя типами АГЛ (3-оксо-C12-АГЛ и 3-оксо-C16-АГЛ) вызывала значительные изменения в уровне экспрессии более 150 белков, связанных с окислительным стрессом, метаболизмом флавоноидов, фитогормонов и пр. (Mathesius et al., 2003). Позже подобные эффекты были продемонстрированы для резуховидки Таля (Arabidopsis thaliana). Обработка проростков 3-оксо-C8-АГЛ приводила к изменению уровня накопления белков, принимающих участие в различных физиологических процессах растений, включая метаболизм углеводов, биосинтез белка, защитные реакции, устойчивость растений к неблагоприятным факторам среды (Miao et al., 2012; Ding et al., 2016). О молекулярных механизмах реакции растений на эти бактериальные сигналы сведений в литературе недостаточно.
Серия независимых исследований позволила выдвинуть предположение, что эффекты воздействия молекул АГЛ на растения зависят от длины ацильной цепи. АГЛ с короткой ацильной цепью (4–6 атомов углерода) увеличивали скорость роста и удлинение первичного корня (von Rad et al., 2008; Bai et al., 2012; Liu et al., 2012; Schenk et al., 2012; Zarkani et al., 2013). Было опубликовано несколько детальных исследований о связи ростстимулирующего эффекта АГЛ с уровнем синтеза ауксинов (von Rad et al., 2008; Bai et al., 2012; Liu et al., 2012; Schenk et al., 2012; Zhao et al., 2016). Удлинение первичного корня A. thaliana при действии 3-оксо-C6-АГЛ происходило посредством регуляции экспрессии генов, участвующих в сигнальных путях ауксина и цитокинина (von Rad et al., 2008; Zhao et al., 2016). Для фасоли азиатской (Vigna radiata) было показано, что АГЛ-индуцированный синтез ауксина играет решающую роль в формировании придаточных корней (Bai et al., 2012). Примечательно, что воздействие АГЛ способствовало изменению соотношения концентраций растительных гормонов – ауксина и цитокинина – в тканях корней и побегов (von Rad et al., 2008).
Длинноцепочечные АГЛ (от 12 до 16 атомов углерода) индуцировали системную устойчивость к различным облигатным патогенам у растений M. truncatula, A. thaliana и H. vulgare (Schikora et al., 2011; Schenk et al., 2012; Zarkani et al., 2013; Schenk et al., 2014). Предположительно, системные эффекты АГЛ обусловлены индукцией синтеза салициловой кислоты и оксилипинов (Schuhegger et al., 2006; Schenk, Schikora, 2015). Кроме того, было показано, что действие 3-оксо-С14-АГЛ вызывало накопление фенольных соединений, каллозы и лигнина в клеточной стенке (Schenk et al., 2014). Модификация клеточных стенок растений при действии АГЛ получила название АГЛ-прайминга (Schikora et al., 2011; Schenk et al., 2014).
Однако влияние АГЛ на процессы роста, развития и устойчивость растений, по-видимому, является более сложным и специфичным (Hartmann et al., 2014). Например, длинноцепочечный 3-оксо-С14-АГЛ, синтезируемый Sinorhizobium meliloti, стимулировал процесс образования клубеньков у M. truncatula (Veliz-Vallejos et al., 2014), тогда как воздействие других АГЛ (C4-АГЛ, C10-АГЛ, 3-оксо-С12-АГЛ) не оказало никакого эффекта. У V. radiata только 3-оксо-С10-АГЛ был способен вызывать рост придаточных корней, в отличие от незамещенных C10-АГЛ или C12-АГЛ (Bai et al., 2012). Одновременно с этим, имеются данные, что активное образование боковых корней у A. thaliana при воздействии 3-оксо-С10-АГЛ не зависило от концентрации ауксина (Ortiz-Castro et al., 2008). Другими исследователями был описан еще один механизм ростстимулирующего действия АГЛ, основанный на изменении интенсивности транспирации (Palmer et al., 2014). Авторы утверждают, что АГЛ может метаболизироваться в L-гомосерин, который стимулирует открытие устьиц и, следовательно, способствует транспорту воды и минеральных элементов в растении.
Использование технологии ДНК-микрочипов позволило оценить глобальные изменения в экспрессии генов растений после воздействия бактериальных сигнальных молекул QS. У проростков A. thaliana, обработанных C6-АГЛ, наблюдалось изменение уровня транскрипции нескольких сотен генов, как в тканях листьев (721 ген), так и в тканях корней (1095 генов) (Bai et al., 2012). При обработке проростков 3-оксо-C6-АГЛ было идентифицировано 2873 дифференциально-экспрессирующихся гена в тканях корней (Zhao et al., 2016). Сравнение полученных транскриптомов показало, что только 151 ген отвечает на обе молекулы АГЛ, в то время как большинство дифференциально-экспрессирующихся генов отвечают только на C6-АГЛ или на 3-оксо-C6-АГЛ. Таким образом, несмотря на структурное сходство этих сигнальных молекул, каждая из них регулирует экспрессию определенного набора генов растения-хозяина. Примечательно, что 19.2% (29 генов) из всех совместно регулируемых генов были отнесены к функциональной категории “биотического или абиотического стресса”. Аналогичные результаты были получены при исследовании влияния АГЛ с различной длиной ацильной цепи на транскрипционный профиль A. thaliana (Schenk et al., 2014). Действие C6-АГЛ, 3-оксо-C10-АГЛ или 3-оксо-С14-АГЛ приводило к изменению экспрессии 214, 226 и 177 генов соответственно. Из 55 генов, которые отвечали на все три АГЛ, 45% (25 генов) были связаны со стрессовыми реакциями и передачей сигналов (рецепторные киназы и белки, участвующие в передаче сигналов кальция). Эти данные свидетельствуют о том, что растения реагируют на различные АГЛ по-разному, но биотический или абиотический стресс является основной функциональной категорией.
Кроме специфичности к АГЛ с разной длиной ацильной цепи, растения способны проявлять стереоселективность по отношению к оптическим изомерам сигнальных молекул. Растения H. vulgare и P. erosus по-разному воспринимали хиральные формы АГЛ, отдавая предпочтение L-изомерам (Gotz et al., 2007). В другой работе продемонстрированы различия в действии S/R-энантиомеров С8-АГЛ на культуру сахарного тростника (Saccharum officinarum). Оба изомера активировали процессы корнеобразования, но S-энантиомер был более эффективным. Примечательно, что S-энантиомер стимулировал развитие почек, а R-энантиомер вызывал противоположный эффект (Olher et al., 2016). Эти результаты позволяют выдвинуть гипотезу о том, что реакции растений на эти соединения опосредуются наличием специфических рецепторов или ферментов.
Влияние АГЛ на растения поднимает вопрос о том, действуют ли эти молекулы через системные сигналы после восприятия на поверхности корня, или АГЛ проникают в ткани растений, транспортируются и оказывают действие непосредственно в надземных органах. Имеются лишь единичные исследования этого вопроса. С использованием радиоактивно меченых С10-АГЛ и C8-АГЛ показан АТФ-зависимый транспорт АГЛ в корневой системе ячменя (Sieper et al., 2013). Большинство молекул транспортировались в пределах центрального цилиндра корня. При этом скорость транспорта молекул АГЛ по корневой системе и тканям побегов коррелировала с длиной ацильной цепи (Sieper et al., 2013). АГЛ с короткой цепью (C6-АГЛ) после нанесения на корни растений обнаруживались в листьях, в то время как более гидрофобные АГЛ с длинной ацильной цепью (3-оксо-C14-АГЛ и С10-АГЛ) оставались в основном в корнях (Gotz et al., 2007; von Rad et al., 2008; Schikora et al., 2011).
Таким образом, ответные реакции растений на воздействия АГЛ являются видо- и АГЛ-специфичными. Это свидетельствует в пользу наличия у растений АГЛ-рецепторов (Bauer, Mathesius, 2004). На данный момент не существует доказательств того, что растения содержат рецепторные белки, сходные с бактериальными АГЛ-рецепторами. Других типов рецепторов АГЛ у растений до сих пор не обнаружено.
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ МЕХАНИЗМОВ QS ДЛЯ ЗАЩИТЫ РАСТЕНИЙ
QS системы на основе АГЛ играют важную роль во взаимодействии бактерий и растений. АГЛ способны стимулировать процессы роста и корнеобразования (von Rad et al., 2008; Bai et al., 2012; Liu et al., 2012; Schenk et al., 2012), а также индуцировать системную устойчивость против широкого спектра патогенов у различных видов растений (Pang, 2009). Последние исследования подчеркивают перспективность использования QS в качестве мишени для борьбы с инфекционными заболеваниями, расширяя тем самым спектр существующих методов и подходов профилактики и защиты растений (Helman, Chernin, 2015). В связи с этим представляется перспективным использование бактериальных агентов биоконтроля, основанных на управлении QS-системами.
QS-системы обеспечивают патогенным бактериям своевременный синтез факторов вирулентности только при достижении определенной клеточной плотности их популяции, что предотвращает раннее обнаружение патогенов растением. Преждевременная активация генов вирулентности, когда плотность популяции недостаточна для успешного инфицирования растения-хозяина, может вызвать защитную реакцию со стороны растения, которое в этом случае будет способно преодолеть атаку со стороны патогена. Преждевременная индукция QS может быть осуществлена либо путем генетической модификации растений генами АГЛ-синтаз (рис. 3г), либо за счет использования полезных АГЛ-продуцирующих бактерий в качестве агентов биоконтроля (рис. 3е).
Растения, трансформированные бактериальными генами АГЛ-синтаз, способны накапливать АГЛ в своих тканях (Fray et al., 1999; Mae et al., 2001; Toth et al., 2004). В 1999 году впервые было получено растение табака обыкновенного (Nicotiana tabacum), трансформированное геном синтазы АГЛ (yenI) из Yersinia enterocolitica. Трансгенные растения были способны синтезировать сигнальные молекулы (3-оксо-С6-АГЛ и С6-АГЛ) в количестве, достаточном для индукции рекомбинантных бактериальных АГЛ-биосенсоров (Fray et al., 1999). Позднее другие авторы продолжили работы в этом направлении и получили линии трансгенного табака, экспрессирующего ген синтазы АГЛ (ехрI) из фитопатогена Erwinia carotovora. АГЛ-продуцирующие трансгенные линии демонстрировали повышенную устойчивость против инфекции E. carotovora, по сравнению с родительскими, даже после длительной инкубации (48 ч) с патогенным микроорганизмом (Mae et al., 2001). Противоположные результаты были получены при исследовании влияния синтеза АГЛ на развитие мягкой гнили у картофеля (Solanum tuberosum). Трансгенные линии картофеля, экспрессирующие ген синтазы АГЛ (yenI) из Yersinia enterocolitica, также были способны к синтезу АГЛ, однако увеличение уровня АГЛ приводило к повышению восприимчивости растений к инфекции Е. саrоtоvоrа (Toth et al., 2004). Это подчеркивает необходимость проведения дальнейших исследований в этой области.
Снижение темпов прогрессирования заболевания в результате активизации синтеза АГЛ может происходить через взаимодействие патогена с другими АГЛ-синтезирующими бактериями. Так, например, патоген Pseudomonas syringae pv. syringae использует QS для регуляции экспрессии генов, отвечающих за синтез факторов вирулентности. Совместная инокуляция с другими АГЛ-синтезирующими бактериями вызывала преждевременную индукцию QS у P. syringae, что приводило к утрате патогеном подвижности и сокращению зон поражения листьев по сравнению с растениями, инокулированными только P. syringae (Dulla, Lindow, 2009). Таким образом, процесс межвидовой коммуникации с участием экзогенных АГЛ может быть использован для борьбы с фитопатогенами.
Quorum quenching (QQ) рассматривается как еще одна многообещающая стратегия защиты растений от патогенных микроорганизмов. Ферменты QQ, разрушающие АГЛ, представляются особенно перспективными, поскольку действуют во внеклеточном пространстве и могут использоваться в каталитических количествах (LaSarre, Federle, 2013; Kusari et al., 2015; Bzdrenga, 2017). Одним из вариантов биотехнологического применения QQ является гетерологичная экспрессия АГЛ-деградирующих ферментов в растениях (рис. 3в). Трансгенные растения, экспрессирующие бактериальные лактоназы, являются более устойчивыми к заражению фитопатогенами. В 2001 г. впервые были получены трансгенные растения табака и картофеля, экспрессирующие ген лактоназы aiiA из Bacillus sр. Такие растения подавляли QS бактерий и демонстрировали повышенную устойчивость к инфекции Е. саrоtоvоrа по сравнению с контрольными (Dong et al., 2000). Позднее аналогичный подход был использован для аморфофаллуса (Amorphophallus konjac) (Schaefer et al., 2008), эвкалипта (Eucalyptus urophylla × E. grandis) (Ouy-ang, Li, 2016) и репы (Brassica rapa) (Vanjildorj et al., 2009). Как и в предыдущих исследованиях, трансгенные растения, экспрессирующие ген лактоназы aiiA из Bacillus sр., проявляли высокую устойчивость к болезням. Таким образом, использование трансгенных растений, способных синтезировать бактериальные АГЛ-лактоназы, демонстрирует обнадеживающие результаты в борьбе с бактериальными болезнями растений. Однако масштабное использование генетически модифицированных растений является проблематичным из-за потенциальных экологических рисков и негативного общественного мнения в отношении трансгенных культур.
Более приемлемый подход заключается в использовании в качестве агентов биоконтроля бактерий, способных синтезировать АГЛ-деградирующие ферменты (рис. 3д). Первые исследования в этой области были проведены с использованием двух агентов биоконтроля – Bacillus sр. A24 (обладающий лактоназной активностью) и генетически сконструированный штамм Pseudomonas fluorescens (с плазмидой pME6863, несущей ген лактоназы aiiA из Bacillus sр. А24) (Molina et al., 2003). Инокуляция растений штаммами Bacillus sр. A24 и P. fluorescens P3/pME6863 приводила к значительному сокращению симптомов мягкой гнили картофеля, вызванной E. саrоtоvоrа, и снижению количества галлов, вызванных Agrobacterium tumefaciens, у томатов. Подавление картофельной гнили наблюдалось даже тогда, когда штамм P. fluorescens P3/pME6863 наносили на клубни через два дня после инокуляции патогеном. Полученные данные свидетельствуют о том, что биоконтроль является в этом случае не только профилактическим, но и лечебным.
В последние годы был предложен еще один способ повышения эффективности агентов биоконтроля, основанный на получении многофункциональных рекомбинантных штаммов путем трансформации ризобактерий генами АГЛ-деградирующих ферментов. Lysobacter enzymogenes считается эффективным агентом для борьбы с болезнями, вызванными патогенными грибами Rhizoctonia solani, Bipolaris sorokiniana, Fusarium graminearum, Uromyces appendiculatus (Li et al., 2008). Тем не менее, L. enzymogenes не активен против инфекции Pectobacterium spp. Для расширения спектра активности этой бактерии был получен рекомбинантный штамм, несущий ген лактоназы aiiA (Qian, 2010). В результате модифицированный штамм L. enzymogenes значительно снижал симптомы бактериальной мягкой гнили растений в экспериментах in vitro и in vivo. Другой бифункциональный рекомбинантный штамм был получен путем экспрессии гена aiiA из Bacillus thuringiensis в клетках Pseudomonas putida. Генетически модифицированные клетки P. putida значительно сокращали площадь мацерации ломтиков картофеля, зараженных Pеctobacterium carotovorum (Li et al., 2011). Таким образом, использование методов генной инженерии открывает возможности для конструирования многофункциональных штаммов с заданными свойствами.
Несмотря на недостаточную изученность этих процессов, очевиден значительный потенциал использования сбалансированных микробных консорциумов в растениеводстве и сельском хозяйстве и, таким образом, в повышении глобальной продовольственной безопасности.
ЗАКЛЮЧЕНИЕ
Ассоциированная с растением микробиота представляет собой сложное, структурированное и динамичное сообщество. Его состав регулируется множеством биотических и абиотических факторов, в том числе комплексной сетью растительно-микробных и микроб-микробных взаимодействий. Важную роль на разных этапах формирования растительно-микробных сообществ играют бактериальные сигнальные системы межклеточной коммуникации (McDougald et al., 2007). Ярким примером таких сигнальных систем, обеспечивающих скоординированный ответ бактерий на изменение условий среды, является QS (Fuqua et al., 1994). Наиболее изучены QS системы грамотрицательных бактерий, функционирующие с участием АГЛ. Эти сигнальные молекулы осуществляют межклеточную коммуникацию как внутри одного вида бактерий, так и межвидовую, а также взаимодействие между бактериями и высшими организмами. Ассоциированные с растениями бактерии способны синтезировать АГЛ, оказывающие влияние на состав микробных сообществ и на важные процессы жизнедеятельности растений. Растения, в свою очередь, способны воспринимать бактериальные АГЛ-сигналы и реагировать на них, не только адаптируясь к изменяющимся условиям, но и выделяя собственные сигналы, которые могут имитировать АГЛ (АГЛ-миметики). Кроме того, некоторые растения обладают ферментами, способными инактивировать АГЛ-сигналы. Эти факты позволяют предположить, что в процессе коэволюции растения выработали конкретные механизмы обнаружения АГЛ во внеклеточной среде и стратегии манипулирования QS системами бактерий.
Представленные в обзоре данные о роли QS в растительно-микробных взаимодействиях свидетельствуют о наличии дополнительных механизмов двухсторонней сигнализации у про- и эукариотических организмов. Гипотеза “двусторонней сигнализации” поддерживается открытием того, что некоторые растительные метаболиты (рибофлавин и его производное люмихром) могут взаимодействовать с бактериальными АГЛ-рецепторами. Эти соединения синтезируются животными, растениями и бактериями, и, по-видимому, используются в качестве сигнальных молекул в межцарственных взаимодействиях. Механизмы, лежащие в основе этих взаимодействий, несомненно, требуют более глубокого и детального изучения. Комплексный подход с применением новейших технологий, в том числе транскриптомного и протеомного анализов, будет способствовать дальнейшему расширению наших знаний о роли QS в межцарственных взаимодействиях. Эти данные могут быть использованы в прикладных целях, в частности, для разработки новых подходов для борьбы с бактериальными инфекциями в медицине и сельском хозяйстве.
ФИНАНСИРОВАНИЕ РАБОТЫ
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-34-00646.
Список литературы
Зайцева Ю.В. Попова А.А., Хмель И.А. Регуляция типа quorum sensing у бактерий семейства Enterobacteriaceae // Генетика. 2014. V. 50. P. 373–391.
Zaitseva Y.V., Popova A.A., Khmel I.A. Quorum sensing regulation in bacteria of the family Enterobacteriaceae // Russ. J. Genet. 2014. V. 50. P. 323–340.
Маркова Ю.А. Растительные метаболиты как регуляторы развития микробных биопленок // Вестн. Оренбургского гос. ун-та. 2014. V. 13. № 174. P. 59–65.
Хмель И.А., Метлицкая А.З. Quorum sensing регуляция экспрессии генов – перспективная мишень для создания лекарств против патогенности бактерий // Мол. биология. 2006. Т. 40. С. 195–210.
Khmel I.A., Metlitskaia A.Z. Quorum sensing of genes expression–perspective drug target against bacterial pathogenicity // Mol. Biol. (Moscow). 2006. V. 40. P. 195–210.
Хохлов А.С. Низкомолекулярные ауторегуляторы развития микроорганизмов. М.: Наука, 1988. 306 с.
Ahumedo M., Diaz A., Vivas-Reyes R. Theoretical and structural analysis of the active site of the transcriptional regulators LasR and TraR, using molecular docking methodology for identifying potential analogues of acyl homoserine lactones (AHLs) with anti-quorum sensing activity // Eur. J. Med. Chem. 2010. V. 45. P. 608–615.
Asfour H.Z. Anti-quorum sensing natural compounds // J. Microsc. Ultrastruct. 2018. V. 6. P. 1–10.
Bai X., Todd C.D., Desikan R., Yang Y., Hu X. N-3-oxo-decanoyl-L-homoserine-lactone activates auxin-induced adventitious root formation via hydrogen peroxide- and nitric oxide-dependent cyclic GMP signaling in mung bean // Plant. Physiol. 2012. V. 158. P. 725–736.
Bauer W.D., Mathesius U. Plant responses to bacterial quorum sensing signals // Curr. Opin. Plant. Biol. 2004. V. 7. P. 429–433.
Bzdrenga J., Daude D., Remy B., Jacquet P., Plener L., Elias M., Chabrière E. Biotechnological applications of quorum quenching enzymes // Chem. Biol. Interact. 2017. V. 267. P. 104–115.
Carlier A., Uroz S., Smadja B., Fray R., Latour X., Dessaux Y., Faure D. The Ti plasmid of Agrobacterium tumefaciens harbors an attM-paralogous gene, aiiB, also encoding N-acyl homoserine lactonase activity // Appl. Environ. Microbiol. 2003. V. 69. P. 4989–4993.
Corral-Lugo A., Daddaoua A., Ortega A., Espinosa-Urgel M., Krell T. Rosmarinic acid is a homoserine lactone mimic produced by plants that activates a bacterial quorum-sensing regulator // Sci. Signal. 2016b. V. 9. № 409. P. ra1.
Corral-Lugo A., Daddaoua A., Ortega A., Espinosa-Urgel M., Krell T. So different and still so similar: The plant compound rosmarinic acid mimics bacterial homoserine lactone quorum sensing signals // Commun. Integr. Biol. 2016b. V. 9. P. e1156832.
Delalande L., Faure D., Raffoux A., Uroz S., D’Angelo-Picard C., Elasri M., Carlier A., Berruyer R., Petit A., Williams P., Dessaux Y. N-hexanoyl-L-homoserine lactone, a mediator of bacterial quorum-sensing regulation, exhibits plant-dependent stability and may be inactivated by germinating Lotus corniculatus seedlings // FEMS Microbiol. Ecol. 2005. V. 52. P. 13–20.
Ding L., Cao J., Duan Y., Li J., Yang Y., Yang G., Zhou Y. Proteomic and physiological responses of Arabidopsis thaliana exposed to salinity stress and N-acyl-homoserine lactone // Physiol. Plant. 2016. V. 158. P. 414–434.
Dong Y.H., Xu J.L., Li X.Z., Zhang L.H. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora // Proc. Natl. Acad. Sci. USA. 2000. V. 97. P. 3526–3531.
Dulla G.F., Lindow S.E. Acyl-homoserine lactone-mediated cross talk among epiphytic bacteria modulates behavior of Pseudomonas syringae on leaves // ISME J. 2009. V. 3. P. 825–834.
Elasri M., Delorme S., Lemanceau P., Stewart G., Laue B., Glickmann E., Oger P.M., Dessaux Y. Acyl-homoserine lactone production is more common among plant-associated Pseudomonas spp. than among soilborne Pseudomonas spp. // Appl. Environ. Microbiol. 2001. V. 67. P. 1198–1209.
Fournier-Larente J., Morin M. P., Grenier D. Green tea catechins potentiate the effect of antibiotics and modulate adherence and gene expression in Porphyromonas gingivalis // Arch. Oral. Biol. 2016. V. 65. P. 35–43.
Fray R.G. Altering plant-microbe interaction through artificially manipulating bacterial quorum sensing // Ann. Bot. 2002. V. 89. P. 245–253.
Fray R.G., Throup J.P., Daykin M., Wallace A., Williams P., Stewart G.S., Grierson D. Plants genetically modified to produce N-acylhomoserine lactones communicate with bacteria // Nat. Biotechnol. 1999. V. 17. P. 1017–1020.
Fuqua W.C., Winans S.C., Greenberg E.P. Quorum sensing in bacteria: the LuxR-LuxI family of cell density-responsive transcriptional regulators // J. Bacteriol. 1994. V. 176. P. 269–275.
Gao M., Teplitski M., Robinson J.B., Bauer W.D. Production of substances by Medicago truncatula that affect bacterial quorum sensing // Mol. Plant. Microbe Interact. 2003. V. 16. P. 827–834.
Givskov M., de Nys R., Manefield M., Gram L., Maximilien R., Eberl L., Molin S., Steinberg P.D., Kjelleberg S. Eukaryotic interference with homoserine lactone-mediated prokaryotic signalling // J. Bacteriol. 1996. V. 178. P. 6618–6622.
Gonzalez J.E., Marketon M.M. Quorum sensing in nitrogen-fixing rhizobia // Microbiol. Mol. Biol. Rev. 2003. V. 67. P. 574–592.
Gotz C., Fekete A., Gebefuegi I., Forczek S.T., Fuksova K., Li X., Englmann M., Gryndler M., Hartmann A., Matucha M., Schmitt-Kopplin P., Schroder P. Uptake, degradation and chiral discrimination of N-acyl-D/L-homoserine lactones by barley (Hordeum vulgare) and yam bean (Pachyrhizus erosus) plants // Anal. Bioanal. Chem. 2007. V. 389. P. 1447–1457.
Gram L., de Nys R., Maximilien R., Givskov M., Steinberg P., Kjelleberg S. Inhibitory effects of secondary metabolites from the red alga Delisea pulchra on swarming motility of Proteus mirabilis // Appl. Environ. Microbiol. 1996. V. 62. P. 4284–4287.
Grandclement C., Tannieres M., Morera S., Dessaux Y., Faure D. Quorum quenching: role in nature and applied developments // FEMS Microbiol. Rev. 2016. V. 40. P. 86–116.
Gregor R., David S., Meijler M.M. Chemical strategies to unravel bacterial-eukaryotic signaling // Chem. Soc. Rev. 2018. V. 47. P. 1761–1772.
Hartmann A., Rothballer M., Hense B.A., Schroder P. Bacterial quorum sensing compounds are important modulators of microbe-plant interactions // Front. Plant Sci. 2014. V. 5. P. 131.
Helman Y., Chernin L. Silencing the mob: disrupting quorum sensing as a means to fight plant disease // Mol. Plant. Pathol. 2015. V. 16. P. 316–329.
Hentzer M., Riedel K., Rasmussen T.B., Heydorn A., Andersen J.B., Parsek M.R., Rice S.A., Eberl L., Molin S., Hoiby N., Kjelleberg S., Givskov M. Inhibition of quorum sensing in Pseudomonas aeruginosa biofilm bacteria by a halogenated furanone compound // Microbiology (SGM). 2002. V. 148. P. 87–102.
Horswill A.R., Stoodley P., Stewart P.S., Parsek M.R. The effect of the chemical, biological, and physical environment on quorum sensing in structured microbial communities // Anal. Bioanal. Chem. 2007. V. 387. P. 371–380.
Jung H.W., Tschaplinski T.J., Wang L., Glazebrook J., Greenberg J.T. Priming in systemic plant immunity // Science. 2009. V. 324. P. 89–91.
Kalia V.C., Patel S.K.S., Kang Y.C., Lee J.K. Quorum sensing inhibitors as antipathogens: biotechnological applications // Biotechnol. Adv. 2019. V. 37. P. 68–90.
Kaufmann G.F., Sartorio R., Lee S.H., Rogers C.J., Meijler M.M., Moss J.A., Clapham B., Brogan A.P., Dickerson T.J., Janda K.D. Revisiting quorum sensing: Discovery of additional chemical and biological functions for 3-oxo-N-acylhomoserine lactones // Proc. Natl. Acad. Sci. USA. 2005. V. 102. P. 309–314.
Koch B., Liljefors T., Persson T., Nielsen J., Kjelleberg S., Givskov M. The LuxR receptor: the sites of interaction with quorum-sensing signals and inhibitors // Microbiology (SGM). 2005. V. 151. P. 3589–3602.
Koh C.L., Sam C.K., Yin W.F., Tan L.Y., Krishnan T., Chong Y.M., Chan K.G. Plant-derived natural products as sources of anti-quorum sensing compounds // Sensors (Basel). 2013. V. 13. P. 6217–6228.
Kusari P., Kusari S., Spiteller M., Kayser O. Implications of endophyte-plant crosstalk in light of quorum responses for plant biotechnology // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 5383–5390.
LaSarre B., Federle M.J. Exploiting quorum sensing to confuse bacterial pathogens // Microbiol. Mol. Biol. Rev. 2013. V. 77. P. 73–111.
Li Q., Ni H., Meng S., He Y., Yu Z., Li L. Suppressing Erwinia carotovora pathogenicity by projecting N-acyl homoserine lactonase onto the surface of Pseudomonas putida cells // J. Microbiol. Biotechnol. 2011. V. 21. P. 1330–1335.
Li S., Jochum C.C., Yu F., Zaleta-Rivera K., Du L., Harris S.D., Yuen G.Y. An antibiotic complex from Lysobacter enzymogenes strain C3: antimicrobial activity and role in plant disease control // Phytopathol. 2008. V. 98. P. 695–701.
Lin Y.H., Xu J.L., Hu J., Wang L.H., Ong S.L., Leadbetter J.R., Zhang L.H. Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes // Mol. Microbiol. 2003. V. 47. P. 849–860.
Liu F., Bian Z., Jia Z., Zhao Q., Song S. The GCR1 and GPA1 participate in promotion of Arabidopsis primary root elongation induced by N-acyl-homoserine lactones, the bacterial quorum-sensing signals // Mol. Plant Microbe Interact. 2012. V. 25. P. 677–683.
Mae A., Montesano M., Koiv V., Palva E.T. Transgenic plants producing the bacterial pheromone N-acyl-homoserine lactone exhibit enhanced resistance to the bacterial phytopathogen Erwinia carotovora // Mol. Plant Microbe Interact. 2001. V. 14. P. 1035–1042.
Manefield M., Rasmussen T.B., Henzter M., Andersen J.B., Steinberg P., Kjelleberg S., Givskov M. Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover // Microbiology (SGM). 2002. V. 148. P. 1119–1127.
Mathesius U., Mulders S., Gao M., Teplitski M., Caetano-Anolles G., Rolfe B.G., Bauer W.D. Extensive and specific responses of a eukaryote to bacterial quorum-sensing signals // Proc. Natl. Acad. Sci. USA. 2003. V. 100. P. 1444–1449.
McDougald D., Rice S.A., Kjelleberg S. Bacterial quorum sensing and interference by naturally occurring biomimics // Anal. Bioanal. Chem. 2007. V. 387. P. 445–453.
Miao C., Liu F., Zhao Q., Jia Z., Song S. A proteomic analysis of Arabidopsis thaliana seedling responses to 3-oxo-octanoyl-homoserine lactone, a bacterial quorum-sensing signal // Biochem. Biophys. Res. Commun. 2012. V. 427. P. 293–298.
Molina L., Constantinescu F., Michel L., Reimmann C., Duffy B., Defago G. Degradation of pathogen quorum-sensing molecules by soil bacteria: a preventive and curative biological control mechanism // FEMS Microbiol. Ecol. 2003. V. 45. P. 71–81.
Morohoshi T., Nakazawa S., Ebata A., Kato N., Ikeda T. Identification and characterization of N-acylhomoserine lactone-acylase from the fish intestinal Shewanella sp. strain MIB015 // Biosci. Biotechnol. Biochem. 2008. V. 72. P. 1887–1893.
Morohoshi T., Sato N., Iizumi T., Tanaka A., Ikeda T. Identification and characterization of a novel N-acyl-homoserine lactonase gene in Sphingomonas ursincola isolated from industrial cooling water systems // J. Biosci. Bioeng. 2017. V. 123. P. 569–575.
Olher V.G., Ferreira N.P., Souza A.G., Chiavelli L.U., Teixeira A.F., Santos W.D., Santin S.M., Ferrarese Filho O., Silva C.C., Pomini A.M. Acyl-homoserine lactone from Saccharum × officinarum with stereochemistry-dependent growth regulatory activity // J. Nat. Prod. 2016. V. 79. P. 1316–1321.
Ortiz-Castro R., Martinez-Trujillo M., Lopez-Bucio J. N-acyl-L-homoserine lactones: a class of bacterial quorum-sensing signals alter post-embryonic root development in Arabidopsis thaliana // Plant. Cell Environ. 2008. V. 31. P. 1497–1509.
Ouyang J., Sun F., Feng W., Sun Y., Qiu X., Xiong L., Liu Y., Chen Y. Quercetin is an effective inhibitor of quorum sensing, biofilm formation and virulence factors in Pseudomonas aeruginosa // J. Appl. Microbiol. 2016. V. 120. P. 966–974.
Ouyang L.J., Li L.M. Effects of an inducible aiiA gene on disease resistance in Eucalyptus urophylla × Eucalyptus grandis // Transgenic Res. 2016. V. 25. P. 441–452.
Palmer A.G., Senechal A.C., Mukherjee A., Ane J.M., Blackwell H.E. Plant responses to bacterial N-acyl L-homoserine lactones are dependent on enzymatic degradation to L-homoserine // ACS Chem. Biol. 2014. V. 9. P. 1834–1845.
Pang Y., Liu X.G., Ma Y.X., Chernin L., Berg G., Gao K.X. Induction of systemic resistance, root colonisation and biocontrol activities of the rhizospheric strain of Serratia plymuthica are dependent on N-acyl homoserine lactones // Eur. J. Plant Pathol. 2009. V. 124. P. 261–268.
Park S.Y., Hwang B.J., Shin M.H., Kim J.A., Kim H.K., Lee J.K. N-acylhomoserine lactonase producing Rhodococcus spp. with different AHL-degrading activities // FEMS Microbiol. Lett. 2006. V. 261. P. 102–108.
Qian G.-L. Reducing Pectobacterium virulence by expression of an N-acyl homoserine lactonase gene Plpp-aiiA in Lysobacter enzymogenes strain OH11 // Biological Control. 2010. Retrieved 1. P. 52.
Rajamani S., Bauer W.D., Robinson J.B., Farrow J.M., 3rd, Pesci E.C., Teplitski M., Gao M., Sayre R.T., Phillips D.A. The vitamin riboflavin and its derivative lumichrome activate the LasR bacterial quorum-sensing receptor // Mol. Plant Microbe Interact. 2008. V. 21. P. 1184–1192.
Rajesh P.S., Rai V.R. Purification and antibiofilm activity of AHL-lactonase from endophytic Enterobacter aerogenes VT66 // Int. J. Biol. Macromol. 2015. V. 81. P. 1046–1052.
Rowe S.L., Norman J.S., Friesen M.L. Coercion in the evolution of plant-microbe communication: a perspective // Mol. Plant Microbe Interact. 2018. V. 31. P. 789–794.
Rudrappa T., Bais H.P. Curcumin, a known phenolic from Curcuma longa, attenuates the virulence of Pseudomonas aeruginosa PAO1 in whole plant and animal pathogenicity models // J. Agric. Food Chem. 2008. V. 56. P. 1955–1962.
Sarkar R., Mondal C., Bera R., Chakraborty S., Barik R., Roy P., Kumar A., Yadav K.K., Choudhury J., Chaudhary S.K., Samanta S.K., Karmakar S., Das S., Mukherjee P.K., Mukherjee J., Sen T. Antimicrobial properties of Kalanchoe blossfeldiana: a focus on drug resistance with particular reference to quorum sensing-mediated bacterial biofilm formation // J. Pharm. Pharmacol. 2015. V. 67. P. 951–962.
Schaefer A.L., Greenberg E.P., Oliver C.M., Oda Y., Huang J.J., Bittan-Banin G., Peres C.M., Schmidt S., Juhaszova K., Sufrin J.R., Harwood C.S. A new class of homoserine lactone quorum-sensing signals // Nature. 2008. V. 454. P. 595–599.
Schenk S.T., Hernandez-Reyes C., Samans B., Stein E., Neumann C., Schikora M., Reichelt M., Mithofer A., Becker A., Kogel K.H., Schikora A. N-acyl-homoserine lactone primes plants for cell wall reinforcement and induces resistance to bacterial pathogens via the salicylic acid/oxylipin pathway // Plant Cell. 2014. V. 26. P. 2708–2723.
Schenk S.T., Schikora A. AHL-priming functions via oxylipin and salicylic acid // Front. Plant Sci. 2015. V. 5. P. 784.
Schenk S.T., Stein E., Kogel K.H., Schikora A. Arabidopsis growth and defense are modulated by bacterial quorum sensing molecules // Plant Signal Behav. 2012. V. 7. P. 178–181.
Schikora A., Schenk S.T., Hartmann A. Beneficial effects of bacteria-plant communication based on quorum sensing molecules of the N-acyl homoserine lactone group // Plant Mol. Biol. 2016. V. 90. P. 605–612.
Schikora A., Schenk S.T., Stein E., Molitor A., Zuccaro A., Kogel K.H. N-acyl-homoserine lactone confers resistance toward biotrophic and hemibiotrophic pathogens via altered activation of AtMPK6 // Plant Physiol. 2011. V. 157. P. 1407–1418.
Schuhegger R., Ihring A., Gantner S., Bahnweg G., Knappe C., Vogg G., Hutzler P., Schmid M., Van Breusegem F., Eberl L., Hartmann A., Langebartels C. Induction of systemic resistance in tomato by N-acyl-L-homoserine lactone-producing rhizosphere bacteria // Plant Cell Environ. 2006. V. 29. P. 909–918.
Sieper T., Forczek S., Matucha M., Kramer P., Hartmann A., Schroder P. N-acyl-homoserine lactone uptake and systemic transport in barley rest upon active parts of the plant // New Phytol. 2013. V. 201. P. 545–555.
Sio C.F., Otten L.G., Cool R.H., Diggle S.P., Braun P.G., Bos R., Daykin M., Camara M., Williams P., Quax W.J. Quorum quenching by an N-acyl-homoserine lactone acylase from Pseudomonas aeruginosa PAO1 // Infect. Immun. 2006. V. 74. P. 1673–1682.
Teplitski M., Robinson J.B., Bauer W.D. Plants secrete substances that mimic bacterial N-acyl homoserine lactone signal activities and affect population density-dependent behaviors in associated bacteria // Mol. Plant Microbe Interact. 2000. V. 13. P. 637–648.
Terwagne M., Mirabella A., Lemaire J., Deschamps C., De Bolle X., Letesson J.J. Quorum sensing and self-quorum quenching in the intracellular pathogen Brucella melitensis // PLoS One. 2013. V. 8. P. e82514.
Toth I.K., Newton J.A., Hyman L.J., Lees A.K., Daykin M., Ortori C., Williams P., Fray R.G. Potato plants genetically modified to produce N-acylhomoserine lactones increase susceptibility to soft rot erwiniae // Mol. Plant Microbe Interact. 2004. V. 17. P. 880–887.
Uroz S., Chhabra S.R., Camara M., Williams P., Oger P., Dessaux Y. N-acyl homoserine lactone quorum-sensing molecules are modified and degraded by Rhodococcus erythropolis W2 by both amidolytic and novel oxidoreductase activities // Microbiology (SGM). 2005. V. 151. P. 3313–3322.
Uroz S., Oger P., Chhabra S. R., Camara M., Williams P., Dessaux Y. N-acyl homoserine lactones are degraded via an amidolytic activity in Comamonas sp. strain D1 // Arch. Microbiol. 2007. V. 187. P. 249–256.
Vandeputte O.M., Kiendrebeogo M., Rajaonson S., Diallo B., Mol A., El Jaziri M., Baucher M. Identification of catechin as one of the flavonoids from Combretum albiflorum bark extract that reduces the production of quorum-sensing-controlled virulence factors in Pseudomonas aeruginosa PAO1 // Appl. Environ. Microbiol. 2010. V. 76. P. 243–253.
Vandeputte O.M., Kiendrebeogo M., Rasamiravaka T., Stevigny C., Duez P., Rajaonson S., Diallo B., Mol A., Baucher M., El Jaziri M. The flavanone naringenin reduces the production of quorum sensing-controlled virulence factors in Pseudomonas aeruginosa PAO1 // Microbiology (SGM). 2011. V. 157. P. 2120–2132.
Vanjildorj E., Song S.Y., Yang Z.H., Choi J.E., Noh Y.S., Park S., Lim W.J., Cho K.M., Yun H.D., Lim Y.P. Enhancement of tolerance to soft rot disease in the transgenic Chinese cabbage (Brassica rapa L. ssp. pekinensis) inbred line, Kenshin // Plant Cell Rep. 2009. V. 28. P. 1581–1591.
Veliz-Vallejos D.F., van Noorden G.E., Yuan M., Mathesius U. A Sinorhizobium meliloti-specific N-acyl homoserine lactone quorum-sensing signal increases nodule numbers in Medicago truncatula independent of autoregulation // Front. Plant Sci. 2014. V. 5. P. 551.
Vikram A., Jayaprakasha G.K., Jesudhasan P.R., Pillai S.D., Patil B.S. Suppression of bacterial cell-cell signalling, biofilm formation and type III secretion system by citrus flavonoids // J. Appl. Microbiol. 2010. V. 109. P. 515–527.
Von Bodman S.B., Bauer W.D., Coplin D.L. Quorum sensing in plant-pathogenic bacteria // Annu. Rev. Phytopathol. 2003. V. 41. P. 455–482.
von Rad U., Klein I., Dobrev P.I., Kottova J., Zazimalova E., Fekete A., Hartmann A., Schmitt-Kopplin P., Durner J. Response of Arabidopsis thaliana to N-hexanoyl-DL-homoserine-lactone, a bacterial quorum sensing molecule produced in the rhizosphere // Planta. 2008. V. 229. P. 73–85.
Zarkani A.A., Stein E., Rohrich C.R., Schikora M., Evguenieva-Hackenberg E., Degenkolb T., Vilcinskas A., Klug G., Kogel K.H., Schikora A. Homoserine lactones influence the reaction of plants to rhizobia // Int. J. Mol. Sci. 2013. V. 14. P. 17122–17146.
Zhao Q., Li M., Jia Z., Liu F., Ma H., Huang Y., Song S. AtMYB44 positively regulates the enhanced elongation of primary roots induced by N-3-oxo-hexanoyl-homoserine lactone in Arabidopsis thaliana // Mol. Plant Microbe Interact. 2016. V. 29. P. 774–785.
Zhu H., Sun S.J. Inhibition of bacterial quorum sensing-regulated behaviors by Tremella fuciformis extract // Curr. Microbiol. 2008. V. 57. P. 418–422.
Дополнительные материалы отсутствуют.


