Микробиология, 2019, T. 88, № 5, стр. 605-618
Погребенные почвы как нетрадиционный источник выделения биотехнологически значимых штаммов бактерий
Е. В. Дёмкина a, *, Е. В. Дорошенко b, Т. Л. Бабич a, В. В. Миронов a, А. В. Борисов c, Т. С. Дёмкина c, Г. И. Эль-Регистан a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
c Институт физико-химических и биологических проблем почвоведения
Российской академии наук
142290 Пущино, Россия
* E-mail: elenademkina@mail.ru
Поступила в редакцию 16.02.2019
После доработки 25.02.2019
Принята к публикации 29.03.2019
Аннотация
Исследования молекулярно-генетического биоразнообразия микробных сообществ палеопочв показали, что около 50% древних риботипов не обнаруживаются среди риботипов современных микробных сообществ. Это определяет целесообразность реактивации и изучения физиологических свойств древних микроорганизмов как потенциально ценных биотехнологических продуцентов. Объектом исследования была бактериальная протеолитическая компонента подкурганных палеопочв, отобранных из сосудов с погребальной пищей курганных могильников “Песчаный-4” и “Неткачево” (XV–XIV вв. до н.э.) (Волгоградская и Ростовская области, Россия). Численность жизнеспособных клеток гетеротрофных бактерий в реактивированных образцах составляла (1.5–16.0) × 107 КОЕ/г почвы (рост на LB-агаре). С использованием приема чередующейся инокуляции образцов в жидкие среды и высева на плотные среды выделены в чистые культуры ряд штаммов, идентифицированных на основании данных анализа нуклеотидных последовательностей гена 16S pPНК. Были выделены следующие штаммы: Bacillus coagulans (Lactobacillus coagulans) – потенциально ценный пробиотик; Aquamicrobium terrae – протеолитик, продуцент поверхностно-активных веществ и биодеградант органического вещества; Bacillus cereus –токсикогенный штамм для аутобредных белых мышей при внутрибрюшной инокуляции; Staphylococcus hominis и St. epidermidis – оппортунистические условные патогены нормофлоры человека (кожных покровов). Все штаммы (кроме Bacillus cereus) характеризовались высокой продуктивностью нейроактивных аминов (ДОФА, ДОРАС, ДА, 5НТР, HVA, 3МТ) и аминокислот (ASP, GLU, GLY, TAU, GABA). Отмечено, что из сосудов с погребальной пищей были выделены, в основном, штаммы, характерные не для почвенных микробных сообществ, а связанные с человеком.
Около 6000 лет назад у степных племен эпохи энеолита появился новый тип погребального обряда: над могильной ямой и окружающей ее поверхностью стали насыпать холм из почвенно-грунтового материала (Раевский, 1985). В отечественную научную литературу археологические памятники подобного рода вошли под названием “курганы”. Не вызывает сомнений, что грунтовые погребальные древне- и средневековые исторические памятники одновременно являются и памятниками природы. Их исследование дает возможность получать представления как об истории, культуре и быте древних племен, так и о состоянии природных систем того времени.
Характеристики микробных сообществ погребенных почв относятся к числу важнейших диагностических показателей, отражающих условия почвообразования, поскольку почвенные микроорганизмы участвуют, в той или иной степени, практически во всех процессах, протекающих в почвах. Проведенные микробиологические исследования подкурганных палеопочв сухих и пустынных степей Нижнего Поволжья показали, что в них до настоящего времени сохраняются микробные сообщества, существовавшие во время сооружения археологических памятников (Демкина и соавт., 2000, 2004). Это подтверждено данными определения возраста микробной фракции с использованием метода 14С атомной масс-спектрометрии (Demkina et al., 2008) и выявленными закономерностями распределения численности микроорганизмов различных трофических групп в курганных насыпях, погребенных и современных почвах (Дёмкина и соавт., 2007).
Известно, что практически в каждом втором курганном погребении эпох бронзы и раннего железа (XXV в. до н.э.–IV в. н.э.) степных племен Евразии в качестве погребальных атрибутов встречаются глиняные сосуды различных типов (горшки, кувшины, банки и др.), в которых находилась погребальная пища. При комплексных почвенно-археологических исследованиях курганов Нижнего Поволжья для реконструкции исходного содержимого погребальных сосудов был применен фосфатный метод, основанный на количественном определении соединений фосфора в придонной части грунта в погребальных сосудах, позволяющий по содержанию подвижных соединений фосфора составить количественные градации и определить качественный состав пищи (Дёмкин и соавт., 1988). Среди погребальной посуды главное внимание уделяется изучению глиняных сосудов, так как в бронзовых сосудах придонный грунт обогащается соединениями меди, которые делают невозможным применение фосфатного метода, а также способствуют активизации металлокисляющих микроорганизмов, не имеющих отношения к исходному пищевому содержимому (Дёмкин и соавт., 2014).
В последние годы методическая база реконструкции погребальной пищи расширилась за счет использования методов почвенной микробиологии (Дёмкин и соавт., 2014). Исследователи исходили из вполне обоснованного предположения, что в придонном грунте того или иного сосуда должны сохраняться жизнеспособными как микроорганизмы, характерные для микробного сообщества почвы, заполнившей сосуд, так и формы, использующие в качестве основного питательного субстрата специфические погребальные продукты.
Исследования биоразнообразия микробных сообществ палеопочв на основе молекулярно-генетических методов определения и оценки генетического разнообразия микроорганизмов (Tiedje et al., 1999) показали, что до 50% риботипов палеопочв не сохраняется в микробных сообществах современных почв (Дёмкин и соавт., 2010).
Помимо вопросов палеоэкологической реконструкции прошлых эпох и моделирования возможных изменений климата, можно предположить, что древние микробные сообщества могут послужить источником для поиска перспективных продуцентов целевых веществ, так как являются хранилищем “законсервированных” временем микроорганизмов.
Сохранению микроорганизмов прошлых эпох способствуют адаптационные механизмы, обеспечивающие их выживание в неблагоприятных экологических условиях (переход бактерий в анабиотические покоящиеся и некультивируемые формы, наноформы) (Вайнштейн, Кудряшова, 2000; Бухарин и соавт., 2005). С применением методов электронной микроскопии установлено, что выжившие сообщества палеопочв представлены анабиотическими цистоподобными покоящимися клетками, а в горизонте (гор.) А1 подкурганных каштановых палеопочв 80% клеток представлены наноформами (их объемы не превышают 0.09 мкм3) (Каширская и соавт., 2010; Кряжевских и соавт., 2012). Цитологические исследования полученных в лабораторных условиях наноклеток позволили предположить, что их формирование представляет универсальную ответную реакцию организма на неблагоприятные условия и действие стрессорных факторов (Вайнштейн, Кудряшова, 2000; Кряжевских и соавт., 2013).
Надо отметить, что популяции покоящихся клеток, в том числе древних микробных сообществ, гетерогенны по сохранению ростового потенциала (Эль-Регистан и соавт., 2006). Ранее нами были подобраны условия для реактивации покоящихся клеток бактерий древних сообществ другого типа – законсервированных в вечномерзлых почвах и подпочвенных отложениях Арктики и Антарктиды (Кряжевских и соавт., 2012; Манучарова и соавт., 2016). Следует отметить особенность микроорганизмов-объектов исследования, а именно селективность условий их развития в захороненных сосудах предположительно с мясной или молочной пищей, где преимущества получали микроорганизмы с протеолитической активностью.
Целью настоящей работы было исследовать в образцах подкурганных погребенных почв из сосудов с погребальной пищей гетеротрофную протеолитическую бактериальную компоненту и оценить возможность получения биотехнологически значимых штаммов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были образцы подкурганных палеопочв, отобранные из сосудов с погребальной пищей курганных могильников “Песчаный-4” и “Неткачево”. Курганный могильник “Песчаный-4” расположен в 2000 м восточнее села Ремонтное Ростовской области (Сальско-Манычская гряда, западная часть Ергенинской возвышенности, юго-восток Русской равнины; географические координаты: 46.560470, 43.657674). Высота над уровнем моря 150–180 м. Курган № 13 расположен в привершинной зоне водораздельного участка на восточном высоком правом берегу р. Джурак-Сал на пахотном поле. В момент проведения раскопок курган был под паром. Погребенная почва XXVIII–XXVII вв. до н.э. (ямная культура) светло-каштановая. Почвообразующие породы представлены лeссовидными суглинками, перекрывающими песчаные отложения палеогенового времени. Раскопки проводились археологической экспедицией Государственного исторического музея (рук. Н.И. Шишлина).
Курганный могильник “Неткачево” расположен в Котовском районе Волгоградской области в 2.5 км к северо-западу от села Неткачево (географические координаты: 50.540484, 44.924029). В природном отношении район исследования приурочен к зоне сухих степей, расположен в южной части Приволжской возвышенности (северная окраина Доно-Медведицкой гряды), на вершине плоского межбалочного водораздела. Абсолютные высоты местности составляют 220–225 м. Образцы были отобраны из кургана № 15, расположенного на склоне водораздела. Погребенная почва XVI–XV вв. до н.э. (срубная культура) каштановая эродированная незасоленная. Раскопки проводились археологической экспедицией Волгоградского государственного университета (рук. А.Н. Дьяченко).
Были проанализированы 4 образца погребенных почв: три из курганного могильника “Песчаный-4” (образцы № 1–3) и один из “Неткачево” (образец № 4).
Все образцы отобраны из глиняных сосудов курганных захоронений, возможно, содержащих молоко или мясные продукты. Исходя из этого, можно предположить присутствие в образцах протеолитических и молочнокислых микроорганизмов. Один из образцов (№ 4) был проанализирован фосфатным методом (Дёмкин и соавт., 2014), что позволило идентифицировать содержимое сосуда как молочный или мясной продукт (табл. 1).
Таблица 1.
Реконструкция погребальной пищи в глиняном горшке курганного могильника “Неткачево” (Дёмкин и соавт., 2014)
| Объект | Содержание P2O5, мг/100 г | Содержимое сосуда по P2O5 | |
|---|---|---|---|
| Погребение 1 | Фон | 5.2 | Мясной или молочный продукт |
| Сосуд | 1.6 | ||
Среды для реактивации и выделения изолятов из палеопочв. Для выделения микроорганизмов из горшков с погребальной пищей применяли среды, в равной степени подходящие для развития молочнокислых и протеолитических бактерий: (1) гидролизованное молоко (обезжиренное молоко с добавлением панкреатина); (2) среда MRS (Lactobacillus MRS Agar/Broth Base), (3) мясо-пептонный агар, содержащий ростовые факторы, селективные для лактобацилл; (4) Lactobacillus Selection Agar/Broth Base (LB), богатая среда для селективного выделения гетеротрофных бактерий; (5) Rogosa SL Agar/Broth Base, богатая среда для культивирования лактобактерий орального и фекального происхождения; (6) лактобакагар (LA); (7) питательная среда для выделения и культивирования лактобацилл; (8) обезжиренное (0.1%) ультрапастеризованное молоко (“Parmalat”).
Количество жизнеспособных бактерий в образцах погребенных почв определяли по численности колониеобразующих единиц (КОЕ) при рассеве десятеричных разведений образцов и клеточных суспензий на агаризованные среды. Почвенные образцы (1 г) предварительно инкубировали в растворе пирофосфата (0.5%) в течение 24 ч, затем добавляли стрессопротектор (метилрезорцин) и стимулятор роста (индолилуксусную кислоту) как описано в работе (Кряжевских и соавт., 2012).
Родовую и видовую принадлежность микроорганизмов, выделенных в чистых культурах, определяли методом секвенирования амплифицированных последовтельностей гена 16S РНК. Тотальную ДНК выделяли из биомассы с использованием набора для выделения ДНК “DiatomtmDNAprep” (ИБХ РАН, Москва, Россия) в соответствии с рекомендациями производителя.
Амплификация генов 16S рРНК. Выделенную ДНК использовали для полимеразной цепной реакции (ПЦР) с универсальными бактериальными праймерами. ПЦР проводили на амплификаторе iCycler фирмы “BioRad” (США) в 10 мкл смеси, содержащей: 1× Taq-буфер (10 мМ Tris-HCl pH 8.3, 50 мМ KCl), 2 мМ MgCl2, 200 мкМ дезоксирибонуклеозидтрифосфатов, по 5 пикомолей 5'- и 3'-концевых праймеров, 1 ед. активности Taq ДНК-полимеразы (“Perkin-Elmer”, США) и 1 мкг ДНК. Амплификацию генов 16S рРНК проводили в следующем режиме: 1 цикл – 3 мин при 94°С, 30 циклов по 0.5 мин при 94°С, 0.5 мин при 50°С, 0.5 мин при 72°С и 7 мин при 72°С. Длину полученных фрагментов проверяли в 1.0% агарозном геле с бромистым этидием.
Cеквенирование ПЦР-продуктов фрагментов генов 16S рРНК проводили на автоматическом секвенаторе 3730 DNA Analyzer с использованием набора BigDye® Terminator v3.1 Cycle Sequencing Kits (“Applied Biosystems”, США) в соответствии с рекомендациями производителя.
Филогенетический анализ последовательностей гена 16S рРНК. Первичный сравнительный анализ полученных нуклеотидных последовательностей проводили с помощью программы BLAST (http://www.ncbi.nlm.nih.gov/blast) в базе данных NCBI GenBank с последовательностями референтных организмов. Последовательности редактировали с помощью программы BioEdit (Hall, 1999). Филогенетический анализ проводили путем построения эволюционных деревьев с помощью программных пакетов MAFFT 6.0. (Katoh, 2009), MEGA version 4.0. (Tamura, 2007). Дендрограммы были построены с использованием алгоритма “метод объединения соседей” (Neighbor joining method).
Органические кислоты в накопительных культурах (НК) образцов почв и чистых культурах бактерий определяли хроматографически (Захарова и соавт., 2013) на ВЭЖХ хроматографе Стайер (“Аквилон”, Россия). Образец микробной или почвенной суспензии центрифугировали для удаления клеток и нерастворимого осадка. Супернатант подкисляли 5 М H2SO4 до рН 2 и вводили в хроматограф. Разделение проводили в изократическом режиме с элюентом 5 мМ H2SO4 и расходом 0.6 мл/мин на колонке Aminex HPX-87H (“BioRad”, США), присоединенной к рефрактометрическому детектору Smartline 2300 (“Knauer”, Германия).
Накопительные культуры (НК) из образцов № 1–4 готовили путем многократного (до 5 раз) пассирования на обезжиренном молоке и дальнейшего культивирования в течение 2 нед. в стандартных и микроаэрофильных (м) условиях.
Протеолитическую активность выделенных бактерий определяли в культуральной жидкости методом Ансона (Нетрусов и соавт., 2005), основанном на определении количества тирозина, образующегося при гидролизе казеина внеклеточными ферментами. За 1 ед. протеолитичской активности (ПЕ) принимали количество фермента, необходимое для образования 1 мкг тирозина за 10 мин в 1 мл культуральной жидкости.
Биодеградативную активность органического вещества бактерии Aquamicrobium terrae определяли по интенсивности разложения осадка сточных вод муниципальных очистных сооружений. Твердофазной аэробной биодеградации (компостированию) подвергали смесь анаэробно сброженного осадка сточных вод (АнОСВ) Люберецких очистных сооружениях АО “Мосводоканал” и древесных опилок лиственных пород деревьев (береза, осина) (Zorpas, 2008). Компостируемая смесь содержала 2 кг АнОСВ и 1.35 кг опилок. В опытный образец вносили 25 г A. terrae (по весу сухих клеток), предварительно разбавив его 500 мл водопроводной воды. Образец инкубировали при температуре 43°C в течение 3 ч. В контроле в компостируемую смесь с добавлением 500 мл водопроводной воды бактерии не вносили. Компостирование проводили в двухкамерной экспериментальной установке объемом 50 л, созданной в соответствии с рекомендациями (Petiot, 2004) с равными условиями в каждой камере. Компостируемую смесь помещали в цилиндрические емкости объемом 9 л каждая. Опыты проводили в трехкратной повторности, как описано ранее (Mironov, 2018). Эффективность компостирования оценивали по изменению температуры компостируемого материала, а также изменению концентрации диоксида углерода и кислорода в газовой фазе (Petric, 2012; Mironov, 2018); автоматический режим поддержания температуры саморазогрева осуществляли с помощью измеритель-регулятора температуры ИРТ-4/16-Т-8Р-8А (“ЭКСИС”, Россия) с точностью 0.1°С. Концентрацию углекислого газа (0–5.0 ± 0.5 об. %) и кислорода (0–30 об. % с погрешностью ±1.0 об. %) определяли в установке с помощью газоанализатора ОКА-92МТ (“Информаналитика”, Россия) непрерывно. Время компостирования составило 10 сут.
Углеводородокисляющую активность бактерии A. terrae, выделенной в чистую культуру, определяли при росте в жидкой минеральной среде Адкинса (Adkins et al., 1992) следующего состава (г/л): K2HPO4 – 1.5; KH2PO4 – 0.75; NH4Cl – 0.3; NaCl – 5.0; MgSO4 ⋅ 7H2O – 0.1; KCl – 0.1; CaCl2 – 0.02; рН 7.0; микроэлементы (1 мл/л) по рецепту (Pfennig, Lippert, 1966). В качестве единственного источника углерода и энергии вносили (0.2–0.5 об. %): (1) стерильную сырую высокопарафинистую (среднее содержание парафинов 5.1%) нефть девонских отложений Узеньского нефтяного месторождения (Казахстан), плотность 0.862 г/см3; (2) смесь жидких н-алканов С14–С17. Культуры инкубировали в статических условиях в герметично закрытых флаконах при температуре 25–28°С в течение 7 сут. Контролем служила стерильная среда с нефтью. Рост бактерий на углеводородах нефти анализировали методом газово-жидкостной хроматографии (Назина и соавт., 2018). Рост на смеси углеводородов С14–С17 определяли по изменению оптической плотности (OD660) культуры (Ultrospec 2100 pro, “Amersham Biosciences”, Великобритания; l = 1 см; λ = 660 нм) и образованию устойчивой эмульсии. Развитие бактерий на углеводородах детектировали через 7 сут роста.
Определение индекса эмульгирования (Е24) при росте бактерии A. terrae на среде Адкинса (Adkins et al., 1992) со смесью парафинов С14–С17 и среде LB определяли модифицированным методом (Zajic et al., 1977). К 1.0 мл гексадекана добавляли 1.0 мл исследуемой культуры. Смесь встряхивали в течение 3 мин, отстаивали в течение 24 ч, после чего фиксировали объем и устойчивость образовавшейся эмульсии. Индекс эмульгирования выражали в % объема эмульсии от объема смеси (100%).
Содержание количества биогенных аминов и аминокислот, синтезируемых выделенными штаммами, определяли в культуральной жидкости культур бактерий стационарной фазы при их росте в средах МПБ и обезжиренном (0.1%) ультрапастеризованном молоке (“Parmalat”) методом высокоэффективной жидкостной хроматографии. Биогенные амины и их предшественники разделяли на обращенно-фазовой колонке ReproSil-Pur (“Dr. Majsch GMBH”, “Элсико”, Москва) с последующей амперометрической детекцией на стеклоугольном электроде. Содержание нейроактивных аминокислот определяли на хроматографической установке LC-304T (“BAS, Inc.”, West Lafayette, СШA) с последующей флуориметрической детекцией.
РЕЗУЛЬТАТЫ
Выделение гетеротрофных бактерий из сосудов с погребальной пищей. При микробиологическом анализе учет численности специфических групп микроорганизмов проводили чашечным методом посева водной суспензии почвенного образца из придонного грунта, отобранного из погребального сосуда, на агаризованные питательные среды. Численность гетеротрофных бактерий была определена в образцах 1–4 высевом почвенных суспензий на агаризованную (1.5%) среду LB. Численность микроорганизмов (КОЕ) в образцах после их 1-сут инкубации в растворе пирофосфата и реактивации клеток методами, разработанными для реактивации покоящихся почвенных арктических микробных сообществ (Кряжевских и соавт., 2012), составила (КОЕ × 107/г почвы): 1 образец – 2.5; 2 – 16.0; 3 – 1.5; 4 – 8.0.
Достаточно высокий титр клеток, способных к размножению, свидетельствовал о хорошем сохранении жизнеспособности бактериями, длительное время (несколько тысяч лет) находящимися в состоянии покоя в горшках с погребальной пищей (молочной или мясной) подкурганных захоронений.
Определение органических кислот в накопительных культурах, полученных инкубацией образцов погребенных почв в обезжиренном молоке при естественной аэрации, показало наличие в них лактата (табл. 2). При этом в микроаэрофильных условиях (полное заполнение сосуда средой) количество образующегося лактата возрастало (табл. 2). Лактат образовывался во всех условиях, что свидетельствовало о наличии в исследуемых образцах молочнокислых бактерий.
Таблица 2.
Органические кислоты, образовавшиеся в накопительных культурах (НК), полученных из образцов погребенных почв, и в чистых культурах изолятов в стандартных (с доступом воздуха) и микроаэрофильных условиях (м)
| Объект | Органическая кислота, ммоль/л | |||||
|---|---|---|---|---|---|---|
| лактат | ацетат | изобутират/этанол | н-бутират | формиат | изовалерат | |
| НК 2 | 24.9 | 19.3 | 1.6 | 0.4 | 0.6 | 0.0 |
| НК 3 | 18.6 | 16.5 | 3.3 | 1.0 | 15.3 | 0.6 |
| НК 4 | 11.9 | 15.0 | 2.6 | 0.2 | 5.3 | 0.0 |
| B. coagulans | 26.3 | 31.8 | 1.3 | 0.0 | 0.0 | 0.0 |
| St. hominis | 1.9 | 4.0 | 2.0 | 1.0 | 0.5 | 1.4 |
| B. coagulans (м)* | 37.52 | 3.71 | 4.14 | 0.43 | 0.00 | 0.19 |
| НК 2 (м) | 26.26 | 5.38 | 1.69 | 1.59 | 2.52 | 0.05 |
| НК 3 (м) | 49.75 | 1.58 | 4.19 | 0.20 | 4.55 | 0.09 |
| НК 4 (м) | 11.57 | 8.39 | 0.71 | 1.39 | 1.53 | 0.06 |
Для выделения чистых культур протеолитических и молочнокислых бактерий (МКБ) использовали прием чередующихся инокуляции образца в обезжиренное молоко и высева на различные среды при соблюдении микроаэрофильных условий (полное заполнение сосудов для культивирования и посев в агаризованные среды уколом). При этом предполагалось, что на всех средах в равной степени будут развиваться как МКБ, так и протеолитические бактерии. Приведем примеры такого выделения чистых культур (все посевы культивировали при 30°С). Схема 1 : в 10 мл физраствора с 0.5% пирувата натрия вносят 1 г почвенного образца, инкубация 1 сут → инокуляция жидкой среды SL или 3.2% молока, инкубация 7 сут → рассев на среды MRS и LA, инкубация 7 сут → инокуляция отдельными колониями 0.5% молока, инкубация 7 сут → рассев на среду LA, инкубация 7 сут → пересев отдельных колоний на среду MRS. Схема 2 : в 10 мл физраствора с 0.5% пирувата натрия вносят 1 г почвенного образца, инкубация 14 сут → инокуляция среды ГМ, инкубация 7 сут → рассев на среду MRS, инкубация 7 сут → инокуляция обезжиренного молока отдельными колониями, инкубация 7 сут → рассев на среды MRS и ГМ+, инкубация 7 сут → пересевы отдельных колоний на среду MRS.
Всего из исследованных образцов были выделены изоляты, большинство из которых по культурально-морфологическим признакам относились к родам Acinetobacter, Microbacterium, Aquamicrobium, Bacillus, Staphylococcus. Из выделенных в чистые культуры изолятов остановимся на следующих, представляющих интерес для биотехнологических целей и биомедицины. Из образца № 1 выделены бактерии Aquamicrobium terrae и Bacillus cereus; из образца № 2 – Staphylococcus hominis; из образца № 3 – St. epidermidis и St. hominis; из образца № 4 – Bacillus coagulans (Lactobacillus coagulans). Идентификация изолятов была проведена на основании анализа последовательностей гена 16S pРНК. Нуклеотидные последовательности изолятов внесены в базу данных GenBank NCBI как: Aquamicrobium terrae DEV26 (MK_542830), Bacillus coagulans DEV11 (MK_542831), Bacillus cereus DEV99 (MK_542832), Staphylococcus epidermidis DEV205 (MK_542833), Staphylococcus hominis DEV49 (MK_542834) (рис. 1–3).
Рис. 1.
Филогенетическое положение выделенного штамма Aquamicrobium terrae (MK_542830), определенное с использованием метода “neighbor-joining”. Цифрами показана статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа 1000 альтернативных деревьев.
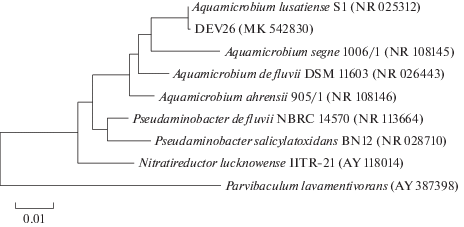
Рис. 2.
Филогенетическое положение выделенных штаммов Bacillus coagulans (MK_542831) и Bacillus cereus (MK_542832), определенное с использованием метода “neighbor-joining”. Цифрами показана статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа 1000 альтернативных деревьев.
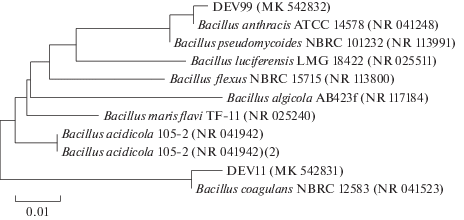
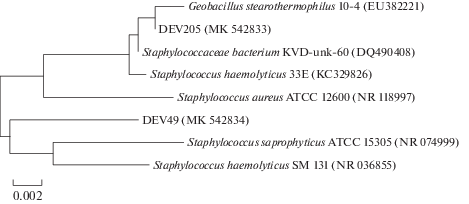
Рис. 3.
Филогенетическое положение выделенного штаммов Staphylococcus epidermidis (MK_542833), и Staphylococcus hominis (MK_542834), определенное с использованием метода “neighbor-joining”. Цифрами показана статистическая достоверность порядка ветвления, определенная с помощью “bootstrap”-анализа 1000 альтернативных деревьев.
Учитывая специфику источника выделения исследуемых бактерий (сосуды с погребальной пищей), были определены их протеолитическая активность и продукция нейроактивных соединений.
Продукция нейроактивных соединений бактериальными штамамми, выделенными из палеопочв. В последние годы большое внимание уделяется способности микроорганизмов – симбионтов человека и животных, продуцировать нейроактивные соединения, участвующие в передаче импульсов через синаптическую цепь между нервными клетками (Олескин и соавт., 2016). Ранее проведенными исследованиями показано, что молочнокислые бактерии, как основные компоненты микробных сообществ желудочно-кишечного тракта человека и животных, являются эффективными продуцентами нейромедиаторов (Олескин и соавт., 2014, 2016).
В табл. 3 и 4 приведены результаты определения содержания внеклеточных биогенных аминов и нейроактивных аминокислот в культуральной жидкости выделенных изолятов, развивающихся в молоке до стационарной фазы роста. Наиболее продуктивными по синтезу дофамина (ДA), дигидроксифенилаланина (ДOФA) – прекурсора дофамина, и 5-гидрокситриптофана (5 НТР) – прекурсора серотонина, оказались штаммы A. terrae и B. coagulans (Lactobacillus sporogenes). По содержанию дофамина B. coagulans превосходил исследованные штаммы МКБ в 10 раз (0.7 мкМ) (Олескин и соавт., 2014). Высокой продуктивностью биогенных аминов характеризовались также штаммы Bacillus sp. I (из образца № 4) и Bacillus sp. II (из образца № 3). Штаммы B. coagulans и A. terrae обладали также высокой биосинтетической активностью в отношении нейроактивных аминокислот: аспарагина (∼0.3 мкМ), глицина (∼1.0–0.7 мкМ), глутатиона (∼0.5 мкМ), таурина (∼1.0 мкМ), существенно более высокой, чем у современных штаммов МКБ (Олескин и соавт., 2014).
Таблица 3.
Концентрации нейроактивных аминов (нМ) в культурах изолятов, выделенных из палеопочв
| Штаммы | Продуктивность, нМ/л | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ДОФА | NA | DOPAC | DA | 5-HT | 5HTP | 5-HIAA | HVA | 3MT | DOPAС/DA | HVA/DA | 5-HIAA/5-HT | |
| Bacillus sp. I | 151.4 | 0.0 | 468.1 | 266.8 | 0.0 | 381.7 | 0.0 | 2758.3 | 1278.4 | 1.8 | 10.3 | |
| B. coagulans | 299.1 | 0.0 | 720.4 | 724.7 | 0.0 | 617.3 | 0.0 | 15.2 | 371.1 | 1.0 | 0.0 | |
| Bacillus sp. II | 0.0 | 1204.6 | 273.5 | 55.9 | 11.4 | 100.2 | 92.2 | 1629.8 | 189.5 | 4.9 | 29.1 | 8.1 |
| A. terrae | 4114.4 | 0.0 | 3398.4 | 441.7 | 0.0 | 438.5 | 482.9 | 600.8 | 1036.9 | 7.7 | 1.4 | |
| St. hominis | 143.0 | 120.6 | 267.1 | 342.4 | 0.0 | 428.6 | 0.0 | 60.5 | 197.6 | 0.8 | 0.2 | |
| St. epidermidis | 55.1 | 160.2 | 70.9 | 59.6 | 0.0 | 246.8 | 0.0 | 14.1 | 391.9 | 1.2 | 0.2 | |
Обозначения. ДОФА – дигидроксифенилаланин (прекурсор дофамина); NA – норадреналин; ДОРАС – дигидроксифенилуксусная кислота (прекурсор дофамина); ДА – дофамин; 5-НТ – 5-гидрокситриптамин (серотонин); 5НТР – 5-гидрокситриптофан (прекурсор серотонина); 5-HIAA – 5-гидроксииндолуксусная кислота (продукт обмена серотонина); HVA – гомованилиновая кислота (основной продукт обмена катехоламинов, в том числе дофамина); 3МТ – 3-метокситирамин – продукт обмена дофамина.
Таблица 4.
Концентрации нейроактивных аминокислот (мкМ) в культуральной жидкости изолятов, выделенных из палеопочв
| Штаммы | Asp | Glu | Gly | Tau | GABA |
|---|---|---|---|---|---|
| St. epidermidis | 0.214 | 1.116 | 0.794 | 0.007 | 0.050 |
| St. hominis | 0.333 | 0.316 | 0.009 | 0.122 | 0.070 |
| A. terrae | 0.303 | 0.529 | 1.025 | 0.048 | 0.063 |
| Bacillus sp. II | 0.049 | 0.902 | 0.477 | 0.960 | 0.135 |
| B. coagulans | 0.175 | 0.549 | 0.746 | 0.022 | 0.093 |
| Bacillus sp. I | 0.084 | 0.296 | 0.446 | 0.215 | 0.138 |
Протеолитическая активность штаммов, выделенных из палеопочв. Все выделенные в чистую культуру бактерии характеризовались умеренной протеолитической активностью (табл. 5), наиболее высокой обладали штаммы A. terrae и Bacillus sp. II (из образца № 3) – около 0.2 ед./мл (по Ансону).
Таблица 5.
Протеолитическая активность выделенных микроорганизмов
| Штамм | Тирозин в опыте, мкг/мл | Тирозин в поправке, мкг/мл | ПЕ |
|---|---|---|---|
| A. terrae | 72.30 | 27.70 | 0.20 |
| Bacillus sp. II | 67.34 | 29.19 | 0.17 |
| Bacillus sp. I | 47.59 | 30.69 | 0.07 |
| St. epidermidis | 35.65 | 27.53 | 0.04 |
| St. hominis | 33.54 | 29.76 | 0.02 |
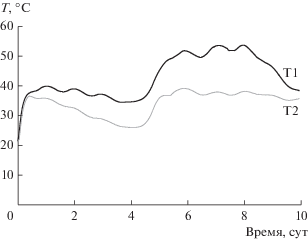
Высокая протеолитическая активность штамма A. terrae предполагала его потенциальную перспективность в биотехнологиях, где используется гидролиз белковых соединений, в частности, при компостировании органических коммунальных отходов. В лабораторных экспериментах в течение исследуемого срока (10 сут) компостирования смеси осадка сточных вод муниципальных очистных сооружений и древесных опилок наблюдали значительное увеличение температуры опытного образца по сравнению с контрольным (рис. 4). В опытном образце термофильный режим компостирования 37–53°C установился уже в первые сутки и удерживался в течение 8 сут. При этом температура обеззараживания 50–53°C была достигнута на 5–6 сут и сохранялась на этом уровне более 48 ч, что считается достаточным для обеззараживания компостной смеси от условно-патогенной микрофлоры и личинок гельминтов. Отметим, что в эти сроки температура в контрольном образце не поднималась выше 39°C.
Рис. 4.
Динамика температуры компостируемой смеси осадка сточных вод с древесными опилками в опытном варианте с внесением бактерий A. terrae (Т1) и в контрольном варианте (без внесения бакте-рий) (Т2).
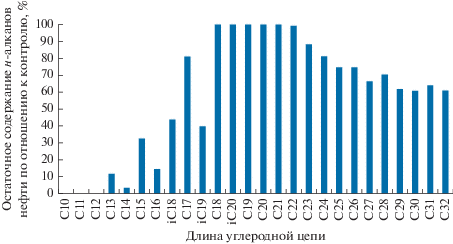
Углеводородокисляющая активность бактерии Aquamicrobium terrae. Еще одним биотехнологически значимым свойством штамма A. terrae была его способность расти на средах с алифатической составляющей нефти в качестве единственного источника углерода и энергии. По литературным данным штамм A. terrae, впервые изолированный из химически загрязненных почв, обладал высокой активностью разложения углеводородов (Zhi-Guo Wu et al., 2014). В наших экспериментах рост штамма A. terrae на сырой нефти Узеньского нефтяного месторождения сопровождался образованием водно-нефтяной эмульсии, что свидетельствовало о способности бактерии синтезировать поверхностно-активные вещества (ПАВ), способствующие эмульгированию водонерастворимых углеводородов. При росте на нефти штамм преимущественно использовал н-алканы С12–С19, а также С23–С32 (рис. 5). Остаточное содержание н-алканов нефти при росте штамма A. terrae представлено на рис. 6.
Рис. 5.
Хроматограмма фракции насыщенных углеводородов нефти Узеньского месторождения: исходной (а) и деградированной штаммом A. terrae (б).
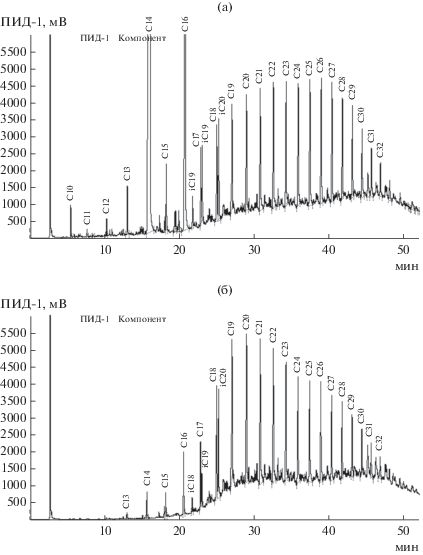
Рис. 6.
Остаточное содержание н-алканов нефти Узеньского месторождения после инкубации (7 сут) со штаммом A. terrae (% по отношению к 100% контроля).
Способность окислять низкомолекулярные н‑алканы нефти была подтверждена при росте бактерий A. terrae на смеси жидких парафинов фракции С14–С17. В этих экспериментах была выявлена высокая эмульгирующая активность штамма, которая в принятых единицах измерения составляла 50%, что демонстрирует способность A. terrae продуцировать внеклеточные биосурфактанты. При смешивании культуральной жидкости с н-гексаном, последующем встряхивании и отстаивании в течении 24 ч, наблюдали сохранение стойкой эмульсии (Е24 = 50%). Таким образом, изолированный из палеопочв штамм A. terrae обладает высокой протеолитической и эмульгирующей активностью, что обусловливает его перспективность для применения в биотехнологиях защиты окружающей среды.
Штамм Bacillus cereus, выделенный из образца № 1, привлек наше внимание высоким сходством культурально-морфологических признаков с B. anthracis (патоген 2 группы). Штамм был определен методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени “АмплиСенс®Bacillus anthracis-FRT” (\32617-Пр/08 от 09.04.08) в ФИЦ ГНУ ВНИИ ветеринарной вирусологии и микробиологии. По результатам бактериологического и молекулярно-генетического анализов изолят был идентифицирован как Bacillus cereus sub. cereus, патогенный для аутобредных белых мышей при внутрибрюшной инокуляции патогена (протокол лабораторных исследований № 16981–16983).
ОБСУЖДЕНИЕ
В общем объеме исследований погребенных почв, относящихся исключительно к компетенции российской науки, изучение микробных сообществ, в основном, велось в аспекте определения численности сохранивших жизнеспособность клеток, их общей биомассы, особенностей морфологии, объяснения возможных механизмов выживания в неростовых условиях в течение длительного времени (Дёмкина и соавт., 2000).
При этом основным направлением исследований была сравнительная характеристика микробной компоненты различных типов палеопочв.
В настоящей работе впервые из образцов палеопочв (возраст XXVIII–XIV вв. до н.э.), отобранных из сосудов с погребальной пищей подкурганных захоронений, выделены в чистую культуру ряд бактерий, которые по своему таксономическому положению скорее характерны для микрофлоры, связанной с человеком, чем для сапротрофной компоненты почвенных микробных сообществ. Все выделенные изоляты можно отнести к трем физиологическим группам.
Штаммы St. hominis и St. epidermidis являются типичными контаминантами кожи человека, относящимися к оппортунистическим условным патогенам. Обращает на себя внимание достаточно выраженная способность обоих штаммов синтезировать внеклеточные биогенные амины и аминокислоты (табл. 4, 5). Эта физиологическая активность, хорошо изученная для молочнокислых бактерий и показанная для представителей нормофлоры человека, ставит вопрос о регуляторных функциях внеклеточных нейроактивных аминов и аминокислот в контроле развития условно-патогенных бактерий, в том числе кожных контаминантов человека.
Высокотоксикогенный штамм Bacillus cereus sub. cereus представляет бактериологический интерес, так как по фенотипическим признакам занимает промежуточное положение между B. cereus и B. anthracis.
Из выделенных молочнокислых изолятов наиболее интересен штамм B. coagulans, характеризующийся высокой синтетической активностью биогенных аминов (табл. 3). Отметим, что все выделенные в чистые культуры изоляты синтезировали дофамин (ДА), но особенно продуктивен был штамм B. coagulans. Единственный продуцент серотонина – Bacillus sp. II, у остальных штаммов метаболизм триптофана останавливался на стадии образования 5-гидрокситриптофана (5НТР) – предшественника серотонина.
По биологическим свойствам B. coagulans занимает промежуточное положение между двумя родами – Bacillus и Lactobacillus (De Vecchi, 2006; Бомко и соавт., 2016). Ряд свойств объединяют B. coagulans с представителями рода Bacillus. Для роста микроорганизм использует такие вещества, как углеводы, пептоны, мясо и дрожжевой экстракт. Продуцирует кислоты из моно-, ди- и трисахаридов. Однако ряд характеристик отличает B. coagulans от представителей рода Bacillus. Как и молочнокислые бактерии, клетки B. coagulans имеют изогнутую форму, слабо подвижны, споры расположены терминально. Бактерия продуцирует молочную кислоту, дает отрицательный оксидазный тест, не восстанавливает нитраты до нитритов.
B. coagulans является одним из наиболее полезных пробиотических микроорганизмов. Обладая спорами, она хорошо “переносит технологические процессы”, устойчива к действию желудочного сока и желчи и хорошо развивается в автохтонном сообществе кишечника (Юлиш, Кривушев, 2011), тогда как значительное количество неспорообразующих молочнокислых бактерий погибают по пути от ротовой полости до кишечника (Савустьяненко, 2011). Попадая в двенадцатиперстную кишку, споры B. coagulans прорастают в вегетирующие клетки в просвете кишечника человека и оказывают различные пробиотические эффекты (Claus, 2005). B. coagulans относится к полурезидентным бактериям: выполнив в организме человека функцию пробиотика, ее клетки переходят в фазу споруляции и покидают организм, выделяясь с фекалиями в виде спор. Как пробиотик B. coagulans увеличивает в микрофлоре желудочно-кишечного тракта численность МКБ и вытесняет патогенную флору. Механизмы пробиотического действия этой бактерии – продукция молочной кислоты и бактериоцинов, а также иммуномодулирующее действие за счет стимуляции клеточного и гуморального иммунитета. В последние десятилетия на основе этой бактерии на мировом фармацевтическом рынке появился ряд препаратов с доказанной клинической эффективностью (FAO/WHO, 2001). Получение новых изолятов этого вида представляет биотехнологический интерес.
Выделенный из палеопочв штамм A. terrae обладал интересным сочетанием физиологических свойств: выраженной протеолитической активностью и высокой эмульгирующей способностью. Последнее обусловливает свойство штамма расти на н-алканах нефти и других гидрофобных субстратах.
A. terrae – грамотрицательная, неподвижная, палочковидная бактерия, не образует спор, способна как к аэробному, так и анаэробному метаболизму, каталазо- и оксидазоположительная, превращает нитраты в нитриты. Согласно литературным данным, A. terrae способен к деградации хлорфенольных и фенольных соединений, что указывает на потенциальную перспективность микроорганизмов этого вида к деградации органических загрязнителей (Kаmpfer et al., 2009). Первоначально выделенный штамм был депонирован в Gen Bank/EMBL в 2014 году (Zhi-Guo Wu et al., 2014).
В нашем исследовании впервые показана эмульгирующая способность штамма A. terrae при росте на углеводородах. Аэробное окисление нефтяных углеводородов микроорганизмами является основным биологическим механизмом трансформации и разложения этих гидрофобных соединений. Ограниченная растворимость углеводородов в воде обусловливает их высокую устойчивость в окружающей среде и, как следствие, низкую биодоступность. Углеводородокисляющие микроорганизмы в большей или меньшей степени способны синтезировать внеклеточные поверхностно-активные вещества (ПАВ), которые взаимодействуют с углеводородами с образованием микроэмульсий. Бактерии используют эту стратегию для преодоления барьера растворимости и увеличения эффективности транспорта углеводородов в клетку для их ассимиляции (Bouchez-Naitali et al., 1999; Van Hamme et al., 2003).
Другое физиологически важное свойство A. terrae – его высокая протеолитическая активность, возможно, является штаммовым признаком, так как не отмечалась ранее для этого вида (Zhi-Guo Wu et al., 2014). Проведенные нами лабораторные испытания A. terrae в процессе компостирования осадка сточных вод муниципальных очистных сооружений показали эффективность его использования для интенсификации биодеградации органического вещества и обеспечения обеззараживания стоков, что может иметь практический интерес в промышленных технологиях утилизации осадков сточных вод.
Таким образом, полученные результаты демонстрируют: 1) высокую выживаемость (сохранение жизнеспособности) в палеопочвах подкурганных захоронений бактерий, в том числе контаминантов человека, а также форм, связанных с его культурой, в частности, культурой питания; 2) вероятность реактивации патогенных бактерий, что демонстрирует, например, изоляция высокотоксичного штамма B. cereus; 3) целесообразность использования таких нетрадиционных источников как палеопочвы для выделения микроорганизмов, перспективных для биотехнологии, на примерах B. coagulans и A. terrae.
Список литературы
Бомко Т.В., Мартынов А.В., Носальская Т.Н., Каблучко Т.В. “Король пробиотиков”. Bacillus coagulans в современном комбинированном пробиотическом препарате “Лактовит Форте” // Annals of Mechnikov Institute. 2016. № 1. С. 17–37.
Бухарин О.В., Гинцбург А.Л., Романова Ю.М., Эль-Регистан Г.И. Механизмы выживания бактерий. М.: Медицина, 2005. 367 с.
Вайнштейн М.Б., Кудряшова Е.Б. О наннобактериях // Микробиология. 2000. Т. 69 № 2. С. 163–174.
Vainshtein M.B., Kudryashova E.B. Nannobacteria // Microbiology (Moscow). 2000. V. 69. P. 129–138.
Дёмкин В.А., Борисов А.В., Дёмкина Т.С., Хомутова Т.Э., Золотарева Б.Н., Каширская Н.Н., Удальцов С.Н., Ельцов М.В. Волго-Донские степи в древности и средневековье (по материалам почвенно-археологических исследований) // Пущино: SYNCHROBOOK, 2010. 120 с.
Дёмкин В.А., Дёмкина Т.С., Удальцов С.Н. Реконструкция погребальной пищи в глиняных сосудах из курганных захоронений с использованием фосфатного и микробиологических методов // Вестник археологии, антропологии и этнографии. 2014. № 2 (25). С. 148–159.
Дёмкин В.А., Лукашов А.В., Ковалевская И.С., Скрипниченко И.И. О возможности историко-социологических реконструкций при почвенно-археологических исследованиях // Препр. Пущино, 1988. С. 15–16.
Дёмкина Т.С., Борисов А.В., Дёмкин В.А. Микробные сообщества палеопочв археологических памятников пустынно-степной зоны // Почвоведение. 2000. Т. 33. № 9. С. 1117–1126.
Demkina T.S., Demkin V.A., Borisov A.V. Microbial communities in the paleosols of archaeological monuments in the desert-steppe zone // Euras. Soil Sci. 2000. V. 33. P. 978–986.
Дёмкина Т.С., Борисов А.В., Дёмкин В.А. Микробиологические исследования подкурганных палеопочв пустынно-степной зоны Волго-Донского междуречья // Почвоведение. 2004. Т. 37. № 7. С. 853–859.
Demkina T.S., Borisov A.V., Demkin V.A. Microbiological study of paleosols buried under kurgans in the desert-steppe zone of the Volga-Don interfluve // Euras. Soil Sci. 2004. V. 37. P. 743–748.
Дёмкина Т.С., Борисов А.В., Ельцов М.В., Дёмкин В.А. Сравнительная характеристика микробных сообществ курганных насыпей, подкурганных и современных почв степной зоны Нижнего Поволжья // Почвоведение. 2007. Т. 40. № 6. С. 738–748.
Demkina T.S., Borisov A.V., Eltsov M.V., Demkin V.A. Comparative characterization of microbial communities in kurgans, paleosols buried undeeunder, and background surface soil in the steppe zone of the lower Volga region // Euras. Soil Sci. 2007. V. 40. P. 665–674.
Захарова А.М., Карцова Л.А., Гринштейн И.Л. Определение органических кислот, углеводов, подсластителей в пищевых продуктах и биологически активных добавках методом высокоэффективной жидкостной хроматографии // Аналитика и контроль. 2013. Т. 17. № 2. С. 204–210.
Каширская Н.Н., Хомутова Т.Э., Дмитриев В.В., Дуда В.И., Сузина Н.Е., Дёмкин В.А. Морфология клеток и биомасса микроорганизмов подкурганных и современных степных почв Нижнего Поволжья // Почвоведение. 2010. Т. 43. № 10. С. 1229–1238.
Kashirskaya N.N., Khomutova T.E., Demkin V.A., Dmitriev V.V., Duda V.I., Suzina N.E. The morphology of the cells and the biomass of the microorganisms in the buried paleosoils and modern steppe of the lower Valga Region // Euras. Soil Sci. 2010. V. 43. P. 1229–1238.
Кряжевских Н.А., Демкина Е.В., Манучарова Н.А., Соина В.С., Гальченко В.Ф., Эль-Регистан Г.И. Реактивация покоящихся и некультивируемых форм бактерий из древних почв и мерзлых подпочвенных отложений // Микробиология. 2012. Т. 81. № 4. С. 474–485.
Kryazhevskikh N.A., Demkina E.V., Galchenko V.F., El-Registan G.I., Manucharova N.A., Soina V.S. Reactivation of dormant and nonculturable bacterial forms from paleosoils and subsoil permafrost // Microbiology (Moscow). 2012. V. 81. P. 435–445.
Кряжевских Н.А., Демкина Е.В., Лойко Н.Г., Баслеров Р.В., Колганова Т.В., Соина В.С., Манучарова Н.А., Гальченко В.Ф., Эль-Регистан Г.И. Сравнение адаптационного потенциала изолятов из вечномерзлых осадочных пород Arthrobacter oxydans и Acinetobacter lwoffii и их коллекционных аналогов // Микробиология. 2013. Т. 82. № 1. С. 27–41.
Kryazhevskikh N.A., Demkina E.V., Loiko N.G., Baslerov R.V., Kolganova T.V., Soina V.S., Manucharova N.A., Gal’chenko V.F., El’-Registan G.I. Comparison of the adaptive potential of the Arthrobacter oxydans and Acinetobacter lwoffiiIsolates from permafrost sedimentary rock and the analogous collection strains // Microbiology (Moscow). 2013. V. 82. P. 29–42.
Манучарова Н.А., Трошева Е.В., Кольцова Е.М., Дёмкина Е.В., Караевская Е.В., Ривкина Е.М., Марданов А.В., Эль-Регистан Г.И. Характеристика структуры прокариотного комплекса многолетнемерзлых грунтов Антарктиды на основании данных молекулярно-биологических методов // Микробиология. 2016. Т. 85. № 1. С. 83–91.
Manucharova N.A., Trosheva E.V., Kol’tsova E.M., Demkina E.V., El’-Registan G.I., Karaevskaya E.V., Rivkina E.M., Mardanov A.V. Characterization of the structure of the prokaryotic complex of the Antarctic permafrost by molecular genetic techniques // Microbiology (Moscow). 2016. V. 85. P. 102–108.
Назина Т.Н., Соколова Д.Ш., Бабич Т.Л., Семенова Е.М., Борзенков И.А., Биджиева С.Х., Меркель А.Ю., Хисаметдинов М.Р., Турова Т.П. Филогенетическое разнообразие микроорганизмов осадка биогазового реактора, перерабатыающего нефтесодержащие и муниципальные отходы // Микробиология. 2018. Т. 87. № 3. С. 314–324.
Nazina T.N., Sokolova D.Sh., Babich T.L., Semenova E.M., Borzenkov I.A., Bidzhieva S.Kh., Merkel A.Yu., Khisametdinov M.R., Tourova T.P. Phylogenetic diversity of microorganisms from the sludge of a biogas reactor processing oil-containing and municipal waste // Microbiology (Moscow). 2018. V. 87. P. 416–424.
Нетрусов А.И., Егорова М.А., Захарчук Л.М. Практикум по микробиологии: Уч. пособие для студ. высш. учеб. заведений. М.: Академия, 2005. 105 с.
Олескин А.В., Жиленкова О.Г., Шендеров Б.А., Амерханова А.М., Кудрин В.С., Клодт П.М. Заквасочные культуры лактобацилл – продуценты нейромедиаторов: биогенных аминов и аминокислот // Молочная промышленность. 2014. № 9. С. 42–43.
Олескин А.В., Эль-Регистан Г.И., Шендеров Б.А. Меж-микробные химические взаимодействия микробиота–хозяин: роль нейромедиаторов // Микробиология. 2016. Т. 85. № 1. С. 3–25.
Oleskin A.V., El’-Registan G.I., Shenderov B.A. Role of neuromediators in the functioning of the human microbiota: “Business talks” among microorganisms and the microbiota-host dialogue // Microbiology (Moscow). 2016. V. 85. P. 1–22.
Раевский Д.С. Модель мира скифской культуры. M.: Наука, 1985. 255 с.
Савустьяненко А.В. Применение пробиотика Lactobacillus sporogenes (Bacillus coagulans) в клинической практике врача // Новости медицины и фармации. 2011. № 8 (362). С. 1–3.
Фролов Ю.Г., Гродский. А.С. Лабораторные работы и задачи по коллоидной химии. М.: Химия, 1986. С. 216.
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. № 4. С. 446–456.
El-Registan G.I., Mulyukin A.L., Nikolaev Yu.A., Galchenko V.F., Suzina N.E., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology (Moscow). 2006. V. 75. P. 380–389.
Юлиш Е.И., Кривушев Б.И. Проблемы дисбактериоза кишечника и методы его коррекции // Здоровье ребенка. 2011. № 7 (34). С. 1–4.
Adkins J.P., Cornell L.A., Tanner R.S. Microbial composition of carbonate petroleum reservoir fluids // Geomicrobiol. J. 1992. V. 10. P. 87–97.
Atlas R.M., Cerniglia C.E. Bioremediation of petroleum pollutants: diversity and environmental aspects of hydrocarbon biodegradation // BioScience. 1995. V. 45. P. 332–338.
Bouchez-Naïtali M., Rakatozafy H., Marchal R., Leveau J.Y., Vandecasteele J.P. Diversity of bacterial strains degrading hexadecane in relation to the mode of substrate uptake // Appl. Microbiol. 1999. V. 86. P. 421–428.
Claus D., Berkeley R.C.W. Genus Bacillus Cohn 1872 // Bergey’s Manual of Systematic Bacteriology / Eds. Snetah P.H.A., Mair N.S., Sharpe M.E. and Holt J.G. Baltimore: Williams and Wilkins, 1986. P. 1105–1139.
Demkina T.S., Khomutova T.E., Kashirskaya N.N., Demkina E.V., Stretovich I.V., El-Registan G.I., Demkin V.A. Age and activation of microbial communities in soils under burial mounds and in recent surface soils of steppe zone // Euras. Soil Sci. 2008. V. 41. P. 1439–1447.
De Vecchi E. Lactobacillus sporogenes or Bacillus coagulans: misidentification or mislabelling? // Int. J. Probiot. Prebiot. 2006. V. 1. P. 3–10.
FAO/WHO Expert Consultation on Evaluation of Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria // FAO/WHO 2001.
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucleic Acids Symp. Ser. 1999. № 41. P. 95–98.
Petric I., Helic A., Avdic E.A. Evolution of process parameters and determination of kinetics for co-composting of organic fraction of municipal solid waste with poultry manure // Bioresource Technol. 2012. V. 117. P. 107–116.
Kampfer P., Martin E., Lodders N., Jakel U. Transfer of Defluvibacter lusatiensis to the genus Aquamicrobium as Aquamicrobium lusatiense comb. nov. and description of Aquamicrobium aerolatum sp. nov. // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 2468–2470.
Katoh K., Asimenos G., Toh H. Multiple alignment of DNA sequences with MAFFT // Meth. Mol. Biol. 2009. V. 537. P. 39–64.
Mironov V.V., Ivanov Y.A. Test results In-vessel composting system at the cattle farm located in the central part of Russia // Agricultural Mechanization in Asia, Africa, and Latin America. 2018. V. 49. № 3. P. 86–90.
Pfennig N., Lippert K.D. Uber das Vitamin B12-Bedfirfnis phototropher Schwefelbakterien // Arch. Mikrobiol. 1966. V. 55. P. 245–256.
Petiot C., De Guardia A. Composting in a laboratory reactor: a review // Compost Sci. Utilizat. 2004. V. 12. P. 69–79.
Tamura K., Dudley J., Nei M., Kumar S. MEGA 4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0 // Mol. Biol. Evol. 2007. V. 24. P. 1596–1599.
Tiedje J.M., Asuming-Brempong S., Nuesslein K., Marsh T.L., Flynn S.J. Opening the black box of microbial diversity // Appl. Soil Ecol. 1999. V. 13. P. 109–122.
Van Hamme J.D., Singh A., Ward O.P. Recent advances in petroleum microbiology // Microbiol. Mol. Biol. 2003. V. 67. P. 503–549.
Zajic J.E., Guignard H., Gerson D.F. Properties and biodegradation of a bioemulsifier from Corynebacterium hydrocarboclastus // Biotechnol. Bioeng. 1977. V. 19. P. 1303–1320.
Zhi-Guo Wu, Fang Wang, Cheng-Gang Gu, Yin-Ping Zhang, Zong-Zheng Yang, Xiao-Wei Wu, Xin Jiang. Aquamicrobium terrae sp. nov., isolated from the polluted soil near a chemical factory // Antonie van Leeuwenhoek. 2014. V. 105. P. 1131–1137.
Zorpas A.A., Loizidou M. Sawdust and natural zeolite as a bulking agent for improving quality of a composting product from anaerobically stabilized sewage sludge // Bioresource Technol. 2008. V. 99. P. 7545–7552.
Дополнительные материалы отсутствуют.


