Микробиология, 2019, T. 88, № 5, стр. 596-604
Численность, таксономическая структура и функции бактериальных комплексов вересковых растений верховых болот
Т. Г. Добровольская a, *, А. В. Головченко a, Е. Н. Юрченко a, А. В. Якушев a, Н. А. Манучарова a, Т. В. Глухова b
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Россия
b Институт лесоведения Российской академии наук
143030 Московская область, Успенское, Россия
* E-mail: dobrtata@mail.ru
Поступила в редакцию 12.12.2018
После доработки 15.04.2019
Принята к публикации 27.04.2019
Аннотация
Изучены бактериальные сообщества шести болотных растений семейства вересковых. Общая численность бактерий на вегетативных органах вересковых растений характеризовалась высокими значениями и была сравнима с таковой сфагновых мхов. Выявлены общие представители таксонов бактерий, обитающие на вересковых растениях и сфагновых мхах. Доминирующие в эпифитно-сапротрофном комплексе бактерии на основании данных применения метода секвенирования нуклеотидных последовательностей гена 16S рРНК были отнесены к родам Pseudomonas, Stenotrophomonas, Serratia, Chryseobacterium. Физиологическое разнообразие гидролитического бактериального блока у вересковых растений было существенно больше, чем у мхов. Анализ таксономической принадлежности и функциональности выделенных бактерий позволяет прогнозировать их способность стимулировать рост растений.
Микробные сообщества верховых торфяников изучаются как отечественными, так и зарубежными исследователями в течение многих десятилетий (Головченко и соавт., 2005; Панкратов и соавт., 2005; Куличевская и соавт., 2007; Дорошенко и соавт., 2007; Opelt et al., 2007; Bragina et al., 2012; Добровольская и соавт., 2013, 2018). При этом исследуются бактерии, обитающие в торфяной толще, но не на болотных растениях. К типичным растениям верховых болот, называемых сфагнофилами, относят ряд растений семейства Вересковых (Ericaceae). Среди представителей этого семейства хозяйственное значение имеют виды рода Vaccinium со съедобными плодами: брусника, голубика, клюква и черника. Традиционное использование вересковых связано, преимущественно, с лекарственными свойствами некоторых видов.
Что касается микробиологического анализа разных органов вересковых растений, то такие работы единичны. Так, из корней голубики выделены эндофитные бактерии Serratia marcescens, обладающие антагонистической активностью по отношению к 11 видам фитопатогенных грибов (Dake et al., 2007). Из ризосферы клюквы были выделены актинобактерии рода Streptomyces, которые так же обладали фунгицидным действием (Mason et al., 2014). На стеблях и корнях клюквы были обнаружены метанотрофы, представленные родами Methylosinus и Mehtylomonas (Stepniewska et al., 2017). В ризосфере голубики в качестве доминирующих филумов были выявлены альфапротеобактерии и ацидобактерии (Yurgel et al., 2018). Однако отсутствуют данные о структурно-функциональной организации бактериальных сообществ болотных растений из семейства вересковых с учетом видов растений и вегетативных органов.
Целью настоящей работы было определить численность, таксономическую структуру и физиологическое разнообразие гетеротрофных бактериальных комплексов шести видов вересковых растений.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на постоянной экспериментальной площадке Западнодвинского лесоболотного стационара Института лесоведения РАН в Тверской области (Вомперский и соавт., 1988). Анализируемый торфяник под сосняком кустарничково-пушицево-сфагновым – часть классического олиготрофного болотного массива “Сосвятское”. В июне 2017 года были отобраны образцы 6 растений из семейства вересковых: подбела обыкновенного (Andromeda polifolia L.), багульника болотного (Ledum palustre L.), голубики обыкновенной (Vaccinium uliginosum L.), черники миртолистной (Vaccinium myrtillus L.), брусники обыкновенной (Vaccinium vitis-idaea L.), клюквы обыкновенной (Vaccinium oxycoccus L.), а также 3 вида сфагнума: бурого (Sphagnum fuscum (Schimp.) H. Klinggr), магелланского (Sphagnum magellanicum Bird.) и обманчивого (Sphagnum fallax H. Klinggr).
Отбор образцов. Растения (5–10 экземпляров каждого) отбирали в четырех точках, удаленных друг от друга на расстоянии 50–100 м. Растения извлекали из торфяного массива вручную, с использованием cтерильных перчаток, затем помещали в стерильные пластиковые пакеты, которые в тот же день в охлажденном виде доставляли в лабораторию для дальнейших исследований. Анализировали вегетативные органы растений: листья, стебли, корни. Для каждого органа нескольких растений одного вида готовили средний образец.
Общую численность бактерий определяли методом прямого подсчета с использованием люминесцентной микроскопии (Методы почвенной микробиологии и биохимии, 1991). Клетки бактерий десорбировали с применением ультразвукового диспергатора Sonopuls HD 2070 (“Bandelin Electronic”, Германия) в течение 2 мин при мощности 50%. Для исследования микрофлоры поверхности корней растений (ризопланы), использовали предварительно отмытые корни. Каждый образец просматривали в 6 повторностях. Препараты окрашивали раствором акридина оранжевого (1 : 10 000) и просматривали в люминесцентном микроскопе ЛЮМАМ-ИЗ (Россия) (светофильтры ЖС-19, ЖС-18, объектив ×90 Л, окуляры ×4 или ×5).
Количество клеток бактерий, содержащихся в 1 г свежего образца, вычисляли по формуле: N = = S1 × a × n/v × S2 × c, где: N – число клеток бактерий в 1 г свежего образца; S1 – площадь препарата (мкм2); а – среднее число бактерий в поле зрения; n – показатель разведения суспензии (мл); v – объем капли, наносимой на стекло (мл); S2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Численность и таксономический состав гетеротрофных сапротрофных бактерий. Численность бактерий определяли методом посева образцов в 5-кратной повторности на агаризованную глюкозо-пептонно-дрожжевую среду (ГПД). Для ингибирования роста грибов в среду (0.5 л) добавляли нистатин (50 мг). Посевы инкубировали при комнатной температуре в течение 2–3 нед. Численность бактерий выражали в колониеобразующих единицах (КОЕ) на 1 г образца. Основных представителей бактерий выделяли в чистые культуры.
Идентификацию доминирующих штаммов до рода осуществляли на основании молекулярно-биологических, морфологических, культуральных и хемотаксономических признаков (Определитель бактерий Берджи, 1997; Manucharova et al., 2008; Добровольская и соавт., 2010). К доминирующим относили бактерии, колонии которых составляли более 30% от общего числа колоний на чашке (Добровольская и соавт., 2010). Для экстрагирования ДНК из клеток чистых культур микроорганизмов применяли стандартные методы PowerSoil DNA Isolation Kit (“Mo Bio”, США), руководствуясь инструкциями производителя. Полимеразную цепную реакцию и дальнейшее секвенирование ПЦР-фрагментов гена 16S rRNA проводили с использованием системы универсальных праймеров (Edwards et al., 1989; Manucharova et al., 2008). С целью предварительного филогенетического анализа полученных нуклеотидных последовательностей генов 16S rRNA использовали программное обеспечение баз данных GenBank (http://www.ncbi.nlm.nih.gov/blast). Анализ и выравнивание последовательностей проводили с помощью программы BioEdit (http://jwbrown.mbio.ncsu.edu/BioEdit/bioedit.html). Построение дендрограмм осуществляли с помощью алгоритма neighbor-joining (NJ) в программе MEGA 4. Статистическую достоверность филогенетических реконструкций оценивали методом “Bootstrap” путем построения 1000 альтернативных деревьев (Thompson et al., 1994).
Физиологическое разнообразие и трофическую специализацию гидролитического бактериального блока определяли комплексным структурно-функциональным методом (Якушев, 2015). Изучали ассоциации микроорганизмов, развивающиеся в жидких питательных средах с биополимерами при их инокулировании смывами с поверхности растений. О сукцессионных изменениях в инициированных к росту сообществах судили по кинетическому параметру, коэффициенту экономической эффективности (Y). Для ингибирования роста грибов в среду вносили нистатин (200 мг/л) и циклогексимид (60 мг/л). В качестве единственного источника углерода использовали коммерческие препараты полимеров: кератин молотый “Sigma-Aldrich”, хитин ракообразных “OligoTech”, целлюлозу порошковую (0.1–0.25 мкм) “Союзреактив”, пектин лимонный “ICN Biomedicals Inc.”, крахмал растворимый “ЛенРеактив”, ксилан березовый “Sigma-Aldrich”, инулин из цикория “Sigma-Aldrich”, декстран T-500 хроматографический “Loba Chemie”, агарозу легкоплавкую “SERVA” (как трудно разлагаемый биополимер), твин 20 “Ferak Berlin” (как водорастворимый аналог жиров), казеин по Гамерстену “Merck” (аналог легко разлагаемого белка), ДНК “Sigma-Aldrich”.
Физиологическое разнообразие гидролитического бактериального блока оценивали по эмпирически выведенному методом главных компонент параметру – среднеарифметическому экономическому коэффициенту ($\bar {Y}$) инициированных микробных сообществ, сформировавшихся на 12 средах с полимерами. Экономический коэффициент конкретного инициированного сообщества $Y = \frac{{{{x}_{m}} - {{x}_{0}}}}{{{{s}_{0}}}},$ где s0 – исходная концентрация полимера (2.5 г/л); xm – максимальная концентрация клеток, достигаемая в питательной среде, x0 – исходная концентрация микроорганизмов в инокулированной культуре.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При оценке структурно-функциональной организации бактериальных сообществ растений из семейства вересковых и мхов численность бактерий, установленная прямым счетом, варьировала от 1 × 109 до 3.4 × 109 кл./г в зависимости от вида и органа растений (табл. 1), и для листьев, и для стеблей кустарничков она характеризовалась близкими значениями. Максимальная численность бактерий (2.5 × 109 кл./г) была выявлена в филлосфере брусники. Поверхность корней (ризоплана) большинства из анализируемых растений была заселена бактериями обильнее, чем поверхность надземных частей растений: пределы колебаний численности бактерий в ризоплане составили 1.5–3.4 × 109 кл./г. Численность бактерий достигала максимальных величин на корнях багульника и клюквы, минимальных – на корнях подбела. Факторный дисперсионный анализ показал, что численность бактерий достоверно различалась как для органов растений (критерий Фишера (F) = 199 при p < 0.001), так и для видов растений (F = 179, при p < 0.001). Численность бактерий на вересковых растениях была одного порядка, что и на сфагновых мхах (табл. 1).
Таблица 1.
Численность бактерий на вегетативных органах вересковых растений и мхов, установленная методом посева
| Растение | Вегетативный орган | Численность бактерий | |
|---|---|---|---|
| прямой метод 109 клеток/г |
метод посева 105 КОЕ/г |
||
| Подбел обыкновенный (Andromeda polifolia L.) |
Листья | 2.0 ± 0.3 | 10.4 ± 0.3 |
| Стебли | 2.1 ± 0.1 | 13.3 ± 3.1 | |
| Корни | 1.5 ± 0.1 | 9.7 ± 1.8 | |
| Багульник болотный (Ledum palustre L.) |
Листья | 1.4 ± 0.1 | 9.2 ± 1.8 |
| Стебли | 2.0 ± 0.3 | 11.4 ± 2.1 | |
| Корни | 3.0 ± 0.2 | 10.3 ± 1.7 | |
| Черника миртолистная (Vaccinium myrtillus L.) |
Листья | 2.5 ± 0.2 | 75.0 ± 7.2 |
| Стебли | 1.9 ± 0.2 | 12.0 ± 1.9 | |
| Корни | 2.6 ± 0.1 | 12.0 ± 2.3 | |
| Брусника обыкновенная (Vaccinium vitis-idaea L.) |
Листья | 2.5 ± 0.1 | 142.0 ± 12.2 |
| Стебли | 2.5 ± 0.1 | 122.0 ± 10.5 | |
| Корни | 2.7 ± 0.1 | 13.0 ± 2.1 | |
| Клюква обыкновенная (Vaccinium oxycoccus L.) |
Листья | 2.3 ± 0.3 | 115.0 ± 15.3 |
| Стебли | 1.8 ± 0.05 | 13.3 ± 1.3 | |
| Корни | 3.4 ± 0.1 | 4.7 ± 0.7 | |
| Голубика обыкновенная (Vaccinium uliginosum L.) |
Листья | 1.1 ± 0.1 | 7.4 ± 1.8 |
| Стебли | 1.7 ± 0.2 | 14.3 ± 2.2 | |
| Корни | 2.3 ± 0.1 | 1.7 ± 0.2 | |
| Сфагнум бурый (Sphagnum fuscum (Schimp.) H. Klinggr) |
Листья, стебли | 1.5 ± 0.07 | 0.3 ± 0.04 |
| Ризоиды | 2.5 ± 0.1 | 0.7 ± 0.02 | |
| Сфагнум магелланский (Sphagnum magellanicum Bird.) |
Листья, стебли | 1.5 ± 0.07 | 0.5 ± 0.03 |
| Ризоиды | 2.2 ± 0.07 | 0.7 ± 0.04 | |
| Сфагнум обманчивый (Sphagnum fallax H. Klinggr) |
Листья, стебли | 2.0 ± 0.1 | 1.8 ± 0.2 |
| Ризоиды | 2.4 ± 0.07 | 2.1 ± 0.3 | |
Численность бактерий эпифитно-сапротрофного комплекса, определенная методом посевов, варьировала для исследуемых образцов в широком диапазоне – от 1 × 105 до 1.42 × 107 КОЕ/г (табл. 1). Максимальные значения были характерны для филлосферы брусники – (122–142) × × 105 КОЕ/г, что коррелировало с результатами, полученными методом прямого подсчета. В ризоплане подбела и багульника численность бактерий была сравнима с таковой в их филлосфере и была значительно меньше у черники, клюквы, голубики, брусники. Отметим, что численность бактерий эпифитно-сапротрофного комплекса на вересковых растениях была на 1–2 порядка больше, чем на сфагновых мхах (табл. 1).
Анализ таксономической структуры бактериальных комплексов вересковых растений выявил монодоминирование грамотрицательных бактерий, которые были идентифицированы до вида на основании метода 16S рРНК. Установлено, что на всех вегетативных органах исследуемых растений, кроме черники, доминировали бактерии рода Stenotrophomonas, представленные видом Stenotrophomonas rhizophila (табл. 2, рис. 1). В бактериальных сообществах черники доминирующими оказались бактерии Pseudomonas koreensis, а бактерии рода Stenotrophomonas были минорными компонентами. В качестве второго доминанта на багульнике выявились представители вида Pseudomonas viridiflava, на подбеле – бактерии видов Chryseobacterium soli и Ch. polytichastri, на голубике – факультативно анаэробные бактерии видов Serratia grimesii и S. proteamaculans (табл. 2). Следует отметить, что идентифицированные доминирующие бактерии принадлежат классу γ-Proteobacteria, кроме рода Chryseobacterium, относящегося к классу Flavobacteria (табл. 3).
Таблица 2.
Доминирующие таксоны культивируемых бактериальных сообществ вересковых растений
| Растение | Роды и виды бактерий | % сходства |
|---|---|---|
| Подбел обыкновенный | Stenotrophomonas rhizophila Chryseobacterium soli Chryseobacterium polytichastri |
100 97–99 98–99 |
| Багульник болотный | Stenotrophomonas rhizophila Pseudomonas viridiflava |
100 99–100 |
| Черника миртолистная | Pseudomonas koreensis | 99–100 |
| Брусника обыкновенная Клюква обыкновенная |
Stenotrophomonas rhizophila | 100 |
| Голубика обыкновенная | Stenotrophomonas rhizophila Serratia grimesii, Serratia proteamaculans |
100 99–100 99–100 |
Рис. 1.
Филогенетическое положение доминирующих родов в бактериальных комплексах вересковых растений, культивируемых на селективных средах. Масштаб показывает эволюционное расстояние, соответствующее 2 нуклеотидным заменам на каждые 10 000 нуклеотидов.
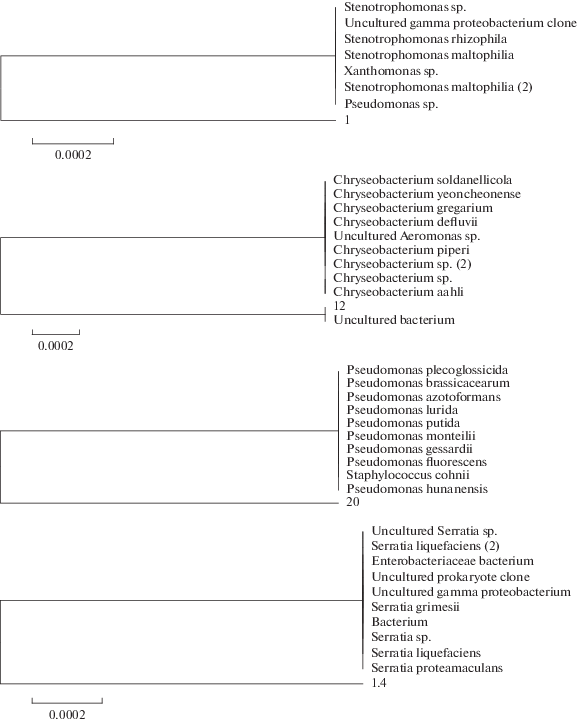
Таблица 3.
Таксономическое положение доминирующих в культивируемых бактериальных сообществах вересковых растений родов
| Название рода | Семейство | Порядок | Класс |
|---|---|---|---|
| Pseudomonas | Pseudomonadaceae | Pseudomonadales | γ-Proteobacteria |
| Stenotrophomonas | Xanthomonadaceae | Xanthomonadales | |
| Serratia | Enterobacteriaceae | Enterobacteriales | |
| Chryseobacterium | Flavobacteriaceae | Flavobacteriales | Flavobacteria |
На сфагновых мхах, растущих рядом, были обнаружены представители тех же таксонов бактерий, что и на вересковых растениях – Pseudomonas sp., Stenotrophomonas rhizophila и Chryseobacterium soli.
При сравнении спектра бактериальных таксонов экзофитов со спектром бактерий, обнаруженных на сфагновых мхах в качестве эндофитов (Щербаков и соавт., 2013), отмечены определенные различия. В эндофитных гетеротрофных бактериальных сообществах сфагновых мхов преобладали представители родов Pseudomonas, Serratia, Burkholderia, Flavobacterium, Collimonas, Stenotrophomonas (жирным шрифтом выделены общие роды).
Теперь дадим краткую характеристику тем родам бактерий, которые доминировали на вересковых растениях и сфагновых мхах. Известно, что бактерии рода Stenotrophomonas (ранее Xanthomonas) выявляются из самых разных местообитаний, в том числе из клинического материала. Бактерии вида Stenotrophomonas rhizophila были изолированы из ризосферы картофеля и описаны как новый вид (Wolf et al., 2002). Было показано, что они способны стимулировать рост растений и подавлять рост фитопатогенных грибов. Отметим, что эти бактерии, как и представители других видов рода Stenotrophomonas, могут использоваться для биоремедиации почв, благодаря их способности деградировать ксенобиотики (Binks et al., 1995). Род Chryseobacterium – результат переклассификации 5 видов рода Flavobacterium (Vandamme et аl., 1994). Обнаруженный в качестве доминанта на подбеле, вид Chryseobacterium soli был ранее изолирован из почвы и описан корейскими исследователями (Weon et al., 2008).
Бактерии рода Serratia относятся к семейству Enterobacteriaceae, некоторые из них являются условно патогенными бактериями. В то же время многие представители рода Serratia способны стимулировать рост растений, обладают антагонизмом по отношению к фитопатогенным грибам и могут уничтожать их за счет высокой хитиназной активности. Такие же свойства присущи видам Serratia grimesii и S. proteamaculans (Grimont et al., 1981; Madhuprakash et al., 2013), которые, как показано в настоящем исследовании, обитают на голубике.
Бактерии вида Pseudomonas viridiflava, изолированные нами как экзофит багульника, были описаны как новый вид рода Pseudomonas в 1966 г. (Lelliot et al., 1966). Позже было установлено, что бактерии этого вида способны к образованию экомицинов – веществ, обладающих высокой антагонистической активностью по отношению к широкому спектру патогенных грибов (Miller et al., 1998). Бактерии вида Pseudomonas koreensis (изолированные из черники) были впервые выделены из сельскохозяйственных почв Кореи и описаны как новый вид (Kwon et al., 2003).
Использование метода комплексного структурно-функционального анализа позволило установить, что бактерии, обитающие на всех исследуемых растениях, способны расти на разных полимерах. Следует отметить, что число потребляемых субстратов не является информативным параметром в отличие от коэффициентов $\overline Y $ и Yразн. Высокие значения Y свидетельствуют о высокой продуктивности сообщества и об эффективном усваивании того или иного полимера, низкие значения Y – о неподходящих условиях культивирования.
Методом главных компонент эмпирически выведен параметр Yразн – разность средних Y на средах с труднодоступными для потребления бактериями (хитин, целлюлоза, агароза, кератин) и легкодоступными (декстран, инулин, пектин, ксилан, крахмал, твин 20, казеин) полимерами. Определенный на среде с ДНК Y в расчете Yразн не используется. Поскольку в трофической классификации микроорганизмов “гидролитики” – деструкторы труднодоступных полимеров, а “копиотрофы” – деструкторы легкодоступных, то Yразн отражает трофическую специализацию гидролитического блока.
Величина показателя $\bar {Y},$ характеризующего физиологическое разнообразие гидролитического бактериального блока филлосферы, была существенно выше у вересковых растений, чем у мхов, растущих рядом (Sphagnum magellanicum Bird. и Polytrichum strictum Brid.). Физиологическое разнообразие бактерий на листьях багульника оказалось ниже, чем на других вересковых, по-видимому, из-за экссудации листьями этого кустарничка бактерицидного эфирного масла ледола. Наиболее физиологически разнообразным оказалось гидролитическое сообщество филлосферы голубики. Что касается других видов вересковых растений, то на основании величин показателя $\bar {Y},$ можно констатировать, что они занимают промежуточное положение между голубикой и багульником (рис. 2).
Рис. 2.
Физиологическое разнообразие ($\bar {Y}$) и трофическая специализация (Yразн) гидролитического бактериального блока. Корреляционные эллипсы приведены для p = 0.95. Мхи: 1 – Sphagnum fuscum, 2 – Sphagnum fallax, 3 – Polytrichum strictum; вересковые кустарнички: 4 – багульник, 5 – голубика, 6 – клюква, 7 – подбел, 8 – черника 9 – брусника; 10 – верховой торф горизонт T1, 11 – низинный торф горизонт T1.
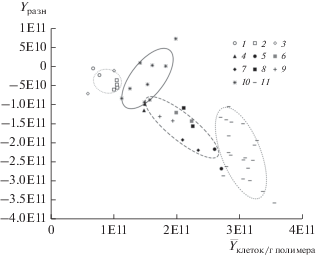
Показатель Yразн, характеризующий трофическую специализацию гидролитического бактериального блока, оказался ниже у подбела и голубики (рис. 2). Очевидно, у этих растений выше физиологическое разнообразие в блоке деструкторов легкодоступных полимеров. По сравнению с вересковыми, у мхов обнаружен олиготрофный и слабо специализированный характер бактериального блока из-за небольшого уровня выделения экссудатов листьями.
Таким образом, общая численность бактерий на вегетативных органах вересковых растений составляет миллиарды клеток на 1 г субстрата и сопоставима с таковой на сфагновых мхах. Численность эпифитно-сапротрофного комплекса бактерий достигала максимальных величин в филлосфере вересковых растений и была на 1–2 порядка выше, чем на сфагновых мхах. Анализ таксономического состава доминирующих на разных органах вересковых растений бактерий выявил их принадлежность к классам γ-Proteobacteria и Flavobacteria. На исследуемых растениях (кроме голубики) доминировали представители вида Stenotrophomonas rhizophila. В качестве второго доминанта на разных растениях были обнаружены представители родов Pseudomonas, Serratia, Chryseobacterium. В бактериальных спектрах вересковых растений и сфагновых мхов, растущих рядом, были обнаружены общие таксоны.
Обзор литературы по таксономии и экологии бактерий, выделенных из растений семейства вересковых, позволил обратить внимание на уникальные функции этих бактерий, связанные как с их антагонистическими свойствами по отношению к фитопатогенным грибам, так и с образованием ими веществ, стимулирующих рост растений. Аналогичные функции были описаны для эндофитных бактерий сфагновых мхов (Щербаков и соавт., 2013). Физиологическое разнообразие гидролитического бактериального блока оказалось существенно выше у вересковых растений, чем у сфагновых мхов. Следует отметить еще одну особенность, свойственную изолированным из растений бактериям – способность расти при низких температурах (4°С) и значениях pH (5), т.е. условиях, характерных для верховых болот. Таким образом, вересковые кустарнички, наряду со сфагновыми мхами, являются источниками бактерий, которые поддерживают жизнестойкость этих растений. Кроме того, чистые культуры этих бактерий могут быть использованы в практических целях – в борьбе с фитопатогенными грибами и для стимулирования роста сельскохозяйственных растений.
Список литературы
Вомперский С.Э., Сирин А.А., Глухов А.И. Формирование и режим стока при гидролесомелиорации. М.: Наука, 1988. 168 с.
Головченко А.В., Санникова Ю.В., Добровольская Т.Г., Звягинцев Д.Г. Сапротрофный бактериальный комплекс верховых торфяников Западной Сибири // Микробиология. 2005. Т. 74. № 4. С. 545–551.
Golovchenko A.V., Sannikova Iu.V., Dobrovolskaia T.G., Zviagintsev D.G. The saprotrophic bacterial complex in the raised peat bogs of Western Siberia // Microbiology (Moscow). 2005. V. 74. P. 471–476.
Добровольская Т.Г., Головченко А.В., Звягинцев Д.Г., Инишева Л.И., Кураков А.В., Смагин А.В., Зенова Г.М., Лысак Л.В., Семенова Т.А., Степанов А.Л., Глушакова А.М., Початкова Т.Н., Кухаренко О.С., Качалкин А.В., Якушев А.В., Поздняков Л.А., Богданова О.Ю. Функционирование микробных комплексов верховых торфяников – анализ причин медленной деструкции торфа. М.: Товарищество научных изданий КМК, 2013. 128 с.
Добровольская Т.Г., Головченко А.В., Лысак Л.В. Бактериальные сообщества верховых торфяников // Материалы Всероссийской X школы молодых ученых с международным участием “Болота и биосфера”. Тверь: ООО “Наукоемкие технологии”, 2018. С. 31–37.
Добровольская Т.Г., Головченко А.В., Лысак Л.В., Зенова Г.М. Физикохимия и биология торфа. Методы оценки численности и разнообразия бактериальных и актиномицетных комплексов торфяных почв: учебное пособие. Томск: Изд-во ТГПУ, 2010. 100 с.
Дорошенко Е.В., Булыгина Е.С., Спиридонова Е.М., Турова Т.П., Кравченко И.К. Выделение и характеристика азотфиксирующих бактерий рода Azospirillum из почвы сфагнового болота // Микробиология. 2007. Т. 76. № 1. С. 107–115.
Doroshenko E.V., Bulygina E.S., Spiridonova E.M., Turova T.P., Kravchenko I.K. Isolation and characterization of nitrogen-fixing bacteria of the genus Azospirillum from the soil of a Sphagnum peat bog // Microbiology (Moscow). 2007. V. 76. P. 93–101.
Куличевская И.С., Белова С.Э., Кевбрин В.В., Дедыш С.Н., Заварзин Г.А. Анализ бактериального сообщества, развивающегося при разложении сфагнума // Микробиология. 2007. Т. 76. № 5. С. 702–710.
Kulichevskaya I.S., Belova S.E., Kevbrin V.V., Dedysh S.N., Zavarzin G.A. Analysis of the bacterial community developing in the course of Sphagnum moss decomposition // Microbiology (Moscow). 2007. V. 76. P. 621–629.
Методы почвенной биохимии и микробиологии. М.: Изд-во Московского ун-та, 1991. 304 с.
Определитель бактерий Берджи. М.: Мир, 1997. Т. 1, 2. 800 с.
Панкратов Т.А., Белова С.Э., Дедыш С.Н. Оценка филогенетического разнообразия прокариотных микроорганизмов в сфагновых болотах с использованием метода FISH // Микробиология. 2005. Т. 74. № 6. С. 831–837.
Pankratov T.A., Belova S.E., Dedysh S.N. Evaluation of the phylogenetic diversity of prokaryotic microorganisms in Sphagnum peat bogs by means of Fluorescence In Situ Hybridization (FISH) // Microbiology (Moscow). 2005. V. 74. P. 722–728.
Щербаков А.В., Брагина А.В., Кузьмина Е.Ю., Берг К., Мунтян А.Н., Макарова Н.М., Мальфанова Н.В., Кардинале М., Берг Г., Чеботарь В.К., Тихонович И.А. Эндофитные бактерии сфагновых мхов как перспективные объекты сельскохозяйственной микробиологии // Микробиология. 2013. Т. 82. № 3. С. 312–322.
Shcherbakov A.V., Bragina A.V., Kuzmina E.Yu., Berg Christian, Muntyan A.N., Makarova N.M., Malfanova N.V., Cardinale Massimiliano, Berg Gabriela, Chebota V.K., Tikhonovich I.A. Endophytic bacteria of Sphagnum mosses as promising objects of agricultural microbiology // Microbiology (Moscow). 2013. V. 82. P. 306–315.
Якушев А.В. Комплексный структурно-функциональный метод характеристики микробных популяций // Почвоведение. 2015. Т. 48. № 4. С. 429–446.
Yakushev A.V. Integral structural-functional method for characterizing microbial populations // Euras. Soil Sci. 2015. V. 48. P. 378–394.
Binks P.R., Nicklin S., Bruce N.C. Degradation of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) by Stenotrophomonas maltophilia PB1 // Appl. Environ. Microbiol. 1995. V. 61. P. 1318–1322.
Bragina A., Berg C., Cardinale M., Shcherbakov A., Chebotar V., Berg G. Sphagnum mosses harbour highly specific bacterial diversity during their whole lifecycle // ISME J. 2012. V. 6. P. 802–813.
Dake X.U., Xiuying XI.A, Na X.U., Lijia A.N. Isolation and identification of a novel endophytic bacterial strain with antifungal activity from the wild blueberry Vaccinium uliginosum // Ann. Microbiol. 2007. V. 57. P. 673–676.
Grimont P., Grimont F. The genus Serratia. The Prokaryotes: A Handbook on Habitats, Isolation, and Identification of Bacteria. Berlin: Springer-Verlag Berlin, 1981. P. 1187–1203.
Kwon S.W., Kim J.S., Park I.C., Yoon S.H., Park D.H., Lim C.K., Go S.J. Pseudomonas koreensis sp. nov., Pseudomonas umsongensis sp. nov. and Pseudomonas jinjuensis sp. nov., novel species from farm soils in Korea // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 21–27.
Lelliott R.A., Billing E., Hayward A.C. A determinative scheme for fluorescent plant pathogenic bacteria // J. Appl. Bacteriol. 1966. V. 29. P. 470–478.
Madhuprakash J., Singh A., Kumar S., Sinha M., Kaur P., Sharma S., Podile A.R., Singh T.P. Structure of chitinase D from Serratia proteamaculans reveals the structural basis of its dual action of hydrolysis and transglycosylation // Int. J. Biochem. Mol. Biol. 2013. V. 4. P. 166.
Manucharova N.A., Vlasenko A.N., Tourova T.P., Panteleeva A.N., Stepanov A.L., Zenova G.M. Thermophilic chitinolytic microorganisms of brown semidesert soil // Microbiology (Moscow). 2008. V. 77. P. 610–615.
Mason C.J., Zeldin E.L., Currie C.R., Raffa K.F., McCown B.H. Populations of uncultivated American cranberry in sphagnum bog communities harbor novel assemblages of Actinobacteria with antifungal properties // Botany. 2014. V. 92. P. 589–595.
Miller C.M., Miller R.V., Garton-Kenny D., Redgrave B., Sears J., Condron M.M., Teplow D.B., Strobel G.A. Ecomycins, unique antimycotics from Pseudomonas viridiflava // J. Appl. Microbiol. 1998. V. 84. P. 937–944.
Opelt K., Chobot V., Hadacek F., Schonmann S., Eberl L., Berg G. Investigations of the structure and function of bacterial communities associated with Sphagnum mosses // Environ. Microbiol. 2007. V. 9. P. 2795–2809.
Stępniewska Z., Goraj W., Kuźniar A., Łopacka N., Małysza M. Enrichment culture and identification of endophytic methanotrophs isolated from peatland plants // Folia Microbiol. 2017. V. 62. P. 381–391.
Vandamme P., Bernardet J.F., Segers P., Kerssters K., Holmes B. New perspectives in the classification of the Flavobacteria: Description of Chryseobacterium gen. nov., Bergeyella gen. nov. and Empedobacter norn. rev. // Int. J. Syst. Bacteriol. 1994. V. 44. P. 827–831.
Weon H.Y., Kim S.H., Kwon S.W., Stackebrandt E., Go S.J. Chryseobacterium soli sp. nov. and Chryseobacterium jejuense sp. nov., isolated from soil samples from Jeju, Korea // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 470–473.
Wolf A., Fritze A., Hagemann M., Berg G. Stenotrophomonas rhizophila sp. nov., a novel plant-associated bacterium with antifungal properties // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 1937–1944.
Yurgel S.N., Douglas G.M., Dusault A., Percival D., Langille M.G.I. Dissection community structure in wild blueberry root and soil // Front. Microbiol. 2018. V. 9. Art. 1187. P. 1–14.
Дополнительные материалы отсутствуют.


