Микробиология, 2019, T. 88, № 5, стр. 619-623
Выделение новых термофильных сульфидогенов из микробных обрастаний, ассоциированных с местом излива подземных вод в Тункинской долине
А. П. Лукина a, Ю. А. Франк a, *, Д. А. Ивасенко a, Л. Б. Глухова a, Э. В. Данилова b, М. Р. Авакян a, О. В. Карначук a
a Лаборатория биохимии и молекулярной биологии, Томский государственный университет
634050 Томск, Россия
b Лаборатория микробиологии, Институт общей и экспериментальной биологии СО РАН
670047 Улан-Удэ, Россия
* E-mail: yulia.a.frank@gmail.com
Поступила в редакцию 11.03.2019
После доработки 29.04.2019
Принята к публикации 29.05.2019
Спорообразующие сульфатредуцирующие бактерии, до недавнего времени объединяемые в род Desulfotomaculum, являются типичными обитателями подземных термальных биотопов (Aüllo et al., 2013; Frank et al., 2016). Образование спор, способность к автотрофии и устойчивость к высоким температурам позволяет этой группе успешно колонизовать глубинные воды. В 2018 году была проведена ревизия Desulfotomaculum, в результате которой выделены четыре новых рода Desulfallas, Desulfofundulus, Desulfofarcimen и Desulfohalotomaculum (Watanabe et al., 2018).
Самоизливающиеся нефтепоисковые скважины дают хорошую возможность получить доступ к воде из термальных горизонтов, расположенных на глубине нескольких километров. Кроме того, артезианская вода, поступающая под давлением из скважины, исключает возможность загрязнения поверхностными микроорганизмами. К настоящему времени основным источником информации о микроорганизмах, населяющих подземные воды, являются молекулярные методы, основанные на высокопроизводительном секвенировании. Культивирование многих организмов, чье присутствие зафиксировано молекулярными подписями, не приводило к успеху (Labonté et al., 2015). В наших попытках усовершенствовать подходы к культивированию представителей подземной биосферы мы обратили внимание на микробные обрастания, которые часто формируются в местах излива подземных скважин. Некоторые термофилы, поступающие из глубинных горизонтов, могут накапливаться в микробных матах, где сохраняется повышенная температура и появляется доступ к органическим соединениям, образуемым фототрофами. Хорошим примером служит получение чистой культуры Melioribacter roseus, выделенного из микробного обрастания в месте излива термальной нефтепоисковой скважины, что в конечном итоге привело к описанию нового филума (Podosokorskaya et al., 2013).
Целью настоящего исследования было выделение термофильных сульфидогенных микроорганизмов из микробных матов, образующихся на изливе термального источника в поселке Жемчуг Тункинского района республики Бурятия.
Нефтепоисковая скважина глубиной около 1 км была пробурена в 50-х годах ХХ в. В настоящее время термальная вода поступает с горизонта 834–864 м и используется для лечебных целей. Термальная вода содержит сероводород, являющийся бальнеологическим компонентом, поэтому культивирование было направлено на выделение сульфатвосстанавливающих микроорганизмов.
Физико-химические параметры термальной воды, рН, температуру и окислительно-восстановительный потенциал, измеряли на изливе скважины рН-метром HI83141 (“Hanna Instruments”). Концентрацию сероводорода измеряли из проб, зафиксированных ацетатом цинка, спектрофотометрически, а элементный состав воды – масс-спектрометрией с индуктивно-связанной плазмой как описано ранее (Karnachuk et al., 2008, Mardanov et al., 2016). Для получения накопительных культур сульфидогенов была использована пресноводная среда Видделя-Бака (WB) с добавлением растворов микроэлементов, витаминов, смеси селената и вольфрамата, и восстановленная раствором сульфида натрия (Widdel, Bak, 1992). В качестве доноров электронов и источников углерода использовали 7.5 мМ формиат, 9 мМ ацетат, 7.3 мМ лактат, 13.5 мМ пропионат, 7 мМ изобутират, а также пептон, желатин (каждый в концентрации 1%) и целлюлозу (100 мг на флакон объемом 12 мл). Во флаконы со средой помещали небольшое количество матов, после чего инкубировали при температуре 50°С. Филогенетическое положение изолятов определяли по последовательности гена 16S рРНК после амплификации с праймерами 27F-1492R. Выделение ДНК и условия амплификации описаны ранее (Frank et al., 2016). Номера доступа гена 16S рРНК в GenBank NCBI – MK802128 и MK788234.
В момент отбора проб микробных матов температура воды составляла 54.8°С, рН 6.75, низкий окислительно-восстановительный потенциал, –238 mV, свидетельствовал о восстановленных условиях (табл. 1). Вода имела выраженный запах сероводорода, концентрация которого составляла 0.93 мг/л.
Таблица 1.
Физико-химические параметры воды сква- жины Г-1
| Параметры | Значения |
|---|---|
| pH | 6.75 |
| Температура, °C | 54.8 |
| Eh, mV | –238 |
| Содержание в воде, мг/л: | |
| Na | 985 |
| Mg | 184 |
| Ca | 168 |
| Si | 100 |
| K | 39.5 |
| Sr | 6.17 |
| B | 4.70 |
| Li | 2.98 |
| Fe | 0.87 |
| Ba | 0.22 |
| Se | 0.20 |
| P | 0.099 |
| Rb | 0.095 |
| Mn | 0.087 |
| Sc | 0.037 |
| Al | 0.024 |
| Ge | 0.019 |
| Zn | 0.012 |
| Cr | 0.009 |
| As | 0.004 |
| ${\text{SO}}_{4}^{{2 - }}$ | <10 |
| H2S | 0.93 ± 0.37 |
Были получены накопительные культуры, активно продуцирующие сероводород на среде с изобутиратом и ацетатом. Выделение чистых культур проводили путем последовательных десятикратных разведений. Наблюдение накопительных культур под микроскопом показало присутствие клеток со спорами. Для их выделения культуры выдерживали при температуре 95°С в течение 15 мин. После чего получали отдельные колонии на твердой среде с добавлением изобутирата и ацетата в качестве источников углерода и электронов. Чистоту выделенных культур спорообразующих сульфидогенов подтвердило отсутствие роста на Plate Count Agar и Anaerobic Agar, а также определение последовательности гена 16S рРНК. Изолят, выделенный на среде с изобутиратом, был обозначен как штамм Bu 1-1, а на среде с ацетатом – BuA. Филогенетический анализ показал, что представители рода Desulfallas являются ближайшими родственниками штамма Bu 1-1, однако все они значительно удалены (рис. 1). Сходство последовательностей гена 16S рРНК, рассчитанное с помощью EzTaxon (Chun et al., 2007) на платформе BIOiPLUG, составляло: 92.77% с Desulfallas alcoholivorax, 92.57% – с Desulfallas sapomandens, 92.43% – c Desulfallas geothermicus, 91.53% – c Desulfallas artcticus, 91.27% – c Desulfallas thermosapovorans. Штамм Bu 1-1, вероятно, является представителем нового рода, так как сходство последовательности гена 16S рРНК значительно ниже порога 98.7%, определяемого для различных видов (Chun et al., 2018). Ближайшим родственником штамма BuA является Desulfotomaculum putei со сходством последовательностей 99.85% (рис. 1). Вероятно, штамм BuA является новым штаммом D. putei. Для штамма Bu 1-1 были определены возможные доноры электронов, которые включали: формиат, ацетат, лактат, пируват, малат, сукцинат, изобутират, пальмитат, фруктозу, сахарозу, глюкозу, этанол, пептон и желатин. Наряду с сульфатом, штамм Bu 1-1 может использовать в качестве акцептора электронов сульфит, тиосульфат, нитрат, арсенат и фумарат. Штамм не восстанавливает элементную серу и нитрит.
Рис. 1.
Дерево, показывающее филогенетическое положение изолятов Bu 1-1 и BuA на основе анализа последовательностей гена 16S рРНК, определенное методом RAxML (randomized axelerated maximum likelihood, Stamatakis, 2014). Бустрепы расчитаны из 1000 итераций. Масштаб соответствует 5 нуклеотидным заменам на каждые 100 нуклеотидов. В качестве удаленного родственника использован Thermodesulfovibrio yellowstonii DSM 11347 (на дендрограмме не показан).
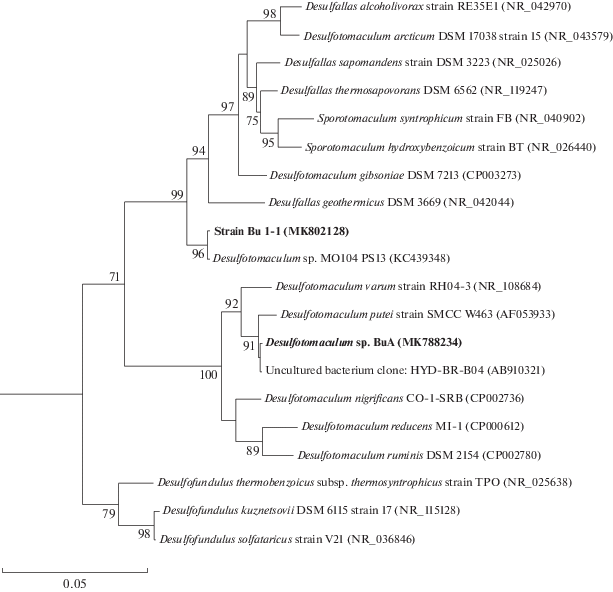
К настоящему времени стало очевидно, что подземные термальные системы являются типичным местообитанием спорообразующих сульфатредуцирующих бактерий. Значительное количество представителей семейства “Desulfotomaculaceae” было выделено из глубинных горизонтов. Desulfotomaculum salinum выделен из нефтегазоносных пластов в Западной Сибири (Назина и соавт., 2005), Desulfotomaculum kuznetsovii (Назина и соавт., 1988) и Desulfotomaculum thermocisternum (Nilsen et al., 1996) – из высокотемпературных нефтяных месторождений, Desulfotomaculum geothermicum (Daumas et al., 1988) и Desulfotomaculum australicum (Love et al., 1993) – из глубинных водоносных пластов, Desulfotomaculum luciae из горячего источника и Desulfotomaculum putei из осадков Триаса (Liu et al., 1997). В 2006 году был описан новый вид Desulfotomaculum thermosubterraneum (Kaksonen et al., 2006), культура которого была получена из черных обрастаний на стенах глубокой шахты в геотермально активном районе Японии. В 2008 году из горячего источника в Тунисе выделен и описан Desulfotomaculum hydrothermale (Haouari et al., 2008). И еще два новых вида, Desulfotomaculum aquiferis и Desulfotomaculum profundi, были выделены из водоносного горизонта, ассоциированного с глубинным месторождением природного газа (Berlendis et al., 2016). Интересно отметить, что последовательность гена 16S рРНК штамма Bu 1-1 полностью совпадала с депонированной в GenBank NCBI KC439348, принадлежащей неопубликованному Desulfotomaculum sp. MP104 PS13. Номер штамма предполагает, что бактерия была выделена из той же шахты Мпоненг в Южной Африке, в которой был найден далекий родственник группы Desulfotomaculum, Candidatus Desulforudis audaxviator (Chivian et al., 2008), выделенный недавно в нашей лаборатории из воды глубинной скважины в Томской области (Karnachuk et al., 2019). Мы предполагаем, что полученные нами из микробных обрастаний чистые культуры Desulfallas sp. Bu 1-1 и Desulfotomaculum sp. BuA происходят из подземных вод, вскрываемых скважиной Г-1 в Тункинской долине. Однако для подтверждения этого факта необходима дальнейшая проверка присутствия родственных филотипов в воде скважины путем профилирования гена 16S рРНК.
Список литературы
Назина Т.Н., Иванова А.Е., Канчавели Л.П., Розанова Е.П. Новая спорообразующая термофильная метилотрофная сульфатвосстанавливающая бактерия Desulfotomaculum kuznetsovii sp. nov. // Микробиология. 1988. Т. 57. С. 823–827. Назина Т.Н., Розанова Е.П., Белякова Е.В., Лысенко A.M., Полтараус А.Б., Турова Т.П., Осипов Г.А., Беляев С.С. Описание “Desulfotomaculum nigrificans subsp. salinus” в качестве нового вида Desulfotomaculum salinum sp. nov. // Микробиология. 2005. Т. 74. С. 654−662.
Aüllo T., Ranchou-Peyruse A., Ollivier B., Magot M. Desulfotomaculum spp. and related Gram-positive sulfate-reducing bacteria in deep subsurface environments // Front. Microbiol. 2013. V. 4. 362. https://doi.org/10.3389/fmicb.2013.00362
Berlendis S., Ranchou-Peyruse M., Fardeau M.-L., Lascourrèges J.-F., Joseph M., Ollivier B., Aüllo T., Dequidt D., Magot M., Ranchou-Peyruse A. Desulfotomaculum aquiferis sp. nov. and Desulfotomaculum profundi sp. nov., isolated from a deep natural gas storage aquifer // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 4329–4338.
Chivian D., Brodie E.L., Alm E.J., Culley D.E., Dehal P.S., DeSantis T.Z., Gihring T.M., Lapidus A., Lin L.-H., Lowry S.R., Moser D.P., Richardson P.M., Southam G., Wanger G., Pratt L.M., Andersen G.L., Hazen T.C., Brockman F.J., Arkin A.P., Onstott T.C. Environmental genomics revealed single-species ecosystem deep within Earth // Science. 2008. V. 322. P. 275–278.
Chun J., Lee J.H., Jung Y., Kim M., Kim S., Kim B.K., Lim Y.W. EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences // Int. J. System. Evol. Microbiol. 2007. V. 57. P. 2259–2261.
Chun J., Oren A., Ventosa A., Christensen H., Arahal D.R., da Costa M.S., Rooney A.P., Yi H., Xu X.-W., De Meyer S., Trujillo M.E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // Int. J. System. Evol. Microbiol. 2018. V. 68. P. 461–466.
Daumas S., Cord-Ruwisch R., Garcia J.L. Desulfotomaculum geothermicum sp. nov., a thermophilic, fatty-acid degrading, sulfate-reducing bacterium isolated with H2 from geothermal ground water // Antonie van Leeuwenhoek. 1988. V. 54. P. 165–178.
Frank Y., Banks D., Avakian M., Antsiferov D., Kadychagov P., Karnachuk O. Firmicutes is an important component of microbial communities in water-injected and pristine oil reservoirs, Western Siberia, Russia // Geomicrobiol. J. 2016. V. 33. P. 387–400.
Haouari O., Fardeau M.-L., Cayol J.-L., Casiot C., Elbaz-Poulichet F., Hamdi M., Joseph M., Ollivier B. Desulfotomaculum hydrothermale sp. nov., a thermophilic sulfate-reducing bacterium isolated from a terrestrial Tunisian hot spring // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 2529–2535.
Kaksonen A.H., Spring S., Schumann P., Kroppenstedt R.M., Puhakka J.A. Desulfotomaculum thermosubterraneum sp. nov., a thermophilic sulfate-reducer isolated from an underground mine located in a geothermally active area // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 2603–2608.
Karnachuk O.V., Frank Y.A., Lukina A.P., Kadnikov V.V., Beletsky A.V., Mardanov A.V., Ravin N.V. Domestication of previously uncultivated Candidatus Desulforudis audaxviator from a deep aquifer in Siberia sheds light on its physiology and evolution // ISME J. 2019. https://doi.org/10.1038/s41396-019-0402-3
Karnachuk O.V., Sasaki K., Gerasimchuk A.L., Sukhanova O., Ivasenko D.A., Kaksonen A.H., Puhakka J.A., Tuovinen O.H. Precipitation of Cu-sulfides by copper-tolerant Desulfovibrio isolates // Geomicrobiol. J. 2008. V. 25. P. 219–227.
Labonté J.M., Field E.K., Lau M., Chivian D., Van Heerden E., Wommack K.E., Kieft T.L., Onstott T.C., Stepanauskas R. Single cell genomics indicates horizontal gene transfer and viral infections in a deep subsurface Firmicutes population // Front. Microbiol. 2015. V. 22. 349. https://doi.org/10.3389/fmicb.2015.00349
Liu Y., Karnauchow T.M., Jarrell K.F., Balkwill D.L., Drake G.R., Ringelberg D., Clarno R., Boone D.R. Description of two new thermophilic Desulfotomaculum spp., Desulfotomaculum putei sp. nov., from a deep terrestrial subsurface, and Desulfotomaculum luciae sp. nov., from a hot spring // Int. J. Syst. Evol. Microbiol. 1997. V. 47. P. 615–621.
Love C.A., Patel B.K.C., Nichols P.D., Stackebrandt E. Desulfotomaculum australicum sp. nov., a thermophilic sulfate-reducing bacterium isolated from the great artesian basin of Australia // Syst. Appl. Microbiol. 1993. V. 16. P. 244–251.
Mardanov A.V., Panova I.A., Beletsky A.V., Avakyan M.R., Kadnikov V.V., Antsiferov D.V., Banks D., Frank Y.A., Pimenov N.V., Ravin N.V., Karnachuk O.V. Genomic insights into a new acidophilic, copper-resistant Desulfosporosinus isolate from the oxidized tailings area of an abandoned gold mine // FEMS Microbiol. Ecol. 2016. V. 92 (8). fiw111. P. 1–36. https://doi.org/10.1093/femsec/fiw111
Nilsen R.K., Torsvik N., Lien T. Desulfotomaculum thermocisternum sp. nov., a sulfate reducer isolated from a hot North Sea oil reservoir // Int. J. Syst. Bacteriol. 1996. V. 46. P. 397–402.
Podosokorskaya O.A., Kadnikov V.V., Gavrilov S.N., Mardanov A.V., Merkel A.Y., Karnachuk O.V., Ravin N.V., Bonch-Osmolovskaya E.A., Kublanov I.V. Characterization of Melioribacter roseus gen. nov., sp. nov., a novel facultatively anaerobic thermophilic cellulolytic bacterium from the class Ignavibacteria, and a proposal of a novel bacterial phylum Ignavibacteriae // Environ. Microbiol. 2013. V. 15. P. 1759–771.
Stamatakis A. RAxML Version 8: A tool for phylogenetic analysis and post-analysis of large phylogenies // Bioinformatics. 2014. V. 30. P. 1312–1313.
Watanabe M., Kojima H., Fukui M. Review of Desulfotomaculum species and proposal of the genera Desulfallas gen. nov., Desulfofundulus gen. nov., Desulfofarcimen gen. nov. and Desulfohalotomaculum gen. nov. // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 2891–2899.
Widdel F.F., Bak R. Gram negative mesophilic sulfate reducing bacteria // The Prokaryotes: a Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications / Eds. Balows A. et al. Berlin: Springer, 1992. P. 3352–3378.
Дополнительные материалы отсутствуют.


