Микробиология, 2019, T. 88, № 6, стр. 735-739
Пептидазная активность бактерий рода Proteinivorax и их возможная экологическая роль в микробном сообществе содовых озер Танатар (Алтайский край)
Е. В. Лаврентьева a, b, *, Е. Б. Эрдынеева a, Я. Е. Дунаевский c, Ю. В. Болтянская d, В. В. Кевбрин d
a Институт общей и экспериментальной биологии CО РАН
670047 Улан-Удэ, Россия
b Бурятский государственный университет им. Д. Банзарова
670000 Улан-Удэ, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
d Институт микробиологии имени С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: lena_l@mail.ru
Поступила в редакцию 24.05.2019
После доработки 19.07.2019
Принята к публикации 29.07.2019
Аннотация
Изучена пептидазная активность у алкалофильных анаэробных протеолитических бактерий рода Proteinivorax, P. tanatarense Z-910T и P. hydrogeniformans Z-710T, выделенные из системы гиперсоленых щелочных озер Танатар (Алтайский край). Показано, что штаммы Z-910 и Z-710 способны гидролизовать пара-нитроанилидные субстраты, проявляя максимальную активность по гидролизу GlpAALpNA и LpNa. Установлено, что пептидазы наиболее активны в щелочных условиях при рН 8–10 и термостабильны до 50°С. Данные ингибиторного анализа и субстратной специфичности изученных внеклеточных ферментов указывают на их принадлежность к классам сериновых пептидаз субтилизин-подобного типа (штамм Z-910) и металлопептидаз аминопептидазного типа (штамм Z-710).
Алкалофильное микробное сообщество представляет собой совокупность взаимодействующих между собой микроорганизмов с кооперативными трофическими связями и обладающих специализированным набором ферментов для трансформации энергии и вещества. Первичная продукция органического вещества в содовых озерах осуществляется, главным образом, за счет активного развития фототрофных микроорганизмов. В состав органического вещества фототрофных микроорганизмов, как и любых других, входят белки, являющиеся потенциальным субстратом для протеолитических бактерий. Последние выделяют внеклеточные пептидазы, осуществляющие гидролиз высокомолекулярных белковых веществ, и в процессе роста поставляют летучие жирные кислоты и аммиак в трофические цепи микробных сообществ (Ryzhmanova et al., 2017). Гидролиз белков, несмотря на однотипность и кажущуюся простоту реакций, является одним из сложных процессов в функционировании биологических систем и осуществляется при участии большого числа разнообразных протеолитических ферментов и множества факторов, регулирующих их активность.
Пептидазы (EC 3.4) представляют собой отдельную подгруппу гидролитических ферментов, которые катализируют расщепление пептидных связей в белковых субстратах. В зависимости от способа действия и каталитического механизма пептидазы делятся на шесть основных классов: сериновые (EC 3.4.21), цистеиновые (EC 3.4.22), аспарагиновые пептидазы (EC 3.4.23), металлопептидазы (EC 3.4.24), треониновые (ЕС 3.4.25) и глутаминовые эндопептидазы (ЕС 3.4.23.32) (http://merops.sanger.ac.uk). Помимо их ключевой метаболической и физиологической значимости, они имеют широкое коммерческое применение во всем мире (Thakur et al., 2018).
К настоящему времени известно несколько истинно алкалофильных (pHmin > 7) анаэробных протеолитических бактерий, относящихся к родам Alkaliphilus, Anaerovirgula, Anoxynatronum, Natranaerobius, Natronincola, Spirochaeta, Anaerobranca, Tindallia и Proteinivorax, выделенных из природных щелочных биоценозов (Kevbrin et al., 2013), однако проблема микробного разложения белков протеолитическими бактериями в системе гиперсоленых озер в настоящее время изучена недостаточно.
Представители последнего рода (порядок Clostridiales, филум Firmicutes) были выделены нами ранее и, на сегодняшний день, включают два вида: P. tanatarense (Kevbrin et al., 2013) и P. hydrogeniformans (Boltyanskaya et al., 2018). Оба вида были выделены из микробных сообществ щелочных озер Танатар (Алтайский край) и характеризуются ограниченным перечнем возможных субстратов. Максимальный рост этих бактерий был получен только на белковых веществах: триптоне, пептоне, дрожжевом экстракте. Однако по трофическим предпочтениям существенным межвидовым различием оказалась способность организмов к гидролизу белка: P. tanatarense мог расти на неразрушенных белках (альбумин, казеин, желатин), тогда как P. hydrogeniformans – нет.
Целью настоящего исследования было изучить пептидазную активность у галоалкалофильных протеолитических бактерий P. tanatarense Z-910T и P. hydrogeniformans Z-710T и определить возможную функциональную роль этих бактерий в трофической системе микробного сообщества.
Для изучения субстратной специфичности внеклеточных пептидаз штаммов Z-910 и Z-710 использовали различные п-нитроанилидные субстраты: BAPA, GlpFpNA, GlpAALpNA, GlpFApNA, L-pNa и F-pNa, специфичные, соответственно, для трипсин-, химотрипсин-, субтилизин-подобных, цистеиновых и аминопептидаз. Активность пептидаз определяли методом Эрлангера (Erlanger et al., 1961): в ячейку микропланшета вносили 160 мкл карбонатного буфера (рН 9.2), добавляли 10 мкл культуральной жидкости, 10 мкл соответствующего субстрата (20 мМ) и измеряли оптическое поглощение раствора в нулевой момент. Затем смесь инкубировали при 37°С, определяя изменение поглощения раствора через определенные промежутки времени. Количество образовавшегося продукта, п-нитроанилина, определяли спектрофотометрически при 405 нм на микропланшетном фотометре StatFax 2100 (“Awareness Technology Inc.”, США) в 96-луночных планшетах, используя дифференциальный фильтр 492 нм. При определении активности по отношению к GlpFApNA к реакционной смеси дополнительно добавляли 5 мкл свежеприготовленного раствора дитиотрейтола (10 мг/мл).
Оптимум pH пептидаз на п-нитроанилидных субстратах определяли с использованием 0.1 М универсального буфера (диапазон рН 3–11.2) по методике, описанной выше. Для определения рН стабильности ферментов реакционную смесь инкубировали 4 ч при 37°С в буфере в диапазоне рН от 3 до 11.2. Затем образцы доводили до рН 9 с помощью 0.1 М универсального буфера, либо 0.5 М раствором NaOH и определяли активность при 37°С, как указано выше.
Температурный оптимум пептидаз определяли, измеряя их активность при температурах от 30 до 60°С. Для изучения температурной стабильности раствор фермента инкубировали при тех же температурах в течение 4 ч, затем определяли активность при 37°С, как указано выше.
Природу функциональных групп активного центра пептидаз исследовали ингибиторным анализом, который проводили как с использованием частично очищенных ферментных препаратов, так и культуральной жидкости. В работе использовали специфические ингибиторы: для сериновых пептидаз – PMSF (фенилметилсульфонил-фторид, 10–3 М); металлопептидаз – EDTA (этилендиаминтетраацетат натрия, 10–1 М); цистеиновых пептидаз – IAA (йодацетамид, 10–2 М).
Была исследована способность штаммов Z-910 и Z-710 секретировать внеклеточные пептидазы, гидролизующие п-нитроанилидные субстраты, специфичные для пяти групп пептидаз: трипсин-, химотрипсин-, субтилизин-подобных, цистеиновых и аминопептидаз (BAPA, GlpFpNA, GlpAALpNA, GlpFApNA и LpNa соответственно), а также белковый субстрат – азоказеин/казеин, используемый для определения общей протеолитической активности.
Ранее в работе Nguyen et al. (2019) было показано, что геном бактерий, в отличие от архей, обладает бóльшим потенциалом для синтеза широкого спектра пептидаз. Нами обнаружено, что штаммы Z-910 и Z-710 способны гидролизовать синтетические субстраты BAPA, GlpAALpNA и LpNa. При этом активность пептидаз в отношении этих субстратов зависела от типа белка, вносимого в среду культивирования. Так, у штамма Z-910 максимальная активность в отношении субстрата GlpAALpNA проявлялась при культивировании штамма на интактной биомассе цианобактерии Geitlerinema sp. Z-T0701, одном из типичных первичных продуцентов содовых озер Танатар, и составила 1.6 ед., тогда как при росте на триптоне и казеине активность по GlpAALpNA не превышала 0.3 ед. Активность пептидаз штамма Z-910 в отношении L-pNa составила 0.36 ед. при культивировании на среде с Geitlerinema sp. и 0.2 ед. на средах с триптоном или казеином. Активность в отношении субстрата трипсин-подобных пептидаз – BAPA, составила 0.9 ед. при росте на триптоне и на биомассе цианобактерии, а на казеине – 0.7 ед. Пептидазы штамма Z-710, выращенного на средах c казеином, пептоном и триптоном, были активны в отношении субстрата для аминопептидаз; наибольшая активность – 0.2 ед., обнаружена при росте на среде с добавлением триптона.
Наличие у изученных бактерий пептидаз с широким спектром субстратной специфичности свидетельствует о том, что в природных условиях обитания эти бактерии: 1) могут проявлять большую гибкость в реализации типа протеолитической активности, 2) являются конкурентоспособными в получении органического азота в условиях содовых озер.
Помимо выявления типов пептидаз, была также изучена их протеолитическая активность в зависимости от условий культивирования продуцентов – штаммов Z-910 и Z-710 (температуры, рН и солености), регуляторно влияющих на синтез пептидаз. При определении активности секретируемых пептидаз в диапазоне температур от 25 до 45°С наибольшая активность на всех субстратах была обнаружена при 35°С. Определение активности внеклеточных пептидаз в зависимости от рН показало, что у обоих штаммов Z-910 и Z-710 ферменты обладали наибольшей активностью при рН 9.0–10.0. По устойчивости к солености (0.5–3 М NaCl) пептидаза штамма Z-910, специфичная к субстрату GlpAALpNA, показала высокую активность в присутствии 1 М NaCl. В отношении синтетических субстратов LpNa и BAPA максимальная ферментативная активность обнаружена при минерализации NaCl 1.5 и 2 М соответственно. Штамм Z-710 проявил наибольшую продуктивность при солености 1, 1.5 и 2 М в отношении пептидаз, активных к GlpAALpNA, BAPA и LpNa соответственно.
Таким образом, проведенные исследования показали, что активность секреции пептидаз штаммами Z-910 и Z-710 регулируется рядом факторов, таких как состав среды (спектр белковых субстратов) и ее физико-химические параметры (рН, температура и соленость), что определяет способность бактерий адаптироваться к изменениям условий обитания в природных системах.
Влияние температуры и рН на протеолитическую активность и стабильность ферментов была изучена на примере наиболее характерных внеклеточных пептидаз, гидролизующих субстраты GlpAALpNA (штамм Z-910) и L-pNa (штамм Z-710). Показано, что пептидазы активны в диапазоне температур от 15 до 50°С с максимумом при 37°С (штамм Z-910) и 30°С (штамм Z-710). Оптимумы рН пептидаз, секретируемых штаммами Z-910 и Z-710, отмечены при рН 9.8 и 9.3 соответственно, диапазон рН стабильности находился в пределах от 4.8 до 10.5 (рис. 1, 2).
Рис. 1.
Температурный оптимум и термостабильность внеклеточных пептидаз P. tanatarense Z-910 и P. hydrogeniformans Z-710. Обозначения: 1 – оптимум по GlpAALpNA для Z-910, 2 – оптимум по LpNa для Z-710, 3 – стабильность по Gl-pAALpNA для Z-910, 4 – стабильность по LpNa для Z-710.
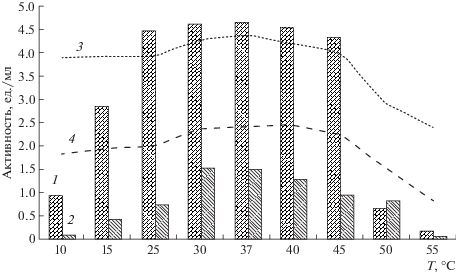
Рис. 2.
рН-Оптимум и рН стабильность внеклеточных пептидаз P. tanatarense Z-910 и P. hydrogeniformans Z-710. Обозначения: 1 – оптимум по GlpAALpNA для Z-910, 2 – оптимум по LpNa для Z-710, 3 – стабильность по GlpAALpNA для Z-910, 4 – стабильность по LpNa для Z-710.
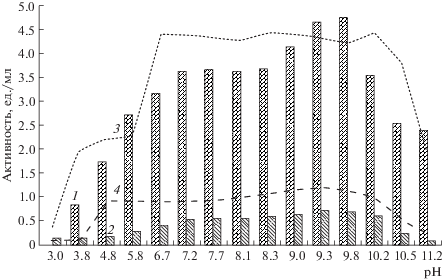
Таким образом, секретируемые пептидазы изученных бактериальных штаммов имели оптимум рН в щелочной области и диапазон рН стабильности, вполне покрывающий диапазон рН, свойственный местам их обитания.
У наиболее характерных пептидаз исследуемых штаммов была определена природа функциональных групп активного центра. Было показано, что активность пептидаз штамма Z-910 подавлялась специфическим ингибитором сериновых пептидаз – PMSF, а на активность пептидаз штамма Z-710 ингибиторное влияние оказывал EDTA. Исходя из результатов ингибиторного анализа и субстратной специфичности, можно сделать вывод, что секретируемые ферменты относятся к классам сериновых пептидаз субтилизин-подобного типа (штамм Z-910) и металлопептидаз аминопептидазного типа (штамм Z-710).
Таким образом, алкалофильные анаэробные протеолитические бактерии P. tanatarense Z-910 и P. hydrogeniformans Z-710 являются синтетиками пептидаз, способных гидролизовать п-нитроанилидные субстраты, с проявлением максимальной активности по гидролизу GlpAALpNA и LpNa. Возможно, что высокая внеклеточная пептидазная активность, обнаруженная у изученных нами штаммов, ассоциирована с типом их клеточной стенки – P. tanatarense Z-910 и P. hydrogeniformans Z-710 относятся к грамположительным бактериям. Ранее было отмечено, что грамположительные бактерии выделяют больше внеклеточных ферментов в окружающую среду, по сравнению с грамотрицательными (Chróst, 1991; Brown et al., 2015).
Характерно, что пептидазный комплекс штамма Z-910 проявлял максимальную активность при культивировании на интактной биомассе цианобактерии, что на энзимологическом уровне подтверждает продемонстрированную ранее в лабораторных экспериментах способность организма утилизировать “природную” белковую компоненту (Болтянская, Кевбрин, 2016). Цианобактерии рода Geitlerinema sp. являются одними из организмов-эдификаторов в микробных сообществах озер Танатар.
Ранее нами была постулирована возможная экологическая роль P. tanatarense в сообществе как анаэробного сапротрофа (Болтянская, Кевбрин, 2016). Другой вид этого рода, P. hydrogenoformans, оказался классическим диссипотрофом, использующим для роста только низкомолекулярные соединения (Boltyanskaya et al., 2018). Проведенные исследования показали, что функциональная роль алкалофильных анаэробных протеолитических бактерий P. tanatarense Z-910 и P. hydrogeniformans Z-710 определяется субстратной специфичностью гидролитических ферментов и высокой энзиматической активностью в отношении используемых субстратов определенной трофической группы.
Таким образом, изучена пептидазная активность у алкалофильных анаэробных протеолитических бактерий Proteinivorax, P. tanatarense Z-910T и P. hydrogeniformans Z-710T, выделенных из системы гиперсоленых щелочных озер Танатар (Алтайский край). Показано, что штаммы Z-910 и Z-710 способны гидролизовать пара-нитроанилидные субстраты, проявляя максимальную активность по гидролизу GlpAALpNA и LpNa. Установлено, что пептидазы наиболее активны в щелочных условиях при рН 8–10 и термостабильны до 50°С. Данные ингибиторного анализа и субстратной специфичности изученных внеклеточных ферментов указывают на их принадлежность к классам сериновых пептидаз субтилизин-подобного типа (штамм Z-910) и металлопептидаз аминопептидазного типа (штамм Z-710).
Список литературы
Болтянская Ю.В., Кевбрин В.В. Трофические взаимодействия протеолитической бактерии Proteinivorax tanatarense в алкалофильном микробном сообществе // Микробиология. 2016. Т. 85. № 4. С. 458–465.
Boltyanskaya Y.V., Kevbrin V.V. Trophic interactions of proteolytic bacteria Proteinivorax tanatarense in an alkaliphilic microbial community // Microbiology (Moscow). 2016. V. 85. P. 481–487.
Boltyanskaya Y., Detkova E., Pimenov N., Kevbrin V. Proteinivorax hydrogeniformans sp. nov., an anaerobic, haloalkaliphilic bacterium fermenting proteinaceous compounds with high hydrogen production // Antonie van Leeuwenhoek. 2018. V. 111. P. 275–284.
Brown L., Wolf J.M., Prados-Rosales R., Casadevall A. Through the wall: Extracellular vesicles in Gram-positive bacteria, mycobacteria and fungi // Nat. Rev. Microbiol. 2015. V. 13. P. 620–630.
Chróst R.J. Environmental control of the synthesis and activity of aquatic microbial ectoenzymes // Microbial Enzymes in Aquatic Environments / Eds. Chróst R.J. New York: Springer, 1991. Part 3. P. 29–59.
Erlanger B.F., Kokowsky N., Cohen W. The preparation and properties of two new chromogenic substrates of trypsin // Arch. Biochem. Biophys. 1961. V. 95. P. 271–278.
Kevbrin V., Boltynskaya Y., Zhilina T., Kolganova T., Lavrentjeva E., Kuznetsov B. Proteinivorax tanatarense gen. nov., sp. nov., an anaerobic, haloalkaliphilic, proteolytic bacterium isolated from a decaying algal bloom, and proposal of Proteinivoraceae fam. nov. // Extremophiles. 2013. V. 17. P. 747–756.
Nguyen T.T.H., Myrold D.D., Mueller R.S. Distributions of extracellular peptidases across prokaryotic genomes reflect phylogeny and habitat // Front. Microbiol. 2019. V. 10. Article 413. P. 1–14. https://doi.org/10.3389/fmicb.2019.00413
Ryzhmanova Y., Oshurkova V., Troshina O., Abashina T., Ariskina E., Avtukh A., Shcherbakova V. Anoxynatronum buryatiense sp. nov., an anaerobic alkaliphilic bacterium from a low mineralization soda lake in Buryatia, Russia // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 4704–4709.
Thakur N., Goyal M., Sharma S., Kumar D. Proteases: Industrial applications and approaches used in strain improvement // Biological Forum – An International J. 2018. V. 10. P. 158–167.
Дополнительные материалы отсутствуют.


