Микробиология, 2019, T. 88, № 6, стр. 715-718
Ревизия последовательности и аннотации генома бактериофага Burkholderia pseudomallei/thailandensis Bp-AMP1 – потенциального природного агента, контролирующего популяции возбудителя мелиоидоза
А. В. Летаров a, b, *, М. А. Летарова a, Е. Е. Куликов a
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119192 Москва, Россия
* E-mail: letarov@gmail.com
Поступила в редакцию 16.06.2019
После доработки 08.07.2019
Принята к публикации 29.07.2019
Аннотация
В последние годы в литературе неоднократно высказывалось предположение, что бактериофаги возбудителя мелиоидоза Burkholderia pseudomallei, родственные фагу Bp-AMP1, могут быть существенным фактором, контролирующим популяции этой бактерии в агроэкосистемах регионов, эндемичных по мелиоидозу. Предполагается, что свойственная этим вирусам зависимость жизненного цикла от температуры может обусловливать модуляцию природного фагового биоконтроля и вносить вклад в сложную феноменологию сезонной динамики заболеваний мелиоидозом. Для успешного развития исследований по физиологии инфекции фага Bp-AMP1 были уточнены сведения об организации его генома. В настоящей работе было установлено истинное положение физических концов вирионной ДНК; выявлено присутствие терминальных повторов длиной в 389 п.н., а также проведена ревизия аннотации генома данного бактериофага.
Возбудитель мелиоидоза Burkholderia pseudomallei является естественным обитателем почвенных и водных экосистем в регионах мира, эндемичных по данному заболеванию (Limmathurotsakul et al., 2016). Заражение мелиоидозом обычно происходит в результате контакта человека с почвой, поэтому наиболее подвержены данной инфекции работники сельскохозяйственной отрасли. Предшествующие исследования показали, что в почвах и воде агроландшафтов (преимущественно рисовых полей) северо-восточного Таиланда, наряду с B. pseudomallei, содержатся бактериофаги этой бактерии, причем большинство изолятов фагов, несмотря на то, что они получены в различных географических пунктах, близкородственны друг другу. Типовым представителем данной группы фагов является бактериофаг Bp-AMP1 (Gatedee et al., 2011; Shan et al., 2014; Withatanung et al., 2016). Интересно, что фаг Bp-AMP1 инфицирует не только B. pseudomallei, но и близкородственный непатогенный вид B. thailandensis, который также встречается в почве и воде северо-восточного Таиланда и других эндемичных по мелиоидозу регионов. Это существенно облегчает работу с бактериофагом, поскольку большинство лабораторных экспериментов можно проводить с использованием непатогенного хозяина без применения специальных мер безопасности.
Интересной особенностью физиологии инфекции фага Bp-AMP1 является то, что этот вирус эффективно лизирует клетки хозяев и образует хорошо заметные бляшки на их газонах при 37°C, однако при 25°C этого не происходит (Shan et al., 2014). Авторы предположили, что инфекция клеток при пониженной температуре ведет к образованию лизогенных (или, возможно, псевдолизогенных) бактерий, которые стабильно размножаются в этих условиях, однако подвержены лизису при повышении температуры (Shan et al., 2014). Математическое моделирование динамики развития популяций бактерий и бактериофагов в воде (например, в воде рисовых чеков) с учетом описанного эффекта показало, что фаги могут вносить существенный вклад в регуляцию численности свободных и вирус-инфицированных (лизогенных или псевдолизогенных) бактерий в различных условиях. При этом конкретный результат существенно зависит не только от температуры, но и от других факторов, например, прозрачности воды для ультрафиолетового излучения (Egilmez et al., 2018). Действие подобных факторов по-видимому может объяснить наблюдаемые различия в сезонной динамике мелиоидоза в соседних районах северо-восточного Таиланда, которые не различаются климатически. Постулируемая важная экологическая роль, которую играют Bp-AMP1-подобные вирусы, делает актуальным детальное исследование молекулярных и физиологических механизмов, лежащих в основе температурного контроля развития жизненного цикла этих фагов.
Экспериментальная работа с фагом Bp-AMP1 существенно облегчается тем фактом, что полная геномная последовательность данного бактериофага была определена, аннотирована и депонирована ранее (Shan et al., 2014). Из числа биологически охарактеризованных вирусов одними из наиболее генетически родственных фагу Bp-AMP1 оказались описанные нами ранее колифаги phiKT и фаг PGT2, который очень близок к phiKT (83% идентичности полных нуклеотидных последовательностей геномов) (Golomidova et al., 2018).
Проведенное нами биоинформационое сравнение депонированной последовательности Bp-AMP1 (GenBank ID HG793132) и фага phiKT (GenBank ID NC_019520) обнаружило существенное различие в организации их генетической карты, имеющее вид кольцевой перестановки геномного фрагмента. Мы предположили, что указанное различие является артефактом, связанным с неверным определением физических концов генома в одной из последовательностей. Поскольку приблизительное положение концов генома фага phiKT ранее было нами проверено экспериментально (наши неопубликованные данные), то наиболее вероятным мы сочли ошибочное расположение концов в депонированной последовательности фага Bp-AMP1. Более того, и фаг Bp-AMP1, и фаг phiKT представляют собой вирусы, отдаленно родственные бактериофагу Т7 (Shan et al., 2014; Golomidova et al., 2018). Для фага Т7 и подобных ему вирусов свойственно наличие прямых концевых повторов генома протяженностью в несколько сотен пар нуклеотидов (Molineux, 2006). Эти повторы были обнаружены у родственных Bp-AMP1 колифагов phiKT и PGT2 (Golomidova et al., 2018), но их наличие не отражено в депонированной геномной последовательности фага Bp-AMP1.
Сравнение опубликованных геномов фагов phiKT и Bp-AMP1 позволило предположить, что в депонированной последовательности последнего фрагмент около 5000 п.н. от левого физического конца геномной ДНК до 1 н.п. депонированной последовательности оказался размещен на правом конце генома. Для проверки этого предположения необходимо было провести повторный анализ ДНК бактериофага.
Бактериофаг Bp-AMP1 и штамм хозяина B. thailandensis DW503 были любезно предоставлены нам проф. Martha Clokie (University of Leicester, UK). Фаг был выращен согласно стандартным процедурам (Shan et al., 2014), и его геномная ДНК была выделена в препаративных количествах.
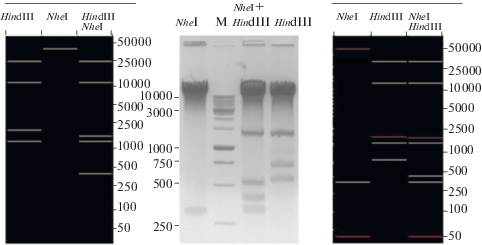
Анализ последовательности генома с помощью модуля GeneQuest программного пакета Lasergene 8 (“DNAStar”, США) позволил подобрать эндонуклеазы рестрикции, для которых в геноме фага Bp-АMP1 имеются сайты, расположенные поблизости от предполагаемых физических концов упакованной в вирионы ДНК. В частности, нами были выбраны ферменты NheI и HindIII. С помощью этих эндонуклеаз был проведен гидролиз фаговой ДНК. Продукты гидролиза разделяли в 1% агарозном геле, при этом выбор нагрузки дорожек позволил визуализировать небольшие фрагменты. Полученные электрофореграммы сравнивали с теоретическими профилями фрагментов, рассчитанными, исходя из искусственно замкнутой в кольцо уникальной последовательности генома (рис. 1). Из полученных данных было очевидно, что левый конец генома содержится в NheI-фрагменте ~350 п.н., так как в уникальной последовательности генома имеется лишь один сайт NheI, расположенный вблизи предполагаемого левого конца. Соответственно, один из концов короткого NheI-фрагмента должен быть образован физическим концом генома. Этот же конец содержится и в HindIII-фрагменте длиной около 770 п.н., который исчезает при дополнительном гидролизе ферментом NheI (рис. 1).
Рис. 1.
Слева – предсказанный рестрикционный профиль ДНК фага Bp-AMP1, исходя из искусственно замкнутой в кольцо уникальной последовательности генома. В центре – разделения рестрикционных фрагментов ДНК фага Bp-AMP1 в 1% агарозном геле с маркером 1kb Ladder (“СибЭнзим”, Россия). Справа – предсказанный рестрикционный профиль для линейной откорректированной последовательности с учетом терминальных повторов.
Для точной локализации левого конца генома HindIII фрагмент длиной ~770 п.н. был элюирован из геля и направлен на секвенирование по Сэнгеру с обратным праймером AMP-LendR (5'- CACAGGCAGCACAGCACA), гибридизующимся примерно в 500 п.н. правее предполагаемого левого конца генома. По резкому обрыву сигнала (рис. 2) удалось установить положение левого конца, начиная с последовательности tagcgccgcc……
Рис. 2.
Хроматограммы автоматического секвенирования по Сэнгеру фрагментов, содержащих физические концы ДНК фага Bp-AMP1 (run-off эксперимент). Верхние панели – обработанные данные, нижние панели – исходные данные (raw data).
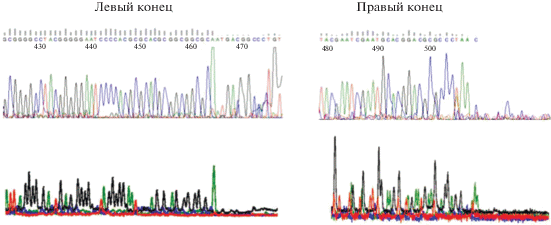
После того, как была получена последовательность генома с выверенным положением левого конца, стало очевидно, что профиль рестрикционных фрагментов фага по ферменту HindIII отличается от предсказанного отсутствием фрагмента ~1300 п.н. Указанный фрагмент должен содержать правый конец генома. Вместо фрагмента ~1300 п.н. в экспериментально определенном профиле рестрикционных фрагментов присутствовал фрагмент около 500 п.н., который отсутствует в теоретически рассчитанном профиле. Это свидетельствовало о предположительном наличии у варианта фага, с которым мы работали, обширной делеции около 1000 п.н. в районе гена интегразы. Наличие данной делеции было подтверждено с помощью ПЦР (данные не приводятся). Используя ПЦР-скрининг фаговых бляшек, мы обнаружили вариант фага, в котором такой делеции нет. Его профиль рестрикционных фрагментов содержал HindIII-фрагмент длиной около 1700 п.н. Секвенирование этого фрагмента с праймером AMP-end-D2 (5'-CT CTG CTG TAC CAG TCA) позволило установить точное положение правого конца по обрыву сигнала секвенирования (рис. 2) по последовательности ….ggacgcgcccta. Таким образом, фаг Bp-AMP1 обладает концевыми повторами длиной в 389 п.н.
Для подтверждения соответствия депонированной последовательности, ДНК фага, свободная от делеции в гене интегразы, была направлена на полногеномное секвенирование. Полученная последовательность оказалась идентична ранее депонированной последовательности фага Bp-AMP1. Вместе с тем инспекция имеющейся аннотации генома фага Bp-AMP1 выявила ряд неточностей. Мы вручную отредактировали аннотацию, в результате чего были дополнительно описаны некоторые рамки считывания, уточнены предсказанные функции некоторых фаговых белков. Поскольку в исходной аннотации значительное число рамок считывания не имело никакого названия, мы ввели сквозную нумерацию ORF, начиная с идентифицированного нами левого конца генома. Кроме этого, мы добавили к последовательности правый терминальный повтор, в результате чего общая длина последовательности стала составлять 42 798 п.н. вместо 42 409 п.н. в исходной версии. Полученная аннотированная последовательность депонирована в базу данных GenBank под номером MN191861.
Список литературы
Egilmez H.I., Morozov A.Y., Clokie M.R.J., Shan J., Letarov A., Galyov E.E. Temperature-dependent virus lifecycle choices may reveal and predict facets of the biology of opportunistic pathogenic bacteria // Sci. Rep. 2018. V. 8. № 1. P. 9642.
Gatedee J., Kritsiriwuthinan K., Galyov E.E., Shan J., Dubinina E., Intarak N., Clokie M.R., Korbsrisate S. Isolation and characterization of a novel podovirus which infects Burkholderia pseudomallei // Virol. J. 2011. V. 8. P. 366.
Golomidova A.K., Kulikov E.E., Kudryavtseva A.V., Letarov A.V. Complete genome sequence of Escherichia coli bacteriophage PGT2 // Genome Announc. 2018. V. 6. pii: e01370-17. https://doi.org/10.1128/genomeA.01370-17
Limmathurotsakul D., Golding N., Dance D.A., Messina J.P., Pigott D.M., Moyes C.L., Rolim D.B., Bertherat E., Day N.P., Peacock S.J., Hay S.I. Predicted global distribution of Burkholderia pseudomallei and burden of melioidosis // Nat. Microbiol. 2016. V. 1. pii: 15008.
Molineux I.J. The T7 group // The Bacteriophages / Eds. Calendar R., Abedon S. Oxford, UK‒New York, USA: Oxford University Press, 2006. P. 277‒301.
Shan J., Korbsrisate S., Withatanung P., Adler N.L., Clokie M.R., Galyov E.E. Temperature dependent bacteriophages of a tropical bacterial pathogen // Front. Microbiol. 2014. V. 5. P. 599.
Withatanung P., Chantratita N., Muangsombut V., Saiprom N., Lertmemongkolchai G., Klumpp J., Clokie M.R., Galyov E.E., Korbsrisate S. Analyses of the distribution patterns of Burkholderia pseudomallei and associated phages in soil samples in Thailand suggest that phage presence reduces the frequency of bacterial isolation // PLoS Negl. Trop. Dis. 2016. V. 10. P. e0005005.
Дополнительные материалы отсутствуют.


