Микробиология, 2019, T. 88, № 6, стр. 725-729
Роль гуминовых веществ в пролонгировании жизнеспособности клеток углеводородокисляющих бактерий
Ю. А. Николаев a, *, Е. В. Демкина a, И. В. Перминова b, Н. Г. Лойко a, И. А. Борзенков a, А. Е. Иванова a, А. И. Константинов b, Г. И. Эль-Регистан a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
b Московский государственный университет имени М.В. Ломоносова,
химический факультет
119234 Москва, Россия
* E-mail: nikolaevya@mail.ru
Поступила в редакцию 05.06.2019
После доработки 11.07.2019
Принята к публикации 29.07.2019
Аннотация
Показано, что внесение гуминовых веществ (9 препаратов) в культуры углеводородокисляющих бактерий приводит к увеличению численности жизнеспособных клеток до 15 раз при хранении культур в среде роста при доступе кислорода при 20–25°С. Биологической активностью индукции образования персистеров, созревающих в покоящиеся формы, обладали наиболее окисленные гуматы, а активностью, направленной на сохранение жизнеспособности – неокисленные, с антиоксидантной активностью.
В настоящее время используется достаточно большое число технологий ликвидации нефтяных проливов (Sihag et al., 2014; Koshlаf, Ball, 2017), из которых применение микробиологических технологий наиболее предпочтительно для природных экосистем. При невысоком уровне загрязнений используют технологии активизации аборигенной микрофлоры агротехническими приемами. Другой подход, так называемая целевая биоремедиация, основан на внесении в загрязненную экосистему бакпрепаратов углеводородокисляющих микроорганизмов (Кузнецов и соавт., 2010). Наиболее часто бакпрепараты для биоремедиации выпускаются в форме паст, порошков или сгущенной биомассы клеток (Дагуров и соавт., 2005). Существенным недостатком всех бакпрепаратов является быстрая гибель микроорганизмом в процессе получения, хранения и транспортировки их товарных форм. В связи с этим повышение эффективности бакпрепаратов сопряжено, прежде всего, с продлением жизнеспособности микробных клеток.
Целью исследования было разработать новые подходы к пролонгированному сохранению жизнеспособности клеток углеводородокисляющих бактерий путем их стабилизации с помощью гуминовых веществ (ГВ).
Использование ГВ было обусловлено тем, что они представляют собой продукты конденсации и окисления фенольных соединений, в том числе алкилрезорцинов, в зависимости от концентрации проявляющих стресс-потенцирующую и антиоксидантную активность (Эль-Регистан и соавт., 2006; Николаев и соавт., 2006; Stasiuk, Kozubek, 2010). Одним из эффектов алкилрезорцинов является индукция стрессовых регулонов (Голод и соавт., 2009), что, в свою очередь, индуцирует образование субпопуляции клеток-персистеров (van den Bergh et al., 2017), обладающих высокой стрессоустойчивостью и, важно подчеркнуть – устойчивостью к автолизу (Balaban et al., 2013).
Объектами исследования были грамотрицательные бактерии Acinetobacter junii и Pseudomonas extermaustralis и грамположительная бактерия Rhodococcus erythropolis из коллекции культур микроорганизмов ФИЦ Биотехнологии РАН, способные к активному окислению углеводородов нефти и их утилизации в качестве единственного источника углерода и энергии.
Бактерии выращивали при 28 ± 2°С на орбитальной качалке (100 об./мин) в конических колбах объемом 250 мл, содержащих 50 мл жидкой минеральной среды К1 (Зайцев, Карасевич, 1981) или среды LB (“Sigma”). В качестве источника углерода для роста A. junii использовали пентадекан (10 мл/л). Инокулят – культуры стационарной фазы роста, вносили в количестве 2% (об.). О росте культур судили по изменению оптической плотности при λ = 540 нм (спектрофотометр Jenway 7315, Великобритания).
Число жизнеспособных клеток (КОЕ/мл) определяли путем высева аликвот десятиричных разведений культур на агаризованную (1.8% агара, “Нelicon”) питательную среду LB (“AMRESCO”).
В экспериментах использовали ряд ГВ различного химического состава и генезиса: гумат техноэкспорт (ГТ), фульвокислоты (ФК), пауэрхумус (РН), иркутский гумат (ГИ), лигногумат (ЛГ), гумат сахалинский (ГС), сапропелевый гумат (С), гумат +7 (Г7), гумат калия “гумиком” (Г) (химический факультет МГУ им. М.В. Ломоносова). Для некоторых ГВ химический состав был определен (табл. 2), для остальных эти данные будут получены и проанализированы в следующих публикациях.
Таблица 1.
Динамика изменения количества жизнеспособных клеток (КОЕ/мл) Acinetobacter junii при длительном хранении контрольных и опытных культур с внесением препарата “Гумиком”
| Длительность хранения, сут | Количество клеток (КОЕ/мл) в вариантах с добавлением ГВ, г/л | |||||
|---|---|---|---|---|---|---|
| 0 (контроль) | 0.03 | 0.15 | 0.6 | 1.5 | 3.0 | |
| 0 | 9.8 × 108 | |||||
| 1 | 7.6 × 108 | 7.7 × 108 | 9.6 × 108 | 8.9 × 108 | 8.7 × 108 | 8.6 × 108 |
| 7 | 2.3 × 108 | 2.4 × 108 | 2.8 × 108 | 5.3 × 108 | 4.0 × 108 | 3.8 × 108 |
| 14 | 5.6 × 107 | 7.0 × 107 | 7.7 × 107 | 1.3 × 108 | 9.6 × 107 | 9.0 × 107 |
| 30 | 6.9 × 106 | 1.5 × 107 | 4.8 × 107 | 7.8 × 107 | 5.4 × 107 | 4.8 × 107 |
| 60 | 4.0 × 106 | 6.4 × 106 | 7.6 × 106 | 8.6 × 106 | 1.2 × 107 | 9.5 × 106 |
| 90 | 2.7 × 106 | 3.1 × 106 | 4.0 × 106 | 5.1 × 106 | 7.5 × 106 | 6.1 × 106 |
| 120 | 8.2 × 105 | 9.3 × 105 | 1.2 × 106 | 2.0 × 106 | 3.5 × 106 | 2.8 × 106 |
Таблица 2.
Структурно-групповой состав исследованных гуматов по данным спектроскопии 13С ЯМР
| Гумат | Распределение углерода по основным структурным фрагментам ГВ, % | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| CHn | CH3O | CH2O | CHO | OCO | Car | CarO | COO | C=O | |
| Гумат + 7 | 12.7 | 2.5 | 1.7 | 2.2 | 4.0 | 44.5 | 13.0 | 13.5 | 5.9 |
| Гумиком | 18.4 | 2.4 | 2.3 | 4.4 | 5.5 | 30.7 | 8.6 | 19.0 | 8.9 |
| Сахалинский | 11.4 | 1.5 | 1.3 | 3.6 | 4.5 | 41.8 | 10.5 | 19.4 | 6.0 |
Структурно-групповой состав препаратов ГВ определяли методом спектроскопии ЯМР 13С в растворе на ЯМР-спектрометре Avance 400 (“Bruker”) с несущей частотой для ядер 13С 100 МГц (Perminova et al., 1998, 2003). Условия получения количественных спектров 13С ЯМР описаны в работе Ковалевский и соавт. (2000). Преобразование Фурье полученного спектра выполняли с использованием программного обеспечения MestReC одноименной компании. Интегрирование спектров для получения количественной информации о структурно-групповом составе гуматов выполняли с помощью программного обеспечения GelTreat, разработанного А.В. Кудрявцевым (химический факультет МГУ). Пределы интегрирования выбирали согласно (Hertkorn et al., 2002).
Статистическую и графическую обработку результатов проводили с использованием пакета прикладных программ Excel 2010.
В первой серии экспериментов было исследовано пролонгирование выживания популяций УОБ A. junii, выращенной на минеральной среде с пентадеканом, и определены механизмы действия 3-х препаратов ГВ (Г, Г7, С). Показано, что внесение ГВ (0.03–3.0 г/л) в бактериальную культуру стационарной фазы роста приводит к увеличению численности жизнеспособных клеток в 7–16 раз при хранении бакпрепаратов от 1 до 4 мес. в провокационных условиях (при доступе кислорода воздуха, в среде роста, при температуре 20–25°С). Определена концентрационная зависимость стимулирующего действия ГВ (табл. 1). Оптимальными были для ГВ: Г – 0.06 г/л; Г7 – 1.0 г/л; С – 0.4% об. Анализ динамики отмирания культур A. junii как контрольных, так и опытных (с Г) вариантов (табл. 1), выявил их бимодальность. За начальной фазой быстрого отмирания (0.167 lg КОЕ/мл сут), характерного для автолиза регулярных стационарных клеток, следовала фаза медленного отмирания (lg 0.015 КОЕ/ мл сут), свойственная клеткам-персистерам, что ранее было показано для условно-патогенных бактерий как признак, детерминирующий этот тип фенотипической гетерогенности бактериальных популяций (Lewis, 2010). Субпопуляция быстро отмирающих клеток (до 30 сут) составляла около 99%, а численность выживших − около 1%, что соответствует численности персистеров в популяциях патогенных бактерий (Balaban et al., 2004, 2013).
Влияние ГВ на титр устойчивых к автолизу клеток-персистеров зависело от концентрации ГВ и сроков хранения культур. В табл. 1 представлены данные для препарата Г, для остальных ГВ выявлена аналогичная зависимость (наличие тех же фаз кривой отмирания). Наиболее выраженный эффект ГВ наблюдался через 1 мес. хранения, когда разница между контрольным и опытными вариантами составляла для разных препаратов ГВ от 400 до 1600%. На более поздних сроках инкубации (2–4 мес.) эта разница сокращалась, однако абсолютное количество выживших через 4 мес. клеток в опытных вариантах было существенно (на 500–700%) больше, чем в контрольных.
При сравнении биологической эффективности препаратов ГВ разного состава отмечены различия в их влиянии на численность образовавшихся клеток-персистеров. При краткосрочном хранении в провокационных условиях высокий титр КОЕ обусловлен наличием клеток-персистеров (1 мес. инкубации), на этот показатель в наибольшей степени влиял препарат ГВ “Г”. При пролонгированных сроках инкубации (4 мес.) выживали только покоящиеся клетки, и наибольший эффект отмечен для ГВ “Г7” и “С”, что коррелировало с их химическим составом (табл. 2). Препарат “Г” отличался большим количеством алкильных групп, высоким содержанием алкоксигрупп, карбоксильных и карбонильных групп, низким содержанием ароматического углерода, как замещенного, так и не замещенного гетероатомами. Такие свойства характерны для более окисленных ГВ. Препараты “Г7” и “С”, напротив, имели существенно меньшее число алкильных групп, высокое содержание ароматического углерода и низкое содержание карбонильных групп, что характеризует их как более восстановленные. Анализ полученных результатов позволил заключить, что стресс-индуцирующая активность, ответственная за образование в стационарных культурах клеток-персистеров, ассоциирована с окисленными гуматами, а продление сохранения колониеобразующей способности клеток определяется вкладом менее окисленных компонентов, обладающих более высокой антиоксидантной активностью.
Таким образом, эффекты действия ГВ на бактериальную популяцию стационарной фазы роста заключаются в: 1) индукции (повышении численности) образования длительно выживающих клеток-персистеров; 2) пролонгации сохранения их жизнеспособности в провокационных условиях хранения за счет их антиоксидантного действия.
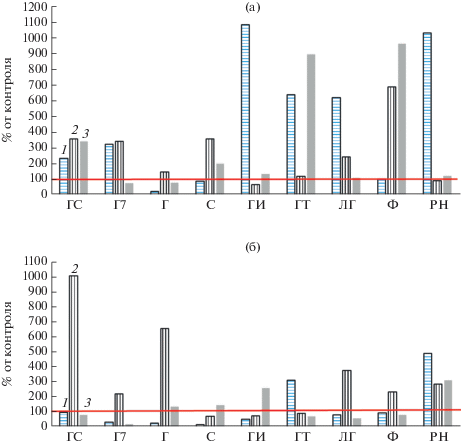
Вторая часть исследования посвящена изучению влияния ГВ на стабилизацию вегетативных клеток углеводородокисляющих бактерий (УОБ). В отличие от предыдущего способа повышения численности жизнеспособных клеток за счет индукции образования персистеров, стабилизации подвергали вегетативные клетки УОБ конца фазы линейного роста, в которых не экспрессированы регулоны стрессоустойчивости (Ткаченко, 2018). Бактерии культивировали в богатой среде LB. В экспериментах с УОБ R. erythropolis и P. extremaustralis, различающихся строением клеточных стенок исследовали стабилизирующую активность 9 препаратов ГВ (ГТ, ФК, РН, ГИ, ЛГ, ГС, С, Г7, Г). ГВ вносили в культуры УОБ в концентрациях: 0.15, 0.5 и 1.5 г/л, культуры хранили в провокационных условиях. Через 1 мес. хранения титр жизнеспособных клеток в опытных культурах с ГВ был выше, чем в контрольных культурах в 3–10 раз (рис. 1). Стабилизация зависела от состава ГВ и их концентрации и была отмечена для всех ГВ, кроме гумата Г (рис. 1). Выраженным стабилизирующим действием на клетки грамположительного R. erythropolis обладали при минимальной концентрации 0.15 г/л гуматы препаратов ГИ, ГТ, ЛГ, РН (титр КОЕ был в 10, 5, 5, 10 раз больше, чем в контроле, соответственно). В случае грамотрицательной УОБ P. extremaustralis стабилизирующее действие ГВ было выражено слабее, увеличение титра КОЕ отмечено для гуматов ГС, Г, ЛГ при средних концентрациях 0.5 г/л, а также для РН при минимальной концентрации (титр КОЕ был больше, чем в контроле, в 10, 6, 4, 5 раз соответственно).
Рис. 1.
Количество жизнеспособных клеток R. erytrhropolis (а) и P. extremaustralis (б) через 1 мес. инкубации с разными концентрациями ГВ (г/л): 1 − 0.15; 2 − 0.5; 3 – 1.5, по сравнению с контролем без ГВ (100%, отмечено горизонтальной линией).
Таким образом, в результате проведенных исследований предложен новый подход к повышению количества жизнеспособных клеток в длительно хранящихся популяциях (культурах) УОБ, основанный на применении препаратов гуминовых веществ (ГВ). Показано, что внесение ГВ в бактериальную культуру стационарной фазы роста индуцирует образование устойчивых к автолизу клеток-персистеров, созревающих в стрессоустойчивые покоящиеся формы, что приводит к увеличению численности жизнеспособных клеток (в 7–16 раз) при хранении бакпрепаратов от 1 до 4 мес. в провокационных условиях (при доступе кислорода воздуха, в среде роста, при температуре 20–25°С). Второй способ основан на стабилизации гуматами вегетативных клеток бактерий, что повышает численность выживающих клеток в течение 1 мес. до 10 раз. Для каждой пары “микроорганизм–гумат” требуется оптимизация концентрации определенного ГВ.
Полученные результаты важны для технологий производства бакпрепаратов различного назначения, в том числе для пищевой промышленности в секторе производства молочнокислой продукции, где остро стоит вопрос повышения численности жизнеспособных клеток.
Список литературы
Голод Н.А., Лойко Н.Г., Лобанов К.В., Миронов А.С., Воейкова Т.А., Гальченко В.Ф., Эль-Регистан Г.И. Роль микробных ауторегуляторов – алкилоксибензолов, в контроле экспрессии стрессовых регулонов // Микробиология. 2009. Т. 78. № 6. С. 731–741.
Golod N.A., Loiko N.G., Lobanov K.V., Mironov A.S., Voieikova T.A., Gal’chenko V.F., Nikolaev Yu.A., El’-Registan G.I. Involvement of alkylhydroxybenzenes, microbial autoregulators, in controlling the expression of stress regulons // Microbiology (Moscow). 2009. V. 78. P. 678–688.
Дагуров А.В. Стом Д.И., Вятчина О.Ф., Балаян А.Э., Кушнарев Д.Ф. О механизме антидотного действия гуматов по отношению к нефтепродуктам // Acta Biomedica Scientifica. 2005. Т. 6. № 44. С. 143–145.
Зайцев Г.М., Карасевич Ю.Н. Утилизация 4-хлорбензойной кислоты штаммом Arthrobacter globiformis // Микробиология. 1981. Т. 50. № 1. С. 35–40.
Zaitcev G.M., Karasevich Yu.N. Utilization of 4-chlorobenzoic acid by Arthrobacter globiformis // Microbiology (Moscow). 1981. V. 50. P. 35–40.
Ковалевский Д.В., Пермин А.Б., Перминова И.В., Петросян В.С. Выбор условий регистрации количественных 13С ЯМР-спектров гумусовых кислот // Вестн. Моск. ун-та. Cер. 2. Химия. 2000. Т. 41. № 1. С. 39–42.
Кузнецов А.Е., Градова Н.Б., Лушников С.В., Энгельхарт М., Вайссер Т., Чеботаева М.В. Прикладная экобиотехнология. М.:, Бином, 2010. Т. 1. С. 472–620.
Николаев Ю.А., Мулюкин А.Л., Степаненко И.Ю., Эль-Регистан Г.И. Ауторегуляция стрессового ответа микроорганизмов // Микробиология. 2006. Т. 75. № 4. С. 489–496.
Nikolaev Yu.A., Mulyukin A.L., Stepanenko I.Yu., El’-Registan G.I. Autoregulation of stress response in microorganisms // Microbiology (Moscow). 2006. V. 75. P. 420–426.
Ткаченко А.Г. Молекулярные механизмы стрессорных ответов у микроорганизмов. Екатеринбург. УрО РАН, 2012. 268 с.
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. № 4. С. 446–456.
El-Registan G.I., Mulyukin A.L., Nikolaev Yu.A., Suzina N.E., Gal’chenko V.F., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology (Moscow). 2006. V. 75. P. 380–389.
Balaban N.Q., Gerdes K., Lewis K., McKinney J.D. A problem of persistence: still more questions than answers? // Nature Rev. Microbiol. 2013. V. 11. P. 587–591.
Balaban N.Q., Merrin J., Chait R., Kowalik L., Leibler S. Bacterial persistence as a phenotypic switch // Science. 2004. V. 305. P. 1622–1625.
Hertkorn N., Permin A.B., Perminova I.V., Kovalevskii D.V., Yudov M.V., Kettrup A. Comparative analysis of partial structures of a peat humic and fulvic acid using one and two dimensional nuclear magnetic resonance spectroscopy // J. Environ. Qual. 2002. V. 31. P. 375–387.
Koshlaf E., Ball A.S. Soil bioremediation approaches for petroleum hydrocarbon polluted environments // AIMS Microbiol. 2017. V. 3. P. 25–49.
Levin-Reisman I., Braunera A., Ronina I., Balaban N.Q. Epistasis between antibiotic tolerance, persistence and resistance mutations // Proc. Natl. Acad. Sci. USA. 2019. July 1. pii: 201906169. https://doi.org/10.1073/pnas.1906169116
Lewis K. Persister cells // Annu. Rev. Microbiol. 2010. V. 64. P. 357–372.
Perminova I.V., Frimmel F.H., Kovalevskii D.V., Abbt-Braun G., Kudryavtsev A.V., Hesse S. Depelopment of a predictive model for calculation of molecular weight of humic substances // Wat. Res. 1998. V. 32. P. 872–881.
Perminova I.V., Frimmel F.H., Kudryavtsev A.V., Kulikova N.A., Abbt-Braun G., Hesse S., Petrosyan V.S. Molecular weight characteristics of aquatic, soil, and peat humic substances as determined by size exclusion chromatography and their statistical evaluation // Environ. Sci. Technol. 2003. V. 37. P. 2477–2485.
Sihag S., Pathak H., Jaroli D. Factors affecting the rate of biodegradation of polyaromatic hydrocarbons // Int. J. Pure Appl. Biosci. 2014. V. 2. P. 185–202.
Stasiuk M., Kozubek A. Biological activity of phenolic lipids // Cell. Mol. Life Sci. 2010. V. 67. P. 841–860.
Van den Bergh B., Fauvart M., Michiels J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters // FEMS Microbiol. Rev. 2017. V. 41. P. 219–251.
Дополнительные материалы отсутствуют.


