Микробиология, 2019, T. 88, № 6, стр. 705-709
Антибиопленочные агенты: неоднозначность терминологии и стратегия поиска
В. К. Плакунов a, *, М. В. Журина a, А. В. Ганнесен a, С. В. Мартьянов a, Ю. А. Николаев a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук, Институт микробиологии им. С.Н. Виноградского
119071 Москва, Россия
* E-mail: plakunov@inmi.ru
Поступила в редакцию 12.04.2019
После доработки 20.05.2019
Принята к публикации 29.05.2019
Аннотация
Проведен анализ взглядов, существующих в современной научной литературе, на природу антибиопленочных агентов и стратегию их поиска. Предложена новая классификация этих веществ с подразделением на четыре основных класса в зависимости от механизма действия. Описана усовершенствованная схема поиска анти- и пробиопленочных агентов, позволяющая повысить эффективность отбора и расширить спектр этих веществ.
Большинство микроорганизмов в природных экотопах существует в виде структурированных сообществ – биопленок (как правило, мультивидовых) (Ножевникова и соавт., 2015), тогда как в лабораторных условиях исследователи чаще всего имеют дело с планктонными культурами микроорганизмов. Рост микробных культур в планктонной форме обусловлен, главным образом, нелимитированным снабжением питательными веществами и обеспечением физико-химических условий среды, близких к оптимальным. Напротив, в результате стрессовых воздействий, в том числе в присутствии биоцидов, микроорганизмы переходят к прикрепленному способу существования, поскольку биопленочный фенотип обеспечивает устойчивость как к воздействию токсичных веществ, так и неблагоприятных условий внешней среды (Плакунов и соавт., 2017). Именно эти обстоятельства создают серьезные трудности при химиотерапии инфекций и заставляют исследователей прилагать огромные усилия для поиска антибиопленочных агентов, способных подавлять рост микробных биопленок.
Для успешного поиска таких агентов большое значение имеет разработка рациональной стратегии, для чего нужно ясно представлять, какие именно вещества могут проявлять себя как антибиопленочные агенты. Между тем, в научной литературе существуют значительные различия как в понимании самого термина “антибиопленочный”, так и в стратегии поиска этих соединений. Многие микробиологи, особенно медицинского профиля с традиционным подходом к проблеме, относят к антибиопленочным агентам только те вещества, которые подавляют рост биопленок, но не влияют на рост планктонных культур. Между тем, среди антибиопленочных агентов такие вещества являются скорее исключением, чем правилом. Этот подход при поиске антибиопленочных агентов приводит к неизбежному ошибочному игнорированию тех соединений, которые потенциально могли бы оказаться весьма полезными при борьбе с микробными биопленками.
По аналогии с классическим, давно существующим термином “антимикробные” агенты, к которым (независимо от механизма их действия) принято относить любые вещества, подавляющие рост планктонных культур микроорганизмов (поскольку понятие биопленки появилось позднее), мы считаем логичным и обоснованным называть “антибиопленочными” агентами любые вещества, препятствующие росту биопленок, независимо от того, подавляют ли они также рост планктонных культур микроорганизмов. Эта точка зрения в последнее время получает все большую экспериментальную поддержку. Можно сослаться, например, на недавно опубликованные статьи, посвященные ингибиторному действию производных тиазолидиона – ингибитора гистидинкиназы YycG, которые авторы рассматривают как перспективные антибиопленочные агенты, хотя эти вещества подавляют рост планктонных культур Staphylococcus epidermidis при тех же концентрациях (6–25 мкМ), что и рост биопленок (Huang et al., 2012; Liu et al., 2015). Более того, производные фуранонов, которые считаются классическими антибиопленочными агентами, подавляющими необходимую для формирования биопленок систему quorum sensing, во многих случаях препятствуют росту и планктонных культур этих же микроорганизмов. Например, сульфанильные производные 2(5Н)-фуранона подавляют рост планктонных культур S. aureus при более низких концентрациях (20 мкг/мл), чем рост биопленок этого микроорганизма (40 мкг/мл) (Sharafutdinov et al., 2017). Серия экспериментов, проведенных с другими производными фуранонов, показала, что наибольшей способностью подавлять формирование биопленок обладают те производные, которые проявляют наибольшую ингибиторную активность в отношении их планктонных культур (Das et al., 2016). Таким образом, как и многие другие исследователи, мы считаем, что антибиопленочными агентами следует называть любые биоцидные вещества, которые подавляют рост или развитие микробных биопленок. Если данные вещества также способны подавлять рост планктонных культур микроорганизмов, это свойство придает им дополнительные преимущества в борьбе с микробными инфекциями.
Для поиска антибиопленочных агентов, прежде всего, нужно понимать причины повышенной устойчивости к биоцидам микробных биопленок, по сравнению с планктонными культурами этих же микроорганизмов. Новейшие данные по этой проблеме изложены в недавно опубликованном обзоре (Hall, Mah, 2017). Как уже было показано в ранних работах, одним из главных факторов устойчивости является внеклеточный полимерный матрикс (ВПМ), экранирующий локализованные в биопленке микробные клетки от стрессовых воздействий как химической, так и физико-химической природы (Стрелкова и соавт., 2013; Tseng et al., 2013). Поэтому нарушение структуры матрикса является одним из наиболее эффективных способов борьбы с биопленками, а при поиске антибиопленочных агентов в первую очередь следует уделять внимание веществам, препятствующим синтезу компонентов ВПМ или нарушающим его архитектуру.
Исходя из этих соображений, по нашему мнению, антибиопленочные агенты можно подразделить на 4 основных класса. Общая схема действия агентов на разных этапах формирования биопленки представлена на рис. 1.
Рис. 1.
Общая схема действия агентов на разных этапах формирования биопленки. Номерами обозначены классы антибиопленочных агентов.
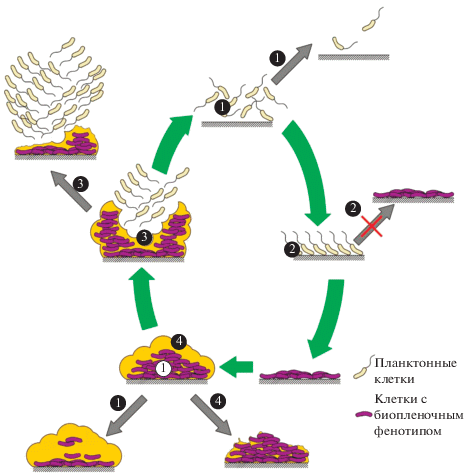
Во-первых, существуют антибиопленочные агенты (в том числе (класс 1) некоторые антибиотики), способные проникать через ВПМ и подавлять рост клеток с “биопленочным” фенотипом. Они примерно в равной степени активны против планктонных культур и формирующихся биопленок (хотя их механизмы действия в этих случаях могут различаться). В отношении “зрелых” биопленок с сильно развитым матриксом их активность, разумеется, ниже. Примером может служить антибиотик азитромицин.
Во-вторых, это “классические” агенты, предотвращающие (класс 2) формирование биопленочного фенотипа (подавляющие экспрессию специфических генов, определяющих формирование “прикрепленного” способа существования). К ним относятся, в первую очередь, вещества, препятствующие функционированию глобальных регуляторных систем (системы “quorum sensing”, системы, зависимой от цикло-ди-ГМФ и др.) В идеальном случае такие вещества подавляют рост биопленок на начальных стадиях формирования “биопленочного” фенотипа (после накопления в популяции необходимых сигналов) и не должны влиять на рост и метаболизм планктонных культур, а также “зрелых” биопленок (если не обладают дополнительными ингибиторными механизмами). На практике этот класс антибиопленочных агентов очень гетерогенен. К нему относятся как ингибиторы, преимущественно подавляющие рост бактерий с биопленочным фенотипом, так и ингибиторы, преимущественно подавляющие синтез ВПМ. Многие из соединений, относящихся к этому классу, проявляют ингибиторную активность и в отношении планктонных культур микроорганизмов, в том числе, как мы уже отмечали, “классические” антибиопленочные вещества – фураноны, которые подавляют рост не только биопленок, но и планктонных культур, особенно в случае грамположительных бактерий.
В-третьих, отдельную группу антибиопленочных агентов (класс 3) составляют вещества, активирующие процесс естественной дисперсии как этапа развития зрелых биопленок. Примерами могут служить окись азота (NO), а также цис-2-деценовая кислота и некоторые другие вещества (Плакунов и соавт., 2017).
И, наконец, в-четвертых, это вещества, вызывающие принудительное (класс 4) разрушение “зрелых” биопленок. К ним относятся ферменты, гидролизующие биополимеры ВПМ (нуклеазы, протеиназы, полисахаридгидролазы), поверхностно-активные вещества (сурфактанты), а также некоторые малые молекулы, повышающие проницаемость ВПМ. Сами по себе они, как правило, не обладают заметными антимикробными свойствами, но делают микроорганизмы внутри биопленок доступными для биоцидов. В последнее время как средства борьбы со зрелыми биопленками привлекают большое внимание антимикробные пептиды, также входящие в данный класс агентов (Khozani et al., 2018).
Следует иметь в виду, что большинство из антибиопленочных агентов обладают комплексным воздействием на биопленки, включающим механизмы, характерные для агентов разных классов. Эта классификация подробно охарактеризована в нашем последнем обзоре (Плакунов и соавт., 2017).
По нашему мнению, подробно изученный нами никлозамид также относится ко второму типу антибиопленочных агентов. При выявлении метаболически активных клеток путем окрашивания МТТ (Плакунов и соавт., 2016) ингибиторное действие никлозамида в отношении биопленок было примерно в два раза выше, чем в отношении планктонных культур (Журина и соавт., 2017). В то же время, никлозамид прямо не подавлял биосинтез ВПМ. Синергидный ингибиторный эффект сочетания никлозамида с антибиотиком азитромицином указывает на то, что механизмы действия этих ингибиторов, скорее всего, различаются.
Другой, изученный нами ранее антибиопленочный агент – 4-гексилрезорцин преимущественно подавляет синтез матрикса биопленок и проявляет ингибиторную активность, синергидную с азитромицином в отношении грамположительных бактерий, т.е. также ведет себя как антибиопленочный агент второго типа (Mart’yanov et al., 2014).
К сожалению, большинство методов поиска антибиопленочных агентов настроены только на вещества второго класса, поскольку основаны на использовании для количественного определения роста биопленок красителя кристаллического фиолетового, который окрашивает как микробные клетки, так и компоненты ВПМ. Поскольку в большинстве биопленок в среднем лишь 20% массы составляют микробные клетки, а основная часть – это ВПМ, фактически о росте биопленок судят по накоплению матрикса. Синтез ВПМ может продолжаться даже если рост микробных клеток в биопленке в значительной степени подавлен. Так, например, обстоит дело в случае низких концентраций антибиотиков, которые стимулируют формирование матрикса (Mart’yanov et al., 2014; Morita et al., 2014). Использование конфокального микроскопа также не позволяет адекватно количественно оценить долю жизнеспособных клеток в биопленке. Таким образом, ценные антибиопленочные агенты, не нарушающие синтез ВПМ, но подавляющие жизнеспособность микроорганизмов в биопленке, могут быть потеряны при скрининге. Для того, чтобы не пропустить при поиске эти вещества, следует определять не только образование общей массы биопленки, но и жизнеспособность в ней микробных клеток. Например, как это описано в нашей методической статье (Плакунов и соавт., 2016), путем окрашивания биопленки метаболизируемыми тетразолиевыми красителями – (МТТ или другими). Можно также использовать газометрические методы: определение поглощения кислорода или выделения СО2. Кроме того, вести поиск антибиопленочных агентов нужно в присутствии бинарных препаратов, один из которых облегчает доступ биоцида внутрь биопленки (нарушает состав или архитектуру ВПМ), т.е. относится в антибиопленочным агентам четвертого класса.
Учитывая все эти обстоятельства, можно сформулировать особенности и преимущества предлагаемого нами подхода к поиску агентов, влияющих на формирование микробных биопленок. Некоторые из этих подходов уже частично реализуются также и другими исследователями.
1. Следует измерять не только рост биопленок, но и жизнеспособность (метаболическую активность) микроорганизмов в биопленках.
2. Проводить поиск следует, прежде всего, среди веществ (в том числе традиционных лекарственных средств, что упростило бы их применение в практике химиотерапии) на основе сходства механизмов их действия с регуляторами формирования биопленок.
3. При поиске, как правило, применять не планшеты, а фильтры из стекловолокна (Плакунов и соавт., 2016). Фильтры – также удобная модель для изучения фотодинамической инактивации биопленок. Фильтры облегчают количественное измерение КОЕ (материал фильтра выполняет роль абразива при диспергировании биопленок). Очень важно, что биопленка на фильтре может быть использована как адекватная модель раневых инфекций.
4. При поиске антибиопленочных агенов целесообразно использовать в качестве тест-объектов мультивидовые биопленки, аналогичные природным.
5. Для поиска следует использовать сочетания антибиопленочных (нарушающих синтез компонентов ВПМ или его архитектуру агентов четвертого типа) и биоцидных препаратов (антибиотиков).
6. При поиске не следует игнорировать наличие пробиопленочных агентов, которые обычно отсеиваются. Они могут быть полезными для биотехнологических процессов (например, при очистке сточных вод), а также как стимуляторы биосинтеза биопленочных биологически активных соединений (например, виолацеина; Мартьянов и соавт., 2018).
В качестве важнейшей перспективы дальнейшего исследования антибиопленочных агентов необходимо целенаправленно искать ингибиторы глобальных регуляторных систем, определяющих на уровне транскрипции переход к биопленочному фенотипу. Пока единственными более или менее удачными примерами являются ингибиторы QS-системы. Для системы цикло-ди-ГМФ (и других систем) таких аналогов еще нет. Необходимо также искать ингибиторы, подавляющие активность ферментов, катализирующих синтез ключевых компонентов ВПМ (адгезинов, компонентов углеводного и белкового скелета и т.д.). Применение предложенных подходов будет способствовать более успешному поиску препаратов и повысит наши возможности управления формированием (подавлением или стимуляцией) микробных биопленок.
ФИНАНСИРОВАНИЕ РАБОТЫРабота выполнена при частичном финансировании РФФИ , проект № 18-29-05048, а также Минобрнауки РФ.
Список литературы
Журина М.В., Ганнесен А.В., Мартьянов С.В., Тетенева Н.А., Штратникова В.Ю., Плакунов В.К. Никлозамид как перспективный антибиопленочный агент // Микробиология. 2017. Т. 86. № 4. С. 439–447.
Zhurina M.V., Gannesen A.V., Mart’yanov S.V., Teteneva N.A., Shtratnikova V.Y., Plakunov V.K. Niclosamide as a promising antibiofilm agent // Microbiology (Moscow). 2017. V. 86. P. 439–447.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. Мультивидовые биопленки в экологии, медицине и биотехнологии // Микробиология. 2015. Т. 84. № 6. С. 623–644.
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. Multispecies biofilms in ecology, medicine, and biotechnology // Microbiology (Moscow). 2015. V. 84. P. 731–750.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. № 4. С. 484–480.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509–513.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Управление формированием микробных биопленок: анти- и пробиопленочные агенты (обзор) // Микробиология. 2017. Т. 86. № 4. С. 402–420.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. Controlling of microbial biofilms formation: anti- and probiofilm agents // Microbiology (Moscow). 2017. V. 86. P. 423–438.
Стрелкова Е.А., Позднякова Н.В., Журина М.В., Плакунов В.К., Беляев С.С. Роль внеклеточного полимерного матрикса в устойчивости бактериальных биопленок к экстремальным факторам среды // Микробиология. 2013. Т. 82. № 2. С. 131–138.
Strelkova E.A., Pozdnyakova N.V., Zhurina M.V., Plakunov V.K., Belyaev S.S. Role of the extracellular polymer matrix in resistance of bacterial biofilms to extreme environmental factors // Microbiology (Moscow). 2013. V. 82. P. 119–125.
Das M.C., Paul S., Gupta P., Tribedi P., Sarkar S., Manna D., Bhattacharjee S. 3-Amino-4-aminoximidofurazan derivatives: small molecules possessing antimicrobial and antibiofilm activity against Staphylococcus aureus and Pseudomonas aeruginosa // J. Appl. Microbiol. 2016. V. 120. P. 842–859.
Hall C.W., Mah T.F. Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria // FEMS Microbiol. Rev. 2017. V. 41. P. 276–301.
Huang R.Z., Zheng L.K., Liu H.Y., Pan B., Hu J., Zhu T., Wang W., Jiang D.B., Wu Y., Wu Y.C., Han S.Q., Qu D. Thiazolidione derivatives targeting the histidine kinase YycG are effective against both planktonic and biofim-associated Staphylococcus epidermidis // Acta Pharmacol. Sinica. 2012. V. 33. P. 418–425.
Khozani R.S., Shahbazzadeh D., Harzandi N., Feizabadi M.M., Bagheri K.P. Kinetics study of antimicrobial peptide, melittin, in simultaneous biofim degradation and eradication of potent biofim producing MDR Pseudomonas aeruginosa isolates // Int. J. Peptide Res. Therap. 2018. https://doi.org/10.1007/s10989-018-9675-z
Liu H., Zhao Y., Zhao D., Gong T., Wu Y., Han H., Xu T., Peschel A., Han S., Qu D. Antibacterial and anti-biofilm activities of thiazolidione derivatives against clinical staphylococcus strains // Emerg. Microb. Infect. 2015. V. 4 (1):e1. https://doi.org/10.1038/emi.2015.1
Mart’yanov S.V., Zhurina M.V., El’Registan G.I., Plakunov V.K. Activation of formation of bacterial biofilms by azithromycin and prevention of this effect // Microbiology (Moscow). 2014. V. 83. P. 723–731.
Мартьянов С.В., Летаров А.В., Иванов П.А., Плакунов В.К. Стимуляция биосинтеза виолацеина в биопленках Chromobacterium violaceum под воздействием диметилсульфоксида // Микробиология. 2018. Т. 87. № 3. С. 325–329.
Mart’yanov S.V., Letarov A.V., Ivanov P.A., Plakunov V.K. Stimulation of violacein biosynthesis in Chromobacterium violaceum biofilms in the presence of dimethyl sulfoxide // Microbiology (Moscow). 2018. V. 87. P. 437–440.
Morita Y., Tomida J., Kawamura Y. Responses of Pseudomonas aeruginosa to antimicrobials // Front. Microbiol. 2014. V. 4. Article 422.
Saxena P., Joshi Y., Rawat K., Bisht R. Biofilms: architecture, resistance, quorum sensing and control mechanisms // Indian J. Microbiol. 2019. V. 59. P. 3–12.
Sharafutdinov I.S., Trizna E.Y., Baidamshina D.R., Ryzhikova M.N., Sibgatullina R.R., Khabibrakhmanova A.M., Latypova L.Z., Kurbangalieva A.R., Rozhina E.V., Klinger-Strobel M., Fakhrullin R.F., Pletz M.W., Bogachev M.I., Kayumov A.R., Makarewicz O. Antimicrobial effects of sulfonyl derivative of 2(5H)-furanone against planktonic and biofilm associated methicillin-resistant and -susceptible Staphylococcus aureus // Front. Microbiol. 2017. V. 8. Article 2246. https://doi.org/10.3389/fmicb.2017.02246
Tseng B.S., Zhang W., Harrison J.J., Quach T.P., Song J.L., Penterman J., Singh P.K., Chopp D.L., Packman A.I., Parsek M.R. The extracellular matrix protects Pseudomonas aeruginosa biofims by limiting the penetration of tobramycin // Environ. Microbiol. 2013. V. 15. P. 2865–2878.
Дополнительные материалы отсутствуют.


