Микробиология, 2019, T. 88, № 6, стр. 645-654
Физиология и геномные характеристики бактерии Geotoga petraea, выделенной из низкотемпературного нефтяного месторождения (Россия)
Е. М. Семенова a, Д. С. Груздев b, Т. П. Турова a, Т. Н. Назина a, *
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: nazina@inmi.ru
Поступила в редакцию 19.06.2019
После доработки 17.07.2019
Принята к публикации 29.07.2019
Аннотация
Бактерии порядка Thermotogales часто встречаются в высокотемпературных нефтяных пластах. Они обладают характерным наружным чехлом “тогой”. Бактерии рода Geotoga были выделены пока только из нефтяных пластов, представлены тремя штаммами, геномы которых не секвенированы, и имеется мало сведений об их внутривидовом фенотипическом разнообразии. Накопительная культура, анаэробно растущая на нефти, была получена из пластовой воды Восточно-Анзирского нефтяного месторождения (Россия). Методом высокопроизводительного секвенирования V3–V4 региона гена 16S рРНК в накопительной культуре были выявлены бактерии родов Tangfeifania (51% от общего числа последовательностей), Halanaerobium (36%), Arcobacter (10%) и Geotoga (3%). Из культуры был выделен штамм HO-Geo1, принадлежащий к известному виду Geotoga petraea (99.2% сходства генов 16S рРНК). Штамм представлен подвижными палочками, окруженными чехлом; растет анаэробно, сбраживает углеводы и белки с образованием уксусной кислоты, H2 и СО2, восстанавливает тиосульфат и элементную серу до сероводорода. В чистой культуре штамм не растет на нефти. Рост в широком интервале температуры (24–55°С, оптимум 47–50°С) и солености (0.2–140 г/л, оптимум 20–40 г/л) объясняет его обитание в низкотемпературном нефтяном пласте с высокоминерализованной пластовой водой. Геном штамма HO-Geo1, размером ~2.15 Мб, включает 2.057 генов, большинство из которых вовлечено в метаболизм белков, аминокислот и углеводов. Высокая галотолерантность штамма HO-Geo1 обусловлена присутствием генов адаптации к гиперосмотическому стрессу. Образование H2 детерминировано наличием генов всех четырех субъединиц НАДФ-зависимой дегидрогеназы. Вероятно, в нефтяном пласте бактерии рода Geotoga используют микробную биомассу и продукты биодеградации нефти, образуемые другими микроорганизмами, и способствуют коррозии металлического нефтепромыслового оборудования.
Микробные сообщества нефтяных пластов интенсивно изучаются в связи с их участием в биодеградации нефти, коррозии металлического нефтяного оборудования и возможностью применения в биотехнологиях повышения нефтеотдачи (Magot et al., 2000; Head et al., 2003; Gray et al., 2010; Liang et al., 2016). С использованием молекулярно-биологических методов, включая метагеномный анализ, получена обширная информация о составе микробных сообществ нефтяных пластов и их потенциальной активности (Bonch-Osmolovskaya et al., 2003; Li et al., 2017). Основным источником органического вещества для микроорганизмов нефтяных пластов является органическое вещество нефти и растворимые в пластовой воде соединения, в том числе жирные кислоты, ароматические и нафтеновые соединения и др. (Magot et al., 2000). Представители порядка Thermotogales являются обычными обитателями высокотемпературных нефтяных пластов (Magot et al., 2000; Gray et al., 2010). Основными субстратами для их роста являются сахара или сложные белковые соединения, поэтому остается неясным их место в микробной пищевой цепи в нефтяном пласте. В ходе метагеномного анализа проб пластовой воды из нефтяного месторождения на Аляске показано, что с увеличением температуры пласта снижается разнообразие микробного сообщества и потенциал биодеградации нефти (Hu et al., 2016). Нуклеотидные последовательности представителей порядка Thermotogales составляли около 1% от общего количества выявленных последовательностей. Реконструированный геном бактерии рода Thermotoga включал Fe-содержащую гидрогеназу, и авторы рассматривают термотог в качестве кандидатов на образование молекулярного водорода в подземном сообществе.
Порядок Thermotogales объединяет анаэробные органотрофные термофильные неспорообразующие палочковидные бактерии, окруженные наружным чехлом или “тогой”. Большинство представителей порядка способны сбраживать широкий ряд субстратов с образованием молекулярного водорода, а также восстанавливать тиосульфат и элементную серу до сероводорода. Гипертермофильные и умеренно термофильные термотоги выделены из разных местообитаний, таких как горячие источники, морские гидротермальные венты и нефтяные пласты. Из нефтяных пластов выделены и описаны бактерии родов Geotoga (Davey et al., 1993), Petrotoga (Davey et al., 1993; Lien et al., 1998; Miranda-Tello et al., 2007), Thermotoga (Fardeau et al., 1997), Kosmotoga (DiPippo et al., 2009), Oceanotoga (Jayasinghearachchi, Lal, 2011) и Pseudothermotoga (Bhandari, Gupta, 2014). Причем бактерии родов Geotoga и Petrotoga пока выделены только из нефтяных пластов, и вероятно, являются аборигенными обитателями этих подземных экосистем. В момент написания настоящей статьи род Geotoga включал всего 2 вида, G. petraea и G. subterranea (Davey et al., 1993). Геотоги являются умеренными термофилами с оптимумом роста при 50 и 45°С соответственно, способными расти при повышенной солености среды до 100 г NaCl/л. В составе рода описаны всего три штамма; геномы типовых штаммов G. petraea и G. subterranea пока не секвенированы, и мало сведений о внутривидовом фенотипическом разнообразии.
При микроскопировании накопительных культур, анаэробно растущих на нефти, выделенных из низкотемпературного Восточно-Анзирского нефтяного месторождения, встречались палочковидные клетки с чехлом, характерным для термотог.
Целью настоящей работы было изучить филогенетическое разнообразие анаэробной накопительной культуры, полученной из пластовой воды низкотемпературного нефтяного месторождения, выделить чистую культуру бактерий порядка Thermotogales, определить ее таксономическое положение, физиологию и геномные характеристики.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. Пробы пластовой воды были отобраны в июне 2016 г. из добывающей скважины 245D Восточно-Анзирского нефтяного месторождения (г. Набережные Челны, Татарстан, Россия). Месторождение разрабатывается с применением заводнения, в пласт нагнетается пресная вода, смешанная с пластовой высокоминерализованной водой хлоридно-натриевого типа, оставшейся после сепарации нефти. В результате общая соленость пластовой воды в пласте снижается с 186–245 до 12–72 г/л, pH 6.3. Скорость сульфатредукции в пробе пластовой воды из скважины 245D составляла 1982 нг S2–/(л сут), скорость метаногенеза из меченых NaH14CO3 и 2-14С-ацетата составляла 9045 и 0 нл СН4/(л сут) соответственно (Назина и соавт., 2017).
Состав сред и условия культивирования. Накопительную культуру HO-245D получали путем посева пластовой воды из скважины 245D в минеральную среду Зейкуса (Zeikus et al., 1975) со стерильной нефтью (0.5% об./об.), микроэлементами (Pfennig, Lippert, 1966) и дрожжевым экстрактом (0.5 г/л). Среду готовили в 100 мл стеклянных флаконах, заполненных 50 мл среды и герметично закрытых резиновыми пробками и металлическими колпачками. В качестве газовой фазы использовали аргон. Культивировали при температуре 28°С в стационарных условиях в темноте. Чистую культуру выделяли путем посева анаэробной накопительной культуры в среде RM следующего состава (г/л дистиллированной воды): NaCl – 20.0; МgCl2 · 2H2O – 18.0; Na2SO4 – 3.0; CaCl2 · 6H2O – 1.5; KCl – 0.5; NH4Cl – 0.33; NaHCO3 – 0.2; дрожжевой экстракт – 1.0; пептон – 5.0; цитрат железа – 0.02; Na2S · 9H2O – 0.2; 1 мл раствора микроэлементов (Pfennig, Lippert, 1966); pH 6.8–7.0. Среду готовили в пробирках Хангейта, аргон служил газовой фазой. Штамм HO-Geo1 выделяли методом последовательных пересевов культуры из наибольшего разведения в жидкую среду RM; посевы инкубировали при 47°C. Использование разных источников углерода определяли на среде RM (без пептона и цитрата железа), содержащей дрожжевой экстракт (0.2 г/л). Сахара, пептон, триптон, дрожжевой экстракт вносили в концентрации 0.5% (вес/об.), спирты, соли органических кислот – 0.2% (вес/об.), аминокислоты – 0.1–0.2% (вес/об.). Контролем служила инокулированная среда, но без соответствующего субстрата. В качестве акцепторов электронов использовали тиосульфат натрия (3.2 г/л) и элементную серу (10.0 г/л). Оптимум и интервалы солености для роста определяли в среде RM, содержащей: 0.5, 2, 2.5, 5.0, 7.5, 10.0, 12.5 и 15.0% (вес/об.) NaCl. Рост при разной температуре определяли в среде RM, содержащей 2.0% (вес/об.) NaCl после инкубирования в течение 7 сут. Рост определяли по наличию молекулярного водорода в газовой фазе, изменению количества белка в среде, образованию сероводорода и летучих кислот, а также микроскопированием. Спектр используемых субстратов и образуемых штаммом ферментов анализировали также с помощью наборов API 50CH и API ZYM (“Biomerieux”, France), согласно инструкции производителя. Штамм HO-Geo1 депонирован во Всероссийскую коллекцию микроорганизмов (ВКМ B-3300).
Микроскопические методы. Морфологию клеток изучали с помощью эпифлуоресцентного микроскопа Axio Imager.D1 (“Carl Zeiss”, Германия) с цифровой камерой Axio Cam HRc и компьютерным программным обеспечением Axio Vision. Ультратонкую структуру клеток изучали, как описано в статье (Назина, Пивоварова, 1979). Cрезы просматривали в просвечивающем электронном микроскопе JEM-100С (“Jeol”, Япония) при ускоряющем напряжении 80 kV.
Аналитические методы. Молекулярный водород, азот и метан в газовой фазе определяли хроматографическим методом; сероводород определяли колориметрически по методу Пахмайра с N,N-диметил-р-фенилендиамином, как описано ранее (Назина и соавт., 2017). Летучие кислоты и низшие спирты анализировали на газовом хроматографе Shimadzu GC 2010 Plus (Япония) с колонкой Zebron ZB-FFAP (30 м × 0.32 мм × 0.25 мкм). Анализ проводили с программированием температуры на колонке от 40 до 150°С, со скоростью изменения 10°С/мин. Температура испарителя и детектора составляла 250°С. В качестве газа-носителя использовали гелий, который подавали со скоростью 34 мл/мин.
Выделение ДНК, амплификация и секвенирование. ДНК из накопительной культуры HO-245D и из чистой культуры выделяли стандартным методом (Maniatis et al., 1982). Для определения чистоты культуры использовали стандартные бактериальные праймеры 8-27f и 1492r (Lane, 1991). Для получения библиотеки генов 16S рРНК накопительной культуры, выращенной на нефти, был амплифицирован V3–V4 гипервариабельный регион этого гена и на основе двойного баркодирования были приготовлены библиотеки, как описано ранее (Fadrosh et al., 2014). Смысловые участки праймеров были взяты в соответствии с парой праймеров Pro341F–Pro805R (Takahashi et al., 2014). Секвенирование проводили на платформе MiSeq (“Illumina”, США) c использованием набора реагентов MiSeq Reagent Kit v3 (600 cycles) (“Illumina”, США) в соответствии с рекомендациями производителя.
Биоинформатический анализ. Полученные фрагменты генов 16S рРНК были обрезаны с использованием программ trimmomatic-0.36 по алгоритму SLIDINGWINDOW:4:15 (Bolger et al., 2014). Разные прочтения объединяли программой SeqPrep (https://github.com/jstjohn/SeqPrep). Для обнаружения химер и демультиплексирования использовали фильтры Qiime (Caporaso et al., 2010). Последовательности c уровнем сходства ≥98% объединяли в операционные таксономические единицы (OTE) и идентифицировали с использованием онлайн-ресурса SILVA (Quast et al., 2014). Выравнивание последовательностей и филогенетическое дерево, включающее референтные последовательности генов 16S рРНК валидно описанных представителей семейства Petrotogac-eae, было выполнено с использованием пакета программ MEGA 7.0 (Kumar et al., 2016) на основании neighbor-joining алгоритма.
Функциональный анализ был выполнен с использованием сервера RAST (Rapid Annotations using Subsystems Technology, v. 2.0) (Aziz et al., 2008) и сервиса BlastKoala (Kanehisa et al., 2016).
Последовательности гена 16S рРНК и генома штамма HO-Geo1 депонированы в базе данных NCBI под номерами MK984240 и SRME01000001.1 соответственно. Библиотека фрагментов генов 16S рРНК накопительной культуры HO-245D депонирована в NCBI, проект PRJNA548274.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Филогенетическое разнообразие накопительной культуры, анаэробно растущей на нефти. Накопительную культуру HO-245D инкубировали в среде с нефтью при 28°С в стационарных условиях. После 7 мес. культивирования в газовой фазе был обнаружен молекулярный водород в концентрации около 3000 ppm, и в среде были детектированы уксусная (85 мг/л), пропионовая (21 мг/л) и изо-масляная (21 мг/л) кислоты. При микроскопировании культуры отмечено большое морфологическое разнообразие с преобладанием палочковидных клеток, различавшихся по длине, диаметру и подвижности, встречались клетки с чехлом. Накопительная культура HO-245D была исследована методом высокопроизводительного секвенирования гипервариабельного V3–V4 региона гена 16S рРНК. С использованием онлайн-ресурса SILVA было показано, что все полученные последовательности принадлежали представителям домена Bacteria и формировали 73 операционных таксономических единицы с уровнем сходства ≥98%. В полученной библиотеке преобладали последовательности бактерий филумов Bacteroidetes (род Tangfeifania, 51% последовательностей), Firmicutes (род Halanaerobium, 36%), Proteobacteria (класс Epsilonproteobacteria, род Arcobacter, 10%) и Thermotogae (род Geotoga, 3%) (табл. 1). Бактерии рода Tangfeifania (семейство Prolixibacteraceae) впервые были выделены из соленоводного озера и до настоящего времени в нефтяных пластах не обнаруживались (Liu et al., 2014). Род Tangfeifania представлен мезофильными, галотолерантными, факультативно-анаэробными бактериями, обладающими слабой ферментативной активностью, принадлежащими к одному виду T. diversioriginum. Анаэробных галоалкалофильных бактерий рода Halanaerobium часто обнаруживали в нефтяных пластах с высокоминерализованными водами, и показано их участие в образовании сероводорода и коррозии металлического оборудования (Ravot et al., 1997; Cluff et al., 2014; Liang et al., 2016). В геноме Halanaerobium hydrogeniformans определены гены, детерминирующие образование молекулярного водорода при сбраживании сахаров (Mormile, 2014). Бактерии рода Arcobacter также обнаруживали в составе микробных сообществ из месторождений нефти и газа (Evans et al., 2018). Род включает анаэробные и микроаэрофильные бактерии, способные к денитрификации и образованию сероводорода. Немногочисленные последовательности в библиотеке из накопительной культуры, растущей на нефти, принадлежали бактериям рода Geotoga, предложенного в статье (Davey et al., 1993). Эта статья остается единственной публикацией, посвященной описанию бактерий рода Geotoga. В связи с вышесказанным, была предпринята попытка выделить геотогу в чистую культуру.
Таблица 1.
Филогенетическое разнообразие представителей домена Bacteria в анаэробной накопительной культуре HO-245D, полученной на нефти, определенное методом высокопроизводительного секвенирования ампликонов гена 16S рРНК
| Филум, ближайший культивируемый родственник (% сходства генов 16S рРНК) | % от количества последовательностей в библиотеке* |
|---|---|
| Bacteroidetes, Tangfeifania (99) | 51 |
| Firmicutes, Halanaerobium (100) | 36 |
| Proteobacteria, Epsilonproteobacteria, Arcobacter (100) | 10 |
| Thermotogae, Geotoga (100) | 3 |
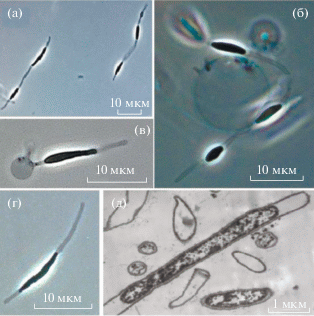
Выделение штамма HO-Geo1 и его морфологические и физиологические свойства. Чистую культуру штамма HO-Geo1 получали методом десятикратных разведений в жидкой среде RM с пептоном и дрожжевым экстрактом. Поскольку известные геотоги являются термотолерантными бактериями с оптимальной температурой роста около 45–50°С, бактерии выделяли при 47°С, что помогло в очистке культуры. Чистоту культуры контролировали микроскопированием и методом анализа гена 16S рРНК. Последовательность гена 16S рРНК штамма HO-Geo1 имела 100% сходства с последовательностью OTU_HO-245D из библиотеки накопительной культуры и 99.2% сходства с геном типового штамма G. petraea T5T, что позволило отнести выделенный штамм к этому виду (рис. 1). Осажденная биомасса чистой культуры имела светло-бежевый цвет. Клетки штамма HO-Geo1 были представлены палочками, размером 0.9–1.4 × 3.8–12.0 мкм, окруженными характерным чехлом – “тогой”, который незначительно расширял клетку (рис. 2а–2д). Клетки были подвижными в экспоненциальной фазе роста. В культуре встречались как одиночные клетки, так и цепочки до 5 клеток, объединенные общим чехлом. Штамм спор не образовывал. В стационарной фазе наблюдались сферы, характерные для представителей порядка Thermotogales (рис. 2в).
Рис. 1.
Филогенетическое дерево, основанное на анализе последовательностей генов 16S рРНК нового штамма G. petraea HO-Geo1, идентичного ему филотипа из накопительной культуры HO-245D (NCBI SRA, project PRJNA548274), анаэробно растущей на нефти, а также генов типовых штаммов видов рода Geotoga и других представителей семейства Petrotogaceae. Дерево построено с использованием алгоритма neighbor-joining. Масштаб показывает эволюционное расстояние, соответствующее 2 заменам на каждые 100 нуклеотидов. Цифрами показана достоверность ветвления на основании “bootstrap”-анализа 100 альтернативных деревьев (значимыми признаются значения больше 75%).
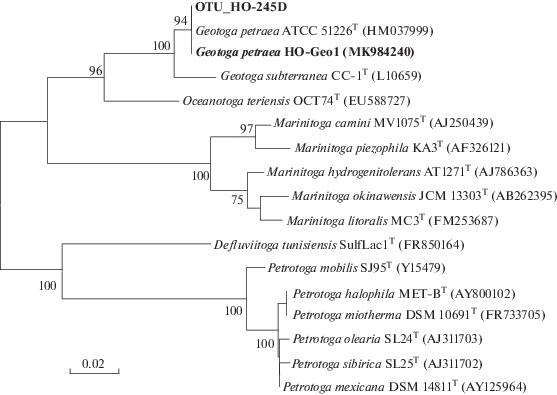
Рис. 2.
Морфология клеток штамма G. petraea HO-Geo1 (световой микроскоп Axio Imager.D1) (а–г) и ультратонкая структура клетки (д) (просвечивающий электронный микроскоп JEM-100С).
Штамм HO-Geo1 рос в интервале рН среды от 6.0 до 8.0 (оптимум 6.5–7.0), в широком интервале температуры – от 24 до 55°С (оптимум 47–50°С) и солености среды – от 0.2 до 140 г NaCl/л (оптимум 20–40 г/л) (рис. 3а, 3б; табл. 2). Штамм не нуждался в восстановителе и рос как в присутствии Na2S · 9H2O, так и без него. Внесение дрожжевого экстракта стимулировало рост.
Рис. 3.
Рост штамма HO-Geo1 при разном со-держа-нии NaCl в среде (а) и температуре инкубирования (б).
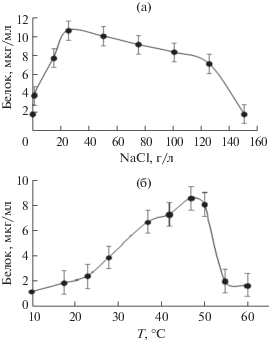
Таблица 2.
Диагностические признаки G. petraea HO-Geo1 и известных видов рода Geotoga
| Признак | G. petraea HO-Geo1 | G. petraea T5T | G. subterranea CC-1T |
|---|---|---|---|
| Размер клеток, мкм | 0.9–1.4 × 3.8–12.0 | 0.6 × 3–20 | 0.5 × 4–7.5 |
| Подвижность | + | + | + |
| Форма клеток | Палочки, до 5 клеток в цепочке, объединены чехлом | Палочки, до 5 клеток в цепочке, объединены чехлом | Палочки, одиночные или в парах, объединены чехлом |
| Образование сфер в стационарной фазе | + | + | + |
| Источники углерода для брожения: | |||
| Ацетат | – | – | – |
| Галактоза | + | + | + |
| Глюкоза | + | + | + |
| Крахмал | – | + | + |
| Ксилоза | + | – | – |
| Лактат | – | – | – |
| Лактоза | + | + | + |
| Мальтоза | – | + | + |
| Манноза | + | + | + |
| Раффиноза | – | – | – |
| Сахароза | + | + | + |
| Этанол | + | – | – |
| Продукты брожения глюкозы | Н2, СO2, ацетат, изопропанол, изо-валерат, этанол, пропионат, н-бутират | Н2, СО2, ацетат, этанол | Н2, СО2, ацетат, этанол |
| Восстановление серы и тиосульфата до сероводорода | + | + | + |
| Т, °C, min/opt/max | 24/47–50/55 | 30/50/55 | 30/45/60 |
| NaCl, min/opt/max, г/л | 0.2/20–40/140 | 5/20/100 | 5/40/100 |
| рН, min/opt/max | 6.0/6.5–7.0/ 8.0 | 5.5/6.5/9.0 | 5.5/6.5/9.0 |
| Г + Ц, мол. % | 29.4 | 29.5 | 29.9 |
| Источник выделения | Пластовая вода нефтяного месторождения (Татарстан, РФ) | Рассол нефтяного месторождения (Оклахома, Техас, США) | |
| Ссылка | Настоящая работа | Davey et al., 1993 | |
С использованием тест-системы API Zym у штамма HO-Geo1 была выявлена активность ряда ферментов, включая щелочную фосфатазу, эстеразу (С4), липазу (С8), кислую фосфатазу, нафтол-AS-BI-фосфогидролазу, α- и β-галактозидазы, β-глюкуронидазу, α-глюкозидазу. Отрицательный результат был показан для липазы (C14), лейцин ариламидазы, валин ариламидазы, цистеин ариламидазы, трипсина, α-химотрипсина, ß-глюкозидазы, N-ацетил-β-глюкозаминидазы, α‑маннозидазы и α-фукозидазы. С использованием китов API 50CH было показано образование кислот из N-ацетилглюкозамина, D-, L-арабинозы, D-галактозы, D-глюкозы, 2,5-кетоглюконата калия, D-, L-ксилозы, D-ликсозы, D-маннозы, D-рибозы, L-сорбозы, D-тагатозы, D-туранозы, D-фруктозы и эскулина. Кислоту штамм не образовывал из D-адонита, амигдалина, D-, L-арабита, арбутина, гентиобиозы, гликогена, глицерина, дульцита, инозита, инулина, глюконата калия, крахмала, ксилита, D-мальтозы, D-мелецитозы, метил-βD-ксилопиранозида, метил-αD-глюкопиранозида, метил-αD-маннопиранозида, D-маннита, L-рамнозы, салицина, D-сорбита, D-трегалозы, D-раффинозы и эритрита. Слабый рост отмечен на D-мелибиозе, D-, L-фукозе и D-целлобиозе. Кроме того, штамм HO-Geo1 использовал для роста дрожжевой экстракт, ксилан, лактозу, D-маннозу, пептон, сахарозу, триптон, этанол. Рост не наблюдался на аргинине, гистидине, глицине, лактате, лизине-HCl, метионине, орнитине и треонине. Показано образование сероводорода из тиосульфата и элементной серы при росте на рибозе или дрожжевом экстракте.
Основные продукты брожения глюкозы включали уксусную кислоту, молекулярный водород и CO2; в зависимости от времени культивирования были зарегистрированы также в небольшом количестве ацетон, этанол, изопропанол, пропионовая, н-масляная и изо-валериановая кислоты (табл. 2).
Проверен рост штамма HO-Geo1 в минеральной среде с нефтью и 45 г NaCl/л. После 90 сут инкубирования при 48°С была проанализирована фракция C10–C34 алканов по сравнению с таковой в стерильном контроле. Какие-либо существенные изменения спектра не были выявлены (данные не представлены).
В настоящее время в базе данных GenBank отсутствует геном типового штамма G. petraea T5T. В составе имеющегося в GenBank генома G. petraea штамма WG14 (BioProject PRJEB15679) отсутствует ген 16S рРНК, позволяющий определить его таксономическую принадлежность, и нет какой-либо опубликованной информации об этом штамме. Учитывая вышесказанное, а также способность выделенного штамма HO-Geo1 продуцировать большое количество молекулярного водорода при росте на разных субстратах в широком интервале температуры и солености, был секвенирован и аннотирован геном G. petraea HO-Geo1 (Grouzdev et al., 2019).
Характеристика генома G. petraea HO-Geo1. Геном G. petraea HO-Geo1 представлен 24 контигами, общим размером 2 150 220 п.н. (Г + Ц) состав, рассчитанный на основании геномной последовательности, составляет 29.4%. Число генов составило 2057, из них 1997 белок-кодирующих последовательностей. В геноме выявлено 52 гена РНК: 46 – тРНК, 3 – рРНК и 3 – нкРНК. В результате аннотирования генома G. petraea HO-Geo1 для большинства белок-кодирующих генов (76.8%) были предсказаны предполагаемые функции, а оставшиеся были аннотированы как гипотетические белки. Распределение генов между функциональными категориями COG (Clusters of Orthologous Groups) представлено в табл. 3.
Таблица 3.
Количество генов в геноме Geotoga petraea HO-Geo1, ассоциированных с основными функциональными категориями (COG)
| Код COG | Количество | % | Описание COG |
|---|---|---|---|
| A | 0 | 0.0 | Процессинг и модификация РНК |
| B | 2 | 0.1 | Структура и динамика хроматина |
| C | 111 | 5.6 | Производство и преобразование энергии |
| D | 22 | 1.1 | Контроль клеточного цикла, деление клеток, разделение хромосом |
| E | 136 | 6.8 | Аминокислотный транспорт и метаболизм |
| F | 72 | 3.6 | Нуклеотидный транспорт и метаболизм |
| G | 129 | 6.5 | Транспорт и метаболизм углеводов |
| H | 69 | 3.5 | Транспорт и метаболизм коферментов |
| I | 55 | 2.8 | Транспорт и метаболизм липидов |
| J | 190 | 9.5 | Трансляция, структура и биогенез рибосом |
| K | 95 | 4.8 | Транскрипция |
| L | 79 | 4.0 | Репликация, рекомбинация и репарация |
| M | 100 | 5.0 | Клеточная стенка/мембрана |
| N | 66 | 3.3 | Клеточная подвижность |
| O | 61 | 3.1 | Посттрансляционная модификация, белковый метаболизм, шапероны |
| P | 72 | 3.6 | Транспорт и обмен неорганических ионов |
| Q | 14 | 0.7 | Биосинтез, транспорт и катаболизм вторичных метаболитов |
| R | 160 | 8.0 | Только общее предсказание функции |
| S | 86 | 4.3 | Функция неизвестна |
| T | 112 | 5.6 | Механизмы передачи сигнала |
| U | 19 | 1.0 | Внутриклеточный оборот, секреция и везикулярный транспорт |
| V | 59 | 3.0 | Защитные механизмы |
| W | 0 | 0.0 | Внеклеточные структуры |
| X | 2 | 0.1 | Мобилом: профаги, транспозоны |
| Z | 0 | 0.0 | Цитоскелет |
| 286 | 14.3 | Не ассоциированы с COG |
В последовательности генома G. petraea HO-Geo1 было обнаружено относительно большое количество генов, отнесенных к функциональным категориям COG, связанным с трансляцией, структурой и биогенезом рибосом (9.5%), транспортом и метаболизмом аминокислот (6.8%), углеводов (6.5%), производством и преобразованием энергии (5.6%), а также с механизмами передачи сигналов (5.6%). Дальнейший анализ генома G. petraea HO-Geo1 показал, что он содержит полный набор генов необходимых для функционирования пентозофосфатного и Эмбдена–Мейергофа–Парнаса путей. Кроме того, в геноме были идентифицированы гены деградации галактозы по пути Лелуара и биосинтеза гликогена. Цикл трикарбоновых кислот и путь Энтнера–Дудорова являются неполными. Бактерия G. petraea HO-Geo1 способна расщеплять такие субстраты, как ксилоза, манноза и лактоза, что согласуется с присутствием в его геноме множества генов, кодирующих расщепление углеводов. Образование водорода, вероятно, опосредовано участием НАДФ-зависимой дегидрогеназы. В геноме G. petraea был найден генный кластер, белки которого являлись гомологами субъединицам НАДФ-зависимой дегидрогеназы Hnd Desulfovibrio fructosivorans (табл. 4).
Таблица 4.
Сравнение белков, потенциально ассоциированных с продукцией H2, идентифицированных в геноме Geotoga petraea HO-Geo1 с субъединицами НАДФ-зависимой дегидрогеназы Desulfovibrio fructosivorans DSM 3604
| Белок | Метка NCBI Locus | Desulfovibrio fructosivorans DSM 3604 | |||
|---|---|---|---|---|---|
| покрытие, % | e-значение | идентичность, % | идентификатор NCBI | ||
| HndA | E4650_07980 | 88 | 2E-51 | 45.8 | Q46505.1 |
| HndB | E4650_07975 | 98 | 3E-27 | 37.2 | Q46506.1 |
| HndC | E4650_07970 | 81 | 0.0 | 63.6 | Q46507.1 |
| HndD | E4650_07965 | 100 | 0.0 | 57.6 | Q46508.1 |
Высокая галотолерантность штамма HO-Geo1 обусловлена присутствием большого количества генов специализированных транспортеров осмопротекторов, связанных с классическими путями адаптации к гиперосмотическому стрессу: proX (E4650_01075, E4650_03990), proW (E4650_03995), proV (E4650_04000) и opuA (E4650_05540), opuBD (E4650_05535, E4650_05545), opuC (E4650_05360, E4650_05850). Информация, полученная в ходе анализа геномных данных, согласуется с экспериментальными результатами изучения фенотипических характеристик штамма HO-Geo1.
Сравнение основных диагностических признаков штамма HO-Geo1 и типового штамма G. petraea T5T показало, что штамм HO-Geo1 отличается отсутствием роста на крахмале и мальтозе и использованием ксилозы и этанола. Кроме того, G. petraea HO-Geo1 рос в более широком интервале температуры и солености среды, что объясняет его присутствие в низкотемпературном нефтяном пласте с высокоминерализованной пластовой водой. Отметим, что способность к росту в широком интервале температуры является особенностью как термофильных, так и мезофильных представителей порядка Thermotogales. Например, бактерия Mesotoga infera, выделенная из подземного хранилища газа, растет в интервале от 20 до 50°С с оптимумом при 37°С (Nesbø et al., 2012). Штамм HO-Geo1 не использовал н‑алканы нефти. В геноме также практически отсутствовали гены деградации ароматических соединений. Вероятно, в нефтяном пласте штамм использует микробную биомассу и продукты биодеградации нефти, образуемые другими компонентами микробного сообщества. Молекулярный водород, образуемый G. petraea HO-Geo1, служит субстратом для микроорганизмов или в присутствии тиосульфата или серы используется на их восстановление до сероводорода. Таким образом, бактерии рода Geotoga осуществляют сопряжение циклов углерода и серы и могут способствовать коррозии металлического нефтепромыслового оборудования.
Список литературы
Назина Т.Н., Пивоварова Т.А. Субмикроскопическая организация и спорообразование у Desulfotomaculum nigrificans // Микробиология. 1979. Т. 48. № 2. С. 302–306.
Nazina T.N., Pivovarova T.A. Submicroscopic organization and sporulation in Desulfotomaculum nigrificans // Microbiology (Moscow). 1979. V. 48. P. 302–306.
Назина Т.Н., Соколова Д.Ш., Бабич Т.Л., Семенова Е.М., Ершов А.П., Биджиева С.Х., Борзенков И.А., Полтараус А.Б., Хисаметдинов М.Р., Турова Т.П. Микроорганизмы низкотемпературных месторождений тяжелой нефти (Россия) и возможность их применения для вытеснения нефти // Микробиология. 2017. Т. 86. № 6. С. 748–761.
Nazina T.N., Sokolova D.Sh., Babich T.L., Semenova E.M., Ershov A.P., Bidzhieva S.Kh., Borzenkov I.A., Poltaraus A.B., Khisametdinov M.R., Tourova T.P. Microorganisms of low-temperature heavy oil reservoirs (Russia) and their possible application for enhanced oil recovery // Microbiology (Moscow). 2017. V. 86. P. 773–785.
Aziz R.K., Bartels D., Best A., DeJongh M., Disz T., Edwards R.A., Formsma K., Gerdes S., Glass E.M., Kubal M., Meyer F., Olsen G.J., Olson R., Osterman A.L., Overbeek R.A., McNeil L.K., Paarmann D., Paczian T., Parrello B., Pusch G.D., Reich C., Stevens R., Vassieva O., Vonstein V., Wilke A., Zagnitko O. The RAST Server: Rapid Annotations using Subsystems Technology // BMC Genomics. 2008. 9:75. https://doi.org/10.1186/1471-2164-9-75
Bhandari V., Gupta R.S. Molecular signatures for the phylum (class) Thermotogae and a proposal for its division into three orders (Thermotogales, Kosmotogales ord. nov. and Petrotogales ord. nov.) containing four families (Thermotogaceae, Fervidobacteriaceae fam. nov., Kosmotogaceae fam. nov. and Petrotogaceae fam. nov.) and a new genus Pseudothermotoga gen. nov. with five new combinations // Antonie van Leeuwenhoek. 2014. V. 105. P. 143–168.
Bolger A.M., Lohse M., Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data // Bioinformatics. 2014. V. 30. P. 2114–2120.
Bonch-Osmolovskaya E.A., Miroshnichenko M.L., Lebedinsky A.V., Chernyh N.A., Nazina T.N., Ivoilov V.S., Belyaev S.S., Boulygina E.S., Lysov Yu.P., Perov A.N., Mirzabekov A.D., Hippe H., Stackebrandt E., L’Haridon S., Jeanthon C. Radioisotopic, culture-based, and oligonucleotide microchip analyses of thermophilic microbial communities in a continental high-temperature petroleum reservoir // Appl. Environ. Microbiol. 2003. V. 69. P. 6143–6151.
Caporaso J.G., Kuczynski J., Stombaugh J., Bittinger K., Bushman F.D., Costello E.K., Fierer N., Peña A.G., Goodrich J.K., Gordon J.I., Huttley G.A., Kelley S.T., Knights D., Koenig J.E., Ley R.E., Lozupone C.A., McDonald D., Muegge B.D., Pirrung M., Reeder J., Sevinsky J.R., Turnbaugh P.J., Walters W.A., Widmann J., Yatsunenko T., Zaneveld J., Knight R. QIIME allows analysis of high-throughput community sequencing data // Nat. Methods. 2010. V. 7. P. 335–336.
Cluff M.A., Hartsock A., Macrae J.D., Carter K., Mouser P.J. Temporal changes in microbial ecology and geochemistry in produced water from hydraulically fractured marcellus shale gas wells // Environ. Sci. Technol. 2014. V. 48. P. 6508–6517.
Davey M.E., Wood W.A., Key R., Nakamura K., Stahl D.A. Isolation of three species of Geotoga and Petrotoga: two new genera, representing a new lineage in the bacterial line of descent distantly related to the “Thermotogales” // Syst. Ap-pl. Microbiol. 1993. V. 16. P. 191–200.
DiPippo J.L., Nesbø C.L., Dahle H., Doolittle W.F., Birkland N.-K., Noll K.M. Kosmotoga olearia gen. nov., sp. nov., a thermophilic, anaerobic heterotroph isolated from an oil production fluid // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 2991–3000.
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2(1). P. 6. https://doi.org/10.1186/2049-2618-2-6
Fardeau M.-L., Ollivier B., Patel B.K.C., Magot M., Thomas P., Rimbault A., Rocchiccioli F., Garcia J.-L. Thermotoga hypogea sp. nov., a xylanolytic, thermophilic bacterium from an oil-producing well // Int. J. Syst. Evol. Microbiol. 1997. V. 47. P. 1013–1019.
Evans M.V., Panescu J., Hanson A.J., Welch S.A., Sheets J.M., Nastasi N., Daly R.A., Cole D.R., Darrah T.H., Wilkins M.J., Wrighton K.C., Mouser P.J. Members of Marinobacter and Arcobacter influence system biogeochemistry during early production of hydraulically fractured natural gas wells in the Appalachian Basin // Front. Microbiol. 2018. V. 9. Article 2646. https://doi.org/10.3389/fmicb.2018.02646
Gray N.D., Sherry A., Hubert C., Dolfing J., Head I.M. Methanogenic degradation of petroleum hydrocarbons in subsurface environments remediation, heavy oil formation, and energy recovery // Adv. Appl. Microbiol. 2010. V. 72. P. 137–161.
Grouzdev D.S., Semenova E.M., Sokolova D.S., Tourova T.P., Poltaraus A.B., Nazina T.N. Draft genome sequence of Geotoga petraea strain HO-Geo1, isolated from a petroleum reservoir in Russia // Microbiol. Resour. Announc. 2019. V. 8. Article e00706-19. https://doi.org/10.1128/MRA.00706-19
Head I.M., Jones D.M., Larter S.R. Biological activity in the deep subsurface and the origin of heavy oil // Nature. 2003. V. 426. P. 344–352. https://doi.org/10.1038/nature02134
Hu P., Tom L., Singh A., Thomas B.C., Baker B.J., Piceno Y.M., Andersen G.L., Banfield J.F. Genome-resolved metagenomic analysis reveals roles for candidate phyla and other microbial community members in biogeochemical transformations in oil reservoirs // mBio. 2016. V. 7. Article e01669-15. https://doi.org/10.1128/mBio.01669-15
Jayasinghearachchi H.S., Lal B. Oceanotoga teriensis gen. nov., sp. nov., a thermophilic bacterium isolated from offshore oil-producing wells // Int. J. Syst. Evol. Microbiol. 2011. V. 61. P. 554–560.
Kanehisa M., Sato Y., Morishima K. BlastKOALA and GhostKOALA: KEGG tools for functional characterization of genome and metagenome sequences // J. Mol. Biol. 2016. V. 428. P. 726–731.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets // Mol. Biol. Evol. 2016. V. 33. P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Lane D.J. 16S/23S rRNA sequencing // Nucleic Acid Techniques in Bacterial Systematics / Eds. Stackebrandt E., Goodfellow M. New York: John Wiley & Sons, 1991. P. 115–175.
Li X.X., Mbadinga S.M., Liu J.F., Zhou L., Yang S.Z., Gu J.D., Mu B.Z. Microbiota and their affiliation with physiochemical characteristics of different subsurface petroleum reservoirs // Int. Biodeterior. Biodegr. 2017. V. 120. P. 170–185.
Liang R., Davidova I.A., Marks C.R., Stamps B.W., Harriman B.H., Stevenson B.S., Duncan K.E., Suflita J.M. Metabolic capability of a predominant Halanaerobium sp. in hydraulically fractured gas wells and its implication in pipeline corrosion // Front. Microbiol. 2016. V. 7. Article 988. https://doi.org/10.3389/fmicb.2016.00988
Lien T., Madsen M., Rainey F.A., Birkeland N.K. Petrotoga mobilis sp. nov., from a North Sea oil-production well // Int. J. Syst. Bacteriol. 1998. V. 48. P. 1007–1013.
Liu Q.-Q., Li X.-L., Rooney A.P., Du Z.-J., Chen G.-J. Tangfeifania diversioriginum gen. nov., sp. nov., a representative of the family Draconibacteriaceae // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 3473–3477.
Magot M., Ollivier B., Patel B.K.C. Microbiology of petroleum reservoirs // Antonie van Leeuwenhoek. 2000. V. 77. P. 103–116. https://doi.org/10.1023/A:1002434330514
Maniatis T., Fritsh E.F., Sambrook J., Engel J. Molecular Cloning: A Laboratory Manual. New York: Cold Spring Harbor Laboratory Press, 1982.
Miranda-Tello E., Fardeau M.-L., Joulian C., Magot M., Thomas P., Tholozan J.-L., Ollivier B. Petrotoga halophila sp. nov., a thermophilic, moderately halophilic, fermentative bacterium isolated from an offshore oil well in Congo // Int. J. Syst. Evol. Microbiol. 2007. V. 57. P. 40–44.
Mormile M.R. Going from microbial ecology to genome data and back: studies on a haloalkaliphilic bacterium isolated from Soap Lake, Washington State // Front. Microbiol. 2014. V. 5. Article 628. https://doi.org/10.3389/fmicb.2014.00628
Nesbø C.L., Bradnan D.M., Adebusuyi A., Dlutek M., Petrus A.K., Foght J., Doolittle W.F., Noll K.M. Mesotoga prima gen. nov., sp. nov., the first described mesophilic species of the Thermotogales // Extremophiles. 2012. V. 16. P. 387–393.
Pfennig N., Lippert K.D. Über das vitamin B12 – bedürfnis phototropher schweferelbakterien // Arch. Microbiol. 1966. V. 55. P. 245–256.
Quast C., Pruesse E., Yilmaz P., Gerken J., Schweer T., Yarza P., Peplies J., Glöckner F.O. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools // Nucleic Acids Res. 2013. V. 41 (Database issue). P. D590−D596.
Ravot G., Magot M., Ollivier B., Patel B.K., Ageron E., Grimont P.A., Thomas P., Garcia J.L. Haloanaerobium congolense sp. nov., an anaerobic, moderately halophilic, thiosulfate- and sulfur-reducing bacterium from an African oil field // FEMS Microbiol. Lett. 1997. V. 147. P. 81–88. https://doi.org/10.1111/j.1574-6968.1997.tb10224.x
Takahashi S., Tomita J., Nishioka K., Hisada T., Nishijima M. Development of a prokaryotic universal primer for simultaneous analysis of Bacteria and Archaea using next-generation sequencing // PLoS One. 2014. V. 9. Article e105592.
Zeikus J.G., Weimer P.J., Nelson D.R. Daniels L. Bacterial methanogenesis: acetate as a methane precursor in pure culture // Arch. Microbiol. 1975. V. 104. P. 129–134.
Дополнительные материалы отсутствуют.


