Микробиология, 2019, T. 88, № 6, стр. 744-748
Влияние температуры на таксономическую структуру бактериальных сообществ почв при разложении лесного опада
Е. Н. Тихонова a, *, Е. В. Менько a, Р. В. Уланова a, Х. Ли b, И. К. Кравченко a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ биотехнологии РАН
119071 Москва, Россия
b Институт прикладной экологии АН КНР
110016 Шэньян, КНР
* E-mail: katerina_inmi@mail.ru
Поступила в редакцию 24.04.2019
После доработки 03.07.2019
Принята к публикации 29.07.2019
Аннотация
В инкубационных экспериментах изучено влияниe температуры на сукцессионные изменения сапротрофного бактериального сообщества серой лесной почвы в ходе разложения листьев и веток осины. Продемонстрирована стабильность структуры микробного сообщества при повышении температуры и выявлено доминирование Beta- и Gammaproteobacteria, а также Actinobacteria и Firmicutes. В то же время снижение температуры приводило к уменьшению бактериального разнообразия и монодоминированию психротолерантных представителей Janthinobacterium.
В наземных экосистемах значительная часть первичной продукции растений поступает в почву в виде свежего растительного материала, образуя детритный пул как доступный субстрат для почвенной фауны и микроорганизмов и основной материал для образования почвенного гумуса (Didion et al., 2014). В смешанных лесах Московской области величина листового опада за год составляет 2.2–7.0 т га–1 или 20–80% от величины первичной продукции (Ведрова, 1997).
Микроорганизмы являются основными участниками биогеохимических процессов в наземных экосистемах, регулируя разложение растительных остатков и поступление в почву питательных веществ, а также обмен парниковых газов в системе почва–атмосфера (Bani et al., 2018). Несмотря на значимость этих процессов в функционировании экосистем, до настоящего времени отсутствует целостное понимание того, как глобальное потепление климата может влиять на микробные сообщества почв, участвующие в этих процессах. Ряд авторов подчеркивает ведущую роль климатических факторов в регуляции разложения растительного опада (Herrmann, Bauhus, 2013), в то время как другие считают определяющим качество растительного субстрата (Herrmann et al., 2015).
В настоящее время накоплен большой объем информации о роли почвенных микроорганизмов в разложении опада в лесах бореального пояса, и значительная часть исследований посвящена анализу микромицетов. Грибы рассматриваются как основные участники этого процесса, так как образуют широкий спектр внеклеточных ферментов, позволяющих эффективно разлагать различные фракции растительного материала (Krishna, Mohan, 2017).
В последние годы наблюдается возрастающий интерес к изучению почвенных бактерий – важного, но малоизученного компонента гидролитических микробных сообществ лесных почв. Бактерии активно участвуют в разложении не только растительных остатков, но и отмершего мицелия грибов, а также играют ведущую роль в почвенных процессах циклов углерода, азота и фосфора.
Для оценки сукцессионных изменений в структуре микробных сообществ перспективным является метод, основанный на анализе модельной группы бактерий, представители которой обладают определенными характеристиками и способны расти на одной питательной среде. При этом становится возможным определение доли разных таксонов бактерий и анализ сообщества с помощью общепринятых синэкологических показателей. В качестве такой модели в почвенной микробиологии широко применяется комплекс сапротрофных аэробных и факультативно-анаэробных бактерий, растущих на глюкозо-пептонно-дрожжевой среде (ГПД), которые участвуют в трансформации растительных остатков (Добровольская и соавт., 1997).
Мы предположили, что глобальное повышение температуры и увеличение активности деструктивных процессов в лесных почвах изменяет состав бактериальных сообществ и приводит к возрастанию их разнообразия.
Целью настоящей работы было оценить влияние температуры на сукцессионные изменения структуры сапротрофного бактериального сообщества серой лесной почвы в ходе разложения листьев и веток осины в контролируемых условиях, моделирующих процесс глобального потепления, в ходе годового цикла наблюдения.
Для экспериментальной проверки этого предположения в марте 2018 года была заложена серия аэробных микрокосмов почв вторичного мелколиственного леса (54.8° N; 37.6° E, Московская область, Серпуховской район, правобережье реки Ока), позволяющих смоделировать годовой цикл превращения растительных остатков. Растительность древесного яруса на экспериментальном участке была представлена кленом остролистным (Acer platanoides), березой (Betula sp.), осиной (Populus tremola) и ольхой (Alnus). Почва была охарактеризована как серая лесная суглинистая на покровных суглинках, подстилаемых мореной (Gleyic Phaeozems).
Микрокосмы, заложенные в шестикратной повторности, инкубировали в течение 360 сут в термостатах при трех температурных режимах, моделирующих среднюю температуру в весенние и осенние месяцы в южном Подмосковье (2°С), среднюю температуру в летний период (12°С) и глобальное повышение температуры(22°С). Для выяснения агентов трансформации растительных остатков в почву были внесены измельченные до размера <0.5 мм фрагменты опавших листьев и тонких веток клена остролистного (5% от веса почвы). В течение всего периода инкубации контролировали и поддерживали влажность почв на уровне 25% вес. (60% полной влагоемкости).
Один раз в месяц проводили определение численности и таксономического состава бактерий сапротрофного блока методом посева на агаризованную ГПД с добавлением циклогексимида, предупреждающего развитие грибов (Добровольская и соавт., 1997), а также определение количества бактериальных клеток методом прямого микроскопирования с люминесцентным флуорохромом (Методы почвенной микробиологии и биохимии, 1991). Для различных стадий сукцессии был рассчитан коэффициент Кс, который отражает отношение численности бактерий, учитываемых прямым счетом, к количеству бактерий, учтенных по числу КОЕ на среде ГПД. На основании анализа состава бактериальных комплексов были определены доминирующие культуры, определена их таксономическая принадлежность методом секвенирования нуклеотидных последовательностей гена 16S рРНК и динамика численности в ходе инкубации.
Количественные характеристики микробной биомассы являются одним из основных параметров, который отражает увеличение микробной активности при разложении сложных органических соединений. Проведенные исследования показали, что внесение листового и древесного опада не приводило к существенному повышению численности КОЕ бактерий (рис. 1), а также количества бактерий и величины микробной биомассы (табл. 1) для всех исследованных температур. Возможной причиной может быть недостаток доступного для микроорганизмов азота. Соотношение C : N в материале листьев и веток составляло 46.45 и 63.08 соответственно.
Рис. 1.
Динамика численности в почвенных микрокосмах культивируемых сапротрофных бактерий в зависимости от температуры инкубации в ходе сукцессии, инициированной внесением материала листьев и веток. 1 – внесение листового опада; 2 – контроль, без внесения субстрата; 3 – внесение древесного опада.
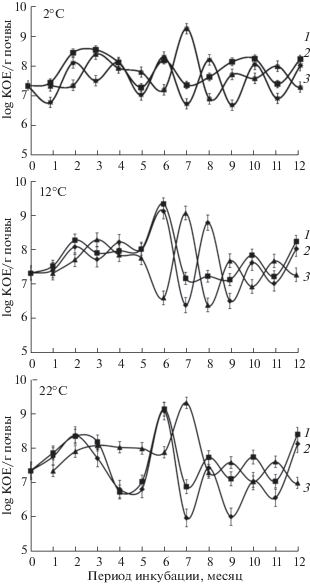
Таблица 1.
Характеристики микробных сообществ почв в зависимости от температуры, внесенного субстрата и стадии сукцессии
| Температура инкубации | 2°С | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Вариант опыта | Контроль | Листья | Ветки | |||||||
| Время инкубации, мес. | 0 | 1 | 6 | 12 | 1 | 6 | 12 | 1 | 6 | 12 |
| Количество бактериальных клеток, ×109 г–1 | 52 | 73 | 78 | 84 | 72 | 93 | 89 | 85 | 74 | 103 |
| Микробная биомасса мкг/г | 11.6 | 11.3 | 34.2 | 37.1 | 15.7 | 41 | 39 | 18.7 | 32.5 | 45.5 |
| Индекс разнообразия Шеннона | 4.12 | 4.00 | 4.08 | 3.89 | 3.31 | 3.86 | 3.31 | 3.73 | 3.28 | 3.20 |
| Коэффициент сукцессии (Кс) | 855 | 858 | 838 | 841 | 264 | 621 | 521 | 385 | 410 | 382 |
| 12°С | ||||||||||
| Контроль | Листья | Ветки | ||||||||
| Время инкубации, мес. | 1 | 6 | 12 | 1 | 6 | 12 | 1 | 6 | 12 | |
| Количество бактериальных клеток, ×109 г–1 | 73 | 90 | 98 | 74 | 87 | 83 | 67 | 76 | 91 | |
| Микробная биомасса мкг/г | 7.9 | 39.5 | 43.6 | 16.4 | 38.2 | 36.4 | 14.8 | 33.5 | 40.1 | |
| Индекс разнообразия Шеннона | 4.28 | 3.86 | 4.02 | 3.89 | 4.14 | 4.06 | 3.88 | 4.15 | 4.16 | |
| Коэффициент сукцессии (Кс) | 795 | 748 | 759 | 218 | 510 | 486 | 248 | 635 | 827 | |
| 22°С | ||||||||||
| Контроль | Листья | Ветки | ||||||||
| Время инкубации, мес. | 1 | 6 | 12 | 1 | 6 | 12 | 1 | 6 | 12 | |
| Количество бактериальных клеток, ×109 г–1 | 65 | 100 | 81 | 77 | 78 | 91 | 71 | 78 | 77 | |
| Микробная биомасса мкг /г | 14.4 | 43.8 | 35.7 | 16.9 | 34.4 | 39.9 | 15.5 | 34.4 | 33.8 | |
| Индекс разнообразия Шеннона | 4.01 | 4.20 | 4.16 | 3.96 | 4.36 | 4.60 | 4.04 | 4.26 | 4.35 | |
| Коэффициент сукцессии (Кс) | 720 | 829 | 780 | 319 | 355 | 377 | 391 | 542 | 691 | |
Сукцессионные исследования во многом объясняют биодинамику почв, поэтому широко используются в почвенной микробиологии. Несмотря на микрозональность почв, сукцессионные события проходят синхронно, если вызывающий сукцессию агент действует одновременно во всей почвенной массе. Метод посева на питательные среды позволяет выявить только небольшую часть почвенных микроорганизмов и дает преимущественно информацию о так называемых r-стратегах. Для индикации стадий микробной сукцессии перспективным представляется применение коэффициента сукцессии (Кс). Внесение субстратов (листья, ветки) привело к снижению величины Кс через 1 мес. инкубации (табл. 1), что может быть связано с падением разнообразия микроорганизмов в системе и увеличением доли быстрорастущих бактерий (r-стратегов). Через 6 мес. величина показателя Кс возросла, что указывает на изменение сообщества и прохождение стадий сукцессии, где преобладают микроорганизмы с К-стратегией (табл. 1). Высокие значения коэффициента в вариантах опыта без внесения субстрата могут быть связаны с наличием микроорганизмов, которые не учитываются на среде ГПД, а также большим количеством медленно растущих форм, клеток, находящихся в состоянии стресса, включая голодание, а также некультивируемых клеток.
В ходе микробного разложения качество листового опада изменяется за счет потери легкодоступных углеродных соединений, что вызывает сукцессионные изменения в составе микробного сообщества. Оценка показателей индекса микробного разнообразия Шеннона в образцах с внесением материала листьев и веток показала, что повышение температуры не приводило к его увеличению, а снижение температуры значительно снижало (табл. 1).
Анализ таксономической структуры бактериальных комплексов выявил доминирование Beta- и Gammaproteobacteria, а также Actinobacteria и Firmicutes. Это совпадает с литературными данными об основных бактериальных филах, участвующих в разложении древесного опада (Tlaskal et al., 2016). Доминирующие культуры были выделены и идентифицированы до вида на основании метода 16S рДНК, и была прослежена динамика их численности в ходе инкубации.
Установлено, что в ходе процесса разложения опада происходит смена бактерий, ответственных за различные стадии разложения растительного материала. На ранних стадиях сукцессии детектировались организмы, обладающие способностью использовать низкомолекулярные органические соединения, в частности, представители Xanthomonadaceae, к которым относится изолят Stenotrophomonas rhizophila (номер депонирования GenBank MK 804606), доля которого составляла 30–70% в первые два месяца инкубации, независимо от температуры. Для других доминирующих культур наблюдали иную картину.
На рис. 2 в качестве примера представлены данные для трех бактерий. Для актинобактерий, идентифицированных как Microbacterium (MK804605), увеличение температуры привело к значительному возрастанию показателей обилия на средних сроках сукцессии, которое достигало от 20 до более чем 50% при разложении материала листьев.
Рис. 2.
Изменение в микрокосмах показателей обилия некоторых доминантных видов почвенных бактерий в ходе сукцессии, инициированной внесением материала листьев и веток; инкубация при: 1 – 12°С; 2 – 2°С; 3 – 22°С.
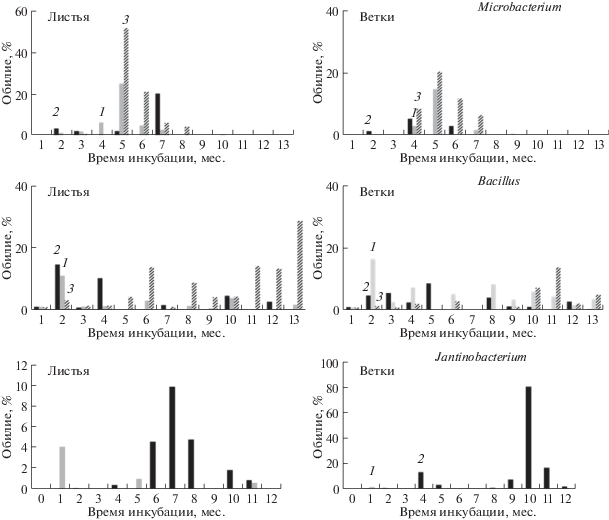
Бактерии, идентифицированные как представители рода Janthinobacterium (MK804601), являются минорным компонентом микробных сообществ при повышенной температуре, и их обилие составляет менее 1%. Однако при низкотемпературном разложении опада наблюдается значительное (в десятки раз) возрастание их обилия, а на поздних стадиях разложения материала веток (10 мес.), они составляют 80% от всех КОЕ на среде ГПД.
Бактерии рода Bacillus (MK804602) составляют существенную часть микробного сообщества (15–20%) на всех этапах разложения растительного опада. Интересно отметить, что как Janthinobacterium, так и Bacillus обладают хитинолитической активностью и могут принимать участие в разложении биомассы мицелиальных грибов, клеточные стенки которых содержат хитин.
Наше предположение о влиянии температуры на разнообразие бактериальных сообществ не получило подтверждения и, вероятно, в условиях глобального потепления температура не станет предиктором изменений состава бактериального комплекса, даже с учетом возрастания потоков углерода. Таким образом, была продемонстрирована стабильность структуры микробного сообщества, как с повышением температуры, так и с увеличением поступления углерода в почвы бореальных лесов. В то же время, снижение температуры приводит к уменьшению бактериального разнообразия и монодоминированию психротолерантных бактерий.
Список литературы
Ведрова Э.Ф. Разложение органического вещества лесных подстилок // Почвоведение. 1997. № 2. С. 216–223.
Добровольская Т.Г., Чернов И.Ю., Звягинцев Д.Г. О показателях структуры бактериальных сообществ // Микробиология. 1997. Т. 66. № 3. С. 408–414.
Dobrovol’skaya T.G., Chernov I.Yu., Zvyagintsev D.G. Characterizing the structure of bacterial communities // Microbiology (Moscow). 1997. V. 66. P. 342–348.
Методы почвенной биохимии и микробиологии / Под ред. Звягинцева Д.Г. М.: Изд-во Московского ун-та, 1991. 304 с.
Bani A., Piolia S., Venturaa M., Panzacchia P., Borruso L., Tognetti R., Tonona G., Brusettia L. The role of microbial community in the decomposition of leaf litter and deadwood // Appl. Soil Ecol. 2018. V. 126. P. 75–84.
Didion M., Frey B., Rogiers N., Thürig E. Validating tree litter decomposition in the Yasso07 carbon model // Ecol. Model. 2014. V. 291. P. 58–68.
Herrmann S., Bauhus J. Effects of moisture, temperature and decomposition stage on respirational carbon loss from coarse woody debris (CWD) of important European tree species // Scand. J. For. Res. 2013. V. 28. P. 346–357.
Herrmann S., Kahl T., Bauhus J. Decomposition dynamics of coarse woody debris of three important central European tree species // For. Ecosyst. 2015. V. 2 (27). P. 1–14.
Krishna M.P., Mohan M. Litter decomposition in forest ecosystems: a review // Energ. Ecol. Environ. 2017. V. 2. P. 236–249.
Tlaskal V., Voriskova J., Baldrian P. Bacterial succession on decomposing leaf litter exhibits a specific occurrence pattern of cellulolytic taxa and potential decomposers of fungal mycelia // FEMS Microbiol. Ecol. 2016. V. 92 (11). P. 1–10. pii: fiw177. https://doi.org/10.1093/femsec/fiw177
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


