Микробиология, 2020, T. 89, № 2, стр. 247-251
Генетический контроль деструкции epsilon-капролактама, толуола и мета-ксилола у штамма Pseudomonas putida CT3
Т. З. Есикова a, *, А. Б. Гафаров a, Т. О. Анохина a
a Федеральный исследовательский центр “Пущинский научный центр биологических исследований РАН”, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, Россия
* E-mail: das3534@rambler.ru
Поступила в редакцию 26.07.2019
После доработки 23.10.2019
Принята к публикации 01.11.2019
Аннотация
Из активного ила городских очистных сооружений был выделен бактериальный штамм CT3, обладающий уникальной способностью разлагать антропогенные токсичные соединения ε-капролактам, толуол и мета-ксилол в качестве единственных источников углерода и энергии. На основании секвенирования и филогенетического анализа гена 16S pРHK изолят был идентифицирован как представитель вида Pseudomonas putida. Установлено, что штамм P. putida СТ3 содержит конъюгативную мегаплазмиду размером около 550 т.п.н., детерминирующую деструкцию ε-капролактама до интермедиатов цикла Кребса. Гены, кодирующие окисление толуола и мета-ксилола по TOL-пути, локализованы на хромосоме.
Микробная деградация играет существенную роль в процессах детоксикации устойчивых поллютантов, загрязняющих окружающую среду в результате практической деятельности человека. Способность к деградации широкого спектра органических соединений, в том числе, токсичных ксенобиотиков, особенно характерна для бактерий рода Pseudomonas. Многие природные штаммы псевдомонад несут плазмиды биодеградации, которые, как правило, детерминируют расщепление одного типа соединений. Эти плазмиды контролируют катаболизм бактериями таких соединений, как, например, салицилат, нафталин, ε-капролактам, камфора, октан, толуол, ксилол и т.д. (Shintani et al., 2010; Smalla et al., 2015).
ε-Капролактам (циклический амид 6-аминогексановой кислоты, КАП) – один из наиболее востребованных на мировом рынке химических продуктов, который используется в качестве сырья для производства поликапролактама, более известного как нейлон-6 (Esikova et al., 2012). Ранее нами было показано, что способность бактерий рода Pseudomonas утилизировать капролактам детерминируется плазмидами (САР плазмидами), которые содержат генетическую информацию, необходимую для полной минерализации ксенобиотика (Есикова и соавт., 2015). Если всего несколько десятилетий назад бактериальных деструкторов КАП выделяли лишь из почв, контактирующих со сточными водами производств КАП и нейлона-6, то в последние годы, так же как и в настоящей работе, деструкторов ксенобиотика находят даже в почвах с неспецифическим загрязнением (Панов и соавт., 2013). Возможно, распространению и селекции признака утилизации КАП среди почвенных бактерий, удаленных от стоков химических производств, способствует загрязнение окружающей среды продуктами полимеризации КАП (каркасы авто- и авиапокрышек, рыболовные сети, одежда и т.п.), а также конъюгационный перенос САР плазмид.
В условиях комплексного загрязнения почв совмещение у микроорганизмов нескольких катаболических оперонов в составе одного мобильного генетического элемента обеспечивает определенное конкурентное преимущество их обладателям. Ранее нами были охарактеризованы штаммы псевдомонад, способные утилизировать капролактам и салицилат в качестве единственных источников углерода и энергии. Было установлено, что способность к биодеградации обоих соединений у них контролируется конъюгативными SAL/CAP плазмидами (Панов и соавт., 2013). Таким образом, впервые был описан новый тип плазмид биодеградации капролактама, в составе которых содержится второй катаболический оперон, детерминирующий утилизацию салицилата – центрального метаболита окисления многих ароматических соединений. Недавно коллекция лаборатории пополнилась новыми уникальными штаммами Pseudomonas, способными утилизировать одновременно капролактам, толуол и мета-ксилол.
Целью данной работы было изучение генетического контроля деградации капролактама, толуола и мета-ксилола в качестве единственных источников углерода и энергии у штамма P. putida CT3, выделенного из городских очистных сооружений.
Штамм P. putida CT3 был выделен методом накопительной культуры из активного ила очистных сооружений г. Пущино (Московская область, Россия). При выделении бактерий использовали минеральную среду М9 (Sambrook et al., 1989) с КАП (1.0 г/л) в качестве единственного источника углерода и энергии. Далее чистые культуры деструкторов КАП проверяли на способность к росту в среде М9, содержащей тот или иной субстрат в качестве единственного источника углерода и энергии. Использовали следующие соединения: нафталин, салицилат, производные бензола (бензол, толуол, этилбензол, фенол, мета-, пара-, орто-ксилол), н-алканы (гексан, октан, нонан, додекан, гексадекан). Бактерии культивировали при 28°С.
Выделение ДНК, амплификацию, секвенирование гена 16S рРНК, филогенетический и ПЦР-анализ целевых генов осуществляли общепринятыми методами (Sambrook et al., 1989).
В результате изучения спектра утилизируемых субстратов у выделенных бактерий-деструкторов для дальнейших исследований был отобран штамм СТ3, обладающий уникальной способностью утилизировать не только КАП, но также толуол и мета-ксилол. Секвенирование гена 16S pРHK изолята (1407 п.н.) и филогенетический анализ полученной последовательности выявил его принадлежность к виду Pseudomonas putida. Уровень сходства гена 16S pРHK с соответствующей последовательностью типового штамма P. putida DSM 291 cоставил 100%. Нуклеотидная последовательность фрагмента гена 16S pРНК штамма P. putida СТ3 длиной 1407 п.н. помещена в GenBank под номером MH553084.
Как было сказано выше, деградация КАП у бактерий Pseudomonas контролируется САР плазмидами. Известно о существовании единственного пути разложения КАП (Negoro, 2002). Что касается толуола (метилбензол, ТОЛ), то описано пять возможных путей расщепления ксенобиотика микроорганизмами (Cao et al., 2009). Наиболее характерными для флуоресцирующих псевдомонад, к которым относятся штаммы P. putida, в том числе, и выделенный нами штамм СТ3, являются два пути разложения толуола: TOL-путь, на начальных этапах которого происходит окисление боковой метильной группы под действием фермента толуолмонооксигеназы, и TOD-путь, у которого трансформация толуола начинается с дигидроксилирования ароматического кольца толуолдиоксигеназой (Хоменков и соавт., 2008; Cao et al., 2009). По этой причине у исследуемого штамма был проведен ПЦР-анализ ключевых генов xylM (TOL-путь) и todC1 (TOD-путь), кодирующих синтез толуолмонооксигеназы и толуолдиоксигеназы соответственно. Для амплификации данных генов были использованы разработанные ранее праймеры: для xylM F 5'-ACC AAA GAG GCG GAA TAA GC-3' и R 5'-TGT TTT ATG GTG ATC CGA ACC-3' (ожидаемый ПРЦ-продукт размером 570 пар нуклеотидов); для todC1 F 5'-AAT CAG ACC GAC ACA TCA CC-3' и R 5'-TCC AGT TAC AGG GAA TGA CC-3' (ожидаемый ПРЦ-продукт размером 625 пар нуклеотидов) (Sokolov et al., 2002). В качестве положительного контроля использовали штамм P. putida TOL25, осуществляющий разложение толуола по TOD-пути, и P. putida TOL8 – по TOL-пути. В результате амплификации целевых генов ПЦР-продукт был получен только для xylM. Размер полученного ампликона соответствовал ожидаемому и составлял 570 п.н. (рис. 1б). Полученные результаты однозначно свидетельствуют о том, что выделенный нами штамм P. putida CT3 окисляет толуол по ТОL-пути.
Рис. 1.
ПЦР-анализ генов, кодирующих толуолдиоксигеназу todC1 (а) и толуолмонооксигеназу xylM (б), у штамма P. putida CT3. (а): 1 – P. putida СT3; 2 – P. putida TOL25; 3 – ДНК-маркер 1 т.п.н. (“Fermentas”, Литва); (б): 1 – P. putida СT3; 2 – P. putida TOL8; 3 – ДНК-маркер 1 т.п.н. (“Fermentas”, Литва).
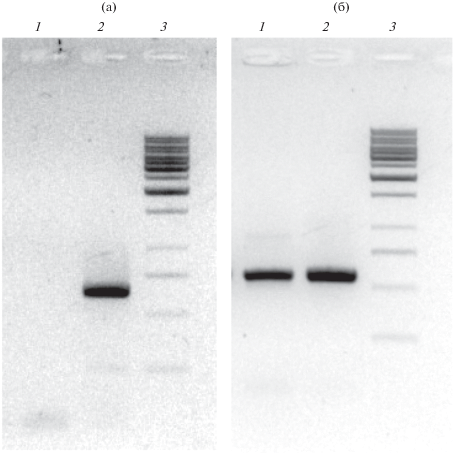
Важно отметить, что разложение толуола по ТОL-пути у бактерий детерминируется, как правило, плазмидами биодеградации, так называемыми ТОL плазмидами. Наиболее изученной из них является плазмида pWWO (117 т.п.н.), обнаруженная в штамме P. putida mt-2, который утилизирует толуол, мета- и пара-ксилол в качестве единственных источников углерода и энергии. Данная плазмида кодирует ферменты полного пути деградации толуола и ксилолов, в том числе, ключевые ферменты толуолмонооксигеназу и катехол-2,3-диоксигеназу. В настоящее время показано широкое распространение pWWO-подобных и других TOL плазмид среди штаммов псевдомонад-деструкторов толуола (Sentchilo et al., 2000). Таким образом, наличие у штамма СТ3 гена xylM, кодирующего синтез толуолмонооксигеназы, является косвенным свидетельством плазмидной локализации генов деградации толуола. Принимая во внимание также тот факт, до сих пор не было описано ни одного бесплазмидного штамма Pseudomonas-деструктора КАП, мы предположили, что выделенная нами бактерия содержит плазмиду, детерминирующую деградацию как капролактама, так и толуола и мета-ксилола. В то же время, нельзя было исключить присутствия у данной бактерии двух катаболических плазмид, одна из которых контролирует разложение капролактама, а другая – толуола и мета-ксилола.
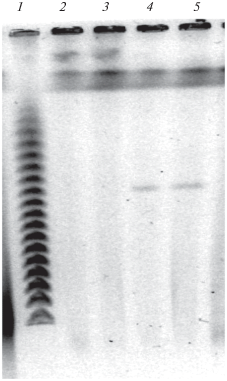
Для выявления плазмидной ДНК у P. putida СТ3 был применен метод пульс-электрофореза геномной ДНК. Было установлено, что штамм СТ3 содержит мегаплазмиду размером около 550 т.п.н. (рис. 2). Для того чтобы подтвердить плазмидную детерминацию признаков деградации КАП и/или ТОЛ был осуществлен конъюгационный перенос плазмиды в бесплазмидный реципиентный штамм P. putida KT2442 (gfp, Kmr, Rifr) методом Дана и Гонзалеса (Dunn, Gunsalus, 1973). Селекцию трансконъюгантов проводили на минеральной среде с капролактамом или толуолом в качестве единственного источника углерода и энергии. В результате проведенных экспериментов колонии трансконъюгантов были получены только на среде с КАП, при этом они не утилизировали толуол и мета-ксилол. Многократные попытки получить трансконъюганты на среде с толуолом не увенчались успехом. Дальнейший анализ САР+ трансконъюгантов показал присутствие в них плазмидной ДНК, по размеру идентичной плазмиде, содержащейся в донорном штамме СТ3 (рис. 2). Следовательно, можно считать доказанным тот факт, что способность штамма СТ3 утилизировать КАП в качестве единственного источника углерода и энергии контролируется плазмидными генами. Что касается генов, детерминирующих разложение толуола и мета-ксилола, то, по всей вероятности, они локализованы на хромосоме.
Рис. 2.
Электрофореграмма плазмидной ДНК штаммов P. putida CT3 и KT2442(CAP): 1 – Lambda Ladder PFG Marker (New England, “BioLabs”); 2, 3 – бесплазмидный реципиентный штамм P. putida KT2442; 4 – исходный штамм-деструктор P. putida CT3; 5 – трансконъюгантный штамм P. putida KT2442(CAP).
Таким образом, в данном исследовании впервые выделен штамм P. putida CT3, обладающий уникальной способностью к одновременной деградации токсичных ксенобиотиков ε-капролактама, толуола и мета-ксилола, гены деградации капролактама у которого локализованы на конъюгативной мегаплазмиде. Уникальность штамма P. putida CT3 заключается также в том, что гены, ответственные за окисление толуола и мета-ксилола по TOL-пути, которые, по всей видимости, локализованы у исследуемого штамма на хромосоме, до сих пор были описаны только в составе TOL плазмид. В настоящее время проводится дальнейшее изучение генетических систем деградации капролактама и толуола у штамма P. putida CT3.
Список литературы
Есикова Т.З., Волкова О.В., Таран С.А., Боронин А.М. Ключевая роль dca-генов в катаболизме epsilon-капролактама у бактерий рода Pseudomonas // Микробиология. 2015. Т. 84. С. 616–619.
Esikova T.Z., Volkova O.V., Taran S.A., Boronin A.M. Key role of the dca genes in ε-caprolactam catabolism in Pseudomonas strains // Microbiology (Moscow). 2015. V. 84. P. 726–729.
Панов А.В., Волкова О.В., Пунтус И.Ф., Есикова Т.З., Кошелева И.А., Боронин А.М. scpA–новый ген салицилатгидроксилазы, локализованный на плазмидах деградации салицилата/капролактама // Молекулярная биология. Т. 47. С. 116–123.
Panov A.V., Volkova O.V., Puntus I.F., Esikova T.Z., Kosheleva I.A., Boronin A.M. scpA, a new salicylate hydroxylase gene localized in salicylate/caprolactam degradation plasmids // Mol. Biol. (Moscow). 2013. V. 47. P. 105–111.
Хоменков В.Г., Шевелев А.Б., Жуков В.Г., Загустина Н.А., Безбородов А.М., Попов В.О. Организация метаболических путей и молекулярно-генетические механизмы биодеградации ксенобиотиков у микроорганизмов // Прикл. биохимия и микробиология. 2008. Т. 44. С. 133–152.
Khomenkov V.G., Shevelev A.B., Zhukov V.G., Zagustina N.A., Bezborodov A.M., Popov V.O. Organization of metabolic pathways and molecular-genetic mechanisms of xenobiotic degradation in microorganisms // Appl. Biochem. Microbiol. 2008. V. 44. P. 117–135.
Cao B., Nagarajan K., Loh K.C. Biodegradation of aromatic compounds: current status and opportunities for biomolecular approaches // Appl. Microbiol. Biotechnol. 2009. V. 85. P. 207–228.
Dunn H.W., Gunsalus I.C. Transmissible plasmids coding early enzymes of naphthalene oxidation in Pseudomonas putida // J. Bacteriol. 1973. V. 114. P. 974–979.
Esikova T.Z., Ponamoreva O.N., Baskunov B.P., Taran S.A., Boronin A.M. Transformation of low-molecular linear caprolactam oligomers by caprolactam-degrading bacteria // JCTB. 2012. V. 87. P. 1284–1290.
Negoro S. Biodegradation of nylon and other synthetic polyamides // Biopolymers. 2002. V. 9. P. 395–415.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 1626 p.
Sentchilo V.S., Perebituk A.N., Zehnder A.J.B., Meer J. Molecular diversity of plasmids bearing genes that encode toluene and xylene metabolism in Pseudomonas strains isolated from different contaminated sites in Belarus // Appl. Environ. Microbiol. 2000. V. 66. P. 2842–2852.
Shintani M., Takahashi Y., Yamane H., Nojiri H. The behavior and significance of degradative plasmids belonging to Inc groups in Pseudomonas within natural environments and microcosms // Microbes Environ. 2010. V. 25. P. 253–265.
Smalla K., Jechalke S., Top E.M. Plasmid detection, characterization and ecology // Microbiol. Spectr. 2015. V. 3 (1). PLAS-0038-2014. https://doi.org/10.1128/microbiolspec.PLAS-0038-2014
Sokolov S., Gafarov A., Esikova T., Boronin A. Diversity of BTEX-degrading Pseudomonas isolated from different regions of Russia // 12th Int. Biodeterioration and Biodegradation Symp. (Biosorption and Bioremediation III). Czech Republic, Prague, 2002. P. 65.
Дополнительные материалы отсутствуют.


