Микробиология, 2020, T. 89, № 2, стр. 180-188
Биоокисление высокосернистых продуктов химического выщелачивания цинкового концентрата
М. И. Муравьев a, *, В. С. Меламуд a, Н. В. Фомченко a
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: maxmuravyov@gmail.com
Поступила в редакцию 16.09.2019
После доработки 15.10.2019
Принята к публикации 01.11.2019
Аннотация
Ранее нами была предложена высокоэффективная технология получения металлов из низкокачественного сульфидного цинкового концентрата в процессе его двустадийной переработки: (1) химического выщелачивания металлов и (2) биоокисления образовавшегося двухвалентного железа с целью его регенерации в трехвалентное (окислитель сульфидных минералов). В настоящей работе впервые предложено совместное биоокисление продуктов химического выщелачивания низкокачественного сульфидного цинкового концентрата: раствора, содержащего 24.2 г/л двухвалентного железа, и осадка, содержащего 29.7% элементной серы. Показано, что совместное биоокисление раствора и осадка микробными ассоциациями, включающими железо- и сероокислителей, обеспечивает не только регенерацию окислителя, но и предотвращает защелачивание раствора, приводящее к связыванию ионов трехвалентного железа в нерастворимый комплекс, что позволяет дополнительно не использовать серную кислоту в технологическом процессе биорегенерации. Наиболее интенсивная биорегенерация ионов трехвалентного железа наблюдалась при температуре 40°С и использовании смешанной культуры микроорганизмов, включавшей по результатам метагеномного анализа в качестве доминирующих литотрофов представителей родов Leptospirillum, Sulfobacillus, Acidithiobacillus, Ferroplasma, а также органотрофа Cuniculiplasma. В этих условиях достигнута скорость окисления двухвалентного железа – 5.4 г/(л сут), а также окисление 59.5% элементной серы в осадке. В работе обсуждается роль миксо- и органотрофных ацидофильных микроорганизмов, доминирующих в ассоциациях при биорегенерации окислителя, в процессе детоксикации среды для роста автотрофной ассоциации за счет утилизации органических соединений, образующихся автотрофами при первичном получении раствора для химического выщелачивания и высокотемпературном химическом выщелачивании цинкового концентрата вследствие автолиза клеток автотрофных микроорганизмов.
Биогидрометаллургические методы получения цветных и благородных металлов из сульфидного сырья, основанные на использовании окислительной активности ацидофильных микроорганизмов, широко распространены на промышленных предприятиях в Австралии, ЮАР, Китае, России, Казахстане, Узбекистане, Чили и др. Например, 10–15% меди и около 5% золота в настоящее время получают с использованием технологий биовыщелачивания/биоокисления (Kaksonen et al., 2018). Ухудшающееся качество добываемого сырья, как следствие истощения богатых руд, а также минеральные особенности руд многих месторождений ставят новые задачи для научных исследований и биотехнологий. Биогидрометаллургические методы, представляющие меньшую опасность для окружающей среды, чем пирометаллургические, могут быть их альтернативой и применяться для утилизации низкокачественных полиметаллических сульфидных концентратов (Fomchenko, Muravyov, 2017, 2018).
Цинковые концентраты, получаемые из полиметаллических сульфидных руд Уральского региона флотационными методами, содержат значительное количество железа и меди, поэтому их дальнейшая переработка на металлургических предприятиях сопровождается значительными потерями цветных металлов в образующихся шлаках. Перспективным методом переработки таких концентратов является биогидрометаллургический, основанный на сочетании химического выщелачивания биологически полученными растворами трехвалентного железа, биоокисления и биорегенерации выщелачивающих растворов. Режимы химического выщелачивания цинкового концентрата раствором трехвалентного железа, полученного с использованием автотрофной мезофильной ассоциации ацидофильных железоокисляющих микроорганизмов, были разработаны ранее (Муравьёв, Фомченко, 2019). Показано, что высокотемпературное (80°С) химическое выщелачивание цинкового концентрата позволяет перевести в жидкую фазу до 92% цинка и 52% меди. При этом окислялось 87% серы сульфидов с образованием осадка, содержащего 30% элементной серы. Этот осадок не мог считаться отходом производства вследствие относительно высокого содержания цветных металлов.
Получающийся после химического выщелачивания раствор имел высокую концентрацию двухвалентного железа (24.2 г/л). Рециркуляция полученного раствора, подвергнутого биорегенерации ацидофильными микроорганизмами, позволяет не только осуществлять процесс с замкнутым циклом технологических потоков, но и повысить концентрацию меди для ее эффективной экстракции.
В процессе биорегенерации окислителя микроорганизмы осуществляют следующую упрощенную реакцию:
(1)
$4{\text{F}}{{{\text{e}}}^{{2 + }}} + 4{{{\text{H}}}^{ + }} + {{{\text{O}}}_{2}} = 4{\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{ }}2{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Окисление двухвалентного железа сопровождается образованием воды и повышением pH раствора, а с увеличением рН интенсифицируется выпадение в осадок трехвалентного железа в виде гидроксосульфатов (ярозитов) по реакции (Dutrizac, 1980):
(2)
$\begin{gathered} 3{\text{F}}{{{\text{e}}}_{2}}{{\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)}_{3}} + 12{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{M}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} = \\ = 2{\text{MF}}{{{\text{e}}}_{3}}{{\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)}_{2}}{{\left( {{\text{OH}}} \right)}_{6}}{\kern 1pt} \downarrow + \,6{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}, \\ \end{gathered} $где M = K+, Na+, ${\text{NH}}_{{\text{4}}}^{ + },$ H3O+.
Осаждение ярозита может отрицательно влиять на выщелачивание сульфидных минералов, препятствуя доступу трехвалентного железа к частицам сульфидов (Deveci et al., 2004; Zhao et al., 2019), а также уменьшая концентрацию окислителя в выщелачивающем растворе. Как известно, окисление элементной серы ацидофильными микроорганизмами приводит к образованию серной кислоты по реакции:
(3)
$2{{{\text{S}}}^{0}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 3{{{\text{O}}}_{2}} = 2{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}}.$С целью предупреждения осаждения железа в результате чрезмерного повышения pH при биорегенерации в настоящей работе предложено совместить биоокисление раствора и осадка, содержащего, как указано выше, элементную серу. Это позволит не только исключить потребление серной кислоты на стадии биорегенерации, но и частично утилизировать осадок, образующийся при химическом выщелачивании.
Целью настоящей работы было исследовать процесс совместного биоокисления раствора и осадка, полученных после химического выщелачивания низкокачественного цинкового концентрата, ассоциациями ацидофильных микроорганизмов при различных температурных режимах.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Продукты химического выщелачивания цинкового концентрата. Раствор выщелачивания, используемый в работе, был получен в процессе высокотемпературного химического выщелачивания цинкового сульфидного концентрата руды Тарньерского месторождения (Свердловская область, Россия), содержавшего (%): цинк (43.3), медь (2.03), железо (13.6), серу сульфидов (30.5), элементную серу (0), серу растворимых сульфатов (1.38). Основными сульфидными минералами концентрата были сфалерит (ZnS), пирротин (Fe1 –xS), пирит (FeS2) и халькопирит (CuFeS2). Условия и процедура химического выщелачивания концентрата в четырех циклах описаны ранее (Муравьёв, Фомченко, 2019). В результате был получен раствор выщелачивания, содержавший (г/л): Fe2+ (24.2), Fe3+ (1.12), Zn2+ (10.0), Cu2+ (0.3). Раствор имел pH 1.25.
Осадок химического выщелачивания, используемый в настоящей работе, содержал (%): цинк (6.17), медь (1.82), железо (17.3), серу сульфидов (6.3), элементную серу (29.7), серу растворимых сульфатов (6.0).
Биоокисление. Опыты проводили в биореакторе объемом 2 л при перемешивании суспензии верхнеприводной турбинной мешалкой с частотой вращения 500 об./мин, барботажем воздуха с расходом 4 л/мин и термостатированием U-образным теплообменником, соединенным с водяным циркуляционным термостатом. В реактор вносили 10 г осадка химического выщелачивания, 900 мл раствора химического выщелачивания и 100 мл посевного материала. Биоокисление проводили при температурах 35, 40 и 45°С.
Микроорганизмы-окислители. В качестве посевного материала при биоокислении были использованы ассоциации ацидофильных микроорганизмов, выращенные при температурах 35, 40 и 45°С в конических колбах на осадке (1 г) и растворе после химического выщелачивания цинкового концентрата (90 мл) при количестве инокулята 10 мл. В качестве инокулята использовали накопительную культуру, полученную на лежалых пиритных отходах обогащения сульфидных руд ПАО “Гайский ГОК” при 28°С (включавшую Acidithiobacillus ferrooxidans, A. thiooxidans, Leptospirillum sp., Ferroplasma spp.), а также культуры, окислявшие пиритно-арсенопиритный концентрат руды Боголюбовского месторождения при 40 и 45°С (включавшие Acidithiobacillus caldus, Leptospirillum sp., Sulfobacillus spp., Ferroplasma spp., Acidiplasma spp., Cuniculiplasma sp.).
Аналитические методы. Значения рН и Eh измеряли с помощью рН-метра “рН-150МИ Измерительная техника” (Россия).
Концентрации Fe3+ и Fe2+ в жидкой фазе определяли титриметрическим методом с трилоном Б (Davis, Jacobsen, 1960). После биоокисления твердую фазу отделяли центрифугированием при 2000 g в течение 2 мин. Твердую фазу промывали дистиллированной водой 3 раза, высушивали до постоянного веса для расчета ее выхода.
Содержание металлов в твердой фазе определяли при растворении в смеси концентрированных соляной и азотной кислот (3 : 1) при кипячении с последующим определением концентрации металлов в растворе атомно-абсорбционным методом.
Содержание серы определяли гравиметрическим анализом с хлоридом бария после растворения в “царской водке”. Содержание элементной серы определяли растворением в четыреххлористом углероде при 50°С с последующим гравиметрическим анализом. Содержание серы растворимых сульфатов определяли гравиметрическим анализом с хлоридом бария после кипячения с карбонатом натрия (Филиппова, 1975).
Минеральный состав осадков был определен двумя методами: а) рентгеновской порошковой дифрактометрией на дифрактометре “ДРОН-2” (Россия); б) минераграфическим анализом рудных минералов в монтированных аншлифах в отраженном и отраженно-проходящем свете с помощью поляризационного микроскопа Olympus BX 51 (“Olympus”, Япония).
Метагеномный анализ микроорганизмов, развившихся в биореакторе. Для проведения метагеномного анализа фрагментов гена 16S рРНК получали биомассу методом дробного центрифугирования: сначала нативной суспензии при 100 g в течение 2 мин, а затем полученного супернатанта при 5000 g в течение 15 мин. Полученный осадок биомассы промывали, центрифугируя при 10 000 g в течение 5 мин в среде 9K (Silverman, Lundgren, 1959), не содержащей солей железа, с рН 1.5, а затем той же средой, но с нейтральным рН. Полученный осадок ресуспендировали в 300 мкл лизирующего буфера (0.15 M NaCl, 0.1 M трилона Б, 15 мг/мл лизоцима, pH 8.0). ДНК выделяли фенол-хлороформным методом (Maniatis et al., 1982). Качественную и количественную оценку полученных препаратов ДНК проводили на спектрофотометре DropSense-96® (“Trinean”, Бельгия). ПЦР производили согласно стандартному протоколу (Kramer, Coen, 2001). В качестве универсальных использовали праймеры Pro341F (5'-CCTACGGGNBGCASCAG-3') и Pro805R (5'-GACTACNVGGGTATCTAATCC-3'). Для дальнейшего секвенирования полученные ампликоны разделяли с помощью электрофореза в агарозном геле. Вырезанные из геля ампликоны очищали с помощью набора для очистки ДНК из геля и реакционных смесей Cleanup Standard (“Евроген”, Россия). Мультиплексные библиотеки ампликонов для секвенирования на системе MiSeq (“Illumina”, США) были подготовлены при помощи набора NEBNext® для фрагментных библиотек (“New England BioLabs”, США). Секвенирование проводили при помощи набора реагентов в режимах, обеспечивающих длину прочтения 300 нк с каждого конца ампликона. Первичную обработку (фильтрацию и демультиплексирование) полученных прочтений производили при помощи ПО CLC Genomics Workbench 7.5 (“Qiagen”, США). Полученные данные были обработаны с помощью онлайн сервиса SILVAngs (https://www.arb-silva.de/ngs/). Для каждого образца было проанализировано около 10 000 фрагментов средней длиной 486 нк.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При осуществлении совместного биоокисления продуктов, полученных при химическом выщелачивании цинкового концентрата, помимо химических превращений, проходящих согласно указанным выше основным реакциям, могут также окисляться сульфидные минералы меди (халькопирит) и цинка (сфалерит), присутствующие в осадке:
(4)
${\text{ZnS}} + 2{\text{F}}{{{\text{e}}}^{{3 + }}} = {\text{Z}}{{{\text{n}}}^{{2 + }}} + {{{\text{S}}}^{0}} + 2{\text{F}}{{{\text{e}}}^{{2 + }}},$(5)
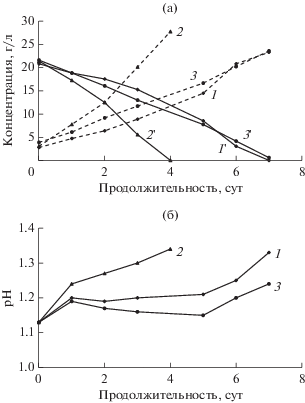
${\text{CuFe}}{{{\text{S}}}_{2}} + 4{\text{F}}{{{\text{e}}}^{{3 + }}} = {\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{S}}}^{0}} + 5{\text{F}}{{{\text{e}}}^{{2 + }}}.$Это подтверждает представленная на рис. 1 динамика изменения концентраций ионов Fe2+ и Fe3+, а также величины pH в процессе совместного биоокисления раствора и осадка ассоциациями ацидофильных микроорганизмов, проходящего при различной температуре. Из представленных данных следует, что концентрация двухвалентного железа наиболее быстро снижалась при 40°С, при этом продолжительность полного окисления двухвалентного железа в среде составила 4 сут. Процессы, идущие при 35 и 45°С характеризовались полным окислением двухвалентного железа в среде в течение 7 сут. Отмечено повышение значений pH реакционной среды вследствие преобладания потребления протонов при окислении ионов железа над их образованием при окислении элементной серы и образовании ярозита. При этом наблюдаемой активности окислителей серы во всех случаях было достаточно для того, чтобы предотвратить повышение pH до значений интенсивного связывания трехвалентного железа в нерастворимый комплекс (>1.9).
Рис. 1.
Изменение концентрации ионов Fe3+ (1, 2, 3) и Fe2+ (1', 2', 3') (а) и величины pH (б) в процессе биоокисления при 35 (1, 1'), 40 (2, 2') и 45°C (3, 3').
Изменения состава осадка, полученного при химическом выщелачивании концентрата, в процессе его совместного биоокисления с раствором, представлены в табл. 1. Из данных следует, что в твердой фазе наиболее значительно снижалось содержание элементной серы (от 29.7 до 11.9–14.1%) за счет ее окисления (по реакции 3), а содержание меди и цинка, наоборот, возрастало вследствие уменьшения массы твердой фазы и лишь незначительного окисления сульфидных минералов. Наименьшее содержание цинка и меди в осадке после биоокисления наблюдалось при 40°С – 6.57 и 2.01% соответственно. На рис. 2 и 3 представлены результаты рентгенодифракционного и минераграфического анализов осадков при биоокислении, соответственно. Рассчитанное на их основе количественное содержание минералов в осадке представлено в табл. 1, откуда следует, что осадок, полученный при 40°С характеризовался меньшим содержанием сульфидов и большим содержанием продукта их окисления – ярозита, по сравнению с осадками, полученными при других температурных режимах. Минераграфический анализ подтвердил наличие также следовых количеств пирротина во всех осадках, несмотря на то, что этот минерал характеризуется легким окислением в сернокислых растворах трехвалентного железа, а также обладает низким электродным потенциалом, быстро окисляясь при образовании гальванических пар с другими сульфидными минералами (Fomchenko, Muravyov, 2019). Степень окисления сульфидных элементов (табл. 2) после стадии биоокисления была относительно низкой, что давало незначительное увеличение общей степени окисления элементов (Zn, Cu, Ss) в исходном сульфидном концентрате по сравнению с окислением на стадии химического выщелачивания. Отмеченные закономерности могли быть обусловлены: 1) относительно короткой продолжительностью биоокисления; 2) упорностью халькопирита в сернокислых растворах трехвалентного железа, а также 3) препятствием доступа окислителя к поверхности сульфидов (на микрофотографиях, рис. 3, видно покрытие частиц сфалерита слоем продуктов реакции).
Таблица 1.
Содержание основных элементов в твердой фазе после совместного биоокисления раствора и осадка, полученных после химического выщелачивания цинкового концентрата. Биоокиление происходило при различной температуре
| Температура, °С | Продолжительность, сут | Содержание элементов, % | Содержание минералов, % | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Zn | Cu | Fe | Ss | S0 | сфалерит | халькопирит | ярозит | ||
| 35 | 7 | 8.10 | 2.40 | 23.9 | 7.7 | 12.2 | 12 | 7 | 60 |
| 40 | 4 | 6.57 | 2.01 | 24.5 | 6.1 | 14.1 | 9 | 5 | 65 |
| 45 | 7 | 7.90 | 2.33 | 24.9 | 7.4 | 11.9 | 12 | 7 | 60 |
Рис. 2.
Дифрактограммы осадков биоокисления при различной температуре. Sp – сфалерит, Ccp – халькопирит, AJrz – аммонийный ярозит, S – элементная сера.
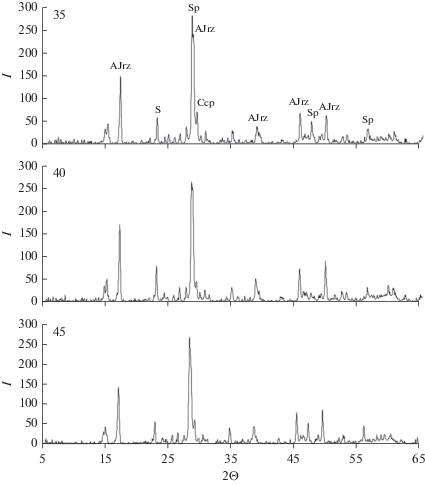
Рис. 3.
Микрофотографии аншлифов осадков после биоокисления при температуре 35 (А1, А2, А3), 40 (B1, B2, B3), и 45°С (C1, C2, C3) в отраженном (А1, А2, B1, B2, C1, C2) и отраженно-проходящем свете (А3, B3, C3). Sp – сфалерит, Ccp – халькопирит, AJrz – аммонийный ярозит, Po – пирротин.

Таблица 2.
Степень окисления элементов в твердой фазе после стадии биоокисления, проходящего при различной температуре
| Температура, °С | Степень окисления, % | ||||||
|---|---|---|---|---|---|---|---|
| при биоокислении | общая (после химического выщелачивания и биоокисления) | ||||||
| Zn | Cu | Ss | S0 | Zn | Cu | Ss | |
| 35 | 3.1 | 2.7 | 9.8 | 69.7 | 92.5 | 52.9 | 89.9 |
| 40 | 9.1 | 5.7 | 17.3 | 59.5 | 93.0 | 54.3 | 90.8 |
| 45 | 4.1 | 4.1 | 12.0 | 70.0 | 92.6 | 53.6 | 90.2 |
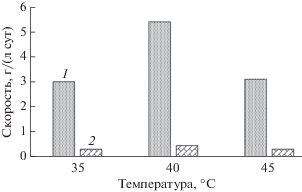
На основании полученных данных были рассчитаны скорости окисления двухвалентного железа в жидкой фазе и элементной серы в твердой фазе в процессе их совместного биоокисления (рис. 4). Максимальная скорость окисления элементной серы и ионов двухвалентного железа наблюдалась при 40°С и составляла, соответственно, 0.443 и 5.4 г/(л сут). При 35 и 45°С скорость окисления как ионов Fe2+, так и элементной серы была одинаковой. При всех температурах скорость окисления ионов двухвалентного железа превышала скорость окисления элементной серы в 10–12 раз. О составе микробного сообщества, участвующего в процессах совместного биоокисления раствора и осадка, полученных после стадии химического выщелачивания сульфидного цинкового концентрата, судили по результатам метагеномного анализа.
Рис. 4.
Скорость окисления Fe2+ (1) и элементной серы (2) в процессе биоокисления при различной температуре.
В табл. 3 представлены результаты метагеномного анализа сообществ, сформировавшихся при различных температурах (более подробная информация представлена на рис. S1, S2 и S3 в дополнительных материалах). Из данных следует, что в процессах доминировали типичные для данных условий представители бактерий родов Aci-dithiobacillus, Leptospirillum и Sulfobacillus, а также архей порядка Thermoplasmatales.
Таблица 3.
Доля последовательностей генов 16S рРНК (%) микроорганизмов по данным метагеномного анализа
| Микроорганизмы | Температура при биоокислении, °С | ||
|---|---|---|---|
| 35 | 40 | 45 | |
| Acidithiobacillus | 68 | 6 | 65 |
| Leptospirillum | 22 | 14 | 0 |
| Sulfobacillus | 3 | 7 | 5 |
| Ferroplasma | 5 | 1 | 19 |
| Acidiplasma | 0.1 | 0.04 | 9 |
| Cuniculiplasma | 0.05 | 69 | 1 |
Доминирующие бактерии рода Acidithiobacillus были филогенетически наиболее близки к видам сероокислителей A. caldus и A. thiooxidans в сообществе, сформированном при 35°С, тогда как при 40 и 45°С – только к A. caldus. Отмеченные различия объясняются температурным диапазоном роста бактерий, который для A. caldus находится в интервале 25–52°С с оптимумом при 37–45°С, а для A. thiooxidans – в интервале 10–37°С с оптимумом при 28–30°С (Mahmoud et al., 2017; Li et al., 2018).
Железоокисляющие автотрофные бактерии рода Leptospirillum, филогенетически наиболее близкие к L. ferriphilum, доминировали в процессах при 35 и 40°С, тогда как при 45°С их обнаружено не было, что также объясняется температурным оптимумом их роста, составляющим для данного вида 30–37°С (Coram, Rawlings, 2002). Хотя в литературе были описаны изоляты L. ferriphilum, способные расти в интервале до 45°С (Coram, Rawlings, 2002; Панюшкина и соавт., 2018), однако в настоящем исследовании процессов биорегенерации подобные штаммы не были обнаружены в числе доминирующих.
Грамположительные миксотрофы рода Sulfobacillus, окисляющие серу и двухвалентное железо, обнаруженные в процессах биоокисления при 35 и 40°С, были наиболее близки к видами S. thermotolerans и S. thermosulfidooxidans, тогда как в сообществе, развившемся при 45°С, – только к S. thermosulfidooxidans. Хотя температурные диапазоны роста у типовых штаммов обоих видов сульфобацилл одинаковы и составляют 20–60°С, однако температурный оптимум роста у S. thermotolerans (Kr1T) – 40°С, а у S. thermosulfidooxidans (ВКМ B-1269T) – 50°C (Bogdanova et al., 2006; Головачева, Каравайко, 1978). Вместе с тем, штаммы указанных видов сульфобацилл отличаются физиологическим полиморфизмом: описаны штаммы S. thermotolerans, обладающие более высоким температурным оптимумом роста, 46°С (Журавлева и соавт., 2011), а также штаммы S. thermosulfidooxidans, имеющие более низкий температурный оптимум – 45°С (Булаев и соавт., 2011).
Доминирующие археи порядка Thermoplasmatales в процессах биорегенерации при всех использованных температурных режимах были представлены железоокисляющими хемолитотрофами, филогенетически наиболее близкими к Ferroplasma acidiphilum, Acidiplasma sp. MBA-1, а также органотрофом Cuniculiplasma sp. Археи семейства Ferroplasmaceae способны окислять железо, а для штамма Acidiplasma sp. MBA-1 была показана способность также окислять элементную серу (Muravyov, Bulaev, 2013). Штаммы F. acidiphilum хотя и отличаются физиологическим полиморфизмом, однако все они имеют более низкий температурный оптимум роста по сравнению с Acidiplasma sp. (Пивоварова и соавт., 2002; Golyshina et al., 2009; Булаев и соавт., 2017), что нашло отражение в количественных показателях состава ассоциаций. Высокая доля последовательностей генов 16S рРНК Cuniculiplasma в сообществе, развившемся при 40°С, связана с температурным оптимумом роста этого микроорганизма, равным 37–40°С (Golyshina et al., 2016).
Наличие миксо- и гетеротрофов, а также органотрофов среди доминирующих на стадии биоокисления микроорганизмов обусловлено присутствием в окисляемом растворе продуктов метаболизма микроорганизмов (органических низкомолекулярных соединений), образующихся при первичном получении раствора (для выщелачивания концентрата) автотрофной ассоциацией микроорганизмов, а также продуктов автолиза клеток, образующихся на стадии выщелачивания концентрата при 80°С. Ранее было показано, что миксотрофы Sulfobacillus spp. способны утилизировать гликолевую кислоту – продукт метаболизма активно растущих культур ацидофилов, а Ferroplasma может использовать органический углерод продуктов автолиза клеток A. caldus и Leptospirillum spp. (Ñancucheo, Johnson, 2010; Zhang et al., 2015). Анализ промышленных процессов биоокисления сульфидного сырья подтверждает преимущественное доминирование F. acidiphilum в конечных реакторах биоокисления, в то время как в первичных реакторах доминировали автотрофы L. ferriphilum и A. caldus, а также миксотрофы Sulfobacillus spp. (Okibe et al., 2003; Mahmoud et al., 2017). Кроме того, известно, что органические вещества ингибируют рост ацидофильных автотрофов, а в недавней работе была показана токсичность продуктов автолиза микроорганизмов для L. ferriphilum и A. ferrooxidans, более выраженная для последнего (Vardanyan et al., 2017). Возможно, этим обусловлено отсутствие бактерии A. ferrooxidans в сообществе, сформированном в процессе биоокисления при 35°С. В ряде работ было показано, что гетеротрофы, такие как Acidiphilum acidophilum, могут повышать эффективность биовыщелачивания металлов вследствие утилизации органических веществ, снижая токсичность среды для роста автотрофных ацидофилов (Vardanyan, Vyrides, 2019). Утилизация органических веществ органотрофом Cuniculiplasma sp., возможно, обеспечила детоксикацию среды для L. ferriphilum и A. caldus в большей степени при 40°С, по сравнению с другими температурными режимами, что обусловило наибольшую интенсивность окисления железа и серы при этом температурном режиме.
Таким образом, в настоящем исследовании показано, что наиболее интенсивная биорегенерация ионов трехвалентного железа в процессе совместного биоокисления раствора и осадка, образовавшихся на первой стадии химического выщелачивания сульфидного цинкового концентрата, наблюдалась при 40°С при использовании смешанной культуры ацидофильных микроорганизмов. Культура включала в качестве доминирующих микроорганизмов литотрофов представителей родов Leptospirillum, Sulfobacillus, Acidithiobacillus, Ferroplasma и органотрофа Cuniculiplasma. В этих условиях достигнута скорость окисления двухвалентного железа 5.4 г/(л сут), а также окисление 59.5% элементной серы в осадке, что предотвращает увеличение pH до значений, при которых происходит связывание ионов трехвалентного железа в нерастворимый комплекс. Степень выщелачивая меди и цинка из сульфидного цинкового концентрата, а также степень окисления сульфидной серы были низкими при всех исследованных температурных режимах, что объясняется: 1) относительно короткой продолжительностью процесса, 2) высокой упорностью халькопирита, 3) препятствием доступа окислителя к частицам сульфидов вследствие образования на поверхности минералов продуктов реакции, а также 4) преимущественным окислением микроорганизмами легкоокисляемых субстратов – двухвалентного железа и элементной серы.
Список литературы
Булаев А.Г., Пивоварова Т.А., Меламуд В.С., Цаплина И.А., Журавлева А.Е., Кондратьева Т.Ф. Полиморфизм штаммов Sulfobacillus thermosulfidooxidans, доминирующих в процессах высокотемпературного окисления золотомышьякового концентрата // Микробиология. 2011. Т. 80. № 3. С. 320–328.
Bulaev A.G., Pivovarova T.A., Melamud V.S., Tsaplina I.A., Zhuravleva A.E., Kondrat’eva T.F. Polymorphism of Sulfobacillus thermosulfidooxidans strains dominating in proces-ses of high-temperature oxidation of gold-arsenic concentrate // Microbiology (Moscow). 2011. V. 80. P. 326–334.
Булаев А.Г., Каныгина А.В., Манолов А.И. Анализ генома полиэкстремофильной археи Acidiplasma sp. MBA-1, доминирующей в микробном сообществе реактора биовыщелачивания // Микробиология. 2017. Т. 86. № 1. С. 80–87.
Bulaev A.G., Kanygina A.V., Manolov A.I. Genome analysis of Acidiplasma sp. MBA-1, a polyextremophilic archaeon predominant in the microbial community of a bioleaching reactor // Microbiology (Moscow). 2017. V. 86. P. 89–95.
Головачева Р.С., Каравайко Г.И. Sulfobacillus – новый род термофильных спорообразующих бактерий // Микробиология. 1978. Т. 47. № 5. С. 815–822.
Журавлева А.Е., Цаплина И.А., Кондратьева Т.Ф. Специфические особенности штаммов термоацидофильного микробного сообщества, окисляющих сурьмяную сульфидную руду // Микробиология. 2011. Т. 80. № 1. С. 74–85.
Zhuravleva A.E., Tsaplina I.A., Kondrat’eva T.F. Specific characteristics of the strains isolated from a thermoacidophilic microbial community oxidizing antimony sulfide ore // Microbiology (Moscow). 2011. V. 80. P. 70–81.
Муравьев М.И., Фомченко Н.В. Химическое выщелачивание низкокачественного цинкового концентрата биораствором трехвалентного железа // Прикл. биохимия и микробиология. 2019. Т. 55. № 4. С. 396–402.
Muravyov M.I., Fomchenko N.V. Ferric leaching of low-grade zinc concentrate with a biologically produced solution // Appl. Biochem. Microbiol. 2019. V. 55. P. 414–419.
Панюшкина А.Е., Цаплина И.А., Кондратьева Т.Ф., Белый А.В., Булаев А.Г. Физиологические и морфологические особенности ацидофильных бактерий Leptospirillum ferriphilum и Acidithiobacillus thiooxidans – членов хемолитотрофной ассоциации микроорганизмов // Микробиология. 2018. Т. 87. № 3. С. 252–265.
Panyushkina A.E., Tsaplina I.A., Kondrat’eva T.F., Belyi A.V., Bulaev A.G. Physiological and morphological characteristics of acidophilic bacteria Leptospirillum ferriphilum and Acidithiobacillus thiooxidans, members of a chemolithotrophic microbial consortium // Microbiology (Moscow). 2018. V. 87. P. 326–338.
Пивоварова Т.А., Кондратьева Т.Ф., Батраков С.Г., Есипов С.Е., Чешенко В.И., Быкова С.А., Лысенко А.М., Каравайко Г.И. Фенотипические особенности штаммов YT и Y-2 Ferroplasma acidiphilum // Микробиология. 2002. Т. 71. № 6. С. 809–818.
Pivovarova T.A., Kondrat’eva T.F., Batrakov S.G., Esipov S.E., Sheichenko V.I., Bykova S.A., Lysenko A.M., Karavaiko G.I. Phenotypic features of Ferroplasma acidiphilum strains YT and Y-2 // Microbiology (Moscow). 2002. V. 71. P. 698–706.
Филиппова Н.А. Фазовый анализ руд и продуктов их переработки. М.: Химия, 1975. 280 с.
Bogdanova T.I., Tsaplina I.A., Kondrat’eva T.F., Duda V.I., Suzina N.E., Melamud V.S., Tourova T.P., Karavaiko G.I. Sulfobacillus thermotolerans sp. nov, a thermotolerant, chemolithotrophic bacterium // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 1039–1042.
Coram N.J., Rawlings D.E. Molecular relationship between two groups of the genus Leptospirillum and the finding that Leptospirillum ferriphilum sp. nov. dominates South African commercial biooxidation tanks that operate at 40°C // A-ppl. Environ. Microbiol. 2002. V. 68. P. 838–845.
Davis D.G., Jacobsen W.R. Determination of iron and iron-aluminum mixtures by titration with EDTA // Anal. Chem. 1960. V. 32. P. 215–217.
Deveci H., Akcil A., Alp I. Bioleaching of complex zinc sulphides using mesophilic and thermophilic bacteria: comparative importance of pH and iron // Hydrometallurgy. 2004. V. 73. P. 293–303.
Dutrizac J.E. The physical chemistry of iron precipitation in the zinc industry // Lead-Zinc-Tin’80 / Eds. Cigan J.M., Mackey T.S., O’Keefe T.J. N.Y.: AIME, 1980. P. 532–564.
Fomchenko N.V., Muravyov M.I. Two-step biohydrometallurgical technology for modernization of processing of sulfidic copper-zinc products // Hydrometallurgy. 2017. V. 174. P. 116–122.
Fomchenko N.V., Muravyov M.I. Two-step biohydrometallurgical technology of copper-zinc concentrate processing as an opportunity to reduce negative impacts on the environment // J. Environ. Manag. 2018. V. 226. P. 270–277.
Fomchenko N.V., Muravyov M.I. Effect of sulfide mineral content in copper-zinc concentrates on the rate of leaching of non-ferrous metals by biogenic ferric iron // Hydrome-tallurgy. 2019. V. 185. P. 82–87.
Golyshina O.V., Yakimov M.M., Lünsdorf H., Ferrer M., Nimtz M., Timmis K.N., Wray V., Tindall B.J., Golyshin P.N. Acidiplasma aeolicum gen. nov., sp. nov., a euryarchaeon of the family Ferroplasmaceae isolated from a hydrothermal pool, and transfer of Ferroplasma cupricumulans to Acidiplasma cupricumulans comb. nov. // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 2815–2823.
Golyshina O.V., Lünsdorf H., Kublanov I.V., Goldenstein N.I., Hinrichs K.U., Golyshin P.N. The novel extremely acidophilic, cell-wall-deficient archaeon Cuniculiplasma divulgatum gen. nov., sp. nov. represents a new family, Cuniculiplasmataceae fam. nov., of the order Thermoplasmatales // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 332–340.
Kaksonen A.H., Boxall N.J., Gumulya Y., Khaleque H.N., Morris C., Bohu T., Cheng K.Y., Usher K., Lakaniemi A.M. Recent progress in biohydrometallurgy and microbial characterization // Hydrometallurgy. 2018. V. 180. P. 7–25.
Kramer M.F., Coen D.M. Enzymatic amplification of DNA by PCR: standard procedures and optimization // Curr. Protoc. Immunol. 2001. V. 10.20. P. 10.20.1–10.20.10.
Li L., Zuo Z., Lv Z., Yang Z., Qi X., Zhou W., Guan H., Liu Y., Mao W. Isolation and characterization of Acidithiobacillus caldus TST3 and the effect of pre-cultivation on its dissolution of phosphorous from rock phosphates // Hydrometallurgy. 2018. V. 177. P. 86–93.
Mahmoud A., Cezac P., Hoadley A.F.A., Contamine F., D’Hugues P. A review of sulfide minerals microbially assisted leaching in stirred tank reactors // Int. Biodeterior. Biodegrad. 2017. V. 119. P. 118–146.
Maniatis T., Fritsch E.F., Sambrook J. Molecular Cloning. A Laboratory Manual. New York: Cold Spring Harbor Laboratory, 1982. 545 p.
Muravyov M.I., Bulaev A.G. A two-step process for the treatment of refractory sulphidic concentrate // Adv. Mater. Res. 2013. V. 825. P. 246–249.
Ñancucheo I., Johnson D.B. Production of glycolic acid by chemolithotrophic iron-and sulfur-oxidizing bacteria and its role in delineating and sustaining acidophilic sulfide mineral-oxidizing consortia // Appl. Environ. Microbiol. 2010. V. 76. P. 461–467.
Okibe N., Gericke M., Hallberg K.B., Johnson D.B. Enumeration and characterization of acidophilic microorganisms isolated from a pilot plant stirred-tank bioleaching operation // Appl. Environ. Microbiol. 2003. V. 69. P. 1936–1943.
Silverman M.P., Lundgren D.G. Studies on the chemoautotrophic iron bacteria Ferrobacillus ferrooxidans. An improved medium and harvesting procedure for securing high yields // J. Bacteriol. 1959. V. 77. P. 642–647.
Vardanyan A.K., Achilleos P., Kafa N., Papadopoulou M., Vardanyan N., Vyrides I. Effect of cell lysis (CLs) products on acidophilic chemolithotrophic microorganisms and role of Acidocella species // Geomicrobiol. J. 2017. V. 34. P. 1–7.
Vardanyan A., Vyrides I. Acidophilic bioleaching at high dissolved organic compounds: Inhibition and strategies to counteract this // Miner. Eng. 2019. V. 143. Article 105943.
Zhang L., Zhou W., Li K., Mao F., Wan L., Chen X., Zhou H., Qiu G. Synergetic effects of Ferroplasma thermophilum in enhancement of copper concentrate bioleaching by Acidithiobacillus caldus and Leptospirillum ferriphilum // Biochem. Eng. J. 2015. V. 93. P. 142–150.
Zhao H., Zhang Y., Zhang X., Qian L., Sun M., Yang Y., Zhang Y., Wang J., Kim H., Qiu G. The dissolution and passivation mechanism of chalcopyrite in bioleaching: An overview // Miner. Eng. 2019. V. 136. P. 140–154.
Дополнительные материалы
- скачать Muravev_1.tiff
- Рис. S1. Доля последовательностей генов 16S рРНК (%) микроорганизмов по данным метагеномного анализа сообщества, развившегося при 35°С
- скачать Muravev_2.tiff
- Рис. S2. Доля последовательностей генов 16S рРНК (%) микроорганизмов по данным метагеномного анализа сообщества, развившегося при 40°С
- скачать Muravev_3.tiff
- Рис. S3. Доля последовательностей генов 16S рРНК (%) микроорганизмов по данным метагеномного анализа сообщества, развившегося при 45°С


