Микробиология, 2020, T. 89, № 2, стр. 131-151
Синтрофия и межвидовой перенос электронов в метаногенных микробных сообществах
А. Н. Ножевникова a, *, Ю. И. Русскова a, Ю. В. Литти a, С. Н. Паршина a, Е. А. Журавлева a, А. А. Никитина a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: nozhevni@mail.ru
Поступила в редакцию 19.04.2019
После доработки 10.10.2019
Принята к публикации 29.11.2019
Аннотация
Анаэробная переработка муниципальных и других органических отходов является микробиологическим процессом, в результате которого из сложных органических веществ получается биогаз, состоящий из метана и углекислого газа (возобновляемый источник энергии), и стабилизированный осадок, который может использоваться в качестве органического удобрения. Разные группы микробного метаногенного сообщества постепенно разлагают сложные органические вещества до простых продуктов брожения, таких как водород, формиат, ацетат, короткоцепочечные летучие жирные кислоты, этанол и другие. Эти низкомолекулярные продукты являются субстратами и переносчиками для образования биогаза синтрофными бактериями и метаногенными археями на последней ступени анаэробного процесса – стадии метаногенеза. В настоящем обзоре рассматриваются синтрофные взаимосвязи между микроорганизмами, участвующими в процессе анаэробной деструкции органических веществ, а также два типа межвидового переноса электронов (МПЭ): опосредованный (IIET – Indirect Interspecies Electron Transfer) и прямой (DIET – Direct Interspecies Electron Transfer). Синтрофные взаимодействия между микроорганизмами на основе DIET можно интенсифицировать путем добавления в анаэробные реакторы различных кондуктивных (электропроводящих) материалов, что представляется исключительно перспективным для практического применения.
РОЛЬ СИНТРОФИИ В БИОДЕГРАДАЦИИ ОРГАНИЧЕСКИХ ВЕЩЕСТВ МЕТАНОГЕННЫМИ МИКРОБНЫМИ СООБЩЕСТВАМИ
Совместный метаболизм в анаэробных условиях, осуществляемый метаногенной микробной ассоциацией бактерии и метаногена, разлагающей этанол, был описан более пятидесяти лет назад (Bryant et al., 1967). Термин “синтрофия” был предложен при изучении смешаной культуры, представляющей собой комбинацию чистых культур фототрофных зеленых серобактерий и серо- или сульфатредукторов (Biebl, Pfennig, 1978). Под синтрофиными взаимодействиям в сообществах микроорганизмов предлагалось понимать совместный рост двух или более видов микроорганизмов на среде, содержащей вещества, недоступные в качестве субстратов роста каждому микробному виду в отдельности. Считалось, что происходит взаимозависимое или катаболическое, использование субстратов синтрофными ассоциациями микроорганизмов, когда один вид потребляет как субстрат продукт обмена другого, и происходит совместный рост на таких средах. Причины синтрофного роста могут быть различными, например, обмен факторами роста, в частности, витаминами между микроорганизмами (протокооперация); обмен субстратами, например, источниками углерода и азота, при котором один член микробной ассоциации может получать энергетический субстрат, а другой фактор роста, а также при синтрофном росте организмов может происходить анаболическое удаление токсического продукта (Заварзин, Бонч-Осмоловская, 1981).
Таким образом, синтрофия существует не только в метаногенных сообществах, однако, именно им посвящен обзор. В настоящее время синтрофия в метаногенном сообществе микроорганизмов определяется как термодинамически взаимозависимый образ жизни сообщества синтрофных бактерий с метаногенными археями, при этом первый организм использует субстрат, например, летучие жирные кислоты (ЛЖК) и образует ацетат, водород (и/или формиат), которые потребляется вторым микроорганизмом – метаногеном (Schink, Stams, 2013). Однако также показана синтрофия двух архей, где роль поставшика субстратов для метаногенной археи Methanococcus thermolithotrophicus (Methanothermococcus thermolithotrophicus) играет гетеротрофный археон Thermococcus celer (Bonch-Osmolovskaya, Stetter, 1991).
Разложение многих простых и сложных органических веществ (ОВ) в анаэробных условиях включает в себя ряд последовательных процессов, которые реализуют близко взаимодействующие и тесно связанные микроорганизмы. Процесс анаэробной деструкции, завершающийся метаногенезом, не так эффективен, как аэробное разложение ОВ в присутствии кислорода, и осуществляется медленно растущими анаэробными микроорганизмами, что связано с низким энергетическим выходом реакций анаэробного разложения ОВ. Энергетическая выгода от анаэробного метаболизма низка и разделена между трофическими группами бактерий, осуществляющих гидролитические, кислотогенные и ацетогенные реакции, а также метаногенными археями, образующими биогаз как конечный продукт процесса разложения ОВ, состоящий в основном из метана, диоксида углерода и небольшого количества примесей, в частности, сероводорода и аммиака. Образование других примесей зависит от состава исходного субстрата (Ножевникова и соавт., 2016).
В анаэробных условиях существует необходимость последовательных реакций деградации и, соответственно, возникновения синергетических взаимодействий, в отличие от процессов в аэробных условиях, когда кислород доступен. Синтрофный метаболизм в метаногенном микробном сообществе играет ключевую роль в превращении ОВ в биогаз. Он осуществляется в природе в болотах, осадках водоемов, переувлажненной почве, желудке жвачных животных, а также в антропогенных экосистемах в процессе анаэробной переработки сельскохозяйственных, промышленных и муниципальных органических отходов в управляемых биотехнологических системах, таких как анаэробные биореакторы (метантенки), полигоны захоронения твердых коммунальных отходов (ТКО) и в неуправляемых несанкционированных свалках ТКО. По сравнению с аэробными условиями, в анаэробных условиях возможности получения энергии микроорганизмами более разнообразны и сложны. Анаэробная деградация сложных ОВ включает большое число взаимозависимых последовательных реакций, в ходе которых продукты метаболизма одной группы микроорганизмов становятся субстратами для другой микробной группы, что приводит к превращению ОВ в более простые. В качестве промежуточных продуктов образуются длинноцепочечные жирные кислоты, спирты, некоторые аминокислоты, ароматические соединения, которые затем разлагаются до более простых субстратов для метаногенов: водорода, формиата, ацетата, метильных соединений, которые они превращают в биогаз. При этом удаление конечного продукта разложения промежуточных ОВ в ходе анаэробного процесса метаногенеза способствует смещению равновесия в сторону продуктов реакции, соответственно, в результате эволюции микроорганизмы образовали партнерские взаимоотношения и разработали специализированные биохимические механизмы, позволяющие им адаптироваться к жизни в анаэробной среде (Morris et al., 2013).
Метаногенное микробное сообщество представляет собой биоценоз анаэробных бактерий и архей, четыре основные группы которых активны на соответствующих этапах биодеградации ОВ: 1) гидролитические бактерии, разлагающие сложные полимерные субстраты на более простые; 2) бродильные ацидогенные бактерии, сбраживающие мономеры до ЛЖК, лактата и других органических кислот, спиртов (метанол, этанол), водорода; 3) синтрофные бактерии, разлагающие ЛЖК, спирты и некоторые другие соединения, образовавшиеся на предыдущих этапах гидролиза и брожения, до H2, CO2 и ацетата, а также они могут разлагать непосредственно ацетат; и 4) три типа метаногенных архей, которые образуют собственно биогаз: преимущественно водородиспользующие, ацетокластические и, в меньшей степени, метилотрофные. Схема разложения ОВ метаногенным микробным сообществом приведена на рис. 1.
Рис. 1.
Образование биогаза анаэробным сообществом в условиях отсутствия нитратов, оксидов металлов и сульфатов (по Schink, Stams, 2013; Shrestha et al., 2014: Sikora et al., 2017).
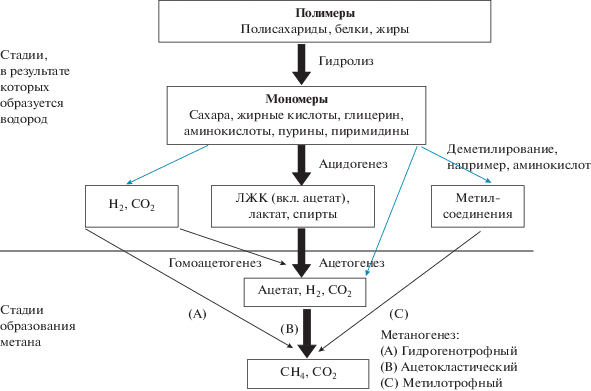
Гидролитические и бродильные бактерии наиболее активны, и их численность в биореакторе выше, чем численность микроорганизмов остальных групп, участвующих в процессе деструкции ОВ. Гидролитические бактерии филогенетически разнообразны, однако два филума – Bacteroidetes и Firmicutes – включают большинство известных к настоящему времени видов. По сравнению с метаногенами, гидролитические бактерии растут быстро и имеют более низкую чувствительность к изменениям таких факторов внешней среды, как pH и температура. Гидролиз биополимеров осуществляется с помощью экзоферментов и происходит вне клеток гидролитиков. Таким образом, низкомолекулярные продукты гидролиза становятся субстратами не только самих гидролитиков, но и многочисленных бродильщиков, так называемых ацидогенов. Ацидогенные бактерии, преобразyющие продукты гидролиза на стадии ацидогенеза в ЛЖК (ацетат, пропионат, изобутират, бутират, валерат и изовалерат), спирты, лактат, формиат, CO2 и H2, относятся к филумам Bacteroidetes, Chloroflexi, Firmicutes и Proteobacteria (Venkiteshwaran et al., 2015). При избыточном накоплении ЛЖК в анаэробном биореакторе может дестабилизироваться процесс метаногенеза вследствие снижения рН среды до уровня, неблагоприятного для микроорганизмов, осуществляющих другие стадии разложения ОВ. Разложение ЛЖК и некоторых других низкомолекулярных веществ с образованием биогаза может произойти только в результате синтрофных реакций, в которых два метаболически различных микроорганизма зависят друг от друга при осуществлении деградации определенного субстрата.
Существуют факультативные и облигатные синтрофные взаимодействия бактерий и архей. В первом случае синтрофные бактерии способны самостоятельно разлагать некоторые субстраты, в том числе простые сахара, а использующий водород архейный спутник влияет на их рост и формирование ими метаболических продуктов. В облигатных синтрофных сообществах бактерии и археи в одиночку не способны разлагать специфические ОВ, а только совместно (Sekiguchi et al., 2006; Stams, Plugge, 2009; Schink, Stams, 2013). Например, бактерии Pelotomaculum schinkii, Syntrophomonas zehnderi, Pelotomaculum isophthalicicum и другие являются облигатными синтрофами (de Bok et al., 2005; Sousa et al., 2007).
Синтрофные бактерии метаногенных сообществ окисляют ЛЖК, бензоат, лактат, этанол, глицерин и некоторые другие соединения до ацетата, двуокиси углерода, водорода и/или формиата, которые немедленно используются гидрогенотрофными и ацетотрофными метаногеными археями (Stams et al., 2012; Schink, Stams, 2013). При этом поддержание низкой концентрации водорода (10–4 атм. и ниже) является обязательным условием для осуществления синтрофного разложения субстратов, иначе энергия Гиббса будет выше нуля, и протекание реакции будет невозможным (McInerney et al., 2008). В соответствии с термодинамическими расчетами, даже небольшое увеличение парциального давления водорода ингибирует деградацию ЛЖК синтрофными культурами (Stams, 1994; Stams, Plugge, 2009; Angelidaki et al., 2011). Реакции синтрофного разложения ЛЖК и некоторых других простых соединений в мезофильных условиях и изменение свободной энергии Гиббса приведены в табл. 1.
Таблица 1.
Реакции синтрофного разложения ЛЖК и некоторых других простых соединений в мезофильных условиях и изменения свободной энергии Гиббса
| Реакции синтрофного разложения без потребляющего водород метаногена | ΔGo', кДж |
|---|---|
| ЛЖК | |
| Ацетат | +105 (Angelidaki et al., 2011) |
| СН3СОО– + 4H2О → ${\text{2HCO}}_{{\text{3}}}^{ - }$ + H+ + H2 | +94.9 (Schink, Stams, 2013) |
| Пропионат (метилмалонильный путь) | +76.1 (de Bok et al., 2004) |
| СН3СН2СОО– + 3Н2О → СН3СОО– + ${\text{НСО}}_{{\text{3}}}^{ - }$ + Н+ + 3Н2 | +76.0 (Angelidaki et al., 2011) |
| Пропионат (путь дисмутации) | +72.2 (de Bok et al., 2004) |
| СН3СН2СОО– + ${\text{2НСО}}_{{\text{3}}}^{ - }$ → СН3СОО– + 3НСОО–Н+ | +72 (Stams et al., 2012) |
| Бутират | +48 (Angelidaki et al., 2011) |
| СН3СН2СН2СОО– + 2Н2О → 2СН3СОО– + Н+ + 2Н2 | |
| Бутират– | +46 (Stams et al., 2012) |
| СН3СН2СН2СОО– + ${\text{2НСО}}_{{\text{3}}}^{ - }$ → 2СН3СОО– + 2НСОО– + Н+ | |
| Этанол и лактат | |
| Этанол | +9.6 (Schink, Stams, 2013) |
| CH3CH2OH + Н2О → СН3СОО– + Н+ + 2Н2 | |
| Лактат | –4.2 (Stams, 1994) |
| ${\text{2}}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{{\text{3}}}^{ - }$ + 2H2O → СН3СОО– + ${\text{HCO}}_{{\text{3}}}^{ - }$ + H+ + 2H2 | |
| Ароматические соединения | |
| Бензоат | + 49.5 (Schink, Stams, 2013) |
| С7Н5О2 + 6Н2О → 3СН3СОО– + 2Н+ + СО2 + 3Н2 | |
| Фенол | +10.2 (Schink, Stams, 2013) |
| С6Н5ОН + 5Н2О → 3СН3СОО– + 3Н+ + 2Н2 | |
| Аминокислоты | |
| Аланин | +2.7 (Schink, Stams, 2013) |
| CH3CH${\text{NН}}_{{\text{3}}}^{ + }$COO– + 2Н2О → СН3СОО– + ${\text{NН}}_{{\text{4}}}^{ + }$ + CO2 + 2Н2 | |
| Глицин | +17.8 (Schink, Stams, 2013) |
| CH2$\left( {{\text{NH}}_{{\text{3}}}^{ + }} \right)$COO– + 2H2O + H+ → 2CO2 + ${\text{NН}}_{{\text{4}}}^{ + }$ + 3H2 | |
| Реакции синтрофного разложения ЛЖК с водородпотребляющими метаногенами | |
| Ацетат | –31 (de Bok et al., 2004; Angelidaki et al., 2011) |
| СН3СОО– + Н+ → СН4 + ${\text{НСО}}_{{\text{3}}}^{ - }$ | –36 (Schink, Stams, 2013) |
| Пропионат | –56.6 (Stams, 1994) |
| СН3СН2СОО– + 1.75H2O → 1.75СН4 + ${\text{1}}{\text{.25НСО}}_{{\text{3}}}^{ - }$ + 0.25Н+ | –56.4 (de Bok et al., 2004) |
| Бутират | –81.7 (Stams, 1994) |
| СН3СН2СН2СОО– + 2.5Н2О → 2.5СН4 + ${\text{1}}{\text{.5НСО}}_{{\text{3}}}^{ - }$ + 0.5Н+ | |
| Реакции утилизации водорода и формиата метаногенами и ацетогенами | |
| Водород | –135.6 (de Bok et al., 2004) |
| 4Н2 + ${\text{НСО}}_{{\text{3}}}^{ - }$ + Н+ → СН4 + 3Н2О | –131.0 (Schink, Stams, 2013) –136 (Angelidaki et al., 2011) |
| Формиат | –130.4 (de Bok et al., 2004) |
| 4НСООН– + Н+ + Н2О → СН4 + ${\text{3НСО}}_{{\text{3}}}^{ - }$ | –130 (Stams et al., 2012) |
| Водород | –105 (Angelidaki et al., 2011) |
| 4Н2 + $2{\text{HCO}}_{3}^{ - }$ + Н+ → СН3СОО– + 4Н2О | –94.9 (Schink, Stams, 2013) |
| Реакция ацетокластического метаногенеза | |
| Ацетат | –31 (Stams, 1994; de Bok et al., 2004) |
| СН3СОО– + Н2О → СН4 + ${\text{НСО}}_{{\text{3}}}^{ - }$ | |
Ранее предполагалось, что основой синтрофного метаболизма является передача водорода между микроорганизмами, однако позже было установлено, что формиат также играет важную роль в передаче электронов, то есть оба интермедиата являются переносчиками электронов от синтрофных бактерий к метаногенным археям (Stams, Plugge, 2009; Sieber et al., 2014; Sikora et al., 2017). Действие муравьиной кислоты (формиата) взаимосвязано с ролью водорода и зависит от факторов окружающей среды (Schink et al., 2017). При стандартных условиях (рН 7.0; концентрация 1 М; давление 1 атм.) происходит следующая обратимая реакция:
В частности, синтрофное микробное разложение пропионата Syntrophobacter fumaroxidans и бутирата Syntrophomonas (Syntrophospora) bryantii происходит, только если метаногенный партнер использует как водород, так и формиат (de Bok et al., 2004; McInerney et al., 2008). При этом межклеточные расстояния между синтрофными микроорганизмами-партнерами определяют скорости переноса молекул-переносчиков электронов – молекулярного водорода и формиата, поэтому для анаэробных синтрофных бактерий и метаногенных архей характерно образование микробных агрегатов и гранул – своеобразных микробных биопленок (Stams, Plugge, 2009).
Syntrophomonas wolfei, использующий жирные кислоты в качестве энергетического субстрата, был первой описанной бактерией, синтрофно окисляющей ЛЖК в ко-культуре с водород- и/или формиат-использующим микроорганизмом (McInerney et al., 2008). Показано, что некоторые бактерии, подобно представителям рода Syntrophobacter, имеют разнообразный метаболизм и растут на различных субстратах либо ферментативно, либо используя анаэробное дыхание в присутствии акцепторов электронов, например, сульфата (Chen et al., 2005). Водород может потребляться водород-использующим партнером, обычно метаногеном, а также сульфатредуктором и гомоацетогенной бактерией, в зависимости от их присутствия в консорциуме микроорганизмов и наличия соответствующих акцепторов электронов. Синтрофные взаимоотношения микроорганизмов в анаэробных условиях предполагают, что оба партнера зависят друг от друга в осуществлении метаболической активности, и эта взаимная зависимость не может быть преодолена простым добавлением косубстрата или другого питательного вещества (Schink, Stams, 2013).
Метаногенные археи являются необходимой составной частью синтрофного метаногенного сообщества. В настоящее время все известные строго анаэробные культивируемые метаногены принадлежат к типу Euryarchaeota домена Archaea (Hedderich, Whitman, 2013). Водород-использующие метаногены представляют самую большую группу, в которую входит более десяти порядков. К ацетокластическим метаногенам, использующим в качестве субстрата ацетат, относятся представители двух родов порядка Methanosarcinales: Methanothrix (сем. Methanosaeta) и Methanosarcina (сем. Methanosarcinaceae). Представители рода Methanothrix являются строго ацетокластическими. Представители рода Methanosarcina способны использовать в качестве субстратов для образования метана не только ацетат и Н2/СО2, но и напрямую метанол и другие метильные соединения. Метилотрофные метаногены относятся к порядку Methanosarcinales, семейству Methanosarcinaceae. Метилированные соединения используют также метилредуцирующие метаногены, неспособные диспропорционировать эти субстраты и облигатно зависящие от Н2 и/или формиата, являющихся донорами электронов для восстановления метильных групп до метана. К ним относятся представители порядков Methanobacteriales, Methanosarcinales, Methanomassiliicoccales. Данные о ме-танобразующих археях, их физиологических свойствах и филогенетической принадлежности обобщены в недавнем обзоре (Каллистова и соавт., 2017). Недавно открыты новые, пока не полученные в чистых культурах, экстремально галофильные метил-восстанавливающие эуриархеоты, существование которых проливает свет на эволюционное происхождение метаногенов (Sorokin et al., 2017).
Открытие переноса генов между членами синтрофного сообщества привело к предположению, что археи и бактерии эволюционно развились как сообщества, а не как отдельные живые организмы с независимыми образами жизни, и что именно мироорганизмы анаэробных синтрофных сообществ играли важнейшую роль в образовании эукариотической клетки. Соответственно была высказана гипотеза, что эукариоты возникли из анаэробной симбиотической ассоциации строго зависимой водород-автотрофной археи (хозяин), использующей молекулярный водород, который образует бактерия (симбионт), как продукт анаэробного органотрофного метаболизма (Martin, Muller, 1998). Однако на основе анализа данных метагеномных сборок о метаболизме недавно открытых асгардархей сделан вывод, что непосредственные предки эукариот, скорее всего, были гетеротрофами, выделявшими водород как конечный продукт метаболизма, который они отдавали протеобактериям. Недавно японскими учеными предложена модель эукариогенеза через симбиоз архей и альфа-протеобактерий, и был описан представитель асгардархей “Candidatus Prometheoarchaeum syntrophicum штамм MK-D1”, который получает энергию из аминокислот и может обмениваться электронами с симбиотическими партнерами – метаногенными археями и сульфатредуцирующими бактериями (Imachi et al., 2019).
Накопление опытных данных о синтрофном метаболизме и геномный анализ микроорганизмов синтрофного метаногенного сообщества открывает новые горизонты научного познания природы эволюции на планете. Изучение синтрофии в анаэробных условиях важно и для практического применения. В мировой практике очистку сточных вод традиционно проводят в метантенках в мезофильных условиях, хотя термофильный процесс протекает гораздо быстрее и обеспечивает обеззараживание сбраживаемых отходов. Например, термофильные метантенки успешно используются на основных крупнейших очистных сооружениях г. Москвы – Курьяновской и Люберецкой станциях очистки сточных вод.
ОСНОВНЫЕ СУБСТРАТЫ СИНТРОФНЫХ БАКТЕРИЙ
При стандартных условиях окисление этанола, ЛЖК и других негазообразных продуктов брожения, сопровождающееся образованием водорода или формиата, является эндоэнергетической реакцией (положительная свободная энергия Гиббса). Однако в синтрофном метаногенном сообществе получение энергии становится возможным, если в системе поддерживается очень низкое парциальное давление водорода, которое обеспечивается партнерами синтрофных бактерий, потребляющими водород.
Этанол стал первым субстратом, для которого было показано явление синтрофии в анаэробных условиях. В лаборатории Технологического университета г. Делфта, Нидерланды, в 1936 г. Баркером (Н. Albert Barker) был описан новый микроорганизм “Methanobacterium omelianskii”, образующий метан из этанола. На протяжении последующих тридцати лет проводилось изучение этого организма, который был реклассифицирован как “Methanobacillus omelianskii”, а также были выделены новые культуры “метаногенов”, образующие метан из органических кислот (бутират, пропионат). Однако в 1967 году Бриант (Marvin P. Bryant) с коллегами в лаборатории Иллинойского университета, США, продемонстрировали, что “Methanobacillus omelianskii” является синтрофной ассоциацией двух микроорганизмов: “метаногена М”, образующего метан из водорода и углекислоты, и “организма S”, который непосредственно разлагает этанол с образованием ацетата и выделением водорода (Bryant et al., 1967). Метаноген позднее был определен как Methanobacterium bryantii штамм М.o.Н., а организм S, превращающий этанол в ацетат и водород, не был выделен и описан в чистой культуре. Таким образом, для данной синтрофной ассоциации микроорганизмов был показан межвидовой перенос водорода при превращении этанола в ацетат и метан. Соответственно, при удалении водорода из среды общая реакция оказалась термодинамически возможна (McInerney et al., 2008; Schink, Stams, 2013; табл. 1).
Организм S:
Метаноген Methanobacterium bryantii штамм М.o.Н.:
Синтрофная ассоциация организмов:
Синтрофное разложение этанола начинается с его окисления до ацетальдегида, сопровождающееся образованием НАДН, и далее ацетальдегид окисляется до ацетата с образованием восстановленного ферредоксина. На окисление одной молекулы этанола затрачивается одна молекула АТФ, энергия образуется путем субстратного фосфорилирования. У некоторых синтрофных бактерий, включая Pelobacter carbinolicus, обнаружены гены ион-транспортного мембранного белка ферредоксин:НАД+оксидоредуктазы и гидрогеназы, которая непосредственно может катализировать окисление НАДН и восстанавливать ферредоксин с образованием водорода (Sikora et al., 2017). Синтрофно окислять этанол способны Thermoanaerobacter brockii, Desulfovibrio vulgaris, P. carbinolicus, Pelobacter acetylenicus, Tepidanaerobacter syntrophicus (Sekiguchi et al., 2006, Rotaru et. al., 2012).
Ацетат образуется на стадиях ацидогенеза и ацетогенеза, осуществляемых бродильными и синтрофными бактериями соответственно, в наибольшем количестве по сравнению с остальными промежуточными продуктами разложения ОВ и является важнейшим предшественником метана. Согласно проведенным исследованиям с использованием изотопного метода, в мезофильных условиях в метаногенных сообществах около 70% CH4 образуется из ацетата, а чуть менее 30% из H2 и CO2 (Venkiteshwaran et al., 2015). Ацетат разлагается с образованием метана в результате ацетокластического расщепления или синтрофного разложения. На путь разложения ацетата влияет температура окружающей среды. В психрофильных условиях анаэробная биодеградация ацетата происходит в основном за счет активности ацетокластических метаногенов, в этих же условиях высокую активность проявляют ацетатобразующие гомоацетогенные бактерии. Так, в аноксидной зоне рисовых чеков вклад ацетокластического метаногенеза в общий метаногенез составлял 85% при температуре 10°С, 67% при 30°С, а при 50°С снижался до нуля (Conrad, 2002). Таким образом, с ростом температуры начинает преобладать процесс анаэробного синтрофного разложения ацетата. В процессе высокоинтенсивного анаэробного сбраживания осадков сточных вод повышение температуры с 55 до 65°С увеличивало вклад синтрофного окисления ацетата в общую генерацию метана с 60 до 100% (Ho et al., 2014). Исследование влияния температуры на метаногенез в озерном осадке также показало, что в термофильных условиях ацетат может практически полностью разлагаться синтрофно (Nozhevnikova et al., 2007). Описано синтрофное разложение ацетата с образованием метана в нефтяном резервуаре при высокой температуре до 60°С (Nazina et al., 2017). Первая термофильная синтрофная ацетатокисляющая бактерия Thermacetogenium phaeum gen. nov., sp. nov. была выделена и описана японскими исследователями (Hattory et al., 2000). Синтрофное разложение ацетата может происходить при участии сульфатвосстанавливающих бактерий, что впервые было показано на примере выделения из заводняемого пласта нефтяного месторождения на полуострове Апшерон микробной ассоциации, включающей сульфатвосстанавливающие бактерии при отсутствии метаногенов, растущей в интервале 20–37°С (Розанова, Назина, 1985).
Появляется все больше данных о физиологии и биохимии синтрофных ацетатокисляющих бактерий, которые относятся к классу Clostridia: Thermoacetogenium phaeum, Pseudothermotoga lettingae, Clostridium ultunense, Clostridium sporomusa, Syntrophaceticus schinkii, Tepidanaerobacter syntrophicus, Tepidanaerobacter acetatoxydans, Candidatus Syntrophonatronum acetioxidans, Moorella sp., и к классу Deltaproteobacteria – Geobacter spp. (Sikora et al., 2017). Показано, что T. phaeum и другие синтрофные ацетатокисляющие бактерии обладают энзиматическим аппаратом, позволяющим использовать путь Вуда–Льюнгдала и образовывать АТФ как при окислении ацетата, так и при его синтезе. Окисление ацетата синтрофами осуществляется через окислительный CODH/ACS путь, а ацетогены, синтезирующие ацетат из водорода и углекислого газа, используют восстановительный CODH/ACS путь, который происходит в противоположном направлении. При этом направление реакций меняется в зависимости от преобладающих концентраций субстратов и продуктов в среде на пограничном энергетическом состоянии системы (Schink, Stams, 2013; Sikora et al., 2017). Синтрофные бактерии в паре с метаногенными археями способны разлагать более длинные, чем ацетат, ЛЖК до ацетата, который, в свою очередь, помимо синтрофного разложения до водорода и углекислоты, служит субстратом для ацетокластических метаногенных архей (Hedderich, Whitman, 2013).
Пропионат образуется на стадии ацидогенеза, и его синтрофное разложение протекает с наименьшей скоростью, по сравнению с другими ЛЖК, поэтому скорость деградации пропионата микробным синтрофным сообществом определяет скорость разложения ОВ в анаэробных условиях. В зависимости от компонентного состава сбраживаемого субстрата, доля пропионата в реакторе может составлять от 8 до 63% от общего содержания продуктов брожения. Показано также, что содержание пропионата в общем пуле ЛЖК увеличивается при возрастании концентрации протеинов и снижается при увеличении содержания углеводов и жиров (Ma et al., 2017). К синтрофным бактериям, разлагающим пропионат, относятся представители семейства Syntrophomonadaceae: бактерии рода Syntrophobacter (S. fumaroxidance, S. wolinii) и Smithella propionica, а также представители семейства Peptococcaceae: представители рода Desulfotomaculum (D. thermocisternum, D. themobaezoicum, D. thermosyntrophicum) и рода Pelotomaticulum (P. thermopropionicum) (Sikora et al., 2017). Выделяют два типа синтрофных бактерий, окисляющих пропионат в сотрудничестве с метаногенами. Первый тип использует метилмалонил-СоА (MMC) путь, в котором при окислении пропионата образуются три пары электронов. Организмы этого типа включают Syntrophobacter spp. и Pelotomaculum spp. (McInerney et al., 2008). Второй тип окисления пропионата обнаружен только у Smithella propionica, которая окисляет пропионат путем дисмутации, и в результате из двух молекул пропионата образуется шестиуглеродный комплекс, распадающийся далее на ацетат и бутират (de Bok et al., 2004) (табл. 1).
Бутират также образуется в ходе анаэробного разложения ОВ на стадии ацидогенеза. При разложении отходов, богатых жирами и углеводами, например, пищевых отходов, происходит быстрое накопление бутирата (Ma et al., 2017). Культивируемые представители, синтрофно окисляющие бутират, достаточно изучены, несмотря на их медленный рост и трудности, связанные с выделением чистой культуры. К настоящему времени описаны два мезофильных (Syntrophomonas и Syntrophus) и два термофильных (Syntrophothermus и Thermosyntropha) рода, включающих 12 видов бактерий, которые окисляют бутират в синтрофной ассоциации с метаногенными археями. К наиболее распространенным бутиратразлагающим синтрофным бактериям относятся представители семейства Syntrophomonadaceae: Syntrophomonas wolfei, S. bryantii, S. curvata, S. sapovorans, S. palmitatica, S. cellicola, S. saponavida, S. erecta, S. zehnderi, Syntrophothermus lipocalidus, Thermosyntropha lipolytica, представители порядка Syntrophobacterales (семейство Syntrophobacteraceae и Syntrophus acidotrophicus) (Sikora et al., 2017). При деградации 1 моля бутирата образуется 2 моля ацетата, что приводит, в свою очередь, к накоплению ацетата и может привести к дестабилизации процесса анаэробного сбраживания (Lins et al., 2014). Синтрофное разложение бутирата происходит по типу β-окисления (Sieber et al., 2010) (табл. 1).
Бензоат является одним из промежуточных соединений при производстве азокрасителей и аминоароматических соединений и может попадать в сточные воды. Способностью использовать бензоат в качестве субстрата для синтрофного роста обладают представители рода Syntrophus – S. buswellii, S. gentianae и S. aciditrophicus, а также представители рода Sporotomaculum – S. syntrophicum, и рода Pelotomaculum P. terephthalicicum и P. isophthalicicum (McInerney et al., 2008). Изменение свободной энергии при синтрофном окислении бензоата составляет от 30 до 45 кДж, это означает, что лишь около трети необходимого АТФ образуется при таком типе окисления бензоата (табл. 1). При анаэробном разложении бензола происходит активирование бензольного кольца в результате реакций карбоксилирования, анаэробного гидроксилирования и образования КоА-тиоэфиров ароматических кислот, а также разрыв до С1- и С2-соединений. Накопление ацетата и водорода отрицательно влияет на анаэробное разложение бензоата, поэтому при синтрофном разложении наличие метаногенного партнера является критически важным (Sieber et al., 2010).
Лактат образуется на стадии сбраживания простых органических субстратов в процессе молочнокислого и смешанного типов брожения. Некоторые микроорганизмы, такие как Lactobacillus plantarum, L. buchneri, L. parabuchneri, Thermosediminibacter oceani, T. litoriperuensis способны использовать лактат несинтрофно и разлагать его в анаэробных условиях. Одной из экологически важных групп, синтрофно разлагающих лактат, являются представители рода Desulfovibrio, которые в отсутствие сульфата в синтрофных ассоциациях с метаногенами разлагают лактат с образованием ацетата и водорода. Именно этот путь разложения лактата является наиболее распространенным (Sikora et al., 2017).
К приведенным сведениям об основных субстратах синтрофных бактерий следует добавить, что из анаэробных реакторов выделено более 25 видов синтрофных бактерий. При этом количественные данные, полученные in situ с помощью молекулярных методов (FISH – флуоресцентной гибридизации in situ, MAR-FISH – мембранной гибридизации), свидетельствуют о низком содержании метаболически активных синтрофов в различных лабораторных и полномасштабных биoреакторах. Количество синтрофных бактерий в этих системах редко превышает 5% от общей численности микроорганизмов, тем не менее, их вклад в работу анаэробного консорциума невозможно недооценивать (Stams et al., 2012).
МЕЖВИДОВОЙ ПЕРЕНОС ЭЛЕКТРОНОВ В ПРОЦЕССЕ МЕТАНОГЕНЕЗА
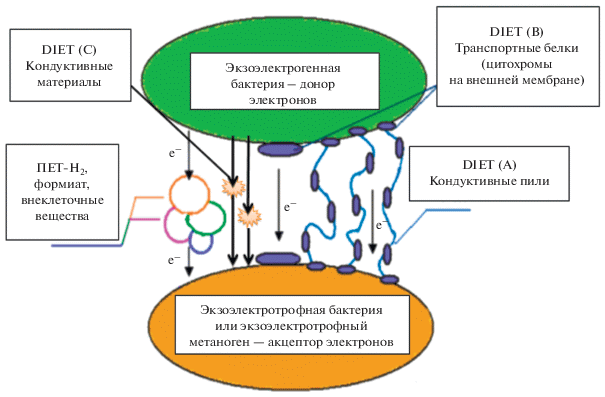
Синтрофные взаимодействия между бактериями и метаногенными археями, включая межвидовой перенос электронов (МПЭ), лежат в основе осуществления эффективного процесса анаэробного разложения ОВ с образованием биогаза. Скорость переноса электронов важна для термодинамики всего процесса анаэробной деструкции и, как указано ранее, вызвана необходимостью обеспечивать низкое парциальное давление водорода в среде (Stams, Plugge, 2009). Соответственно, скорость передачи электронов между синтрофными бактериями и метаногенными археями может быть узким местом для процесса анаэробной деградации ОВ. На сегодняшний день показано, что в метаногенных сообществах микроорганизмы могут передавать электроны от одного вида другому, используя 1) опосредованный перенос электронов (Indirect Interspecies Electron Transfer – IIET), который происходит через соединения биогенного происхождения – водород и формиат в качестве переносчиков, и/или 2) прямой перенос (Direct Interspecies Electron Transfer – DIET), который осуществляется при прямом контакте синтрофной бактерии и метаногенной археи (Cruz Viggi et al., 2014; Barua, Dhar, 2017; Yan et al., 2017; Baek et al., 2018; Martins et al., 2018; Park et al., 2018). Основные схемы МПЭ приведены на рис. 2.
МЕХАНИЗМЫ ОПОСРЕДОВАННОЙ ПЕРЕДАЧИ ЭЛЕКТРОНОВ
Первые публикации об IIET – опосредованном переносе электронов через водород и формиат – появились в конце 1970-х годов. Однако механизм передачи электронов между синтрофными бактериями и метаногенными археями через водород и/или формиат в метаногенных сообществах стал более или менее изучен только к настоящему времени (Schink, Stams, 2013; Sieber et al., 2014; Schink et al., 2017). Опосредованный межвидовой перенос электронов IIET представлен двумя способами в зависимости от переносчика: с использованием водорода или формиата и через внеклеточные вещества, например, гуминовые кислоты и другие соединения (Martins et al., 2018). Этот тип переноса электронов между синтрофными бактериями и метаногенными археями назван опосредованным, потому что электроны, необходимые для процессов восстановления и окисления, переносятся растворимыми веществами – водородом, формиатом или через внеклеточные вещества. Описаны два пути опосредованной передачи электронов, IIET: 1) через водород и формиат, которые действуют как переносчики (шаттлы) электронов и 2) через другие нерастворимые биохимические соединения, в частности, гуминовые вещества. Выше были приведены случаи взаимодействия синтрофных бактерий и метаногенных архей в ко-культурах, разлагающих частично окисленные соединения, образующиеся в процессе анаэробного брожения: ЛЖК (ацетат, бутират, пропионат) и этанол. При высоких концентрациях водорода (>10 Па) активность гидрогеназы синтрофов ингибируется, и, следовательно, метаболизм синтрофных бактерий также подавляется, в то время как рост метаногенов стимулируется (Stams, Plugge, 2009; Sieber et al., 2012).
Следует отметить, что образование формиата было обнаружено в ко-культурах, растущих на некоторых белках и аминокислотах, а также на пропионате и бутирате (Sousa et al., 2007; Stams, Plugge, 2009). В некоторых сообществах межвидовой перенос электронов через формиат может преобладать, благодаря тому, что у формиата в три раза выше коэффициент диффузии по сравнению с водородом (Shrestha et al., 2014).
Основным ограничением IIET, осуществляемого с помощью водорода или формиата, является то, что любое замедление процесса потребления этих веществ вызывает накопление ЛЖК, которое блокирует синтрофный процесс. Это происходит, потому что накопление ЛЖК снижает рН, а низкие рН неблагоприятны для метаногенов, так как при низких рН ЛЖК начинают переходить из диссоциированной формы в недисоциированную (например, бутират переходит в масляную кислоту), которая диффундирует через клеточную мембрану, снижает внутриклеточный рН и вызывает повреждение клетки (Baek et al., 2016). В многочисленных анаэробных нишах IIET может осуществляться с помощью нерастворимых веществ, присутствующих в перегное − гумуса и гуминовых кислот, при этом как хиноны так и нехиноновые функциональные группы способны к переносу электронов и являются важными окислительно-восстановительными функциональными элементами гумуса, и передача электронов микроорганизмами может осуществляться между восстановленным и окисленным гумусом. Физиологически различные анаэробные микроорганизмы были исследованы на способность окислять субстраты, используя гуминовые кислоты или аналог гумуса – aнтрахинон-2,6-дисульфонат (AQDS)/восстановленный (AHQDS) в качестве конечного акцептора электронов, например сульфатредукторы Desulfitobacterium PCE1 и Desulfovibrio G11, метаноген Methanospirillum hungatei JF1, окисляли водород с восстановлением гуминовых кислот или AQDS, а Desulfitobacterium dehalogenans и Desulfitobacterium PCE1 разлагали лактат до ацетата с восстановлением гуминовых веществ (Cervantes et al., 2002). На примере ко-культуры Geobacter metalireducens и G. sulvurreducens, которые разлагали этанол с восстановлением фумарата в присутствии гуминовых веществ, была продемонстрирована способность синтрофных бактерий к МПЭ, где в качестве молекулы-шаттла выступает хинон гуминовых веществ – Quinone-mediated Interspecies Electron Transfer (QUIET), таким образом, обеспечивая МПЭ между этими двумя организмами (Smith et al., 2015). Гуминовые кислоты могут быть окислительно-восстановительными посредниками в анаэробном абиотическом восстановлении нерастворимых металлических оксидов, таких как Fe(III) и Mn(IV), и, будучи повторно окисляемыми, принимать участие в качестве донора электронов для восстановления соединений с положительным окислительно-восстановительным потенциалом. Многие анаэробные микроорганизмы способны восстанавливать гумус, и при этом восстановленные гуминовые вещества могут мигрировать в менее восстановленные зоны почв и отложений, чтобы снова служить донорами электронов для новых восстановительных реакций с экологически важными для данных ниш акцепторами электронов (Lovley et al., 1999).
МЕХАНИЗМЫ ПРЯМОГО МЕЖВИДОВОГО ПЕРЕНОСА ЭЛЕКТРОНОВ
Со времени первого экспериментального подтверждения прямого межвидового переноса электронов (DIET) прошло менее десяти лет (Summers, 2010), но предположения о существовании электроактивных взаимодействий между микроорганизмами высказывались ранее (Reguera et al., 2005; Stams, Plugge, 2009). DIET – это процесс переноса свободных электронов от одной микробной клетки к другой, при котором для транспорта электронов не используются восстановленные молекулы (водород, формиат, гуматы), как при II-ET (Dube, Guiot, 2015). Напомним, что бактерии, способные выделять и передавать электроны, называются экзоэлектрогенными, а метаногенные археи или другие микроорганизмы, принимающие электроны, называются электротрофными (Barua, Dhar, 2017). Феномен DIET был открыт в экспериментах с синтрофной бинарной культурой, состоящей из двух организмов – Geobacter metallireducens, окисляющей этанол экзоэлектрогенной бактерии, и электротрофной бактерии Geobacter sulfurreducens, восстанавливающей фумарат, при этом для доказательства возможности DIET в этой синтрофной ко-культуре Geobacter использовали штамм G. sulfurreducens, у которого отсутствовал ген hyb, отвечающий за способность использовать водород (Summers et al., 2010). Последовательный пересев бинарной культуры приводил к стимулированию образования бактериями электропроводящих агрегатов до 1 мм в диаметре, в которых наблюдали увеличенную продукцию мультигемового цитохрома c-типа OmcS, предположительно обеспечивавшего процесс DIET между двумя микроорганизмами через большое количество электропроводящих пилей в матриксе без образования растворимых интермедиатов (Summers et al., 2010; Lovley, 2017a). Электроны, высвобождающиеся во время потребления этанола G. metallireducens, передавались G. sulfurreducens для восстановления фумарата в сукцинат. IIET через водород или формиат в этих экспериментах был исключен, потому что G. sulfurreducens не мог использовать водород или формиат. Метатранскриптомный анализ показал низкое содержание транскриптов гидрогеназы и субъединиц формиатдегидрогеназы, что, таким образом, стало убедительным свидетельством прямого переноса электронов между G. metallireducens и G. sulfurreducens (Shrestha et al., 2013).
При DIET между клетками микроорганизма-донора электронов и микроорганизма-акцептора образуется поток электронов без образования их переносчиков, то есть водорода или формиата (Rotaru et al., 2012; Kouzuma et al., 2015; Storck et al., 2016; Lovley, 2017b); DIET, в отличие от IIET, не ингибируется высокой концентрацией водорода в среде. Одно из первых наблюдений процесса DIET было проведено на электрокондуктивных агрегатах микроорганизмов (Summers et al., 2010). Агрегация микроорганизмов в гранулы и биопленки в биореакторах и природных микробных сообществах обеспечивает необходимую близость клеток синтрофных партнеров для проведения межклеточных метаболических реакций с использованием процесса DIET (Lovley et al., 2017b). Анаэробные метаногенные гранулы и биопленки – это специализированная микросреда, в которой синтрофные бактериальные и архейные организмы развиваются в непосредственной близости. Для экзоэлектрогенных бактерий, разлагающих ОВ, нужен сток электронов, и электротрофные метаногены представляют собой идеальных партнеров для ассимиляции этих электронов через непрямые (клеточный матрикс) или прямые (е-пили, белковые структуры) клеточные контакты и для последующего образования метана. Метаногенные гранулы обладают электропроводимостью, и имеются достоверные доказательства того, что величина электропроводимости зависит от микробного состава гранулы и влияет на эффективность преобразования ОВ (Dube, Guiot, 2015). К настоящему времени описаны три типа DIET: А) при прямом контакте через электронпроводящие пили; В) через связанные с наружной мембраной электронтранспортирующие белки, в которых обнаруживают цитохромы с-типа; С) через небиологические электропроводящие (кондуктивные) материалы (Lovley, 2017b; Park et al., 2018).
Прямой межвидовой перенос электронов с помощью пилей (DIET-А)
При данном типе DIET передача электронов происходит через проводящие их пили без образования растворимых интермедиатов. Эти длинные выросты на клеточных стенках синтрофных бактерий называют “электронтранспортирующие пили”, “кондуктивные нанопровода” или просто “е-пили”, представляющие транспортные каналы для переноса электронов, например, от экзоэлектрогенных синтрофных бактерий на электротрофные метаногены. В результате изучения микробного внеклеточного переноса электронов этого типа DIET показано, что е-пили играют роль “нанопроводов” в процессах формирования кондуктивных биопленок с участием G. sulfurreducens (Shimoyama et al., 2009; Lovley, 2012), между синтрофными ко-культурами Geobacter (Summers et al., 2010), и также при совместном культивировании G. metallireducens с Methanosarcina barkeri (Rotaru et al., 2014a) или с Methanosaeta harundinacea (Rotaru et al., 2014a). Некоторые электронотрофные микроорганизмы, такие как Thiobacillus denitrificans (Kato et al., 2012a), метаногенные археи Methanosaeta harundinacea и Methanosarcina barkeri могут принимать и использовать электроны от G. sulfurreducens и G. metallireducens при синтрофном окислении фумарата (Rotaru et al., 2014a, 2014b).
Пространственная организация синтрофов и метаногенов считается критически важной для метаногенеза. Pelotomaculum thermopropionicum и Мethanothermobacter thermautotrophicus образуют крупные агрегаты, которые могут превышать несколько сотен микрометров в диаметре при синтрофном метаногенезе, где в качестве субстрата используется пропионат. Методом гель-электрофореза и микроскопического наблюдения с использованием флуоресцентно меченых антител нитевидные структуры, соединяющие P. thermopropionicum и М. thermautotrophicus были определены как пили, принадлежащие P. thermopropionicum. В симбиотических отношениях пили Pelotomaculum thermopropionicum имеют уникальные функции: с их помощью организм захватывает синтрофных партнеров, а также осуществляет специфическую межвидовую передачу сигналов для активации метаболизма архейного партнера и передачу ему электронов. Транскриптомные исследования показали, что значительное число генов в археях, включая вовлеченных в метаногенез, регулировалось путем контакта с белком пилей. Молекулярный механизм для передачи сигналов между P. thermopropionicum и М. thermautotrophicus является первым описанным примером, где белок играет роль межвидового коммуникатора между прокариотами (Shimoyama et al., 2009).
Обнаружение у синтрофных бактерий е-пилей привело к новому пониманию межвидовых взаимодействий между микроорганизмами в анаэробных биореакторах, например, в полномасштабных биореакторах для обработки сточных вод пивоваренного завода. Микробные гранулы, отобранные в этих биореакторах, были способны проводить электроны и содержали бактерии (Geobacter) и археи (Methanosaeta), транспортирующие электроны друг к другу (в процессе образования биогаза (Morita et al., 2011; Rotaru et al., 2014b). Действительно, показано, что е-пили обладают кондуктивностью, то есть способностью эффективно проводить электроны, которую до последнего времени объясняли присутствием большого количества ароматических аминокислот в составе белка пилей – пилина. Гены, кодирующие пилин, присутствуют у многих микроорганизмов таких родов, как Desulfobacterium, Deferribacter, Geoalkalibacter и Desulfobacula, однако механизм кондуктивности в настоящее время обсуждается. Предлагаются следующие модели переноса электронов вдоль нанопилей: туннелирование – явление исключительно квантовой природы/прыжки электронов с участием цитохромов для пилей Shewanella oneidensis; передача электронов за счет перекрывания pi–pi орбиталей ароматических аминокислот на примере нанопроводов Geobacter sulfurreducens; и электронная делокализации или электроволновая передача (Malvankar, Lovley, 2014). Методом криоэлектронной микроскопии обнаружено, что белковые нановолокна G. sulfurreducens состоят из полимеризованных цепей длиной 1 микрометр, содержащих определенным образом упакованные гексагемы цитохрома OmcSс, тем самым определяя молекулярный механизм электронной кондуктивности нанопилей. Роль белка пилина, ранее считавшегося структурной составляющей таких проводящих волокон, связывают с его потенциальной способностью регулировать секрецию и сборку нановолокон OmcS, а также других мультигемных цитохромов. Наличие кондуктивных нанопилей объясняет замечательную способность почвенных бактерий к переносу электронов на удаленные акцепторы для дыхания и совместного использования энергии и питательных веществ синтрофными партнерами (Wang et al., 2019).
В ДНК из почвы рисового поля было выявлено большое количество генов пилина, OmcS и цитохрома c, ассоциированного с е-пилями G. sulfurreducens. Был сделан вывод о возможности прямой передачи электронов (DIET) между Methanothrix (раньше Methanosaeta) и разными видами Geobacter (Holmes et al., 2017). У бактерий Aeromonas hydrophila, Acidithiobacillus ferroxidans, Desulfovibrio desulfuricans и Rhodopseudomonas palustris было показано образование электропроводимых белковых нитей, выполняющих роль е-пилей, но существенно отличающихся от них структурой, а именно меньшей толщиной и большей длиной (Walker et al., 2018). Недавно с помощью атомно-силовой микроскопии впервые обнаружено наличие кондуктивных пилей у археи Methanospirillum hungatei, хотя ранее считалось, что подобные электропроводящие структуры присутствуют только у бактерий (Walker et al., 2019).
Прямой межвидовой перенос электронов через белки, связанные с наружными мембранами цитохромов с-типа (DIET-В)
Цитохромы (или гемопротеины) – это мембранные железосодержащие белки. Наиболее часто встречается цитохром с, который является одноэлектронным переносчиком, свободно связанным с клеточной мембраной. Цитохромы с широко распространены у Geobacter и Shewanella и других электроактивных бактерий (Lovley, 2017a). Показано, что цитохромами с также обладают многие метаногенные археи (Kletzin et al., 2015). Транспорт электронов через связанные с мембраной белки (такие как OmcZ) может быть механизмом образования метана, и цитохром OmcZ считается важным интермедиатом при передаче электронов между микрорганизмом – их источником и микроорганизмом-акцептором (Park et al., 2018). Большую роль в межвидовом переносе электронов при синтрофии играет образование микробных агрегатов, таких как гранулы и биопленки, которые часто наблюдаются в метаногенных микробных сообществах, в том числе в анаэробной системе обработки сточных вод. Установлено, что электроны могут напрямую передаваться при очень близком контакте клеток. Еще одним механизмом реализации DIET является клеточная агрегация и синтез большого количества внеклеточного полимерного матрикса, причем компоненты матрикса могут служить проводниками электронов (Lovley, 2017a). Совместная агрегация наблюдается также в ко-культурах синтрофов и метаногенов, которые не образуют агрегаты в чистых культурах. Молекулярные механизмы, с помощью которых эти микроорганизмы принимают электроны от синтрофных партнеров, менее ясны, чем те, которые участвуют в DIET типа А (Park et al., 2018). Недавное открытие наличия полимеризованных цепей гексагемов цитохрома OmcS в структуре нанопилей G. sulfurreducens (Wang et.al., 2019) может привести к необходимости пересмотра классификации процесса DIET.
Стимулирование DIET и метаногенеза кондуктивными (электропроводящими) материалами (DIET-C)
Отсутствие у микроорганизмов пилей, с помощью которых мог бы осуществляться процесс DIET, может компенсироваться присутствием небиологических проводящих кондуктивных материалов на основе угля или оксидов железа. В начале 2010-х годов были начаты эксперименты с углеродными кондуктивными материалами, такими как: углеродная ткань (Sasaki et al., 2010), частицы графита (Kato et al., 2012a), (полу)кондуктивные и (нано)железо-оксидные минералы (магнетит) (Kato et al., 2012b), гранулированный активированный уголь (Liu et al., 2012), древесный уголь (Chen et al., 2014b), нержавеющая сталь, углеродные нити и ткани (Chen et al., 2014a; Dang et al., 2017). Результаты этих работ показали, что в присутствии кондуктивных материалов значительно увеличивалась скорость метаногенеза, и для этого процесса ввели новый термин “электрическая синтрофия” (Kato et al., 2012a).
Было высказано предположение, что стимулирующий эффект, оказываемый гранулированным активированным углем (ГАУ) на метаногенез, может состоять в замене им биогенных электропроводящих сетей, соединяющих электронпередающие и электронпринимающие микроорганизмы (Liu et al., 2012). Обладая высокой электропроводностью, ГАУ может являться проводником между синтрофами и метаногенами (Rotaru et al., 2014a). Добавление ГАУ к ко-культуре Geobacter metallireducens и G. sulfurreducens с omcS удаленным геном заметно ускоряло синтрофное окисление этанола, где ГАУ служит электронным каналом, тем самым облегчая DIET. Также было обнаружено, что при добавлении ГАУ в кокультуры G. metallireducens или G. sulfurreducens и М. barkeri микробные клетки были тесно связаны с ГАУ, но не были в близком контакте друг с другом. Это указывает на использование механизма проводимости, в котором электроны двигаются через кондуктивные материалы от электрон-передающих к электрон-принимающим клеткам (Baek et al., 2015; Yamada et al., 2015). Также ко-культура G. metallireducens и M. barkeri не окисляла этанол при отсутствии древесного угля в среде, однако в его присутствии осуществляла окисление этанола с образованием метана (Chen et al., 2014b).
Было продемонстрировано, что отсутствие связанного с пилями цитохрома c-типа (OmcS), необходимого для внеклеточной передачи электронов штамму Geobacter, могло быть компенсировано присутствием магнетита. Без магнетита мутантные штаммы Geobacter, не имеющие генов для синтеза OmcS, не были способны к эффективному формированию жизнеспособных ко-культур, но в присутствии магнетита OmcS-дефицитные мутанты вели себя так же, как дикий штамм, то есть мутация компенсировалась добавлением магнетита (Liu et al., 2015). На основании теоретических расчетов было высказано предположение, что DIET-С за счет потока электронов через частицы магнетита является гораздо более быстрым механизмом переноса электронов, по сравнению с IIET с водородом в качестве переносчика. Также экспериментально показано, что в присутствии магнетита скорость передачи электронов была в 106 раз выше (Cruz Viggi et al., 2014). Микроорганизмы способны прикрепляться к поверхности кондуктивных материалов и использовать их в качестве проводников для обмена электронами (Barua, Dhar, 2017). В анаэробных реакторах и при стационарном культивировании под действием кондуктивных материалов ускоряется синтрофное разложение бензоата, который является общим промежуточным звеном в анаэробном метаболизме ароматических соединений (Zhuang et al., 2015). Такие же выводы были сделаны исходя из результатов анаэробного разложения ЛЖК: бутирата (Zhang, Lu, 2016; Zhao et al., 2016; Salvador et al., 2017), пропионата (Yamada et al., 2015; Zhao et al., 2016; Yang et al., 2016; Jing et al., 2017; Xia et al., 2019), ацетата (Yamada et al., 2015; Fu et al., 2019), а также для этанола (Kato et al., 2012b; Rotaru et al., 2014a).
В термофильных условиях в среде с ацетатом в присутствии магнетита значительно возрастало количество представителей родов Tepidoanaerobacter и Coprothermobacter, способных разлагать ацетат в синтрофных ассоциациях с метаногенными археями (Yamada et al., 2015). Таким образом, кондуктивные материалы могут действовать как твердотельные переносчики электронов, обеспечивающие процесс DIET-С в синтрофных метаногенных консорциумах. Учитывая повсеместное распространение кондуктивных материалов в природе, такие взаимодействия могут быть широко распространены в почве и донных отложениях, а также могут использоваться при разработке эффективных процессов в биоэнергетике.
Помимо анаэробных реакторов и при стационарном культивировании участие кондуктивных материалов в межвидовом переносе электронов было продемонстрировано и на природных объектах. Так, в пробах донных осадков двух озер вблизи Пекина образование метана из бутирата в качестве органического субстрата ускорялось при добавлении наночастиц оксида железа (Fe3O4) в качестве кондуктивного, проводящего электроны материала. Добавление других кондуктивных материалов, таких как карбоновые нанотрубки и магнетит, также стимулировало синтрофное разложение бутирата и образование метана, что указывает на процесс DIET-С (Zhang, Lu, 2016).
Была исследована роль минеральных компонентов прибрежного песка с высоким содержанием железа в Ботническом заливе Балтийского моря, образующего полупроводящие частицы, в процессе метаногенеза в прибрежных морских осадках. Показано, что кондуктивные частицы способствуют синтрофному окислению ацетата в сочетании с CO2-восстановительным метаногенезом с участием Geobacter и Methanosarcina. Антропогенное воздействие, обусловленное внесением проводящих материалов, может в конечном итоге увеличить потоки метана – мощного парникового газа – из прибрежных осадков в атмосферу (Rotaru et al., 2018).
Из болотных осадков на Тибетском плато были получены высокообогащенные консорциумы, содержащие бактерии рода Syntrophomonas и археи, относящиеся к роду Methanocella (класс Methanomicrobia). В присутствии нано-Fe3O4, существенно ускоряющего синтрофное разложение бутирата, наблюдалось образование метана (Fu et al., 2019).
Существующие общие черты между микробными нанопроводами (е-пилями) и синтетическими кондуктивными материалами помогут в изучении молекулярных механизмов передачи электронов между микроорганизмами и будут важны для разработки биомедицинских сенсорных устройств (Malvankar, Lovley, 2014). Изучение процесса DIET пока еще находится на ранней стадии; последующие исследования помогут познать разнообразие микроорганизмов, способных к DIET, роль DIET в анаэробных микробных сообществах, а также биохимию и физиологию этого процесса.
ЭФФЕКТИВНОСТЬ И ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ РАЗЛИЧНЫХ КОНДУКТИВНЫХ МАТЕРИАЛОВ
Проводящие электроны кондуктивные материалы, такие как оксиды железа, активированный уголь, угольная ткань и другие участвуют в прямом переносе электронов (DIET-С). Микроорганизмы прикрепляются к поверхностям проводящих материалов или, в зависимости от размера частиц, формируют проводящие электроны биопленки или агрегаты. В метаногенных системах проводящие электроны материалы могут играть важную роль в интенсификации процесса DIET и метаногенеза (Baek et al., 2018). Все чаще кондуктивные материалы применяются в анаэробных реакторах. При добавлении гранул активированного угля наблюдалось развитие и накопление специфических электроактивных микроорганизмов (Lee et al., 2016). Процессы анаэробного сбраживания смеси органических отходов, органической фракции муниципальных твердых органических отходов и синтетических сточных вод в присутствии карбоновых кондуктивных материалов заметно ускорялись (Dang et al., 2016, 2017). Кондуктивные материалы на основе железа, в частности, магнетит, испытывались при очистке реальных и синтетических сточных вод (Yin et al., 2016). Сравнительная эффективность различных кондуктивных материалов, используемых для стимуляции DIET-C между микроорганизмами, основанная на анализе сравнительных результатов экспериментов по влиянию использования различных стимулирующих синтрофные процессы электрон-проводящих кондуктивных материалов на скорость образования и выход метана, представлена в табл. 2 (Martins et al., 2018). В подобной работе (Park et al., 2018) также приведена подробная систематизация проведенных исследований DIET-C с анализом полученных данных.
Таблица 2.
Увеличение образования метана в присутствии электропроводящих (кондуктивных) материалов (по Martins et al., 2018)
| Кондуктивные материалы | Размер частиц, нм | Концентрация, г/л | Субстрат | Увеличение выхода метанa (в разы)* |
|---|---|---|---|---|
| Гидроксид железа FeO(OH) | 1–2 | 1.8 | Реальные молочные сточные воды | 2.0 |
| Магнетит FeO · Fe2O3 | 0.01–0.3 | 0.01–25 | Ацетат, этанол, бензоат, бутират, пропионат, смесь ЛЖК, реальные и синтетические молочные сточные воды | 1.3–3.6 |
| 0.03 | 3.4–4.2 | Ацетат, этанол | 1.1 | |
| Красный шлам | 20 | Активный ил из муниципальных установок очистки сточных вод | 1.4 | |
| Нержавеющая сталь | 500–2000 | 25.7 | Синтетические сточные воды | 1.3 |
| Марганец | 0.07–1.5 | 2–8 | Синтетические сточные воды | 4.4 |
| Полианилиновые нанопруты | 0.25–3 | 1.2 | Сахароза | 2.0 |
| Графен | 0.03–2.0 | Этанол, синтетические сточные воды | 1.2–1.5 | |
| Многостенные углеродные нанотрубки | 0.010–0.2 | 0.1–5.0 | H2/CO2, ацетат, бутират, промышленные сточные воды производства сахара из сахарной свеклы | 1.1–17 |
| Углеродные нанотрубки | 0.001 | 1.0 | Сaхароза, глюкоза | 1.8–2 |
| Графит | 6–25 | 12–132 | Синтетические сточные воды и сточные воды | 1.3 |
| Гранулированный активированный уголь | 2000 | 3.3–50 | Ацетат, этанол, бутират, пропионат, глюкоза, синтетические сточные воды пивоваренного завода, синтетические молочные сточные воды, активный ил, органическя фракция ТКО, синтетические сложные отходы | 1.1–18 |
| Порошковый активированный уголь | 149–177 | 5 | Синтетические сточные воды пивоваренного завода | 1.9 |
| Углеродное волокно | 3–30 шт. | Синтетические сточные воды (глюкоза) и синтетические комплексные отходы | 1.2 | |
| Углеродная ткань | 10–20 шт. | Этанол, синтетические сточные воды, сточные воды от сжигания твердых коммунальных отходов (ТКО), органическая часть ТКО, синтетические сложные отходы | 1.3–10 | |
| Биоуголь | 60–700 | 0.3–42.7 | Этанол, бутират, пропионат, ил, синтетические сточные воды | 1.2–1.3 |
Наибольшее количество опытов было поставлено с использованием магнетита, ГАУ и карбоновой ткани. По результатам, приведенным в табл. 2, все использованные в экспериментах кондуктивные материалы заметно стимулировали образование метана в интервале от 1.1 до 18 раз. Эти данные согласуются с результатами математического моделирования, которое показало, что скорость МПЭ на основе DIET может быть в 8.6 раза выше, чем на основе IIET (Storck et al., 2016). Несмотря на разные условия приведенных в табл. 2 экспериментов, их результаты по практическому применению кондуктивных материалов для ускорения метаногенеза очень интересны, хотя полученные данные довольно трудно сравнимы, так как размер частиц кондуктивных материалов, внесенные концентрации и субстраты сильно варьировали. Тем не менее, исходя из опубликованных экспериментальных данных, можно утверждать, что кондуктивные материалы на основе углерода и магнетита лучше стимулируют метаногенные сообщества, чем кондуктивные материалы на основе металлов. Для точной оценки эффективности кондуктивных материалов следует учитывать их различные физические и химические характеристики (площадь поверхности, форма, размер пор и объем, электропроводность), используемые субстраты и условия проведения экспериментов (Martins et al., 2018).
Исследования по применению кондуктивных материалов активно продолжаются при анаэробной очистке концентрированных сточных вод. При периодическом культивировании добавление кондуктивных материалов позволяет сократить стадию лагфазы, предшествующую образованию метана, и увеличить выход метана. Интересно, что добавление кондуктивных материалов в чистую культуру метаногена также увеличивает метаногенную активность, и это коррелирует с изменением окислительно-восстановительного потенциала (Salvador et al., 2017). Однако пока неизвестно, по какому механизму происходит увеличение метаногенной активности при добавлении кондуктивных материалов. В анаэробных реакторах с непрерывным культивированием внесение кондуктивных материалов приводит к интенсификации метаногенеза, а также способствует более стабильной работе биореактора при более высокой нагрузке. Кроме того, показано, что добавление кондуктивных материалов в биореакторы и системы очистки сточных вод приводило к снижению накопления летучих жирных кислот и повышению эффективности процесса (Zhao et al., 2017).
Добавление наночастиц магнетита ускоряло восстановительное дегалогенирование 2,4-дихлорнитробензола в анаэробном реакторе. Анализ микробного сообщества из него показал увеличение биоразнообразия, что предполагает наличие совместного метаболизма на основе DIET (Wang et al., 2017). Показатели скорости метаногенной деградации бензоата по сравнению с контролями увеличились на 25 и 53% в присутствии гематита и магнетита соответственно (Zhuang et al., 2015).
Современные исследования в области биотехнологии анаэробной очистки сточных вод направлены, в первую очередь, на полноту разложения ОВ и, соответственно, повышения эффективности и скорости метаногенеза. Проведено изучение влияния таких кондуктивных материалов, как магнетит, карбоновая ткань и гранулированный уголь на скорость потребления ЛЖК микроорганизмами метаногенного микробного сообщества в термофильных условиях. Показано, что при использовании магнетита в концентрациях 1.2–11.6 г/л пропорционально увеличивалась скорость анаэробного разложения ЛЖК, в то время как добавление гранулированного угля или угольной ткани ускоряло метаногенез, но не в линейной зависимости от концентрации данных кондуктивных материалов (Литти и соавт., 2018).
Карбоновая ткань существенно стимулирует превращение ко-субстратов пропионата и бутирата в метан, ускоряя разложение этих ЛЖК в 2.4 и 6.7 раз соответственно. В результате экспериментов с карбоновыми нитями и этанолом в качестве субстрата метаногенеза было высказано предположение о том, что, помимо синтрофов и метаногенов, электроактивными являются не менее половины представителей других групп метаногенного сообщества, в частности, Pseudomonas и Desulfotomaculum (Barua, Dhar, 2017; Lin et al., 2017). Модельные сточные воды текстильного производства, содержащие красители на основе ароматических азосоединений, обесцвечивались в анаэробном реакторе только в присутствии угля разной пористости. Это свидетельствовало об ускорении реакции разрыва азо-связи; следовательно, внесение материалов на основе угля может быть рекомендовано на практике для осветления стоков текстильной промышленности (Pereira et al., 2014).
Исследование влияния гранулированного активированного угля (ГАУ) на скорость синтрофной деградации пропионата и бутирата при высокой нагрузке анаэробного реактора показало, что при дозе 5 г/л ГАУ наблюдалось резкое увеличение скорости деградации субстратов, в то время как при высокой дозе ГАУ (25 г/л) скорость деградации субстратов снижалась. Эти данные указывают на необходимость тщательного подбора дозы ГАУ (Xu et al., 2015). Для более глубокого понимания причин повышения и понижения скорости синтрофных процессов был применен метод секвенирования генов 16S рРНК к исследованию межклеточного переноса электронов через ГАУ в биореакторe. Секвенирование генов 16S рРНК показало изменения в архейной части метаногенного сообщества в присутствии ГАУ: содержание Mеthanosarcina уменьшилось, а Methanosaeta – увеличилось. При этом, по сравнению с контрольным экспериментом, в опытном биореакторe производство метана и скорость его образования были, соответственно, на 31 и 72% выше. Таким образом, результаты этого исследования подтвердили участие ГАУ в процессе DIET (Park et al., 2018). Внесение ГАУ в биореактор, работающий на модельном субстрате, имитирующем органическую фракцию ТКО, стимулировало развитие синтрофных бактерий. По сравнению с контрольным биореактором, в котором их численность составляла не более 0.3–3.0%, при добавлении ГАУ количество представителей родов Syntrophomonas увеличивалось до 12–17%, Desulfotomaculum до 7–12%, Symbiobacterium до 15%, Bacillus – 19–30%. Однако численность представителей гидролитических бактерий, в частности, родов Peptostreptococcus и Anaerovirgula, упало с 2–16% до менее 0.05% и с 22–74% до 1% соответственно, при этом численность бактерий рода Geobacter (0.3%) не изменилась (Dang et al., 2017).
Для практического применения кондуктивных материалов с целью стимуляции анаэробного разложения ОВ необходимо предварительно подобрать их концентрации, поскольку большие количества кондуктивных материалов могут иметь токсичный эффект на метаногенное сообщество микроорганизмов, а слишком низкие концентрации – не иметь эффекта на DIET. Также следует протестировать сыпучие кондуктивные материалы на оптимальный размер частиц и принять во внимание их стоимость (Martins et al., 2018). В перспективе применение кондуктивных материалов и управление процессом DIET для повышения эффективности работы анаэробных реакторов могут увеличиваться. Так, в обзоре, посвященном новому определению биотехнологии “электроферментация”, дается экскурс в историю изучения электрофизического воздействия на микробные системы в XX в., и суммируются последние опытные данные относительно возможности управлять процессами и оптимизировать их для получения более чистых продуктов, а также ускорять рост микробных клеток или обеспечивать выход определенного продукта. Вводится понятие электрометаногенез – увеличение продукции метана в биоэлектрохимическом анаэробном реакторе (Schievano et al., 2016).
В созданной для технологии “DarkHydrogen” анаэробной ферментации инновационной двустадийной биоэлектрохимической установке BES (Bioelectrochemical System), с использованием карбоновой ткани в качестве анода и катода и глюкозы как основного источника углерода, в микробном консорциуме в метаногенном реакторе произошли изменения. В образующемся биогазе водород отсутствовал, а соотношение метана и углекислого газа составило 85 : 15 (Sasaki et al., 2018). Молекулярные механизмы, с помощью которых микроорганизмы принимают электроны от синтрофных партнеров и с электродов менее ясны, чем те, которые участвуют в DIEТ-А. Механизмы действия электрического тока на процесс метаногенеза активно исследуется. Недавно описана синтрофия, базирующаяся на переносе водорода в электрически кондуктивном биопленочном аноде, где субстратом служил бутират, который использовал Geobacter, будучи экзоэлектрогеном в синтрофии с ацетогенами Sphaerochaeta и Treponema, являющимися основными потребителями водорода в биопленке (Dhar et al., 2019).
В настоящее время активно развивается новое научное направление “электромикробиология” (Lovley, 2012). Высказаны гипотезы и сделаны интересные открытия о трофических взаимосвязях бактерий и архей в метаногенном микробном сообществе и стимулировании процессов анаэробной деструкции ОВ при применении не только кондуктивных материалов, а также под влиянием электрического поля, образующегося в биореакторах с помощью внешнего источника электроэнергии. С применением электрохимических методов для управления и ускорения процессов разложения органических отходов открываются новые возможности оптимизации промышленной биологической очистки сточных вод и концентрированных стоков, а также переработки текучих и твердых органических отходов в полезные продукты, в частности, в органические и органоминеральные удобрения.
ЗАКЛЮЧЕНИЕ
В последнее время становится очевидным, что синтрофные процессы при образовании метана – конечного продукта анаэробной деструкции в отсутствие других акцепторов электронов из сложных органических веществ, намного более разнообразны, чем считалось ранее. Фундаментальные исследования и технологические разработки анаэробных биореакторов к настоящему времени привели к существенному развитию и применению технологий анаэробной переработки отходов во всем мире. Открытие межвидового переноса электронов (МПЭ) и его разновидностей – опосредованного (IET) и прямого (DIET), включающих как минимум пять вариантов, показало неисчерпаемые ресурсы разнообразия природных процессов. При МПЭ микроорганизмы могут совместно использовать образующуюся во время анаэробного катаболизма энергию более прямым и эффективным способом, чем считалось раньше. При DIET поток электронов передается между синтрофными партнерами с более высокой скоростью, чем при переносе с помощью водорода и/или формиата. Имеются указания на то, что, хотя проводящие пили и внеклеточные цитохромы играют ключевую роль в DIET, кондуктивные (электропорводящие) материалы, в том числе минеральные и углеродные, могут заменить эти биологические проводящие структуры в процессе DIET. Учитывая, что размножение микроорганизмов и синтез их биологических структур (например, цитохромов) требует большого количества энергии, можно предположить, что анаэробные микроорганизмы могут эффективно использовать искусственные и природные проводящие минералы в качестве электронных каналов для DIET. Имеющиеся на сегодняшний день данные указывают также на то, что добавление кондуктивных материалов в микробные сообщества может значительно ускорить метаногенез. Более глубокое понимание сложных микробных взаимодействий с участием DIET поможет не только изучить синтрофный процесс в энергетически ограниченных анаэробных условиях, но и создаст новые стратегии для разработки более эффективных биоэнергетических процессов. Доказано, что различные кондуктивные материалы ускоряют процесс DIET, и их применение при эксплуатации анаэробных биореакторов, а также использование внешнего источника электроэнергии для создания электрического поля в метантенке открывают новые возможности оптимизации процессов промышленной биологической очистки сточных вод, управления и ускорения процессов разложения концентрированных и твердых органических отходов. Это указывает на перспективу интенсификации процесса анаэробного разложения органических отходов при их переработке в биогаз и биоудобрение в анаэробных биореакторах. Учитывая большое разнообразие микроорганизмов в природе, вполне вероятно, что существует множество уникальных молекулярных механизмов для улучшения межвидовых взаимодействий. Изучение структурного состава нанопилей (биологических нанопроводов), обеспечивающих проводимость в микробных сообществах, открывает новые перспективы в области нанотехнологий по созданию возобновляемых “зеленых” электропроводящих материалов. Перспективными являются работы по изучению влияния на микробные процессы внешнего источника электроэнергии, создания и использования управляемого электрического поля в анаэробных биореакторах. Новые исследования в области электромикробиологии вносят достойный вклад в экологию, физиологию, эволюцию микроорганизмов и биотехнологию.
Список литературы
Заварзин Г.А., Бонч-Осмоловская Е.А. Синтрофные взаимодействия в сообществах микроорганизмов // Изв. АH СССР. 1981. № 2. С. 165–173.
Каллистова А.Ю., Меркель А.Ю., Тарновецкий И.Ю., Пименов Н.В. Образование и окисление метана прокариотами // Микробиология. 2017. Т. 86. № 6. С. 661–683.
Kallistova A.Yu., Merkel A.Yu., Tarnovetskii I.Yu., Pimenov N.V. Methane formation and oxidation by prokaryotes // Microbiology (Moscow). 2017. V. 86. P. 671–691.
Литти Ю.В., Русскова Ю.И., Чернова Н.А., Ножевникова А.Н., Михеева Э.Р. Влияние электропроводящих материалов на скорость потребления летучих жирных кислот термофильным метаногенным сообществом микроорганизмов // V Международная конференция молодых ученых биотехнологов, молекулярных биологов и вирусологов / Новосибирск: АНО “Инновационный центр Кольцово”, 2018. С. 64–68.
Ножевникова А.Н., Каллистова А.Ю., Литти Ю.В., Кевбрина М.В. Биотехнология и микробиология анаэробной переработки органических коммунальных отходов / Под ред. Ножевниковой А.Н. М.: Университетская книга, 2016. 320 с.
Розанова Е.П., Назина Т.Н. Разложние ацетата бинарной синтрофной ассоциацией, включающей сульфатвосстанавливающие бактерии // Микробиология. 1985. Т. 54. С. 497–498.
Angelidaki I., Karakashev D., Batstone J.D., Plugge C.M., Stams J.M.A. Biomethanation and its potential // Methods Enzymol. 2011. V. 494. P. 328–347.
Baek G., Kim J., Cho K., Bae H., Lee C. The biostimulation of anaerobic digestion with (semi)conductive ferric oxides: their potential for enhanced biomethanation // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 10355–10366.
Baek G., Kim, J., Lee C. A long-term study on the effect of magnetite supplementation in continuous anaerobic digestion of dairy effluent – Enhancement in process performance and stability // Bioresour. Technol. 2016. V. 222. P. 344–354.
Baek G., Kim J., Kim J., Lee C. Role and potential of direct interspecies electron transfer in anaerobic digestion // Energies. 2018. V. 11. Article 107. https://doi.org/10.3390/en11010107
Barua S., Dhar B.R. Advances towards understanding and engineering direct interspecies electron transfer in anaerobic digestion // Bioresour. Technol. 2017. V. 244. P. 698–707.
Biebl H., Pfennig N. Growth yields of green sulfur bacteria in mixed cultures with sulfur and sulfate reducing bacteria // Arch. Microbiol. 1978. V. 117. P. 9–16.
Bonch-Osmolovskaya E.A., Stetter K. O. Interspecies hydrogen transfer in cocultures of thermophilic Archaea // System. Appl. Microbiol. 1991. V. 14. P. 205−208.
Bryant M.P., Wolin E.A., Wolin M.J., Wolfe R.S. Methanobacillus omelianskii, a symbiotic association of two species of bacteria // Arch. Mikrobiol. 1967. V. 59. P. 20–31.
Cervantes F.J., De Bok F.A.M., Duong-Dac T., Stams A.J.M., Lettinga G., Field J.A. Reduction of humic substances by halorespiring, sulphate-reducing and methanogenic microorganisms // Environ. Microbiol. 2002. V. 4. P. 51–57.
Chen S., Liu X., Dong X. Syntrophobacter sulfatireducens sp. nov., a novel syntrophic, propionate-oxidizing bacterium isolated from UASB reactors // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 1319–1324.
Chen S., Rotaru A.E., Liu F., Philips J., Woodard T.L., Nevin K.P., Lovley D.R. Carbon cloth stimulates direct interspecies electron transfer in syntrophic co-cultures // Bioresour. Technol. 2014a. V. 173. P. 82–86.
Chen S., Rotaru A.E., Shrestha P.M., Malvankar N.S., Liu F., Fan W., Nevin K.P., Lovley D.R. Promoting interspecies electron transfer with Biochar // Sci. Rep. 2014b. V. 4. Article 5019. https://doi.org/10.1038/srep05019
Conrad R. Control of microbial methane production in wetland rice fields // Nutr. Cycl. Agroecosyst. 2002. V. 64. P. 59–69.
Cruz Viggi C., Rossetti S., Fazi S., Paiano P., Majone M., A-ulenta F. Magnetite particles triggering a faster and more robust syntrophic pathway of methanogenic propionate degradation // Environ. Sci. Technol. 2014. V. 48. P. 7536–7543.
Dang Y., Holmes D.E., Zhao Z., Woodard T.L., Zhang Y., Sun D., Wang L.Y., Nevin K.P., Lovley D.R. Enhancing anaerobic digestion of complex organic waste with carbon-based conductive materials // Bioresour. Technol. 2016. V. 220. P. 516–522.
Dang Y., Sun D., Woodard T.L., Wang L.Y., Nevin K.P., Holmes D.E. Stimulation of the anaerobic digestion of the dry organic fraction of municipal solid waste (OFMSW) with carbon-based conductive materials // Bioresour. Technol. 2017. V. 238. P. 30–38.
de Bok F.A.M., Plugge C.M., Stams A.J.M. Interspecies electron transfer in methanogenic propionate degrading consortia // Water Res. 2004. V. 38. P. 1368–1375.
de Bok F.A., Harmsen H.J., Plugge C.M., de Vries M.C., Akkermans A.D., de Vos W.M., Stams A.J. The first true obligately syntrophic propionate-oxidizing bacterium, Pelotomaculum schinkii sp. nov., co-cultured with Methanospirillum hungatei, and emended description of the genus Pelotomaculum // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 1697–1703.
Dhar B.R., Park J.-H., Park H.-D., Lee H.-S. Hydrogen-based syntrophy in an electrically conductive biofilm anode // Chem. Engin. J. 2019. V. 359. P. 208–216.
Dubé C.-D., Guiot S.R. Direct interspecies electron transfer in anaerobic digestion: a review // Adv. Biochem. Eng. Biotechnol. 2015. V. 151. P. 101–115.
Fu L., Zhou T., Wang J., You L., Lu Y., Yu L., Zhou S. NanoFe3O4 as solid electron shuttles to accelerate acetotrophic methanogenesis by Methanosarcina barkeri // Front. Microbiol. 2019. V. 10. Art. 388.
Ha P.T., Lindemann S.R., Shi L., Dohnalkova A.C., Fredrickson J.K., Madigan M.T., Beyenal H. Syntrophic anaerobic photosynthesis via direct interspecies electron transfer // Nat. Commun. 2017. V. 8. Article 13924. https://doi.org/10.1038/ncomms13924
Hattori S., Kamagata Y., Hanada S., Shoun H. Thermacetogenium phaeum gen. nov., sp. nov., a strictly anaerobic, thermophilic, syntrophic acetate-oxidizing bacterium // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 1601–1609.
Hedderich R., Whitman W.B. Physiology and biochemistry of the methane-producing Archaea / The Prokaryotes. Springer-Verlag, 2013. P. 635–662.
Ho D., Jensen P., Batstone D. Effects of temperature and hydraulic retention time on acetotrophic pathways and performance in high-rate sludge digestion // Environ. Sci. Technol. 2014. V. 48. P. 6468–6476.
Holmes D.E., Shrestha P.M., Walker D.J.F., Dang Y., Nevin K.P., Woodard T.L., Lovley D.R. Metatranscriptomic evidence for direct interspecies electron transfer between Geobacter and Methanothrix species in methanogenic rice paddy soils // Appl. Environ. Microbiol. 2017. V. 83. Article e00223-17.
Imachi H. Nobu M.K., Nakahara N., Morono Y., Ogawara M., Takaki Y., Takano Y.,Uematsu K., Ikuta T., Ito M., Matsui Y., Miyazaki M., Murata K., Saito Y., Sakai S., Song C., Tasumi E., Yamanaka Y., Yamaguchi T., Kamagata Y., Tamaki H., Takai K. Isolation of an archaeon at the prokaryote-eukaryote interface // BioRχiv. 2019. Preprint. https://doi.org/10.1101/726976
Jing Y., Wan J., Angelidaki I., Zhang S., Luo G. iTRAQ quantitative proteomic analysis reveals the pathways for methanation of propionate facilitated by magnetite // Water Res. 2017. V. 108. P. 212–221.
Kato S., Hashimoto K., Watanabe K. Microbial interspecies electron transfer via electric currents through conductive minerals // Proc. Natl. Acad. Sci. USA. 2012a. V. 109. P. 10042–10046.
Kato S., Hashimoto K., Watanabe K. Methanogenesis facilitated by electric syntrophy via (semi)conductive iron-oxide minerals // Environ. Microbiol. 2012b. V. 14. P. 1646–1654.
Kletzin A., Heimerl T., Fleschsler J., van Niftrik L., Rachel R., Klingl A. Cytochromes c in Archaea: distribution, maturation, cell architect and the special case of Ignococcus hospitalis // Front. Microbiol. 2015. V. 6. Article 439.
Kouzuma A., Kato S., Watanabe K. Microbial Interspecies Interactions: recent findings in syntrophic consortia // Front. Microbiol. 2015. V. 6. Article 477. https://doi.org/10.3389/fmicb.2015.00477
Lee J.Y., Lee S.H., Park H.D. Enrichment of specific electro-active microorganisms and enhancement of methane production by adding granular activated carbon in anaerobic reactors // Bioresour. Technol. 2016. V. 205. P. 205–212.
Lin R., Cheng J., Zhang J., Zhou J., Cen K., Murphy J.D. Boosting biomethane yield and production rate with graphene: the potential of direct interspecies electron transfer in anaerobic digestion // Bioresour. Technol. 2017. V. 239. P. 345–352.
Lins P., Reitschuler C., Illmer P. Methanosarcina spp., the key to relieve the start-up of a thermophilic anaerobic digestion suffering from high acetic acid loads // Bioresour. Technol. 2014. V. 152. P. 347–354.
Liu Q.S., Wang P., Zhao S.S., Zhang W. Treatment of an industrial chemical waste-water using a granular activated carbon adsorption-microwave regeneration process // J. Chem. Technol. Biotechnol. 2012. V. 87. P. 1004–1009. https://doi.org/10.1002/jctb.3720
Liu F., Rotaru A.E., Shrestha P.M., Malvankar N.S., Nevin K.P., Lovley D.R. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange // Environ. Microbiol. 2015. V. 17. P. 648–655.
Lovley D.R., Fraga J.L., Coates J.D., Blunt-Harris E.L. Humics as an electron donor for anaerobic respiration // Environ. Microbiol. 1999. V. 1. P. 89–98.
Lovley D.R. Electromicrobiology // Annu. Rev. Microbiol. 2012. V. 66. P. 391–409.
Lovley D.R. Happy together: microbial communities that hook up to swap electrons // ISME J. 2017a. V. 11. P. 327–336.
Lovley D.R. Syntrophy goes electric: direct interspecies electron transfer // Annu. Rev. Microbiol. 2017b. V. 71. P. 643–664.
Ma H., Liu H., Zhang L., Yang M., Fu B., Liu H. Novel insight into the relationship between organic substrate composition and volatile fatty acids distribution in acidogenic co-fermentation // Biotechnol. Biofuels. 2017. V. 10. P. 137.
Malvankar N.S., Lovley D.R. Microbial nanowires for bioenergy applications // Curr. Opin. Biotechnol. 2014. V. 27. P. 88–95.
Martin W., Muller M. The hydrogen hypothesis for the first eukaryote // Nature. 1998. V. 392. P. 37–41.
Martins G., Salvador A.F., Pereira L., Alves M. Methane production and conductive materials: a critical review // Environ. Sci. Technol. 2018. V. 52. P. 10241–10253.
McInerney M.J., Struchtemeyer C.G., Sieber J., Mouttaki H., Stams A.J.M., Schink B., Rohlin L., Gunsalus R.P. Physiology, ecology, phylogeny, and genomics of microorganisms capable of syntrophic metabolism // Ann. N.Y. Acad. Sci. 2008. V. 1125. P. 58–72.
Morris B.E.L., Henneberger R., Huber H., Moissl-Eichinger C. Microbial syntrophy: interaction for the common good // FEMS Microbiol. Rev. 2013. V. 37. P. 384–406.
Morita M., Malvankar N.S., Franks A.E., Summers Z.M., Giloteaux L., Rotaru A.E., Rotaru C., Lovley D.R. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates // mBio Amer. Soc. Microbiol. 2011. V. 2. e00159-11. https://doi.org/10.1128/mBio.00159-11
Nazina T.N., Shestakova N.M., Ivoilov V.S., Tourova T.P., Feng Q., Poltaraus A.B. Microbial diversity and syntrophic acetate degradation to methane in a high-temperature petroleum reservoir // Adv. Biotechnol. 2017. P. 1–22.
Nozhevnikova A.N., Nekrasova V., Ammann A., Zehnder A.B., Wehrli B., Holliger C. Influence of temperature and high acetate concentrations on methanogenensis in lake sediment slurries // FEMS Microbiol. Ecol. 2007. V. 62. P. 336–344.
Park J.H., Kang H.J., Park K.H., Park H.D. Direct interspecies electron transfer via conductive materials: A perspective for anaerobic digestion applications // Bioresour. Technol. 2018. V. 254. P. 300–311.
Pereira R.A., Pereira M.F.R., Alves M.M., Pereira L. Carbon based materials as novel redox mediators for dye wastewater biodegradation // Appl. Catal. 2014. V. 144. P. 713–720.
Reguera G., McCarthy K.D., Mehta T., Nicoll J.S., Tuominen M.T., Lovley D.R. Extracellular electron transfer via microbial nanowires // Nature. 2005. V. 435. P. 1098–1101.
Rotaru A.-E., Shrestha P.M., Liu F., Ueki T., Nevin K., Summers Z.M., Lovley D.R. Interspecies electron transfer via hydrogen and formate rather than direct electrical connections in cocultures of Pelobacter carbinolicus and Geobacter sulfurreducens // Appl. Environ. Microbiol. 2012. V. 78. P. 7645–7651.
Rotaru A.-E., Shrestha P.M., Liu F., Markovaite B., Chen S., Nevin K.P., Lovley D.R. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri // Appl. Environ. Microbiol. 2014a. V. 80. P. 4599–4605.
Rotaru A.-E., Shrestha P.M., Liu F., Shrestha M., Shrestha D., Embree M. A new model for electron flow during anaerobic digestion: direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane // Energy Environ. Sci. 2014b. V. 7. P. 408–415.
Rotaru A.-E., Calabrese F., Stryhanyuk H., Musat F., Shrestha P.M., Weber H.S., Snoeyenbos-West O.L.O., Hall P.O.J., Richnow H.H., Musat N., Thamdrupa B. Conductive particles enable syntrophic acetate oxidation between Geobacter and Methanosarcina from coastal sediments // mBio Amer. Soc. Microbiol. 2018. V. 9. P. 1–14.
Salvador A.F., Martins G., Melle-Franco M., Serpa R., Stams A.J.M., Cavaleiro A.J., Pereira M.A., Alves M.M. Carbon nanotubes accelerate methane production in pure cultures of methanogens and in a syntrophic coculture // Environ. Microbiol. 2017. V. 19. P. 2727–2739.
Sasaki K., Morita M., Hirano S., Sasaki D., Ohmura N., Igarashi Y. Efficient degradation of rice straw in the reactors packed by carbon fiber textiles // Appl. Microbiol. Biotechnol. 2010. V. 87. P. 1579–1586.
Sasaki K., Sasaki D., Tsuge Y., Morita M., Kondo A. Changes in the microbial consortium during dark hydrogen fermentation in a bioelectrochemical system increases methane production during a two-stage process // Biotechnol. Biofuels. 2018. V. 11. P. 173.
Schievano A., Pepé Sciarria T., Vanbroekhoven K., De Wever H., Puig S., Andersen S.J., Rabaey K., Pant D. Electro-fermentation – merging electrochemistry with fermentation in industrial applications // Trends Biotechnol. 2016. V. 34. P. 866–878.
Schink B., Stams A.J.M. Syntrophism among Prokaryotes // The Prokaryotes. Prokaryotic Communities and Ecophysiology / Eds. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin, Heidelberg: Springer Berlin Heidelberg, 2013. P. 471–493.
Schink B., Montag D., Keller A., Müller N. Hydrogen or formate – alternative key players in methanogenic degradation // Environ. Microbiol. Rep. 2017. V. 9. P. 189–202.
Sekiguchi Y., Imachi H., Susilorukmi A., Muramatsu M., Ohashi A., Harada H., Hanada S., Kamagata Y. Tepidanaerobacter syntrophicus gen. nov., sp. nov., an anaerobic, moderately thermophilic, syntrophic alcohol- and lactate-degrading bacterium isolated from thermophilic digested sludges // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 1621–1629.
Shimoyama T., Kato S., Ishii S., Watanabe K. Flagellum mediates symbiosis // Science. 2009. V. 323. P. 1574.
Shrestha P.M., Rotaru A.E., Summers Z.M., Shrestha M., Liu F., Lovely D.R. Transcriptomic and genetic analysis of direct interspecies electron transfer // Appl. Environ. Microbiol. 2013. V. 79. P. 2397–2404.
Shrestha P.M., Rotaru A.E. Plugging in or going wireless: strategies for interspecies electron transfer // Front. Microbiol. 2014. V. 5. Article 237. https://doi.org/10.3389/fmicb.2014.00237
Sieber J.R., McInerney M.J., Plugge C.M., Schink B., Gunsalus R.P. Methanogenesis: syntrophic metabolism // Handbook of Hydrocarbon and Lipid Microbiology. Heidelberg: Springer Berlin Heidelberg, 2010. P. 337–355.
Sieber J.R., Le H.M., Mcinerney M.J. The importance of hydrogen and formate transfer for syntrophic fatty, aromatic and alicyclic metabolism // Environ. Microbiol. 2014. V. 16. P. 177–188.
Sikora A., Detman A., Chojnacka A., Blaszczyk M.K. Anaerobic Digestion: I. A common process ensuring energy flow and the circulation of matter in ecosystems. II. A tool for the production of gaseous biofuels // Fermentation Processes. 2017. Ch. 14. P. 271–301.
Smith J.A, Nevin K.P, Lovley D.R. Syntrophic growth via quinonemediated interspecies electron transfer // Front Microbiol. Microbial Physiology and Metabolism. 2015. V. 6: Article 121. P. 1–8.
Sorokin D.Y., Makarova K.S., Abbas B., Ferrer M., Golyshin P.N., Galinski E.A., Ciordia S., Mena M.C., Merkel A.Y., Wolf Y.I., van Loosdrecht M.C.M., Koonin E.V. Discovery of extremely halophilic, methyl-reducing euryarchaea provides insights into the evolutionary origin of methanogenesis // Nature Microbiol. 2017. V. 2. Article 17081.
Sousa D.Z., Smidt H., Madalena Alves M., Stams A.J.M. Syntrophomonas zehnderi sp. nov., an anaerobe that degrades long-chain fatty acids in co-culture with Methanobacterium formicicum // Int. J. Syst. Evol. Microbiol. 2007. V. 57. P. 609–615.
Stams A.J. Metabolic interactions between anaerobic bacteria in methanogenic environments // Antonie van Leeuwenhoek. 1994. V. 66. P. 271–294.
Stams A.J.M., Plugge C.M. Electron transfer in syntrophic communities of anaerobic bacteria and archaea // Nat. Rev. Microbiol. 2009. V. 7. P. 568–577.
Stams A.J.M., Sousa D.Z., Kleerebezem R., Plugge C.M. Role of syntrophic microbial communities in high-rate methanogenic bioreactors // Water Sci. Technol. 2012. V. 66. P. 352–362.
Storck T., Virdis B., Batstone D.J. Modelling extracellular limitations for mediated versus direct interspecies electron transfer // ISME J. 2016. V. 10. P. 621–631.
Summers Z.M., Fogarty H.E., Leang C., Franks A.E., Malvankar N.S., Lovley D.R. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria // Science. 2010. V. 330. P. 1413–1415.
Venkiteshwaran K., Bocher B., Maki J., Zitomer D. Relating anaerobic digestion microbial community and process function // Microbiol. Insights. 2016. V. 8 (Suppl. 2). P. 37–44. https://doi.org/10.4137/MBI.S33593
Walker D.J.F., Adhikari D.E., Holmes D.E., Ward J.E., Woodard T.L., Nevin K.P., Lovley D.R. Electrically conductive pili from pilin genes of phylogenetically diverse microorganisms // ISME J. 2018. V. 12. P. 48–58.
Walker D.J.F., Martz.E., Holmes D.E., Zhou Z., Nonnenmann S., Lovley D.R. The Archaellum of Methanospirillum hungatei is electrically conductive // mBio Amer. Soc. Microbiol. 2019. V. 10. pii: e00579-19. https://doi.org/10.1128/mBio.00579-19
Wang C., Ye L., Jin J., Chen H., Xu X., Zhu L. Magnetite nanoparticles enhance the performance of a combined bioelectrode-UASB reactor for reductive transformation of 2,4-dichloronitrobenzene // Sci. Rep. 2017. V. 7. Article 10319.
Wang F., Gu Y., O’Brien J. P., Yi S. M., Yalcin S. E., Srikanth V., Shen C., Vu D., Ing N.L., Hochbaum A.I., Egelman E.H., Malvankar N.S. Structure of microbial nanowires reveals stacked hemes that transport electrons over micrometers fengbin // Cell. 2019. V. 177. P. 361–369.
Xia X., Zhang J., Song T., Lu Y. Stimulation of Smithella-dominating propionate oxidation in a sediment enrichment by magnetite and carbon nanotubes // Environ. Microbiol. Rep. 2019. V. 11. P. 236–248.
Xu S., He C., Luo L., Lu F., He P., Cui L. Comparing activated carbon of different particle sizes on enhancing methane generation in upflow anaerobic digester // Bioresour. Technol. 2015. V. 196. P. 606–612.
Yamada C., Kato S., Ueno Y., Ishii M., Igarashi Y. Conductive iron oxides accelerate thermophilic methanogenesis from acetate and propionate // J. Biosci. Bioeng. 2015. V. 119. P. 678–682.
Yan W., Shen N., Xiao Y., Chen Y., Sun F., Kumar Tyagi V., Zhou Y. The role of conductive materials in the start-up period of thermophilic anaerobic System // Bioresour. Technol. 2017. V. 239. P. 336–344.
Yang Z., Guo R., Shi X., Wang C., Wang L., Dai M. Magnetite nanoparticles enable a rapid conversion of volatile fatty acids to methane // RSC Adv. 2016. V. 6. P. 25662–25668.
Yin Q., Miao J., Li B., Wu G. Enhancing electron transfer by ferroferric oxide during the anaerobic treatment of synthetic wastewater with mixed organic carbon // Int. Biodeterior. Biodegrad. 2017. V. 119. P. 4–10.
Zhang J., Lu Y. Conductive Fe3O4 nanoparticles accelerate syntrophic methane production from butyrate oxidation in two different lake sediments // Front. Microbiol. 2016. V. 7. P. 1–9.
Zhao Z., Zhang Y., Holmes D.E., Dang Y., Woodard T.L., Nevin K.P., Lovley D.R. Potential enhancement of direct interspecies electron transfer for syntrophic metabolism of propionate and butyrate with biochar in up-flow anaerobic sludge blanket reactors // Bioresour. Technol. 2016. V. 209. P. 148–156.
Zhao Z., Li Y., Quan X., Zhang Y. Towards engineering application: Potential mechanism for enhancing anaerobic digestion of complex organic waste with different types of conductive materials // Water Research. 2017. V. 115. P. 266–277.
Zhuang L., Tang J., Wang Y., Hu M., Zhou S. Conductive iron oxide minerals accelerate syntrophic cooperation in methanogenic benzoate degradation // J. Hazard. Mater. 2015. V. 293. P. 37–45.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология