Микробиология, 2020, T. 89, № 2, стр. 189-199
Связь удельной скорости окисления метана почвой и обилия метанотрофов, оцененного с помощью количественной ПЦР
А. Ф. Сабреков a, b, c, *, М. В. Семенов d, И. Е. Терентьева c, Ю. В. Литти a, e, Д. В. Ильясов a, f, М. В. Глаголев a, b, c, f, g
a Институт водных проблем РАН
119333 Москва, Россия
b Югорский государственный университет
628012 Ханты-Мансийск, Россия
c Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
d очвенный институт им. В.В. Докучаева
119017 Москва, Россия
e Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
117312 Москва, Россия
f Институт лесоведения РАН
143030 Московская обл., пос. Успенское, Россия
g Факультет почвоведения МГУ имени М.В. Ломоносова
119992 Москва, Россия
* E-mail: sabrekovaf@gmail.com
Поступила в редакцию 25.08.2019
После доработки 25.10.2019
Принята к публикации 29.10.2019
Аннотация
Число копий генов pmoA рассматривается в качестве микробиологического показателя почв, характеризующего численность и потенциальную активность метанотрофов. До сих пор остается открытым вопрос, насколько эффективно данный показатель может быть использован для прогнозирования и моделирования актуальной активности потребления метана. В данном исследовании производилось сравнение величин удельной скорости окисления метана почвой при его атмосферной концентрации и числа копий генов pmoA, определенного с помощью количественной полимеразной цепной реакции. Пробы почвы были отобраны в мае, июле и сентябре 2018 г. в лесных экосистемах подзоны средней тайги Западной Сибири близ г. Ханты-Мансийск. Полученные величины удельной скорости окисления метана изменялись в интервале от 0.01 до 8 нг СН4/г сухой почвы в час. Число копий генов pmoA на 1 г сухой почвы варьировало от 107 до 109 копий. Корреляция между этими двумя величинами ослабевала при увеличении масштаба рассмотрения от почвенного профиля до масштаба экосистем и разных сезонов года. Удельная скорость окисления метана значимо возрастала при переходе через пороговое значение обилия метанотрофов – 2 × 108 копий генов pmoA/г. При этом, если рассматривать интервалы ниже и выше этого порогового значения числа копий генов pmoA, то значимого возрастания удельной скорости окисления метана с ростом обилия метанотрофов не наблюдается. Таким образом, определение лишь обилия метанотрофов не может считаться достаточным для оценки активности метанотрофии в автоморфных почвах, поэтому необходимо рассматривать влияние прочих факторов.
Метан – ключевой парниковый газ для атмосферы Земли. По величине потенциала глобального потепления на вековом горизонте прогноза он превосходит углекислый газ в 28 раз (Ciasis et al., 2013). Также он принимает важное участие в ряде значимых фотохимических реакций в различных слоях атмосферы Земли (Seinfeld, Pandis, 2006). Таким образом, изучение источников и стоков метана и влияющих на них факторов необходимо для обоснованного прогноза глобальных изменений климата и оценки возможностей антропогенной регуляции климата. Главным стоком метана в атмосфере (85–90% от общего стока) является его фотохимическое разложение. Вторым по важности (10–15% от общего стока) и главным биологическим механизмом стока является потребление метана метанотрофными микроорганизмами, живущими в автоморфных (не переувлажненных) почвах (Dunfield, 2007; Dutaur, Verchot, 2007; Ciasis et al., 2013).
Лесные почвы характеризуются наиболее высокими величинами потребления метана по сравнению с почвами других экосистем (Dutaur, Verchot, 2007; Kolb, 2009; Aronson et al., 2013). В сочетании с огромными площадями лесов это ведет к тому, что лесные почвы ответственны за большую часть всего биологического стока метана. В связи с этим изучение потребления метана в лесных экосистемах и понимание механизмов, контролирующих изменение активности метанотрофии на разных временных и пространственных масштабах, наиболее важны для качественного ретроспективного анализа и прогноза баланса метана в атмосфере Земли.
Активность потребления метана зависит от условий окружающей среды и характеризуется изменчивостью во времени. При моделировании окисления метана в автоморфных почвах используется ряд характеристик, таких как температура, влажность почвы, количество минеральных соединений азота. При этом микробиологические показатели почв до сих пор не находят широкого применения в этих моделях. Развитие молекулярно-биологических методов, основанных на выделении нуклеиновых кислот из почвы и последующем их анализе, позволило определять структуру, численность и функции разных групп микроорганизмов в почве, не выделяя их в чистую культуру (Prosser, 2015). В частности, с помощью количественной ПЦР (кПЦР) стало возможным оценивать обилие микроорганизмов, ответственных за протекание того или иного процесса, по количеству копий функциональных генов, которые кодируют синтез фермента, ответственного за одну из реакций в рамках этого процесса (Okano et al., 2004; Sharma et al., 2007). Обилие потребляющих метан микроорганизмов-метанотрофов определяется по количеству копий гена pmoA, который кодирует одну из субчастиц мембранно-связанного фермента окисления метана – метанмонооксигеназы (Culpepper, Rosenzweig, 2012). Число копий генов pmoA или его транскриптов рассматривается в качестве перспективного микробиологического показателя почв, с помощью которого можно оценивать потенциальную активность сообщества метанотрофов и границы значений интенсивности потребления метана (Kou et al., 2017). По сравнению с генами число копий их транскриптов служит более надежным индикатором потенциальной активности процесса (Prosser, 2015). Однако в настоящее время количество работ, оценивающих число копий транскриптов генов pmoA, невелико, поскольку определение данного показателя сопряжено с рядом объективных технических трудностей, таких как деструктивная активность рибонуклеаз и удаление примесей ДНК (Wang et al., 2012).
До сих пор остается открытым вопрос о том, насколько эффективно показатели обилия функциональных генов могут быть использованы для прогнозирования и моделирования актуальной активности процессов, в том числе потребления метана (Graham et al., 2014, 2016). Для решения этой задачи необходимо сопоставление обилия копий функциональных генов и активности процесса для разных сезонов и типов экосистем, которое показывает, в какой мере потребление метана почвами контролируется обилием метанотрофов, а в какой – прочими факторами. В настоящей работе характеристикой потребления метана был выбран не его удельный поток с поверхности (поскольку метан потребляется, этот поток – отрицательный), а удельная скорость окисления на 1 г почвы за 1 ч при атмосферной концентрации метана. Это было сделано для того, чтобы исключить из анализа влияние различий в интенсивности диффузии, которая в значительной степени определяет величину удельного потока метана в автоморфных почвах (Crill, 1991; Striegl, 1993; Aronson et al., 2013), но в меньшей степени влияет на удельную скорость окисления метана в таких экосистемах.
Сопряженное определение числа копий генов pmoA и удельной скорости окисления для автоморфных почв, то есть почв, в которых метанотрофы потребляют только атмосферный метан, было проведено в целом ряде работ (см., например, Kolb et al., 2005; Knief et al., 2006; Kravchenko, Sukhacheva, 2017). В них проводится сопоставление этих двух показателей по отдельности для разных экосистем, а также вычисляется удельная скорость окисления метана на одну клетку. Однако в данных работах не рассматривается характер связи (например, линейный, логарифмический, экспоненциальный) между этими двумя показателями, как для разных экосистем, так и на временном масштабе сезона и пространственном масштабе почвенного профиля.
Целью настоящей работы было определить характер связи обилия метанотрофов и величины поглощения метана почвой на примере лесных экосистем средней тайги Западной Сибири (ЗС) на разных пространственно-временных масштабах. Для этого требовалось сопоставить полученные результаты определения удельной скорости окисления СН4 и числа копий генов pmoA для разных глубин, сезонов и типов экосистем, оценить характер и силу полученных связей, а также остаточную вариабельность удельной скорости потребления СН4, которую уже нельзя будет связать с динамикой численности метанотрофов.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследований. Полевые работы и отбор проб проводили с 25 по 28 мая, с 10 по 15 июля и с 9 по 12 сентября 2018 г. в трех типичных лесных экосистемах в зоне средней тайги ЗС близ г. Ханты-Мансийск. Исследовательские полигоны располагались на расстоянии нескольких километров друг от друга на второй надпойменной террасе р. Обь. Грунтовые воды залегали глубоко (>5 м), все исследованные почвы были автоморфными подзолистыми кислыми элювиально-иллювиально-дифференцированными. Ниже даны краткие описания исследованных лесных экосистем.
Кедровый лес (61.08571° с.ш., 69.46918° в.д.). Естественный сомкнутый древостой, в котором доминирует сосна сибирская кедровая (Pinus sibirica) с примесью пихты сибирской (Abies sibirica), ели сибирской (Picea obovata) и березы повислой (Betula pendula). Проективное покрытие (ПП) 80–90%. Травянистый ярус развит слабо (ПП не более 10%), в нем представлены хвощ лесной (Equisetum sylvaticum) и кислица обыкновенная (Oxalis acetosella). Моховый ярус развит фрагментарно в местах нарушений и ветровальных окнах, в нем представлены кукушкин лeн (Polytrichum commune) и плевроциум (Pleurozium schreberi). Значение рН водной вытяжки из почвы с глубины 10 см – 5.1.
Березовый лес (61.05623° с.ш., 69.42942° в.д.). Сомкнутый древостой (ПП = 60–70%), сформировавшийся на месте сплошной вырубки, проведенной около 30 лет назад. В древесном ярусе доминируют береза повислая и осина (Populus tremula) с подростом ели сибирской. В травяно-кустарничковом ярусе доминируют брусника (Vaccinium vitis-idaea), хвощ лесной и вейник седоватый (Calamagrostis canescens). Значение рН водной вытяжки из образца почвы с глубины 10 см – 5.8.
Смешанный лес (61.08301° с.ш., 69.45383° в.д.). Сомкнутый естественный древостой (ПП = 80%), состоящий из сосны сибирской, пихты сибирской, березы повислой и осины. Травяно-мохово-кустарничковый ярус фрагментарен, наиболее развит под широколиственными породами и состоит из черники обыкновенной (Vaccinium myrtillus), плевроциума и гилокомия блестящего (Hylocomium splendens). Значение рН водной вытяжки из образца почвы с глубины 10 см – 5.3.
Измерения удельного потока метана. В каждую из трех проведенных поездок в трех исследованных экосистемах устанавливали по три стальных основания, на каждом из которых проводили три последовательных измерения удельного потока (УП) метана с поверхности почвы с паузой в 20 мин между измерениями. Измерения УП метана осуществляли статическим камерным методом, как это описано в работе Sabrekov et al. (2016). Отбор газа из камер проводили с шагом по времени 15 мин при помощи шприцев объемом 20 мл через резиновую пробку со шлангом, герметично установленную в верхней части камеры. Время экспозиции составляло 60 мин в мае и 45 мин в июле и сентябре. В течение всего измерения воздух внутри камеры перемешивался с помощью вентилятора, присоединенного проводами к аккумулятору, находящемуся вне камеры. Концентрацию метана во всех отобранных пробах газа определяли на хроматографе Кристалл-5000 (“Хроматэк”, Россия), оснащенном двумя пламенно-ионизационными детекторами, со стальными колонками (длиной 1 м), наполненными сорбентом HayeSep Q (80–100 mesh), при 80°C с азотом в качестве газа-носителя (скорость потока – 35 мл/мин).
Отбор проб почвы осуществляли с помощью садовой лопатки и почвенного бура с глубин 3, 10, 20 и 30 см, на расстоянии около 1 м от каждого из оснований. Почву отбирали в предварительно промытые дистиллированной водой и просушенные банки из полиэтилена низкого давления объемом 100 мл. Банки заполняли почвой целиком и затем плотно закрывали, чтобы не допустить изменения естественной влажности почвы. Всего на протяжении трех экспедиций было отобрано 72 образца почвы.
Инкубационные эксперименты осуществляли в соответствии с широко используемой методикой, описанной в ряде работ (Crill, 1991; Christiansen et al., 2012, 2017), в течение 48 ч после отбора проб в поле. В стеклянную колбу объемом 120 мл при атмосферной концентрации метана (ок. 2 ppmv) помещали 1–4 г почвы при естественной влажности. Из колбы отбирали пробу газа, после чего колбу сразу плотно закрывали пробкой из бромбутилового каучука и завинчивали крышкой для обеспечения герметичности. Инкубацию проводили в 2–3 повторностях в климатической камере MK-53 (“Binder”, Германия) при температуре почвы in situ во время отбора с точностью до 2°С на протяжении от 4 ч до 3 сут в зависимости от температуры инкубации и глубины отбора (дольше всего инкубировались пробы с глубины 20 и 30 см, отобранные в мае). В течение этого периода из колбы после перемешивания в ней газа с помощью шприца с иглой отбирали 2 или 3 пробы газа объемом 3 мл. После инкубации с помощью высушивания при 70°С определяли влажность почвенных образцов.
Почвенную ДНК экстрагировали из образцов массой 0.25 г с помощью набора PowerSoil DNeasy kit (“QIAGEN”, Нидерланды) согласно протоколу производителя. Первичную обработку почвенных образцов проводили с использованием гомогенизатора Precellys 24 (BertinTechnologies, Франция). Выделенные экстракты ДНК до анализа хранили при температуре –20°C.
Количественная оценка обилия копий генов pmoA была проведена методом ПЦР в реальном времени с использованием специфичных праймеров A189F (GGNGACTGGGACTTCTGG; Holmes et al., 1999) и mb661R (CCGGMGCAACGTCYTTACC; Costello, Lidstrom, 1999). Реакционную смесь готовили с использованием набора реактивов SuperMix Eva Green (“Bio-Rad”, США). В качестве стандартов применяли растворы клонированных фрагментов гена pmoA чистой культуры Methylovulum psychrolerans. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (“Bio-Rad”, США) по протоколу, изложенному в работе Yun et al. (2012). Анализ проводили в трех повторностях для каждого образца. Число копий генов на 1 г почвы рассчитывали с помощью программного обеспечения CFX Manager с учетом разведения и массы навески. Качество проведенной кПЦР оценивали при помощи определения длины получившихся фрагментов ДНК посредством гель-электрофореза. Итоговые результаты пересчитывали на 1 г сухой почвы.
Определение температуры, влажности и кислотности почвы. На каждом исследовательском полигоне на глубинах 0, 10, 20 и 50 см измеряли температуру почвы (°С) при помощи термодатчиков “Thermochron” iButton DS 1921G (“Dallas Semiconductor”, США) и объемную влажность почвы (см3/см3) с помощью сенсора HydraProbe II (“Stevens Water Monitoring Systems”, США). Значение pH определяли в водной вытяжке (5 г почвы на 30 мл деионизированной воды) с помощью прибора SevenCompact S220-Basic (“Mettler Toledo”, США).
Статистическая обработка. Для расчетов и статистической обработки данных использовали интерактивную систему MATLAB v. 9.1 (“MathWorks”, США). УП и величину удельной скорости окисления метана вычисляли методом экспоненциальной регрессии (в координатах время–концентрация с помощью функции nlin-fit), как было описано ранее (Sabrekov et al., 2016). Поглощению метана почвой соответствуют отрицательные значения УП и положительные значения удельной скорости окисления. Различия между характеристиками центральной тенденции оценивали с помощью двустороннего критерия Стьюдента (функция ttest2), пороговый уровень значимости равен 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Активность окисления метана в исследованных почвах. Величина удельной скорости окисления метана при его атмосферной концентрации (1.33 мг СН4/м3) в исследованных экосистемах составляла от 0.01 до 8 нг СН4/г сухой почвы в час. Наибольшие значения были характерны для проб с глубин 3 и 10 см (рис. 1). Такие величины удельной скорости окисления близки к изложенным в литературе, посвященной изучению потребления метана в ненарушенных лесных экосистемах (Crill, 1991), или превышают их в 2–10 раз (Семенов и соавт., 2004; Кравченко и соавт., 2005; Christiansen et al., 2012, 2017). УП метана варьировал от 0 до –0.18 мг СН4/м2 в час (табл. 1), что соответствует литературным данным для лесов бореального пояса (Семенов и соавт., 2004; Fang et al., 2010; Sabrekov et al., 2015), причем медианы УП в июле и сентябре (–0.13 и –0.15 мг СН4/м2 в час соответственно) близки к 90%-ому перцентилю для лесов умеренного пояса и превышают его для бореальных лесов, согласно базе данных величин УП в автоморфных почвах, представленной в статье (Dutaur, Verchot, 2007). Медианы УП для всех исследованных почв значимо не различались для данных, полученных в июле и сентябре, в то время как их майские значения были значимо ниже по абсолютной величине, чем в июле и сентябре.
Рис. 1.
Зависимость удельной скорости окисления метана при атмосферной концентрации (1.33 мг СН4/м3) от глубины почвы для всех исследованных экосистем (цифры рядом с кривыми обозначают месяц: 1 – май, 2 – июль, 3 – сентябрь; буквы обозначают тип экосистемы: Б – березовый лес, К – кедровый лес, СЛ – смешанный лес; цифры рядом с буквами обозначают номера точек, рядом с которыми отбирались образцы, характеризуя, таким образом, внутри-экосистемную вариабельность). Средний уровень случайной погрешности индивидуального измерения удельной скорости окисления метана – ±5–10%.
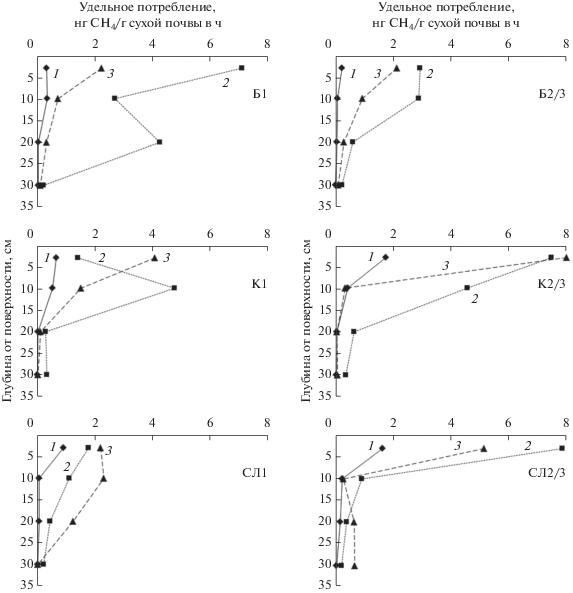
Таблица 1.
Сезонная динамика удельного потока метана, а также температуры почвы и влажности почвы на глубине 10 см для трех исследованных экосистем
| Исследованная экосистема | $\frac{{{\text{Медиана}} \pm {\text{стд}}\,\,{\text{УП,}}\,\,{\text{мг}}\,\,{{{\text{C}}{{{\text{H}}}_{4}}} \mathord{\left/ {\vphantom {{{\text{C}}{{{\text{H}}}_{4}}} {{{{\text{м}}}^{2}}}}} \right. \kern-0em} {{{{\text{м}}}^{2}}}}\,\,{\text{в}}\,\,{\text{час}}}}{{{\text{Температура}},\,\,^\circ {\text{C}};\,\,{\text{влажность}}\,\,{\text{почвы, }}{{{\text{с}}{{{\text{м}}}^{3}}} \mathord{\left/ {\vphantom {{{\text{с}}{{{\text{м}}}^{3}}} {{\text{с}}{{{\text{м}}}^{3}}}}} \right. \kern-0em} {{\text{с}}{{{\text{м}}}^{3}}}}\,\,({\text{на}}\,\,{\text{глубине}}\,\,10\,\,{\text{см}})}}$ | ||
|---|---|---|---|
| май | июль | сентябрь | |
| Березовый лес | $\frac{{ - 0.005 \pm 0.010}}{{0.4;\,\,0.43}}$ | $\frac{{ - 0.133 \pm 0.011}}{{13.6;\,\,0.17}}$ | $\frac{{ - 0.153 \pm 0.019}}{{8.5;\,\,0.16}}$ |
| Кедровый лес | $\frac{{ - 0.034 \pm 0.020}}{{ - 0.5;\,\,0.25}}$ | $\frac{{ - 0.141 \pm 0.040}}{{11.9;\,\,0.22}}$ | $\frac{{ - 0.150 \pm 0.024}}{{7.6;\,\,0.18}}$ |
| Смешанный лес | $\frac{{ - 0.022 \pm 0.006}}{{ - 0.3;\,\,0.34}}$ | $\frac{{ - 0.122 \pm 0.025}}{{12.6;\,\,0.26}}$ | $\frac{{ - 0.139 \pm 0.015}}{{9.9;\,\,0.15}}$ |
Полученные результаты характеризуют исследованные лесные экосистемы как очень мощный сток атмосферного метана. Величины УП могут показаться неправдоподобно высокими по модулю для лесов бореального климатического пояса, если ориентироваться на базу данных, представленную в работе Dutaur, Verchot (2007). Однако эта база содержит очень мало данных, полученных в России вообще и в бореальных лесах России в частности. Высокие по абсолютной величине значения УП (–0.10 мг СН4/м2 в час и ниже) были, например, зарегистрированы в лесных экосистемах Московской области (Семенов и соавт., 2004) и луговых экосистемах близ г. Красноярск (Menyailo et al., 2008). Достоверность полученных результатов подтверждается их согласованностью между собой: сравнительно высоким по модулю, согласно литературным данным, значениям УП соответствуют сравнительно высокие, согласно литературным данным, величины удельной скорости окисления метана при его атмосферной концентрации. Кроме того, такие значения УП и удельной скорости окисления все же встречаются в литературе, хоть и воспринимаются в работе Dutaur, Verchot (2007) как выбросы со статистической точки зрения.
Обилие метанотрофов в исследованных почвах. Число копий генов pmoA варьировало в диапазоне от n × 107 до n × 109 ед./г почвы (рис. 2). Лишь в трех образцах наблюдались значения порядка 106 ед./г почвы, что могло быть обусловлено ингибированием реакции амплификации. Полученные значения превышают на 2–4 порядка число копий генов pmoA в почве экосистемы широколиственного леса опытной станции Тимирязевской академии в г. Москва (Kravchenko, Sukhacheva, 2017) и широколиственного леса в Британской Колумбии (Christiansen et al., 2017). В других работах отмечаются более высокие величины, тем не менее, не превышающие 2 × 108 копий генов pmoA/г почвы (Degelmann et al., 2010; Praeg et al., 2017; Tiwari et al., 2018). Таким образом, полученные в настоящем исследовании значения числа копий генов pmoA являются рекордными для автоморфных почв: нам не удалось найти ни одной работы, зарегистрировавшей столь высокое число копий генов метанотрофов в этих почвах.
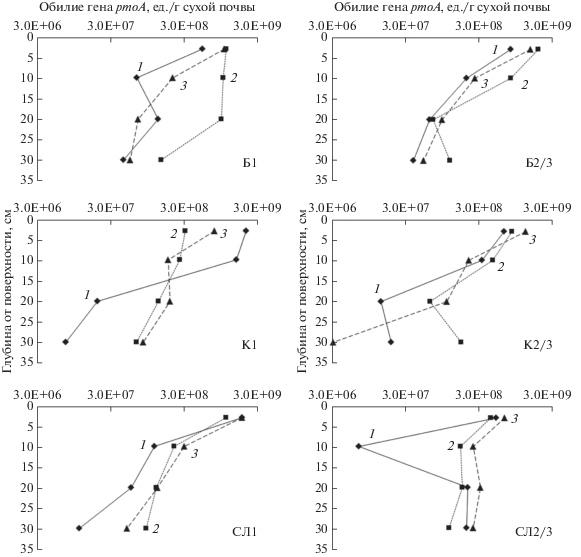
Рис. 2.
Зависимость обилия метанотрофов, характеризуемого числом копий генов pmoA на 1 г сухой почвы, от глубины почвы для всех исследованных экосистем (цифры рядом с кривыми обозначают месяц: 1 – май, 2 – июль, 3 – сентябрь; буквы обозначают тип экосистемы: Б – березовый лес, К – кедровый лес, СЛ – смешанный лес; цифры рядом с буквами обозначают номера точек, рядом с которыми отбирались образцы, характеризуя таким образом внутриэкосистемную вариабельность). Средний уровень случайной погрешности индивидуального измерения количества копий генов pmoA – ±30–50%. Шкалы на оси абсцисс даны в логарифмическом масштабе.
Поскольку этот параметр начал измеряться недавно, данных по нему накоплено сравнительно немного, а методика их получения находится в стадии совершенствования. При проведении кПЦР применяются разные пары праймеров и протоколы, что, в совокупности с использованием различающихся реактивов, приводит к отличиям в полученных результатах на порядки (Degelmann et al., 2010). В связи с этим, сравнение полученных разными авторами на разных объектах абсолютных величин обилия копий генов метанотрофных микроорганизмов может быть не вполне корректным (Baldrian, 2019). Удалось найти лишь три публикации, содержащие другие релевантные для сравнения характеристики метанотрофного сообщества автоморфных почв, помимо обилия метанотрофов. Анализ этих работ показывает, что полученные нами величины обилия метанотрофов могут быть реалистичны. Так, в статье Kravchenko, Sukhacheva (2017) число копий генов pmoA/г почвы на 4 порядка меньше по сравнению с нашими данными, но при этом УП по абсолютной величине ниже в 8 раз, а удельная скорость окисления метана ниже на 2–3 порядка. В другой статье (Christiansen et al., 2017) число копий генов pmoA/г почвы также меньше на 4 порядка, чем в исследованных в настоящей работе почвах, но и удельная скорость окисления СН4 при атмосферной концентрации метана на 2–3 порядка ниже. Наконец, в работе Degelmann et al. (2010) число копий генов pmoA/г почвы в почвах под буком и елью на 1–2 порядка меньше, чем в исследованных нами лесных почвах. В то же время УП метана по абсолютной величине в этих почвах был в 4–5 раз ниже, чем полученный в настоящей работе. Таким образом, видна повторяющаяся закономерность в том, что меньшему по сравнению с исследованными нами почвами числу копий генов pmoA всегда соответствуют меньшие значения удельной скорости окисления и УП (по абсолютной величине). При этом зависимость между указанными показателями имеет нелинейный характер. То есть возможной причиной того, что столь высокие величины числа копий генов pmoA не регистрировались ранее, может быть то, что до сих пор не были исследованы почвы, в которых окисление метана происходит настолько активно. Имеющиеся в литературе данные, по крайней мере, такому предположению не противоречат. Тем не менее, нельзя исключать, что полученные нами значения числа копий генов pmoA могут быть завышенными из-за ошибки при проведении анализа. Решением в данной ситуации может быть выполнение аналогичных измерений для тех же самых объектов на базе другой лаборатории.
Динамика удельной скорости окисления и числа копий генов pmoA на разных масштабах. Для всех профилей почвы, независимо от сезона отбора, число копий генов pmoA/г почвы снижалось с глубиной – на порядок–два от поверхности до 30 см (рис. 2). Для удельной скорости окисления СН4 ситуация аналогична (рис. 1). При этом не наблюдалось общего для всех экосистем тренда по распределению числа копий генов pmoA в зависимости от сезона отбора образцов. В березовом лесу для всех глубин отбора в целом характерно возрастание числа копий генов pmoA от мая к июлю с дальнейшим снижением к сентябрю. В смешанном лесу максимум числа копий генов pmoA обнаружен в сентябре. В кедровом лесу для разных экосистем и глубин можно выделить различные сезонные тренды обилия генов pmoA. Аналогичный ход сезонной динамики можно проследить и для удельной скорости окисления СН4 (рис. 1): в березовом лесу максимальные величины этого показателя характерны для июля, в смешанном лесу – для сентября, а в кедровом лесу в разных точках на разных глубинах ситуация отличается.
Значимых отличий в числе копий генов pmoA между экосистемами обнаружено не было. Вероятно, это связано с сильной внутриэкосистемной вариабельностью данного показателя. При этом в точках, расположенных под широколиственными деревьями (Б1, Б2/3, СЛ1), число копий генов pmoA было значимо больше, чем в точках, расположенных под сосной сибирской (К1 и СЛ2/3). Причем это было характерно как для июля (P = = 0.0173, N = 5), так и для сентября (P = 0.0460, N = 5), а также для объединенного по этим месяцам массива данных (P = 0.0016, N = 10). Аналогичная картина наблюдалась для почв центральной Германии: количество копий генов pmoA под буковым лесом было значимо выше, чем под еловым (Degelmann et al., 2010).
В то же время, величина удельной скорости окисления СН4 для точек под широколиственными породами была значимо (P = 0.0088, N = 5) меньше, чем в точках под сосной сибирской, но только для данных, полученных в сентябре. В июле значимых различий в удельной скорости окисления между этими двумя группами не наблюдалось (P = 0.8320, N = 5), ввиду того, вероятно, что была засуха, и фактор увлажнения имел особенно высокое значение, в отличие от сентября, когда острого дефицита влаги в почве уже не было. Например, точка К1 располагалась между тесно стоящими соснами, что резко ограничивало количество попадающей на нее влаги, в то время как точка СЛ2/3 располагалась под краем кроны большой сосны, и на нее попадала стекающая по кроне влага. Как результат, в июле, в период дефицита влаги, в точке К1 удельная скорость окисления на глубине 3 см была 1.4 нг СН4/г сухой почвы в час, а в точке СЛ2/3 – 7.9 нг СН4/г сухой почвы в час.
Таким образом, в сентябре при отсутствии острого дефицита влаги в точках под широколиственными породами было выше число копий генов pmoA/г почвы, но ниже удельная скорость окисления СН4 по сравнению с точками под сосной сибирской. Вероятно, такая контринтуитивная картина может быть объяснена воздействием прочих экологических факторов, влияющих на метанотрофию, а именно влажности почвы. В сентябре в точках под сосной сибирской она была значимо меньше по сравнению с точками под широколиственными породами. Таким образом, в точках под сосной сибирской была выше доля пор, заполненных почвенным воздухом, а значит, метан быстрее диффундировал через поры почвы, обеспечивая тем самым большую величину удельной скорости окисления.
Связь удельной скорости окисления и числа копий генов pmoA. Характер зависимости удельной скорости окисления СН4 от числа копий генов pmoA представлен на рис. 3. По крайней мере, в ряде случаев удельная скорость окисления очень сильно коррелирует с обилием метанотрофов в рамках одного почвенного профиля в конкретный момент времени (рис. 3а). Это объясняется тем, что метанотрофия – ключевой процесс как конструктивного, так и энергетического метаболизма определенной группы организмов, а ген pmoA кодирует связанную с мембранами форму ключевого фермента катаболизма метанотрофов – метанмонооксигеназу (Dunfield, 2007; Kolb, 2009; Aronson et al., 2013). Следовательно, получение метанотрофами энергии, а значит, и их численность должны быть при прочих равных четко (не обязательно линейно) связаны с общим количеством потребляемого субстрата.
Рис. 3.
Характер зависимости удельной скорости окисления метана исследованными почвами при атмосферной концентрации (1.33 мг СН4/м3) от обилия метанотрофов, характеризуемого числом копий генов pmoA на 1 г сухой почвы (а – для образцов, отобранных в сентябре в одной из точек в березовом лесу, удельная скорость окисления СН4 последовательно убывает в ряду образцов, взятых с глубины 3, 10, 20 и 30 см; б – для образцов, отобранных во всех экосистемах в мае; в – для образцов, отобранных во всех экосистемах в сентябре; г – для всех образцов, при этом данные сгруппированы по обилию метанотрофов в 10 классов одинаковой ширины, планки погрешности – ошибка среднего для каждого класса). Средний уровень случайной погрешности индивидуального измерения удельной скорости окисления – ±5–10%, индивидуального измерения числа копий генов pmoA – ±30–50%. На частях (б), (в) и (г) шкалы на оси абсцисс даны в логарифмическом масштабе.
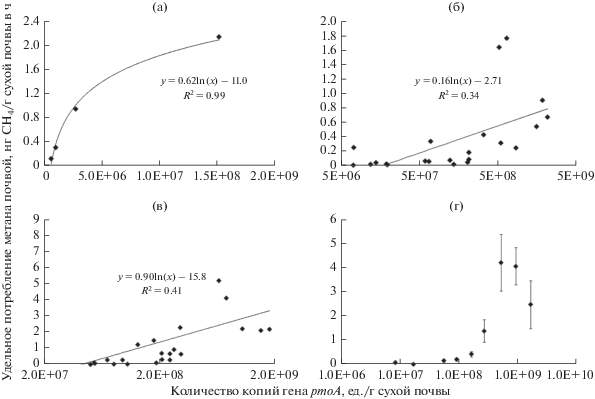
При переходе от единичного почвенного профиля к разным профилям, пусть и полученным при одновременном отборе образцов, четкая картина зависимости нарушается (рис. 3б и 3в). Такое же снижение коэффициента детерминации зависимости удельного потока от какого-либо фактора при все большем увеличении пространственного масштаба исследования уже отмечалось нами ранее (правда, в основном, для эмиссии метана) и объяснялось тогда на основе представлений о мультипликативном действии факторов среды на процесс газообмена (Glagolev et al., 2007).
В первую очередь, это связано с проницаемостью почвы для субстрата: почва имеет сложную структуру, которая формирует внутриагрегатную и межагрегатную пористость, характеристики которых обуслoвливают транспорт газов, в частности, метана, вглубь по профилю (Crill, 1991; Striegl, 1993; Moldrup et al., 2013). Именно транспортными ограничениями можно объяснить нелинейный характер зависимости удельной скорости окисления СН4 от обилия метанотрофов: обитающие во внутренней части почвенных агрегатов микроорганизмы потребляют метан уже в более низкой концентрации после того, как он прошел через слой метанотрофов, живущих на поверхности почвенных частиц. Другой вероятный вариант объяснения: диффузия метана к обитающим внутри агрегатов метанотрофам происходит медленно и лимитирует скорость потребления ими метана. В любом случае, при более низкой концентрации метана его потребление даже на энергетические функции “поддержания” будет снижаться (Dorofeev et al., 1992) по законам ферментативной кинетики (Михаэлиса–Ментен); хотя молекул ферментов/клеток микробов/копий генов pmoA может быть много, при дефиците субстрата результирующая скорость ферментативной реакции оказывается мала.
Дополнительно усложняет картину варьирующая влажность почвы, влияющая, с одной стороны, на активность микроорганизмов (которым влага необходима для процессов жизнедеятельности), а с другой – на газопроницаемость почвы (вода заполняет поры и уменьшает интенсивность диффузии газов через почву) – об этом см., например, в статье Dunfield (2007). Кроме того, метанотрофы для своего роста могут ситуативно использовать иные субстраты помимо метана, то есть может иметь место так называемая факультативная метанотрофия (Dedysh et al., 2005; Kolb, 2009; Tveit et al., 2019). В ряде случаев может наблюдаться эффект “запаздывания”, когда сначала происходит увеличение численности метанотрофов в благоприятный момент, а при ухудшении условий среды (например, засухe или похолодании) микроорганизмы снижают свою активность, сохраняя при этом повышенную биомассу. Недостаток использованного метода оценки обилия метанотрофных микроорганизмов состоит в том, что с его помощью, помимо метаболически активных метанотрофов, также учитываются гены pmoA покоящихся и мертвых клеток (Благодатская и соавт., 2016; Kravchenko, Sukhacheva, 2017), что также увеличивает разброс в результатах. Наконец, метанотрофы могут принадлежать к разным таксономическим группам, а значит иметь и разную активность, эффективность потребления субстрата, число копий гена в клетке и т.д. (Kolb, 2009; Tveit et al., 2019).
При рассмотрении всего массива данных целиком (то есть одновременно на масштабах почвенного профиля, внутриэкосистемном, межэкосистемном и сезонном) картина зависимости удельной скорости окисления от обилия метанотрофов становится еще более сложной. Для того чтобы нивелировать влияние высокой погрешности индивидуальных измерений числа копий генов pmoA, весь диапазон изменения этой величины был разделен на 10 интервалов равной ширины, и для значений, попавших в каждый из интервалов, были посчитаны средние величины числа копий генов pmoA и удельной скорости окисления СН4 (рис. 3г). Образцы распределились между интервалами сравнительно равномерно, за исключением одного интервала, оставшегося пустым. Как видим, можно выделить две группы интервалов, внутри которых удельная скорость окисления не отличается значимо (рис. 3г). Границей между группами выступает значение около 2 × 108 копий генов pmoA/г почвы. Дальнейшее возрастание числа копий генов pmoA (т.е. повышение численности метанотрофов) не приводит к значимому увеличению удельной скорости окисления СН4. Возможные причины этого уже частично обсуждались выше. Согласно Tveit et al. (2019), метанотрофы с высоким сродством к метану, ответственные за поглощение метана в автоморфных почвах, не образуют розеточных структур и формируют сферические колонии. При низкой численности метанотрофов их отдельные клетки или небольшие группы клеток не создают друг для друга дефицита субстрата, так как сквозь поровое пространство почв диффундирует достаточное для всех количество метана в единицу времени. При высокой численности метанотрофы, расположенные на поверхности почвенных агрегатов или самих колоний, потребляют метан так интенсивно, что его концентрация при поступлении внутрь частиц и/или колоний оказывается недостаточной для энергоэффективного потребления.
Коэффициент вариации для величин удельной скорости окисления СН4 при обилии генов pmoA больше 2 × 108 копий/г почвы оказывается довольно высоким, изменяясь от 0.5 до 1.1 (т.е. от 50 до 110%) для разных интервалов (рис. 3г). Такая вариабельность не может быть объяснена погрешностью индивидуальных измерений удельной скорости окисления СН4, максимальное значение которой не превышает 30%. Следовательно, значительное влияние на величину удельной скорости окисления метана в автоморфных почвах оказывают, помимо численности метанотрофов, и другие факторы: температура и влажность почвы, гранулометрический и агрегатный состав, pH, аэрация, физиологическая активность микроорганизмов и т.д. Это означает, что при построении прогнозных математических моделей потребления метана в автоморфных почвах важная роль должна быть отведена учету влияния условий среды, а также количества и доступности субстрата. Определение лишь микробиологических показателей почв не может считаться достаточным при оценке активности метанотрофии.
Список литературы
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество науч. изд. КМК, 2016. 243 с.
Кравченко И.К., Семенов В.М., Кузнецова Т.В., Быкова С.А., Дулов Л.Е., Пардини Д., Гисперт М., Боукс П., Ван Климпут О., Гальченко В.Ф. Физико-химические и биологические факторы, контролирующие окисление атмосферного метана в серых лесных почвах // Микробиология. 2005. Т. 74. С. 255–260.
Kravchenko I.K., Semenov V.M., Kuznetsova T.V., Bykova S.A., Dulov L.E., Pardini D., Gispert M., Boeckx P., Van Cleemput O., Gal’chenko V.F. Physicochemical and biological factors affecting atmospheric methane oxidation in gray forest soils // Microbiology (Moscow). 2005. V. 74. P. 216–220.
Сабреков А.Ф., Глаголев М.В., Фастовец И.А., Смоленцев Б.А., Ильясов Д.В., Максютов Ш.Ш. Связь потребления метана с дыханием почв и травяно-мохового яруса в лесных экосистемах южной тайги Западной Сибири // Почвоведение. 2015. Т. 48. С. 963–973.
Sabrekov A.F., Glagolev M.V., Fastovets I.A., Smolentsev B.A., Il’yasov D.V., Maksyutov Sh.Sh. Relationship of methane consumption with the respiration of soil and grass–moss layers in forest ecosystems of the southern taiga in Western Siberia // Euras. Soil Sci. 2015. V. 48. P. 841–851.
Семенов В.М., Кравченко И.К., Кузнецова Т.В., Семенова Н.А., Быкова С.А., Дулов Л.Е., Гальченко В.Ф., Пардини Д., Гисперт М., Боукс П., Ван Климпут О. Сезонная динамика окисления атмосферного метана в серых лесных почвах // Микробиология. 2004. Т. 73. С. 423–429.
Semenov V.M., Kravchenko I.K., Kuznetsova T.V., Semenova N.A., Bykova S.A., Dulov L.E., Gal’chenko V.F., Pardini G., Gispert M., Boeckx P., Van Cleemput O. Seasonal dynamics of atmospheric methane oxidation in gray forest soils // Microbiology (Moscow). 2004. V. 73. P. 356–362.
Aronson E.L., Allison S.D., Helliker B.R. Environmental impacts on the diversity of methane-cycling microbes and their resultant function // Front. Microbiol. 2013. V. 4. Article 225. https://doi.org/10.3389/fmicb.2013.00225
Baldrian P. The known and the unknown in soil microbial ecology // FEMS Microbiol. Ecol. 2019. V. 95. https://doi.org/10.1093/femsec/fiz005
Christiansen J.R., Gundersen P., Frederiksen P., Vesterdal L. Influence of hydromorphic soil conditions on greenhouse gas emissions and soil carbon stocks in a Danish temperate forest // Forest Ecology and Management. 2012. V. 284. P. 185–195.
Christiansen J.R., Levy-Booth D., Prescott C.E., Grayston, S.J. Different soil moisture control of net methane oxidation and production in organic upland and wet forest soils of the Pacific coastal rainforest in Canada // Can. J. Forest Res. 2017. V. 47. P. 628–635.
Ciais P., Sabine C., Govindasamy B., Bopp L., Brovkin V., Canadell J., Chhabra A., DeFries R., Galloway J., Heimann M., Jones C., Le Quéré C., Myneni R., Piao S. Thornton P. Carbon and other biogeochemical cycles // Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, 2014. P. 465–570.
Costello A.M., Lidstrom M.E. Molecular characterization of functional and phylogenetic genes from natural populations of methanotrophs in lake sediments // Appl. Environ. Microbiol. 1999. V. 65. P. 5066–5074.
Crill P.M. Seasonal patterns of methane uptake and carbon dioxide release by a temperate woodland soil // Glob. Biogeochem. Cycles. 1991. V. 5. P. 319–334.
Culpepper M.A., Rosenzweig A.C. Architecture and active site of particulate methane monooxygenase // Crit. Rev. Biochem. Mol. Biol. 2012. V. 47. P. 483–492.
Dedysh S.N., Knief C., Dunfield P.F. Methylocella species are facultatively methanotrophic // J. Bacteriol. 2005. V. 187. P. 4665–4670.
Degelmann D.M., Borken W., Drake H.L., Kolb S. Different atmospheric methane-oxidizing communities in European beech and Norway spruce soils // Appl. Environ. Microbiol. 2010. V. 76. P. 3228–3235.
Degelmann D.M., Borken W., Kolb S. Methane oxidation kinetics differ in European beech and Norway spruce soils // Eur. J. Soil Sci. 2009. V. 60. P. 499–506.
Dorofeev A.G., Glagolev M.V., Bondarenko T.F., Panikov N.S. Observation and explanation of the unusual growth kinetics of Arthrobacter globiformis // Microbiology (Moscow). 1992. V. 61. P. 24–31.
Dunfield P.F. The soil methane sink // Greenhouse Gas Sinks / Eds. Reay D.S., Hewitt C.N., Smith K.A., Grace J. CABI, Wallingford, UK, 2007. P. 152–170.
Dutaur L., Verchot L. A global inventory of the soil CH4 sink // Glob. Biogeochem. Cycles. 2007. V. 21. P. 1–9.
Fang H.J., Yu G.R., Cheng S.L., Zhu T.H., Wang Y.S., Yan J.H., Wang M., Cao M., Zhou M. Effects of multiple environmental factors on CO2 emission and CH4 uptake from old-growth forest soils // Biogeosci. 2010. V. 7. P. 395–407.
Glagolev M.V., Golovatskaya E.A., Shnyrev N.A. Greenhouse gas emission in West Siberia // Contemp. Probl. Ecol. 2008. V. 1. P. 136–146.
Graham E.B., Knelman J.E., Schindlbacher A., Siciliano S., Breulmann M., Yannarell A., Beman J.M., Abell G., Philippot L., Prosser J., Foulquier A., Yuste J.C., Glanville H.C., Jones D.L., Angel R., Salminen J., Newton R.J., Bürgmann H., Ingram L.J., Hamer U., Siljanen H.M.P., Peltoniemi K., Potthast K., Bañeras L., Hartmann M., Banerjee S., Yu R.-Q., Nogaro G., Richter A., Koranda M., Castle S.C., Goberna M., Song B., Chatterjee A., Nunes O.C., Lopes A.R., Cao Y., Kaisermann A., Hallin S., Strickland M.S., Garcia-Pausas J., Barba J., Kang H., Isobe K., Papaspyrou S., Pastorelli R., Lagomarsino A., Lindström E.S., Basiliko N., Nemergut D.R. Microbes as engines of ecosystem function: when does community structure enhance predictions of ecosystem processes? // Front. Microbiol. 2016. V. 7. Article. 214.
Graham E.B., Wieder W.R., Leff J.W., Weintraub S.R., Townsend A.R., Cleveland C.C., Philippot L., Nemergut D.R. Do we need to understand microbial communities to predict ecosystem function? A comparison of statistical models of nitrogen cycling processes // Soil Biol. Biochem. 2014. V. 68. P. 279–282.
Holmes A.J., Roslev P., McDonald I.R., Iversen N., Henriksen K., Murrell J.C. Characterization of methanotrophic bacterial populations in soils showing atmospheric methane uptake // Appl. Environ. Microbiol. 1999. V. 65. P. 3312–3318.
Knief C., Kolb S., Bodelier P.L., Lipski A., Dunfield P.F. The active methanotrophic community in hydromorphic soils changes in response to changing methane concentration // Environ. Microbiol. 2006. V. 8. P. 321–333.
Kolb S. The quest for atmospheric methane oxidizers in forest soils // Environ. Microbiol. Rep. 2009. V. 1. P. 336–346.
Kolb S., Knief C., Dunfield P.F., Conrad R. Abundance and activity of uncultured methanotrophic bacteria involved in the consumption of atmospheric methane in two forest soils // Environ. Microbiol. 2005. V. 7. P. 1150–1161.
Kou Y., Li J., Wang Y., Li C., Tu B., Yao M., Li X. Scale-dependent key drivers controlling methane oxidation potential in Chinese grassland soils // Soil Biol. Biochem. 2017. V. 111. P. 104–114.
Kravchenko I., Sukhacheva M. Methane oxidation and diversity of aerobic methanotrophs in forest and agricultural soddy-podzolic soils // Appl. Soil Ecol. 2017. V. 119. P. 267–274.
Moldrup P., Chamindu Deepagoda T.K.K., Hamamoto S., Komatsu T., Kawamoto K., Rolston D.E., de Jonge L.W. Structure-dependent water-induced linear reduction model for predicting gas diffusivity and tortuosity in repacked and intact soil // Vadose Zone Journal. 2013. V. 12. № 3.
Okano Y., Hristova K.R., Leutenegger C.M., Jackson L.E., Denison R.F., Gebreyesus B., Lebauer D., Scow K.M. Application of real-time PCR to study effects of ammonium on population size of ammonia-oxidizing bacteria in soil // Appl. Environ. Microbiol. 2004. V. 70. P. 1008–1016.
Praeg N., Wagner A.O., Illmer P. Plant species, temperature, and bedrock affect net methane flux out of grassland and forest soils // Plant Soil. 2017. V. 410. P. 193–206.
Sabrekov A.F., Glagolev M.V., Alekseychik P.K., Smolentsev B.A., Terentieva I.E., Krivenok L.A., Maksyutov S.S. A process-based model of methane consumption by upland soils // Environ. Res. Lett. 2016. V. 11. Article 075001.
Seinfeld J.H., Pandis S.N. Atmospheric Chemistry and Physics: from Air Pollution to Climate Change. John Wiley & Sons, 2006. 1232 p.
Sharma S., Radl V., Hai B., Kloos K., Fuka M.M., Engel M., Schauss K., Schloter M. Quantification of functional genes from procaryotes in soil by PCR // J. Microbiol. Methods. 2007. V. 68. P. 445–452.
Striegl R.G. Diffusional limits to the consumption of atmospheric methane by soils // Chemosphere. 1993. V. 26. P. 715–720.
Tiwari S., Singh C., Singh J.S. Land use changes: a key ecological driver regulating methanotrophs abundance in upland soils // Energy Ecol. Environt. 2018. V. 3. P. 355–371.
Tveit A.T., Hestnes A.G., Robinson S.L., Schintlmeister A., Dedysh S.N., Jehmlich N., von Bergen M., Herbold C., Wagner M., Richter A., Svenning M.M. Widespread soil bacterium that oxidizes atmospheric methane // Proc. Natl. Acad. Sci. USA. 2019. V. 116. P. 8515–8524.
Wang Y., Hayatsu M., Fujii T. Extraction of bacterial RNA from soil: challenges and solutions // Microbes Environ. 2012. V. 27. P. 111–121.
Yun J., Zhuang G., Ma A., Guo H., Wang Y., Zhang H. Community structure, abundance, and activity of methanotrophs in the Zoige wetland of the Tibetan Plateau // Microbial Ecol. 2012. V. 63. P. 835–843.
Дополнительные материалы отсутствуют.


