Микробиология, 2020, T. 89, № 2, стр. 152-168
Нестероидные противовоспалительные средства как разновидность эмерджентных загрязнителей
Е. А. Тюмина a, b, Г. А. Бажутин b, А. д. П. Картагена Гомез b, И. Б. Ившина a, b, *
a Институт экологии и генетики микроорганизмов УрО РАН – филиал Пермского федерального
исследовательского центра УрО РАН
614081 Пермь, Россия
b Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
* E-mail: ivshina@iegm.ru
Поступила в редакцию 05.08.2019
После доработки 04.09.2019
Принята к публикации 01.11.2019
Аннотация
Нестероидные противовоспалительные средства (НПВС) представляют собой группу широко применяемых в медицинской и ветеринарной практике фармацевтических препаратов. НПВС на уровне нано- и микрограммов обнаруживаются в почвах, сточных, поверхностных, грунтовых водах, донных осадках, снеге, антарктических льдах и питьевой воде. Несмотря на незначительные детектируемые количества в окружающей среде, НПВС оказывают хроническое экотоксическое воздействие на биотические компоненты экосистем. Активно разрабатываются биотехнологические способы нейтрализации микрополлютантов группы НПВС с использованием грибов и бактерий. Настоящая работа содержит обзор литературы за последние 5–10 лет по обнаружению, экотоксичности и способам нейтрализации опасных эмерджентных загрязнителей группы НПВС.
Бурное развитие промышленности, инфраструктуры и сельского хозяйства, масштабное освоение природных ресурсов, урбанизация, повышение уровня жизни и потребительского спроса привело к резкому снижению качества природной среды и увеличению числа местообитаний, в которых организмы находятся в экстремальных условиях загрязнения среды высокотоксичными поллютантами – эмерджентными загрязнителями, поступление которых в окружающую среду не регулируется и не контролируется, а обнаружение стало возможным в связи с развитием аналитических методов (Barroso et al., 2019). Наиболее опасными среди них являются фармацевтические поллютанты в виду высокой устойчивости их химической структуры и выраженной биологической активности за счет присутствия в молекулах реакционно-активных функциональных групп (Chinnaiyan et al., 2018). Источниками фармацевтического загрязнения окружающей среды являются: 1) интенсивное развитие фармацевтической промышленности, 2) отсутствие высокоэффективных методов изъятия, хранения и уничтожения фармацевтических отходов, включая способы очистки промышленных стоков фармацевтических предприятий, 3) повсеместное часто неконтролируемое потребление лекарственных препаратов населением и широкое применение их в ветеринарии и на рыбоводческих фермах, 4) попадание химических остатков фармацевтических продуктов и непосредственно фармацевтических препаратов в окружающую среду (с продуктами жизнедеятельности человека после терапевтического применения, выбрасыванием просроченных лекарств населением в канализационные системы и на полигоны твердых бытовых отходов) (aus der Beek et al., 2016; Kot-Wasik et al., 2016). На сегодня в водных объектах 71 страны мира обнаружено более 600 химических веществ, относящихся к фармацевтическим препаратам (aus der Beek et al., 2016). Чаще всего и в сравнительно низких концентрациях (от десятков нг/л до сотен мкг/л) − это тотально применяемые антибиотики, нестероидные противовоспалительные средства (НПВС), гормональные препараты, спазмолитики, гиполипидемические препараты, терапевтические средства для лечения рака, антиэпилептики и антидепрессанты, а также статины и противодиабетические препараты, все чаще потребляемые в связи с распространением малоподвижного образа жизни людей, обусловленного урбанизацией (aus der Beek et al., 2016).
Проблема фармацевтического загрязнения окружающей среды приобрела планетарный характер по масштабам и экологической значимости. НПВС обнаруживают даже в таких особо охраняемых регионах, как Антарктика, территория которой до недавнего времени считалась неподверженной антропогенному воздействию (González-Alonso et al., 2017). Несмотря на относительно низкие уровни обнаружения фармпрепаратов, их постоянное пополнение в окружающей среде может привести к высоким долговременным концентрациям и стимулировать потенциально отрицательное воздействие на человека и биосферу (Liu et al., 2017; Mezzelani et al., 2018). В связи с этим в настоящее время формируется новое направление в изучении загрязнения окружающей среды, основанное на определении содержания экофармполлютантов и их метаболитов в природных экосистемах, выявлении источников фармацевтического загрязнения, потенциальных и реальных уровней токсического воздействия фармполлютантов на живые организмы с целью разработки и внедрения эффективных методов нейтрализации и утилизации фармотходов и выведения фармполлютантов из водных и сухопутных сред (Баренбойм, Чиганова, 2012).
Поскольку традиционные методы утилизации фармотходов и обезвреживания сточных вод неэффективны (Vieno, Sillanpää et al., 2014), актуальность приобретает проблема изыскания эффективных способов выведения из окружающей среды фармполлютантов, гарантирующих полное разрушение их структуры, в том числе разработки инновационных технологий, основанных на практической эксплуатации интактных клеток микроорганизмов. Перспективность использования жизнеспособных микроорганизмов обусловлена тем, что спектр метаболизируемых ими веществ намного шире набора естественных субстратов отдельных ферментов и включает широкий круг структурных гомологов и аналогов природных и неприродных трансформируемых и утилизируемых соединений (Ivshina et al., 2018; Anteneh, Franco, 2019). Несомненный приоритет по показателям эффективности и экологичности признается за биотехнологическими методами обеззараживания опасных отходов, основанными на их биокаталитической ферментации или трансформации. Биотехнологические процессы нейтрализации антропогенных загрязнителей, в отличие от химических, протекают в умеренных условиях, при физиологических температурах, нормальном давлении и рН среды, в меньшей степени загрязняют окружающую среду побочными продуктами. Также важно, что биологическое обезвреживание химических отходов экономически менее затратно.
В наиболее общем смысловом определении НПВС – наиболее часто и повсеместно детектируемые в окружающей среде лекарственные препараты различной химической структуры, обладающие противовоспалительным, жаропонижающим и болеутоляющим действием (Лазаренко, 2016). Фармацевтические вещества группы НПВС имеют разнообразную и сложную химическую при-роду, к ним относят (табл. 1): производные индолуксусной (индометацин, сулиндак, этодолак), фенилуксусной (диклофенак), пропионовой (ибупрофен, напроксен, флурбипрофен, кетопрофен) кислот, салицилаты (ацетилсалициловая кислота), пиразолидины (метамизол), оксикамы (м-елоксикам), алканоны (набуметон) и производные сульфаномида (нимесулид) (Лазаренко, 2016). При наличии реактивных групп (в частности, гидроксильной, амидной) молекулы НПВС обладают как высокой реакционной способностью, так и стабильностью. Это обусловливает их устойчивость к биоразложению, экотоксичность, способность к персистированию и, следовательно, опасность для окружающей среды. Наиболее известный случай негативного экотоксического воздействия НПВС связан с массовым сокращением популяций трех видов грифов на территории Индийского субконтинента, вызванным интоксикацией и почечной недостаточностью птиц вследствие их кормления тушами крупного рогатого скота, обработанного диклофенаком (Swan et al., 2006). Способность к миграции НПВС в пищевой цепочке описана в нескольких работах. Так, N.L. Richards и соавт. (2011) обнаружили диклофенак и ибупрофен в шерсти выдры (Lutra lutra) на территории Великобритании, что свидетельствует о загрязнении этими фармполлютантами водных экосистем и рыбной фауны – среды обитания и кормовой базы выдр. Следует особо отметить, что на сегодняшний день практически не известна “экологическая судьба” НПВС в окружающей среде. Если вопросы воздействия их на человека и животных активно изучаются (Alsop, Wilson, 2019), появляются работы по влиянию тотально используемых НПВС на растения (Alkimin et al., 2019), то исследования в отношении микроорганизмов в их микробных сообществах, которым при контакте с фармацевтическим ксенобиотиками приходится решать проблему их детоксикации, только начинают разворачиваться (Jiang et al., 2017; Ivshina et al., 2019).
Таблица 1.
Перечень НПВС, наиболее часто обнаруживаемых в окружающей среде
| НПВС | Химическая структура | Номенклатура, CAS | Фармакологическая группа |
|---|---|---|---|
| Ацетилсалициловая кислота | 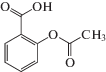 |
ИЮПАК: 2-ацетилоксибензойная кислота Брутто-формула: C9H8O4 CAS: 50-78-2 |
Производные салициловой кислоты |
| Диклофенак | 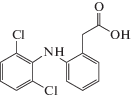 |
ИЮПАК: 2-(2-(2,6-дихлорфениамино)фенил)уксусная
кислота Брутто-формула: C14H11Cl2NO2 CAS: 15307-86-5 |
Производные фенилуксусной кислоты |
| Ибупрофен | 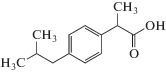 |
ИЮПАК: (RS)-2-(4-(2-Метилпропил)фенил)пропановая
кислота Брутто-формула: C13H18O2 CAS: 15687-27-1 |
Производные пропионовой кислоты |
| Индометацин | 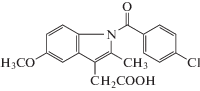 |
ИЮПАК: 2-[1-(4-хлорбензоил)-5-метокси-2-метилиндол-3-ил]уксусная кислота Брутто-формула: C19H16ClNO4 CAS: 53-86-1 |
Производные уксусной кислоты |
| Кетопрофен | 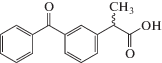 |
ИЮПАК: 2-(3-бензоилфенил)пропановая кислота Брутто-формула: C16H14O3 CAS: 22071-15-4 |
Производные пропионовой кислоты |
| Меклофенамовая кислота | 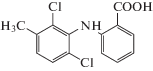 |
ИЮПАК: 2-(2,6-дихлоро-3-метиламино)бензойная кислота Брутто-формула: C14H11Cl2NO2 CAS: 644-62-2 |
Фенаматы |
| Мелоксикам | 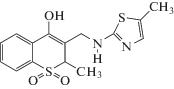 |
ИЮПАК: (4-гидрокси-2-метил-N-(5-метил-2-тиазолил)-2Н-1,2-бензотиазин-3-карбоксамид 1,1-диоксид Брутто-формула: C14H13N3O4S2 CAS: 71125-38-7 |
Оксикамы |
| Мефенамовая кислота | 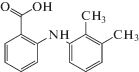 |
ИЮПАК: 2-(2,3-диметиланилино)бензойная кислота Брутто-формула: C15H15NO2 CAS: 61-68-7 |
Фенаматы |
| Напроксен | 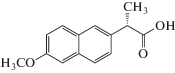 |
ИЮПАК: (S)-6-метокси-α-метил-2-нафталинуксусная кислота Брутто-формула: C14H14O3 CAS: 22204-53-1 |
Производные пропионовой кислоты |
| Нимесулид | 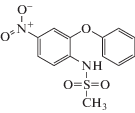 |
ИЮПАК: N-(4-нитро-2-феноксифенил)метансульфонамид Брутто-формула: C13H12N2O5S CAS: 51803-78-2 |
Производные сульфонамида |
| Нифлумовая кислота | 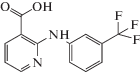 |
ИЮПАК: 2-[[3-(трифторметил)фенил]амино]-3-пиридинкарбоновая кислота Брутто-формула: C13H9F3N2O2 CAS: 4394-00-7 |
Фенаматы |
| Пироксикам | 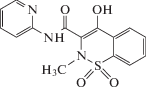 |
ИЮПАК: 4-гидрокси-2-метил-N-2-пиридинил-2H-1,2-бензотиазин-3-карбоксамид-1,1-диоксид Брутто-формула: C15H13N3O4S CAS: 36322-90-4 |
Оксикамы |
| Фенопрофен | 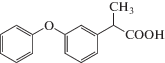 |
ИЮПАК: 2-(3-феноксифенил)пропановая кислота Брутто-формула: C15H14O3 CAS: 29679-58-1 |
Производные пропионовой кислоты |
| Этодолак | 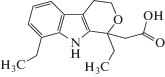 |
ИЮПАК: 2-(1,8-диэтил-4,9-дигидро-3Н-пирано[3,4-b]индол-1-ил)уксусная кислота Брутто-формула: C17H21NO3 CAS: 41340-25-4 |
Производные уксусной кислоты |
На данный момент существуют лишь разрозненные сведения, касающиеся отдельных аспектов экологической проблемы НПВС для окружающей среды. В настоящем обзоре обобщена актуальная информация (за последние 5–10 лет) по обнаружению НПВС в открытых экосистемах и живых организмах, их экотоксичности и экологической опасности, а также о способах разложения с использованием микроорганизмов разных таксономических групп.
ОБНАРУЖЕНИЕ НПВС В ОКРУЖАЮЩЕЙ СРЕДЕ
НПВС относятся к широко распространенным фармполлютантам (aus der Beek et al., 2016). Первое упоминание о присутствии НПВС в окружающей среде приводится в работе Hignite, Azarnoff (1977): салициловую кислоту детектировали в концентрации 1.83–28.79 мкг/л в очищенных сточных водах (Канзас, США).
В период с 2009 по 2019 гг. в водных промышленных и природных системах по всему миру обнаружено 26 фармполлютантов группы НПВС медицинского и ветеринарного назначения (табл. S1 ). Они детектированы в поверхностных (речные, озерные, морские, океанические), грунтовых, сточных водах (муниципальные, индустриальные, больничные), в почвах, донных осадках, питьевой воде, снеге и ледниках Антарктиды (González-Alonso et al., 2017; Gumbi et al., 2017; Toušová et al., 2019). Экологические концентрации НПВС варьируют от единиц нанограмм до сотен микрограмм. В муниципальных сточных водах содержание фармполлютантов достигает 100–200 мкг/л (Agunbiade, Moodley, 2016; Gumbi et al., 2017). Наиболее высокие уровни НПВС – 1.407 мг/л ацетилсалициловой кислоты, зарегистрированы в неочищенных муниципальных сточных водах (Sim et al., 2011). На настоящий момент наиболее часто обнаруживаемыми соединениями являются диклофенак (35 стран), ибупрофен (28 стран), напроксен (21 страна) и кетопрофен (19 стран).
Попадание НПВС в окружающую среду происходит, главным образом, с промышленными и муниципальными сточными водами (Vieno, Sillanpää, 2014). Противовоспалительные средства полностью не метаболизируются в организме человека, и неутилизированные соединения выделяются в неизмененном виде или в комплексах с глюкуроновой кислотой (Vieno, Sillanpää, 2014). Отсутствие строгого контроля в сфере оборота лекарственных средств приводит к тому, что непригодные для медицинского использования лекарственные препараты (бракованные, с истекшим сроком годности), в том числе НПВС, поступают в канализационные системы без предварительной обработки (Bashaar et al., 2017). Серьезную антропогенную нагрузку также несут сточные воды фармацевтических предприятий и медицинских учреждений, в которых содержание НПВС достигает десятков мкг/л (Sim et al., 2011; Botero-Coy et al., 2018). Очистные сооружения не справляются с фармацевтической нагрузкой – эффективность удаления некоторых НПВС не превышает 30% (Баренбойм, Чиганова, 2012; Botero-Coy et al., 2018). Кроме того, имеется информация, что в процессе очистки сточных вод концентрация НПВС может повышаться в результате высвобождения их из конъюгатов (HELCOM, 2014; Vieno, Sillanpää, 2014; Kot-Wasik et al., 2016). Отслеживание сезонной динамики фармполлютантной нагрузки на водные экосистемы показало, что зимой концентрация НПВС выше, чем в весенне-летний период, что связано с низкой турбуляцией водных масс, низкими температурами и, следовательно, слабой биодеградирующей активностью микроорганизмов (Yang et al., 2017).
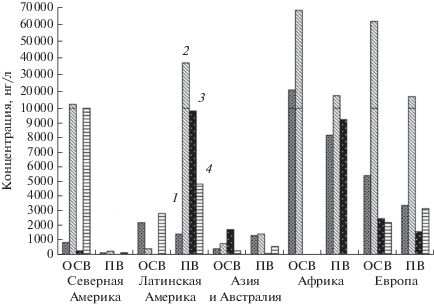
Распространение фармпрепаратов и их метаболитов в водных объектах, миграция с водотоками, воздействие на гидробиоту, биоаккумуляция и биомагнификация и, наконец, потенциальная опасность загрязнения питьевых вод свидетельствуют об исключительной опасности водного загрязнения фармполлютантами (Баренбойм, Чиганова, 2012). Как видно из рис. 1, наиболее высокие (до 70 мкг/л) концентрации в очищенных сточных и поверхностных водах характерны для ибупрофена (Agunbiade, Moodley, 2016; Gumbi et al., 2017), что связано с чрезвычайной востребованностью данного лекарства среди населения. Наиболее высокие (29 мкг/л) концентрации напроксена детектированы в очищенных сточных водах Канады (Tong et al., 2015). Высокий (9–10 мкг/л) уровень кетопрофена обнаружен в странах Латинской Америки и Африки (Spongberg et al., 2011; Gumbi et al., 2017). Значительные (до 20 мкг/л) концентрации диклофенака выявлены в очищенных сточных водах в странах Африки и Европы (Kot-Wasik et al., 2016; Gumbi et al., 2017).
Рис. 1.
Максимальные концентрации отдельных НПВС, детектированные в очищенных сточных (ОСВ) и поверхностных водах (ПВ) (с учетом данных, представленных в таблице S1 ). 1 – диклофенак; 2 – ибупрофен; 3 – кетопрофен; 4 – напроксен.
В России исследования по обнаружению фармацевтических поллютантов в окружающей среде немногочисленны и локальны. Первые работы инициированы в 2009 г. рекогносцировочными исследованиями Института водных проблем в интересах МГУП “Мосводоканал” с целью создания методологии обнаружения фармацевтических микрополлютантов в водных экосистемах, а также выявления фармакологической активности ксенобиотиков, не являющихся лекарствами (так называемые квазилекарства) (Баренбойм, Чиганова, 2012). В результате проведенных исследований в водных объектах Москвы и Московской области обнаружены 49 фармацевтических соединений и 43 метаболита известных лекарственных веществ. Среди НПВС детектировали диклофенак в концентрациях 0.19–0.35 нг/л в сточных и 0.025 нг/л в поверхностных водах (Баренбойм и соавт., 2014). Оценку фармацевтического загрязнения сточных и поверхностных вод в г. Санкт-Петербург проводили в рамках исследовательского проекта BASE Project под эгидой Хельсинкской комиссии по защите Балтийского моря (HELCOM, 2014). В сточных водах обнаружены 20 лекарственных препаратов. В обработанных сточных водах концентрация диклофенака составляла 153.8–750 нг/л (HELCOM, 2014). Выявлена сезонная динамика изменения уровня диклофенака в процессе очистки сточных вод: его средняя концентрация летом составляла 335 нг/л, в то время как зимой – 510–550 нг/л. По данным Я.В. Русских и соавт. (2014), в поверхностных водах Санкт-Петербурга, Ленинградской области и республики Карелия диклофенак обнаруживался в концентрации до 270.0 нг/л. Концентрация кетопрофена в очистных сооружениях Санкт-Петербурга варьировала от 7.2–267 нг/л в очищенных до 7.5–756 нг/л в неочищенных сточных водах (HELCOM, 2014). В поверхностных водах (р. Нева) максимальный уровень кетопрофена достигал 260 нг/л (Русских и соавт., 2014).
Таким образом, задокументированные концентрации НПВС в водных экосистемах в России сопоставимы с мировыми уровнями фармацевтического загрязнения. Такие концентрации НПВС в окружающей среде несут потенциальные экологические риски, рассчитанные по коэффициентам экологической опасности, и представляют собой источник неблагоприятных эффектов для окружающей среды.
ЭКОТОКСИЧНОСТЬ НПВС
Стабильность химической структуры и выраженная биологическая активность фармпрепаратов обусловливают их высокую устойчивость к биоразложению, токсичность, способность к персистированию в пищевых цепочках и, следовательно, потенциальную опасность для окружающей среды (табл. 2). Ряд исследователей обнаружили биоаккумуляцию НПВС в морских (Mezzelani et al., 2018) и пресноводных (Ikkere et al., 2018) моллюсках, рыбах (UNESCO, HELCOM, 2017), растениях (Pi et al., 2017). Феномен биомагнификации фармполлютантов по продвижению по пищевой цепочке от водных беспозвоночных к наземным выявлен в работе (Richmond et al., 2018). Беспрепятственная миграция фармполлютантов внутри одной экосистемы и между разными биоценозами может негативно отражаться на экологическом балансе в открытых системах разного уровня.
Таблица 2.
Острая и хроническая токсичность НПВС в отношении организмов разных таксономических групп
| Вещество | Организм | Экспозиция | Показатель, мг/л | Литературный источник | Категория опасности | |
|---|---|---|---|---|---|---|
| ЭД50 | ЛД50 | |||||
| Острая токсичность | ||||||
| Диклофенак | Aliivibrio fischeri1 | 15 мин | 15.90 | Di Nica et al., 2017 | III | |
| Raoultella sp. | 24 ч | 1950.00 | Domaradzka et al., 2016 | IV | ||
| Vibrio fisheri | 15 мин | 22.80 | de García et al., 2016 | III | ||
| V. fisheri | 15 мин | 14.04 | Czech et al., 2014 | III | ||
| Atyaephyra desmarestii2 | 96 ч | 6.30–6.40 | Nieto et al., 2016 | II | ||
| Dafnia magna | 48 ч | 2.69 | Czech et al., 2014 | II | ||
| Eisenia fetida | 72 ч | 90.49* | Pino et al., 2015 | II | ||
| Hyalella azteca | 72 ч | 4.60 | Gómez-Oliván et al., 2014 | II | ||
| Danio rerio3 | 96 ч | 4.44 | Alsop, Wilson, 2019 | II | ||
| Ибупрофен | A. fischeri1 | 15 мин | 18.30 | Di Nica et al., 2017 | III | |
| Bacillus thuringiensis | 24 ч | 809.30 | Marchlewicz et al., 2017a | IV | ||
| V. fisheri | 15 мин | 44.53 | de García et al., 2016 | III | ||
| A. desmarestii2 | 96 ч | 10.10–13.30 | Nieto et al., 2016 | III | ||
| E. fetida | 72 ч | 64.80* | Pino et al., 2015 | II | ||
| H. azteca | 72 ч | 1.70 | Gómez-Oliván et al., 2014 | II | ||
| Chlorella vulgaris4 | 48 ч | 82.25 | Geiger et al., 2016 | III | ||
| Напроксен | B. thuringiensis1 | 24 ч | 4690.00 | Górny et al., 2019 | IV | |
| D. magna2 | 24 ч | 85.34 | Kwak et al., 2018 | III | ||
| H. azteca | 72 ч | 7.60 | Gómez-Oliván et al., 2014 | II | ||
| Moina macropora | 48 ч | 74.13 | Kwak et al., 2018 | III | ||
| Индометацин | D. rerio3 | 48 ч | 171.70 | 110.90 | Selderslaghs et al., 2012 | IV |
| Кетопрофен | D. magna2 | 48 ч | 17.16 | Collard et al., 2013 | III | |
| M. macropora | 48 ч | 2.93 | Collard et al., 2013 | II | ||
| Ацетилсалициловая кислота | V. fisheri1 | 15 мин | 114.28 | de García et al., 2016 | IV | |
| H. azteca2 | 72 ч | 2.60 | Gómez-Oliván et al., 2014 | II | ||
| Салициловая кислота | V. fisheri1 | 15 мин | 105.50 | de García et al., 2016 | IV | |
| E. fetida2 | 72 ч | 162.68* | Pino et al., 2015 | III | ||
| Этодолак | Brachionus calyciflorus2 | 24 ч | >25.00 | Passananti et al., 2015 | III | |
| Ceriodaphnia dubia | 24 ч | >25.00 | Passananti et al., 2015 | III | ||
| НПВС коктейль | A. desmarestii | 96 ч | Д 29.90 И 74.70 |
Nieto et al., 2016 | III | |
| H. azteca | 72 ч | Д 0.0076 И 0.0073 Н 0.0126 |
Novoa-Luna et al., 2016 | I | ||
| Хроническая токсичность | ||||||
| Диклофенак | D. magna2 | 21 сут | 50.00 | Liu et al., 2017 | III | |
| Folsomia candida | 4 нед | 170.00* | 1099.00* | Chen et al., 2015 | III/IV | |
| Ибупрофен | Dreissena polymorpha2 | 14 сут | 13.40 | Parolini et al., 2011 | III | |
| Напроксен | D. magna2 | 21 сут | 30.00 | Kwak et al., 2018 | III | |
| M. macropora | 7 сут | 1.10 | Kwak et al., 2018 | II | ||
| Этодолак | B. calyciflorus2 | 48 ч | >10.00 | Passananti et al., 2015 | III | |
| P. subcapitata4 | 72 ч | 15.44 | Passananti et al., 2015 | III | ||
Примечания. 1 – бактерии, 2 – беспозвоночные, 3 – позвоночные, 4 – водоросли. Д – диклофенак, И – ибупрофен, Н – напроксен. * мг/кг. ЭД50 – средняя эффективная доза; ЛД50 – средняя летальная доза. I – высокотоксичные, II – токсичные, III – опасные для водных организмов, IV – нетоксичные (European Union, 2017).
Экотоксические эффекты отдельных НПВС и микстур приведены в табл. S2 . По многочисленным данным, НПВС вызывают нарушения во всех системах органов живых организмов. Наиболее общей ответной реакцией у беспозвоночных и позвоночных животных на воздействие НПВС различной химической природы является индукция окислительного стресса. Это выражается в изменении активности антиоксидантных ферментов (каталазы, супероксиддисмутазы, глутатион-S-трансферазы и др.), суммарного количества белков, а также в перекисном окислении липидов (Novoa-Luna et al., 2016). НПВС индуцируют нарушения в системе самоочищения организма: цитологические изменения почек и печени в организме рыб (Oncorhynchus mykiss, Salmo trutta) под воздействием (0.1–100 мкг/л) диклофенака описаны в работе (Schwarz et al., 2017). В присутствии диклофенака и кетопрофена выявлены нарушения кровоснабжения и сердечные аномалии у пресноводных рыб Clarias gariepinus и Danio rerio (Selderslaghs et al., 2012). Кроме того, у беспозвоночных и позвоночных животных НПВС индуцируют метаболические пертурбации: от изменения активности ферментов детоксикации до митохондриальной дисфункции и снижении функциональной активности мембран (Mezzelani et al., 2018). Известно, что НПВС способствуют изменениям на молекулярно-генетическом уровне, вызывая нарушения в экспрессии генов и разрыв цепи ДНК (Liu et al., 2017; Mezzelani et al., 2018).
Помимо перечисленных токсических эффектов, НПВС могут вызывать эндокринные нарушения. Так, K. Kwak и соавт. (2018) на модели культуры клеток H295R зафиксировали индукцию выработки половых гормонов под действием напроксена. Эндокринные нарушения у двустворчатых моллюсков и рыб в присутствии мефенамовой кислоты и диклофенака выявлены в работе (Collard et al., 2013).
По результатам единичных исследований установлено, что воздействие экотоксикантов группы НПВС на высшие растения и водоросли сопровождается индукцией окислительного стресса и изменением содержания хлорофилла, антоцианов и каротиноидов (Alkimin et al., 2019).
Микроорганизмы играют ключевую роль в окружающей среде, участвуя в биогеохимических циклах, а также являясь природной системой “первичного реагирования” на ксенобиотическую нагрузку в открытых экосистемах. Поэтому микроорганизмы представляют особый интерес в качестве объектов исследования экотоксических эффектов фармацевтических поллютантов. Исследования влияния НПВС на микроорганизмы проводятся явно недостаточно. До сих пор они сконцентрированы лишь на определении ингибирующих и токсических концентраций НПВС и таксономическом перераспределении микроорганизмов внутри микрокосмов под влиянием этих поллютантов. Существует явный недостаток информации о механизмах и эффективности защитных реакций микроорганизмов, индуцируемых присутствием фармацевтических поллютантов.
НПВС ингибируют рост речных биопленок (Corcoll et al., 2014), активного ила очистных сооружений (Jiang et al., 2017) и почвенных бактерий (Cycoń et al., 2016). Ингибирование физиологической активности микроорганизмов под воздействием фармполлютантов может приводить к нарушению важнейших экологических процессов в биосфере, таких как круговорот углерода и азота (Pino-Otín et al., 2017). Информация об изменении таксономического состава природных микробных сообществ в ответ на появление и присутствие фармполлютантов дает представление об устойчивости определенных групп микроорганизмов, а также их возможном участии в процессах деструкции и элиминации этих ксенобиотиков. Обнаружено, что под воздействием диклофенака в сообществе активного ила возрастало количество представителей родов Nitratireductor, Asticcacaulis и Pseudoxanthomonas (Nguyen et al., 2019). Напроксен в концентрации 100 мг/л оказывал токсическое действие на представителей Archaea, Betaproteobacteria и Planctomycetes в естественном сообществе речной экосистемы, а количество Alphaproteobacteria и Gammaproteobacteria, напротив, увеличивалось (Grenni et al., 2014). Влияние НПВС-коктейля на сообщество активного ила сопровождалось увеличением представителей Actinobacteria, Alphaproteobacteria, Deltaproteobacteria и Gammaproteobacteria (Jiang et al., 2017). Эти сведения свидетельствуют о том, что микроорганизмы данных таксонов могут быть вовлечены в процессы биологической деструкции фармполлютантов.
БИОЛОГИЧЕСКАЯ ДЕСТРУКЦИЯ НПВС
Деструкция рассматриваемых фармацевтических поллютантов начинается с их окисления. В качестве биологических окислителей отдельных НПВС и их смесей используются бактериальные и грибные штаммы, микробные консорциумы, водоросли и высшие растения (табл. S3 ). Масштабы исследований варьируют от лабораторных экспериментов в условиях периодического культивирования микроорганизмов-деструкторов до изучения биологического разложения фармацевтических веществ в пилотных установках и работающих очистных сооружениях (Marco-Urrea et al., 2010a; Moreira et al., 2018; Nguyen et al., 2019). Подавляющее большинство исследований посвящено изучению процессов биодеградации НПВС с использованием бактерий и грибов.
Биодеградация НПВС с использованием грибов. Ибупрофен подвергался полной и быстрой деградации, осуществляемой плесневыми грибами (Aspergillus nidulans, Eurotium amstelodami, Bipolaris tetramera), а также грибами семейства Полипоровых, или так называемыми грибами белой гнили (Trametes versicolor, Ganoderma lucidum, Irpex lacteus, Bjerkandera sp., Phanerochaete chrysosporium) (Rodarte-Morales et al., 2010; Gonda et al., 2016; Torán et al., 2017). Процесс биодеструкции ибупрофена сопровождался образованием 1-гидрокси-, 2-гидрокси- и 1,2-дигидроксиибупрофена.
Полная деструкция диклофенака достигалась при использовании грибов белой гнили Trametes versicolor (Marco-Urrea et al., 2010b; Stenholm et al., 2018), Bjerkandera sp. и Phanerochaete chrysosporium (Rodarte-Morales et al., 2010), аскомицетов Aspergillus niger, Beauveria bassiana, Penicillium oxalicum, зигомицетов Cunninghamella echinulata, C. elegans (Olicón-Hernández et al., 2019) и агарикомицета Pleurotus ostreatus (Palli et al., 2017). Основными метаболитами грибной биоконверсии диклофенака являлись 4'-гидрокси- и 5-гидроксидиклофенак.
Эффективное разложение напроксена в почве, а также в мембранном биореакторе и в процессе твердофазной очистки шлама очистных сооружений было достигнуто с использованием грибов Trametes versicolor (Marco-Urrea et al., 2010a), Bjerkandera sp. и Phanerochaete chrysosporium (Rodarte-Morales et al., 2010), Aspergillus niger (Aracagök et al., 2017).
Гриб Trametes versicolor полностью трансформировал кетопрофен с образованием 2-[3-(4-гидроксибензил)фенил]-, 2-[(3-гидрокси(фенил)метил)фенил]- и 2-(3-бензоил-4-гидроксифенил)-пропановой кислоты (Marco-Urrea et al., 2010c; Torán et al., 2017). Штамм Phanerochaete sordida YK-624 трансформировал мефенамовую кислоту практически полностью (90%) в течение 6 сут с образованием 3'-гидроксиметил-, 3'-гидроксиметил-5-гидрокси-, 3'-гидроксиметил-6'-гидрокси- и 3'-карбоксимефенамовой кислоты (Hata et al., 2010). Использование грибов Aspergillus niger, Bipolaris tetramera приводило на 28 сут эксперимента к 80% биодеструкции мефенамовой кислоты, используемой в качестве единственного источника углерода и энергии. Aspergillus nidulans трансформировал в течение 28 сут пироксикам (100 мкг/л) с образованием гидроксипироксикама (Gonda et al., 2016).
Несмотря на высокую деградирующую активность грибов в отношении фармполлютантов, существует ряд ограничений их широкого использования в процессах очистки сточных вод: 1) оптимальный режим функционирования грибов наблюдается при pH 4.5, в то время как pH сточных вод составляет около 7; 2) необходимость внесения дополнительного энергетического субстрата; 3) возможность обрастания биореактора; 4) характер посевного (спорового) материала; 5) способность к синтезу микотоксинов; 6) потеря биодеградационной активности в процессе иммобилизации; 7) неэффективная конкуренция с автохтонными бактериями, сопровождающаяся снижением ферментативной активности грибами, снижением их биомассы, повреждением мицелия (Rodarte-Morales et al., 2010; Olicón-Hernández et al., 2019). В связи с этим бактериальная деградация фармполлютантов приобретает все большую популярность.
Биодеградация НПВС с использованием бактерий. Ибупрофен является одним из наиболее легко биодеградируемых препаратов из группы НПВС и отличается достаточно высокой степенью разложения в биореакторах лабораторного масштаба, а также в процессе очистки сточных вод. В работе R.W. Murdoch и A.G. Hay (2015) на предмет биодеструктирующей активности ибупрофена (500 мг/л) была изучена бета-протеобактерия Variovorax sp. Ibu-1. Этот штамм практически полностью (90%) метаболизировал ибупрофен в качестве единственного источника углерода в течение 150 ч с образованием 3-гидроксиибупрофена. Способность к полному разложению (5 и 20 мг/л) ибупрофена в условиях метаболизма и кометаболизма (в присутствии 1 мг/л глюкозы) отмечена у штамма Bacillus thuringiensis B1(2015b) (Marchlewicz et al., 2016). В дальнейшем авторы изучали биодеградирующий потенциал данного штамма в отношении ибупрофена (5, 10 мг/л) в присутствии разных косубстатов (глюкозы, фенола, бензоата), хлорфенолов (2-хлорфенола, 4-хлорфенола) и тяжелых металлов (меди, кадмия, хрома, кобальта). Полная биодеструкция (10 мг/л) ибупрофена наблюдалась через 36–85 ч, при этом в присутствии 4-хлорфенола убыль вещества составила только 20% (Marchlewicz et al., 2017a, 2017b). Анализ продуктов разложения ибупрофена выявил среди них наличие гидроксипроизводных и хинонов. Актинобактериальный штамм Patulibacter medicamentivorans I11 деградировал ибупрофен (50–1000 мкг/л) с разной степенью эффективности: максимальные показатели убыли вещества достигались на 90 ч эксперимента при начальной концентрации ибупрофена 50 мкг/л (Salgado et al., 2018). Авторами впервые описана подробная схема бактериальной метаболизации этого фармполлютанта с образованием 22 продуктов. В общем случае деградация ибупрофена начиналась с отщепления карбоксильной боковой цепи с образованием катехинов (Salgado et al., 2018).
Отдельные исследования по биоконверсии ибупрофена были проведены с вовлечением в этот процесс бактериальных консорциумов. Применение активного ила описано в работах (Almeida et al., 2013; Langenhoff et al., 2013). При этом эффективность биодеструкции ибупрофена варьировала в широком диапазоне – от 100% на 2–8 ч до 68% на 28 сут. Полная биодеструкция ибупрофена была достигнута с использованием бактериального сообщества речной воды (Koumaki et al., 2017), однако микробный консорциум морской воды лишь частично (28%) деградировал этот фармполлютант (Baena-Nogueras et al., 2017).
Диклофенак – наиболее устойчивый к биологической трансформации НПВС (He et al., 2018). Эффективность его нейтрализации в очистных сооружениях остается достаточно низкой (Botero-Coy et al., 2018). Как правило, биодеградация диклофенака отсутствовала либо была незначительной в условиях современных очистных установок, в том числе в мембранных биореакторах, реакторах с неподвижным или подвижным био-пленочным слоем, а также гидроботанических площадках (Bragança et al., 2016). Тем не менее, имеются немногочисленные сведения об эффективной трансформации диклофенака в биореакторах разных конструкций. Так, в работе K.S. Jewell и соавт. (2016) описана практически полная биотрансформация диклофенака (250 мкг/л) в течение 24 ч в условиях реактора с подвижным биопленочным слоем, что сопровождалось образованием 20 метаболитов, среди которых обнаруживались диклофенак-лактам, диклофенак-бензойная кислота, 4'-гидрокси- и 5-гидроксидиклофенак. Использование активного ила для биоконверсии диклофенака в разных концентрациях описано в нескольких работах при эффективности удаления диклофенака от 10 до 80% (Langenhoff et al., 2013; Nguyen et al., 2019). Полная биоконверсия диклофенака почвенным микробным консорциумом продемонстрирована в работах (Facey et al., 2018; Thelusmond et al., 2018).
Исследования, посвященные поиску отдельных активных штаммов-биодеструкторов НПВС достаточно ограничены. При этом в качестве биодеструкторов рассматриваются в основном энтеробактерии и актинобактерии. С использованием энтеробактерии Klebsiella sp. KSC достигнута полная метаболизация диклофенака (70 мг/л) в течение 72 ч с образованием 12 продуктов (Stylianou et al., 2018). Штаммы Enterobacter hormaechei D15 и E. cloacae D16 конвертировали диклофенак (10 мг/л) на 52.8 и 82.0% в течение 48 ч соответственно, с образованием в качестве промежуточного продукта 1-(2,6-дихлофенил)-1,3-дигидро-2H-индол-2-она (Aissaoui et al., 2017). Штамм Raoultella sp. KDF8 в присутствии этанола как соокислителя деградировал диклофенак в высокой концентрации (1 г/л) на 92% в течение 72 ч (Palyzová et al., 2019). Биоконверсия сопровождалась образованием 32 метаболитов, среди которых были детектированы малоновая, оксоглутаровая, 3‑гидроксиглутаровая, гидроксилевулиновая кислоты, что свидетельствовало о раскрытии цикла и дехлорировании исходной молекулы диклофенака. Бактериальный штамм Labrys portucalensis F11 деструктировал диклофенак (34 мМ) в качестве единственного источника углерода на 70% в течение 30 сут (Moreira et al., 2018). В присутствии ацетата натрия продолжительность биодеструкции экотоксиканта в концентрации 1.7 и 34 мМ составляла 6 и 25 сут соответственно. Биодеградация диклофенака сопровождалась образованием 12 метаболитов, включая гидроксипроизводные и бензохинонимин.
Актинобактерии рода Brevibacterium метаболизировали диклофенак (10 мг/л) в качестве единственного источника углерода на 35% в течение 30 сут (Bessa et al., 2017), а введение в среду культивирования глюкозы в качестве дополнительного энергетического источника повысило эффективность биодеструкции в 2.5 раза. Штамм Microbacterium flavescens MG7, выделенный из ризосферы канареечника тростниковидного (Phalaris arundinacea), деструктировал диклофенак (2 мг/л) на 15 и 35% в качестве единственного источника углерода и в присутствии фенола, соответственно (Węgrzyn, Felis, 2018).
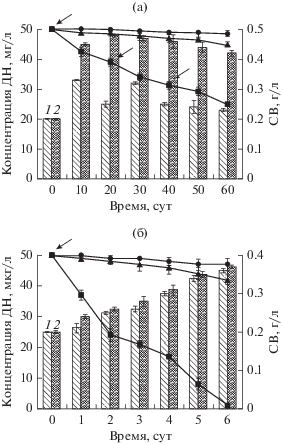
Отметим явный недостаток информации о механизмах и эффективности защитных реакций бактериальной клетки, индуцируемых на присутствие диклофенака. Лишь недавно проведены исследования по биодеструкции этого экотоксиканта с использованием экологически значимых видов родококков в условиях соокисления (Ivshina et al., 2019; Tyumina et al., 2019). В присутствии глюкозы (0.5%) клетки Rhodococcus ruber ИЭГМ 346 полностью деструктировали 50 мкг/л диклофенака в течение 6 сут (рис. 2). С использованием штаммов R. ruber ИЭГМ 231 и ИЭГМ 346 достигнута частичная (50%) деградация диклофенака в высокой (50 мг/л) концентрации. Биоконверсия диклофенака родококками в этих условиях протекала по трем путям метаболизации гидроксипроизводных экотоксиканта (4'-гидрокси- и 5-гидроксидиклофенак) с образованием 16 метаболитов. В процессе деградации молекулы наблюдался разрыв связи C–N, а также раскрытие ароматического кольца c образованием фумарилацетоуксусной кислоты и продуктов ее гидролиза – фумаровой и ацетоуксусной кислот, которые могут считаться конечными продуктами детоксикации диклофенака.
Рис. 2.
Динамика биодеградации 50 мг/л (а) и 50 мкг/л (б) диклофенака клетками Rhodococcus ruber ИЭГМ 346 (◼) в присутствии глюкозы. (⚫) контроль абиотической деструкции, (▲) контроль биосорбции, (1) сухой вес (СВ) родококков в присутствии диклофенака и глюкозы и (2) СВ родококков в присутствии глюкозы. Стрелками обозначено довнесение глюкозы (модифицировано по Ivshina et al., 2019).
Следует отметить ключевую экологическую роль родококков в метаболизации ксенобиотиков и устойчивых органических соединений, в том числе фармполлютантов (Ivshina et al., 2012, 2015). Поэтому особый интерес представляет изучение активации специфических механизмов в клетках родококков в ответ на токсическое воздействие диклофенака. Установлено, что на популяционном уровне наиболее характерной реакцией родококков является формирование многоклеточных агрегатов в жидкой среде, что, по-видимому, обеспечивает способность популяции адаптироваться и расти в условиях, при которых одиночные клетки не способны к размножению и биодеструкции токсиканта. У одиночных клеток нередко отмечается отслоение оболочки и излитие внутриклеточного содержимого во внешнюю среду, а также появление морфологических аномалий клеток, изменение их формы и размеров, площади поверхности и ее шероховатости (рис. 3). В присутствии фармполлютанта происходило изменение ζ-потенциала, повышение гидрофобности и содержания общих клеточных липидов (Ivshina et al., 2019). Отмеченные морфологические и физико-химические изменения рассматриваются как механизмы адаптации клеток и, как следствие, повышения их устойчивости к токсическому воздействию фармполлютанта.
Рис. 3.
3D АСМ/КЛСМ и АСМ клеток Rhodococcus ruber ИЭГМ 346: a, д – клетки, выращенные в LB-бульоне в течение 2 сут; г, з – клетки, выращенные в присутствии 50 мг/л диклофенака в течение 10 сут; б, в, е, ж – клетки, выращенные в присутствии 50 мкг/л диклофенака в течение 10 сут (модифицировано по Ivshina et al., 2019).

Имеются единичные работы по биодеструкции напроксена отдельными бактериальными штаммами. Биоконверсия напроксена (6 мг/л) гамма-протеобактериальным штаммом Stenotrophomonas maltophilia KB2 варьировала от 28 до 78% за 35 сут инкубации в условиях метаболизма и кометаболизма (глюкоза) соответственно (Wojcieszyńska et al., 2014). В присутствии фенола напроксен (6 мг/л) полностью разлагался клетками Bacillus thuringiensis B1 в течение 28 сут (Marchlewicz et al., 2016; Górny et al., 2019). Варьирование условий культивирования Planococcus sp. S5 обеспечивало биодеструкцию напроксена (6 мг/л) на 21.50–86.27% за 35 сут инкубации (Domaradzka et al., 2015; Wojcieszyńska et al., 2016). Установлено, что нитрификация может способствовать более эффективной биодеградации некоторых НПВС, в том числе напроксена (Park et al., 2017; He et al., 2018), что обусловлено субстратной неспецифичностью аммоний-монооксигеназ у нитрифицирующих бактерий. Использование анаэробного консорциума активного ила в условиях диссимилятивного восстановления марганца позволило добиться деструкции напроксена на 52% за 42 сут (Liu et al., 2018). В работе (Wolfson et al., 2018) описана полная биотрансформация напроксена метаногенным микробным консорциумом, что сопровождалось деметилированием исходной молекулы.
Возможность биодеструкции кетопрофена показана только с использованием бактериальных консорциумов. Высокая степень удаления этого фармполлютанта наблюдалась в присутствии нитрифицирующих бактерий (Park et al., 2017). Бактериальный консорциум сточной воды (Raoultella ornithinolytica B6, Pseudomonas aeruginosa strain JPP, Pseudomonas sp. P16, Stenotrophomonas sp. 5LF 19TDLC) полностью утилизировал кетопрофен (2–5 мМ) в течение 2–7 сут в зависимости от условий освещенности (Ismail et al., 2016). Среди метаболитов идентифицировали 3-этилфенил(фенил)- и 3-гидроксифенил(фенил)метанон, 3-гидроксифенил(оксо)уксусную кислоту. С использованием консорциума речной воды показана 50% деградация кетопрофена (40 мкг/л) в течение 6–11 сут (Koumaki et al., 2017). Активный ил полностью разлагал 100 мкг кетопрофена в течение 8–25 ч (Almeida et al., 2013).
Полная биодеструкция (1 мкг/л) мефенамовой кислоты и индометацина микробным консорциумом морской воды достигалась за 28 сут инкубации (Baena-Nogueras et al., 2017). В работе (Park et al., 2017) отмечено, что эффективность удаления этих НПВС нитрифицирующими бактериями составляла меньше 40% и не повышалась в условиях кометаболизма. Биоконверсия мефенамовой кислоты (10 мкг/л) за 24 сут инкубации аммоний-нитрит-окисляющими, нитрит-окисляющими и гетеротрофными бактериями достигала 85.0, 47.6 и 66.4% соответственно (Velázquez, Nacheva, 2017).
Конверсия фенопрофена (1 мкг/л) в присутствии микробного консорциума морской воды составляла лишь 28% за 28 сут (Baena-Nogueras et al., 2017). Процесс биоразложения нимесулида (10 мкМ) бактериями, изолированными вблизи резервуара для хранения нефти, в присутствии пентана протекал крайне медленно: остаточное содержание вещества на 96 сут эксперимента составляло 20% (Bragança et al., 2016).
Дальнейшие исследования, по-видимому, могут быть сфокусированы, во-первых, на поиске активных биодеструкторов не только отдельных фармполлютантов и их смесей, но и комплексах с другими поллютантами, фенолами, углеводородами, тяжелыми металлами. Во-вторых, переход от лабораторных экспериментов к промышленной эксплуатации микробных биодеструкторов должен быть сопряжен с использованием не синтетических сред, а реальных сточных вод.
ЗАКЛЮЧЕНИЕ
Серьезная озабоченность присутствием фармполлютантов в открытых экосистемах появилась сравнительно недавно – только в начале 2000-х годов медикаментозное загрязнение окружающей среды начали рассматривать как новую экологическую проблему, несущую растущую реальную и уже не скрытую угрозу человеку и биосфере в глобальном масштабе. Присутствие в окружающей среде микрозагрязнителей группы НПВС создает риск хронического токсического воздействия на живые организмы и угрозу дестабилизации природных экосистем. Физико-химические способы борьбы с НПВС-загрязнением неэффективны и экологически небезопасны, в связи с чем активно разрабатываются биокатализаторы на основе отдельных штаммов микроорганизмов или микробных консорциумов, способных к эффективной детоксикации и выведению этих фармполлютантов из водных и наземных экосистем. Параллельно наблюдается нарастание интереса к фундаментальному изучению степени биодоступности и токсического воздействия фармполлютантов на природные микробные сообщества, играющие роль системы первичного реагирования, и микроорганизмы, инициирующие адаптивные реакции. Углубленное изучение механизмов и метаболических путей детоксикации и биодеградации фармполлютантов группы НПВС и новые штаммы-биодеструкторы с детально изученными физиологическими и биохимическими характеристиками позволят создать предпосылки для реализации в обозримом будущем инновационных технических решений процессов доочистки сточных вод предприятий фармацевтического профиля, а также для разработки экологически безопасных биотехнологических способов обезвреживания и утилизации опасных фармацевтических отходов.
Список литературы
Баренбойм Г.М., Чиганова М.А. Загрязнение поверхностных и сточных вод лекарственными препаратами // Вода: химия и экология. 2012. № 10. С. 40–46.
Баренбойм Г.М., Чиганова М.А., Березовская И.В. Особенности загрязнения поверхностных водных объектов компонентами лекарственных средств // Водное хозяйство России: проблемы, технологии, управление. 2014. № 3. С. 131–141.
Лазаренко Л.В. Лекарственные поражения печени и поджелудочной железы у животных при использовании нестероидных противовоспалительных препаратов: монография. Пермь: ФКОУ ВО Пермский институт ФСИН России, 2016. 94 с.
Русских Я.В., Чернова Е.Н., Никифоров В.А., Жаковская З.А. Лекарственные соединения в водных объектах Северо-Запада России // Региональня экология. 2014. № 1–2. С. 77–83.
A gunbiade F.O., Moodley B. Occurrence and distribution pattern of acidic pharmaceuticals in surface water, wastewater, and sediment of the Msunduzi River, Kwazulu-Natal, South Africa // Environ. Toxicol. Chem. 2016. V. 35. P. 36–46.
Aissaoui S., Ouled-Haddar H., Sifour M., Harrouche K., Sghaier H. Metabolic and co-metabolic transformation of diclofenac by Enterobacter hormaechei D15 isolated from activated sludge // Curr. Microbiol. 2017. V. 74. P. 381–388.
Alkimin G.D., Daniel D., Frankenbach S., Serôdio J., Soares A.M.V.M., Barata C., Nunes B. Evaluation of pharmaceutical toxic effects of non-standard endpoints on the macrophyte species Lemna minor and Lemna gibba // Sci. Total Environ. 2019. V. 657. P. 926–937.
Almeida B., Oehmen A., Marques R., Brito D., Carvalho G., Barreto Crespo M.T. Modelling the biodegradation of non-steroidal anti-inflammatory drugs (NSAIDs) by activated sludge and a pure culture // Bioresour. Technol. 2013. V. 133. P. 31–37.
Alsop D., Wilson J.Y. Waterborne pharmaceutical uptake and toxicity is modified by pH and dissolved organic carbon in zebrafish // Aquat. Toxicol. 2019. V. 210. P. 11–18.
Anteneh Y.S., Franco C.M.M. Whole cell Actinobacteria as biocatalysts // Front. Microbiol. 2019. V. 10. Article 77. https://doi.org/10.3389/fmicb.2019.00077
Aracagök Y.D., Göker H., Cihangir N. Biodegradation of micropollutant naproxen with a selected fungal strain and identification of metabolites // Z. Naturforsch. C. 2017. V. 72. P. 173–179.
aus der Beek T., Weber F.A., Bergmann A., Hickmann S., Ebert I., Hein A., Küster A. Pharmaceuticals in the environment – Global occurrences and perspectives // Environ. Toxicol. Chem. 2016. V. 35. P. 823–835.
Baena-Nogueras R.M., González-Mazo E., Lara-Martín P.A. Degradation kinetics of pharmaceuticals and personal care products in surface waters: photolysis vs biodegradation // Sci. Total Environ. 2017. V. 590–591. P. 643–654.
Barroso P.J., Santos J.L., Martín J., Aparicio I., Alonso E. Emerging contaminants in the atmosphere: Analysis, occurrence and future challenges // Crit. Rev. Environ. Sci. Technol. 2019. V. 49. P. 104–171.
Bashaar M., Thawani V., Hassali M.A., Saleem F. Disposal practices of unused and expired pharmaceuticals among general public in Kabul // BMC Public Health. 2017. V. 17. Article 45. https://doi.org/10.1186/s12889-016-3975-z
Bessa V.S., Moreira I.S., Tiritan M.E., Castro P.M.L. Enrichment of bacterial strains for the biodegradation of diclofenac and carbamazepine from activated sludge // Int. Biodeterior. Biodegrad. 2017. V. 120. P. 135–142.
Botero-Coy A.M., Martínez-Pachón D., Boix C., Rincón R.J., Castillo N., Arias-Marín L.P., Manrique-Losada L., Torres-Palma R., Moncayo-Lasso A., Hernández F. An investigation into the occurrence and removal of pharmaceuticals in Colombian wastewater // Sci. Total Environ. 2018. V. 642. P. 842–853.
Bragança I., Danko A.S., Pacheco J., Frascari D., Delerue-Matos C., Domingues V.F. Cometabolic degradation of anti-inflammatory and analgesic pharmaceuticals by a pentane enrichment culture // Water Air Soil Pollut. 2016. V. 227. Article 227. https://doi.org/10.1007/s11270-016-2933-9
Chen G., Den Braver M.W., Van Gestel C.A.M., Van Straalen N.M., Roelofs D. Ecotoxicogenomic assessment of diclofenac toxicity in soil // Environ. Pollut. 2015. V. 199. P. 253–260.
Chinnaiyan P., Thampi S.G., Kumar M., Mini K.M. Pharmaceutical products as emerging contaminant in water: relevance for developing nations and identification of critical compounds for Indian environment // Environ. Monit. Assess. 2018. V. 190. Article 288. https://doi.org/10.1007/s10661-018-6672-9
Collard H.J., Ji K., Lee S., Liu X., Kang S., Kho Y., Ahn B., Ryu J., Lee J., Choi K. Toxicity and endocrine disruption in zebrafish (Danio rerio) and two freshwater invertebrates (Daphnia magna and Moina macrocopa) after chronic exposure to mefenamic acid // Ecotoxicol. Environ. Saf. 2013. V. 94. P. 80–86.
Corcoll N., Acuña V., Barceló D., Casellas M., Guasch H., Huerta B., Petrovic M., Ponsatí L., Rodríguez-Mozaz S., Sabater S. Pollution-induced community tolerance to non-steroidal anti-inflammatory drugs (NSAIDs) in fluvial biofilm communities affected by WWTP effluents // Chemosphere. 2014. V. 112. P. 185–193.
Cycoń M., Borymski S., Żołnierczyk B., Piotrowska-Seget Z. Variable effects of non-steroidal anti-inflammatory drugs (NSAIDs) on selected biochemical processes mediated by soil microorganisms // Front. Microbiol. 2016. V. 7. Article 1969. https://doi.org/10.3389/fmicb.2016.01969
Czech B., Jośko I., Oleszczuk P. Ecotoxicological evaluation of selected pharmaceuticals to Vibrio fischeri and Daphnia magna before and after photooxidation process // Ecotoxicol. Environ. Saf. 2014. V. 104. P. 247–253.
De García S.O., García-Encina P.A., Irusta-Mata R. Dose-response behavior of the bacterium Vibrio fischeri exposed to pharmaceuticals and personal care products // Ecotoxicology. 2016. V. 25. P. 141–162.
Di Nica V., Villa S., Finizio A. Toxicity of individual pharmaceuticals and their mixtures to Aliivibrio fischeri: Experimental results for single compounds and considerations of their mechanisms of action and potential acute effects on aquatic organisms // Environ. Toxicol. Chem. 2017. V. 36. P. 807–814.
Domaradzka D., Guzik U., Hupert-Kocurek K., Wojcieszyńska D. Cometabolic degradation of naproxen by Planococcus sp. strain S5 // Water Air Soil Pollut. 2015. V. 226. Article 297. https://doi.org/10.1007/s11270-015-2564-6
Domaradzka D., Guzik U., Hupert-Kocurek K., Wojcieszyńska D. Toxicity of diclofenac and its biotransformation by Raoultella sp. DD4 // Polish J. Environ. Stud. 2016. V. 25. P. 2211–2216.
European Union. Committee of Experts on the Transport of Dangerous Goods and on the Globally Harmonized System of Classification and Labelling of Chemicals Sub-Committee of Experts on the Globally Harmonized System of Classification and Labelling of Chemicals Thirty-Sixt. 2017. 534 p.
Facey S.J., Nebel B.A., Kontny L., Allgaier M., Hauer B. Rapid and complete degradation of diclofenac by native soil microorganisms // Environ. Technol. Innov. 2018. V. 10. P. 55–61.
Geiger E., Hornek-Gausterer R., Saçan M.T. Single and mixture toxicity of pharmaceuticals and chlorophenols to freshwater algae Chlorella vulgaris // Ecotoxicol. Environ. Saf. 2016. V. 129. P. 189–198.
Gómez-Oliván L.M., Neri-Cruz N., Galar-Martínez M., Islas-Flores H., García-Medina S. Binary mixtures of diclofenac with paracetamol, ibuprofen, naproxen, and acetylsalicylic acid and these pharmaceuticals in isolated form induce oxidative stress on Hyalella azteca // Environ. Monit. Assess. 2014. V. 186. P. 7259–7271.
Gonda S., Kiss-Szikszai A., Szucs Z., Balla B., Vasas G. Efficient biotransformation of non-steroid anti-inflammatory drugs by endophytic and epiphytic fungi from dried leaves of a medicinal plant, Plantago lanceolata L. // Int. Biodeterior. Biodegrad. 2016. V. 108. P. 115–121.
González-Alonso S., Merino L.M., Esteban S., López de Alda M., Barceló D., Durán J.J., López-Martínez J., Aceña J., Pérez S., Mastroianni N., Silva A., Catalá M., Valcárcel Y. Occurrence of pharmaceutical, recreational and psychotropic drug residues in surface water on the northern Antarctic Peninsula region // Environ. Pollut. 2017. V. 229. P. 241–254.
Górny D., Guzik U., Hupert-Kocurek K., Wojcieszyńska D. Naproxen ecotoxicity and biodegradation by Bacillus thuringiensis B1(2015b) strain // Ecotoxicol. Environ. Saf. 2019. V. 167. P. 505–512.
Grenni P., Patrolecco L., Ademollo N., Di Lenola M., Barra Caracciolo A. Capability of the natural microbial community in a river water ecosystem to degrade the drug naproxen // Environ. Sci. Pollut. Res. 2014. V. 21. P. 13470–13479.
Gumbi B.P., Moodley B., Birungi G., Ndungu P.G. Detection and quantification of acidic drug residues in South African surface water using gas chromatography-mass spectrometry // Chemosphere. 2017. V. 168. P. 1042–1050.
Hata T., Kawai S., Okamura H., Nishida T. Removal of diclofenac and mefenamic acid by the white rot fungus Phanerochaete sordida YK-624 and identification of their metabolites after fungal transformation // Biodegradation. 2010. V. 21. P. 681–689.
He Y., Langenhoff A.A.M., Comans R.N.J., Sutton N.B., Rijnaarts H.H.M. Effects of dissolved organic matter and nitrification on biodegradation of pharmaceuticals in aerobic enrichment cultures // Sci. Total Environ. 2018. V. 630. P. 1335–1342.
HELCOM. BASE project 2012-2014: Pilot activity to identify sources and flow patterns of pharmaceuticals in St. Petersburg to the Baltic Sea. 2014. 54 p.
Hignite C., Azarnoff D.L. Drugs and drug metabolites as environmental contaminants: Chlorophenoxyisobutyrate and salicylic acid in sewage water effluent // Life Sci. 1977. V. 20. P. 337–341.
Ikkere L.E., Perkons I., Sire J., Pugajeva I., Bartkevics V. Occurrence of polybrominated diphenyl ethers, perfluorinated compounds, and nonsteroidal anti-inflammatory drugs in freshwater mussels from Latvia // Chemosphere. 2018. V. 213. P. 507–516.
Ismail M.M., Essam T.M., Ragab Y.M., Mourad F.E. Biodegradation of ketoprofen using a microalgal–bacterial consortium // Biotechnol. Lett. 2016. V. 38. P. 1493–1502.
Ivshina I.B., Vikhareva E.V, Richkova M.I., Mukhutdinova A.N., Karpenko J.N. Biodegradation of drotaverine hydrochloride by free and immobilized cells of Rhodococcus rhodochrous IEGM 608 // World J. Microbiol. Biotechnol. 2012. V. 28. P. 2997–3006.
Ivshina I.B., Mukhutdinova A.N., Tyumina H.A., Vikhareva H.V., Suzina N.E., El’-Registan G.I., Mulyukin A.L. Drotaverine hydrochloride degradation using cyst-like dormant cells of Rhodococcus ruber // Curr. Microbiol. 2015. V. 70. P. 307–314.
Ivshina I.B., Tyumina E.A., Vikhareva E.V. Biodegradation of emerging pollutants: focus on pharmaceuticals // Microbiol. Australia. 2018. V. 39. P. 117–122.
Ivshina I.B., Tyumina E.A., Kuzmina M.V., Vikhareva E.V. Features of diclofenac biodegradation by Rhodococcus ruber IEGM 346 // Sci. Rep. 2019. V. 9. Article 9159. https://doi.org/10.1038/s41598-019-45732-9
Jewell K.S., Falås P., Wick A., Joss A., Ternes T.A. Transformation of diclofenac in hybrid biofilm–activated sludge processes // Water Res. 2016. V. 105. P. 559–567.
Jiang C., Geng J., Hu H., Ma H., Gao X., Ren H. Impact of selected non-steroidal anti-inflammatory pharmaceuticals on microbial community assembly and activity in sequencing batch reactors // PLoS One. 2017. V. 12. Article e0179236. https://doi.org/10.1371/journal.pone.0179236
Kot-Wasik A., Jakimska A., Śliwka-Kaszyńska M. Occurrence and seasonal variations of 25 pharmaceutical residues in wastewater and drinking water treatment plants // Environ. Monit. Assess. 2016. V. 188. Article 661. https://doi.org/10.1007/s10661-016-5637-0
Koumaki E., Mamais D., Noutsopoulos C. Environmental fate of non-steroidal anti-inflammatory drugs in river water/sediment systems // J. Hazard. Mater. 2017. V. 323. P. 233–241.
Kwak K., Ji K., Kho Y., Kim P., Lee J., Ryu J., Choi K. Chronic toxicity and endocrine disruption of naproxen in freshwater waterfleas and fish, and steroidogenic alteration using H295R cell assay // Chemosphere. 2018. V. 204. P. 156–162.
Langenhoff A., Inderfurth N., Veuskens T., Schraa G., Blokland M., Kujawa-Roeleveld K., Rijnaarts H. Microbial removal of the pharmaceutical compounds ibuprofen and diclofenac from wastewater // Biomed. Res. Int. 2013. V. 2013. Article 325806.https://doi.org/10.1155/2013/325806
Liu W., Sutton N.B., Rijnaarts H.H.M., Langenhoff A.A.M. Anaerobic biodegradation of pharmaceutical compounds coupled to dissimilatory manganese (IV) or iron (III) reduction // J. Hazard. Mater. 2018. https://doi.org/10.1016/j.jhazmat.2018.04.078
Liu Y., Wang L., Pan B., Wang C., Bao S., Nie X. Toxic effects of diclofenac on life history parameters and the expression of detoxification-related genes in Daphnia magna // Aquat. Toxicol. 2017. V. 183. P. 104–113.
Marchlewicz A., Domaradzka D., Guzik U., Wojcieszyńska D. Bacillus thuringiensis B1(2015b) is a Gram-positive bacteria able to degrade naproxen and ibuprofen // Water. Air. Soil Pollut. 2016. V. 227. Article 197. https://doi.org/10.1007/s11270-016-2893-0
Marchlewicz A., Guzik U., Hupert-Kocurek K., Nowak A., Wilczyńska S., Wojcieszyńska D. Toxicity and biodegradation of ibuprofen by Bacillus thuringiensis B1 (2015b) // Environ. Sci. Pollut. Res. 2017a. V. 24. P. 7572–7584.
Marchlewicz A., Guzik U., Smułek W., Wojcieszyńska D. Exploring the degradation of ibuprofen by Bacillus thuringiensis B1(2015b): The new pathway and factors affecting degradation // Molecules. 2017b. V. 22. Article E1676. https://doi.org/10.3390/molecules22101676
Marco-Urrea E., Pérez-Trujillo M., Blánquez P., Vicent T., Caminal G. Biodegradation of the analgesic naproxen by Trametes versicolor and identification of intermediates using HPLC-DAD-MS and NMR // Bioresour. Technol. 2010a. V. 101. P. 2159–2166.
Marco-Urrea E., Pérez-Trujillo M., Cruz-Morató C., Caminal G., Vicent T. Degradation of the drug sodium diclofenac by Trametes versicolor pellets and identification of some intermediates by NMR // J. Hazard. Mater. 2010b. V. 176. P. 836–842.
Marco-Urrea E., Pérez-Trujillo M., Cruz-Morató C., Caminal G., Vicent T. White-rot fungus-mediated degradation of the analgesic ketoprofen and identification of intermediates by HPLC-DAD-MS and NMR // Chemosphere. 2010c. V. 78. P. 474–481.
Mezzelani M., Gorbi S., Fattorini D., D’Errico G., Consolandi G., Milan M., Bargelloni L., Regoli F. Long-term exposure of Mytilus galloprovincialis to diclofenac, ibuprofen and ketoprofen: Insights into bioavailability, biomarkers and transcriptomic changes // Chemosphere. 2018. V. 198. P. 238–248.
Moreira I.S., Bessa V.S., Murgolo S., Piccirillo C., Mascolo G., Castro P.M.L. Biodegradation of diclofenac by the bacterial strain Labrys portucalensis F11 // Ecotoxicol. Environ. Saf. 2018. V. 152. P. 104–113.
Murdoch R.W., Hay A.G. The biotransformation of ibuprofen to trihydroxyibuprofen in activated sludge and by Variovorax Ibu-1 // Biodegradation. 2015. V. 26. P. 105–113.
Nguyen L.N., Nghiem L.D., Kumar Pramanik B., Oh S. Cometabolic biotransformation and impacts of the anti-inflammatory drug diclofenac on activated sludge microbial communities // Sci. Total Environ. 2019. V. 657. P. 739–745.
Nieto E., Hampel M., González-Ortegón E., Drake P., Blasco J. Influence of temperature on toxicity of single pharmaceuticals and mixtures, in the crustacean A. desmarestii // J. Hazard. Mater. 2016. V. 313. P. 159–169.
Novoa-Luna K.A., Romero-Romero R., Natividad-Rangel R., Galar-Martínez M., SanJuan-Reyes N., García-Medina S., Martínez-Vieyra C., Neri-Cruz N., Gómez-Oliván L.M. Oxidative stress induced in Hyalella azteca by an effluent from a NSAID-manufacturing plant in Mexico // Ecotoxicology. 2016. V. 25. P. 1288–1304.
Olicón-Hernández D.R., Camacho-Morales R.L., Pozo C., González-López J., Aranda E. Evaluation of diclofenac biodegradation by the ascomycete fungus Penicillium oxalicum at flask and bench bioreactor scales // Sci. Total Environ. 2019. V. 662. P. 607–614.
Palli L., Castellet-Rovira F., Pérez-Trujillo M., Caniani D., Sarrà-Adroguer M., Gori R. Preliminary evaluation of Pleurotus ostreatus for the removal of selected pharmaceuticals from hospital wastewater // Biotechnol. Prog. 2017. V. 33. P. 1529–1537.
Palyzová A., Zahradník J., Marešová H., Řezanka T. Characterization of the catabolic pathway of diclofenac in Raoultella sp. KDF8 // Int. Biodeterior. Biodegrad. 2019. V. 137. P. 88–94.
Park J., Yamashita N., Wu G., Tanaka H. Removal of pharmaceuticals and personal care products by ammonia oxidizing bacteria acclimated in a membrane bioreactor: Contributions of cometabolism and endogenous respiration // Sci. Total Environ. 2017. V. 605–606. P. 18–25.
Parolini M., Binelli A., Provini A. Chronic effects induced by ibuprofen on the freshwater bivalve Dreissena polymorpha // Ecotoxicol. Environ. Saf. 2011. V. 74. P. 1586–1594.
Passananti M., Lavorgna M., Iesce M.R., DellaGreca M., Brigante M., Criscuolo E., Cermola F., Isidori M. Photochemical fate and eco-genotoxicity assessment of the drug etodolac // Sci. Total Environ. 2015. V. 518–519. P. 258–265.
Pi N., Ng J.Z., Kelly B.C. Bioaccumulation of pharmaceutically active compounds and endocrine disrupting chemicals in aquatic macrophytes: Results of hydroponic experiments with Echinodorus horemanii and Eichhornia crassipes // Sci. Total Environ. 2017. V. 601–602. P. 812–820.
Pino M.R., Val J., Mainar A.M., Zuriaga E., Español C., Langa E. Acute toxicological effects on the earthworm Eisenia fetida of 18 common pharmaceuticals in artificial soil // Sci. Total Environ. 2015. V. 518–519. P. 225–237.
Pino-Otín M.R., Muñiz S., Val J., Navarro E. Effects of 18 pharmaceuticals on the physiological diversity of edaphic microorganisms // Sci. Total Environ. 2017. V. 595. P. 441–450.
Richards N.L., Cook G., Simpson V., Hall S., Harrison N., Scott K.S. Qualitative detection of the NSAIDs diclofenac and ibuprofen in the hair of Eurasian otters (Lutra lutra) occupying UK waterways with GC-MS // Eur. J. Wildl. Res. 2011. V. 57. P. 1107–1114.
Richmond E.K., Rosi E.J., Walters D.M., Fick J., Hamilton S.K., Brodin T., Sundelin A., Grace M.R. A diverse suite of pharmaceuticals contaminates stream and riparian food webs // Nat. Commun. 2018. V. 9. Article 4491. https://doi.org/10.1038/s41467-018-06822-w
Rodarte-Morales A.I., Moreira M.T., Feijoo G., Lema J.M. Evaluation of two fungal strains for the degradation of pharmaceutical and personal care products (PPCPs) // Chem. Eng. Trans. 2010. V. 20. P. 31–36.
Salgado R., Brito D., Noronha J.P., Almeida B., Bronze M.R., Oehmen A., Carvalho G., Barreto Crespo M.T. Metabolite identification of ibuprofen biodegradation by Patulibacter medicamentivorans under aerobic conditions // Environ. Technol. 2018. P. 1–16.
Schwarz S., Schmieg H., Scheurer M., Köhler H.R., Triebskorn R. Impact of the NSAID diclofenac on survival, development, behaviour and health of embryonic and juvenile stages of brown trout, Salmo trutta f. fario // Sci. Total Environ. 2017. V. 607–608. P. 1026–1036.
Selderslaghs I.W.T., Blust R., Witters H.E. Feasibility study of the zebrafish assay as an alternative method to screen for developmental toxicity and embryotoxicity using a training set of 27 compounds // Reprod. Toxicol. 2012. V. 33. P. 142–154.
Sim W.-J., Lee J.-W., Lee E.-S., Shin S.-K., Hwang S.-R., Oh J.-E. Occurrence and distribution of pharmaceuticals in wastewater from households, livestock farms, hospitals and pharmaceutical manufactures // Chemosphere. 2011. V. 82. P. 179–186.
Spongberg A.L., Witter J.D., Acuña J., Vargas J., Murillo M., Umaña G., Gómez E., Perez G. Reconnaissance of selected PPCP compounds in Costa Rican surface waters // Water Res. 2011. V. 45. P. 6709–6717.
Stenholm Å., Hedeland M., Arvidsson T., Pettersson C.E. Removal of diclofenac from a non-sterile aqueous system using Trametes versicolor with an emphasis on adsorption and biodegradation mechanisms // Environ. Technol. 2019. V. 40. P. 2460–2472.
Stylianou K., Hapeshi E., Vasquez M.I., Fatta-Kassinos D., Vyrides I. Diclofenac biodegradation by newly isolated Klebsiella sp. KSC: Microbial intermediates and ecotoxicological assessment // J. Environ. Chem. Eng. 2018. V. 6. P. 3242–3248.
Swan G.E., Cuthbert R., Quevedo M., Green R.E., Pain D.J., Bartels P., Cunningham A.A., Duncan N., Meharg A.A., Oaks J.L., Parry-Jones J., Shultz S., Taggart M.A., Verdoorn G., Wolter K. Toxicity of diclofenac to Gyps vultures // Biol. Lett. 2006. V. 2. P. 279–282.
Thelusmond J.R., Kawka E., Strathmann T.J., Cupples A.M. Diclofenac, carbamazepine and triclocarban biodegradation in agricultural soils and the microorganisms and metabolic pathways affected // Sci. Total Environ. 2018. V. 640–641. P. 1393–1410.
Tong A.Z., Ghoshdastidar A.J., Fox S. The presence of the top prescribed pharmaceuticals in treated sewage effluents and receiving waters in southwest Nova Scotia, Canada // Environ. Sci. Pollut. Res. 2015. V. 22. P. 689–700.
Torán J., Blánquez P., Caminal G. Comparison between several reactors with Trametes versicolor immobilized on lignocellulosic support for the continuous treatments of hospital wastewater // Bioresour. Technol. 2017. V. 243. P. 966–974.
Toušová Z., Vrana B., Smutná M., Novák J., Klučárová V., Grabic R., Slobodník J., Giesy J.P., Hilscherová K. Analytical and bioanalytical assessments of organic micropollutants in the Bosna River using a combination of passive sampling, bioassays and multi-residue analysis // Sci. Total Environ. 2019. V. 650. P. 1599–1612.
Tyumina E.A., Bazhutin G.A., Vikhareva E.V., Selyaninov A.A., Ivshina I.B. Diclofenac as a factor in the change of Rhodococcus metabolism // IOP Conf. Ser. Mat. Sci. 2019. V. 487. Article 012027. https://doi.org/10.1088/1757-899X/487/1/012027
UNESCO, HELCOM. Pharmaceuticals in the aquatic environment of the Baltic Sea region – A status report. UNESCO Emerging Pollutants in Water Series. Paris: UNESCO Publishing, 2017. 120 p.
Velázquez Y.F., Nacheva P.M. Biodegradability of fluoxetine, mefenamic acid, and metoprolol using different microbial consortiums // Environ. Sci. Pollut. Res. 2017. V. 24. P. 6779–6793.
Vieno N., Sillanpää M. Fate of diclofenac in municipal wastewater treatment plant – A review // Environ. Int. 2014. V. 69. P. 28–39.
Węgrzyn A., Felis E. Isolation of bacterial endophytes from Phalaris arundinacea and their potential in diclofenac and sulfamethoxazole degradation // Polish J. Microbiol. 2018. V. 67. P. 321–331.
Wojcieszyńska D., Domaradzka D., Hupert-Kocurek K., Guzik U. Bacterial degradation of naproxen – Undisclosed pollutant in the environment // J. Environ. Manage. 2014. V. 145. P. 157–161.
Wojcieszyńska D., Domaradzka D., Hupert-Kocurek K., Guzik U. Enzymes involved in naproxen degradation by Planococcus sp. S5 // Polish J. Microbiol. 2016. V. 65. P. 177–182.
Wolfson S.J., Porter A.W., Campbell J.K., Young L.Y. Naproxen is transformed via acetogenesis and syntrophic acetate oxidation by a methanogenic wastewater consortium // Microb. Ecol. 2018. V. 76. P. 362–371.
Yang L., He J.T., Su S.H., Cui Y.F., Huang D.L., Wang G.C. Occurrence, distribution, and attenuation of pharmaceuticals and personal care products in the riverside groundwater of the Beiyun River of Beijing, China // Environ. Sci. Pollut. Res. 2017. V. 24. P. 15838–15851.
Дополнительные материалы
- скачать Tyumina.docx
- Дополнительные материалы


