Микробиология, 2020, T. 89, № 3, стр. 290-299
Сборка светособирающих комплексов LH2 Thiorhodospira sibirica с разным уровнем содержания каротиноидов
М. А. Большаков a, *, А. А. Ашихмин a, З. К. Махнева a, А. А. Москаленко a
a Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение Федерального исследовательского центра “Пущинский научный центр биологических исследований
Российской академии наук”
142290 Московская обл., Пущино, Россия
* E-mail: lfbv22@gmail.com
Поступила в редакцию 05.12.2019
После доработки 24.12.2019
Принята к публикации 25.01.2020
Аннотация
В фотосинтетических мембранах Thiorhodospira (T.) sibirica, независимо от условий культивирования, всегда собираются два типа комплекса LH2: коротковолновый B800–830 и длинноволновый B800–850. В данной работе изучено влияние качественного и количественного содержания каротиноидов на сборку этих комплексов. Для уменьшения количества каротиноидов в фотосинтетических мембранах и комплексах использовали ингибитор каротиноидгенеза – дифениламин (ДФА). В клетках T. sibirica А12 ингибирование каротиноидгенеза варьировало в пределах 40–50%. Только один раз удалось полностью подавить биосинтез каротиноидов, при этом у ДФА-комплексов LH2 изменился спектр поглощения, уменьшилась стабильность структуры, и они легко разрушались в процессе выделения. Действие ДФА на клетки T. sibirica Kir-3 было более эффективно: из клеток этого штамма были выделены комплексы В800–850 и В800–830, содержание каротиноидов в которых было снижено до 80, 50 и 10%. Их спектральные характеристики в ближней ИК-области не зависели от количества каротиноидов в комплексах и были аналогичны нативным комплексам дикого типа. С увеличением концентрации ДФА в среде культивирования, одновременно с общим уменьшением содержания каротиноидов, в комплексах появлялись каротиноиды из более ранних этапов биосинтеза, такие как нейроспорин, ζ-каротин и их гидрокси-производные. Показано, что эффективность передачи энергии от каротиноидов к бактериохлорофиллу во всех комплексах LH2 не зависела от состава и количества каротиноидов в образцах и составляла около 40%. Поскольку комплекс LH2 типа В800–850 в ближней ИК-области аналогичен по спектральным характеристикам комплексам В800–850 из Rhodospirillum molischianum, основу структуры которых составляют 8 пар α/β-гетеродимеров, то можно предположить, что структура изучаемого комплекса В800–850 из T. sibirica также состоит из 8 пар α/β-гетеродимеров. Известно, что на один α/β-гетеродимер приходится только одна молекула каротиноида, следовательно, на один комплекс LH2 из T. sibirica с 10% содержанием каротиноидов в среднем приходится менее одной (8 × 0.1 = 0.8) молекулы каротиноида. Это означает, что в популяции комплексов LH2 есть как бескаротиноидные комплексы LH2, так и комплексы, содержащие одну или более молекул каротиноидов. Очевидно, что комплексы LH2 обоих типов собираются независимо от количества каротиноидов на один комплекс, и каротиноиды не являются обязательным компонентом для их корректной сборки in vivo.
Начальный этап фотосинтеза – поглощение фотона солнечного света у фотосинтезирующих бактерий – происходит в так называемой антенне, которая у пурпурных бактерий состоит из пигмент-белковых комплексов: прицентрового (LH1) и периферийного (LH2) (Cogdell et al., 2006; Gabrielsen et al., 2009). Наиболее часто у бактерий присутствует комплекс LH2 типа В800–850, но кроме него в мембранах могут также собираться более коротковолновые комплексы LH2: В800–840, В800–830 и В800–820 – у бактерий Allochromatium (Alc.) vinosum, Rhodopseudomonas palustris и Thiorhodospira (T.) sibirica (Carey et al., 2014; Muzziottia et al., 2017). У пурпурных несерных бактерий для комплекса LH2 типа В800–850 определена пространственная структура с высоким разрешением (McDermott et al., 1995; Koepke et al., 1996; Prince et al., 2003). Установлено, что он представляет собой цилиндр, который построен из 8 (Rhodospirillum (Rs.) molischianum) или 9 (Rhodoblastus (Rbl.) acidophilus) пар α- и β-полипептидов (Koepke et al., 1996; Prince et al., 2003). В комплексе В800–850 из Rbl. acidophilus молекулы бактериохлорофилла (БХл) формируют два кольца, которые называют по полосам поглощения БХл в ближней ИК-области (БХл800 и БХл850). Кольцо БХл800 этого комплекса состоит из 9 молекул БХл, плоскости порфириновых колец которых располагаются параллельно плоскости мембраны. Кольцо БХл850 состоит из 18 молекул БХл, и плоскости порфириновых колец этих молекул БХл располагаются перпендикулярно плоскости мембраны (Papiz et al., 2003; Cogdell et al., 2006). Комплексы серных бактерий изучены хуже, и только для комплекса LH2 из Ectothiorhodospira (Ect.) haloalkaliphila были получены кристаллы, которые позволили установить его структуру с разрешением 3.7 Å (Leiger et al., 2019). Показано, что структура этих комплексов LH2, также, как и у несерных бактерий, построена из восьми α/β-гетеродимеров, которые связывают 3 молекулы БХл и одну молекулу каротиноида. Подобие основных структурных элементов комплексов LH2 у серных и несерных бактерий находит дополнительное подтверждение в схожести их спектральных и биохимических характеристик.
Более коротковолновые типы комплексов LH2 (В800–840, В800–830 и В800–820) могут собираться в фотосинтетической мембране в зависимости от условий культивирования. В клетках штаммов Alc. vinosum ATCC 17899 и D при освещении ≥1200 лк и в присутствии сульфида натрия собираются преимущественно комплексы В800–850, а в присутствии тиосульфата натрия и освещении ≤500 лк – комплексы В800–820 и В800–840 (Большаков и соавт., 2016; Carey et al., 2014). Причиной сдвига длинноволнового максимума полосы поглощения БХл в периферийных комплексах является гетерогенный (неоднородный) пептидный состав этих комплексов. Было показано, что в клетках Alc. vinosum D присутствуют шесть pucB и A генов, которые кодируют 6 разных α- и β-полипептидов (Carey et al., 2014). В комплексе B800–850 на α1 приходится около половины присутствующих α-полипептидов, а α2 и α3 составляют остальную часть. Состав β-полипептидов в этом комплексе примерно одинаков. В комплексе B800–820 полипептиды α5 и α6 являются основными компонентами и присутствуют в одинаковых пропорциях (30–40%), тогда как β5 составляет около половины всех β-полипептидов. В комплексе LH2 типа B800–840 основными α-полипептидами являются α1 и α2, а основным β-полипептидом является β5 (Carey et al., 2014). В результате взаимодействия молекул БХл850 с аминокислотами разных α- и β-полипептидов происходит изменение угла наклона плоскости порфиринового кольца БХл850, что в свою очередь и приводит к смещению максимума БХл850 в коротковолновую область. Поскольку на положение длинноволнового максимума БХл в комплексах LH2 влияет только угол наклона плоскости порфиринового кольца молекул БХл (Razjivin et al., 2000; Niedzwiedzki et al., 2012; Löhner et al., 2015), то, с высокой долей вероятности, можно утверждать, что разные типы комплексов LH2 из одной бактерии сформированы одинаковым количеством α/β-гетеродимеров.
Отметим, что T. sibirica Kir-3 не реагирует изменением спектральных характеристик при модификации состава среды культивирования или условий освещения. В ее клетках всегда присутствуют два типа комплексов LH2: коротковолновый B800–830 и длинноволновый B800–850. Поэтому можно предположить, что у T. sibirica Kir-3 отсутствует светоиндуцированный синтез разных типов α- и β-полипептидов. Вероятно, что эти пептиды синтезируются независимо от интенсивности света и состава среды, что и приводит к сборке сразу двух типов комплексов LH2 (B800–830 и B800–850). Ранее в работе Разживина и соавт. (2007) было высказано предположение, что эти комплексы образуют прочную связь типа B800–830–850, однако в настоящей работе показано, что комплексы B800–830 и B800–850 хорошо разделяются хроматографическими методами на два отдельных комплекса.
Основными пигментами у фотосинтезирующих бактерий является БХл, а вспомогательными – каротиноиды. Молекула каротиноида располагается в пространстве между α- и β-полипептидами в так называемом “гидрофобном кармане”. Ее полиеновая цепь контактирует, как минимум, с 15 аминокислотами α/β гетеродимера, в результате приобретая изогнутую S-конформацию (Cogdell et al., 2006).
Каротиноиды присутствуют в мембранах всех фотосинтезирующих организмов, выполняя несколько функций в процессе фотосинтеза: светособирающую, структурную, защитную и т.д. (Griffiths et al., 1955; Glaeser, Klug 2005; Telfer et al., 2008; Gabrielsen et al., 2009). Для изучения различных аспектов функционирования каротиноидов в бактериальных антенных комплексах необходимо сравнивать свойства этих объектов с каротиноидами и без них. Имеется много данных о том, что комплексы LH2 типа В800–850 у бескаротиноидных мутантов несерных бактерий не собираются, и на этом основании был сделан вывод, что каротиноиды необходимы для сборки этих комплексов (Jones et al., 1992; Lang et al., 1994, 1995; Chi et al., 2014). У серных бактерий ситуация несколько иная, и с помощью ингибирования биосинтеза каротиноидов дифениламином (ДФА) можно получить практически бескаротиноидные клетки с нормальным набором пигмент-белковых комплексов с нативными спектральными характеристиками. К настоящему времени такие клетки были получены для штаммов двух видов серных бактерий: Alc. vinosum МГУ (старое название Allochromatium minutissimum) и Ect. haloalkaliphila (Москаленко и соавт., 1991; Makhneva et al., 2008; Большаков, 2012; Ashikhmin et al., 2014). К сожалению, использование ДФА имеет ограничения и подходит не для всех видов серных бактерий. Поэтому поиск серных бактерий, у которых можно полностью ингибировать биосинтез каротиноидов, является важной задачей. Изучение структурных и физико-химических свойств бескаротиноидных пигмент-белковых комплексов позволит уточнить свойства и механизмы функционирования этих пигментов и лучше понять механизм сборки этих комплексов in vivo.
В настоящей работе представлены данные по ингибированию биосинтеза каротиноидов в клетках T. sibirica и выделению из них комплексов LH2 (В800–830 и В800–850) с разным качественным и количественным содержанием каротиноидов и изучению их свойств.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и условия культивирования. Клетки штаммов T. sibirica А12 и Kir-3 выращивали на модифицированной среде Ормерода (около 2000 лк; 27–30°C), их использовали сразу или хранили при –20°С (Ormerod et al., 1961). В качестве источника света использовали лампы накаливания мощностью 75 Вт. Клетки собирали в стационарной фазе роста (4–6 сут). Для ингибирования биосинтеза каротиноидов использовали разные концентрации ДФА: 18, 36, 53 и 71 мкМ.
Для выделения пигмент-содержащих мембран клетки ресуспендировали в 50 мМ трис-HCl буфере (рН 8.0) и разрушали на ультразвуковом дезинтеграторе УЗД2-0.1-22 (22 кГц, дважды по 60 с). Мембраны выделяли методом дифференциального центрифугирования, как описано в работе (Moskalenko et al., 2005). Поскольку комплексы В800–830 и В800–850 имеют близкую электрофоретическую подвижность и, следовательно, их нельзя разделить методом электрофореза, то для их выделения использовали хроматографию на колонке с DEAE-TOYOPEARL 650 S в градиенте концентрации NaCl (Большаков и соавт., 2016). Выделенные мембраны и комплексы хранили при температуре –18°С.
Анализ каротиноидов проводили методом ВЭ-ЖХ (Ashikhmin et al., 2014) на колонке Spherisorb ODS2, 5 мкм (“Waters”, США). Для разделения смеси пигментов использовали следующие растворы: Раствор “А”: 23% этилацетат и 77% раствора “С”. Раствор “B”: чистый этилацетат. Раствор “С”: 90% ацетонитрила и 10% воды. Концентрацию каротиноидов рассчитывали согласно коэффициентам экстинкции (Gall et al., 2005) и площадей полос поглощения в области 360–550 нм с помощью программы LC-solution (“Shimadzu”, Япония).
Методы спектроскопии. Спектры поглощения клеток пурпурных бактерий, выделенных из них хроматофоров и пигмент-белковых комплексов регистрировали при комнатной температуре на спектрофотометре Cary 50 (“Varian”, Австралия), спектры флуоресценции (800–870 нм) и возбуждения флуоресценции (область возбуждения 300–650 нм) – на модифицированном спектрофлуориметре Cary Eclips (“Varian”, Австралия), спектры кругового дихроизма – на спектрополяриметре JASCO – 600 (Япония) в диапазонах длин волн от 230 до 600 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе работа проводилась на образцах из штамма T. sibirica A12. Их спектры поглощения представлены на рис. 1. В спектре поглощения мембран T. sibirica, в отличие от других серных и несерных бактерий, присутствуют четыре Qy-перехода БХл в ближней ИК-области с максимумами при 800, 830, 850 и 895 нм, характерные для комплексов LH2 (В800–830 и В800–850) и ансамбля LH1–RC (В890) соответственно (рис. 1а, спектр 1). Из этих мембран выделены оба типа комплексов LH2 (В800–830 и В800–850; результаты не показаны). Однако в присутствии 71 мкМ ДФА добиться активного роста культуры в серии проведенных опытов удалось только один раз (рис. 1а, спектр 2). В данной мембране практически полностью отсутствовали окрашенные каротиноиды (область 420–550 нм). Используя стандартную методику электрофореза, была выделена смесь ДФА-комплексов LH2, однако разделить ДФА-комплексы В800–850 и В800–830 не удалось (рис. 1а, спектр 3). Выделенные ДФА-комплексы спектрально отличались от нативных: практически полностью отсутствовала полоса БХл при 850 нм, а полоса при 800 нм сместилась в более коротковолновую область. Используя метод хроматографии, выделить из ДФА-мембран комплексы LH2 также не удалось, так как они быстро окислялись (разрушались). Поскольку рост T. sibirica A12T в присутствии ДФА был сложно прогнозируемым, то воспроизвести эти результаты не удалось, и поэтому дальнейшая работа была проведена на клетках T. sibirica Kir-3.
Рис. 1.
Спектры поглощения контрольной мембраны (1), ДФА-мембраны (2) и смеси ДФА-комплексов LH2 (3) из T. sibirica штамм A12 (а); контрольной мембраны (1) и ДФА-мембраны (2) из T. sibirica штамм Kir-3 (б).
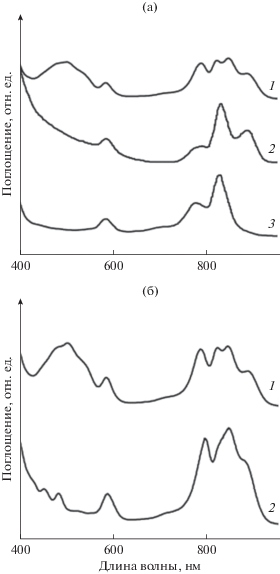
Спектры поглощения фотосинтетических мембран у обоих штаммов T. sibirica были похожи (рис. 1а и 1б). Из этих мембран были выделены два типа комплексов LH2 и LH1–RC. В ближней ИК-области спектра комплексы LH2 имеют две Qy полосы поглощения. У комплекса В800–850 они локализованы при 790 и 852 нм, а у комплекса В800–830 при 793 и 826 нм (рис. 2). Комплекс LH1 имеет один Qy переход при 894 нм, а полосы поглощения РЦ, локализованные при 890, 800 и 756 нм, маскируются полосами поглощения светособирающих комплексов (рис. 2). Комплекс В800–850 в ближней ИК-области аналогичен по спектральным характеристикам комплексам В800–850 из Rs. molischianum, основу структуры которых составляют 8 пар α/β-гетеродимеров (Koepke et al., 1996). Можно предположить, что структура изучаемого комплекса В800–850 также состоит из 8 пар α/β-гетеродимеров.
Рис. 2.
Спектры поглощения пигмент-белковых комплексов В800–850 (1), В800–830 (2) и В890/LH1–RC (3), выделенных из T. sibirica Kir-3. На вставке показаны спектры поглощения ДФА-комплексов В800–850 (а) и В800–830 (б), выделенных из контрольных клеток (1) и выращенных в присутствии 12 (2), 36 (3) и 53 (4) мкМ ДФА. Спектры нормированы по Qx полосе БХл (590 нм).
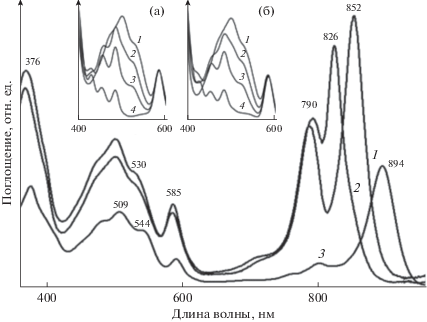
Спектры поглощения обоих комплексов LH2 совпадают в каротиноидной области (420–550 нм) по положению и интенсивности полос, что свидетельствует о близком составе каротиноидов (рис. 2). Это подтверждается данными ВЭ-ЖХ анализов (табл. 1). В обоих комплексах LH2 содержатся практически одинаковые количества родопина и дидегидрородопина. Небольшое отличие заключается в содержании спириллоксантина и ангидрородовибрина (табл. 1). В спектре поглощения комплекса LH1–RC более выражена полоса при 544 нм, что указывает на более высокое содержание спириллоксантина (рис. 2, табл. 1).
Таблица 1.
Каротиноидный состав (моль, %) комплексов B800–830 и B800–850, выделенных из клеток штамма T. sibirica Kir-3 и клеток, выращенных в присутствии 18, 36 и 53 мкМ ДФА
| Каротиноид | Контроль | 18 мкМ ДФА | 36 мкМ ДФА | 53 мкМ ДФА | |||||
|---|---|---|---|---|---|---|---|---|---|
| B800–850 | B800–830 | В800–890 | B800–850 | B800–830 | B800–850 | B800–830 | B800–850 | B800–830 | |
| ζ-Каротин | – | – | – | – | 3.4 | – | 3.3 | 2.9 | |
| ОН-ζ-каротин | – | – | – | – | – | – | 0.7 | 0.4 | |
| Нейроспорин | – | – | – | – | – | – | 0.6 | 0.5 | |
| ОН-нейроспорин | – | – | 9.4 | 14.0 | 29.2 | 22.3 | 4.1 | 3.0 | |
| Ликопин | – | – | 2.6 | 1.1 | 13.9 | 13.0 | Следы | Следы | |
| Родопин | 30.8 | 30.8 | 12.7 | 43.3 | 31.4 | 6.6 | 9.1 | 0.7 | 1.2 |
| Дидегидрородопин | 6.0 | 5.4 | 7.3 | 2.6 | – | – | – | Следы | Следы |
| Ангидрородовибрин | 58.4 | 53.5 | 29.4 | 21.0 | 21.7 | 1.9 | 5.6 | 0.6 | 1.8 |
| Спириллоксантин | 4.7 | 10.3 | 50.6 | 1.1 | 6.8 | Следы | Следы | Следы | 0.2 |
| СКК* | 0 | 0 | 20 | 25 | 45 | 50 | 90 | 90 | |
Обычно для выращивания бактерий Alc. vinosum МГУ и Ect. haloalkaliphila с полностью подавленным биосинтезом каротиноидов использовали 71 мкМ (12 мг/л) ДФА (Москаленко и соавт., 1991; Большаков, 2012; Makhneva et al., 2008; Ashikhmin et al., 2014). Однако при данной концентрации ДФА клетки T. sibirica не росли, поэтому мы провели скрининг разных концентраций ДФА. При снижении концентрации ингибитора до 35.5 и 17.75 мкМ были получены клетки с 50 и 80% содержанием каротиноидов соответственно. ДФА в концентрации 53.25 мкМ тормозил рост культуры, и ее выход на стационарную фазу был достигнут только к 16 сут культивирования, значительно позже чем в контроле (3–4 сут). По нашим расчетам общее содержание каротиноидов в мембранах из этих клеток (рис. 1б, спектр 2) не превышало 10%, по сравнению с контролем. Из всех ДФА-клеток были выделены фотосинтетические мембраны и светособирающие комплексы (рис. 2, вставка).
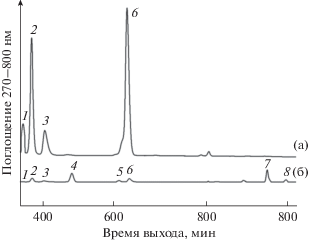
Был изучен каротиноидный состав всех комплексов методом ВЭЖХ (рис. 3). В ДФА-комплексах В800–850 и В800–830 c содержанием каротиноидов 75–80% снижалось содержание спириллоксантина, ангидрородовибрина и дидегидрородопина, при этом появлялись каротиноиды из более ранних этапов биосинтеза, которых нет в контрольных мембранах: ОН-нейроспорин и ликопин (табл. 1). В ДФА-комплексах c содержанием каротиноидов ~50% наблюдалось еще более заметное уменьшение содержания основных каротиноидов и увеличение содержания ликопина и ОН-нейроспорина (табл. 1). В комплексах с минимальным содержанием каротиноидов (~10%) количество родопина, дидегидрородопина и ангидрородовибрина не превышало 1–2%, а спириллоксантин присутствовал только в следовых количествах. Основными каротиноидами в этих образцах являлись промежуточные продукты работы фитоиндесатуразы: ζ-каротин, нейроспорин и их гидрокси-производные (табл. 1).
Рис. 3.
Часть ВЭЖХ хроматограммы комплексов В800–830 (а) и ДФА-В800–830 (б) из T. sibirica Kir-3. Идентификация пиков: 1 – дидегидрородопин, 2 – родопин, 3 – спириллоксантин, 4 – ОН-нейроспорин, 5 – ОН-ζ-каротин, 6 – ангидрородовибрин, 7 – нейроспорин, 8 – ζ-каротин. Хроматограмма записана при 270–800 нм.
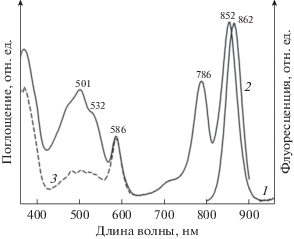
В комплексах В800–830 и В800–850 эффективность переноса энергии с каротиноидов на БХл составила порядка 40% (рис. 4). Даже при снижении содержания каротиноидов до 10% этот показатель не изменился и варьировал в пределах 2–3% (на рисунке не показано). Таким образом, изменение каротиноидного состава не влияло на эффективность передачи энергии на БХл, что согласуется с результатами более ранних работ в нашей лаборатории. При сравнении эффективности передачи энергии от каротиноидов на БХл во всех модифицированных комплексах LH2 из Alc. vinosum не было обнаружено прямой зависимости между уменьшением сопряженных двойных связей (СДС) у каротиноидов и увеличением эффективности этого процесса (Ашихмин и соавт., 2018).
Рис. 4.
Спектр поглощения комплекса B800–850, выделенного из клеток штамма T. sibirica Kir-3 дикого типа (1) и спектры флуоресценции (2) и возбуждения флуоресценции этого комплекса (3) – показан пунктиром.
Измерение сигнала кругового дихроизма (КД) в области 220–600 нм показало зависимость между содержанием каротиноидов в комплексах и интенсивностью сигнала КД этих пигментов. В контрольных комплексах В800–830 и В800–850 в спектрах КД отмечены положительные полосы с максимумами при 250, 340, 360, 385, 515 и 540 нм и отрицательные – с максимумами при 225, 315 и 465 нм (рис. 5). Форма КД-спектров комплексов В800–830 и В800–850 незначительно отличается, что указывает на сходное пространственное положение каротиноидов в этих комплексах. В ДФА комплексах в спектре КД отмечена тенденция к уменьшению как положительных, так и отрицательных сигналов, что коррелирует с уменьшением содержания каротиноидов.
Рис. 5.
Спектры КД комплексов В800–850 из T. sibirica Kir-3: контрольные (1), с 80% (2) и 40% (3) и 10% (4) содержанием каротиноидов.
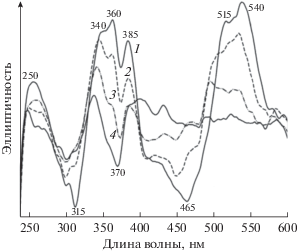
Отметим, что обычно при выходе культуры на стационарную фазу роста в комплексах накапливаются каротиноиды из финальных этапов биосинтеза, такие как спириллоксантин у Rhodospirillum rubrum и сфероиден/сфероиденон у Rhodobacter sphaeroides (Yeliseev et al., 1996). В случае T. sibirica на поздних этапах роста в комплексах LH2 присутствуют преимущественно родопин и ангидрородовибрин (суммарно более 80%), то есть промежуточные продукты биосинтеза каротиноидов, при этом содержание спириллоксантина не превышает 5–10%. Похожие данные были получены ранее для бактерий Ect. haloalkaliphila и Alc. vinosum ATCC 17899 (Ashikhmin et al., 2014; Большаков и соавт., 2016). Ранее мы условно разделили биосинтез каротиноидов у Alc. vinosum МГУ на две ветви с конечными продуктами родопином и спириллоксантином соответственно. Основанием для такого деления было высокое содержание родопина в комплексе LH2, а также встраивание лимитированных количеств спириллоксантина в комплекс LH2 (Большаков и соавт., 2017). На основании указанных результатов было предположено, что в мембранах Alc. vinosum МГУ присутствуют два типа комплексов LH2, один из которых связывает в основном родопин, а второй – спириллоксантин. Неясно, существует ли такая же тенденция в комплексах В800–850 и В800–830 из T. sibirica Kir-3, так как они содержат сравнительно мало родопина (30.8%) и много ангидрородовибрина (53.5–58.4%), который мы отнесли к спириллоксантиновой ветви биосинтеза. Возможно, что в эти комплексы можно легко встроить значительные количества спириллоксантина, но для этого нужны дополнительные эксперименты, что является целью дальнейшей работы.
У T. sibirica биосинтез каротиноидов протекает в несколько стадий. Сначала фитоиндесатураза последовательно проводит четыре реакции десатурации, превращая фитоин в фитофлуин, затем в ζ‑каротин, нейроспорин и, наконец, в ликопин. На втором этапе, на ликопин последовательно воздействуют ферменты гидратаза, десатураза и метилтрансфераза: ликопин → родопин → 3,4-дидегидрородопин → ангидрородовибрин → родовибрин → ОН-спириллоксантин → спириллоксантин. Промежуточные продукты работы фитоиндесатуразы (ζ-каротин и нейроспорин) никогда не обнаруживаются в нормальных клетках и мембранах и выявляются только при нарушении биосинтеза каротиноидов. По факту их можно рассматривать как каротиноиды-предшественники для ликопина. Появление их в ДФА-комплексах LH2 свидетельствует о частичном нарушении в работе фитоиндесатуразы под действием ингибитора ДФА. В результате образуются каротиноиды промежуточных стадий работы этого фермента. Опираясь на полученные в данной статье результаты и опыт предыдущих работ, можно утверждать, что ДФА действует как на фитоинсинтетазу, значительно снижая синтез предшественника С40 каротиноидов – фитоина, так и в значительной степени на фитоиндесатуразу, нарушая ее работу. Однако очевидно, что другие ферменты каротиноидгенеза (гидратаза, десатураза и метилтрансфераза) продолжают быть активными, и поэтому появляются продукты более поздних стадий биосинтеза (спириллоксантин, ангидрородовибрин, родопин) или новые – ОН-нейроспорин (табл. 1).
Известно, что в комплексах LH2 пурпурных бактерий один α/β-гетеродимер нековалентно связывает только одну молекулу каротиноида (Cogdell et al., 2006; Gabrielsen et al., 2009). Если предположить, что комплексы LH2 из T. sibirica состоят из 8 α/β-гетеродимеров, то они должны содержать и 8 молекул каротиноидов. Таким образом, 100 контрольных комплексов LH2 должны содержать 800 молекул каротиноидов. В ДФА-комплексах LH2 с максимальным ингибированием каротиноидгенеза (90% ингибирование) на 100 комплексов приходится 80 молекул каротиноидов. Следовательно, только 80 ДФА-LH2 комплексов из 100 могут содержать по одной молекуле каротиноида, а остальные 20 ДФА-LH2 комплексов – ни одной. Однако эти представления отражают среднее содержание каротиноидов на один комплекс. Ранее мы выявили гетерогенность по каротиноидному составу ДФА-комплексов LH2 в мембранах разных бактерий (Makhneva et al., 2008; Большаков и соавт., 2015). Было установлено, что в популяции ДФА-комплексов присутствуют более и менее термостабильные комплексы, и их термостабильность возрастает с увеличением количества каротиноидов на комплекс. Например, из ДФА-клеток Rbl. acidophilus были выделены комплексы ДФА-В800–850 с ~46% содержанием каротиноидов. Из этой фракции удалось выделить комплексы LH2 с содержанием каротиноидов около 90%, тогда как остальные комплексы LH2 с содержанием каротиноидов менее 1 молекулы на один комплекс были разрушены. Поэтому можно предположить, что в исследуемых ДФА-мембранах с 10% содержанием каротиноидов количество комплексов LH2 без каротиноидов превышает 10%.
Процесс сборки комплексов LH2 in vivo практически не изучен, однако известно, что при мутациях в генах СrtI и СrtB (фитоинсинтетаза и фитоиндесатураза) подобные комплексы в клетках несерных бактерий не собираются (Jones et al., 1992; Lang et al., 1994, 1995; Chi et al., 2014). В таких мутантах биосинтез каротиноидов работает по принципу “всe или ничего”: мутанты, нокаутированные по данному гену, сохраняют 100% синтез каротиноидов, предшествующих этому гену. Таким образом, у несерных бактерий существует простая взаимосвязь: есть 100% синтез каротиноидов – есть сборка комплексов LH2, нет синтеза каротиноидов – нет сборки комплексов LH2. В клетках, выращенных в присутствии ингибитора, состав каротиноидов и их количество в расчете на один комплекс изменяется в широких пределах (от 100 до 1–2%). Поэтому возникает вопрос: сколько каротиноидов нужно для сборки одного комплекса LH2 in vivo? Данные, полученные с ингибиторами каротиноидгенеза, показывают, что сборка комплекса LH2 у серных бактерий происходит независимо от биосинтеза каротиноидов, и комплексы у серных бактерий собираются в отсутствии каротиноидов. Фактически это означает, что каротиноиды не требуются для его сборки in vivo. Разница в конечном результате нокаутирования генов биосинтеза каротиноидов и действия ингибитора может быть связана с тем, что в первом случае выключается цепочка: ген (СrtI и СrtB) – фермент биосинтеза каротиноида – ансамбль ферментов этого биосинтеза – каротиноид. Во втором случае выключается только последнее звено этой цепочки, что позволяет нам сделать вполне обоснованное предположение об участии ансамбля ферментов биосинтеза каротиноидов в формировании места сборки комплексов типа LH2. Вопрос о механизме сборки комплексов LH2 in vivo в настоящее время остается открытым и требует дальнейших исследований. Однако уже сейчас ясно, что каротиноиды не являются обязательным компонентом для корректной сборки этих комплексов.
Список литературы
Ашихмин А.А., Махнева З.К., Большаков М.А., Москаленко А.А. Влияние количества сопряженных двойных связей в молекулах каротиноидов на эффективность переноса энергии на бактериохлорофилл в светособирающих комплексах LH2 из Allochromatium vinosum штамм МГУ // Докл. Академии наук. 2018. Т. 483. С. 332–336.
Ashikhmin A., Makhneva Z., Bolshakov M.A., Moskalenko A. The influence of the number of conjugated double bonds in carotenoid molecules on the energy transfer efficiency to bacteriochlorophyll in light-harvesting complexes LH2 from Allochromatium vinosum strain MSU // DAN. 2018. V. 483. P. 321–325.
Большаков М.А. Роль каротиноидов в процессе фотоокисления бактериохлорофилла in vivo: Автореф. дисс. … канд. биол. наук, 20.12.2012. Пущино: Институт фундаментальных проблем биологии РАН. 2012. 22 с.
Большаков М.А., Ашихмин А.А., Махнева З.К., Москаленко А.А. Периферийный светособирающий комплекс LH2 может собираться в клетках пурпурной несерной бактерии Rhodoblastus acidophilus без каротиноидов // Биохимия. 2015. Т. 80. С. 1420–1430.
Bolshakov M.A., Ashikhmin A.A., Makhneva Z.K., Moskalenko A.A. Peripheral light harvesting LH2 complex can be assembled in cells of nonsulfur purple bacterium Rhodoblastus acidophilus without carotenoids // Biochemistry (Moscow). 2015. V. 80. P. 1169–1177.
Большаков М.А., Ашихмин А.А., Махнева З.К., Москаленко А.А. Влияние интенсивности освещения и ингибирования биосинтеза каротиноидов на сборку периферийных светособирающих комплексов пурпурной серной бактерии Allochromatium vinosum ATCC 17899 // Микробиология. 2016. Т. 85. С. 403–414.
Bolshakov M.A., Ashikhmin A.A., Makhneva Z.K., Moskalenko A.A. Effect of illumination intensity and inhibition of carotenoid biosynthesis on assembly of peripheral light-harvesting complexes in purple sulfur bacteria Allochromatium vinosum ATCC 17899 // Microbiology (Moscow). 2016. V. 85. P. 420–429.
Большаков М.А., Ашихмин А.А., Махнева З.К., Москаленко А.А. Встраивание спириллоксантина в пигмент-белковые комплексы LH2 и LH1-RC пурпурной серной бактерии Allochromatium minutissimum // Микробиология. 2017. Т. 85. С. 538–550.
Bolshakov M.A., Ashikhmin A.A., Makhneva Z.K., Moskalenko A.A. Spirilloxanthin incorporation into the LH2 and LH1-RC pigment-protein complexes from a purple sulfur bacterium Allochromatium minutissimum // Microbiology (Moscow). 2017. V. 85. P. 403–414.
Москаленко А.А., Бриттон Ж., Коннор А., Йанг А., Торопыгина О.А. Содержание каротиноидов в хроматофорах и пигмент-белковых комплексах, выделенных из клеток Chromatium minutissimum // Биол. мембраны. 1991. Т. 8. С. 249–260.
Разживин А.П., Степаненко И.А., Козловский В.С., Компанец В.О., Чекалин С.В., Махнева 3.К., Москаленко А.А., Тихонов А.В., Попов В.О., Тихонова Т.В. Динамика возбуждений в прочно связанных ассоциатах комплексов В800–850 и В800–830 из фотосинтезирующей пурпурной бактерии Thiorhodospira sibirica // Биол. мембраны. 2007. Т. 24. С. 457–464.
Razjivin A.P., Stepanenko I.A., Kozlovsky V.S., Kompanets V.O., Chekalin S.V., Makhneva Z.K., Moskalenko A.A., Tikhonov A.V., Popov V.O., Tikhonova T.V. Excitation dynamics in strongly bounded associates of B800–850 and B800–830 complexes from photosynthetic purple bacterium Thiorhodospira sibirica // Biochemistry (Moscow). Suppl. Series A: Membrane and Cell Biology. 2007. V. 1. P. 336–342.
Ashikhmin A., Makhneva Z., Moskalenko A. The LH2 complexes are assembled in the cells of purple sulfur bacterium Ectothiorhodospira haloalkaliphila with inhibition of carotenoid biosynthesis // Photosynth. Res. 2014. V. 119. P. 291–303.
Carey A.M., Hacking K., Picken N., Honkanen S., Kelly S., Niedzwiedzki D.M., Blankenship R.E., Shimizu Y., Wang-Otomo Z.Y., Cogdell R.J. Characterisation of the LH2 spectral variants produced by the photosynthetic purple sulphur bacterium Allochromatium vinosum // Biochim. Biophys. Acta. 2014. V. 1837. P. 1849–1860.
Chi S.C., Mothersole D.J., Dilbeck P., Niedzwiedzki D.M., Zhang H., Qian P., Vasilev C., Grayson K.J., Jackson P.J., Martin E.C., Li Y., Holten D., Hunter C.N. Assembly of functional photosystem complexes in Rhodobacter sphaeroides incorporating carotenoids from the spirilloxanthin pathway // Biochim. Biophys. Acta. Bioenerg. 2015. V. 1847. P. 189–201.
Cogdell R.J., Gall A., Kohler J. The architecture and function of the light-harvesting apparatus of purple bacteria: from single molecules to in vivo membranes // Q. Rev. Biophys. 2006. V. 39. P. 227–324.
Gabrielsen M., Gardiner A.T., Cogdell R.J. Peripheral complexes of purple bacteria // The Purple Phototrophic Bacteria / Eds. Daldal F., Thurnauer M.C., Beatty J.T., Hunter C.N. New York: Springer, 2009. P. 135–153.
Gall A., Henry S., Takaichi S., Bruno R., Cogdell R.J. Preferential incorporation of colored-carotenoids occurs in the LH2 complexes from non-sulphur purple bacteria under carotenoid-limiting conditions // Photosynth. Res. 2005. V. 86. P. 25–35.
Glaeser J., Klug G. Photo-oxidative stress in Rhodobacter sphaeroides: protective role of carotenoids and expression of selected genes // Microbiology (SGM). 2005. V. 151. P. 1927–1938.
Griffiths M., Sistrom W.R. Cohen-Bazire G., Stanier R.Y. Function of carotenoids in photosynthesis // Nature. 1955. V. 196. P. 1211–1214.
Jones M.R., Fowler G.J., Gibson L.C., Grief G.G., Olsen J.D., Crielaard W., Hunter C.N. Mutants of Rhodobacter sphaeroides lacking one or more pigment-protein complexes and complementation with reaction-centre, LH1, and LH2 genes // Mol. Microbiol. 1992. V. 6. P. 1173–1184.
Koepke J., Hu X., Muenke C., Schulten K., Hartmut M. The crystal structure of the light-harvesting complex II (B800–850) from Rhodospirillum molischianum // Structure. 1996. V. 4. P. 581–597.
Lang H.P., Hunter C.N. The relationship between carotenoid biosynthesis and the assembly of the light-harvesting LH2 complex in Rhodobacter sphaeroides // Biochem. J. 1994. V. 298. P. 197–205.
Lang H.P., Cogdell R.G., Takaichi S., Hunter C.N. Complete DNA sequence, specific Tn5 insertion map, and gene assignment of the carotenoid biosynthesis pathway of Rhodobacter sphaeroides // J. Bacteriol. 1995. V. 177. P. 2064–2073.
Leiger K., Linnanto M.J., Ratsep M., Timpmann K., Ashikhmin A.A., Moskalenko A.A., Fufina N.Y., Gabdulkhakov A.G., Freiberg A. Controlling photosynthetic excitons by selective pigment photooxidation // J. Phys. Chem. 2019. V. 123. P. 29–38.
Löhner A., Carey A.M., Hacking K., Picken N., Kelly S., Cogdell R., Köhler J. The origin of the split B800 absorption peak in the LH2 complexes from Allochromatium vinosum // Photosynth. Res. 2015. V. 123. P. 23–31.
Makhneva Z., Bolshakov M., Moskalenko A. Heterogeneity of carotenoid content and composition in LH2 of the purple sulphur bacterium Allochromatium minutissimum grown under carotenoid-biosynthesis inhibition // Photosynth. Res. 2008. V. 98. P. 633–641.
McDermott G., Prince S., Freer A., Hawthornthwaite-Lawless A., Papiz M., Cogdell R.G., Isaacs N. Crystal structure of an integral membrane light-harvesting complex from photosynthetic bacteria // Nature. 1995. V. 374. P. 517–521.
Moskalenko A.A., Makhneva Z.K., Fiedor L., Scheer H. Effects of carotenoid inhibition on the photosynthetic RC–LH1 complex in purple sulphur bacterium Thiorhodospira sibirica // Photosynth. Res. 2005. V. 86. P. 71–80.
Muzziottia D., Adessiab A., Faralonic C., Torzilloc G., Philippisab R. Acclimation strategy of Rhodopseudomonas palustris to high light irradiance // Microbiol. Res. 2017. V. 197. P. 49–55.
Niedzwiedzki D.M., Bina D., Picken N., Honkanen S., Blankenship R.E., Holten D., Cogdell R.J. Spectroscopic studies of two spectral variants of light-harvesting complex 2 (LH2) from the photosynthetic purple sulfur bacterium Allochromatium vinosum // Biochim. Biophys. Acta. 2012. V. 1817. P. 1576–1587.
Ormerod J.G., Ormerod K.S., Gest H. Light-dependent utilization of organic compounds and photoproduction of molecular hydrogen by photosynthetic bacteria; relationships with nitrogen metabolism // Arch. Biochem. Biophys. 1961. V. 94. P. 449–463.
Papiz M.Z., Prince S.M., Howard T., Cogdell R.J., Isaacs N.W. The structure and thermal motion of the B800–850 LH2 complex from Rps. acidophila at 2.0 Å resolution and 100 K: new structural features and functionally relevant motions // J. Mol. Biol. 2003. V. 326. P. 1523–1538.
Prince S.M., Howard T.D., Myles D.A., Wilkinson C., Papiz M.Z., Freer A.A., Cogdell R.J., Isaacs N.W. Detergent structure in crystals of the integral membrane light-harvesting complex LH2 from Rhodopseudomonas acidophila strain 10050 // J. Mol. Biol. 2003. V. 326. P. 307–315.
Razjivin A.P., Moskalenko A.A., Novoderezhkin V.I. Model of detergent-induced spectral changes of the B800-850 complex from Chromatium minutissimum // IUBMB Life. 2000. V. 50. P. 115–117.
Yeliseev A.A., Eraso J.M., Kaplan S. Differential carotenoid composition of the B875 and B800–850 photosynthetic antenna complexes in Rhodobacter sphaeroides 2.4.1: involvement of spheroidene and spheroidenone in adaptation to changes in light intensity and oxygen availability // J. Bacteriol. 1996. V. 178. P. 5877–5883.
Дополнительные материалы отсутствуют.


