Микробиология, 2020, T. 89, № 3, стр. 356-366
Разнообразие прокариот в биотопах соленого щелочного озера Гуджирганское (Баргузинская долина, Бурятия)
Е. В. Лаврентьева a, b, *, Е. Б. Эрдынеева a, Т. Г. Банзаракцаева a, О. Р. Коцюрбенко c, О. А. Батурина d, В. В. Хахинов b, Л. П. Козырева a
a Институт общей и экспериментальной биологии СО РАН
670047 Улан-Удэ, Россия
b Бурятский государственный университет
670000 Улан-Удэ, Россия
c Югорский государственный университет
628012 Ханты-Мансийск, Россия
d Институт химической биологии и фундаментальной медицины СО РАН
630090 Новосибирск, Россия
* E-mail: lena_l@mail.ru
Поступила в редакцию 30.12.2019
После доработки 10.02.2020
Принята к публикации 05.03.2020
Аннотация
В пересыхающем соленом щелочном озере Гуджирганское, расположенном в Баргузинской долине Бурятии (Байкальская рифтовая зона), был определен гидрохимический состав воды и минералогический состав микробных матов и донных осадков. С использованием анализа ампликонов гена 16S рРНК изучено разнообразие прокариот в различных биотопах ‒ рассол (1 проба), осадки (3), микробные маты (3). В момент отбора проб в октябре 2017 г. озеро было практически пересохшим, остаточный рассол с минерализацией 100 г/дм3 встречался фрагментарно; микробные образования двух точек отбора представляли собой сухие корки. Проанализировано 38636 нуклеотидных последовательностей, отнесенных к 193 ОТЕ. Во всех биотопах доминировали бактерии, представители архей составляли 0.013–4.5%. Для биотопов отмечены различия в таксономическом составе. В воде доминировали представители Gammaproteobacteria (36.5%), Bacteroidetes (25.4%) и Alphaproteobacteria (18.3%). В плотной сухой корке (Гудж 1-мат), доминировали Gammaproteobacteria (52%), а Cyanobacteria составляли лишь 3.4%. В сухой корке (Гудж 2-мат) основу сообщества также составляли Gammaproteobacteria (80%), главным образом разнообразные представители рода Aliidiomarina (68%). В придонном микробном мате под остаточным рассолом основу сообществ составляли Gammaproteobacteria (37.4%) и Cyanobacteria (27.8%). В донных осадках преобладали Firmicutes (30‒32%), в точке отбора 1 субдоминировали Actinobacteria (14.56%) и Deinococcus‒Thermus (15.4%). Полученные данные позволили оценить современное состояние озера и таксономическое разнообразие микробных сообществ в биотопах озера Гуджирганское.
Крупнейшая межгорная Баргузинская котловина, характеризующаяся резко-континентальным климатом, расположена между Баргузинским и Икатским хребтами у северо-восточного побережья Байкала в Бурятии. Минимальная температура воздуха зимой здесь может достигать ‒52°С, а максимальная летом ‒ +38°С (Намсараев и соавт., 2007). По котловине протекает река Баргузин, являющаяся крупнейшим притоком Байкала. В долине реки расположены 4 группы соленых озер, разнообразных по происхождению и морфологии, гидрохимическому и гидрологическому режимам. Многие из них имеют повышенную минерализацию, и на некоторых озерах наблюдается садка солей на берегах или на дне высохшего озера (Намсараев и соавт., 2007). Группа Алгинских озер, окружающие их болота и термальный источник представляют единый гидроминеральный комплекс общей площадью около 15 км2. Формирование сульфатного натриевого состава солоноватых и рапных озер в долине обусловлено сочетанием трех факторов – тектонических условий котловины, климата и состава термальных вод (Намсараев и соавт., 2007).
Соленое озеро Гуджирганское относится к группе Алгинских озер и представляет эвапоритовую систему с нестабильным водным режимом. В течение сухого сезона большая часть озера покрыта солевыми корками, и при понижении температуры наблюдается осаждение мирабилита. При наступлении водного периода часть соли переходит в раствор. Поступление мирабилита происходит из геологических образований через толщу песчано-глинистых отложений.
Микробиологические исследования в озерах Баргузинской долины проводились на протяжении 30 лет и в основном были связаны с выделением новых видов экстремофильных бактерий и изучением функционирования микробных сообществ (Горленко, 2007). Исследования микробного разнообразия сообществ современными методами, основанными на идентификации генов 16S рРНК, в этих соленых озерах не проводились. Исследования разнообразия позволят выделить новые, ранее не культивируемые таксоны прокариот, а также могут стать в дальнейшем основой для мониторинговых наблюдений за состоянием биоразнообразия в условиях изменяющегося климата.
Основная цель данного исследования – оценить современное состояние озера Гуджирганское и разнообразие прокариот в различных биотопах.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
На протяжении последних 25 лет в Баргузинской долине регистрируется пониженное количество осадков, выражающееся в продолжительном засушливом периоде, в том числе осенью. На момент отбора проб (октябрь, 2017 г.) площадь озера Гуджирганское, в основном, была покрыта сухой соляной коркой толщиной от 0.5 до 5 см. На ее поверхности наблюдалось выпадение кристаллов тенардита (Na2SO4). В небольших углублениях находился остаточный рассол. Верхние слои осадков были представлены серым илом.
Для исследований были намечены три точки, в которых были отобраны образцы из различных биотопов: рассол (находился только в точке отбора 3), донные осадки с глубиной залегания до 10 см и микробные маты. Характеристика образцов приведена в табл. 1.
Таблица 1.
Характеристика биотопов в озере Гуджирганское
| Биотоп | Наименование образца | Координаты | Характеристика | Минералогический состав |
|---|---|---|---|---|
| Микробный мат | Гудж 1-мат | 53°640′042′′ N 109°954′181′′ E | Плотная сухая корка со слоем мата зеленого цвета (толщина 3 см) | Тенардит (Na2SO4); Галит (NaCl) |
| Гудж 2-мат | 53°640′042′′ N 109°954′181′′ E | Сухой микробный мат зеленовато-красного
цвета (0.5 см) |
Тенардит (Na2SO4) | |
| Гудж 3-мат | 53°639′676′′ N 109°959′505′′ E | Придонный мат: рыжевато-зеленого цвета, под водой на поверхности донных осадков (0.3 см) | Тенардит (Na2SO4); Доломит (CaMg(CO3)2); Конинкит ((Fe,Al)PO4 · 3H2O); Кварц (α-SiO2) |
|
| Донные осадки | Гудж 1-до | 53°640′042′′ N 109°954′181′′ E | Серый ил, отобран на глубине до 10 см | Анортит (СaNa)(Si,Al)4O8; Кварц (α-SiO2); Конинкит ((Fe,Al)PO4 · 3H2O); Доломит (CaMg(CO3)2) |
| Гудж 2-до | 53°640′042′′ N 109°954′181′′ E | Серый ил, отобран на глубине до 10 см | Доломит (CaMg(CO3)2); Кварц (α-SiO2); Тенардит (Na2SO4); Конинкит ((Fe,Al)PO4 · 3H2O) |
|
| Гудж 3-до | 53°639′676′′ N 109°959′505′′ E | Серый ил, отобран на глубине до 10 см | Анортит (СaNa)(Si,Al)4O8; Доломит (CaMg(CO3)2); Тенардит (Na2SO4); Кварц (α-SiO2); Конинкит ((Fe,Al)PO4 · 3H2O); Кристаллы сульфита магния (MgSO3 · H2O) |
|
| Рассол | Гудж 3-вода | 53°639′676′′ N 109°959′505′′ E | Прозрачный остаточный рассол | ‒* |
В рассоле на месте отбора проб были измерены рН и температура с помощью портативного рН метра с сенсорным термометром (рН-200 HM Digital, Южная Корея). Минерализацию определяли при помощи тест-кондуктометра TDS-4 (Сингапур). Для химического анализа рассол отбирали в пластиковую бутылку. Макрокомпонентный состав рассола определяли с помощью гидрохимических методов в ЦКП ГИН СО РАН (г. Улан-Удэ).
Минералогический состав донных осадков и микробных матов проводили методом рентгенофазового анализа (РФА) на дифрактометре D8 Advance (“Bruker AXS”, Германия) (CuKα – излучение) с автоматическим сменщиком образцов и детектором Vantec-1 в ЦКП БНЦ СО РАН (г. Улан-Удэ).
Для молекулярно-генетического анализа пробы осадков и микробных образований отбирали в стерильные пластиковые 15 мл пробирки типа Falkon и фиксировали этанолом до конечной концентрации 50% (об./об.). Пробу рассола фильтровали через стерильный мембранный фильтр с размером пор 0.22 мкм. Фильтр затем помещали в стерильную пластиковую микропробирку и фиксировали этанолом. Пробы были доставлены в лабораторию в течение суток и до выделения ДНК находились в холодильнике при 4°С.
Выделение ДНК из рассола, осадков и микробных матов проводили с помощью набора DNeasy PowerSoil Kit (“Qiagen”, США) по протоколу производителя. Качественную и количественную оценку полученных препаратов ДНК проводили с помощью спектрофотометра Nanodrop 1000 (“Thermo Fisher Scientific”, США). Регион V3-V4 гена 16S рРНК был амплифицирован с помощью праймеров 343F (5'-CTCCTACGGRRSGCAGCAG-3') и 806R (5'-GGACTACNVGGGTWTCTAAT-3'), содержащих адаптерные последовательности (“Illumina”), линкер и баркод (Fadrosh et al., 2014). Амплификацию проводили в условиях, описанных ранее (Brouchkov et al., 2017). Ампликоны смешивали по 200 нг каждый и чистили в 1% агарозном геле с помощью набора MinElute Gel Extraction Kit (“Qiagen”). Секвенирование проводили в ЦКП “Геномика” СО РАН (ИХБФМ СО РАН) на секвенаторе MiSeq (“Illumina”), используя набор Reagent Kit v3 (2 × 300, “Illumina”).
Полученные парные последовательности анализировали с помощью UPARSE скриптов, используя Usearch v11.0 (Edgar, 2013). Биоинформатическая обработка была проведена в ноябре 2017 г. и включала перекрывание парных прочтений, фильтрацию по качеству и длине, учет одинаковых последовательностей, отбрасывание синглтонов, удаление химер и получение ОТЕ (операционные таксономические единицы) с помощью алгоритма кластеризации UPARSE. Таксономическая принадлежность последовательностей OTE определялась с помощью SINTAX (Edgar, 2016) и референсной базы 16S RDP training set v16 (Wang et al., 2007). Альфа-разнообразие анализировали Usearch. Серверы NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi) и EzBioCloud (https:// www.ezbiocloud.net/) были использованы для поиска ближайших гомологов.
Результаты высокопроизводительного секвенирования доступны в базе данных NCBI под номером PRJNA597968 (https://www.ncbi.nlm.nih.gov/bioproject/597968).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гидрохимическая и минералогическая характеристики проб. В момент проведения отбора проб рассол имел минерализацию 100 г/дм3, температура составляла 12°С, рН – 9.86.
В катионном составе рассола (г/дм3) преобладал Na+ (35.4), также обнаружены Mg2+ (0.44), Ca2+ (0.03) и Fe3+ (0.001). Основным анионом являлся ${\text{SO}}_{4}^{{2 - }}$ (55.9 г/дм3), концентрация HCO3– и ${\text{CO}}_{3}^{{2 - }}$ была 9.76 и 1.5 г/дм3 соответственно. Концентрация иона Cl– в рассоле составила 7.13 г/дм3. Проведенная на основе полученных данных типизация природной воды в озере Гуджирганское по формуле Курлова:
определяет ее как сульфатную натриевую. Основную роль в формировании гидрохимического состава рассола озера играет разгрузка подземных минерализованных вод по тектоническим разломам и трещинам высокосейсмичной территории Баргузинской долины.
В минералогическом составе практически во всех исследуемых образцах присутствует тенардит. В донных осадках и в микробном мате Гудж 3-мат также были обнаружены доломит, кварц, конинкит. Наиболее широкий спектр минералов был определен в образце Гудж 3-до, помимо вышеперечисленных минералов рентгенофазовый анализ выявил анортит и кристаллы сульфита магния. Характерной особенностью всех донных осадков являлось присутствие минерала доломита. В засушливых эвапоритовых средах широко распространен карбонатный минерал – доломит, и на его долю приходится около 50% мировых углеводородных бассейнов и нефтяных пластов (Mazzullo, 2004).
Присутствие в минералогическом составе микробных матов и донных осадков светлых и/или полупрозрачных минералов способствует проведению микробным сообществом фотохимических реакций для синтеза органического вещества. Минеральная корка выполняет, вероятно, и защитную функцию от воздействия ультрафиолетового излучения, и сохраняя влагу, необходимую для развития прокариотного сообщества.
Анализ микробного разнообразия. Впервые с использованием высокопроизводительного секвенирования гена 16S рРНК было изучено таксономическое разнообразие микробного сообщества в различных биотопах озера Гуджирганское. Анализ сообщества проведен на 38636 достоверных нуклеотидных последовательностях, отнесенных к 193 OTЕ. Сообщество рассола было представлено доменом Bacteria. В донных осадках и микробных матах на его долю приходилось 95.7 и 95.5%. Оставшиеся 4.3 и 4.5%, соответственно, составляли домен Archaea.
В микробных сообществах биотопов озера Гуджирганское выявлены последовательности генов 16S рРНК представителей 8 бактериальных филумов (рис. 1). В сообществах доминировали представители Proteobacteria (13.7–90.2% от общего числа проанализированных фрагментов генов 16S рРНК), Bacteroidetes (5–33.4%), Firmicutes (0.2–43.1%) и Cyanobacteria (0.3–30.9%), но их соотношение существенно варьировало в исследованных биотопах. На рис. 2 показаны наиболее представленные таксоны в микробных сообществах биотопов озера.
Рис. 2.
Относительная численность наиболее представленных таксонов в микробном сообществе биотопов оз. Гуджирганское.
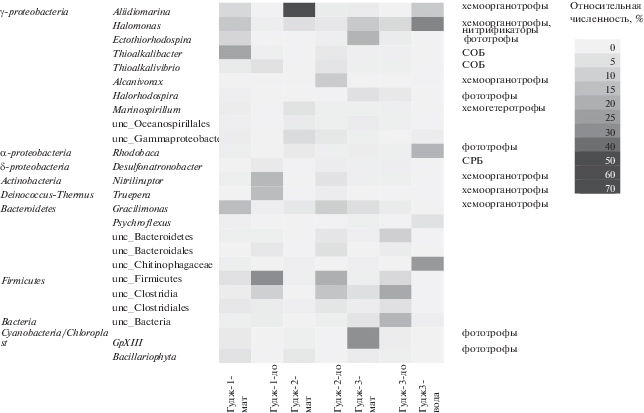
Наибольшее количество прочтений было получено для проб рассола, сухого микробного мата (Гудж 2-мат) и придонного мата (Гудж 3-мат). Анализ индексов таксономического разнообразия и богатства прокариотных ОТЕ показал, что наибольшее количество ОТЕ и максимальное видовое богатство, оцененное с помощью индекса Chao1 приходятся на донные осадки Гудж 2-до (табл. 2). Наибольшее видовое разнообразие, оцененное с помощью индексов Симпсона и Шеннона, выявлено в донных осадках Гудж 2-до и Гудж 3-до. Наименьшим количеством ОТЕ и богатством отличались пробы рассола (Гудж 3-рассол) и сухого микробного мата (Гудж 2-мат). Для этих же проб рассчитаны наименьшие индексы разнообразия.
Таблица 2.
Индексы таксономического разнообразия и богатства прокариотных ОТЕ в биотопах оз. Гуджирганское
| Образец/Биотоп | Количество прочтений | Богатство | chao1 | Индексы разнообразия | |
|---|---|---|---|---|---|
| Симпсон | Шеннон | ||||
| Гудж 1-мат | 4656 | 125 | 133.7 | 0.078 | 4.88 |
| Гудж 2-мат | 7589 | 77 | 83.1 | 0.075 | 4.45 |
| Гудж 3-мат | 6189 | 128 | 130.0 | 0.11 | 4.62 |
| Гудж 1-до | 4676 | 109 | 111.3 | 0.09 | 4.85 |
| Гудж 2-до | 3878 | 140 | 140.7 | 0.06 | 5.38 |
| Гудж 3-до | 4296 | 129 | 130.1 | 0.05 | 5.54 |
| Гудж 3-вода | 7352 | 62 | 63.5 | 0.17 | 3.35 |
Для оценки сходства таксономического состава микробных сообществ трех типов биотопов (рассол, микробные маты и донные осадки) была построена диаграмма Венна (рис. 3). В биотоп донных осадков были объединены библиотеки последовательностей всех исследуемых трех донных осадков (Гудж 1-до, Гудж 2-до, Гудж 3-до). По такому же принципу для анализа был сформирован биотоп микробных матов из последовательностей, полученных из образцов Гудж 1-мат, Гудж 2-мат, Гудж 3-мат.
Рис. 3.
Диаграмма Венна. Число общих ОТЕ в микробных сообществах трех биотопов озера Гуджирганское (n ‒ количество объединенных образцов, цифрами показано количество ОТЕ).
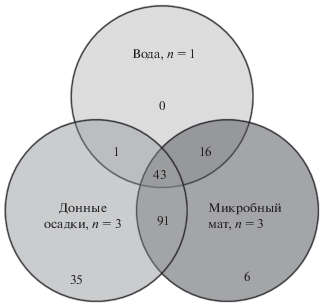
Анализ последовательностей генов 16S рРНК всех образцов показал, что более 22.3% ОТЕ являются общими. Наибольшее количество общих последовательностей для всех трех типов биотопов принадлежали представителям Gammaproteobacteria родов Aliidiomarina и Halomonas. Присутствие этих типичных обитателей соленых экосистем вполне закономерно: высокая степень солености в исследуемом озере способствует развитию и широкому распространению галофильных и галотолерантных бактерий. Максимальное количество уникальных ОТЕ (18.2%) было выявлено в биотопе донных осадков. Следует отметить, что среди них доминировали бактерии, характерные для геотермальных систем рода Truepera филума Deinococcus‒Thermus. Некультивируемые Bacteroidales и Clostridia являлись содоминантами и вносили значительный вклад в состав уникальных ОТЕ донных осадков. В донных осадках озера Гуджирганское они в перспективе могут представлять потенциально новые таксоны бактерий. В биотопе матов выявлены 3.1% уникальных ОТЕ, основную часть которых представляли три филотипа бактерий рода Aliidiomarina. Ближайшие гомологи обнаруженных последовательностей были выделены из воды соленых озер Шира (Хакасия, Россия) (Chiu et al., 2014) и Моно Лейк (Калифорния, США) (Farooqui et al., 2016). Также среди уникальных ОТЕ микробных матов были выявлены последовательности, близкородственные пурпурным серным бактериям рода Ectothiorhodospira, галофильным бактериям родов Alkalicoccus и Halomonas.
ОТЕ, выявленные в рассоле, были характерны и для других биотопов.
По данным диаграммы, наибольшее таксономическое сходство, более 47%, имели сообщества биотопов донных осадков и матов. Сходство сообществ биотопа матов и биотопа рассола было значительно меньше и составило 8.3%.
Таксономический состав микробного сообщества рассола в озере Гуджирганское. Микробное сообщество рассола представлено бактериями доминирующих филумов Proteobacteria (γ- и α- классов ‒ 36.5 и 17.4% соответственно) и Bacteroidetes (25.4%).
Gammaproteobacteria в сообществе были представлены, в основном, родом Halomonas (пор. Oceanospirillales, сем. Halomonadaceae). Хемоорганотрофные, умеренно-галофильные, аэробные или факультативно анаэробные бактерии рода Halomonas выделяются из различных солесодержащих источников окружающей среды по всему миру, таких как солнечные солеварни, открытый океан, эстуарии, моря, солончаки, засоленные почвы, соленые и содовые озера и др. Способность к денитрификации является одним из таксономических признаков рода Halomonas и часто рассматривается как приспособление к переменным физико-химическим условиям природной среды (Болтянская, 2007). Метаболическая и физиологическая универсальность рода способствует выживанию галомонад в экстремальной среде, позволяя им использовать многие формы временно доступных питательных веществ.
Halomonas доминировали в рассоле, тогда как их содержание в других биотопах было значительно ниже (от 1 до 12%). 25% зарегистрированных последовательностей были близкородственны к культивируемому галофильному виду H. sulfidaeris Esulfide 1T (99.53%). Впервые этот вид был выделен из сульфидной породы, отобранной в районе глубоководного гидротермального вента хребта Хуан-де-Фука на северо-востоке Тихого океана (Kaye et al., 2004). H. sulfidaeris является психротолерантной бактерией, у которой минимальные и оптимальные характеристики роста аналогичны тем, что наблюдаются у видов Halomonas, выделенных из антарктических проб и проб морского льда, что, предположительно, отражает их адаптацию к холоду. Фенотипические тесты показали, что бактерии являются физиологически и метаболически универсальными. Они способны расти в широком диапазоне температур от ‒1 до 35°С, концентрации NaCl 0.5‒24%, рН 5‒10; способны к редукции нитрата в аэробных и анаэробных условиях, росту при низком содержании органического вещества, гидролизу казеина, росту на ряде сахаров, спиртов и аминокислот. Также в рассоле были обнаружены последовательности, близкородственные галофильному виду (97.9%) H. shengliensis SL014B-85T, изолированному из засоленной почвы нефтяного месторождения Шенли, Китай. Штамм, в отличие от H. sulfidaeris, имеет умеренные ростовые характеристики: рост наблюдается при температуре 10‒42°С, 0‒15% NaCl и рН 8.0‒9.0 (Wang Y.-N. et al., 2007).
Представители рода Aliidiomarina (пор. Alteromonadales, сем. Idiomarinaceae) – хемоорганотрофные, гало- и мезофильные бактерии ‒ составляли еще одну многочисленную группу класса Gammaproteobacteria (11.6%). Их характеристика приведена в разделе, посвященном структуре микробных сообществ матов.
Большинство последовательностей, отнесенных к классу Alphaproteobacteria (17.38%), показали 100% сходство к алкалофильной, умеренно галофильной пурпурной несерной бактериохлорофил а-содержащей бактерии рода Rhodobaca (пор. Rhodobacterales, сем. Rhodobacteraceae) ‒ Rbc. barguzinensis VKM B-2406, выделенной из микробного мата содово-соленого озера Баргузинской долины (Болдарева и соавт., 2008). Rbc. barguzinensis является факультативным анаэробом, способным к росту при 5‒80 г/л NaCl и температуре 20‒35°С, осуществляющим широкий круг метаболических реакций аэробно в темноте и анаэробно в присутствии света. Известно, что Rhodobaca обладают уникальной способностью к фототрофному и хемотрофному росту на самых разных органических соединениях и характерны для щелочных и соленых содовых озер Сибири и Африканской рифтовой долины (Горленко, 2007).
Представители филума Bacteroidetes составляли четвертую часть микробного сообщества рассола. По данным EzBioCloud филотипы имели наибольшее сродство (99.53%) к некультивируемому бактериальному клону ML310M-34 (класс Cytophagia), выявленному в сообществе монимолимниона содового озера Моно Лэйк, Калифорния (Edwardson et al., 2018).
Таким образом, микробное сообщество рассола было представлено, в основном, аэробными и факультативно-анаэробными гетеротрофными умеренно-галофильными гаммапротеобактериями и фотосинтезирующими бактериохлорофилл-а содержащими альфапротеобактериями, способными к функционированию в условиях соленой и щелочной среды в широком диапазоне температуры.
Таксономический состав микробного сообщества в микробных матах озера Гуджирганское. Наибольшее количество нуклеотидных последовательностей в сообществе микробных матов принадлежало представителям таксонов Gammaproteobacteria, Cyanobacteria, Firmicutes и Bacteroidetes.
В образце сухой корки Гудж 1-мат среди доминирующих Gammaproteobacteria преобладали филотипы (22%), близкородственные сероокисляющей гаммапротеобактерии рода Thioalkalibacter (пор. Halothiobacillales, сем. Thioalkalibacteriaceae) – Th. halophilus ALCO1 (98.83%) ‒ единственному валидно описанному представителю рода, выделенного из гиперсоленого щелочного озера Алтайского края (Banciu et al., 2008). Thioalkalibacter halophilus является факультативно алкалофильным галофилом, способным расти как в слабощелочных условиях, так и при высоких значениях pH (Banciu et al., 2008; Sorokin et al., 2015).
Еще одной крупной группой Gammaproteobacteria в сообществе являлись представители порядка Ectothiorhodospirales, сем. Ectothiorhodospiraceae. Представители семейства широко распространены в солоноватых, соленых и гиперсоленых озерах, а также в содовых озерах с различным содержанием солей (Горленко, 2007). Они адаптированы к соленым и щелочным условиям и осуществляют аноксигенный фотосинтез с использованием восстановленных соединений серы, водорода, органических соединений или арсенита в качестве доноров электронов. Филотипы из сухой корки были близкородственны (99.5%) к пурпурной серной бактерии Ectothiorhodospira variabilis.
Более 12% последовательностей в сообществе Гудж1-мат принадлежали филуму Bacteroidetes, роду Gracilimonas. Наибольшее же сродство 10% ОТЕ показали с некультивируемым бактериальным клоном SL134 (99.53%), обнаруженным в засоленном литоральном грунте Аравийского моря (Keshri et al., 2015), и 2% были близкородственны к некультивируемому бактериальному клону TX4CB_109 (98.82%) из щелочной засоленной почвы оз. Текскоко, Мексика (Valenzuela-Encinas et al., 2009). Изученные последовательности проявили сродство на уровне 95.5‒96% с культивируемым штаммом Rhodohalobacter halophilus – факультативно-анаэробной гало- и алкалифильной гетеротрофной бактерией, выделенной из солевого испарителя в Китае (Xia et al., 2017).
Галомонады составляли около 10% в сообществе и были близкородственны к известным культивируемым штаммам родов Halomonas.
От сухой корки Гудж 1-мат микробный мат пробы Гудж 2-мат отличался доминированием филотипов, близкородственных представителям рода Aliidiomarina (кл. Gammaproteobacteria, пор. Alteromonadales, сем. Idiomarinaceae), объединяющих аэробные галофильные гетеротрофные бактерии, для которых наиболее характерным признакам является наличие протеолитической активности. Aliidiomarina также присутствовали и в других пробах, но в Гудж 2-мат их количество превышало 68%. Все 20 ОТЕ были близкородственны к культивируемым видам, преимущественно A. maris (38.23%), A. minuta (12.72%), A. shirensis (16.55%) на уровне 98‒99% сходства. Каждый из этих видов представляет интерес. Так, A. maris растет в широком диапазоне температуры (4‒42°С), образует протеазу, восстанавливает нитраты (Zhang et al., 2012); A. minuta в экстремальных условиях (при низкой температуре, в отсутствие источника углерода и NaCl) образует очень мелкие клетки, способствующие выживанию (Faroqui et al., 2016), A. shirensis, выделенный из соленого меромиктического озера Шира (Россия, Хакасия), способен к росту при низкой температуре (1°С) (Chiu et al., 2014).
Следует также отметить, что в сообществе Гудж 2-мат более 6% составляли гетеротрофные Halomonas и более 2% ‒ пурпурные несерные бактерии р. Rhodobaca.
Только в микробном мате Гудж 3-мат, отобранном под водой, наряду с Gammaproteobacteria (40%) доминировали Cyanobacteria (31%). 30% Gammaproteobacteria составляли филотипы семейства Ectothiorhodospiraceae рода Ectothiorhodospira (23%), близкородственные аноксигенной пурпурной бактерии Ect. variabilis (аналогично Гудж 1-мат) и экстремально галофильному роду Halorhodospira – H. halophila (5.3%). Известно, что Ectothiorhodospira наиболее приспособлены не только к экстремальной солености, но и к щелочным условиям среды. Представители рода Halorhodospira обладают высокой гибкостью по отношению к различным концентрациям солей (Горленко, 2007).
Следует отметить, что представители класса Gammaproteobacteria на сегодняшний день охватывают все известные группы экстремальных галофильных, алкалофильных серных бактерий.
Филум Cyanobacteria представлен в микробном мате Гудж 3-мат (27.5%) порядком Oscillatoriales, родом Planktothrix.
Таксономический состав микробного сообщества в донных осадках озера Гуджирганское. Во всех сообществах донных осадков доминировали бактерии филума Firmicutes (39‒43%). Как показывают исследования, проведенные с помощью амплификации гена 16S рРНК, так и метагеномные исследования, представители Firmicutes широко распространены в засоленных местообитаниях (Van Horn et al., 2014; Naghoni et al., 2017; Vavourakis et al., 2016, 2018).
Полученные нуклеотидные последовательности отнесены к некультивируемым бактериальным клонам с таксономической принадлежностью лишь на уровне семейства Proteinivoraceae и Halanaerobiaceae класса Clostridia. Известно, что представители семейства Proteinivoraceae являются анаэробными алкалофильными спорообразующими хемоорганотрофами. Семейство Halanaerobiaceae – анаэробные, умеренно галофильные хемоорганотрофные бактерии.
В условиях нестабильного водного режима озера Гуджирганское можно предположить, что доминирование в донных отложениях Firmicutes обусловлено широкими метаболическими возможностями представителей этого филума, их адаптационными способностями к экстремальным факторам окружающей среды и спорообразованию (у некоторых представителей класса Clostridia).
В пробе Гудж 1-до субдоминантами являлись Actinobacteria и Deinococcus‒Thermus. В филуме Actinobacteria 13.5% ОТЕ относились к роду Nitriliruptor (класс Nitriliruptoria) с единственным валидным видом N. alkaliphilus, впервые выделенным из донных осадков содовых озер Кулундинской степи, Россия (Sorokin et al., 2009). Это единственные алкалофильные и умеренно галофильные актинобактерии, способные использовать для роста алифатические нитрилы. Однако наибольшее сходство ОТЕ имели с некультивируемыми актинобактериальными клонами из щелочных соленых озер Египта и Китая. Nitriliruptor также обнаружен в пробе Гудж 2-до. Известно, что хемоорганотрофные Actinobacteria имеют различные стратегии выживания, обладают широким метаболическим и деградационным потенциалом (Genderjahn et al., 2018). Actinobacteria были выделены из засоленных почв в Мексике (Valenzuela-Encinas et al., 2009) и описаны как доминирующий тип в засушливых средах, таких как пустыня Намиб (Makhalanyane et al., 2013).
ОТЕ, отнесенные к роду Truepera (филум Deinococcus‒Thermus, класс Deinococci, пор. Deinococcales, сем. Trueperaceae), составляли 11.7% в пробе Гудж 1-до и менее 1% в других пробах осадков. ОТЕ проявляли наибольшее сходство к некультивируемым бактериальным клонам (98.3‒98.5%) из экстремальных шахтных хвостохранилищ в пустыне Атакама (Чили) и кратерных базальтах озера Лонар (Индия). Аэробные и хемоорганотрофные Deinococcus‒Thermus характеризуются высокой устойчивостью к экстремальным факторам окружающей среды – высокой температуре и ионизирующему излучению (Genderjahn et al., 2018). Возможно, присутствие бактерий рода Truepera в озере Гуджирганское косвенно свидетельствует о наличии притока подземных вод из термального источника Алгинского. Хотя последовательности, относящиеся к этим таксонам, представляют относительно невысокий процент от общего числа прочтений в сообществе, в соленом озере Гуджирганское эти организмы, по-видимому, имеют конкурентное преимущество для выживания наряду с алкало-галофильными микроорганизмами.
Содоминантами (10.5%) в сообществе Гудж 2-до являлись бактерии рода Alcanivorax (Gammaproteobacteria, пор. Oceanospirillales, сем. Alcanivoracaceae) – аэробные и микро-аэрофильные бактерии, выделяемые из воды и морских осадков, принципиальной особенностью которых является утилизация алифатических углеводородов в качестве единственных источников углерода и энергии (Yakimov et al., 2019). На настоящий момент идентичность углеводородокисляющих прокариот в соленых щелочных внутриконтинентальных озерах остается неизученной.
Разнообразие архей. Все основные репрезентативные последовательности домена Archaea, полученные в соленом озере Гуджирганское, отнесены к Euryarchaeota и представлены классом Halobacteria. Это наблюдение согласуется с результатами предыдущих исследований соленых озер (Xu et al., 2001; Genderjahn et al., 2018). Низкое разнообразие и распространение архей в изученных биотопах озера Гуджирганское обусловлено низким содержанием хлорида в рассоле и донных осадках и свидетельствует о том, что археи являются более высокоспециализированными прокариотами для выживания в гиперсоленых системах.
Следует отметить, что во всех биотопах обнаружена большая доля некультивируемых прокариот. Этот важный неизученный микробный компонент в соленом озере Гуджирганское представлен как на уровне домена Bacteria (до 17%), так и на других крупных таксономических уровнях: unc_Firmicutes (до 29% Гудж-3-вода), unc_Chitinophagaceae (до 25% Гудж-1-мат), unc_Bacteroidetes (до 10% Гудж-3-до).
Таким образом, группа Алгинских озер представляет уникальный природный комплекс на территории Баргузинской долины. В отличие от других озер Баргузинской долины, эта группа соленых озер характеризуется сульфатно-натриевым типом воды, образующимся в результате сочетания нескольких факторов: разгрузки термальных трещинно-жильных вод, испарения, вымораживания воды (Плюснин и соавт., 2019). В результате сульфатного засоления в озере Гуджирганское в осенне-зимний период наблюдается отложение солей на всей поверхности озера и подледная садка солей. Следует отметить, что под слоем ила залегает пласт мирабилита мощностью до 3.5 м. Осаждение мирабилита на поверхности изученного озера происходит при температуре ‒6°С. Минералогический анализ во всех исследованных нами образцах показал присутствие тенардита, доломита, кварца и конинкита. Ранее, в работе Плюснина и соавт. (2019), кроме этих минералов обнаружены астраханин и энаргит.
Экстремальная среда соленого озера Гуджирганское является динамической системой, где в течение года происходит переход от солоноватого типа к соленому, что оказывает сильное влияние на состав микробных сообществ in situ в различных биотопах. Впервые для оценки микробного разнообразия озера Гуджирганское был использован метод секвенирования нового поколения, что позволило показать современное состояние микробных сообществ в различных биотопах озера. Мы предполагаем, что микробные сообщества озера Гуджирганское состоят из множества высокоадаптируемых организмов с гетерогенными физиологическими возможностями. Распределение организмов в изученных биотопах показало адаптационную стратегию микробного сообщества к обстановке и изменениям окружающей среды в условиях резко-континентального климата. Например, гетеротрофные бактерии с чрезвычайно разнообразными метаболическими функциями способны образовывать эндоспоры, которые устойчивы к высыханию в засушливый период. Учитывая уникальную и экстремальную природу условий озера Гуджирганское, показательно, что там сосуществуют микробные таксоны различных функциональных групп, в том числе фототрофные, сероокисляющие, сульфатредуцирующие бактерии, хемоорганотрофы, бактерии-деструкторы углеводородов и др., приспособленные к соленым, экстремально соленым и щелочным условиям.
Список литературы
Болдарева Е.Н., Акимов В.Н., Бойченко В.А., Стадничук И.Н., Москаленко А.А., Махнева З.К., Горленко В.М. Новая алкалофильная несерная пурпурная бактерия, Rhodobaca barguzinensis sp. nov., из содового озера Баргузинской долины (Восточная Сибирь, Бурятия) // Микробиология. 2008. Т. 77. № 2. С. 241‒254.
Boldareva E.N., Akimov V.N., Boychenko V.A., Stadnichuk I.N., Moskalenko A.A., Makhneva Z.K., Gorlenko V.M. Rhodobaca barguzinensis sp. nov., a new alkaliphilic purple nonsulfur bacterium isolated from a soda lake of the Barguzin Valley (Buryat Republic, Eastern Siberia) // Microbiology (Moscow). 2008. V. 77. P. 206‒218.
Болтянская Ю.В. Галоалкалофильные денитрифицирующие бактерии рода Halomonas из содовых озер // Труды Института микробиологии имени С.Н. Виноградского: Алкалофильные микробные сообщества / Отв. ред. Гальченко В.Ф. М.: Наука, 2007. Выпуск 14. С. 276–298.
Горленко В.М. Аноксигенные фототрофные бактерии содовых озер // Труды Института микробиологии имени С.Н. Виноградского: Алкалофильные микробные сообщества / Отв. ред. Гальченко В.Ф. М.: Наука, 2007. Выпуск 14. С. 225–257.
Намсараев Б.Б., Зайцева С.В., Хахинов В.В., Иметхенов А.Б., Ринчино С.Х., Максанова Л.Б.-Ж. Минеральные источники и озера Баргузинской долины. Улан-Удэ: Издательство Бурятского госуниверситета, 2007. 98 с.
Плюснин А.М., Хажеева З.И., Санжанова С.С., Перязева Е.Г., Ангахаева Н.А. Сульфатные минеральные озера Западного Забайкалья: условия образования, химический состав воды и донных отложений // Геология и геофизика. 2020. В печати. doi: .
Banciu H.L., Sorokin D.Y., Tourova T.P., Galinski E.A., Muntyan M.S., Kuenen J.G., Muyzer G. Influence of salts and pH on growth and activity of a novel facultatively alkaliphilic, extremely salt-tolerant, obligately chemolithoautotrophic sulfur-oxidizing Gammaproteobacterium Thioalkalibacter halophilus gen. nov., sp. nov. from South-Western Siberian soda lakes // Extremophiles. 2008. V. 12. P. 391‒404. https://doi.org/10.1007/s00792-008-0142-1
Brouchkov A., Kabilov M., Filippova S., Baturina O., Rogov V., Galchenko V., Mulyukin A., Fursova O., Pogorelko G. Bacterial community in ancient permafrost alluvium at the Mammoth Mountain (Eastern Siberia) // Gene. 2017. V. 636. P. 48‒53. https://doi.org/10.1016/j.gene.2017.09.021
Chiu H.-H., Rogozin D.Y., Huang S.-P., Degermendzhy A.G., Shieh W.Y., Tang S.-L. Aliidiomarina shirensis sp. nov., a halophilic bacterium isolated from Shira Lake in Khakasia, southern Siberia, and a proposal to transfer Idiomarina maris to the genus Aliidiomarina // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 1334‒1339.
Edgar R.C. UPARSE: highly accurate OTU sequences from microbial amplicon reads // Nat. Methods. 2013. V. 10. P. 996–998.
Edgar R.C. SINTAX: a simple non-Bayesian taxonomy classifier for 16S and ITS sequences. bioRxiv preprint. 2016. P. 1‒20. https://doi.org/10.1101/074161
Edwardson C.F., Hollibaugh J.T. Composition and activity of microbial communities along the redox gradient of an alkaline, hypersaline, lake // Front. Microbiol. 2018. V. 9. Art. 14. P. 1‒18. https://doi.org/10.3389/fmicb.2018.00014
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2. Art. 6. P. 1‒7. https://doi.org/10.1186/2049-2618-2-6
Farooqui S.M., Wright M.H., Greene A.C. Aliidiomarina minuta sp. nov., a haloalkaliphilic bacterium that forms ultra-small cells under non-optimal conditions // Antonie van Leeuwenhoek. 2016. V. 109. P. 83‒93.
Genderjahn S., Alawi M., Mangelsdorf K., Horn F., Wagner D. Desiccation- and saline-tolerant bacteria and archaea in Kalahari pan sediments // Front. Microbiol. 2018. V. 9. Art. 2082. P. 1‒15. https://doi.org/10.3389/fmicb.2018.02082
Kaye J.Z., Carmen Ma’rquez M., Ventosa A., Baross J.A. Halomonas neptunia sp. nov., Halomonas sulfidaeris sp. nov., Halomonas axialensis sp. nov. and Halomonas hydrothermalis sp. nov.: halophilic bacteria isolated from deep-sea hydrothermal-vent environments // Int. J. Syst. Evol. Microbiol. 2004. V. 54. P. 499‒511.
Keshri J., Basit Y., Avinash M., Bhavanath J. The abundance of functional genes, cbbL, nifH, amoA and apsA, and bacterial community structure of intertidal soil from Arabian Sea // Microbiol. Res. 2015. V. 175. P. 57‒66. https://doi.org/10.1016/j.micres.2015.02.007
Makhalanyane T.P., Valverde A., Lacap D.C., Pointing S.B., Tuffin M.I., Cowan D.A. Evidence of species recruitment and development of hot desert hypolithic communities // Environ. Microbiol. Rep. 2013. V. 5. P. 219–224. https://doi.org/10.1111/1758-2229.12003
Mazzullo S.J. Overview of porosity evolution in carbonate reservoirs // Kansas Geological Survey Bulletin. 2004. V. 79. P. 22‒29.
Naghoni A., Emtiazi G., Amoozegar M.A., Cretoiu M.S., Stal L.J., Etemadifar Z., Fazeli S.A.S., Bolhuis H. Microbial diversity in the hypersaline Lake Meyghan, Iran // Sci. Rep. 2017. V. 7. Art. 11522. P. 1‒13. https://doi.org/10.1038/s41598-017-11585-3
Sorokin D.Y., Van Pelt S., Tourova T.P., Evtushenko L.I. Nitriliruptor alkaliphilus gen. nov., sp. nov., a deep-lineage haloalkaliphilic actinobacterium from soda lakes capable of growth on aliphatic nitriles, and proposal of Nitriliruptoraceae fam. nov. and Nitriliruptorales ord. nov. // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 248‒253.
Sorokin D.Y., Banciu H., Muyzer G. Functional microbiology of soda lakes // Curr. Opin. Microbiol. 2015. V. 25. P. 88‒96.
Yakimov M.M., Golyshin P.N., Crisafi F., Denaro R., Giuliano L. Marine, aerobic hydrocarbon-degrading Gammaproteobacteria: the family Alcanivoracaceae // Handbook of hydrocarbon and lipid microbiology. Taxonomy, genomics and ecophysiology of hydrocarbon-degrading microbes / Ed. McGenity T.J. Springer, Cham. 2019. P. 167‒179. https://doi.org/10.1007/978-3-319-60053-6_24-1.
Valenzuela-Encinas C., Neria-González I., Alcántara-Hernández R.J., Estrada-Alvarado I., Zavala-Díaz de la Serna F.J., Dendooven L., Marsch R. Changes in the bacterial populations of the highly alkaline saline soil of the former lake Texcoco (Mexico) following flooding // Extremophiles. 2009. V. 13. P. 609‒621. https://doi.org/10.1007/s00792-009-0244-4
Van Horn D.J., Okie J.G., Buelow H.N., Gooseff M.N., Barrett J.E., Takacs-Vesbach C.D. Soil microbial responses to increased moisture and organic resources along a salinity gradient in a polar desert // Appl. Environ. Microbiol. 2014. V. 80. P. 3034‒3043. https://doi.org/10.1128/AEM.03414-13
Vavourakis C.D., Ghai R., Rodriguez-Valera F., Sorokin D.Y., Tringe S.G., Muyzer G. Metagenomic insights into the uncultured diversity and physiology of microbes in four hypersaline soda lake brines // Front. Microbiol. 2016. V. 7. Art. 211. P. 1‒18. https://doi.org/10.3389/fmicb.2016.00211
Vavourakis C.D., Andrei A., Mehrshad M., Ghai R., Sorokin D.Y., Muyzer G. A metagenomics roadmap to the uncultured genome diversity in hypersaline soda lake sediments // Microbiome. 2018. V. 6. Art. 168. P. 1‒18. https://doi.org/10.1186/s40168-018-0548-7
Wang Y.-N., Cai H., Chi C.-Q., Lu A.-H., Lin X.-G., Jiang Z.-F., Wu X.-L. Halomonas shengliensis sp. nov., a moderately halophilic, denitrifying, crude-oil-utilizing bacterium // Int. J. Syst. Evol. Microbiol. 2007. V. 57. P. 1222‒1226. https://doi.org/10.1099/ijs.0.64973-0
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy // Appl. Environ. Microbiol. 2007. V. 73. P. 5261‒5267.
Zhang Y.J., Zhang X.Y., Zhao H.L., Zhou M.Y., Li H.J., Gao Z.M., Chen X.L., Dang H.Y., Zhang Y.Z. Idiomarina maris sp. nov., a marine bacterium isolated from sediment // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 370‒375.
Xia J., Xie Z.H., Dunlap C.A., Rooney A.P., Du Z.J. Rhodohalobacter halophilus gen. nov., sp. nov., a moderately halophilic member of the family Balneolaceae // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1281–1287.
Xu Y., Wang Z.X., Xue Y., Zhou P.J., Ma Y., Ventosa A., Grant W. Natrialba hulunbeirensis sp. nov. and Natrialba chahannaoensis sp. nov., novel haloalkaliphilic archaea from soda lakes in Inner Mongolia Autonomous Region, China // Int. J. Syst. Evol. Microbiol. 2001. V. 51. P. 1693‒1698. https://doi.org/10.1099/00207713-51-5-1693
Дополнительные материалы отсутствуют.



