Микробиология, 2020, T. 89, № 3, стр. 259-275
О механизмах и роли фотосинтетического образования водорода у зеленых микроводорослей
Е. В. Петрова a, Г. П. Кукарских a, Т. Е. Кренделева a, Т. К. Антал a, b, *
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Россия
b Псковский государственный университет, пл. Ленина, дом 2
180000 Псков, Россия
* E-mail: taras_an@mail.ru
Поступила в редакцию 06.06.2019
После доработки 02.09.2019
Принята к публикации 03.03.2020
Аннотация
Обзор посвящен описанию механизмов образования молекулярного водорода и выяснению физиологической роли [FeFe]-гидрогеназы в адаптации клеток зеленых микроводорослей к изменяющимся условиям среды, в первую очередь, к анаэробным условиям. Основной акцент сделан на понимании взаимосвязи и взаиморегуляции процессов биопродукции водорода, фотосинтетического электронного транспорта, реакций ферментативного брожения и поглощения кислорода в условиях анаэробиоза.
Семейство гидрогеназ включает обширную группу ферментов, катализирующих обратимую реакцию окисления молекулярного водорода у различных микроорганизмов, главным образом, прокариотических: 2H+ + 2e– ⇄ H2 (Happe, Kaminski, 2002). Функциональное значение данной реакции состоит в оптимизации окислительно-восстановительного баланса внутри клетки в анаэробных условиях в соответствии с метаболической потребностью и в зависимости от присутствия молекулярного водорода в газовой фазе (Vignais, Billoud, 2007). Среди оксигенных фототрофных организмов только у цианобактерий и представителей некоторых родов зеленых микроводорослей, среди которых Chlamydomonas, Chlorella и Scenedesmus, есть активные гидрогеназы; при этом, только у водорослей продукция водорода тесно связана с реакциями фотосинтеза.
Зеленые микроводоросли обладают гидрогеназой с биметаллическим кофактором FeFe-типа, которая характеризуется высокой эффективностью в направлении синтеза молекулярного водорода. Структурные гены водорослевой гидрогеназы обычно представлены несколькими паралогами, у Chlamydomonas reinhardtii ‒ генами HYDA1 и HYDA2, кодирующими два структурно сходных фермента, которые различаются по своему вкладу в продукцию водорода (Forestier et al., 2003; Meuser et al., 2012). Для созревания гидрогеназы необходимы продукты генов HYDEF и HYDG, которые обеспечивают синтез и встраивание кофактора (т.н. Н-кластера) в апофермент (Posewitz et al., 2005; Mulder et al., 2011). Гидрогеназа у C. reinhardtii представляет собой мономерный белок, формирующий в растворе глобулу, внутри которой расположен H-кластер, связанный с поверхностью белка каналами для обмена протонами и подведения молекулярного кислорода. Важно отметить, что HYD гены находятся в ядре водорослевой клетки, тогда как гидрогеназа проявляет активность строго в хлоропласте, где она функционально связана с процессом фотосинтетического транспорта электронов через ферредоксин (Фд) PetF. В клетке C. reinhardtii обнаружено шесть форм Фд, но только PetF взаимодействует как с гидрогеназой, так и с фотосистемой (ФС) 1 (Winkler et al., 2010; Sawyer, Winkler, 2017). Как известно, FeFe-гидрогеназы обладают высокой чувствительностью к молекулярному кислороду и требуют анаэробных условий для функциональной активности. У зеленых микроводорослей молекулярный кислород ингибирует гидрогеназную активность за счет подавления экспрессии HYD генов, нарушения процесса созревания фермента, а также окислительной деструкции каталитического центра (Ghirardi et al., 2007; Swanson et al., 2015).
Особый интерес представляет собой проблема возникновения и структурной модификации водорослевой гидрогеназы в ходе эволюции, а также оценка значимости данного приобретения для зеленых микроводорослей. Предположительно, предшественником водорослевой гидрогеназы являлся фермент, по структуре близкий к клостридиальной FeFe-гидрогеназе, гены которого могли быть переданы от представителя нефотосинтетических бактерий к предку современных водорослей путем латерального переноса (Meyer et al., 2007). В ходе эволюции водоросли выработали механизмы локализации гидрогеназной активности в хлоропласте, где происходит биосинтез и посттрансляционная модификация фермента (Sawyer et al., 2017). Необходимо отметить, что бактериальные FeFe-гидрогеназы содержат, кроме основного Н-кластера, домены со вспомогательными железосерными центрами (F-кластерами), которые обеспечивают обмен электронами между Н-кластером и бактериальным Фд. Открытие гидрогеназы бактериального типа с F-кластером у зеленой микроводоросли Chlorella variabilis NC64A (Trebouxiophyceae, Chlorophyta) проливает свет на эволюцию этого фермента у водорослей (Meuser et al., 2012). Очевидно, что водорослевые гидрогеназы, содержащие только Н-кластер, произошли от более древнего фермента бактериального типа, который сохранился у некоторых представителей эволюционно древних линий зеленых водорослей. Основным следствием модификации структуры водорослевой гидрогеназы является способность фермента эффективно взаимодействовать с PetF, которая отсутствует у гидрогеназ бактериального типа, в том числе у фермента из Chlorella variabilis NC64A (Engelbrecht et al., 2017). Таким образом, наиболее интересными аспектами эволюции водорослевой гидрогеназы является локализация активного фермента в хлоропласте и его тесное взаимодействие с фотосинтетической электронно-транспортной цепью (ЭТЦ). Очевидно, что данные особенности указывают на специфическую роль гидрогеназы в регуляции электронного транспорта в хлоропласте в анаэробных условиях, необходимых для поддержания активного состояния фермента (Melis, 2007; Hemschemeier, Happe, 2011; Цыганков, 2014).
Настоящий обзор посвящен описанию механизмов образования молекулярного водорода и их вероятной регуляторной роли в хлоропласте зеленых микроводорослей на примере модельного одноклеточного организма – C. reinhardtii, метаболизм которого наиболее подробно изучен в настоящее время. Особенное внимание уделено фотообразованию водорода при минеральном голодании. Как известно, недостаток макроэлементов, таких как азот, фосфор, железо, магний или сера, является одним из основных природных стрессовых факторов и играет важную роль в жизнедеятельности фитопланктонных организмов, значительная часть которых обитает в обедненных минеральным питанием районах Мирового океана (Moore, 2013). В биотехнологии минеральное голодание используется для стимуляции биосинтеза целевых продуктов, таких как биотопливо и каротиноиды (астаксантин) (Solovchenko, Chekanov, 2014; Solovchenko, 2015; Shurin et al., 2016), а также рассматривается в качестве одного из способов получения водорода путем биофотолиза воды в хлоропласте микроводорослей (Scoma, Toth, 2015).
ОСОБЕННОСТИ МЕТАБОЛИЗМА Chlamydomonas reinhardtii
Одноклеточная зеленая микроводоросль C. reinhardtii представляет собой общепринятую модель для изучения различных физиологических и метаболических процессов, включая биогенез хлоропластов, подвижность жгутиков, таксисы, фотосинтез, сигнальные пути и регуляторные механизмы (Harris, 2001). Выбор данной водоросли в качестве модельного организма обусловлен простотой жизненного цикла, относительной легкостью получения мутантов и высокой способностью адаптироваться к неблагоприятным внешним воздействиям. Жизненный цикл хламидомонады включает вегетативный и генеративный процессы, при этом диплоидная фаза цикла развития клеток наблюдается только на стадии зиготы, остальные стадии, включая зооспоры, взрослые клетки и гаметы, являются гаплоидными. Гаплоидное состояние клеток С. reinhardtii удобно для изучения генетических мутаций, поскольку рецессивные мутации проявляются фенотипически. К настоящему времени хорошо изучен генетический аппарат С. reinhardtii, а проведенные комплексные исследования метаболизма с использованием методов протеомики, транскриптомики и метаболомики (Nguyen et al., 2008; Matthew et al., 2009; Chen et al., 2010; González-Ballester et al., 2010; Schmollinger et al., 2014; Juergens et al., 2015) делают эту водоросль привлекательным объектом для изучения наиболее актуальных проблем, в том числе принципов и механизмов адаптации фототрофных организмов к изменяющимся условиям среды (Rolland et al., 2009; Toepel et al., 2011; Aucoin et al., 2016).
Род Chlamydomonas включает примерно 500 видов, обитающих, в основном, в почве и пресной воде. В естественных условиях основным типом питания у этих водорослей является автотрофный, когда источником углерода служит преимущественно двуокись углерода. Среди видов Chlamydomonas встречаются как облигатные автотрофы, так и миксотрофные организмы, у которых тип питания смешанный, то есть источником углерода может служить как двуокись углерода, так и органический субстрат. Большинство лабораторных штаммов C. reinhardtii могут расти гетеротрофно, используя внеклеточный ацетат в качестве источника углерода. В отличие от высших растений, в хлоропласте этой водоросли полностью сохраняется структурная организация и функциональная активность фотосинтетического аппарата при выращивании культуры в полной темноте на среде с ацетатом. Эта особенность темнового метаболизма позволяет получать культуры с фотосинтетическими мутациями, которые летальны для клеток при выращивании на свету.
При фотоавтотрофных условиях роста клетки хламидомонады запасают световую энергию, как и высшие растения, в реакциях оксигенного фотосинтеза ‒ ключевого анаболического процесса углеродного метаболизма (рис. 1). В клетке C. reinhardtii имеется один хлоропласт, который вытянут вдоль поверхности в форме бокала для увеличения площади поглощения света. Хлоропласт содержит тилакоидные структуры, состоящие из бислойной мембраны и внутримембранного пространства – люмена. В тилакоидных мембранах происходят светозависимые реакции фотосинтеза, в то время как темновые реакции ассимиляции СО2 (цикл Кальвина) протекают в пространстве между внутренней оболочкой хлоропласта и тилакоидами – строме. Тилакоиды формируют стопки гран, связанных между собой тяжами строматических тилакоидов – ламелл. В хлоропласте хламидомонады находится крупный пиреноид, который представляет собой специализированный микрокомпартмент и является частью СО2-концентрирующего механизма и центром карбоксилирования (Wang et al., 2011).
Рис. 1.
Схема ключевых путей углеродного метаболизма в клетке C. reinhardtii (Antal, 2018). ПФП – пентозофосфатный путь, ТАГ – триацилглицериды. Дыхание в митохондрии включает цикл Кребса и дыхательную ЭТЦ. Цифрами обозначено количество атомов углерода в молекуле.
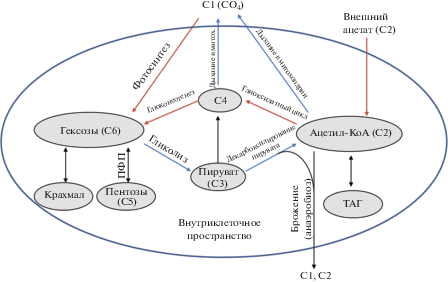
Центральную роль в углеродном метаболизме Chlamydomonas играет ацетилкофермент А (ацетил-КоА) – ключевое соединение для многих биохимических процессов, в том числе цикла Кребса, глиоксилатного цикла, биосинтеза липидов и путей ферментативного брожения (Mus et al., 2007; Johnson, Alric, 2013) (рис. 1). Основными источниками ацетил-КoA в водорослевой клетке являются пируват – конечный продукт гликолиза, а также экзогенный ацетат при миксотрофном или гетеротрофном типе питания. Глиоксилатный цикл катализирует превращение ацетил-КoA в сукцинат, который может быть далее использован для синтеза углеводов в процессе глюконеогенеза, являющегося, по сути, обратным гликолизу процессом (Eastmond, Graham, 2001). Таким образом, в присутствии ацетата в среде синтез крахмала в клетке осуществляется либо полностью (при гетеротрофном типе питания), либо частично (при миксотрофном) за счет реакций глюконеогенеза (Ball et al., 1990).
В клетке C. reinhardtii компоненты гликолиза локализованы, главным образом, в хлоропласте, осуществляя окисление глюкозы до пирувата, сопряженное с генерацией АТФ и НАДН (рис. 1). Пируват, в свою очередь, превращается в ацетил-КoA, который в аэробных условиях метаболизируется в цикле Кребса. Альтернативным гликолизу путем окисления глюкозы у хламидомонады является пентозофосфатный путь, в ходе которого происходит синтез пентоз и образование НАДФН. Метаболиты пентозофосфатного пути являются предшественниками синтеза нуклеотидов, а также могут вступать в реакции гликолиза (Kruger, von Schaewen, 2003).
Одной из особенностей метаболизма Chla-mydomonas является способность адаптироваться к длительному пребыванию в условиях дефицита кислорода. Это происходит, в основном, благодаря активации разнообразных путей ферментативного брожения, поддерживающих гликолиз за счет анаэробного расщепления пирувата на более простые органические соединения, молекулярный водород и двуокись углерода в отсутствие дыхания (Mus et al., 2007; Atteia et al., 2013; Catalanotti et al., 2013; Yang et al., 2015).
РЕГУЛЯЦИЯ ЭЛЕКТРОННОГО ТРАНСПОРТА В ХЛОРОПЛАСТЕ
Образование водорода клетками зеленых микроводорослей на свету неразрывно связано с реакциями фотосинтеза и является, по-видимому, одним из анаэробных механизмов регуляции фотосинтетического электронного транспорта и сопряженных процессов. За последнее десятилетие опубликовано достаточно много исчерпывающих обзоров, посвященных организации и регуляции световых реакций фотосинтеза у высших растений и зеленых микроводорослей (Eberhard et al., 2008; Rochaix, 2011; Alric, 2014; Tikhonov, 2015; Yamori, Shikanai, 2016; Govindjee et al., 2017). Основным путем фотосинтетического электронного транспорта в “световых” или первичных процессах фотосинтеза (ППФ) является т.н. линейный поток электронов от воды к НАДФ+ и далее в цикл Кальвина при участии трех пигмент-белковых комплексов в тилакоидной мембране хлоропласта: ФС1, ФС2, а также цитохромного комплекса b6/f (рис. 2). Фотосистемы обеспечивают поглощение световой энергии, в основном с помощью светособирающих антенных комплексов (ССК), и преобразование поглощенной энергии в энергию восстановленных и окисленных форм переносчиков электронов в реакционном центре. Взаимодействие между тремя типами пигмент-белковых комплексов обеспечивается подвижными переносчиками электронов: пластохиноном (ПХ), пластоцианином (Пц) и Фд.
Рис. 2.
Схема линейного электронного транспорта (широкие прямые стрелки), альтернативных путей транспорта электронов (тонкие прямые стрелки) и транслокации протонов (пунктир) в хлоропласте C. reinhardtii в аэробных условиях.
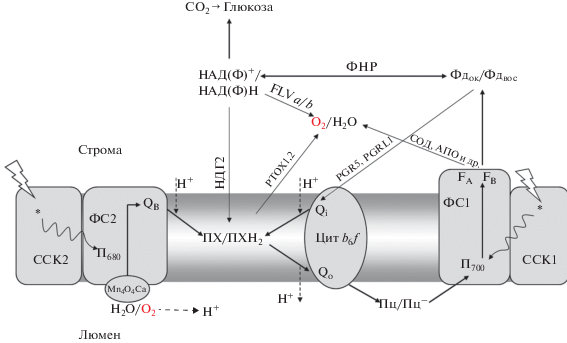
У оксигенных фотосинтетиков принципы линейного фотосинтетического электронного транспорта описываются т.н. Z-схемой, согласно которой последовательность реакций переноса электронов определяется величиной редокс потенциала компонентов цепи (Govindjee et al., 2017). В ФС2 электронный транспорт стартует с донирования электрона димером Хл а (П680) в синглетно возбужденном состоянии в цепь переносчиков на акцепторной стороне фотосистемы, последним из которых является QB – молекула ПХ, нековалентно связанная с QB-сайтом ФС2 (рис. 2). На донорной стороне ФС2 катион-радикал П680+ окисляет марганцевый кластер в кислород-выделяющем комплексе ФС2. При последовательном накоплении четырех положительных зарядов в марганцевом кластере происходит окисление двух молекул воды, образование молекулы кислорода и высвобождение четырех протонов в люмен.
Дважды восстановленная форма QB протонируется из стромы, после чего теряет аффинность к месту связывания в ФС2 и переходит в ПХ пул в виде пластогидрохинона (ПХН2), в то время как новая окисленная молекула занимает ее место. ПХН2 диффундирует внутри билипидного слоя и связывается с Qо-сайтом цитохромного комплекса b6 f, где происходит депротонирование и окисление молекулы. При этом протоны высвобождаются в люмен, один из двух электронов переносится через цепочку кофакторов на Пц, а второй электрон транспортируется на молекулу ПХ, связанную с Qi-сайтом комплекса b6 f. В результате обратного переноса электрона в ПХ пул осуществляется т.н. Q-цикл, назначение которого состоит в увеличении количества протонов, транслоцированных из стромы в люмен, на количество электронов, перенесенных от ФС2 к ФС1.
В ФС1 первичный донор электронов димер хлорофилла а (П700) в возбужденном синглетном состоянии восстанавливает железо-серные кластеры FA и FB при участии нескольких промежуточных переносчиков электронов. В свою очередь, окисленная форма П700 напрямую восстанавливается пластоцианином. На стромальной стороне тилакоидной мембраны молекула Фд взаимодействует с ФС1, окисляя железо-серный кластер FB. Далее электроны переносятся на двухэлектронный акцептор НАДФ+ с помощью фермента Фд-НАДФ редуктазы (ФНР) (рис. 2).
Процессы окисления воды в ФС2 и восстановления/окисления ПХ в цитохромном комплексе сопровождаются протонированием люмена, что приводит к формированию электрохимического градиента в мембране и, соответственно, генерации протон-движущей силы, которая используется в реакциях фосфорилирования АДФ до АТФ при участии хлоропластной АТФ-синтазы ‒ мультипротеинового комплекса, обеспечивающего фотофосфорилирование.
У C. reinhardtii всего лишь несколько компонентов ППФ выявляют структурные отличия от высших растений, включая ССК фотосистем и участие цитохрома c6, наряду с Пц, в переносе электронов от комплекса b6 f к ФС1 (Gorman, Levine, 1966; Drop et al., 2014).
Система регуляции фотосинтеза у растений включает адаптационные изменения на уровне организма, хлоропластов, тилакоидных мембран, а также отдельных компонентов ФСА (Тихонов, 1999; Niyogi, 2000; Peltier et al., 2010; Rochaix, 2011). По своему характеру и функциональной направленности основные регуляторные механизмы в хлоропласте можно разделить на антиоксидантные, фотозащитные, а также те, которые управляют электронными и энергетическими потоками и регулируют ферментативную активность. Однако это разделение достаточно условное, поскольку отдельные регуляторные молекулы или системы могут обладать сразу несколькими функциями. В запуске регуляторных механизмов участвуют два основных показателя состояния фотосинтеза: транстилакоидный рН градиент и редокс состояние переносчиков электронов в тилакоидной мембране и строме хлоропласта. К основным рН-зависимым механизмам относится энергозависимый компонент (qE) нефотохимического тушения (NPQ) и фотосинтетический контроль электронного транспорта через комплекс b6 f, а c редокс состоянием ЭТЦ связаны переход состояний (state transition), тиоредоксиновая система и ПХ-зависимая редокс регуляция экспрессии генов (Tikhonov, 2013; Tikhonov, 2015).
Механизмы регуляции первичных процессов фотосинтеза можно условно разделить на “медленные” и “быстрые” (Рубин, Кренделева, 2003). Медленная регуляция включает модификацию структуры хлоропласта, количества и функциональных свойств фотосинтетических компонентов вследствие синтеза белков de novo. Этот тип регуляции обеспечивает способность организма адаптироваться к изменениям внешней среды путем управления экспрессией генов, содержанием и активностью ферментов или целых метаболических путей, однако эти изменения не закрепляются на генетическом уровне. Структурная перестройка антенных комплексов ФС1 и 2 является важным адаптационным механизмом, в котором изменение способности поглощать свет является следствием изменения состава и организации субъединиц антенны (Drozak, Romanowska, 2006; Eberhard et al., 2008).
Быстрые регуляторные механизмы обеспечивают изменения свойств компонентов ФСА в секундном или минутном диапазоне без синтеза белка. Эти процессы связаны, в основном, с посттрансляционной модификацией белков в результате: 1) протонирования/депротонирования аминокислот в зависимости от величины рН стромы и люмена; 2) обратимого образования дисульфидных связей между тиоловыми группами цистеина при участии белка тиоредоксина; и 3) фосфорилирования/дефосфорилирования аминокислот киназами/фосфатазами. Этот тип регуляции наиболее актуален при световой индукции фотосинтеза, а также в условиях переменной и избыточной освещенности. Наиболее важными “быстрыми” процессами являются NPQ, переход состояний, фотосинтетический контроль и регуляция ферментативной активности при участии тиоредоксиновой системы (Finazzi et al., 2002; Peers et al., 2009; Shinopoulos, Brudvig, 2012; Tikhonov, 2015).
Фотозащита ФС2 обеспечивается, в основном, за счет регуляции диссипации избыточной энергии в ССК2 (Бухов, 2004; Joliot, Finazzi, 2010; Tikhonov, 2013). Изменения NPQ обусловлены, главным образом, рН-зависимой регуляцией ксантофиллового цикла и конформационными переходами специализированных белков (Johnson, Ruban, 2011; Fan et al., 2015). В хлоропластах высших растений и зеленых водорослей основной ксантофилловый цикл включает превращение фотосинтетического ксантофилла виолаксантина в фотопротекторный ксантофилл зеаксантин (Horton, 2014). Также для эффективного нефотохимического тушения у высших растений необходим PsbS белок, рН-зависимые изменения которого влияют на функциональную связь между коровым комплексом ФС2 и ССК2. У зеленых водорослей важную роль в NPQ играют не PsbS белки, а пигментсодержащие стрессовые белки семейства LHCSR (Light-Harvesting Complex Stress-Related) (Bonente et al., 2011), в частности, белок LHCSR3 (Finazzi et al., 2006; Tibiletti et al., 2016).
Одним из важных механизмов регуляции распределения световой энергии между ФС1 и ФС2 является фосфорилирование белков ССК2 (Tikkanen et al., 2011; Tikkanen, Aro, 2012). Восстановление пула хинонов на свету активирует CCК2-протеинкиназу посредством взаимодействия ПХН2 с Qo-сайтом комплекса b6 f (Vener et al., 1997; Zito et al., 1999). После фосфорилирования антенны CСК2 теряют связь с центрами ФС2, агрегируют или мигрируют в стромальную область тилакоидов, где происходит их взаимодействие с ФС1. Таким образом, мембраны переходят из т.н. состояния 1, в котором ССК2 связаны с ФС2, в состояние 2, в котором часть ССК2 теряет связь с ФС2. Обратный переход из состояния 2 в состояние 1 обусловлен активностью хлоропластной фосфатазы (PPH1/TAP38), которая катализирует дефосфорилирование ССК2, после чего антенный комплекс восстанавливает способность к взаимодействию с ФС2. Известно, что у высших растений количество комплексов ССК2, вовлеченных в переход состояний, не превышает 20%, в то время как у зеленых микроводорослей этот показатель достигает 80% (Allen, 1992; Delosme et al., 1996), что указывает на более важную адаптационную роль этого процесса у микроводорослей. В отличие от высших растений, у микроводорослей переход состояний играет фотозащитную роль, например, при адаптации к условиям дефицита кислорода и ATФ (Cardol et al., 2009).
При снижении доступности двуокиси углерода и других стрессовых воздействиях в хлоропластах усиливаются альтернативные пути транспорта электронов, что связано с переключением части основного (линейного) фотосинтетического потока электронов на молекулярный кислород в качестве конечного акцептора, либо на циклический режим функционирования (Кувыкин и соавт., 2008; Curien et al., 2016) (рис. 2). Активация альтернативных путей может рассматриваться как “быстрый” редокс зависимый регуляторный механизм, хотя этот процесс также зависит от экспрессии соответствующих генов.
Циклический электронный транспорт вокруг ФС1 (ЦЭТ) возвращает электроны от акцепторов в строме в ПХ пул как минимум, по двум основным путям (Yamamoto et al., 2011; Tikhonov, 2015). Первый путь участвует в прямом переносе электронов с Фд в ПХ пул при участии белков PGR5 и PGRL1 (Hertle et al., 2013; Labs et al., 2016), в то время как ключевой реакцией второго пути является перенос электронов с НАД(Ф)Н в ПХ пул при участии фермента НАДН дегидрогеназы (НДГ) (Nishikawa et al., 2012, Yamori, Shikanai, 2016) (рис. 2). В клетке хламидомонады необходимым компонентом первого пути является PGRL1, а во втором пути участвует НДГ второго типа, активность которой не сопряжена с протонированием люмена (Jans et al., 2008; Desplats et al., 2009; Iwai et al., 2010). ЦЭТ является доминирующим путем электронного транспорта на начальных стадиях индукции фотосинтеза и в условиях стресса, когда линейный транспорт электронов снижен из-за неактивного состояния цикла Кальвина, недостатка СО2 или О2. Основная физиологическая роль ЦЭТ состоит в регуляции соотношения между АТФ и НАДФН, а также в активации рН-зависимого NPQ и фотосинтетического контроля (Shikanai, 2016; Shikanai, Yamamoto 2017).
Псевдоциклический транспорт электронов в хлоропласте включает образование супероксидного радикала в ФС1 (${\text{O}}_{2}^{ - }$) на свету и пути его безопасного восстановления до воды с помощью ферментативной антиоксидантной системы, включающей супероксиддисмутазу (СОД), аскорбатпероксидазу (АПО) и другие ферменты (Asada, 1999, 2006) (рис. 2). Очевидно, что псевдоциклический путь представляет собой безопасный способ утилизации электронов из фотосинтетической ЭТЦ при низкой скорости фиксации СО2. Для хламидомонады характерно значительное поглощение кислорода в хлоропласте на свету (до 80%), в основном, за счет псевдоциклического транспорта (Liran et al., 2016). Важной отличительной особенностью зеленых микроводорослей является существование дополнительного псевдоциклического пути бактериального типа, осуществляющего безопасное восстановление кислорода до воды в хлоропласте при участии железосодержащих флавопротеинов FlvA и FlvB, использующих в качестве субстрата НАДФН (Peltier et al., 2010; Dang et al., 2014) (рис. 2).
У высших растений пластидная терминальная оксидаза (PTOX) принимает участие в синтезе каротиноидов и биогенезе хлоропластов (Okegawa et al., 2008). Согласно традиционным представлениям, PTOX располагается со стороны стромы, не формируя комплексы с другими компонентами мембраны, и принимает участие в окислении ПХ пула (Bennoun, 1982; Nixon, 2000; Joët et al., 2002) (рис. 2). В хлоропласте C. reinhardtii обнаружены две терминальные оксидазы (PTOX1 и РТОХ2), которые не участвуют в синтезе каротиноидов, однако способствуют адаптации клетки к восстановительным условиям (Houille-Vernes et al., 2011).
Необходимо отметить, что многие из описанных выше быстрых регуляторных механизмов эффективно функционируют не только в аэробных, но и в анаэробных условиях на свету. В частности, переход состояний, ЦЭТ и NPQ помогают водорослевой клетке адаптироваться к условиям высокой восстановленности ЭТЦ и энергетического голодания при дефиците кислорода.
МЕХАНИЗМЫ И РОЛЬ ОБРАЗОВАНИЯ ВОДОРОДА У ЗЕЛЕНЫХ МИКРОВОДОРОСЛЕЙ
Особенности анаэробного метаболизма
Метаболизм оксигенных фототрофных организмов адаптирован к аэробным условиям существования. Однако гипоксия довольно широко распространена в некоторых водных и почвенных средах обитания микроводорослей и цианобактерий, хотя обычно носит временный характер. Дефицит кислорода может быть результатом действия ряда факторов окружающей среды, в том числе недостаточной освещенности, ограниченной аэрации и высокой активности гетеротрофных микроорганизмов. Цветение водорослей или цианобактерий, образование клеточных пленок и локальных скоплений фитопланктона может также приводить к созданию микроаэробных или анаэробных условий даже в дневное время.
В естественной среде микроводоросли наиболее часто переходят в анаэробиоз в ночное время суток. В этих условиях клетки испытывают серьезный дефицит энергии из-за одновременного прекращения фото- и окислительного фосфорилирования. Так, аэробный темновой метаболизм позволяет эффективно генерировать энергию при наличии запасов углеводов, поскольку при полном окислении молекулы глюкозы до двуокиси углерода и воды образуется более 30 молекул АТФ. В то же время в анаэробных условиях дыхание блокировано, поэтому происходит неполное окисление глюкозы до пирувата в процессе гликолиза, которое не требует присутствия кислорода; при этом образуется только 2 молекулы АТФ. Гликолиз сопровождается генерацией НАДН, который необходимо реокислять для поддержания процесса. Кроме того, метаболизация пирувата через цикл Кребса затруднена в отсутствие дыхания. Таким образом, утилизация продуктов гликолиза является центральной проблемой анаэробного метаболизма у водорослей.
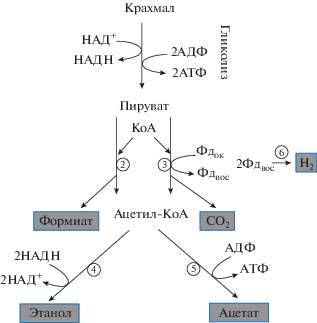
Хламидомонада широко распространена во влажных почвах, где клетки часто подвергаются воздействию анаэробных условий, что объясняет наличие специальных путей анаэробного метаболизма бактериального типа у этой микроводоросли. Полученные в последние годы результаты геномных, транскриптомных и биохимических исследований значительно улучшили понимание особенностей анаэробного метаболизма у этого организма (Dubini et al., 2009; Terashima et al., 2010; Catalanotti et al., 2013; Subramanian et al., 2014). Для решения проблемы утилизации продуктов гликолиза в клетках хламидомонады в анаэробных условиях активируется целый ряд путей брожения, позволяющих расщеплять пируват на более простые органические соединения, молекулярный водород и двуокись углерода, которые выводятся из клетки в окружающую среду (Atteia et al., 2013, Catalanotti et al., 2013, Yang et al., 2015). У С. reinhardtii реакции брожения связаны с синтезом АТФ и/или окислением НАДН, что позволяет также генерировать дополнительную энергию и утилизировать избыток восстановителя, то есть гибко регулировать баланс между энергетическим обеспечением и редокс состоянием переносчиков электронов (Atteia et al., 2013, Catalanotti et al., 2013). Ферменты брожения в клетке С. reinhardtii участвуют в образовании ацетата, этанола, формиата и СО2 в качестве основных конечных продуктов, а такие вещества как глицерин, лактат, сукцинат и молекулярный водород образуются в меньших количествах. На рис. 3 показаны основные реакции брожения в клетке C. reinhardtii. Превращение пирувата в ацетил-КоА обеспечивается двумя параллельными реакциями, которые катализируются пируват-формиат лиазой (реакция 2) и пируват-ферредоксин оксидоредуктазой (реакция 3), и приводят также к образованию сопутствующих продуктов: формиата и СО2. Реакция 3 сопровождается восстановлением Фд. В свою очередь, ацетил-КоА может восстанавливаться до этанола при последовательном участии ацетальдегиддегидрогеназы и алкогольдегидрогеназы (реакция 4), используя 2 молекулы НАДН в качестве донора электронов. Альтернативным путем метаболизации ацетил-КоА является его превращение в ацетат в результате активности ферментов фосфат-ацетилтрансферазы и ацетаткиназы (реакция 5). При этом энергия макроэргической связи молекулы ацетил-КоА используется для фосфорилирования одной молекулы АДФ.
Образование водорода в темноте и на свету
Образование водорода в клетке С. reinhardtii в анаэробных условиях в темноте происходит, в основном, при последовательном участии ферментов пируват-Фд оксидоредуктазы и FeFe-гидрогеназы, то есть является частью процесса брожения. Как отмечалось в предыдущем разделе, пируват-Фд оксидоредуктаза катализирует превращение молекулы пирувата в ацетил-КоА, которое сопровождается образованием одной молекулы СО2 и восстановлением двух молекул Фд в хлоропласте; последний может донировать электроны на гидрогеназу (Noth et al., 2013) (см. реакции 3 и 6 на рис. 3). Дополнительный путь выделения водорода в темноте может быть связан с реакцией обратимого переноса электронов с Фд на НАДФ+, катализируемой ФНР (рис. 2). Равновесие в этой реакции сильно смещено в направлении восстановления НАДФ+ из-за существенной разницы между редокс потенциалами Фд растительного типа (‒400…−450 мВ) и НАДФ (−350 мВ). Но в условиях, когда концентрация НАДФН в хлоропласте значительно превышает уровень восстановленного Фд, в том числе при анаэробной темновой инкубации, возрастает вероятность обратной реакции восстановления Фд от НАД(Ф)Н.
У мутанта C. reinhardii СС-5128 hydEF-1 mt+ отсутствует гидрогеназная активность из-за мутации гена HydEF (Posewitz et al., 2005). Данный мутант и соответствующий ему родительский штамм были использованы для изучения физиологической роли гидрогеназы в темновом анаэробном метаболизме (Dubini et al., 2009). Сравнение ряда параметров культуры между родительским и мутантным штаммом выявило снижение ферментативной продукции СО2 (реакция 3 на рис. 3) и увеличение образования сукцината в клетках hydEF. При этом отсутствие гидрогеназной активности не приводило к ухудшению физиологического состояния культуры, по-видимому, в результате метаболической компенсации, когда нарушение одного из путей брожения приводит к изменению баланса между остальными путями. В целом продукция водорода в темновых анаэробных условиях низкая и не оказывает значительного воздействия на адаптацию клетки к дефициту кислорода.
При переносе водорослевой культуры из темновых анаэробных условий на свет выход водорода возрастает на несколько порядков по сравнению с темновым уровнем, однако эти изменения носят транзиторный характер, полностью затухая в течение нескольких минут. Данный феномен был открыт более 70 лет тому назад на клетках Scenedesmus (Gaffron, Rubin, 1942), послужив первым доказательством фотообразования водорода у эукариот. Резкий выброс водорода в этих условиях обусловлен быстрой индукцией фотосинтетического транспорта электронов и восстановлением PetF и НАДФ+ в хлоропласте (Cournac et al., 2002) в течение периода времени, пока ферменты цикла Кальвина находятся в инактивированном состоянии (Michelet et al., 2013). Активация процесса фиксации СО2 на свету зависит от ряда факторов, включающих рН стромы, редокс состояние тиоредоксина, содержание АТФ и др. (Werdan et al., 1975). Из-за неактивного состояния цикла Кальвина на начальной стадии индукции фотосинтеза возникает проблема остановки фотосинтетического электронного транспорта, что, в свою очередь, тормозит процесс активации цикла Кальвина. В аэробных условиях эта проблема решается за счет перенаправления части электронов из фотосинтетической цепи на молекулярный кислород по альтернативным путям, как описано в предыдущих разделах (рис. 2). Однако в условиях дефицита кислорода, роль альтернативного акцептора электронов у зеленых микроводорослей могут выполнять протоны. Таким образом, в момент перехода культуры водорослей из темновых анаэробных условий на свет избыток электронов в фотосинтетической цепи утилизируется за счет продукции водорода, а гидрогеназа играет роль аналогичную псевдоциклическому транспорту электронов в хлоропласте в аэробных условиях. Более того, образование водорода в хлоропласте сопровождается подщелачиванием стромы в результате утилизации протонов, что важно для активации Рубиско – ключевого фермента цикла Кальвина, активность которого низка при нейтральных значениях рН, однако возрастает при более высоком рН (Mott, Berry, 1986). Выход водорода на свету быстро снижается вследствие активации темновых реакций и генерации кислорода в ФС2, который ингибирует гидрогеназную активность. Таким образом, физиологическая роль гидрогеназы при переходе “темнота‒свет” связана с утилизацией электронов на начальной стадии индукции фотосинтеза. Действительно, исследование роли гидрогеназной реакции в индукции фотосинтеза с использованием мутанта C. reinhardtii hydEF показали, что наличие гидрогеназы способствует более быстрой активации реакций фиксации СО2 на свету после темновой анаэробной инкубации (Ghysels et al., 2013). Необходимо отметить, что авторами данной публикации также показано важное участие перехода состояний в индукции фотосинтеза. Так, анаэробные условия индуцируют переход в состояние 2 в клетках зеленых микроводорослей, которое способствует высокой активности ЦЭТ (Cardol et al., 2009). В свою очередь, ЦЭТ поддерживает фотофосфорилирование, обеспечивая АТФ для активации цикла Кальвина. При этом способность осуществлять переход состояний или присутствие гидрогеназной активности в клетке не являются строго необходимыми для активации процесса фиксации СО2, однако совместное участие этих механизмов значительно ускоряет процесс.
Импульсный режим освещения микроводорослей позволяет поддерживать высокие значения фотопродукции водорода на вспышку в течение продолжительного времени. Так, было показано, что освещение культуры C. reinhardtii последовательностью вспышек насыщающего света длительностью 1 с, разделенных более продолжительными темновыми интервалами (9 с), сопровождается интенсивным фотообразованием водорода в течение нескольких суток (Kosourov et al., 2018). Данные результаты позволяют сделать предположение о возможной фотозащитной роли гидрогеназы в качестве акцептора электронов в хлоропласте в условиях переменной освещенности, по аналогии с ролью псевдоциклических путей электронного транспорта в аэробных условиях. Однако данное предположение не имеет экспериментального подтверждения на данный момент.
Ранее было показано, что фотообразование водорода может происходить продолжительно, в течение нескольких недель, при постоянном освещении клеток C. reinhardtii, культивируемых на среде с ацетатом, светом низкой интенсивности (около 10 мкмоль фотонов м–2 с–1) (Scoma et al., 2014). При данной освещенности скорость фотообразования кислорода находится ниже уровня дыхания, поскольку компенсаторная точка фотосинтеза у этой водоросли соответствует значениям в интервале от 30 до 70 мкмоль фотонов м–2 с–1 в зависимости от условий культивирования. Вследствие недостаточной освещенности в клетках возникает дефицит кислорода и активируется гидрогеназа. В этих условиях электроны для синтеза водорода поступают, в основном, из ФС2 (Scoma et al., 2014). Образующийся в ФС2 кислород эффективно утилизируется в процессах дыхания, а экзогенный ацетат служит основным субстратом для реакций митохондриального дыхания. На низком свету внутренние запасы крахмала в клетках незначительны, поэтому катаболизм углеводов оказывает слабое влияние на фотообразование водорода. Скорость выделения водорода таким путем незначительна, а возможная физиологическая роль не изучена, хотя условия дефицита освещенности весьма актуальны для природного фитопланктона.
Другой метод световой индукции длительного фотообразования водорода клетками C. reinhardtii был предложен Nagy и соавт. (2018). Его отличительной особенностью является искусственное субстратное лимитирование цикла Кальвина за счет удаления СО2 из газовой фазы, отсутствие экзогенного ацетата, т.е. автотрофный тип питания, и высокая интенсивность света ‒ 3000 мкмоль фотонов м–2 с–1. Отсутствие СО2 в газовой фазе фотореактора способствует переключению фотосинтетического электронного транспорта на функционирование в режиме альтернативного потока на кислород, что приводит к снижению уровня кислорода в клетке. Дополнительно этому способствует высокая интенсивность света, при которой фотосинтетическая цепь, включая ПХ пул, почти полностью переходит в восстановленное состояние, что снижает скорость образования кислорода в ФС2. Эти условия приводят к значительному снижению уровня кислорода в клетке и активации гидрогеназы. Фотообразование водорода по данному протоколу представляет собой “утечку” электронов из фотосинтетической цепи при доминировании путей электронного транспорта на кислород. Предложенный метод позволяет поддерживать достаточно высокую скорость продукции водорода в течение нескольких дней, однако оценка физиологической роли гидрогеназной реакции в этих условиях не представляется целесообразной, поскольку такие условия априори отсутствуют в естественной среде.
Продукция водорода при минеральном голодании
Наиболее изученным подходом для поддержания длительной фотопродукции водорода является депривация водорослевых клеток по основным элементам минерального питания (Saroussi et al., 2017; Antal et al., 2018). В частности, дефицит серы широко используется в качестве метода, позволяющего регулировать углеродный метаболизм клетки таким образом, чтобы индуцировать самопроизвольный переход культуры в анаэробные условия и последующее продолжительное образование водорода на свету. Механизмы, лежащие в основе этого явления, изучались с начала 2000-х годов, в основном, на примере C. reinhardtii. В соответствии с предложенным ранее протоколом получения голодающей по сере культуры (Melis et al., 2000) сначала необходимо перенести клетки с полной трис-ацетат-фосфатной среды на модифицированную среду, в которой сульфат заменен на хлорид. Затем культуру помещают в фотобиореактор закрытого типа (без доступа атмосферного воздуха) и инкубируют на постоянном свету. В этих условиях микроводоросли последовательно проходят через аэробную и анаэробную стадии голодания. Начальная (аэробная) стадия продолжительностью примерно одни сутки характеризуется резким снижением скорости деления клеток, скорости фотосинтеза, а также интенсивным поглощением ацетата из среды и накоплением крахмала, содержание которого в хлоропласте может возрастать в 10‒20 раз. Синтез крахмала усиливается в результате транзиторной апрегуляции реакций поглощения внешнего ацетата и глюконеогенеза (Toepel et al., 2013). Очевидно, что в основе самопроизвольного перехода культуры в анаэробные условия лежит инактивация фотосинтетических реакций в голодающих клетках. Необходимо отметить, что наиболее чувствительной частью фотосинтетического аппарата к дефициту серы являются реакции цикла Кальвина, ингибирование которых протекает быстрее, чем реакций фотосинтетического электронного транспорта (Zhang et al., 2002). Преимущественная инактивация темновых стадий фотосинтеза приводит к усилению альтернативных потоков электронов на кислород в хлоропласте, что приводит к ингибированию выделения кислорода клетками даже при достаточно высокой активности ФС2. В отличие от фотосинтеза, реакции дыхательной цепи в митохондриях сохраняют высокую активность в условиях дефицита серы (Melis et al., 2000), а скорость дыхания возрастает из-за избытка восстановительных эквивалентов (Antal et al., 2006). Инактивация фотосинтетических реакций при высокой скорости дыхания является основной причиной перехода голодающей культуры в анаэробиоз.
После полного поглощения кислорода из среды в клетках активируются пути анаэробного метаболизма, включая брожение и фотообразование водорода (рис. 4). Продукция водорода в суспензионной культуре C. reinhardtii продолжается несколько дней до гибели клеток и сопровождается постепенной деградацией крахмала и накоплением таких продуктов брожения, как ацетат, этанол, формиат, лактат, СО2 и др. Необходимо отметить, что феномен фотопродукции водорода является результатом синергического действия двух стрессовых факторов: дефицита серы и кислорода.
Рис. 4.
Пути электронного транспорта в хлоропласте C. reinhardtii во время анаэробной стадии минерального голодания. Доминирующие пути обозначены утолщенными прямыми стрелками. Цифрами отмечены отдельные реакции или совокупность реакций переноса электронов.
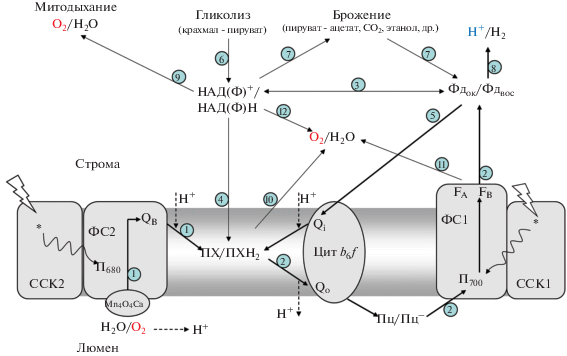
В момент перехода голодающей культуры в анаэробные условия цикл Кальвина полностью ингибирован, а кислород не может быть использован в качестве конечного акцептора электронов, поэтому происходит практически полное восстановление переносчиков фотосинтетической и дыхательной цепей. Действительно, в момент, когда содержание кислорода в среде становится нулевым, наблюдается быстрая инактивация ФС2 (Antal et al., 2003), обусловленная восстановлением пула ПХ, и, соответственно, блокировкой электронного транспорта в ФС2. Восстановление переносчиков электронов в клетке приводит к снижению скоростей фото- и окислительного фосфорилирования. Активация гидрогеназы в этих условиях способствует реокислению фотосинтетической цепи, реактивации ФС2 и росту скорости образования кислорода в клетке (Antal et al., 2003).
Необходимо отметить, что в результате переноса электронов от ФС2 на гидрогеназу в хлоропласте голодающей клетки осуществляется биофотолиз воды: 2Н2О → 2Н2 + О2. При этом водород выделяется из клетки во внешнюю среду, а образованный кислород быстро восстанавливается в процессах дыхания и альтернативного транспорта электронов в хлоропласте (пути 9, 10, 11 и 12 на рис. 4). Несмотря на то, что фотообразование водорода связано, в основном, с активностью ФС2, которая поставляет около 80% электронов для продукции водорода (пути 1, 2 и 8 на рис. 4), скорость данного процесса ограничена не столько активностью ФС2, сколько скоростью утилизации фотосинтетически образованного кислорода в клетке. Так, в работе (Volgusheva et al., 2013) было показано, что высокая скорость утилизации кислорода в голодающих клетках способствует увеличению выхода водорода. Как известно, ассимиляция ацетата из среды подавляется на анаэробной стадии инкубации без серы (Tsygankov et al., 2002), поэтому дыхание поддерживается, в основном, за счет генерации НАДН в реакциях гликолиза (пути 6 и 9 на рис. 4). Необходимо отметить, что между хлоропластом и митохондриями в растительной клетке существует редокс равновесие благодаря малат-оксалоацетатному шунту, поэтому восстановитель, генерируемый в строме хлоропласта, может перераспределяться в митохондрии. НАДН в строме хлоропласта также восстанавливает фотосинтетическую цепь на уровне ПХ пула, внося минорный вклад в фотопродукцию водорода (пути 6, 4, 2 и 8 на рис. 4). Таким образом, следующие тесно взаимосвязанные процессы участвуют в регуляции окислительно-восстановительного и энергетического баланса в клетке на анаэробной стадии серного голодания: фотообразование водорода и кислорода в хлоропласте, утилизация кислорода и деградация крахмала. Определенный вклад в данный баланс вносят также реакции брожения, использующие НАД и Фд в качестве доноров и акцепторов электронов.
Было показано, что на анаэробной стадии голодания существует тесная связь между фотообразованием водорода, переходом состояний, ЦЭТ, дыханием и энергизацией тилакоидных мембран. В частности, ЦЭТ оказывает ингибиторное действие на фотопродукцию водорода, свидетельствуя о конкурентных отношениях с гидрогеназой за восстановленный Фд (пути 5 и 8 на рис. 4) (Antal et al., 2009).
Недостаток таких элементов как азот, фосфор или магний оказывает схожее с дефицитом серы воздействие на клеточный метаболизм, характеризующийся инактивацией фотосинтеза, накоплением крахмала и переходом культуры в анаэробиоз с последующим продолжительным выделением водорода на свету (Batyrova et al., 2012; Philipps et al., 2012; Volgusheva et al., 2015). Данный факт указывает на наличие общих механизмов адаптации зеленых микроводорослей к дефициту основных макроэлементов. Функциональное значение фотообразования водорода в процессе адаптации к минеральному голоданию недостаточно изучено, однако такие исследования проводятся в данное время. В частности, в нашей лаборатории получены данные о снижении жизнеспособности культуры мутанта C. reinhardtii hydEF в условиях серного голодания по сравнению с родительским штаммом (в печати). Физиологическая роль гидрогеназы в голодающей клетке может быть обусловлена следующими факторами. Во-первых, активация гидрогеназы на анаэробной стадии минерального голодания поддерживает фотосинтетический электронный транспорт и фотофосфорилирование. Во-вторых, индуцированная гидрогеназой реактивация ФС2 приводит к увеличению скорости фотообразования кислорода, который утилизируется в реакциях клеточного дыхания, усиливая, таким образом, электронный транспорт в дыхательной цепи митохондрий и поддерживая другие пути аэробного метаболизма. В-третьих, наличие ФС2-независимого пути продукции водорода предполагает возможную регуляцию гликолиза за счет утилизации одного из его продуктов ‒ НАДН. Необходимо также учитывать, что продукция водорода сопровождается депротонированием стромы хлоропласта и, вероятно, изменением баланса между разными путями брожения. В целом, способность зеленых микроводорослей выделять водород на свету в условиях дефицита макроэлементов может представлять собой механизм адаптации к высоким восстановительным условиям, возникающим при переходе голодающей клетки в анаэробиоз, за счет регуляции продукции кислорода, фосфорилирования и гликолиза.
ЗАКЛЮЧЕНИЕ
На данный момент физиологическая роль гидрогеназной реакции у зеленых микроводорослей все еще остается слабоизученной стороной феномена фотообразования водорода, исследования которого обусловлены, в первую очередь, интересом к биологическому способу получения водорода. Для понимания этой роли важно принимать во внимание тот факт, что существенное образование водорода возможно только в связи с фотосинтетическим электронным транспортом. Поскольку водорослевая гидрогеназа сохранила характерную для FeFe-гидрогеназ высокую чувствительность к кислороду, то это указывает на ее участие в регуляции фотосинтетического электронного транспорта и сопряженных процессов в анаэробных или микроаэробных условиях. Кроме дефицита кислорода, для эффективного фотообразования водорода необходима низкая скорость цикла Кальвина – основного акцептора восстановительных эквивалентов в хлоропласте на свету, которая наблюдается на начальном этапе индукции фотосинтеза, при нехватке СО2 или при действии стрессовых факторов различной природы. К последним относится недостаток элементов минерального питания, который является одним из наиболее актуальных стрессов для фитопланктона. К настоящему времени достоверно подтверждена физиологическая роль гидрогеназы в условиях индукции фотосинтеза после темновой анаэробной инкубации, а также проводятся исследования в данном направлении на голодающих по макроэлементам культурах C. reinhardtii. В целом, водорослевая гидрогеназа выполняет функцию, аналогичную реакции Мелера в аэробных условиях, оптимизируя редокс состояние электрон-транспортных цепей и рН стромы, а также оказывая влияние на процессы гликолиза и брожения. Для более глубокого понимания значимости фотообразования водорода у зеленых микроводорослей необходимо не только проведение лабораторных исследований в искусственно созданных условиях, но и определение условий, характерных для этого процесса в естественной среде обитания. В скором времени можно ожидать развития исследований в этом направлении в связи с появлением высокочувствительных сенсоров водорода, позволяющих проводить измерения содержания водорода in situ.
Список литературы
Белякова Г.А., Дъяков Ю.Т., Тарасов К.Л. Ботаника: в 4 т. Т. 1‒2. Водоросли и грибы: учебник – 2-е изд., стер. М.: Академия, 2010. 320 с.
Бухов Н.Г. Динамическая световая регуляция фотосинтеза // Физиология растений. 2004. Т. 51. С. 825–837.
Bukhov N.G. Dynamic light regulation of photosynthesis (a review) // Russ. J. Plant Physiol. 2004. V. 51. P. 742‒753.
Заварзин Г.А., Колотилова Н.Н. Введение в природоведческую микробиологию. М.: Изд. дом “Университет”, 2001. 255 с.
Кувыкин И.В., Вершубский А.В., Птушенко В.В., Тихонов А.Н. Кислород как альтернативный акцептор в фотосинтетической цепи электронного транспорта С3‑растений // Биохимия. 2008. Т. 73. С. 1329–1344.
Kuvykin I.V., Vershubskii A.V., Ptushenko V.V., Tikhonov A.N. Oxygen as an alternative electron acceptor in the photosynthetic electron transport chain of C3 plants // Biochemistry (Moscow). 2008. V. 73. P. 1063‒1075.
Рубин А.Б., Кренделева Т.Е. Регуляция первичных процессов фотосинтеза // Успехи биол. химии. 2003. Т. 43. С. 225‒266.
Тихонов А.Н. Регуляция световых и темновых стадий фотосинтеза // Соросовский Образовательный Журнал. 1999. Т. 11. С. 8–15.
Цыганков А.А. Метаболизм водорода у микроводорослей // Современные проблемы фотосинтеза / Под ред. Аллахвердиева С.И.,. Рубина А.Б, Шувалова В.А.. Ижевск: Институт компьютерных исследований, 2014. Т. 1. С. 461–487.
Allen J.F. Protein phosphorylation in regulation of photosynthesis // Biochim. Biophys. Acta. 1992. V. 1098. P. 275–335.
Alric J. Redox and ATP control of photosynthetic cyclic electron flow in Chlamydomonas reinhardtii: (II) involvement of the PGR5-PGRL1 pathway under anaerobic conditions // Biochim. Biophys. Acta. 2014. V. 1837. P. 825–834.
Anderson J.M., Chow W.S., De Las Rivas J. Dynamic flexibility in the structure and function of photosystem II in higher plant thylakoid membranes: the grana enigma // Photosynth. Res. 2008. V. 98. P. 575–587.
Antal T., Konyukhov I., Volgusheva A., Plyusnina T., Khruschev S., Kukarskikh G., Goryachev S., Rubin A. A chlorophyll fluorescence induction and relaxation system for the continuous monitoring of photosynthetic capacity in photobioreactors // Physiol. Plant. 2018. V. 165. P. 476‒486.
Antal T.K. The metabolic acclimation of Chlamydomonas reinhardtii to depletion of essential nutrients: application for hydrogen production // Microalgal Hydrogen Production: Achievements and Perspectives / Eds. Seibert M., Torzillo G. Croydon. UK: CPI Group Ltd., 2018. V. 16. P. 235‒264.
Antal T.K., Kovalenko I.B., Rubin A.B., Tyystjärvi E. Photosynthesis-related quantities for education and modeling // Photosynth. Res. 2013. V. 117. P. 1–30.
Antal T.K., Krendeleva T.E., Laurinavichene T.V., Makarova V.V., Ghirardi M.L., Rubin A.B., Tsygankov A.A., Seibert M. The dependence of algal H2 production on Photosystem II and O2 consumption activities in sulfur deprived Chlamydomonas reinhardtii cells // Biochim. Biophys. Acta. 2003. V. 1607. P. 153–160.
Antal T.K., Volgusheva A.A., Kukarskih G.P., Bulychev A.A., Krendeleva T.E., Rubin A.B. Effects of sulfur limitation on the PS II functioning in Chlamydomonas reinhardtii as probed by the chlorophyll a fluorescence // Physiol. Plantarum. 2006. V. 128. P. 360‒367.
Antal T.K., Volgusheva A.A., Kukarskih G.P., Krendeleva T.E., Rubin A.B. Relationships between H2 photoproduction and different electron transport pathways in sulfur-deprived Chlamydomonas reinhardtii // Int. J. Hydrogen Energy. 2009. V. 34. P. 9087–9094.
Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions // Plant. Physiol. 2006. V. 141. P. 391–396.
Asada K. The water-water cycle in chloroplasts: scavenging of active oxygen and dissipation of excess photons // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1999. V. 50. P. 601−639.
Atteia A., van Lis R., Tielens A.G., Martin W.F. Anaerobic energy metabolism in unicellular photosynthetic eukaryotes // Biochim. Biophys. Acta. 2013. V. 1827. P. 210–218.
Aucoin H.R., Gardner J., Boyle N.R. Omics in Chlamydomonas for Biofuel Production // Subcell. Biochem. 2016. V. 86. P. 447‒469.
Badger M.R., von Caemmerer S., Ruuska S., Nakano H. Electron flow to oxygen in higher plants and algae: rates and control of direct photoreduction (Mehler reaction) and rubisco oxygenase // Phil. Trans. R. Soc. London B. 2000. V. 355 P. 1433–1446.
Ball S.G., Dirick L., Decq A., Martiat J.-C., Matagne R. Physiology of starch storage in the monocellular alga Chlamydomonas reinhardtii // Plant Sci. 1990. V. 66. P. 1–9.
Batyrova K., Tsygankov A., Kosourov S. Sustained hydrogen photoproduction by phosphorus-deprived Chlamydomonas reinhardtii cultures // Int. J. Hydrogen Energy. 2012. V. 37. P. 8834–8839.
Bennoun P. Evidence for a respiratory chain in the chloroplast // Proc. Natl. Acad. Sci. USA. 1982. V. 79. P. 4352–4356.
Bonente G., Formighieri C., Mantelli M., Catalanotti C., Giuliano G., Morosinotto T., Bassi R. Mutagenesis and phenotypic selection as a strategy toward domestication of Chlamydomonas reinhardtii strains for improved performance in photobioreactors // Photosys. Res. 2011. V. 108. P. 107‒120.
Cardol P., Alric J., Girard-Bascou J., Franck F., Wollman F.A., Finazzi G. Impaired respiration discloses the physiological significance of state transitions in Chlamydomonas // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 15979–15984.
Catalanotti C., Yang W., Posewitz M.C., Grossman A.R. Fermentation metabolism and its evolution in algae // Front. Plant Sci. 2013. V. 4. P. 150.
Chen M., Zhao L., Sun Y.L., Cui S.X., Zhang L.F., Yang B., Wang J., Kuang T.Y., Huang F. Proteomic analysis of hydrogen photoproduction in sulfur-deprived Chlamydomonas cells // J. Proteome Res. 2010. V. 9. P. 3854‒3866.
Chochois V., Dauvillée D., Beyly A., Tolleter D., Cuiné S., Timpano H., Ball S., Cournac L., Peltier G. Hydrogen production in Chlamydomonas: Photosystem II-dependent and -independent pathways differ in their requirement for starch metabolism // Plant. Physiol. 2009. V. 151. P. 631–640.
Cournac L., Mus F., Bernard L., Guedeney G., Vignais P., Peltier G. Limiting steps of hydrogen production in Chlamydomonas reinhardtii and Synechocystis PCC 6803 as analyzed by light-induced gas exchange transients // Int. J. Hydrogen Energy. 2002. V. 27. P. 1229–1237.
Curien G., Flori S., Villanova V., Magneschi1 L., Giustini C., Forti G., Matringe M., Petroutsos D., Kuntz M., Finazzi G. The water to water cycles in microalgae // Plant Cell Ph-ysiol. 2016. V. 57. P. 1354–1363.
Dang K.V., Plet J., Tolleter D., Jokel M., Cuiné S. Combined increases in mitochondrial cooperation and oxygen photoreduction compensate for deficiency in cyclic electron flow in Chlamydomonas reinhardtii // Plant Cell. 2014. V. 26. P. 3036‒3050.
Delosme R., Olive J., Wollman F.-A. Changes in light energy distribution upon state transitions: An in vivo photoacoustic study of the wild type and photosynthesis mutants from Chlamydomonas reinhardtii // Biochim. Biophys. Acta. 1996. V. 1273. P. 150–158.
Desplats C., Mus F., Cuine S., Billon E., Cournac L., Peltier G. Characterization of Nda2, a plastoquinone-reducing type II NAD(P)H dehydrogenase in Chlamydomonas chloroplasts // J. Biol. Chem. 2009. V. 284. P. 4148–4157.
Drop B., Webber-Birungi M., Yadav S.K., Filipowicz-Szymanska A., Fusetti F., Boekema E.J., Croce R. Light-harvesting complex II (LHCII) and its supramolecular organization in Chlamydomonas reinhardtii // Biochim. Biophys. Acta. 2014. V. 1837. P. 63–72.
Drozak A., Romanowska E. Acclimation of mesophyll and bundle sheath chloroplasts of maize to different irradiances during growth // Biochim. Biophys. Acta. 2006. V. 1757. P. 1539–1546.
Dubini A., Mus F., Seibert M., Grossman A.R., Posewitz M.C. Flexibility in anaerobic metabolism as revealed in a mutant of Chlamydomonas reinhardtii lacking hydrogenase activity // J. Biol. Chem. 2009. V. 284. P. 7201–7213.
Eastmond P.J., Graham I.A. Re-examining the role of the glyoxylate cycle in oilseeds // Trends Plant Sci. 2001. V. 6. P. 72–78.
Eberhard S., Finazzi G., Wollman F.A. The dynamics of photosynthesis // Annu. Rev. Genet. 2008. V. 42. P. 463–515.
Engelbrecht V., Rodriguez-Macia P., Esselborn J., Sawyer A., Hemschemeier A., Rudiger O., Lubitz W., Winkler M., Happe T. The structurally unique photosynthetic Chlorella variabilis NC64A hydrogenase does not interact with plant-type ferredoxins // Biochim. Biophys. Acta. V. 1858. P. 771‒778.
Fan X., Zhang J., Li W., Peng L. The NdhV subunit is required to stabilize the chloroplast NADH dehydrogenase-like complex in Arabidopsis // Plant J. 2015. V. 82. P. 221–231.
Finazzi G., Johnson G.N., Dall’osto L., Zito F., Bonente G., Bassi R., Wollman F.A. Nonphotochemical quenching of chlorophyll fluorescence in Chlamydomonas reinhardtii // Biochem. 2006. V. 45. P. 1490–1498.
Finazzi G., Rappaport F., Furia A., Fleischmann M. Involvement of state transition in the switch between linear and cyclic electron flow in Chlamydomonas reinhardtii // EMBO Rep. 2002. V. 3. P. 280–285.
Forestier M., King P., Zhang L., Posewitz M., Schwarzer S., Happe T., Ghirardi M.L., Seibert M. Expression of two [Fe]-hydrogenases in Chlamydomonas reinhardtii under anaerobic conditions // Eur. J. Biochem. 2003. V. 270. P. 2750–2758.
Franck F., Houyoux P.A. The Mehler reaction in Chlamydomonas during photosynthetic induction and steady-state photosynthesis in wild-type and in a mitochondrial mutant // Photosynthesis. Energy from the sun / Eds. Allen J.F., Gantt E., Golbeck J.H., Osmond B. Netherlands, Dordrecht: Springer, 2008. P. 581–584.
Gaffron H., Rubin J. Fermentative and photochemical production of hydrogen in algae // J. Gen. Physiol. 1942. V. 26. P. 219–240.
Ghirardi M.L., Posewitz M.C., Maness P.C., Dubini A., Yu J., Seibert M. Hydrogenases and hydrogen photoproduction in oxygenic photosynthetic organisms // Annu. Rev. Plant Biol. 2007. V. 58. P. 71‒91.
Ghysels B., Godaux D., Matagne R.F., Cardol P., Franck F. Function of the chloroplast hydrogenase in the microalga Chlamydomonas: the role of hydrogenase and state transitions during photosynthetic activation in anaerobiosis // PLoS One. 2013. V. 8. P. e64161.
González-Ballester D., Casero D., Cokus S., Pellegrini M., Merchant S.S., Grossman A.R. RNA-seq analysis of sulfur-deprived Chlamydomonas cells reveals aspects of acclimation critical for cell survival // Plant Cell. 2010. V. 22. P. 2058−2084.
Gorman D.S., Levine R.P. Photosynthetic electron transport chain of Chlamydomonas reinhardi. V. Purification and properties of cytochrome 553 and ferredoxin // Plant Physiol. 1966. V. 41 P. 1643–1647.
Govindjee, Shevela D., Björn L.O. Evolution of the Z-scheme of photosynthesis: a perspective // Photosynth. Res. 2017. V. 133. P. 5–15.
Happe T., Kaminski A. Differential regulation of the Fe-hydrogenase during anaerobic adaptation in the green alga Chlamydomonas reinhardtii // Eur. J. Biochem. 2002. V. 269. P. 1022–1032.
Harris E.H. Chlamydomonas as a model organism // Ann. Rev. Plant Physiol. Plant Mol. Biol. 2001. V. P. 363–406.
Hasan S.S., Yamashita E., Cramer W.A. Transmembrane signaling and assembly of the cytochrome b6f–lipidic charge transfer complex // Biochim Biophys Acta. 2013. V. 1827. P. 1295–1308.
Hemschemeier A., Happe T. Alternative photosynthetic electron transport pathways during anaerobiosis in the green alga Chlamydomonas reinhardtii // Biochim. Biophys. Acta. 2011. V. 1807. P. 919–926.
Hertle A.P., Blunder T., Wunder T., Pesaresi P., Pribil M., Armbruster U., Leister D. PGRL1 is the elusive ferredoxin-plastoquinone reductase in photosynthetic cyclic electron flow // Mol. Cell. 2013. V. 49. P. 511‒523.
Houille-Vernes L., Rappaport F., Wollman F.A., Alric J., Johnson X. Plastid terminal oxidase 2 (PTOX2) is the major oxidase involved in chlororespiration in Chlamydomonas // Proc. Natl. Acad. Sci. USA. 2011. V. 108. P. 20820‒20825.
Iwai M., Takizawa K., Tokutsu R., Okamuro A., Takahashi Y., Minagawa J. Isolation of the elusive supercomplex that drives cyclic electron flow in photosynthesis // Nature. 2010. V. 464. P. 1210–1213.
Jans F., Mignolet E., Houyoux P.-A., Cardol P., Ghysels B., Cuink S., Cournac L., Peltier G., Remacle G., Franck F. A type II NAD(P)H dehydrogenase mediates light-independent plastoquinone reduction in the chloroplast of Chlamydomonas // Proc. Natl. Acad. Sci. 2008. V. 105. P. 20546–20551.
Johnson M.P., Ruban A.V. Restoration of rapidly reversible photoprotective energy dissipation in the absence of PsbS protein by enhanced ΔpH // J. Biol. Chem. 2011. V. 286. P. 19973–19981.
Johnson X., Alric J. Central carbon metabolism and electron transport in Chlamydomonas reinhardtii: metabolic constraints for carbon partitioning between oil and starch // Eukaryot. Cell. 2013. V. 12. P. 776‒793.
Joliot P., Finazzi G. Proton equilibration in the chloroplast modulates multiphasic kinetics of nonphotochemical quenching of fluorescence in plant // Proc Natl. Acad. Sci. USA. 2010. V. 107. P. 12728−12733.
Juergens M.T., Deshpande R.R., Lucker B.F., Park J.J. The regulation of photosynthetic structure and function during nitrogen deprivation in Chlamydomonas reinhardtii // Plant Physiol. 2015. V. 167. P. 558–573.
Kosourov S., Jokel M., Aro E.-M., Allahverdiyeva Y. A new approach for sustained and efficient H2 photoproduction by Chlamydomonas reinhardtii // Energy Environ. Sci. 2018. V. 11. P. 1431.
Kouřil R., Dekker J.P., Boekema E.J. Supramolecular organization of photosystem II in green plants // Biochim. Biophys. Acta. 2012. V. 1817. P. 2–12.
Krieger-Liszkay A., Feilke K. The dual role of the plastid terminal oxidase PTOX: between a protective and a pro-oxidant function // Front. Plant. Sci. 2015. V. 6. P. 1147.
Kruger N.J., von Schaewen A. The oxidative pentose phosphate pathway: structure and organization // Curr. Opin. Plant Biol. 2003. V. 6. P. 236–246.
Kuntz M. Plastid terminal oxidase and its biological significance // Planta. 2004. V.218. P. 896–999.
Kuvykin I.V., Vershubskii A.V., Ptushenko V.V., Tikhonov A.N. Oxygen as an alternative electron acceptor in the photosynthetic electron transport chain of C3 plants // Biochemistry (Moscow). 2008. V. 73. P. 1063‒1075.
Labs M., Rühle T., Leister D. The antimycin A-sensitive pathway of cyclic electron flow: from 1963 to 2015 // Photosynth. Res. 2016. V. 129. P. 231–238.
Liran O., Semyatich R., Milrad Y., Eilenberg H., Weiner I., Yacoby I. Microoxic niches within the thylakoid stroma of air-grown Chlamydomonas reinhardtii protect [FeFe]-hydrogenase and support hydrogen production under fully aerobic environment // Plant Physiol. 2016. V. 172. P. 264‒271.
Matthew T., Zhou W., Rupprecht J., Lim L, Thomas-Hall S.R., Doebbe A. The metabolome of Chlamydomonas reinhardtii following induction of anaerobic H2 production by sulfur depletion // J. Biol. Chem. 2009. V. 284. P. 23415‒23425.
Mehler A.H. Studies on reactions of illuminated chloroplasts. I. Mechanism of the reduction of oxygen and other Hill reagents // Arch. Biochem. Biophys. 1951. V. 33. P. 65−67.
Melis A. Photosynthetic H2 metabolism in Chlamydomonas reinhardtii (unicellular green algae) // Planta. 2007. V. 226. P. 1075–1086.
Melis A., Zhang L., Forestier M., Ghirardi M., Seibert M. Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green alga Chlamydomonas reinhardtii // Plant Physiol. 2000. V. 122. P. 127–136.
Meuser J.E., D’Adamo S., Jinkerson R.E., Mus F., Yang W., Ghirardi M.L., Seibert M., Grossman A.R., Posewitz M.C. Genetic disruption of both Chlamydomonas reinhardtii [FeFe]-hydrogenases: Insight into the role of HYDA2 in H2 production // Biochem. Biophys. Res. Commun. 2012. V. 417. P. 704‒709.
Meyer J. [FeFe] hydrogenases and their evolution: a genomic perspective // Cell. Mol. Life Sci. 2007. V. 64. P. 1063–1084.
Michelet L., Zaffagnini M., Morisse S., Sparla F., Perez-Perez M.E., Francia F., Danon A., Marchand C.H., Fermani S., Trost P., Lemaire S.D. Redox regulation of the Calvin‒Benson cycle: something old, something new // Front. Plant Sci. 2013. V. 4. P. 470.
Moore C.M. Processes and patterns of oceanic nutrient limitation // Nat. Geosci. 2013. V. 6. P. 701–710.
Mott K.A., Berry J.A. Effects of pH on activity and activation of ribulose 1,5-bisphosphate carboxylase at air level CO2 // Plant Physiol. 1986. V. 82. P. 77–82.
Mulder D.W., Shepard E.M., Meuser J.E., Joshi N., King P.W., Posewitz M.C., Broderick J.B., Peters J.W. Insights into [FeFe]-hydrogenase structure, mechanism, and maturation // Structure. 2011. V. 19. P. 1038‒1052.
Mus F., Dubini A., Seibert M., Posewitz M.C., Grossman A.R. Anaerobic acclimation in Chlamydomonas reinhardtii: anoxic gene expression, hydrogenase induction, and metabolic pathways // J. Biol. Chem. 2007. V. 282. P. 25475–25486.
Nagy V., Podmaniczki A., Vidal-Meireles A., Tengölics R., Kovács L., Rákhely G., Scoma A., Tóth S.Z. Water-splitting-based, sustainable and efficient H2 production in green algae as achieved by substrate limitation of the Calvin‒Benson‒Bassham cycle // Biotechnol. Biofuels. 2018. V. 11. P. 69.
Nguyen A.V., Thomas-Hall S.R., Malnoë A., Timmins M., Mussgnug J.H., Rupprecht J., Kruse O., Hankamer B., Schenk P.M. Transcriptome for photobiological hydrogen production induced by sulfur deprivation in the green alga Chlamydomonas reinhardtii // Eukaryot. Cell. 2008. V. 7. P. 1965–1979.
Nishikawa Y., Yamamoto H., Okegawa Y., Wada S., Sato N., Taira Y., Sugimoto K., Makino A., Shikanai T. PGR5-dependent cyclic electron transport around PSI contributes to the redox homeostasis in chloroplasts rather than CO2 fixation and biomass production in rice // Plant Cell Physiol. 2012. V. 53. P. 2117–2126.
Nixon P.J. Chlororespiration // Phil. Trans. R. Soc. Lond. B. 2000. V. 355. P. 1541−1547.
Niyogi K.K. Safety valves for photosynthesis // Curr. Opin. Plant Biol. 2000. V. 3. P. 455– 460.
Noth J., Krawietz D., Hemschemeier A., Happe T. Pyruvate ferredoxin oxidoreductase is coupled to light-independent hydrogen production in Chlamydomonas reinhardtii // J. Biol. Chem. 2013. V. 288. P. 4368–4377.
Okegawa Y., Long T.A., Iwano M., Takayama S., Kobayashi Y. A balanced PGR5 level is required for chloroplast development and optimum operation of cyclic electron transport around photosystem I // Plant Cell Physiol. 2008. V. 48. P. 1462–1471.
Peers G., Truong T.B., Ostendorf E., Busch A., Elrad D., Grossman A.R., Hippler M., Niyogi K.K. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis // Nature. 2009. V. 462. P. 518–521.
Peltier G., Tolleter D., Billon E., Cournac L. Auxiliary electron transport pathways in chloroplasts of microalgae // Photosynth. Res. 2010. V. 106. P. 19–31.
Philipps G., Happe T., Hemschemeier A. Nitrogen deprivation results in photosynthetic hydrogen production in Chlamydomonas reinhardtii // Planta. 2012. V. 235. P. 729‒745.
Posewitz M.C., King P.W., Smolinksi S.L., Smith R.D., Ginley A.R., Ghirardi M.L., Seibert M. Identification of genes required for hydrogenase activity in Chlamydomonas reinhardtii // Biochem. Soc. Trans. 2005. V. 33. P. 102–104.
Rochaix J.-D. Reprint of: regulation of photosynthetic electron transport // Biochim. Biophys. Acta. 2011. V. 1807. P. 878–886.
Rolland N., Atteia A., Decottignies P., Garin J., Hippler M., Kreimer G., Lemaire S.D., Mittag M., Wagner V. Chlamydomonas proteomics // Curr. Opin. Microbiol. 2009. V. 12. P. 285–291.
Saroussi S., Sanz-Luque E.; Kim R.G., Grossman A.R. Nutrient scavenging and energy management: acclimation responses in nitrogen and sulfur deprived Chlamydomonas // Curr. Opin. Plant Biol. 2017. V. 39. P. 114‒122.
Sawyer A., Bai Y., Lu Y., Hemschemeier A., Happe T. Compartmentalization of [FeFe]-hydrogenase maturation in Chlamydomonas reinhardtii // Planta J. 2017. V. 90. P. 6.
Sawyer A., Winkler M. Evolution of Chlamydomonas reinhardtii ferredoxins and their interactions with [FeFe]-hydrogenases // Photosynth. Res. 2017. V. 134. P. 307‒316.
Schmollinger S., Mühlhaus T., Boyle N.R., Blaby I.K., Casero D. Nitrogen-sparing mechanisms in Chlamydomonas affect the transcriptome, the proteome, and photosynthetic metabolism // Plant Cell. 2014. V. 26. P. 1410–1435.
Scoma A., Durante L., Bertin L., Fava F. Acclimation to hypoxia in Chlamydomonas reinhardtii: can biophotolysis be the major trigger for long-term H2 production? // New Phytol. 2014. V. 204. P. 890–900.
Scoma A., Toth S.Z. On the pathways feeding the H2 production process in nutrient-replete, hypoxic conditions. Commentary on the article “Low oxygen levels contribute to improve photohydrogen production in mixotrophic non-stressed Chlamydomonas cultures”, by Jurado-Oller et al., Biotechnology for Biofuels, published September 7, 2015; 8:149 // Biotech. Biofuels. 2015. V. 10. P. 116.
Shikanai T. Regulatory network of proton motive force: contribution of cyclic electron transport around photosystem I // Photosynth. Res. 2016. V. 129. P. 253–260.
Shikanai T., Yamamoto H. Contribution of cyclic and pseudo-cyclic electron transport to the formation of proton motive force in chloroplasts // Mol. Plant. 2017. V. 10. P. 20–29.
Shinopoulos K.E., Brudvig G.W. Cytochrome b559 and cyclic electron transfer within photosystem II // Biochim. Biophys. Acta. 2012. V. 1817. P. 66–75.
Shurin J.B., Burkart M.D., Mayfield S.P., Smith V.H. Recent progress and future challenges in algal biofuel production [version 1; peer review: 4 approved] // F1000Research. 2016. 5(F1000 Faculty Rev): 2434. https://doi.org/10.12688/f1000research.9217.1 Solovchenko A., Chekanov K. Production of carotenoids using microalgae cultivated in photobioreactors // Production of biomass and bioactive compounds using bioreactor technology / Eds. Paek K.-Y., Hosakatte N.M., Zhong J.-J. Dordrecht: Springer Science Business Media, 2014. P. 63–91.
Solovchenko A.E. Recent breakthroughs in the biology of astaxanthin accumulation by microalgal cell // Photosynth. Res. 2015. V. 125. P. 437‒449.
Staehelin L.A., van der Staay G.W.M. Structure, composition, functional organization and dynamic properties of thylakoid membranes // Oxygenic photosynthesis: the light reactions / Eds. Ort D.R., Yocum C.F. Dordrecht: Kluwer Academic Publishers, 1996. P. 11–30.
Subramanian V., Dubini A., Astling D.P., Laurens L.M., Old W.M., Grossman A.R., Posewitz M.C., Seibert M. Profiling Chlamydomonas metabolism under dark, anoxic H2-producing conditions using a combined proteomic, transcriptomic, and metabolomic approach // J. Proteome Res. 2014. V. 13. P. 5431–5451.
Swanson K.D., Ratzloff M.W., Mulder D.W., Artz J.H., Ghose S., Hoffman A., White S., Zadvornyy O.A., Broderick J.B., Bothner B., King P.W., Peters J.W. [FeFe]-hydrogenase oxygen inactivation is initiated at the H cluster 2Fe subcluster // J. Am. Chem. Soc. 2015. V. 137. P. 1809–1816.
Terashima M., Specht M., Naumann B., Hippler M. Characterizing the anaerobic response of Chlamydomonas reinhardtii by quantitative proteomics // Mol. Cell Proteomics. 2010. V. 9. P. 1514–1532.
Tibiletti T., Auroy P., Peltier G., Caffarri S. Chlamydomonas reinhardtii PsbS protein is functional and accumulates rapidly and transiently under high light // Plant Physiol. 2016. V. 171. P. 2717–2730.
Tikhonov A.N. Induction events and short-term regulation of electron transport in chloroplasts // Photosynth. Res. 2015. V. 125. P. 65‒94.
Tikhonov A.N. pH-Dependent regulation of electron transport and ATP synthesis in chloroplasts // Photosynth. Res. 2013. V. 116. P. 511‒534.
Tikkanen M., Aro E.-M. Thylakoid protein phosphorylation in dynamic regulation of photosystem II in higher plants // Biochim. Biophys. Acta. 2012. V. 1817. P. 232–238.
Tikkanen M., Grieco M., Aro E.-M. Novel insights into plant light-harvesting complex II phosphorylation and “state transitions” // Trends Plant. Sci. 2011. V. 16. P. 126–131.
Toepel J., Albaum S., Arvidsson S., Goesmann A., la Russa M., Rogge K., Kruse O. Construction and evaluation of a whole genome microarray of Chlamydomonas reinhardtii // BMC Genomics. 2011. V. 12. P. 579.
Toepel J., Illmer-Kephalides M., Jaenicke S., Straube J., May P., Goesmann A., Kruse O. New insights into Chlamydomonas reinhardtii hydrogen production processes by combined microarray/RNA-seq transcriptomics // Plant Biotechnol. J. 2013. V. 11. P. 717–733.
Tsygankov A., Kosourov S., Seibert M., Ghirardi M.L. Hydrogen photoproduction under continuous illumination by sulfur-deprived, synchronous Chlamydomonas reinhardtii cultures // Int. J. Hydrogen Energy. 2002. V. 27. P. 1239–1244.
Vener A.V., van Kan P.J., Rich P.R., Ohad I., Andersson B. Plastoquinol at the quinol oxidation site of reduced cytochrome bf mediates signal transduction between light and protein phosphorylation: thylakoid protein kinase deactivation by a single-turnover flash // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 1585–1590.
Vignais P.M., Billoud B. Occurrence, classification, and biological function of hydrogenases: an overview // Chem. Rev. 2007. V. 107. P. 4206‒4272.
Volgusheva A., Kukarskikh G., Krendeleva T., Rubin A., Mamedov F. Hydrogen photoproduction in green algae Chlamydomonas reinhardtii under magnesium deprivation // RSC Advances. 2015. V. 5. P. 5633 –5637.
Volgusheva A., Styring S., Mamedov F. Increased photosystem II stability promotes H2 production in sulfur-deprived Chlamydomonas reinhardtii // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 7223–7228.
Wang H., Alvarez S., Hicks L.M. Comprehensive comparison of iTRAQ and label-free LC-based quantitative proteomics approaches using two Chlamydomonas reinhardtii strains of interest for biofuels engineering // J. Proteome Res. 2011. V. 11. P. 487−501.
Wecker M.S.A., Meuser J.E., Posewitz M.C., Ghirardi M.L. Design of a new biosensor for algal H2 production based on the H2-sensing system of Rhodobacter capsulatus // Int. J. Hydrogen Energy. 2011. V. 36. P. 11229–11237.
Werdan K., Heldt H.W., Milovancev M. The role of pH in the regulation of carbon fixation in the chloroplast stroma. Studies on CO2 fixation in the light and dark // Biochim. Biophys. Acta. 1975. V. 396. P. 276–292.
Winkler M., Hemschemeier A., Jacobs J., Stripp S., Happe T. Multiple ferredoxin isoforms in Chlamydomonas reinhardtii ‒ their role under stress conditions and biotechnological implications // Eur. J. Cell Biol. 2010. V. 89. P. 998–1004.
Yamamoto H., Peng L., Fukao Y., Shikanai T. An Src homology 3 domain-like fold protein forms a ferredoxin-binding site for the chloroplast NADH dehydrogenase-like complex in Arabidopsis // Plant Cell. 2011. V. 23. P. 1480–1493.
Yamori W., Shikanai T. Physiological functions of cyclic electron transport around photosystem I in sustaining photosynthesis and plant growth // Annu. Rev. Plant Biol. 2016. V. 67. P. 81–106.
Yang W., Catalanotti C., Wittkopp T.M., Posewitz M.C., Grossman A.R. Algae after dark: mechanisms to cope with anoxic/hypoxic conditions // Plant J. 2015. V. 82. P. 481–503.
Zhang L., Happe T., Melis A. Biochemical and morphological characterization of sulfur-deprived and H2-producing Chlamydomonas reinhardtii (green alga) // Planta. 2002. V. 214. P. 552–561.
Zito F., Finazzi G., Delosme R., Nitschke W., Picot D., Wollman F.A. The Qo site of cytochrome b6 f complexes controls the activation of the LHCII kinase // EMBO J. 1999. V. 18. P. 2961–2969.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология