Микробиология, 2020, T. 89, № 4, стр. 488-492
Стимулирующий эффект адреналина на биопленки Micrococcus luteus C01
Н. Д. Данилова a, Т. В. Соловьева a, С. В. Мартьянов a, М. В. Журина a, А. В. Ганнесен a, *
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
* E-mail: andrei.gannesen@gmail.com
Поступила в редакцию 26.02.2020
После доработки 13.03.2020
Принята к публикации 27.03.2020
Аннотация
Впервые показан стимулирующий эффект адреналина на формирование биопленок Micrococcus luteus С01 в модельных системах. В присутствии 900 пг/мл адреналина в среде через 24 ч роста наблюдали увеличение метаболической активности бактерий в биопленке на 52.3% по сравнению с контролем без адреналина. Однако через 72 ч роста общее количество биопленки в присутствии адреналина увеличивалось на 89.5%, тогда как метаболическая активность бактерий в биопленке сохранялась на уровне контроля. Можно полагать, что мишенью стимулирующего эффекта адреналина являются процессы метаболизма бактерий, определяющие как их рост (на начальных этапах развития биопленок), так и синтез матрикса биопленки, более выраженный в зрелых биопленках.
Биопленки – это погруженные во внеклеточный матрикс структурированные сообщества микроорганизмов, которые являются основной формой существования микроорганизмов в природе (Ножевникова и соавт., 2015). Micrococcus luteus повсеместно встречается в воде и почве (Mauclaire, Egli, 2010), кроме того, является одним из доминирующих представителей микробиоты кожи человека (Kloos et al., 1974, Daeschlein et al., 2012). Показано, что его клетки локализуются преимущественно в роговом слое кожи, а также в полостях волосяных фолликулов (Lange-Asschenfeldt et al., 2011). Помимо кожи, M. luteus может быть компонентом микробиоты слизистых оболочек человека (например, влагалища, – Chen et al., 2017; Ako-Nai, Omo-Omorodion, 2019). Вероятно, вследствие адаптации к обитанию на коже, M. luteus обладает одним из самых коротких геномов среди свободноживущих бактерий – около 2.5 млн пар оснований (Young et al., 2009), что накладывает на M. luteus ряд метаболических ограничений, например, неспособность расти на среде с глюкозой (и рядом других сахаров) как единственным источником углерода. При этом M. luteus может представлять интерес в области биотехнологии как потенциальный источник биотоплива в виде биологически синтезируемых алкенов, поскольку обладает соответствующим набором генов метаболизма аминокислот и жирных кислот (Young et al., 2010; Surger et al., 2018). Также M. luteus, благодаря кератинолитической активности, может быть интересен как потенциальный агент для утилизации отходов птицефабрик (Laba et al., 2015). Несмотря на это, процесс формирования биопленок M. luteus и возможность регуляции этого процесса только начинают изучаться, прямые исследования биопленок M. luteus малочисленны (Matsuura, 2013).
Согласно результатам, полученным в последнее время, микробиота кожи играет важную роль в функционировании кожного покрова, иммунной системы человека и тесным образом взаимосвязана с системами гуморальной регуляции (Erin Chen et al., 2018). Логично предположить, что макроорганизм-хозяин, в свою очередь, может воздействовать на биопленки: регуляторные соединения организма человека, не обладающие прямым антимикробным действием, способны оказывать влияние на рост микроорганизмов. Это показано для натрийуретических пептидов (Gannesen et al., 2018, Ганнесен и соавт., 2018), вещества P (N’Diaye et al., 2016), катехоламинов (Lyte et al., 2003; Frank, Patel, 2008). Подобное влияние может быть следствием длительной коэволюции организма человека и его комменсалов. Ранее уже было показано воздействие адреналина на ряд микроорганизмов-комменсалов человека, в том числе на формирование биопленок (например, Bansal et al., 2007), хотя прямым антимикробным действием адреналин не обладает (Boyanova, 2017). Более детально исследовано влияние адреналина на некоторых представителей энтеробактерий, у которых обнаружена сигнальная система, основу которой составляют молекулы катехоламинов – адреналин и норадреналин (Lesouhaitier et al., 2009). Это свидетельствует о развившейся в ходе эволюции способности эукариотического макроорганизма регулировать рост прокариотических комменсалов, что важно с точки зрения изучения метаболизма данных микроорганизмов. При этом сведений о влиянии адреналина на грамположительные микроорганизмы очень мало, а его влияние на M. luteus не исследовано вовсе.
Будучи комменсалом кожи человека, M. luteus также подвергается воздействию регуляторных молекул хозяина. В настоящей работе мы исследовали влияние эпинефрина (адреналина) на M. luteus в различных модельных системах формирования биопленок. В работе использовали штамм M. luteus С01, выделенный с кожи здорового добровольца (Журина и соавт., 2017). Поскольку неизвестно, какова концентрация адреналина в экологической нише M. luteus как комменсала человека, в работе использовали концентрацию адреналина, равную 900 пг/мл, указанную в обзоре Boyanova et al. (2017). В этой концентрации адреналин не является субстратом для роста M. luteus, поскольку данное количество вещества слишком мало, чтобы быть значимым источником углерода и энергии.
Бактерии выращивали на обогащенной клостридиальной среде (reinforced clostridial medium, RCM) состава (г/л дистиллированной воды): дрожжевой экстракт – 13; пептон – 10; глюкоза – 5; NaCl – 5; ацетат натрия – 3; крахмал – 1; гидрохлорид цистеина – 0.5; pH среды 6.8–7.0. Инкубацию проводили при 33°С, что соответствует температуре экологической ниши, в которой обитает данная бактерия на коже (Boutcher et al., 1995; Lange-Asschenfeldt et al., 2011). Результаты представляли в виде медиан относительных значений (% от контроля). Эксперименты проводили не менее чем в трех независимых повторностях. Статистическую обработку данных проводили при помощи определения непараметрического критерия Манна–Уитни при р < 0.05 с использованием пакета Excel 2010.
В работе применены две модельные системы для исследования биопленок. В первой системе использовали химически чистые тефлоновые кубики размером 4 × 4 × 4 мм в качестве носителя биопленок (Ганнесен и соавт., 2015). Кубики погружали в жидкую среду, в которую вносили инокулят. В этом случае биопленки формируются в равновесии с планктонной культурой. По окончании инкубации (72 ч) измеряли условную оптическую плотность планктонной культуры на спектрофотометре ПЭ-5400ВИ (“Экрос”, РФ) при длине волны 540 нм (ОП540). Биопленки на кубиках отмывали от планктонных клеток и окрашивали красителем кристаллическим фиолетовым (КФ), как описано ранее (Ганнесен и соавт., 2015). Оптическая плотность экстракта красителя является количественным показателем роста биопленок. Вторая модельная система включает выращивание биопленок на мелкопористых стекловолоконных фильтрах марки Whatman GF/F (Плакунов и соавт., 2016). В данной системе, после нанесения инокулята на фильтр, биопленки формируются без планктонной культуры, поскольку фильтры располагаются на поверхности агаризованной среды в чашках Петри. Таким образом, стадия обратимой адгезии клеток к поверхности протекает практически мгновенно.
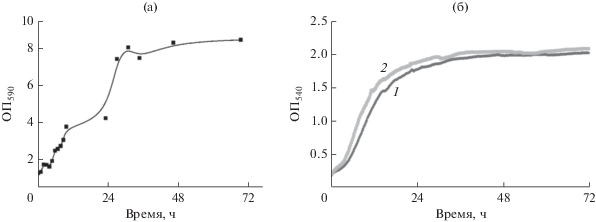
Была предварительно исследована динамика роста биопленок M. luteus С01 (рис. 1а). В ходе работы было принято исследовать зрелые биопленки (в стационарной фазе) и формирующиеся (в экспоненциальной фазе). Показно, что биопленки M. luteus C01 достигали стационарной фазы к 60 ч инкубации, а после 24 ч биопленки находились в стадии формирования. На основании данных о динамике роста был принят период культивирования M. luteus C01 в дальнейшей работе, равный 72 ч (соответствующий зрелым биопленкам). С помощью планшетного спектрофотометра XMark (“Biorad”, США) исследовали также динамику роста планктонных культур и влияние на него адреналина (рис. 1б). Показано, что в контрольных образцах время удвоения составляло 4.25 ч (удельная скорость роста 0.163 ч–1), тогда как в присутствии адреналина оно сокращалось до 3.25 ч (удельная скорость роста 0.21 ч–1). Максимальная ОП540 в контроле составляла 1.985, тогда как в присутствии адреналина – 2.03 (102.3% от контроля).
Рис. 1.
Динамика роста биопленок (а) и планктонных культур (б) M. luteus C01: 1 – контроль, 2 – образцы с 900 пг/мл адреналина.
Результаты исследования роста биопленок M. luteus С01 в присутствии адреналина (“Sigma”) на тефлоновых кубиках при помощи окрашивания КФ по стандартной методике (Ганнесен и соавт., 2015) представлены на рис. 2. После 72 ч инкубации условная ОП540 планктонной культуры в присутствии адреналина не отличалась значительно от ОП540 в контроле без его добавления (104.2% от контроля, рис. 2, а), т.е. урожай клеток был так же немного выше, чем в контроле. При этом рост биопленок значительно стимулировался в присутствии адреналина (189.5% от контроля, рис. 2, б). Таким образом, при отсутствии воздействия на планктонные культуры, в исследуемой концентрации адреналин стимулировал рост биопленок M. luteus С01 практически в два раза, что является свидетельством в пользу регуляторной функции адреналина в отношении клеток данного микроорганизма с биопленочным фенотипом.
Рис. 2.
Влияние адреналина на рост планктонных культур (а) и биопленок (б–д) M. luteus C01: 1 – контрольные образцы без добавок; 2 – образцы c 900 пг/мл адреналина. Обозначения: а – планктонные культуры после 72 ч инкубации; б – биопленки на тефлоновых кубиках после 72 ч инкубации (окраска КФ); в – биопленки на тефлоновых кубиках после 72 ч инкубации (окраска МТТ); г – биопленки на тефлоновых кубиках после 24 ч инкубации (окраска МТТ); д – биопленки на стекловолоконных фильтрах после 72 ч роста (окраска МТТ).
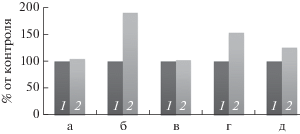
С целью изучения механизма действия адреналина использовали другую стратегию для изучения биопленок M. luteus С01 в той же модели с кубиками: количественное определение метаболической активности бактерий в составе биопленки. Для этого биопленки окрашивали 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромидом (МТТ) по методике, разработанной ранее (Плакунов и соавт., 2016; Журина и соавт., 2017). Если окрашивание универсальным красителем КФ позволяет определять тотальную биомассу биопленок (матрикс и клетки), то окрашивание МТТ позволяет детектировать только метаболически активные клетки в составе биопленки (рис. 2, в; 2, г). МТТ, будучи акцептором электронов от электрон-транспортной цепи (ЭТЦ), восстанавливается в нерастворимый формазан. Величина ОП экстракта формазана пропорциональна количеству метаболически активных клеток.
Окрашивание МТТ биопленок, выращенных на тефлоновых кубиках в течение 72 ч (рис. 2, в), показало отсутствие стимулирующего эффекта адреналина (отличие от окрашивания КФ): метаболическая активность бактерий не отличалось значительно от контрольных образцов (102.5%). Однако при окрашивании 24-часовых биопленок МТТ наблюдали значимый стимулирующий эффект адреналина: метаболическая активность бактерий в составе биопленок была на 52.3% выше, чем в контроле (рис. 2, г). Таким образом, в первые сутки инкубации адреналин оказывал стимулирующий эффект на рост (или дыхательный метаболизм) бактерий, который при продолжении инкубации нивелировался. Чтобы определить причину этого явления, использовали вторую модельную систему для формирования биопленок. Существует принципиальное различие между этими моделями: в модели с кубиками происходит параллельный рост как биопленки, так и планктонной культуры в динамическом равновесии между ними, при котором клетки могут переходить из планктонной культуры в биопленку и наоборот. На модели с фильтрами этого не происходит, после адгезии клеток к поверхности образуется только биопленка. После инкубации 72 ч на стекловолоконных фильтрах биопленки M. luteus C01 на среде с исследуемой концентрацией адреналина проявляли большую, чем в контроле, метаболическую активность (125.3% от контроля, рис. 2, д). Таким образом, в этой системе количество метаболически активных клеток в биопленках по истечении 72 ч инкубации в присутствии в среде адреналина увеличивалось, а в системе с кубиками оно оставалось на уровне контроля. Однако в системе с кубиками, где биопленки росли в динамическом равновесии с планктонной культурой, стимуляция метаболической активности адреналином наблюдалась по истечении 24 ч инкубации, тогда как после 72 ч инкубации значительно увеличивалась тотальная биомасса биопленок, окрашиваемая КФ. На основании полученных данных можно предположить, что один из механизмов действия адреналина на биопленки M. luteus С01 заключается в стимуляции синтеза внеклеточного полимерного матрикса биопленок. Количество метаболически активных клеток в биопленках на кубиках практически идентично контролю, в то время как в системе с фильтрами метаболическая активность биопленок в присутствии адреналина выше. Можно полагать, что адреналин ускоряет процесс созревания микробных биопленок, а также оказывает стимулирующий эффект на синтез внеклеточного матрикса.
Таким образом, нами впервые показан регуляторный эффект адреналина на рост биопленок M. luteus С01 в модельных экспериментах. Действие адреналина выражено в стимуляции роста биопленок, по-видимому, за счет активации процесса синтеза внеклеточного полимерного матрикса. Детальный механизм этого явления требует дальнейшего изучения.
Список литературы
Ганнесен А.В., Лезуатье О., Нетрусов А.И., Плакунов В.К., Фейоле М.Ж.Ж. Регуляция натрийуретическими пептидами формирования моновидовых и бинарных биопленок бактерий микробиоты кожи Staphylococcus epidermidis и Staphylococcus aureus // Микробиология. 2018. Т. 87. С. 469–482.
Gannesen A.V., Lesouhaitier O., Netrusov A.I., Plakunov V.K., Feuilloley M.G.J. Regulation of formation of monospecies and binary biofilms by human skin microbiota components, Staphylococcus epidermidis and Staphylococcus aureus, by human natriuretic peptides // Microbiology (Moscow). 2018. V. 87. P. 597–609.
Ганнесен А.В., Журина М.В., Веселова М.А., Хмель И.А., Плакунов В.К. Регуляция процесса формирования биопленок Pseudomonas chlororaphis в системе in vitro // Микробиология. 2015. Т. 84. С. 281–290.
Gannesen A.V., Zhurina M.V., Veselova M.A., Plakunov V.K. Regulation of biofilm formation by Pseudomonas chlororaphis in an in vitro system // Microbiology (Moscow). 2015. V. 84. P. 319–327.
Журина М.В., Ганнесен А.В., Мартьянов С.В., Тетенева Н.А., Штратникова В.Ю., Плакунов В.К. Никлозамид как перспективный антибиопленочный агент // Микробиология. 2017. Т. 86. С. 439–447.
Zhurina M.V., Gannesen A.V., Mart’yanov S.V., Teteneva N.A., Shtratnikova V.Y., Plakunov V.K. Niclosamide as a promising antibiofilm agent // Microbiology (Moscow). 2017. V. 86. P. 455–462.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. Мультивидовые биопленки в экологии, медицине и биотехнологии // Микробиология. 2015. Т. 84. С. 623–644.
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. Multi-species biofilms in ecology, medicine, and biotechnology // Microbiology (Moscow). 2015. V. 84. P. 731–750.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. С. 484–489.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509–513.
Ako-Nai K.A., Omo-Omorodion B. Bacterial colonization of the vagina, oropharynx, breast milk and anterior nares of neonates among HIV seropositive pregnant women and seronegative pregnant counterparts // J. Microbiol. Exp. 2019. V. 7. P. 116–124.
Boutcher S.H., Maw G.J., Taylor N.A. Forehead skin temperature and thermal sensation during exercise in cool and thermoneutral environments // Aviat. Space Environ. Med. 1995. V. 66. P. 1058–1066.
Boyanova L. Stress hormone epinephrine (adrenaline) and norepinephrine (noradrenaline) effects on the anaerobic bacteria // Anaerobe. 2017. V. 44. P. 13–19.
Chen C., Song X., Wei W., Zhong H., Dai J., Lan Z., Li F., Yu X., Feng Q., Wang Z., Xie H., Chen X., Zeng C., Wen B., Zeng L., Du H., Tang H., Xu C., Xia Y., Xia H., Yang H., Wang J., Wang J., Madsen L., Brix S., Kristiansen K., Xu X., Li J., Wu R., Jia H. The microbiota continuum along the female reproductive tract and its relation to uterine-related diseases // Nat. Commun. 2017. V. 8. P. 875.
Chen Y.E., Fischbach M.A., Belkaid Y. Skin microbiota–host interactions // Nature. 2018. V. 553. P. 427–436.
Daeschlein G., Scholz S., Ahmed R., von Woedtke T., Haase H., Niggemeier M., Kindel E., Brandenburg R., Weltmann K.D., Juenger M. Skin decontamination by low-temperature atmospheric pressure plasma jet and dielectric barrier discharge plasma // J. Hosp. Infect. 2012. V. 81. P. 177–183.
Frank K.L., Patel R. Intravenously administered pharmaceuticals impact biofilm formation and detachment of Staphylococcus lugdunensis and other staphylococci // Diagn. Microbiol. Infect. Dis. 2008. V. 60. P. 9–16.
Gannesen A.V., Lesouhaitier O., Racine P.J., Barreau M., Netrusov A.I., Plakunov V.K., Feuilloley M.G. Regulation of monospecies and mixed biofilms formation of skin Staphylococcus aureus and Cutibacterium acnes by human natriuretic peptides // Front. Microbiol. 2018. V. 9. P. 2912. https://doi.org/10.3389/fmicb.2018.02912
Hanafy R.A., Couger M.B., Baker K., Murphy C., O’Kane S.D., Budd C., French D.P., Youssef N. Draft genome sequence of Micrococcus luteus strain O’Kane implicates metabolic versatility and the potential to degrade polyhydroxybutyrates // Genom. Data. 2016. V. 9. P. 148–153.
Jahns A.C., Lundskog B., Ganceviciene R., Palmer R.H., Golovleva I., Zouboulis C.C., McDowell A., Patrick S., Alexeyev O.A. An increased incidence of Propionibacterium acnes biofilms in acne vulgaris: a case-control study // Br. J. Dermatol. 2012. V. 167. P. 50–58.
Khorvash F., Abdi F., Kashani H.H, Naeini F.F., Narimani T. Staphylococcus aureus in acne pathogenesis: a case-control study // N. Am. J. Med. Sci. 2012. V. 4. P. 573–576.
Kloos W.E., Tornabene T.G., Schleifer K.H. Isolation and characterization of micrococci from human skin, including two new species: Micrococcus lylae and Micrococcus kristinae // Int. J. Syst. Evol. Microbiol. 1974. V. 24. P. 79–101.
Laba W., Choinska A., Rodziewicz A., Piegza M. Keratinolytic abilities of Micrococcus luteus from poultry waste // Brazil. J. Microbiol. 2015. V. 46. P. 691–700.
Lange-Asschenfeldt B., Marenbach D., Lang C., Patzelt A., Ulrich M., Maltusch A., Terhorst D., Stockfleth E., Sterry W., Lademann J. Distribution of bacteria in the epidermal layers and hair follicles of the human skin // Skin Pharmacol. Physiol. 2011. V. 24. P. 305–311.
Lesouhaitier O., Veron W., Chapalain A., Madi A., Blier A.-S., Dagorn A., Connil N., Chevalier S., Orange N., Feuilloley M. Gram-negative bacterial sensors for eukaryotic signal molecules // Sensors (Basel, Switzerland). 2009. V. 9. P. 6967–6990.
Lyte M., Freestone P.P.E., Neal C.P., Olson B.A., Haigh R.D., Bayston R., Williams P.H. Stimulation of Staphylococcus epidermidis growth and biofilm formation by catecholamine inotropes // Lancet. 2003. V. 361. P. 130–135.
Matard B., Meylheuc T., Briandet R., Casin I., Assouly P., Cavelier-balloy B., Reygagne P. First evidence of bacterial biofilms in the anaerobe part of scalp hair follicles: a pilot comparative study in folliculitis decalvans // J. Eur. Acad. Dermatol. Venereol. 2013. V. 27. P. 853–860.
Matsuura K., Asano Y., Yamada A., Naruse K. Detection of Micrococcus luteus biofilm formation in microfluidic environments by pH measurement using an ion-sensitive field-effect transistor // Sensors. 2013. V. 13. P. 2484–2493.
Mauclaire L., Egli M. Effect of simulated microgravity on growth and production of exopolymeric substances of Micrococcus luteus space and earth isolates // FEMS Immun. Med. Microbiol. 2010. V. 59. P. 350–356.
N’Diaye A., Gannesen A., Borrel V., Maillot O., Enault J., Racine P.-J., Plakunov V., Chevalier S., Lesouhaitier O., Feuilloley M.G.J. Substance P and calcitonin gene-related peptide: key regulators of cutaneous microbiota homeostasis // Front. Endocrinol. 2016. V. 8. Article 15. https://doi.org/10.3389/fendo.2017.00015
Phillips K.G., Jacques S.L., McCarty O.J.T. Measurement of single cell refractive index, dry mass, volume, and density using a transillumination microscope // Phys. Rev. Lett. 2012. V. 109. Article 118105. https://doi.org/10.1103/PhysRevLett.109.118105
Surger M.J., Angelov A., Stier P., Übelacker M., Liebl W. Impact of branched-chain amino acid catabolism on fatty acid and alkene biosynthesis in Micrococcus luteus // Front. Microbiol. 2018. V. 9. Article 374. https://doi.org/10.3389/fmicb.2018.00374
Ten Broeke-Smits N.J., Kummer J.A., Bleys R.L., Fluit A.C., Boel C.H. Hair follicles as a niche of Staphylococcus aureus in the nose; is a more effective decolonisation strategy needed? // J. Hosp. Infect. 2010. V. 76. P. 211–214.
Young M., Artsatbanov V., Beller H.R., Chandra G., Chater K.F., Dover L.G., Goh E.B., Kahan T., Kaprelyants A.S., Kyrpides N., Lapidus A., Lowry S.R., Lykidis A., Mahillon J., Markowitz V., Mavromatis K., Mukamolova G.V., Oren A., Rokem J.S., Smith M.C., Young D.I., Greenblatt C.L. Genome sequence of the fleming strain of Micrococcus luteus, a simple free-living actinobacterium // J. Bacteriol. 2009. V. 192. P. 841–860.
Дополнительные материалы отсутствуют.


