Микробиология, 2020, T. 89, № 4, стр. 419-431
Биовыщелачивание теннантита и энаргита умеренно-термофильными ацидофильными микроорганизмами
Ю. А. Елкина a, b, *, Е. А. Мельникова b, В. С. Меламуд b, А. Г. Булаев a, b
a Биологический факультет, Московский государственный университет им. М.В. Ломоносова
119192 Москва, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: yollkina@mail.ru
Поступила в редакцию 30.12.2019
После доработки 13.03.2020
Принята к публикации 18.03.2020
Аннотация
Целью данной работы было изучение процесса биовыщелачивания халькопирита (CuFeS2), энаргита (Cu3AsS4) и теннантита (Cu12As4S13) различными чистыми и смешанными культурами умеренно-термофильных микроорганизмов, представителей групп, доминирующих в технологических процессах (Acidithiobacillus caldus MBC-1, Sulfobacillus thermosulfidooxidans SH-1 и Acidiplasma sp. MBA-1), в различных условиях (температура от 40 до 60°C, присутствие в среде ионов Fe2+, пирита (FeS2) и пирротина (FeS)). Показано, что биовыщелачивание меди из халькопирита и энаргита в большей степени зависело от температуры и практически не зависело от состава культуры микроорганизмов. За 30 сут эксперимента в оптимальных условиях (50–55°C) из халькопирита было выщелочено 25–27% меди, а из энаргита – 14% меди. Повышение температуры до 60°C ингибировало биовыщелачивание меди из обоих минералов. Оптимальной температурой для биовыщелачивания теннантита было 45°C, при этом скорость биовыщелачивания существенно зависела от состава микробной культуры. В эксперименте со смешанной культурой всех трех штаммов было выщелочено 26% меди, тогда как в экспериментах с чистыми культурами A. caldus MBC-1, S. thermosulfidooxidans SH-1 и Acidiplasma sp. MBA-1 за 30 сут – 12, 21 и 18% меди соответственно. Внесение в среду Fe2+ в виде сульфата позволило увеличить степень выщелачивания меди из энаргита и теннантита, что связано с тем, что при биоокислении Fe2+ микроорганизмами генерируются ионы Fe3+, которые являются сильным окислителем и играют важную роль в процессе выщелачивания сульфидных минералов. В присутствии пирита и пирротина скорость выщелачивания энаргита и теннантита увеличивалась, вероятно, из-за присутствия в среде ионов Fe3+, которые образовывались при биоокислении сульфидных минералов железа. Результаты работы показывают, что разные факторы среды по-разному влияли на биовыщелачивание минералов меди, что должно учитываться, в том числе, при планировании испытаний по биовыщелачиванию минерального сырья.
Большая часть запасов меди в мире (около 90%) содержится в сульфидных рудах, которые, главным образом, перерабатываются путем получения медных концентратов и их пирометаллургической переработки (World Copper Factbook, 2017; Pietrzyk, Tora, 2018). В настоящее время в металлургии меди существует проблема, связанная с истощением запасов богатого и легко перерабатываемого минерального сырья, особенно актуальная с точки зрения необходимости восполнения сырьевой базы крупных действующих предприятий в старых горно-рудных районах (Watling, 2006; Машковцев, 2007; Filippou et al., 2007; Gentina, Acevedo, 2013; Mudd et al., 2013; Northey et al., 2014; Наталенко и соавт., 2015; Иванов и соавт., 2017; Singer, 2017; Полянская и соавт., 2018; Mudd, Jowitt, 2018). Поэтому в переработку вовлекаются низкокачественные руды, в том числе труднообогатимые, а также руды, содержащие токсичные примеси, например, мышьяк (Filippou et al., 2007). Их переработка традиционными пирометаллургическими методами сопряжена с рядом трудностей, такими как потеря ценных продуктов с отходами обогащения и необходимость использования специальных систем очистки газов, так как при пирометаллургической переработке такого сырья образуются высокотоксичные летучие оксиды мышьяка As2O3 и As4O6 (Diaz et al., 2018).
Альтернативой для пирометаллургической переработки сульфидных руд, в том числе медных, являются гидрометаллургические технологии, основанные на методах кислотного выщелачивания и биовыщелачивания, которые, по разным оценкам, обеспечивают от 15 до 20% мирового производства меди (Johnson, 2014; World Copper Factbook, 2017). Тогда как кислотное выщелачивание применяется в основном для переработки оксидных руд, то биовыщелачивание повсеместно используется для переработки сульфидных руд, в том числе бедных и труднообогатимых (Gentina, Acevedo, 2013; Johnson, 2014).
Для переработки бедных сульфидных руд цветных металлов в основном используются кучное и отвальное биовыщелачивание. В промышленности биогидрометаллургические технологии кучного выщелачивания меди в основном применяют в странах с теплым климатом, например, в Чили и некоторых других странах Южной Америки (Gentina, Acevedo, 2013). В настоящее время около 5% мирового производства меди осуществляется именно кучным биовыщелачиванием (Johnson, 2014).
В основе биовыщелачивания цветных металлов лежит процесс окисления сульфидных минералов ацидофильными микроорганизмами, которые используют в качестве источника энергии элементарную серу и ее восстановленные соединения и двухвалентное железо. Используемые в биогидрометаллургии ацидофильные хемолитотрофные микроорганизмы обладают различными физиологическими свойствами, которые позволяют им приспособиться к широкому диапазону условий (Johnson, 2014; Кондратьева и соавт., 2015). Таким образом, варьируя условия процесса биовыщелачивания, можно повысить эффективность биотехнологических методов переработки сульфидных руд. В промышленности для проведения процессов биовыщелачивания используются не чистые культуры микроорганизмов, а смешанные микробные популяции, при этом при проведении технологических процессов часто наблюдается сукцессия, связанная с изменением условий в процессе переработки минерального сырья. Так как окисление сульфидных минералов является экзотермическим процессом, при проведении процессов кучного биовыщелачивания со временем происходит увеличение температуры и вытеснение мезофильных микроорганизмов термофильными (Brierley, 2003; Plumb et al., 2007; Riekkola-Vanhanen, 2007).
Взаимодействие между микроорганизмами в популяциях, осуществляющих процессы биовыщелачивания, в значительной степени влияет на скорость и эффективность процесса биоокисления сульфидных руд (Кондратьева и соавт., 2015; Mahmoud et al., 2017). Так как промышленные процессы биовыщелачивания сопровождаются повышением температуры и осуществляются при повышенной температуре (40–50°C), то доминирующими в популяциях, осуществляющих данные процессы, зачастую являются умеренно-термофильные микроорганизмы. Показано, что такие микроорганизмы относятся к родам бактерий Acidithiobacillus и Sulfobacillus и родам архей Acidiplasma и Ferroplasma семейства Ferroplasmaceae (Rawlings et al., 1999; Okibe et al., 2003; Dopson, Lindstrom, 2004; Morin, d’Hugues, 2007; van Hille et al., 2011, van Hille et al., 2013; Muravyov, Bulaev, 2013; Bulaev et al., 2020; Mahmoud et al., 2017) (табл. S1 , дополнительные материалы). Умеренно-термофильные представители рода Acidithiobacillus (вид A. caldus) являются автотрофными микроорганизмами, которые в микробных сообществах могут обеспечивать миксотрофных и гетеротрофных представителей родов Sulfobacillus и Acidiplasma органическим источником углерода (Кондратьева и соавт., 2015).
Наиболее распространенным минералом меди, имеющим наибольшее значение для промышленности, является халькопирит (CuFeS2) (Baba et al., 2012). Нужно отметить, что он является упорным к процессу биологического выщелачивания минералом, но халькопиритные концентраты успешно подвергаются пирометаллургическим переделам (Watling, 2006; Baba et al., 2012). Мышьяк-содержащие минералы меди также широко распространены: энаргит (Cu3AsS4) часто встречается в эпитермальных золото-медных месторождениях, теннантит (Cu12As4S13) может быть обнаружен в мезотермальных месторождениях (Filippou et al., 2007). Необходимо отметить, что переработка руд, содержащих энаргит и теннантит, является проблемой из-за токсичных газовых выбросов (Filippou et al., 2007; Diaz et al., 2018). Поэтому для переработки мышьяк-содержащих медных руд и концентратов предлагаются различные альтернативные методы, например, автоклавное выщелачивание (Ягудина, 2015).
Сульфидные минералы подвергаются биоокислению посредством различных многостадийных механизмов, при этом в процессе биоокисления формируются различные интермедиаты, которые могут замедлять процессы биовыщелачивания. В частности, на поверхности некоторых сульфидных минералов образуется слой элементарной серы, которая сравнительно инертна, что приводит к снижению скорости процесса биовыщелачивания (Schippers, Sand, 1999). Процесс биовыщелачивания халькопирита интенсивно изучается много лет (Rodriguez et al., 2003; Ma et al., 2018). Так, показано, что преобладание в смешанной микробной культуре, окисляющей халькопирит, сероокислителей позволяло ускорить процесс его биовыщелачивания (Ma et al., 2018). В отличие от биоокисления халькопирита, биовыщелачивание энаргита и теннантита является менее изученным. Разработка технологий для биотехнологической переработки минерального сырья различного состава требует данных о зависимости процесса биовыщелачивания разных сульфидных минералов от разных условий среды (температуры, pH, Eh), а также от состава микробной популяции, которая осуществляет процесс.
Целью данной работы было изучение процесса биовыщелачивания халькопирита, энаргита и теннантита при различной температуре чистыми и смешанными культурами умеренно-термофильных микроорганизмов – представителей групп, доминирующих в технологических процессах чанового биоокисления сульфидных концентратов, для определения влияния разных факторов на процесс биовыщелачивания содержащих мышьяк сульфидных минералов меди и сравнения его с влиянием изучаемых факторов на процесс биовыщелачивания халькопирита.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования являлись сульфидные минералы меди халькопирит (CuFeS2), энаргит (Cu3AsS4) и теннантит (Cu12As4S13), а также пирит (FeS2) и пирротин (FeS), измельченные до крупности не более 75 мкм. В работе использован пирит (месторождение Акчатау, Карагандинская область, Казахстан); халькопирит (месторождение Уансала, Перу) был предоставлен компанией “Магазин камней “Камневеды” (Россия), энаргит (Березняковское месторождение, Челябинская область, Россия) был предоставлен компанией “Магазин коллекционных минералов” (Россия), теннантит (Березовское месторождение, Свердловская область, Россия) был предоставлен компанией “Мир самоцветов” (Россия), пирротин (месторождение Таежное, Республика Саха, Россия) был предоставлен Геологическим музеем ГУП “Сахагеоинформ” Госкомгеологии Республики Саха (Якутия) (Россия). Минералы были идентифицированы по макроскопическим свойствам. В образцах минералов определяли содержание основных элементов (железа, меди, мышьяка, сурьмы).
В работе использованы чистые и смешанные культуры умеренно-термофильных ацидофильных микроорганизмов, включая штаммы Acidi-thiobacillus caldus MBC-1, Sulfobacillus thermosulfidooxidans SH-1 и Acidiplasma sp. MBA-1, выделенные ранее из образцов руд и пульпы реакторов биоокисления (Булаев и соавт., 2012; Muravyov, Bulaev, 2013). Свойства штаммов представлены в табл. 1. Необходимо отметить, что все исследованные штаммы способны к окислению серы, но A. caldus MBC-1 является наиболее активным сероокислителем, что было показано в модельном эксперименте (рис. S1 , дополнительные материалы). Данные штаммы был выбраны для проведения экспериментов, так как они являются представителями групп микроорганизмов, которые доминируют в микробных популяциях, осуществляющих процессы реакторного биоокисления сульфидных концентратов различного состава, в том числе, в промышленном масштабе (табл. S1, дополнительные материалы). Поскольку важным для понимания закономерностей процесса биовыщелачивания различных сульфидных минералов является вопрос о роли отдельных микроорганизмов в этом процессе, то для проведения экспериментов были использованы как чистые, так и смешанные культуры штаммов микроорганизмов в различном сочетании.
Таблица 1.
Физиологические свойства штаммов, использованных при проведении экспериментов
| Штамм | Донор электронов | Углеродное питание | Температура, °С (оптимум/верхний предел) |
|---|---|---|---|
| Acidithiobacillus caldus MBC-1 | S0 | Автотроф | 45/53 |
| Sulfobacillus thermosulfidooxidans SH-1 | Fe2+, S0 | Миксотроф | 50/60 |
| Acidiplasma sp. MBA-1 | Fe2+, S0 | Гетеротроф | 50–55/63 |
Условия культивирования. Для проведения экспериментов была использована жидкая питательная среда, содержащая минеральные соли (г/л): (NH4)2SO4 – 3.0, KCl – 0.2, MgSO4 · 7H2O – 0.5, K2HPO4 – 0.5. Чтобы установить начальный pH на уровне 1.5, в среду добавляли 1.5 мл/л концентрированной серной кислоты. Для роста двух исследуемых штаммов (S. thermosulfidooxidans SH-1 и Acidiplasma sp. MBA-1) необходимо наличие органического источника углерода, поэтому в среду также добавляли 0.02% дрожжевого экстракта.
Опыты проводили в колбах со 100 мл питательной среды и 2 г соответствующего минерала на ротационной качалке (200 об./мин) в течение 30 сут. Эксперименты по определению влияния состава культуры на скорость биовыщелачивания минералов проводили при 45°C, так как при данной температуре могут расти все исследуемые штаммы. Для экспериментов использовали следующие сочетания штаммов: чистая культура S. thermosulfidooxidans SH-1; чистая культура Acidiplasma sp. MBA-1; чистая культура Acidithiobacillus caldus MBC-1; смешанная культура S. thermosulfidooxidans SH-1 и A. caldus MBC-1; смешанная культура Acidiplasma sp. MBA-1 и A. caldus MBC-1; смешанная культура S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1. Кроме того, исследовали зависимость процесса биовыщелачивания минералов от температуры в пределах от 40 до 60°C с шагом в 5°C. В этих экспериментах использовали смешанную культуру, содержащую все три штамма. С данной смешанной культурой при 50°C были проведены эксперименты по биовыщелачиванию в присутствии 35 мМ (~2 г/л) ионов Fe2+, которые вносили в среду в виде FeSO4 · 7H2O. Биоокисление ионов Fe2+ микроорганизмами приводило к генерации ионов Fe3+, которые являются окислителем и могут воздействовать на процесс биоокисления сульфидных минералов.
Был проведен эксперимент по влиянию присутствия сульфидных минералов железа – пирита (FeS2) и пирротина (FeS) – на биовыщелачивание теннантита и энаргита. Эксперименты проводили в колбах со 100 мл питательной среды и 1 г энаргита или теннантита и 1 г пирита или пирротина на ротационной качалке (200 об./мин) при 50°C в течение 30 сут с использованием смешанной культуры S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1.
Штаммы во всех экспериментах инокулировали таким образом, чтобы начальная численность каждого микроорганизма составляла примерно 1 × 107 кл/мл.
Анализ проб. Для проведения анализа отбирали пробы жидкой фазы на 10, 20 и 30 сут. Во всех отобранных пробах измеряли pH, окислительно-восстановительный потенциал (Eh), содержание двух- и трехвалентного железа, мышьяка и меди. Концентрацию ионов железа в среде определяли спектрофотометрически роданидным методом (Резников и соавт., 1970). Содержание мышьяка в среде измеряли с помощью метода атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой. Содержание меди измеряли на атомно-абсорбционном спектрометре “Perkin Elmer 3100” (США). Степень выщелачивания меди из минералов оценивали по концентрации ионов меди в среде.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данные, полученные в экспериментах по биовыщелачиванию минералов, представлены в табл. 2–4 и на рис. 1−4, а также на рис. S2–S4 в файле с дополнительными материалами.
Таблица 2.
Изменение концентрации меди в среде в процессе биовыщелачивания халькопирита в различных условиях (при температурах 40–60°C чистыми и смешанными культурами микроорганизмов)
| Т, °C | Состав культуры | Концентрация Cu2+, г/л | ||
|---|---|---|---|---|
| 10 сут | 20 сут | 30 сут | ||
| 45 | S. thermosulfidooxidans SH-1 | 0.5 ± 0.04 | 0.8 ± 0.05 | 1.1 ± 0.02 |
| A. caldus MBC-1 | 0.5 ± 0.05 | 0.8 ± 0.09 | 1.2 ± 0.09 | |
| Acidiplasma sp. MBA-1 | 0.6 ± 0.01 | 0.9 ± 0.03 | 1.3 ± 0.09 | |
| S. thermosulfidooxidans SH-1 и A. caldus MBC-1 | 0.6 ± 0.09 | 0.9 ± 0.17 | 1.3 ± 0.08 | |
| Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 0.5 ± 0.08 | 0.9 ± 0.12 | 1.2 ± 0.22 | |
| S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 0.5 ± 0.07 | 0.9 ± 0.09 | 1.2 ± 0.12 | |
| 40 | S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 0.5 ± 0.02 | 0.7 ± 0.01 | 1.0 ± 0.01 |
| 50 | 0.8 ± 0.28 | 1.2 ± 0.32 | 1.8 ± 0.29 | |
| 55 | 0.9 ± 0.10 | 1.5 ± 0.29 | 1.9 ± 0.11 | |
| 60 | 0.7 ± 0.11 | 0.9 ± 0.09 | 1.2 ± 0.07 | |
Таблица 3.
Изменение концентрации меди в среде в процессе биовыщелачивания энаргита в различных условиях (при температурах 40–60°C чистыми и смешанными культурами микроорганизмов)
| Т, °C | Состав культуры | Концентрация Cu2+, г/л | ||
|---|---|---|---|---|
| 10 сут | 20 сут | 30 сут | ||
| 45 | S. thermosulfidooxidans SH-1 | 0.9 ± 0.68 | 1.2 ± 0.12 | 1.4 ± 0.01 |
| A. caldus MBC-1 | 0.8 ± 0.04 | 1.1 ± 0.17 | 1.2 ± 0.07 | |
| Acidiplasma sp. MBA-1 | 0.6 ± 0.14 | 0.9 ± 0.20 | 1.1 ± 0.33 | |
| S. thermosulfidooxidans SH-1 и A. caldus MBC-1 | 0.6 ± 0.05 | 0.9 ± 0.07 | 1.0 ± 0.03 | |
| Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 0.7 ± 0.03 | 1.1 ± 0.01 | 1.2 ± 0.02 | |
| S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 0.7 ± 0.02 | 0.9 ± 0.13 | 1.3 ± 0.17 | |
| 40 | S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 0.5 ± 0.07 | 0.7 ± 0.04 | 0.8 ± 0.06 |
| 50 | 0.8 ± 0.13 | 1.2 ± 0.19 | 1.4 ± 0.09 | |
| 55 | 1.0 ± 0.09 | 1.1 ± 0.04 | 1.4 ± 0.01 | |
| 60 | 0.6 ± 0.22 | 0.6 ± 0.06 | 0.6 ± 0.21 | |
| 50 | S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 + Fe2+ | 0.9 ± 0.15 | 1.4 ± 0.07 | 1.7 ± 0.01 |
Таблица 4.
Изменение концентрации меди в среде в процессе биовыщелачивания теннантита в различных условиях (при температурах 40–60°C чистыми и смешанными культурами микроорганизмов)
| Т, °C | Состав культуры | Концентрация Cu2+, г/л | ||
|---|---|---|---|---|
| 10 сут | 20 сут | 30 сут | ||
| 45 | S. thermosulfidooxidans SH-1 | 1.3 ± 0.27 | 1.6 ± 0.07 | 2.1 ± 0.05 |
| A. caldus MBC-1 | 0.9 ± 0.22 | 1.1 ± 0.15 | 1.2 ± 0.26 | |
| Acidiplasma sp. MBA-1 | 1.0 ± 0.06 | 1.6 ± 0.08 | 1.8 ± 0.01 | |
| S. thermosulfidooxidans SH-1 и A. caldus MBC-1 | 1.4 ± 0.38 | 2.1 ± 0.51 | 2.2 ± 0.03 | |
| Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 1.3 ± 0.11 | 1.9 ± 0.01 | 2.8 ± 0.23 | |
| S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 1.1 ± 0.44 | 1.7 ± 0.22 | 2.7 ± 0.14 | |
| 40 | S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 | 0.9 ± 0.02 | 1.2 ± 0.07 | 1.6 ± 0.02 |
| 50 | 1.0 ± 0.06 | 1.5 ± 0.04 | 1.9 ± 0.09 | |
| 55 | 1.3 ± 0.10 | 1.3 ± 0.08 | 1.5 ± 0.01 | |
| 60 | 1.2 ± 0.09 | 1.3 ± 0.28 | 1.3 ± 0.02 | |
| 50 | S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 + Fe2+ | 1.9 ± 0.31 | 2.4 ± 0.05 | 2.3 ± 0.07 |
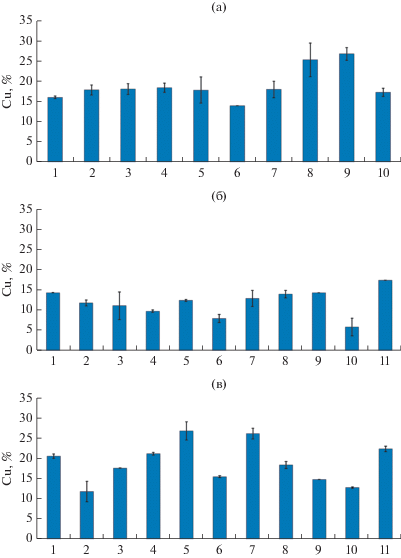
Рис. 1.
Извлечение меди из халькопирита (а), энаргита (б) и теннантита (в) после 30 сут биовыщелачивания. Варианты эксперимента: 1 – чистая культура S. thermosulfidooxidans SH-1, 45°C; 2 – чистая культура A. caldus MBC-1, 45°C; 3 – чистая культура Acidiplasma sp. MBA-1, 45°C; 4 – S. thermosulfidooxidans SH-1 и A. caldus MBC-1, 45°C; 5 – Acidiplasma sp. MBA-1 и A. caldus MBC-1, 45°C; 6 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 40°C; 7 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 45°C; 8 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 50°C; 9 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 55°C; 10 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 60°C; 11 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 50°C, среда с 35 мМ Fe2+.
При окислении халькопирита во всех условиях, кроме биовыщелачивания при температурах 50, 55 и 60°C, происходило постепенное увеличение pH (до 1.91–1.95) (рис. S2 а и S2б, кривые 1–7). При 50 и 55°C pH на 20 сут повысился до 1.92 и 1.82 соответственно, а потом наблюдалось его снижение на 30 сут (до 1.63 и 1.72 соответственно) (рис. S2 б, кривые 8 и 9). При 60°C pH постепенно повышался и на 30 сут достиг значения 2.27 (рис. S2 б, кривая 10).
Значения Eh в большинстве вариантов эксперимента с халькопиритом соответствовали величинам, наблюдаемым при активном окислении сульфидных минералов (>750 мВ) (рис. S2 в и S2г), но при 60°C наблюдаемое значение Eh было значительно ниже, чем в других вариантах эксперимента, и составило примерно 600 мВ (рис. S2 г, кривая 10). Относительно низким был Eh в эксперименте с Acidiplasma sp. MBA-1: на 30 сут он составил 692 мВ (рис. S2 в, кривая 3).
В экспериментах с чистыми и смешанными культурами при 40 и 45°C суммарная концентрация ионов железа (Fe3+ и Fe2+) на 30 сут эксперимента составила 0.9–1.1 г/л (рис. S2 д и S2е, кривые 1–7). При 50°С она составила 0.7 г/л (рис. S2 е, кривая 8), а при 55°С была существенно ниже – около 0.4 г/л (рис. S2 е, кривая 9). При 60°C суммарная концентрация ионов железа составила 0.8 г/л (рис. S2 е, кривая 10). Необходимо отметить, что во всех вариантах эксперимента, за исключением биовыщелачивания при 60°C, практически все железо было представлено ионами Fe3+, а концентрации ионов Fe2+ были следовыми (рис. S2 е и S2з, кривые 1–9). При 60°C на 30 сут концентрации ионов Fe3+ и Fe2+ составили 0.1 и 0.7 г/л соответственно (рис. S2 е и S2з, кривая 10).
При более высокой температуре в растворах сульфата трехвалентного железа увеличивается скорость образования ярозита, согласно реакции (Das et al., 1996):
где Me – это ионы K+, Na+, ${\text{NH}}_{{\text{4}}}^{ + },$ H3O+.
Это приводит к уменьшению концентрации ионов Fe3+ в среде, чем может объясняться относительно низкая концентрация ионов железа при 55°C (рис. S2 е и S2з, кривая 9). При 60°C железо было представлено, главным образом, ионами Fe2+, поэтому существенного снижения концентрации ионов железа в среде в результате формирования осадка ярозита происходить не могло (рис. S2 е и S2з, кривая 10). Исходя из данных о концентрации ионов железа в среде при различных вариантах эксперимента, можно утверждать, что практически при всех условиях биовыщелачивание халькопирита проходило достаточно активно, но при 60°C процесс биоокисления ингибировался, что приводило к высокому соотношению концентраций ионов Fe2+/Fe3+ (рис. S2 е и S2з, кривая 10).
Данные по изменению содержания меди в жидкой фазе в процессе биовыщелачивания халькопирита представлены в табл. 2. Необходимо отметить, что в экспериментах с разными чистыми и смешанными культурами микроорганизмов концентрации ионов меди в среде и, соответственно, степени биовыщелачивания меди (рис. 1а, столбцы 1–5 и 7) различались очень незначительно (16–18%). При этом степень биовыщелачивания зависела от температуры и достигала максимума при 50 и 55°C (25 и 27% соответственно) (рис. 1а, столбцы 8 и 9). При 60°C степень выщелачивания была несколько ниже (17%) (рис. 1а, столбец 10), что, вероятно, объясняется снижением активности микроорганизмов при высокой температуре.
В процессе биовыщелачивания энаргита pH в разных вариантах различался незначительно, и на 30 сут эксперимента он составил 1.6–1.7 (рис. S3 а и S3б, кривые 1–10). В варианте, где в среду вносили дополнительно 35 мМ Fe2+, pH на 30 сут был несколько ниже, чем в других вариантах (1.55) (рис. S3 б, кривая 11).
Eh в большинстве вариантов условий окисления энаргита на 30 сут был в диапазоне 750–760 мВ (рис. S3 в и S3г, кривые 1–8), но при проведении биовыщелачивания при 60°C он был ниже и составил 593 мВ (рис. S3 г, кривые 10). Это свидетельствует о том, что при температуре 60°C активность штаммов снижалась по сравнению с более низкими температурами. В варианте эксперимента, в котором в среду вносили 35 мМ Fe2+, Eh был значительно выше (835 мВ) (рис. S3 г, кривые 11), чем в других вариантах условий, что может объясняться значительно более высокой концентрацией ионов Fe3+, которые образовались при окислении Fe2+, по сравнению с другими вариантами эксперимента.
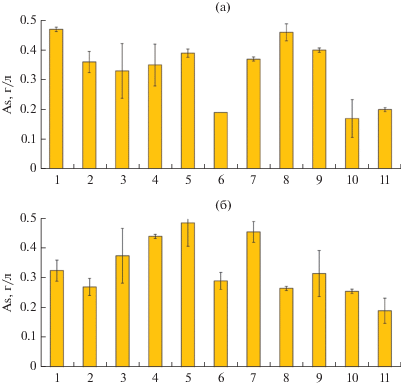
Концентрации мышьяка в среде после 30 сут биовыщелачивания энаргита показаны на рис. 2а. При 45°C концентрации мышьяка не различались значительно и составили 0.33–0.39 г/л (рис. 2а, столбцы 2–5 и 7). Исключение составил эксперимент с чистой культурой S. thermosulfidooxidans SH-1, в котором концентрация мышьяка составила 0.47 г/л (рис. 2а, столбец 1). Концентрация мышьяка была также относительно высокой при 50°C (0.46 г/л) (рис. 2а, столбец 8). При этом при 40 и 60°C концентрации мышьяка были относительно низкими (0.19 и 0.17 г/л соответственно) (рис. 2а, столбцы 6 и 10). В варианте эксперимента, в котором в среду вносили 35 мМ Fe2+, концентрация мышьяка также была достаточно низкой – 0.20 г/л (рис. 2а, столбец 11).
Рис. 2.
Концентрация мышьяка в среде после 30 сут биовыщелачивания энаргита (а) и теннантита (б). Варианты эксперимента: 1 – чистая культура S. thermosulfidooxidans SH-1, 45°C; 2 – чистая культура A. caldus MBC-1, 45°C; 3 – чистая культура Acidiplasma sp. MBA-1, 45°C; 4 – S. thermosulfidooxidans SH-1 и A. caldus MBC-1, 45°C; 5 – Acidiplasma sp. MBA-1 и A. caldus MBC-1, 45°C; 6 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 40°C; 7 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 45°C; 8 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 50°C; 9 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 55°C; 10 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 60°C; 11 – S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1, 50°C, среда с 35 мМ Fe2+.
Результаты опытов по биовыщелачиванию меди из энаргита показаны в табл. 3 и на рис. 1б. Извлечение меди из энаргита при температуре 45°C разными культурами различалось незначительно (10–12%) (рис. 2б, столбцы 2–5). Несколько выше была степень выщелачивания в эксперименте с чистой культурой S. thermosulfidooxidans SH-1 и при использовании смешанной культуры трех штаммов (14 и 13% соответственно) (рис. 2б, столбцы 1 и 7). Степень биовыщелачивания энаргита смешанной культурой трех штаммов при температурах 45–55°C была примерно одинаковой (13–14%) (рис. 2б, столбцы 7–9), однако при 40 и 60°C степень выщелачивания меди была ниже (8 и 6% соответственно) (рис. 2б, столбцы 6 и 10). Таким образом, скорость выщелачивания меди, очевидно, зависела от температуры, но при 60°C активность биовыщелачивания снижалась.
Необходимо отметить, что концентрации ионов железа во всех вариантах эксперимента, кроме того, в котором в среду вносили сульфат железа, были следовыми, так как энаргит может содержать только примеси железа. В варианте, в котором в среду вносили 35 мМ Fe2+, суммарная концентрация железа, начиная с 10 сут, снизилась до 0.89 и к концу эксперимента составила 0.71 г/л (рис. 3Sд). При этом уже на 10 сут железо в среде полностью окислилось до Fe3+, что свидетельствует об активном окислении железа микроорганизмами. Вероятно, концентрация ионов железа, по сравнению с начальной, снизилась более чем в два раза из-за образования ярозита. Нужно отметить, что степень выщелачивания меди из энаргита была самой высокой именно в варианте с внесением в среду сульфата двухвалентного железа (17%) (рис. 1б, столбец 11). Относительно низкая концентрация мышьяка в среде в данном варианте эксперимента (рис. 2б, столбец 11) объясняется образованием осадка скородита в присутствии относительно высоких концентраций ионов Fe3+ (Das, 2019):
Таким образом, присутствие ионов железа в среде привело к увеличению скорости выщелачивания меди из энаргита, но при этом вызвало переосаждение мышьяка.
В процессе биовыщелачивания теннантита pH в большинстве экспериментов различался незначительно; он постепенно увеличивался в процессе выщелачивания и на 30 сут эксперимента составил 1.99–2.13 (рис. S4 а и S4б, кривые 2–10). В эксперименте с чистой культурой S. thermosulfidooxidans SH-1 (рис. S4 а, кривая 1) и в варианте, где в среду вносили дополнительно 35 мМ Fe2+ (рис. S4 б, кривая 11), значения pH на 30 сут были выше, чем в других вариантах (2.36 и 2.67 соответственно).
Eh в большинстве вариантов условий окисления теннантита на 30 сут был в среднем ниже, чем при окислении халькопирита и теннантита, и составил в разных вариантах эксперимента 589–700 мВ (рис. S4 а и S4б, кривые 1–4 и 8–11). В экспериментах при температурах 40 и 45°C Eh со смешанной культурой штаммов S. thermosulfido-oxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 (рис. S4 а и S4б, кривые 6 и 7) был несколько выше (723 и 753 мВ соответственно). Кроме того, несколько выше, чем в других вариантах, Eh был в эксперименте со смешанной культурой Acidiplasma sp. MBA-1 и A. caldus MBC-1 (рис. S4 а, кривая 5). Необходимо отметить, что в варианте эксперимента с внесением 35 мМ Fe2+ Eh был относительно низким и составил 608 мВ на 30 сут эксперимента (рис. S4 б, кривая 11).
Концентрации мышьяка в среде после 30 сут биовыщелачивания теннантита показаны на рис. 2б. В отличие от экспериментов с энаргитом, при биовыщелачивании теннантита при 45°C концентрации мышьяка различались в экспериментах с разными культурами достаточно значительно и составили от 0.27 до 0.49 г/л (рис. 2б, столбцы 1–5 и 7). При этом самой низкой она была в эксперименте с чистой культурой A. caldus MBC-1 (рис. 2б, столбец 2), а самой высокой – в экспериментах со смешанными культурами (рис. 2б, столбцы 4, 5 и 7). Наиболее низкой концентрация мышьяка была в эксперименте, в котором в среду вносили сульфат железа, что, очевидно, объясняется выпадением осадка скородита, как и в эксперименте с энаргитом (рис. 2б, столбец 11).
Результаты опытов по биовыщелачиванию меди из теннантита показаны в табл. 4 и на рис. 1в. В отличие от халькопирита и теннантита, степени извлечения меди из теннантита при температуре 45°C разными культурами микроорганизмов различались значительно и составляли от 12 до 27% (рис. 1в, столбцы 1–5 и 7). Наименьшей степень выщелачивания меди была в эксперименте с чистой культурой A. caldus MBC-1 (рис. 1в, столбец 2), а наибольшей в экспериментах со смешанными культурой Acidiplasma sp. MBA-1 и A. caldus MBC-1 (рис. 1в, столбец 5) и культурой S. thermosulfidooxidans SH-1, Acidiplasma sp. MBA-1 и A. caldus MBC-1 (рис. 1в, столбец 7) (27 и 26% соответственно). Таким образом, можно утверждать, что биовыщелачивание теннантита в большей степени зависело от состава микробной культуры, чем процесс биовыщелачивания халькопирита и энаргита. Оптимальной температурой для биовыщелачивания теннантита была 45°C (26%) (рис. 1в, столбец 7), тогда как при более низкой и высоких температурах степень выщелачивания меди составила 13–18% (рис. 1в, столбцы 6 и 8–10).
Концентрации ионов железа в среде так же, как и в экспериментах с энаргитом, были следовыми, за исключением эксперимента, в котором в среду вносили сульфат железа. Закономерности изменения концентраций ионов железа Fe3+ и Fe2+ в экспериментах с теннантитом (рис. 4Sд) отличались от полученных в экспериментах с энаргитом (рис. 3Sд). Начиная с 10 сут суммарная концентрация железа снизилась до 0.22 г/л и к концу эксперимента составила всего 0.12 г/л. При этом на 10 сут железо в среде почти полностью окислилось до Fe3+, что свидетельствовало об активном окислении железа микроорганизмами. Вероятно, практически полное окисление железа могло привести и к его осаждению. На 20 сут концентрация ионов Fe3+ снизилась до 0.03 г/л, а на 30 сут – до 0.01 г/л. При этом на 20 и 30 сут концентрации ионов Fe2+ составили 0.12 и 0.11 г/л соответственно. Это подтверждается также низким значением Eh на момент окончания эксперимента. Также стоит отметить, что, хотя степень биовыщелачивания меди в данном варианте была выше, чем в аналогичных условиях без внесения в среду сульфата железа, после 20 сут биовыщелачивания концентрация меди перестала расти (табл. 4).
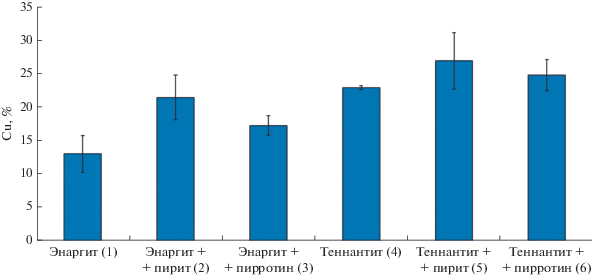
Результаты биовыщелачивания энаргита и теннантита в присутствии пирита и пирротина представлены на рис. 3 и 4. Было показано, что степень выщелачивания меди и из энаргита, и из теннантита в присутствии и пирита, и пирротина была выше, чем в экспериментах, где биовыщелачиванию подвергались энаргит и теннантит без добавления других минералов (рис. 3в и 4). Концентрации мышьяка в среде в присутствии пирита и пирротина при этом были ниже, чем в их отсутствии (рис. 3е), что объясняется осаждением мышьяка в присутствии ионов железа, источником которых были пирит и пирротин.
Рис. 3.
Изменение концентрации ионов металлов в среде в процессе биовыщелачивания и концентрация мышьяка после 30 сут биовыщелачивания энаргита и теннантита в присутствии пирита и пирротина: (а) − pH; (б) – концентрация ионов Fe3+ в среде; (в) − Eh; (г) – концентрация ионов Fe2+ в среде; (д) – концентрация меди в среде; (е) – концентрация мышьяка в среде; 1 – энаргит; 2 – энаргит и пирит; 3 – энаргит и пирротин; 4 – теннантит; 5 – теннантит и пирит; 6 – теннантит и пирротин.
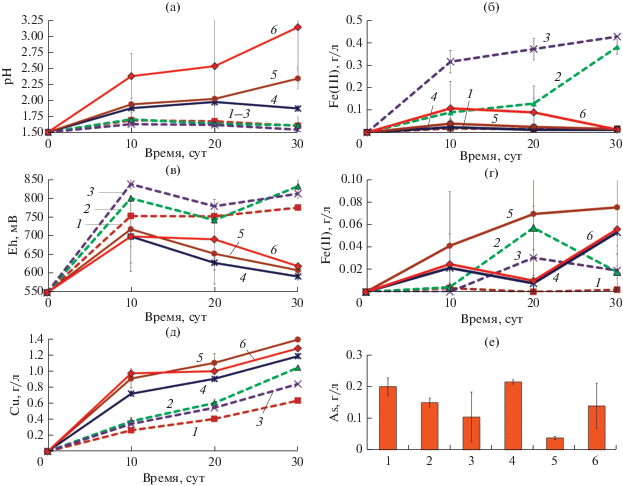
Рис. 4.
Извлечение меди из энаргита и теннантита после 30 сут биовыщелачивания в присутствии пирита и пирротина (%).
Несмотря на то, что при биовыщелачивании энаргита и теннантита в присутствии пирита и пирротина наблюдались схожие закономерности выщелачивания меди, закономерности изменения других параметров жидкой фазы различались.
Значения pH при биовыщелачивании энаргита во всех вариантах значительно не различались и на 30 сут эксперимента составили 1.54–1.61 (рис. 3а, кривые 1–3). Значения Eh во всех вариантах эксперимента по выщелачиванию энаргита были достаточно высокими (775–831 мВ) (рис. 3б, кривые 1–3). При этом концентрации ионов Fe3+ при биовыщелачивании энаргита в присутствии пирита и пирротина постепенно возрастали и на 30 сут составили 0.38 и 0.43 г/л соответственно (рис. 3г, кривые 2 и 3). Концентрации ионов Fe2+ при этом были на порядок ниже и повышались на 20 сут, а затем снижались (рис. 3д, кривые 2 и 3). Концентрации ионов железа в среде при биовыщелачивании энаргита без пирита и пирротина были следовыми (рис. 3г и 3д, кривая 1).
В процессе биовыщелачивания теннантита значения pH значительно увеличивались и различались в разных вариантах эксперимента (рис. 3а, кривые 4–6). На 30 сут эксперимента pH при биовыщелачивании теннантита составил 1.87 (рис. 3а, кривая 4), а при биовыщелачивании теннантита в присутствии пирита и пирротина он составил 2.34 и 3.13 (рис. 3а, кривые 5 и 6). Такое повышение pH приводило к тому, что концентрации ионов Fe3+ постепенно снижались (рис. 3г, кривые 5 и 6), так как при относительно высоких значениях pH увеличивается скорость образования нерастворимых соединений Fe3+ (Das et al., 1996). При этом концентрации ионов Fe2+ повышались в процессе биовыщелачивания и на 30 сут составили в присутствии пирита и пирротина 0.075 и 0.056 г/л (рис. 3д, кривые 5 и 6).
Таким образом, было показано, что в присутствии пирита и пирротина биовыщелачивание меди из энаргита и теннатита ускорялось (рис. 3в), но при этом данные о параметрах жидкой фазы показывали, что взаимодействие минералов с пиритом и пирротином, а также с микроорганизмами и окислителем Fe3+, вероятно, различалось, и механизмы их окисления могут иметь свои особенности.
В данной работе исследование биовыщелачивания сульфидных минералов меди проводилось в диапазоне температур, которые обычно поддерживаются в промышленных реакторах биовыщелачивания, а также с использованием культур микроорганизмов, являющихся представителями доминирующих в сообществах промышленных и лабораторных реакторов групп (Mahmoud et al., 2017) (табл. S1). Таким образом, они позволяли провести сравнительную оценку влияния температуры на выщелачивание исследуемых минералов, а также вклад различных групп микроорганизмов в окисление тех или иных минералов. Необходимо также отметить, что процессы биовыщелачивания различных сульфидных минералов проводятся разными авторами с использованием различных экспериментальных методов, что не всегда делает возможным корректное сопоставление данных, полученных в разных работах. В данной работе эксперименты с разными сульфидными минералами были проведены в единых методических условиях, что позволяет сопоставить влияние разных факторов на выщелачивание трех сульфидных минералов меди.
Было показано, что разные факторы среды по-разному влияли на процесс биовыщелачивания халькопирита, энаргита и теннантита. Так, скорость выщелачивания меди из халькопирита и энаргита зависела в большей степени от температуры, тогда как скорость выщелачивания меди из теннантита определялась составом микробной культуры. Для халькопирита увеличение скорости биовыщелачивания при повышении температуры известно и было продемонстрировано в работах разных авторов (Rodriguez et al., 2003; Liu et al., 2017). Подобная зависимость была также показана для биовыщелачивания энаргита, который намного более активнее выщелачивался термофильными археями рода Sulfolobus при 68°C, чем мезофильной бактерией Acidithiobacillus ferrooxidans при 35°C (Munoz et al., 2006). Результаты нашей работы демонстрируют, что скорость выщелачивания халькопирита в большей степени зависела от температуры, возрастая в диапазоне 40–55°C, и практически не зависела от состава микробной культуры. Скорость биовыщелачивания энаргита в меньшей степени зависела от температуры и практически не различалась при температурах 45–55°C. Скорость биовыщелачивания теннантита не увеличивалась при температуре выше 45°C, а наоборот, снижалась в диапазоне 45–55°C, но в значительной степени определялась составом микробной культуры. Таким образом, было показано, что одни и те же факторы разнонаправленно влияют на процесс биовыщелачивания сульфидных минералов меди. Нужно отметить, что в нашей предыдущей работе было показано, что хлорид-ион, который ускоряет процесс биовыщелачивания халькопирита (Bevilaqua et al., 2013), ингибирует биовыщелачивание энаргита и теннантита (Bulaev et al., 2019). Таким образом, в настоящей работе были получены данные, которые могут представлять собой интерес как для дальнейших исследований в области переработки минерального сырья комплексного состава, так и для фундаментально-научных исследований в области механизмов взаимодействия микроорганизмов, осуществляющих биовыщелачивания, и сульфидных минералов.
Полученные результаты указывают на необходимость углубленных исследований процессов биовыщелачивания разных по составу видов минерального сырья, в частности, влияния различных факторов среды на биоокисление различных сульфидных минералов, что может быть перспективным для дальнейшего развития биогидрометаллургических технологий. Было показано, что сульфидные минералы меди, зачастую присутствующие в одних сульфидных рудах и концентратах, наиболее активно выщелачиваются в различных условиях (соленость, температура) и разными группами микроорганизмов. Данные о влиянии факторов среды и роли разных ацидофильных микроорганизмов в окислении тех или иных минералов позволяют разработать подходы для регуляции технологических параметров процессов с учетом особенной состава конкретного минерального сырья, например, разрабатывать многостадийные схемы биовыщелачивания, которые будут включать стадии биовыщелачивания при различных температурах, обеспечивающих оптимальные условия для окисления разных компонентов концентрата.
Список литературы
Булаев А.Г., Пивоварова Т.А., Кузнецов Б.Б., Колганова Т.В., Кондратьева Т.Ф. Скорость окисления сульфидных минералов сообществами ацидофильных хемолитотрофных микроорганизмов из разных мест обитания // Микробиология. 2012. Т. 81. С. 434–442.
Bulaev A.G., Pivovarova T.A., Kuznetsov B.B., Kolganova T.V., Kondrat’eva T.F. Rates of sulfide mineral oxidation by acidophilic chemolithotrophic microbial communities from various sources // Microbiology (Moscow). 2012. V. 81. P. 397–404.
Иванов А.И., Вартанян С.С., Черных А.И., Волчков А.Г., Конкина О.М., Корчагина Д.А., Кузнецов В.В., Барышев А.Н., Донец А.И., Лихачев А.П. Состояние минерально-сырьевой базы цветных металлов (свинец, цинк, медь, никель, кобальт) // Минеральные ресурсы России. Экономика и управление. 2017. № 4. С. 11–18.
Кондратьева Т.Ф., Булаев А.Г., Муравьев М.И. Микроорганизмы в биогеотехнологиях переработки сульфидных руд. М.: Наука, 2015. 212 с.
Машковцев Г.А. Современное состояние минерально-сырьевой базы отечественной металлургии // Минеральные ресурсы России. Экономика и управление. 2007. № 5. С. 16–25.
Наталенко А.Е., Пак В.А., Ставский А.П. Основные направления развития минерально-сырьевой базы Российской Федерации // Минеральные ресурсы России. Экономика и управление. 2015. № 1. С. 2–8.
Полянская И.Г., Рыльков С.А., Юрак В.В., Масленников В.В. Минерально-сырьевая база Уральского федерального округа: на пути к сбалансированному недропользованию (на примере твердых полезных ископаемых) // Изв. Уральского гос. горного ун-та. 2018. № 3(51). С. 131–141.
Резников А.А., Муликовская Е.П., Соколов И.Ю. Методы анализа природных вод. М.: Недра, 1970. 140 с.
Ягудина Ю.Р. Разработка и обоснование параметров комбинированной технологии переработки теннантитсодержащих руд медно-колчеданных месторождений Урала. Автореферат дис. … канд. техн. наук, 22.12.2015. Магнитогорск: Магнитогорский гос. техн. ун-т им. Г.И. Носова, 2015. 20 с.
Baba A.A., Ayinla K.I., Adekola F.A., Ghosh M.K., Ayanda O.S., Bale R.B., Sheik A.R., Pradhan S.R. A review on novel techniques for chalcopyrite ore processing // Int. J. Mining Engin. Min. Process. 2012. V. 1. P. 1–16.
Bevilaqua D., Lahti H., Suegama P.H., Garcia O., Benedetti A.V., Puhakka J.A.,Tuovinen O.H. Effect of Na-chloride on the bioleaching of a chalcopyriteconcentrate in shake flasks and stirred tank bioreactors // Hydrometallurgy. 2013. V. 138. P. 1–13.
Brierley J.A. Response of microbial systems to thermal stress in heap-biooxidation pretreatment of refractory gold ores // Hydrometallurgy. 2003. V. 71. P. 13–19.
Bulaev A., Elkina Yu., Melnikova E., Melamud V. Effect of sodium chloride on copper bioleaching from sulfide minerals and concentrates // SGEM. 2019. V. 19. Is. 1.3. P. 799–804.
Bulaev A., Melamud V., Boduen A. Bioleaching of non-ferrous metals from arsenic-bearing sulfide concentrate // Solid State Phenomena. 2020. V. 299. P. 1064–1068.
Das B. Theoretical study of formation of secondary arsenic minerals: scorodite and pharmacosiderite // ACS Earth Space Chem. 2019. V. 3. P. 192–201.
Das G.K., Acharya S., Anand S., Das R.P. Jarosites: A review, mineral processing and extractive // Metallurgy Rev. 1996. V. 16. P. 185–210.
Diaz J.A., Serrano J., Leiva E. Bioleaching of arsenic-bearing copper ores // Minerals. 2018. V. 8. Art. 215. https://doi.org/10.3390/min8050215
Dopson M., Lindstrom E.B. Analysis of community composition during moderately thermophilic bioleaching of pyrite, arsenical pyrite, and chalcopyrite // Microb. Ecol. 2004. V. 48. P. 19–28.
Filippou D., St-Germain P., Grammatikopoulos T. Recovery of metal values from copper – arsenic minerals and other related resources // Miner. Process Extr. Metall. Rev. 2007. V. 28. P. 247–298.
Gentina J.C., Acevedo F. Application of bioleaching to copper mining in Chile // Electron. J. Biotechnol. 2013. V. 16. P. 16. https://doi.org/10.2225/vol16-issue3-fulltext-12
Johnson D.B. Biomining – biotechnologies for extracting and recovering metals from ores and waste materials // Curr. Opin. Biotechnol. 2014. V. 30. P. 24–31.
Liu H., Xia J., Nie Z., Liu L., Wang L., Ma C., Zheng L., Zhao Y., Wen W. Comparative study of S, Fe and Cu speciation transformation during chalcopyrite bioleaching by mixed mesophiles and mixed thermophiles // Miner. Eng. 2017. V. 106. P. 22–32.
Ma L., Wang X., Liud X., Wang S., Wang H. Intensified bioleaching of chalcopyrite by communities with enriched ferrous or sulfur oxidizers // Bioresour. Technol. 2018. V. 268. P. 415–423.
Mahmoud A., Cezac P., Hoadley A.F.A., Contaminea F., D’Hugues P. A review of sulfide minerals microbially assisted leaching in stirred tank reactors // Int. Biodeteriorat. Biodegradat. 2017. V. 119. P. 118–146.
Morin D.H.R., d’Hugues P. Bioleaching of a cobalt containing pyrite in stirred reactors: a case study from laboratory scale to industrial application // Biomining / Eds. Rawlings D.E., Johnson B.D. Berlin: Springer, 2007. P. 35–55.
Mudd G., Jowitt S. Growing global copper resources, reserves and production: discovery is not the only control on supply // Econ. Geol. 2018. V. 113. P. 1235–1267.
Mudd G.M., Weng Z., Jowitt S.M. A detailed assessment of global cu resource trends and endowments // Econ. Geol. 2013. V. 108. P. 1163–1183.
Munoz J.A., Blazquez M.L., Gonzalez F., Ballester A., Acevedo F., Gentina J.C., Gonzalez P. Electrochemical study of enargite bioleaching by mesophilic and thermophilic microorganisms // Hydrometallurgy. 2006. V. 84. P. 175–186.
Muravyov M.I., Bulaev A.G. Two-step oxidation of a refractory gold-bearing sulfidic concentrate and the effect of organic nutrients on its biooxidation // Minerals Engin. 2013. V. 45. P. 108–114.
Northey S., Mohr S., Mudd G., Weng Z., Giurco D. Modelling future copper ore grade decline based on a detailed assessment of copper resources and mining // Resources, Conservation and Recycling. 2014. V. 83. P. 190–201.
Okibe N., Gericke M., Hallberg K.B., Johnson D.B. Enumeration and characterization of acidophilic microorganisms isolated from a pilot plant stirred-tank bioleaching operation // Appl. Environ. Microbiol. 2003. V. 69. P. 1936–1943.
Pietrzyk S., Tora B. Trends in global copper mining – a review // IOP Conference Series: Materials Science and Engineering. 2018. V. 427. 012002.
Plumb J.J., Hawkes R.B., Franzmann P.D. The microbiology of moderately thermophilic and transiently thermophilic ore heaps // Biomining. Berlin-Heidelberg: Springer, 2007. P. 217–235.
Rawlings D.E., Coram N.J., Gardner M.N., Deane S.M. Thiobacillus caldus and Leptospirillum ferrooxidans are widely distributed in continuous flow biooxidation tanks used to treat a variety of metal containing ores and concentrates // Process Metallurgy. Elsevier. 1999. V. 9. P. 777–786.
Riekkola-Vanhanen M. Talvivaara black schist bioheapleaching demonstration plant // Adv. Mater. Res. 2007. V. 20. P. 30–33.
Rodriguez Y., Ballester B., Blazquez M.L., Gonzalez F., Munoz J.A. New information on the chalcopyrite bioleaching mechanism at low and high temperature // Hydrometallurgy. 2003. V. 71. Iss. 1–2. P. 47–56.
Singer D.A. Future copper resources // Ore Geol. Rev. 2017. V. 86. P. 271–279.
van Hille R.P., van Wyk N., Harrison S.T.L. Review of the microbial ecology of BIOX® reactors illustrate the dominance of the genus Ferroplasma in many commercial reactors // Biohydrometallurgy: Biotech Key to Unlock Minerals Resources Value. Changsha: Central South University Press, 2011. P. 1021.
van Hille R.P., van Wyk N., Froneman T., Harrison S.T.L. Dynamic evolution of the microbial community in BIOX leaching tanks // Adv. Mater. Res. 2013. V. 825. P. 331–334.
Watling H.R. The bioleaching of sulphide minerals with emphasis on copper sulphides – a review // Hydrometallurgy. 2006. V. 84. № 1–2. P. 81–108.
World Copper Factbook 2017, International Copper Study Group, Lisbon, Portugal.
Дополнительные материалы
- скачать ESM_1.docx
- Таблица S1.
Рис. S1. - Рис. S3.


